Журнал физической химии, 2020, T. 94, № 9, стр. 1312-1316
Термофизические свойства ионных жидкостей на основе катиона 1-бутил-3-метилимидазолия
Т. Э. Скребец a, Н. В. Шкаева a, *, Д. С. Косяков a
a Северный (Арктический) федеральный университет имени М.В. Ломоносова
163002 Архангельск, Россия
* E-mail: n.shkaeva@narfu.ru
Поступила в редакцию 28.11.2019
После доработки 09.01.2020
Принята к публикации 21.01.2020
Аннотация
Методом термогравиметрического анализа (ТГА) исследованы термофизические свойства трех ионных жидкостей на основе катиона 1-бутил-3-метилимидазолия. Определены температуры и энтальпии плавления и термической деструкции, рассмотрены ИК-спектры газообразных продуктов термического разложения. Рассмотрена связь между структурой соединений и их термохимическими характеристиками.
В настоящее время большое внимание уделяется исследованию ионных жидкостей, как растворителей особого вида. Их уникальные свойства (относительно низкие температуры плавления, особенности протекающих в них реакций, легкость отделения продуктов растворения от растворителя) вызывают большой интерес и привлекают большое внимание многих исследователей.
В числе прочего ионные жидкости рассматриваются как перспективные среды в технологических процессах переработки растительных материалов, а также для исследования свойств отдельных их компонентов – целлюлозы, лигнина, лигноуглеводных комплексов и других [1–6]. Как правило, для этих целей используют ионные жидкости на основе замещенного имидазолия. Практически всегда при этом процессы приходится вести при повышенных температурах, поэтому характеристика термофизических свойств ионных жидкостей, таких как теплоемкость, температуры и теплоты фазовых переходов, и в первую очередь, характер процессов термической деструкции этих соединений имеют большое значение.
Разнообразие возможностей использования ионных жидкостей определяет интерес к их термофизическим свойствам и изучению их термической стабильности [7–11].
В работе [7] исследована термическая стабильность ряда ионных жидкостей (фосфатов и трифталатов) на основе катионов алкил-3-метилимидазолия методом ТГА в атмосфере воздуха. Авторы поставили под сомнение значимость результатов, полученных путем относительно быстрого нагревания образца (10–20 K/мин), поскольку это давало различие в результатах по температуре начала разложения. По их мнению, такие эксперименты дают воспроизводимые результаты только при одинаковых навесках образца. Показана термическая нестабильность фосфатов алкил-3-метилимидазолия в воздухе при температуре выше 473 K и установлено, что примесь диоксида кремния ускоряет процесс разложения ионных жидкостей. Кроме того, авторы исследовали влияние материала тигля на результат эксперимента и показали, что наименьшее влияние оказывают тигли из серебра и оксида алюминия.
В работе [8] показано, что катионы имидазолия термически более стабильны, чем катионы тетраалкиламмония, а также сделан вывод о влиянии аниона на тепловой эффект разложения – эндотермический с неорганическими анионами и экзотермический с исследованными органическими анионами.
Авторы [9] исследовали термическую стабильность и влияние скорости нагревания на термохимические свойства этилсульфата 1-этил-3-метилимидазолия ([Emim][EtSO4]) и метилсульфата 1-бутил-3-метилимидазолия ([Bmim][MeSO4]) методами ТГА и дифференциальной сканирующей калориметрии (ДСК) в инертной атмосфере. Для обеих ионных жидкостей было отмечено два значения температуры, при которых наблюдалось уменьшение массы образца: 393–613 K и 548–723 K. Авторы объясняют это тем, что в диапазоне 393–613 K происходит разложение анионов [EtSO4]– и [MeSO4]–, а в диапазоне 548–723 K – разложение катионов [Emim]+ и [Bmim]+. Это согласуется с данными Holbrey [10], где определен диапазон температур разложения катионов [Emim]+ 623–673 K. Кроме того, в [9] показана зависимость температуры разложения от скорости нагревания и сделан вывод о некорректности их определения в динамическом режиме ТГА. Проведена серия экспериментов в изотермическом режиме – ионные жидкости нагревались до нужной температуры (323–413 K) и выдерживались в течение 24 ч. Сделан вывод о термической стабильности обеих ионных жидкостей в течение 24 ч при температуре не более 60°С. С помощью метода ДСК авторы работы определили температуры стеклования обеих ионных жидкостей 194.6 K для ([Emim][EtSO4] и 181.1 K для ([Bmim][MeSO4]. Интересным представляется факт, что авторам удалось определить температуры плавления и кристаллизации для [Bmim][MeSO4], а для [Emim][EtSO4] пиков, соответствующим фазовым переходам на ДСК-кривой не наблюдалось, что соответствуют полностью аморфной структуре.
В работе [10] Holbrey с соавторами синтезировали и исследовали ряд ионных жидкостей на основе катионов 1,3-диалкилимидазолия и метил- и этилсульфат-анионов методами ДСК и ТГА. Для метилсульфата 1,3-диметилимидазолия при нагревании на ДСК кривой был отмечен широкий пик фазового перехода при температуре 316 K. Авторы исследования предполагают, что в данном случае происходит переход из одной твердой фазы в другую, совпадающий с точкой плавления. При охлаждении для данной ионной жидкости был отмечен узкий пик кристаллизации при 255 K. На ДСК-кривых метилсульфата 1,2,3-триметилимидазолия и этилсульфата 1-метил-3-этилимидазолия таких эффектов отмечено не было. Температуры стеклования ионных жидкостей были определены в пределах от 208 до 176 K. На ТГ-кривых для всех ионных жидкостей авторы отметили плавное уменьшение массы в диапазоне температур 323–623 K (7–16% потери массы), при более высоких температурах наблюдалась резкая убыль массы. Авторы также предполагают последовательное термическое разложение: при температурах до 623 K, по их мнению, разлагается анион, а резкая убыль массы при более высоких температурах объясняется разложением катиона.
Целью настоящей работы является термогравиметрический анализ ионных жидкостей на основе замещенного имидазолия (хлорида, ацетата, метилсульфата) и оценка их термической устойчивости.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования выбраны ацетат, хлорид и метилсульфат 1-бутил-3-метилимидазолия (Sigma-Aldrich, Германия, степень чистоты не менее 95%). Поскольку все три жидкости обладают высокой гигроскопичностью, хранение их осуществляли над молекулярным ситом 4А (Sigma-Aldrich, Германия) и использовали в дальнейшем без дополнительной очистки.
Термогравиметрический анализ проводили с помощью сопряженной системы синхронного термического анализа STA 449 F3 Jupiter фирмы NETZSCH (Германия) и фурье-ИК-спектрометра Tensor 27 фирмы Bruker (Германия) с внешней газовой кюветой.
Синхронный термоанализатор объединяет в себе дифференциальный сканирующий калориметр теплового потока и термомикровесы с разрешением в диапазоне одного микрограмма. Для нагревания используется высокотемпературная печь с нагревательным элементом из карбида кремния (SiC), позволяющим достигать температуры 1823 K.
Перед началом измерений была выполнена калибровка микровесов с помощью встроенного калибровочного груза, а также калибровка системы по температуре и энтальпии. С этой целью применяли стандартные калибровочные образцы высокочистых металлов: индия, олова, висмута, цинка, алюминия и золота.
Все эксперименты выполняли в динамическом режиме – камера образца во время измерения постоянно продувалась аргоном (99.995%, 20 мл/мин). Предварительно проводили измерение базовой линии (эксперимент с пустыми тиглями). Навеску исследуемого вещества массой 20–30 мг помещали в тигель из Al2O3 (в работе [7] показаны преимущества тиглей из оксида алюминия при проведении ТГА). Измерения проводили в режиме нагревания от 300 до 1200 K со скоростью 2 и 10 K/мин, в качестве образца сравнения использовался пустой тигель из аналогичного материала.
Уточненные кривые ДСК получали на калориметре DSC Q2000 (TA Instruments, США). Навеску исследуемого вещества массой 5–10 мг помещали в алюминиевый тигель. Измерения проводились в режиме линейного нагревания от 293 K до температуры на 20° превышающей ожидаемую температуру плавления со скоростью 10 градусов в минуту в токе аргона. Предварительно проводилась калибровка прибора, включающая определение сопротивления и емкости ячейки. Калибровка включает в себя эксперимент с пустой ячейкой и с калибровочными образцами сапфира. Кроме этого проводилась калибровка константы ячейки с образцом высокочистого индия. Удельные энтальпии плавления рассчитывались путем интегрирования пика на ДСК-кривой, соответствующего плавлению исследуемого соединения. Управление системой ДСК, сбор и обработку данных проводили с помощью ПО “TA Instrument Explorer” и “TA Universal Analysis”.
ИК-спектры газообразных продуктов термического разложения регистрировали с помощью ИК-фурье-спектрометра, связанного с термоанализатором внешней обогреваемой линией подачи газа. ИК-спектр регистрировали непрерывно в течение всего эксперимента. Управление системой, сбор и обработку данных проводили с помощью ПО “NETZSCH-Proteus” и “OPUS”.
Для повышения достоверности измерений исследование каждого образца повторяли не менее трех раз с последующей статистической обработкой полученных результатов (значение доверительной вероятности 0.95).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
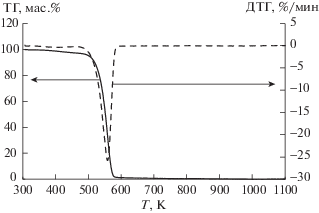
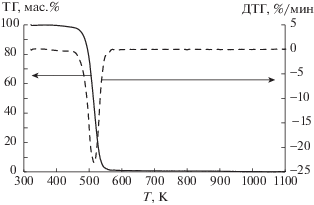
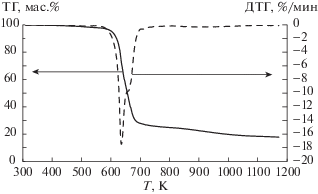
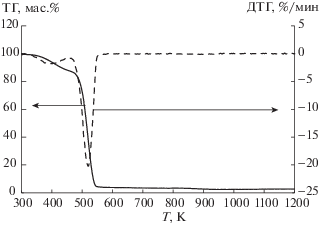
Результаты термогравиметрического анализа (рис. 1–3) показали, что как при скорости нагревания 10 K/мин, так и при скорости 2 K/мин, для всех трех ионных жидкостей был отмечен только один диапазон температур, при которых наблюдалось резкое уменьшение массы (табл. 1). Полученные данные не совпадают с данными авторов работы [9] для метилсульфата 1-бутил-3-метилимидазолия. Наличие двух температурных диапазонов убыли массы было установлено нами только в случае анализа обводненных ионных жидкостей (рис. 4). Одновременное разложение катиона и аниона ионных жидкостей было далее подтверждено при анализе ИК-спектров.
Таблица 1.
Термофизические характеристики ионных жидкостей
| Соединение | Т1, K | Т2, K | Н, кДж/моль |
|---|---|---|---|
| Ацетат 1-бутил-3-метилимидазолия | 493–532 | 514.9 | 45.9 |
| Хлорид 1-бутил-3-метилимидазолия | 536–571 | 558.7 | 38.2 |
| Метилсульфат 1-бутил-3-метилимидазолия | 621–666 | 635.5 | 54.2 |
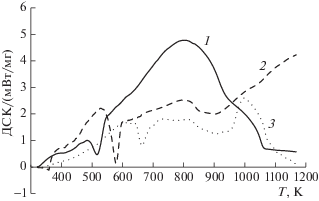
Обнаружено, что исследованные ионные жидкости термически устойчивы ниже температуры 473–493 K, причем, термическая устойчивость возрастает в ряду ацетат – хлорид – метилсульфат 1-бутил-3-метилимидазолия. Уровень температур начала разложения значительно выше температур, при которых эти жидкости обычно применяют [1, 2, 6] в исследованиях взаимодействия их с растительными материалами. Независимо от природы аниона тепловой эффект разложения является эндотермическим (табл. 1), что также не соответствует ранее полученным результатам [8]. Фазовый переход обнаружен на кривой ДСК только для хлорида 1-бутил-3-метилимидазолия. По кривой ДСК, полученной на калориметре Q2000 (рис. 5) определили температуру и теплоту плавления данной ионной жидкости, равные соответственно 340 K и 14.5 кДж/моль. Согласно литературным данным, температура плавления хлорида 1-бутил-3-метилимидазолия составляет 333 [12] – 343 [13] K. Таким образом, определенная нами температура плавления хорошо коррелирует с литературными данными.
Рис. 5.
ДСК-кривые ионных жидкостей: ацетат 1-бутил-3-метилимидазолия (1), хлорид 1-бутил-3-метилимидазолия (2), метилсульфат 1-бутил-3-метилимидазолия (3).
Анализ ИК-спектров газообразных продуктов термического разложения, снятых при температурах максимальной скорости разложения (табл. 2), показал, что для всех трех ионных жидкостей наблюдаются полосы, соответствующие валентным СН-колебаниям, как в имидазольном кольце, так и в алкильных группах. Кроме этого, в спектре ацетата 1-бутил-3-метилимидазолия наблюдаются полосы, соответствующие валентным колебаниям группы С=О, а в спектре метилсульфата 1-бутил-3-метилимидазолия – полосы, соответствующие валентным колебаниям связи S=O. Это подтверждает разрушение структуры как катиона, так и аниона в данном диапазоне температур.
Таблица 2.
Характеристические полосы поглощения продуктов разложения ионных жидкостей
| Положение полосы, см–1 | Отнесение положения полосы |
|---|---|
| Ацетат 1-бутил-3-метилимидазолия | |
| 3117 | Валентные С–Н колебания в имидазольном кольце |
| 2965 2885 |
Валентные С–Н колебания в алкильных группах |
| 1777 1759 |
Валентные колебания группы С=О |
| 1504 | Валентные С=С колебания в имидазольном кольце |
| 1450 1373 |
Деформационные колебания С–Н связей в алкильных группах |
| 1236 | Валентные колебания группы С–О |
| Метилсульфат 1-бутил-3-метилимидазолия | |
| 2967 | Валентные С–Н колебания в алкильных группах |
| 1507 | Валентные С=С колебания в имидазольном кольце |
| 1375 1358 1342 |
Деформационные С–Н колебания в алкильных группах |
| 1121 1062 |
Валентные колебания связи S=O |
| Хлорид 1-бутил-3-метилимидазолия | |
| 3112 | Валентные С–Н колебания в имидазольном кольце |
| 2965 2892 |
Валентные С–Н колебания в алкильных группах |
| 1506 | Валентные С=С колебания в имидазольном кольце |
| 1459 1373 |
Деформационные С–Н колебания в алкильных группах |
Таким образом, установлено, что при термическом разложении исследованных ионных жидкостей разрушение катиона и аниона идет практически одновременно.
Показано, что два температурных диапазона убыли массы на ТГА-кривой могут быть обусловлены обводнением ионных жидкостей в связи с их высокой гигроскопичностью.
Показан эндотермический характер теплового эффекта разложения ионных жидкостей на основе катиона 1-бутил-3-метилимидазолия как с органическим, так и с неорганическим анионом.
Определено, что ацетат и хлорид 1-бутил-3-метилимидазолия являются стабильными при температурах до 493 и 553 K соответственно, а метилсульфат 1-бутил-3-метилимидазолия стабилен до 613 K, что делает возможным применение этих ионных жидкостей в качестве растворителей растительных материалов и их компонентов.
Работа выполнена в Центре коллективного пользования научным оборудованием “Арктика” Северного (Арктического) федерального университета имени М.В. Ломоносова.
Список литературы
Sun N., Rahman M. et al. // Green Chemistry. 2009. V. 11. P. 645.
Miyafuji H. // Intech. 2013. V. 12. P. 299.
Yinghuai Z., Tang Yanting K. // Intech. 2013. V. 13. P. 315.
Боголицын К.Г., Махова Т.А., Скребец Т.Э. // Изв. вузов. Лесной журнал. 2010. № 2. С. 134.
Ладесов А.В., Косяков Д.С., Боголицын К.Г. // Там же. 2011. № 6. С. 81.
Скребец Т.Э., Ивахнов А.Д. // Химия растительного сырья. 2016. № 2. С. 13.
Kosmulski M., Gustafsson J., Rosenholm J.B. // Thermochim. Acta. 2004. V. 412. P. 47.
Ngo H.L., LeCompte K., Hargens L., McEwen A.B. // Ibid. 2000. V. 357. P. 97.
Ferna’ndez A., Torrecilla J.S., Garcı’a J., Rodrı’guez F. // J. Chem. Eng. Data. 2007. V. 52. P. 1979.
Holbrey J.D., Matthew Reichert W., Swatloski R.P. et al. // Green Chemistry. 2002. V. 4. P. 407.
Mikkola Jyri-Pekka, Kirillin A., Tuuf Jean-Christopher et al. // Ibid. 2007. V. 9. P. 1229.
Ngo H.L., LeCompte K., Hargens L., McEven A.B. // Thermochmica Acta. 2000. V. 97. P. 357.
Yunqiao Pu, Nan Jiang, Ragauskas A.J. // J. Wood Chemistry and Technology. 2007. V. 27. P. 23.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии