Журнал физической химии, 2020, T. 94, № 9, стр. 1434-1436
Протолитические равновесия глицил-L-аспарагиновой кислоты в водном растворе
С. Н. Гридчин a, *, Н. В. Чернявская a, В. М. Никольский b
a Ивановский государственный химико-технологический университет
Иваново, Россия
b Тверской государственный университет
Тверь, Россия
* E-mail: sergei_gridchin@mail.ru
Поступила в редакцию 30.12.2019
После доработки 20.02.2020
Принята к публикации 10.03.2020
Аннотация
Потенциометрическим методом определены константы ступенчатой диссоциации глицил-L-аспарагиновой кислоты при 298.15 K и значениях ионной силы 0.1, 0.3, 0.5. 1.0, 1.5 (KNO3). Полученные данные экстраполированы на нулевую ионную силу по уравнению с одним индивидуальным параметром, и рассчитаны величины термодинамических констант диссоциации.
Ранее в нашей лаборатории исследованы равновесия кислотно-основного взаимодействия в водных растворах L-валил-L-валина [1], D,L-валил-D,L-лейцина [2], L-лейцил-L-лейцина [2], D,L-лейцил-глицина [2], глицил-D,L-лейцина [2], D,L-аланил-D,L-лейцина [3], D,L-аланил-D,L-валина [4], D,L-аланил-глицина [5], D,L-аланил-D,L-аланина [6], D,L-аланил-D,L-аспарагина [6], глицил-L-аспарагина [6], D,L-аланил-D,L-серина [7], глицил-D,L-серина [8], глицил-D,L-треонина [8], глицил-D,L-валина [8], глицил-глицина [9], глицил-β-аланина [10], β-аланил-глицина [11] и β-аланил-β-аланина [12], проанализировано влияние ионной силы раствора на реализацию исследованных процессов и определены стандартные термодинамические характеристики соответствующих реакций. В настоящей работе объект исследования – глицил-L-аспарагиновая кислота (H2L):
В литературе отсутствует информация о влиянии ионной силы на протолитические равновесия указанного дипептида. В то же время эта информация имеет первостепенное значение для описания равновесий в растворах соединений с пространственным разделением зарядовых центров (амино- и карбоксилатных групп), поскольку большинство существующих схем теоретической оценки влияния концентрационных условий на изменение термодинамических характеристик реакций основано на моделях электростатических взаимодействий в предположении геометрически правильной сферической или эллипсоидальной формы заряженных частиц, и приемлемые по точности результаты могут быть получены лишь после определения индивидуальных для каждой конкретной системы эмпирических параметров экстраполяционных уравнений, определение которых, в свою очередь, требует предварительного экспериментального исследования соответствующих равновесий в широком интервале значений ионной силы раствора. Поэтому цель настоящей работы – потенциометрическое исследование процессов кислотно-основного взаимодействия в растворах глицил-L-аспарагиновой кислоты при нескольких значениях ионной силы и определение значений термодинамических констант соответствующих реакций.
Протолитические равновесия в растворах глицил-L-аспарагиновой кислоты исследовали методом потенциометрического титрования при 298.15 K и значениях ионной силы 0.1, 0.3, 0.5, 1.0 и 1.5 моль/л. В качестве “фонового” электролита использовали нитрат калия. Точный объем раствора дипептида помещали в термостатированную потенциометрическую ячейку. Начальная концентрация дипептида варьировалась в интервале 4 × 10–3–6 × 10–3 моль/л. Титрование проводили стандартными растворами гидроксида калия и азотной кислоты, содержащими “фоновый” электролит, чтобы избежать изменения ионной силы в процессе титрования за счет разбавления.
Для определения равновесной концентрации ионов водорода измеряли ЭДС цепи, состоящей из стеклянного электрода ЭСЛ-43-07 и насыщенного хлорсеребряного электрода ЭВЛ-1МЗ. Потенциал стеклянного электрода контролировали потенциометром Р-363/3. В качестве нуль-инструмента использовали рН-метр-миливольтметр рН-340. Точность измерения потенциала составляла ±0.1 мВ. Температуру потенциометрической ячейки и электродов поддерживали с точностью ±0.05 K. Перед снятием каждой кривой титрования потенциометрическую установку калибровали по стандартным растворам HNO3 и KOH, содержащими “фоновый” электролит для создания необходимой ионной силы.
Обработку потенциометрических данных осуществляли по программе PHMETR, предназначенной для расчета констант равновесия с произвольным числом реакций по измеренной равновесной концентрации одной из частиц [13]. В основу работы программы положен принцип поиска минимума критериальной функции F путем варьирования в каждой итерации подлежащих определению значений pK:
Таблица 1.
Величины pK диссоциации глицил-L-аспарагиновой кислоты при 298.15 K
| I (KNO3) | H3L+ = = H2L + H+ | H2L = = HL– + H+ | HL– = = L2– + H+ |
|---|---|---|---|
| 0 | 2.83 ± 0.04 | 4.54 ± 0.04 | 8.81 ± 0.05 |
| 0.1 | 2.84 ± 0.04 | 4.30 ± 0.04 | 8.36 ± 0.05 |
| 0.3 | 2.86 ± 0.03 | 4.33 ± 0.04 | 8.35 ± 0.04 |
| 0.5 | 2.85 ± 0.03 | 4.33 ± 0.03 | 8.31 ± 0.04 |
| 1.0 | 2.89 ± 0.04 | 4.37 ± 0.04 | 8.34 ± 0.04 |
| 1.5 | 2.92 ± 0.04 | 4.39 ± 0.04 | 8.41 ± 0.05 |
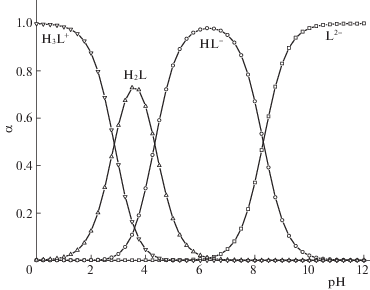
Рис. 1.
Диаграмма протолитических равновесий глицил-L-аспарагиновой кислоты при 298.15 K и I = 0.5 (KNO3).
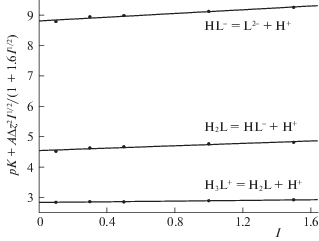
Величины термодинамических констант ступенчатой диссоциации глицил-L-аспарагиновой кислоты, также представленные в табл. 1, рассчитывали экстраполяцией данных, полученных при фиксированных значениях ионной силы, на нулевую ионную силу (рис. 2) по уравнению с одним индивидуальным параметром [16]:
Рис. 2.
Влияние ионной силы раствора на константы ступенчатой диссоциации глицил-L-аспарагиновой кислоты при 298.15 K (“фоновый” электролит – нитрат калия).
Работа выполнена в НИИ Термодинамики и кинетики химических процессов ИГХТУ в рамках государственного задания на выполнение НИР (Тема № FZZW-2020-0009).
Список литературы
Гридчин С.Н. // Журн. общ. химии. 2013. Т. 83. № 7. С. 1061.
Гридчин С.Н. // Там же. 2015. Т. 85. № 4. С. 563.
Гридчин С.Н., Горболетова Г.Г. // Там же. 2008. Т. 78. № 3. С. 444.
Васильев В.П., Кочергина Л.А., Крутова О.Н. // Журн. физ. химии. 2003. Т. 77. № 12. С. 2145.
Гридчин С.Н., Горболетова Г.Г., Пырэу Д.Ф. // Там же. 2007. Т. 81. № 12. С. 2165.
Gorboletova G.G., Kochergina L.A. // J. Term. Anal. Cal. 2007. V. 87. № 2. P. 561.
Гридчин С.Н., Пырэу Д.Ф. // Журн. физ. химии. 2015. Т. 89. № 1. С. 5.
Гридчин С.Н. // Там же. 2016. Т. 90. № 11. С. 1649–1656.
Горболетова Г.Г., Гридчин С.Н., Сазонова Е.С. // Там же. 2005. Т. 79. № 8. С. 1390.
Gridchin S.N., Gorboletova G.G., Pyreu D.F. // J. Term. Anal. Cal. 2007. V. 90. № 2. P. 607.
Гридчин С.Н., Пырэу Д.Ф. // Журн. общ. химии. 2007. Т. 77. № 6. С. 948.
Васильев В.П., Кочергина Л.А., Крутова О.Н. // Изв. вузов. Химия и хим. технология. 2003. Т. 46. № 6. С. 69.
Бородин В.А., Козловский Е.В., Васильев В.П. // Журн. неорган. химии. 1986. Т. 31. № 1. С. 10.
Химмельблау Д. Прикладное нелинейное программирование. М.: Мир, 1975. 417 с.
Бугаевский A.A., Дунай Б.А. // Журн. аналит. химии. 1971. Т. 26. № 2. С. 205.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высшая школа, 1982. 320 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


