Экология, 2023, № 6, стр. 435-445
Фотосинтетический аппарат мха гилокомиума блестящего устойчив к низким экстремальным температурам
А. В. Часов a, *, Ф. В. Минибаева a
a Казанский институт биохимии и биофизики – обособленное структурное подразделение
Федерального исследовательского центра “Казанский научный центр РАН”
420111 Казань, а/я 261, Россия
* E-mail: chasov@kibb.knc.ru
Поступила в редакцию 13.03.2023
После доработки 08.06.2023
Принята к публикации 14.06.2023
- EDN: BEOGAR
- DOI: 10.31857/S0367059723060033
Аннотация
Показано влияние положительных и отрицательных температур, а также обезвоживания/регидратации на максимальную фотохимическую эффективность, скорость переноса электронов в фотосистеме II и нефотохимическое тушение мха Hylocomium splendens, широко распространенного в бореальных лесах Северного полушария. Обнаружено, что данный мох устойчив к воздействию низких отрицательных (–20 и –80°C) температур и значительным потерям воды. Напротив, в гидратированном состоянии он неустойчив к длительному воздействию положительной температуры (40°C). Высокая устойчивость к низким температурам и обезвоживанию позволили H. splendens успешно адаптироваться к произрастанию в северных широтах и занять обширный ареал.
Hylocomium splendens (Hedw.) Bruch et al. – мох-космополит, произрастающий на всех континентах, за исключением Антарктиды. Особенно широко распространен в тундрах, арктических пустынях и бореальных лесах северных широт. H. splendens широко используется в прикладных целях в качестве модельного объекта, в том числе для биоиндикации накопления тяжелых металлов или исследования продуктивности [1, 2]. Для анализа физиологического состояния растений и их реакции на стрессовые воздействия измерение фотосинтетических параметров является одним из наиболее информативных и адекватных методических подходов [3]. Например, показано [4], что доступность воды в Арктике и ультрафиолетовое излучение оказывают существенное влияние на физиологию мха H. splendens и его фотосинтетические параметры. Известно, что многие мхи являются экстремофильными растениями, способными выживать в чрезвычайно неблагоприятных условиях [5–7]: часто заселяют обнаженные субстраты и доминируют на территориях с неблагоприятными условиями среды.
Мохообразные считаются потомками древнейших растений, появившихся на суше. Ключевой адаптацией, позволившей этим растениям выжить в новых условиях, послужило приспособление к колебаниям температуры и обезвоживанию [6]. Судя по широкому ареалу распространения, H. splendens приспособлен к различным климатическим воздействиям, в том числе к неблагоприятным температурам. Несмотря на очевидную важность, влияние температур на фотосинтетические параметры H. splendens до настоящего времени не исследовано.
Цель настоящей работы – изучить механизмы стрессовой устойчивости, позволившие H. splendens, с одной стороны, быть мхом-космополитом и занимать различные экологические ниши, с другой, являться одним из доминирующих видов в растительной популяции северных широт. Для этого были смоделированы условия, которые в природе поставили бы растение на грань выживания. Гидратированные побеги мха были подвергнуты влиянию высокой положительной температуры (40°C), низкой отрицательной (–20°C) и низкой критической (–80°C), чрезвычайно редко встречаемой в природе.
В задачи исследования входил анализ влияния данных температур, а также обезвоживания/регидратации на максимальную фотохимическую эффективность (FV/FM), скорость переноса электронов (ETR) в фотосистеме II (ФСII) и нефотохимическое (Штерн-Фольмеровское) тушение (NPQ) мха H. splendens. Кроме того, важным представляется анализ зависимости изменения ETR и NPQ от интенсивности действующего света. В связи с этим были проанализированы кривые быстрого светового отклика, предоставляющие информацию о максимальной фотосинтетической способности, квантовом выходе и эффективности использования побегами мха радиации.
МАТЕРИАЛ И МЕТОДЫ
Растительный материал. Объектом исследования служили побеги H. splendens, собранные в Моркинском районе Республики Марий Эл (координаты: 56.245347°, 48.766790°). После очистки побеги высушивали на воздухе в течение 2 сут между листами бумаги, затем сухие образцы хранили в морозильной камере при температуре –20°C в темноте.
Температурные воздействия и обезвоживание. Образцы по 0.3 г мха гидратировали в чашках Петри при дневном освещении на фильтровальной бумаге, смоченной 7 мл дистиллированной H2O, в течение 23 ч при 5°C и далее 1 ч при 25°C (контрольный вариант). Для анализа фотосинтетических параметров до и после воздействия экстремальных температур гидратированные образцы в закрытых чашках Петри (на фильтровальной бумаге в случае теплового воздействия и без – при холодовом воздействии) помещали в термостат (40°C) или морозильную камеру (–20 и –80°C) в темноту. Охлаждение до –80°C проводили ступенчато: 2 ч образцы выдерживали при –20°C, затем 1 ч – при –80°C. Для исследования временнóй динамики действия температур образцы охлаждали при –20°C в течение 10, 20 и 30 мин, 1, 2, 3, 6 ч и 3 сут, аналогично нагревали при 40°С за исключением интервалов в 20 мин, 2 ч и 3 сут.
Для получения кривых быстрого светового отклика ETR и NPQ побеги выдерживали в течение 1 ч при –20°C или 40°C. Для изучения температурного восстановления при 25°C после холодового или теплового воздействия образцы в чашках Петри переносили на дневное освещение и выдерживали от 10 мин до 119 ч, кроме того, образцы после холодового воздействия помещали на влажную фильтровальную бумагу. Для изучения кратковременного температурного восстановления при 25°C в течение 1, 5 и 10 мин после холодового воздействия (рис. 1а–в) образцы переносили сразу в темноту для темновой адаптации (см. ниже). Для анализа эффектов обезвоживания гидратированные образцы в открытых чашках Петри помещали в эксикатор с силикагелем при 25°C в темноте. Регидратацию проводили в течение 24 ч при 25°C.
Рис. 1.
Фотосинтетические параметры FV/FM (а, г), ETR (б, д) и NPQ (в, е) при действии на побеги мхов H. splendens температуры –20°C в течение 72 ч (а–в), 3 ч (–20°C) или ступенчатого охлаждения (с –20°С, 2 ч до –80°С, 1 ч) (г–е) с последующим переносом образцов в оптимальные условия (25°C). На графиках представлены среднее арифметическое и SE, разница с контролем достоверна при P ≤ 0.05 (*).

Относительное содержание воды (ОСВ) при обезвоживании определяли по формуле: (масса мха после обезвоживания – сухая масса) / (масса мха после гидратации – сухая масса) × 100% [8].
Анализ фотосинтетических параметров. Модулированную флуоресценцию хлорофилла a измеряли на базе системы PAM (от англ. Pulsе Amplitude Modulation) при помощи флуориметра FMS1+ (Hansatech Instruments, Великобритания) со стандартной листовой клипсой с использованием красного светодиода [3]. Измерения проводили в верхней части первого яруса мха. После периода темновой адаптации продолжительностью не менее 10 мин производили вспышку насыщающего света в 85 единиц продолжительностью 0.7 с (максимальная интенсивность до 13 000 мкмоль фотонов/м2 с) и измеряли FV/FM, где FM – максимальная флуоресценция, FV – переменная флуоресценция, или (FM – F0), где F0 – минимальный выход флуоресценции в адаптированном к темноте состоянии. Далее после снижения уровня флуоресценции до исходного темнового значения F0 включали непрерывный действующий свет (AL) с плотностью потока 133 мкмоль фотонов/м2 с. Через 40 с включали второй насыщающий импульс для определения стационарного уровня флуоресценции хлорофилла а (FT) и максимального выхода флуоресценции (${\text{F}}_{{\text{M}}}^{'}$) в адаптированном к свету состоянии для расчета NPQ (NPQ = (FM – ${\text{F}}_{{\text{M}}}^{'}$)/${\text{F}}_{{\text{M}}}^{'}$)) и ETR (ETR = = 0.5 × PAR × ФФСII), где PAR – фотосинтетически активное излучение, а ФФСII – действительный квантовый выход фотохимических реакций в ФСII на свету, рассчитываемый как (${\text{F}}_{{\text{M}}}^{'}$ – FT)/FM. Кривые быстрого светового отклика ETR и NPQ были измерены путем увеличения AL в 8 шагов по 20 с каждый от 33 до 445 мкмоль фотонов/м2 с со вспышками насыщающего света в конце экспозиции для каждого уровня освещенности.
Статистический анализ. Опыты проводили как минимум в пяти биологических повторностях. Все экспериментальные данные имеют нормальное распределение признака. Для сравнения средних значений признаков использовали однофакторный ANOVA с оценкой попарных различий с помощью критериев Тьюки, Бонферрони. На рисунках представлены средние арифметические значения и стандартные ошибки (SE).
РЕЗУЛЬТАТЫ
Состояние фотосинтетического аппарата мха H. splendens при действии низких отрицательных температур. При исследовании временнóй динамики действия отрицательной температуры –20°C на побеги H. splendens обнаружены лишь несущественные колебания FV/FM, близкие к контрольным значениям (см. рис. 1а). При последующем выдерживании побегов при комнатной температуре произошло небольшое снижение FV/FM. Двукратное уменьшение показателей ETR и NPQ наблюдалось при температуре –20°C (рис. 1б, в): значения стали минимальными уже через 20 мин, вероятно, к этому времени происходило полное промерзание побегов мха, образцы становились хрупкими. Тем не менее такое воздействие не было для мха повреждающим, поскольку подобная температура характерна для мест обитания мха в зимний период и не является для него критической: после 3-дневного выдерживания мха при –20°C и последующем переносе в оптимальные условия (25°C) происходило быстрое (через 5 мин) восстановление ETR и NPQ. Вероятно, после оттаивания побегов мха, которое происходило уже через 1–2 мин, фотосинтетический аппарат быстро восстанавливал свою активность до уровня контроля (см. рис. 1б, в).
Сравнение фотосинтетических параметров при действии низкой отрицательной температуры (–20°C) в течение 3 ч и ступенчатом охлаждении до низкой критической температуры (–80°C) показало, что все исследуемые фотосинтетические параметры характеризуются более низкими значениями при охлаждении до –80°C, чем при –20°C (см. рис. 1г–е). Восстановление FV/FM и ETR после ступенчатого охлаждения до –80°C происходило с такой же скоростью, как и после воздействия –20°C, однако абсолютные значения этих показателей были несколько меньше (см. рис. 1г, д). Восстановление NPQ при комнатной температуре после ступенчатого охлаждения до –80°C практически не отличалось от значений NPQ образцов после охлаждения до –20°C (см. рис. 1е).
Состояние фотосинтетического аппарата мха H. splendens при тепловом воздействии. Обнаружено, что 10- и 30-минутное тепловое воздействие, достигнутое путем выдерживания гидратированного мха при 40°C, приводило к снижению фотосинтетических параметров и быстрому их восстановлению после переноса мха в условия оптимальной температуры (25°C, 1 ч) (рис. 2а–в). При тепловом воздействии (40°C) в течение 1 ч FV/FM и ETR снижались на 31 и 38% соответственно (см. рис. 2а, б), а NPQ на 72% (см. рис. 2в). При переносе побегов мха в условия оптимальной температуры на 2 ч наблюдалась тенденция к восстановлению параметров фотосинтетического аппарата (см. рис. 2а–в).
Рис. 2.
Фотосинтетические параметры FV/FM (а, г), ETR (б, д) и NPQ (в, е) при действии на побеги мхов H. splendens температуры 40°C в течение 6 ч (а–в) или 1 ч (г–е) с последующим переносом образцов на разных этапах теплового воздействия в оптимальные условия (25°C).

Более длительное тепловое воздействие (40°C) в течение 3 и 6 ч приводило к критическому снижению параметров фотосинтетической активности. При последующем выдерживании мха при оптимальной температуре не наблюдалось восстановления величин исследуемых параметров. Более детальное изучение динамики восстановления фотосинтетических параметров при 25°С в побегах мха, подвергнутых одночасовому тепловому воздействию, выявило, что частичное восстановление фотосинтетических параметров в оптимальных условиях происходило через 6 ч, а полное восстановление – через сутки (рис. 2г, д). Исключением стала динамика изменения NPQ, которое через 2 ч уже достоверно не отличалось от контрольного уровня (рис. 2е).
Состояние фотосинтетического аппарата мха H. splendens при разных температурах и действии света различной интенсивности. Показано, что действие температуры –20°C в течение 1 ч снижало ETR на 17–62% при различных интенсивностях AL в сравнении с контрольным вариантом – максимальное снижение было при 133 мкмоль фотонов/м2 с, и разница постепенно уменьшалась при увеличении интенсивности AL (рис. 3). После окончания действия отрицательной температуры ETR начинала восстанавливаться уже через 1 ч нахождения побегов в нормальных условиях (25°C), при этом кривая быстрого светового отклика при низких интенсивностях AL (133–179 мкмоль фотонов/м2 с) уже совпадала с кривой контрольного образца (см. рис. 3). При увеличении времени нахождения побегов мха (3, 24 и 96 ч) при 25°C кривые зависимости ETR практически не отличались от контрольного варианта при всех интенсивностях AL. Интересно, что кривые быстрого светового отклика для NPQ достоверно не отличались от контрольных, хотя и наблюдалась тенденция к повышению, особенно при интенсивности AL > 194 мкмоль фотонов/м2 с как при действии температуры –20°C, так и последующем восстановлении в оптимальных условиях (25°C, рис. 4).
Рис. 3.
Кривые быстрого светового отклика для ETR при увеличении интенсивности действующего света на побеги мха H. splendens в контроле, после 1 ч действия температуры –20°C и при 1, 3, 24 и 96 ч последействия при 25°C.

Рис. 4.
Кривые быстрого светового отклика для NPQ при увеличении интенсивности действующего света на побеги мха H. splendens в контроле, после 1 ч действия температуры –20°C и при 1, 3, 24 и 96 ч последействия при 25°C.

Анализ зависимости ETR и NPQ побегов мха от интенсивности AL показал, что одночасовая тепловая обработка является стрессовым фактором для мха, что подтверждалось снижением уровня этих показателей (рис. 5, 6). В отличие от воздействия отрицательных температур, при которых наибольшее снижение ETR наблюдалось при низких интенсивностях AL, в случае теплового воздействии по мере увеличения интенсивности AL происходило постепенное снижение ETR на 19–60% у мха в сравнении с уровнем, наблюдаемым в контроле (см. рис. 5). Частичное восстановление параметров ETR произошло уже через 1–6 ч, а полное после 1–2 сут нахождения образцов мха при комнатной температуре и дневном освещении.
Рис. 5.
Кривые быстрого светового отклика для ETR при увеличении интенсивности действующего света на побеги мха H. splendens в контроле, после 1 ч действия температуры 40°C и при 1, 3, 6, 24 и 48 ч последействия при 25°C.

Рис. 6.
Кривые быстрого светового отклика для NPQ при увеличении интенсивности действующего света на побеги мха H. splendens в контроле, после 1 ч действия температуры 40°C и при 1, 3, 6, 24 и 48 ч последействия при 25°C.

Восстановление NPQ произошло достаточно быстро: уже через 1 ч при интенсивности AL 33 мкмоль фотонов/м2 с оно совпадало с контрольным вариантом, а при более высоких интенсивностях AL кривая NPQ лежала примерно посередине между кривыми контрольного варианта и кривой, полученной при тепловой обработке. Через 3 ч нахождения пробегов мха при температуре 25°C кривая NPQ практически полностью совпадала с кривой контрольного варианта (см. рис. 6). Интересно, что дальнейшее нахождение побегов при температуре 25°C в течение 6 ч привело к снижению параметров NPQ до уровня кривой после 1 ч восстановления. После одних суток восстановления характер зависимости NPQ от интенсивности света был сложным: при низких интенсивностях AL (33–233 мкмоль фотонов/м2 с) уровень NPQ был близок к таковому при тепловом воздействии, а при высоких (400–445 мкмоль фотонов/м2 с) – на уровне NPQ после 1 и 6 ч выдерживания при температуре 25°C (см. рис. 6). Еще сутки нахождения побегов при этой температуре привели вновь к восстановлению параметров NPQ до контрольных значений, но лишь при высоких интенсивностях AL (400–445 мкмоль фотонов/м2 с).
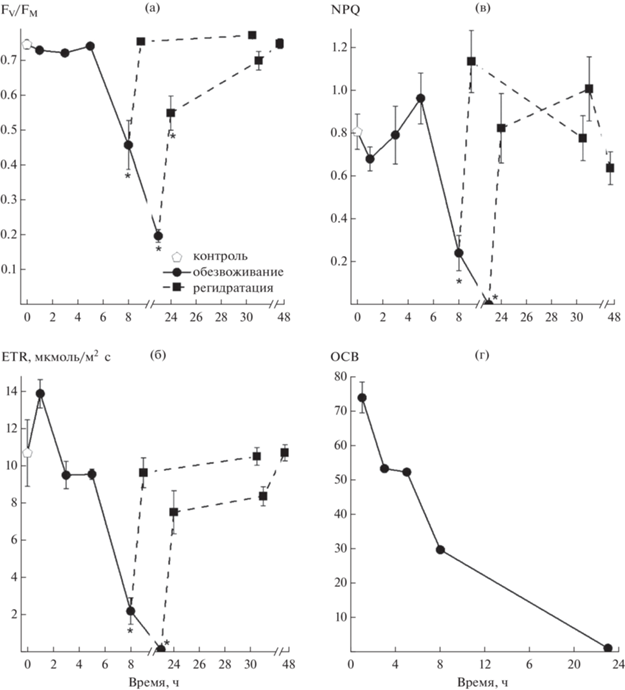
Состояние фотосинтетического аппарата мха H. splendens при обезвоживании и последующей регидратации. Обезвоживание мха путем выдерживания побегов в эксикаторе над силикагелем приводило к значительным изменениям фотосинтетических параметров. Они начинали снижаться к 8 ч обезвоживания (рис. 7а–в), когда ОСВ достигало значений 30% (рис. 7г). Последующая гидратация побегов мха, находящихся на этой стадии обезвоживания, приводила к быстрому восстановлению всех исследованных фотосинтетических параметров уже через 1 ч и не изменялась через сутки регидратации (см. рис. 7а–в). При полном обезвоживании (ОСВ не более 1%) работа фотосинтетического аппарата прекращалась: ETR и NPQ падали до нулевых значений, а FV/FM была снижена более чем на 70% от таковой контрольного варианта. В ходе последующей регидратации частичное восстановление фотосинтетических параметров произошло через 1 ч и полное – через сутки.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование фотосинтетических параметров показало, что H. splendens является экстремофильным растением, устойчивым к воздействию неблагоприятных температур и значительным потерям воды. Во влажном состоянии мох адаптируется к воздействию критических отрицательных температур и кратковременному, но не длительному действию повышенной температуры. Вероятно, мхи способны сохранять жизнеспособность после замораживания длительное время. Так, были продемонстрированы жизнеспособность и восстановление ростовых процессов мха Chorisodontium aciphyllum, находившегося в условиях вечной мерзлоты Антарктиды в течение как минимум 1530 лет [9]. Обнаружено, что устойчивые к обезвоживанию мхи можно подвергать глубокой заморозке без каких-либо криопротекторов [6]. Поскольку толщина листьев мхов всего в одну клетку и они не имеют внутренних воздушных пространств, то при замораживании на их внешних поверхностях образуется ледовая пленка и внутри клеток не образуются кристаллы льда, что помогает изолировать клетки и предотвращает их повреждение [5]. Считается, что в защите мхов от холодового воздействия участвуют Ca2+, АБК, белки, подобные белкам позднего эмбриогенеза, сахара и различные жирные кислоты [5, 6].
Наши эксперименты показали, что замораживание побегов при –20°C, а также ступенчатое замораживание при –20°C/–80°C не является повреждающим воздействием на гидратированный мох, поскольку при последующем его переносе в оптимальные условия происходит быстрое восстановление фотосинтетических параметров (см. рис. 1). Напротив, тепловое воздействие на гидратированный мох является повреждающим. Если после кратковременного (до 1 ч) воздействия и последующего переноса побегов в оптимальные условия происходит восстановление фотосинтетических параметров, то после более длительного (3–6 ч) теплового воздействия восстановления этих параметров не происходит (см. рис. 2). Известно, что стресс, индуцированный высокой температурой, значительно увеличивает проницаемость мембран, повреждает субъединицы ФСII и снижает активность выделения кислорода в результате частичного повреждения марганцевого комплекса ФСII, что приводит к ограничению транспорта электронов на донорной стороне ФСII [3]. По нашим данным, 3 ч воздействия температуры 40°C снижает ETR до 0.82 мкмоль/м2 с, что составляет лишь 5.8% от контрольного значения (см. рис. 2б), а последующего восстановления в оптимальных условиях не происходит, и это свидетельствует о падении фотосинтезирующей активности и жизнеспособности мха.
Известно, что мхи могут сохранять свою жизнеспособность при действии высоких температур, однако только в обезвоженном состоянии. Так, показано, что Racomitrium aquaticum, R. lanuginosum, Tortula intermedia, Bryum argenteum могут выдерживать непродолжительное воздействие температуры 100°C и выше [7, 10]. Нахождение мхов в обезвоженном/неактивном состоянии – это одна из стратегий избегания негативных последствий действия высоких температур, так как в увлажненном виде мхи менее устойчивы к высоким температурам, и оптимальной для роста мхов является температура около 20°C [5, 10].
Существует зависимость изменения ETR и NPQ от интенсивности действующего света [11]. В условиях низкой интенсивности света бóльшая часть поглощенной световой энергии может использоваться в процессе фотосинтеза (благодаря высокой эффективности фотосинтетического аппарата), в то время как в условиях высокой интенсивности используется только небольшая часть PAR. Этим может объясняться то, что в стрессовых условиях (–20°C, 1 ч) при высокой интенсивности действующего света происходили понижение ETR и повышение NPQ (см. рис. 3, 4), то есть поглощенная энергия рассеивалась в виде тепла.
Эффективность рассеивания энергии зависит от величины градиента рН, а NPQ защищает цепь электронов транспорта от чрезмерного восстановления и является одним из механизмов фотозащиты, функционирующих в случае повышенной радиации [3]. Анализируя кривые быстрого светового отклика, мы обнаружили, что после 1 ч действия отрицательных температур, приводящего к заморозке мха, ETR восстанавливается быстрее (частично через 1 ч и полностью через 3 ч), чем после 1 ч тепловой обработки, когда полное восстановление происходит только через сутки (см. рис. 3, 5). При этом после холодового воздействия кривые NPQ лежат выше контрольной кривой, что может свидетельствовать об адаптации мха к данному воздействию, в том числе путем преобразования энергии в тепло (см. рис. 4). Парадоксально, но через сутки восстановления после теплового стресса кривая быстрого светового отклика NPQ на низких интенсивностях практически совпадает с опытной и находится ниже контрольной (см. рис. 6). Вероятно, происходят какие-то перестройки фотосинтетического аппарата мха, которые позволяют ему после такого стресса более эффективно работать, так как меньше энергии рассеивается в виде тепла при одинаковой скорости переноса электронов. Такая тенденция сохраняется и через 2 суток эксперимента. В листьях сосудистых растений в процессе тепловой диссипации энергии участвует хлорофилл-связывающий белок ФСII [3]. Во мхе Physcomitrium patens паралог хлорофилл-связывающих белков также способствует повышению уровня NPQ и вносит вклад в фотозащиту при действии света высокой интенсивности [12].
Нами установлено, что H. splendens устойчив к значительным потерям воды. Известно, что у мхов в цикле обезвоживания/регидратации происходят характерные и обратимые структурные изменения внутриклеточных органелл: вакуолей, хлоропластов, митохондрий и цитоскелета [6]. Вероятно, фотосинтетический аппарат мхов остается неповрежденным, что подтверждают данные по быстрому восстановлению его активности в ходе последующей регидратации (см. рис. 7). В обезвоженном состоянии и при невысоких температурах мхи способны сохранять жизнеспособность длительное время, даже после хранения в гербарии (до 19 лет) [5, 13]. Считается, что устойчивость к высоким температурам неразрывно связана с обезвоживанием [5, 10]. Скорее всего, в наших экспериментах при действии высокой температуры повреждение мхов, обнаруживаемое по критическому падению и отсутствию восстановления фотосинтетических параметров (см. рис. 2а–в), в большей степени связано именно с повреждающим действием воды, которая при высокой температуре может находиться и в жидкой, и в газообразной фазе – фактически происходит “варка”.
Не исключено, что повреждающее действие на фотосинтетический аппарат могут оказывать и активные формы кислорода. На трех мхах – Racomitrium japonicum, Hypnum plumaeforme и Plagiomnium cuspidatum, контрастных по условиям произрастания, было показано, что обезвоживание при 22°C не вызывало, а при 38°C вызывало серьезные повреждения, особенно ФСII, что в основном было обусловлено инактивацией NPQ, сопровождаемой высоким накоплением супероксидного анион-радикала и перекиси водорода [14]. При отрицательных температурах внутриклеточная вода не оказывает негативного влияния на фотосинтетический аппарат H. splendens, о чем свидетельствует незначительное снижение FV/FM (см. рис. 1). В оптимальных условиях для большинства растений соотношение FV/FM близко к значениям 0.83–0.85 [15]. В случае воздействия высокой температуры падение FV/FM было более значительным (см. рис. 2а, г). Вероятно, низкие значения FV/FM при высоких температурах свидетельствуют о замедлении реакции фотолиза воды в ФСII [3]. Так, при действии высоких температур на листья дуба были обнаружены уменьшение квантового выхода электронного транспорта ФСII и снижение доли открытых реакционных центров ФСII [16]. Известно, что из-за физиологических особенностей проводимость воды у многих мохообразных зависит от внешнего капиллярного действия, и их водный потенциал (давление пара) уравновешивается потенциалом окружающей среды [6]. В природных условиях при росте температуры и воздействии солнечных лучей повышается температура побегов мхов, увеличивается подвижность молекул воды, и мхи быстро теряют воду. Вероятно, данные обстоятельства не позволяют мхам выработать механизмы адаптации к высоким температурам в гидратированном состоянии. В случае низкотемпературного воздействия или обезвоживания наблюдаемые нами падения фотосинтетических параметров являются обратимыми (см. рис. 1, рис. 7). Считается, что мохообразные в отличие от сосудистых растений сохранили уникальный архаичный механизм устойчивости к обезвоживанию [6]. Из-за своих физиологических особенностей и, как следствие, уникальных адаптационных механизмов к действию неблагоприятных факторов среды мхи осваивают экологические ниши, не доступные для других видов растений. Результаты настоящего исследования проливают свет на механизмы, позволяющие мху H. splendens успешно адаптироваться к условиям произрастания в северных широтах.
Работа выполнена при финансовой поддержке гранта РНФ № 22-24-00595 (для А.В. Часова).
Авторы декларируют отсутствие конфликта интересов.
Список литературы
Gerdol R., Bragazza L., Marchesini R. Element concentrations in the forest moss Hylocomium splendens: variation associated with altitude, net primary production and soil chemistry // Environ. Pollut. 2002. V. 116. № 1. P. 129–135.https://doi.org/10.1016/S0269-7491(01)00198-1
Cowden P., Aherne J. Interspecies comparison of three moss species (Hylocomium splendens, Pleurozium schreberi, and Isothecium stoloniferum) as biomonitors of trace element deposition // Environ. Monit. Assess. 2019. V. 191: 220.https://doi.org/10.1007/s10661-019-7354-y
Гольцев В.Н., Каладжи М.Х., Кузманова М.А., Аллахвердиев С.И. Переменная и замедленная флуоресценция хлорофилла a – теоретические основы и практическое приложение в исследовании растений. М.; Ижевск: Институт компьютерных исследований, 2014. 220 с.
Arróniz-Crespo M., Gwynn-Jones D., Callaghan T.V. et al. Impacts of long-term enhanced UV-B radiation on bryophytes in two sub-Arctic heathland sites of contrasting water availability // Ann. Bot. 2011. V. 108. № 3. P. 557–565.https://doi.org/10.1093/aob/mcr178
Glime J.M. Bryophyte Ecology. V. 1: Physiological Ecology. 2017. https://digitalcommons.mtu.edu/bryophyte-ecology1/ (Electronic resource).
Takezawa D. Mechanisms underlying freezing and desiccation tolerance in bryophytes // Survival Strategies in Extreme Cold and Desiccation. Advances in Experimental Medicine and Biology. Eds. Iwaya-Inoue M. Singapore: Springer, 2018. V. 1081. P. 167–187.https://doi.org/10.1007/978-981-13-1244-1_10
Zhuo L., Liang Y.Q., Yang H.L. et al. Thermal tolerance of dried shoots of the moss Bryum argenteum // J. Therm. Biol. 2020. V. 89: 102469.https://doi.org/10.1016/j.jtherbio.2019.102469
Barrs H.D., Weatherley P.E. A re-examination of the relative turgidity technique for estimating water deficits in leaves // Aust. J. Biol. Sci. 1962. V. 15. P. 413–428.
Roads E., Longton R.E., Convey P. Millennial timescale regeneration in a moss from Antarctica // Current Biol. 2014. V. 24. № 6. P. R222–R223.https://doi.org/10.1016/j.cub.2014.01.053
Hearnshaw G.F., Proctor M.C.F. The effect of temperature on the survival of dry bryophytes // New Phytol. 1982. V. 90. P. 221–228.https://doi.org/10.1111/j.1469-8137.1982.tb03254.x
Long S.P., Humphries S., Falkowski P.G. Photoinhibition of photosynthesis in nature // Annu. Rev. Plant Physiol. 1994. V. 45. P. 633–662.https://doi.org/10.1146/annurev.pp.45.060194.003221
Alboresi A., Gerotto C., Giacometti G.M. et al. Physcomitrella patens mutants affected on heat dissipation clarify the evolution of photoprotection mechanisms upon land colonization // PNAS. 2010. V. 107. № 24. P. 11 128–11 133.https://doi.org/10.1073/pnas.1002873107
Бардунов Л.В. Древнейшие на суше. М.: Наука, 1984. 160 с.
Xia H., Chen K., Liu L. et al. Photosynthetic regulation in fluctuating light under combined stresses of high temperature and dehydration in three contrasting mosses // Plant Sci. 2022. V. 323: 111379.https://doi.org/10.1016/j.plantsci.2022.111379
Björkman O., Demmig B. Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77 K among vascular plants of diverse origins // Planta. 1987. V. 170. P. 489–504.https://doi.org/10.1007/BF00402983
Haldimann P., Feller U. Inhibition of photosynthesis by high temperature in oak (Quercus pubescens L.) leaves grown under natural conditions closely correlates with a reversible heat-dependent reduction of the activation state of ribulose-1,5-bisphosphate carboxylase/oxygenase // Plant Cell Environ. 2004. V. 27. P. 1169–1183.https://doi.org/10.1111/j.1365-3040.2004.01222.x
Дополнительные материалы отсутствуют.