Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 143-146
Распространение сибоглинид (Annelida, Siboglinidae) в море Лаптевых и прилежащих районах Арктического бассейна
Н. П. Карасева 1, Н. Н. Римская-Корсакова 1, В. Н. Кокарев 2, М. И. Симаков 3, Р. В. Смирнов 4, М. М. Ганцевич 1, *, академик РАН В. В. Малахов 1
1 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
2 Факультет биологических наук и аквакультуры, Северный университет
Буде, Норвегия
3 Институт океанологии имени П.П. Ширшова Российской академии наук
Москва, Россия
4 Зоологический институт Российской академии наук
Санкт-Петербург, Россия
* E-mail: mgantsevich@gmail.com
Поступила в редакцию 08.11.2022
После доработки 23.11.2022
Принята к публикации 25.11.2022
- EDN: NASNDJ
- DOI: 10.31857/S2686738922700081
Аннотация
Цель статьи – оценить биологическое разнообразие в море Лаптевых бескишечных морских червей семейства Siboglinidae (Annelida), метаболизм которых обеспечивается симбиотическими бактериями, окисляющими сероводород и метан. В пределах географических границ моря Лаптевых найдено 7 видов сибоглинид, еще 1 вид обнаружен в прилежащем секторе арктического бассейна. Наибольшее число находок и наибольшее биологическое разнообразие сибоглинид обнаружено в восточной части моря Лаптевых на поле многочисленных метановых факелов. Одна находка отмечена в приустьевом районе р. Лена на глубине 25 м. Обсуждается возможная связь сибоглинид с районами просачиваний метана.
Сибоглиниды (Siboglinidae) – семейство бескишечных морских кольчатых червей, жизнедеятельность которых обеспечивается симбиотическими бактериями. За исключением рода Osedax, имеющего гетеротрофных симбионтов, все остальные сибоглиниды культивируют хемоавтотрофных симбионтов [1]. Большинство видов сибоглинид имеет в качестве симбионтов бактерий, окисляющих сероводород [2, 3]. У других видов найдены симбионты, окисляющие метан [4, 5]. Известны виды с симбионтами, окисляющими как сероводород, так и метан [2, 5, 6].
Моря российского сектора Арктики, в том числе море Лаптевых, рассматриваются как регион с большими ресурсами углеводородов [7, 8]. Цель настоящей работы состоит в том, чтобы оценить биологическое разнообразие сибоглинид в море Лаптевых и сопоставить их распространение с районами просачиваний метана.
В основу работы положены сборы сибоглинид, сделанные в ходе 63-го, 69-го и 72-го рейсов научно-исследовательского судна “Академик Мстислав Келдыш” в 2015, 2017 и 2018 г. соответственно. Для сбора донной фауны были использованы дночерпатели “Океан” и Ван Вина, а также трал Сигсби. Для составления карты распространения сибоглинид использованы также данные ранее опубликованных работ [9–11].
Фауна сибоглинид моря Лаптевых и прилежащего сектора Арктического бассейна включает следующие виды.
1. Oligobrachia haakonmosbiensis Smirnov, 2000 описан из грязевого вулкана “Haakon Mosby” в Норвежском море [12]. Недавно показано, что O. haakonmosbiensis – это комплекс из 3 криптических видов, не различимых морфологически [13]. В восточной Арктике, включая море Лаптевых, встречается только один из криптических видов, а именно “Oligobrachia CPL-clade” [14]. Это самый широко распространенный вид сибоглинид в море Лаптевых (рис. 1, табл. 1).
Рис. 1.
Находки сибоглинид в море Лаптевых и прилежащем секторе Арктического бассейна (географические границы моря Лаптевых показаны пунктирной линией). Залежи газогидратов показаны по Соловьеву и др., 1987. Мелкими кружками обозначены метановые факелы (по Shakhova et al., 2015). Цифры в крупных кружках обозначают виды сибоглинид и соответствуют номерам в табл. 1.
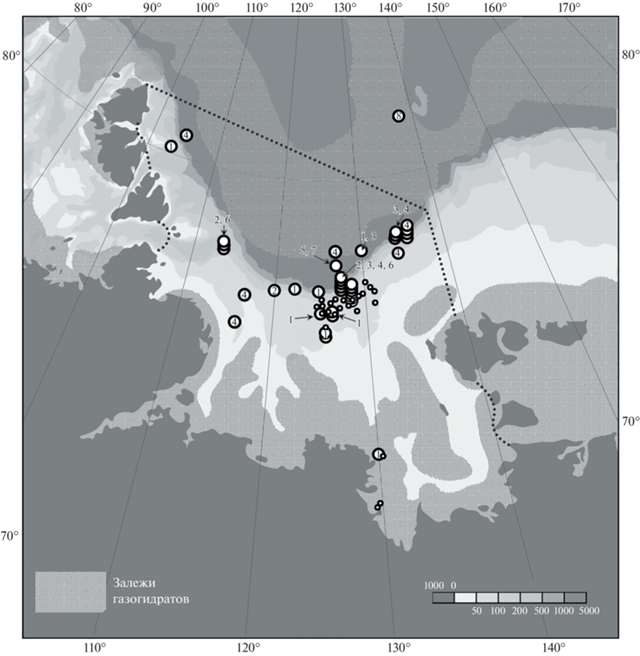
Таблица 1.
Виды сибоглинид, обнаруженные в море Лаптевых и прилежащем секторе Арктического бассейна
| № | Вид | Число находок | Диапазон глубин |
|---|---|---|---|
| 1. | Oligobrachia haakonmosbiensis | 16 | 25–300 м |
| 2. | Nereilinum squamosum | 4 | 240–560 м |
| 3. | Polarsternium rugellosum | 4 | 100–556 м |
| 4. | Siboglinum hyperboreum | 15 | 55–2000 м |
| 5. | Siboglinum sp. | 1 | 1556 м |
| 6. | Sclerolinum contortum | 4 | 310–1080 м |
| 7. | Siboglinidae gen. sp. | 1 | 1556 м |
| 8. | Polybrachia gorbunovi | 1 | 3700–3800 м |
2. Nereilinum squamosum Smirnov, 1999 – арктический вид, известный из Баренцева моря и моря Лаптевых. В последнем найден на 4 станциях на нижней границе шельфа и на материковом склоне на глубинах 240–560 м (рис. 1, табл. 1).
3. Polarsternium rugellosum Smirnov, 1999 – известен только по находкам в северо-восточной части моря Лаптевых на глубинах 100–556 м (рис. 1, табл. 1).
4. Siboglinum hyperboreum Ivanov, 1960 – арктический вид, известный из Гренландского моря и Арктического бассейна. В море Лаптевых вид распространен от архипелага Северная Земля на западе до северо-восточной окраины моря на глубинах от 55 до 2000 м.
5. Siboglinum sp. обнаружен на одной станции в центральной части моря Лаптевых на глубине 1556–1560 м (рис. 1, табл. 1). Определение видовой принадлежности оказалось невозможным из-за плохой сохранности материала.
6. Sclerolinum contortum Smirnov, 2000 – космополитический батиальный вид, обитающий в Арктическом бассейне, в Норвежском море, Мексиканском заливе, а также в Антарктике в районе Южных Шетландских и Южных Сандвичевых островов (Smirnov, 2000). В море Лаптевых вид был обнаружен на глубинах 310 и 1080 м (рис. 1, табл. 1).
7. Siboglinidae gen. sp. обнаружен в центральной части моря Лаптевых на глубине 1556–1560 м вместе с упомянутым выше Siboglinum sp. Согласно молекулярно-филогенетическому анализу Siboglinidae gen. sp. является сестринским по отношению к роду Crispabrachia [14].
8. Polybrachia gorbunovi (Ivanov, 1949) добыт при тралении в диапазоне глубин 3700–3800 м за пределами формальных географических границ моря Лаптевых, но в прилежащем секторе Арктического бассейна [9].
Сибоглиниды обитают в различных биотопах, среди которых мягкие осадки на шельфе и материковом склоне, богатые органическими останками грунты, гидротермальные биотопы и районы метановых просачиваний [15]. Сибоглиниды, содержащие симбионтов, окисляющих сероводород, тоже могут встречаться в районах метановых просачиваний. Это объясняется тем, что высокие концентрации сероводорода в осадке могут возникать в результате анаэробного окисления метана свободноживущими прокариотами с использованием сульфатов [16, 17].
Как известно, основные залежи метана в арктических морях представлены газогидратами многолетнемерзлых пород на небольших глубинах вблизи побережья и донными газогидратами, которые занимают глубоководные районы Арктического бассейна [18]. Высокие концентрации метана в приустьевых районах вызваны диссоциацией газогидратов многолетнемерзлых толщ под влиянием речного стока [19]. В море Лаптевых с газогидратами прибрежных многолетнемерзлых пород можно связать находку O. haakonmosbiensis в приустьевом районе р. Лены на глубине 25 м (рис. 1). Метан, образовавшийся в результате диссоциации донных газогидратов, мигрирует по системе разломов и высвобождается в толщу воды [20]. На внешней части шельфа в восточной части моря Лаптевых располагается поле многочисленных метановых факелов, где встречены все 7 видов, отмеченных для моря Лаптевых (рис. 1). Для этого района характерно как наибольшее биологическое разнообразие, так наибольшее число находок сибоглинид.
Список литературы
Hilario A., Capa M., Dahlgren T.G. et al. New perspectives on the ecology and evolution of siboglinid tubeworms // PLoS One. 2011. V. 6. P. 1–14.
Lösekann T., Knitte K., Nadalig T. et al. Diversity and abundance of aerobic and anaerobic methane oxidizers at the Haakon Mosby mud volcano, Barents Sea // Appl. Environ. Microbiol. 2007. V. 73. P. 3348–3362.
Sen A., Duperron S., Hourdez S. et al. Cryptic frenulates are the dominant chemosymbiotrophic fauna at Arctic and high latitude Atlantic cold seeps. PLoS ONE. 2018. V. 13. № 12. e0209273.
Schmaljohann R., Flügel H.J. Methane-oxidizing bacteria in Pogonophora // Sarsia. 1987. V. 72. P. 91–98.
Naganuma T., Elsaied H.E., Hoshii D., Kimura H. Bacterial endosymbioses of gutless tube-dwelling worms in nonhydrothermal vent habitats // Mar. Biotechnol. 2005. V. 7. P. 416–428.
Savvichev A.S., Kadnikov V.V., Kravchishina M. et al. Methane as an Organic Matter Source and the Trophic Basis of a Laptev Sea Cold Seep Microbial Community // Geomicrobiol. J. 2018. V. 35. P. 411–423.
Bird K.J., Charpentier R.R., Gautier D. et al. Circum-Arctic Resource Appraisal: Estimates of Undiscovered Oil and Gas North of the Arctic Circle // U.S. Geological Survey Fact Sheet. 2008. P. 2008–3049.
Gautier D.L., Bird K.J., Charpentier R.R. et al. Assessment of Undiscovered Oil and Gas in the Arctic // Science. 2009. V. 324. P. 1175–1179.
Иванов А.В. Погонофоры // Фауна СССР. Новая сер. № 75. М., Л.: Изд-во АН СССР. 1960. 271 с.
Sirenko B., Demisenko S., Deubel H., Rachor E. Deep water communities of the Laptev sea and adjacent parts of arctic ocean // Explorations of the fauna of the seas. 2004. V. 54. № 62. P. 28–73.
Savvichev A.S., Kadnikov V.V., Kravchishina M.D. et al. Methane as an Organic Matter Source and the Trophic Basis of a Laptev Sea Cold Seep Microbial Community // Geomicrobiology Journal. 2018. V. 35. № 5. P. 411–423.
Smirnov R.V. Two new species of Pogonophora from the arctic mud volcano off northwestern Norway // Sarsia. 2000. V. 85. № 2. P. 41–150.
Sen A., Didriksen A., Hourdez S., Svenning M.M., Rasmussen T.L. Frenulate siboglinids at high Arctic methane seeps and insight into high latitude frenulate distribution // Ecology and Evolution. 2020. V. 10. № 3. P. 1339–1351.
Карасева Н.П., Римская-Корсакова Н.Н., Екимова И.А., Кокарев В.Н., Симаков М.И., Ганцевич М.М., Малахов В.В. Первая находка погонофор (Annelida, Siboglinidae) в Восточно-Сибирском море совпадает с районами метановых просачиваний // Доклады Российской академии наук. Науки о жизни. 2021. Т. 501. № 1. С. 517–521.
Dando P.R., Southward A.J., Southward E.C., Lamont P., Harvey R. Interactions between sediment chemistry and frenulate pogonophores (Annelida) in the north-east Atlantic // Deep Sea Res. Part I. 2008. V. 55. P. 966–996.
Aharon P., Fu B. Sulfur and oxygen isotopes of coeval sulfate–sulfide in pore fluids of cold seep sediments with sharp redox gradients // Chem. Geol. 2003. V. 195. P. 201–218.
Dattagupta S., Arthur M.A., Fisher C.R. Modification of sediment geochemistry by the hydrocarbon seep tubeworm Lamellibrachia luymesi; a combined empirical and modeling approach // Geochimica et Cosmochimica Acta. 2008. V. 72. P. 2298–2315.
Соловьёв В.А. Гинзбург Г.Д., Телепнев Е.В., Миха-люк Ю.Н. Криотермия и гидраты природного газа в недрах Северного Ледовитого океана. Л. ПНО “Севморпуть”. 1987. 150 с.
Шахова Н.Е., Семилетов И.П., Бельчева Н.Н. Великие сибирские реки как источники метана на арктическом шельфе // Доклады Академии наук. 2007. Т. 414. № 5. С. 683–685.
Shakhova N., Semiletov I., Sergienko V., Lobkovsky L. The East Siberian Arctic Shelf: towards further assessment of permafrost-related methane fluxes and role of sea ice // Phil. Trans. R. Soc. A. 2015. V. 373. 20140451.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


