Цитология, 2022, T. 64, № 6, стр. 534-543
Анализ механизмов подавления миграции эндометриальных стволовых клеток при селективной химической активации механочувствительных каналов Piezo1
В. Ю. Васильева 1, Е. А. Морачевская 1, Ю. А. Негуляев 1, В. И. Чубинский-Надеждин 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: vchubinskiy@gmail.com
Поступила в редакцию 10.06.2022
После доработки 20.06.2022
Принята к публикации 20.06.2022
- EDN: ZYIMII
- DOI: 10.31857/S0041377122060116
Аннотация
В работе исследовали возможные молекулярные механизмы, которые могли бы опосредовать подавление клеточной подвижности эндометриальных мезенхимных стволовых клеток человека (эМСК) при селективной химической активации механочувствительных каналов Piezo1 низкомолекулярным гетероциклическим соединением Yoda1. Согласно данным литературы, стимуляция активности Piezo1 в плазматической мембране может приводить к активации различных сигнальных путей, в частности связанных с активностью каналов TRPV4 или с высвобождением внутриклеточной АТФ во внеклеточную среду и последующим запуском пуринергических каскадов. Мы предположили, что Piezo1-зависимая активация этих сигнальных путей может вносить вклад в торможение миграции эМСК при действии агониста Yoda1. С помощью полимеразной цепной реакции и иммунофлюоресцентного окрашивания выявлена экспрессия TRPV4 в эМСК на уровне мРНК и белка. В то же время, миграционные тесты показали, что ингибирование каналов TRPV4 (реагентом HC067047) не отменяло эффекта снижения клеточной подвижности эМСК в присутствии Yoda1. Кроме того, добавление в среду апиразы – дифосфогидролазы, катализирующей быстрое расщепление АТФ, не приводило к восстановлению миграционного потенциала эМСК, снижающегося при действии агониста Yoda1. Результаты работы позволяют исключить из рассмотрения гипотезы о TRPV4- или АТФ-зависимом подавлении миграции эМСК при селективной химической активации механочувствительных каналов Piezo1; обсуждаются предпосылки для поиска ионных механизмов, лежащих в основе наблюдаемых изменений подвижности эндометриальных стволовых клеток.
Механоуправляемые ионные каналы плазматической мембраны играют ведущую роль в передаче механических сигналов и формировании интегрального клеточного ответа на изменения свойств микроокружения. Ранее в наших электрофизиологических исследованиях была изучена механозависимая активация каналов в эндометриальных мезенхимных стволовых клетках человека (эМСК) (Chubinskiy-Nadezhdin et al., 2017, 2019a), представляющих интерес с точки зрения регенеративной медицины ввиду нескольких преимуществ, таких как доступность, неинвазивные протоколы их получения и отсутствие существенных этических проблем (Banu et al., 2008; Zemel’ko et al.,2012; Chen et al., 2019). Недавно в эМСК были идентифицированы механочувствительные каналы Piezo1, способные в физиологических условиях проводить ионы Са2+ из внеклеточной среды в цитоплазму (Chubinskiy-Nadezhdin et al., 2022). Полученные нами результаты, в том числе данные о функциональной кластеризации каналов, позволяют полагать, что Са2+-проницаемые каналы Piezo1 могут вносить существенный вклад в локальные механизмы кальциевой сигнализации и сопряженные процессы клеточной механотрансдукции эМСК.
Перспективным инструментом исследования физиологической роли каналов Piezo1 в нативных клетках оказались их селективные химические агонисты, способные специфически присоединяться к канальным молекулам, приводя к изменению их конформационной структуры и активации ионных токов в отсутствие механического стимула (Syeda et al., 2015; Wang et al., 2018). Недавно обнаружено, что селективный активатор каналов Piezo1 низкомолекулярное гетероциклическое соединение Yoda1 ингибирует подвижность эМСК в тестах по заживлению экспериментальной раны (wound healing assay) (Chubinskiy-Nadezhdin et al., 2022).
Этот достаточно неожиданный результат согласуется с ранее полученными данными на клетках 3Т3B-SV40 (Chubinskiy-Nadezhdin et al., 2019b) и мотивирует нас обратиться к выяснению механизмов обнаруженного эффекта подавления миграционного потенциала эМСК при повышении активности механочувствительных каналов Piezo1. Согласно данным литературы, стимуляция активности Piezo1 может приводить к активации различных сигнальных путей, связанных, в частности, с активностью ионных каналов TRPV4 (Swain et al., 2020; Swain, Liddle, 2021) или с высвобождением внутриклеточной АТФ во внеклеточную среду и последующим запуском пуринергических каскадов (Mousawi et al., 2020). Мы предположили, что Piezo1-зависимая активация этих сигнальных систем может вносить вклад в Yoda1-индуцированное ингибирование миграции эМСК.
Специального внимания заслуживают предположения о возможном участии ионных каналов TRPV4 в Piezo-зависимом сигналинге в стволовых клетках. Взаимодействие между Piezo1 и TRPV4 было показано ранее в хондроцитах (Servin-Vences et al., 2017), остеобластах (Yoneda et al., 2019) и эндотелиальных клетках (Swain, Liddle, 2021). Сообщалось, что в клетках эндотелия сосудов (HUVEC) механочувствительные каналы Piezo1 стимулируют активность каналов TRPV4, результирующий вход кальция через которые приводит к ремоделированию актина и нарушению адгезивных контактов (Swain et al., 2020, Swain, Liddle, 2021). Наши результаты по миграции стволовых клеток (Chubinskiy-Nadezhdin et al., 2022) вкупе с приведенными данными из литературы позволяют считать вероятным вовлечение TRPV4 в обнаруженное нами ингибирование клеточной подвижности при селективной химической активации каналов Piezo1 в эМСК. С использованием апробированных подходов может быть проверена гипотеза о функционировании аналогичного механизма взаимодействия между каналами Piezo1 и TRPV4 в стволовых клетках и возможного вклада в подавление их миграционного потенциала.
Вторая гипотеза базируется на данных, полученных на мезенхимных стволовых клетках, о выбросе АТФ во внеклеточную среду вследствие активации Piezo1 (Mousawi et al., 2020). Ранее показано также снижение скорости зарастания раны на монослое эМСК при внесении АТФ в среду культивирования (Semenova et al., 2020). Подтверждение предположения о Piezo-зависимом выбросе АТФ в эМСК может дать непротиворечивое объяснение ранее обнаруженным эффектам ингибирования миграции при действии внеклеточного АТФ (Semenova et al., 2020) или агониста Yoda1 (Chubinskiy-Nadezhdin et al., 2019b, 2022).
Задачей настоящей работы являлась последовательная проверка предположений о возможных молекулярных участниках регуляции клеточной подвижности при селективной химической активации механочувствительных каналов Piezo1. В независимых экспериментах на модели зарастания раны были проверены две предложенные гипотезы о возможных механизмах, которые могли бы опосредовать подавление миграции эМСК, наблюдаемое при действии соединения Yoda1, селективного агониста каналов Piezo1.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Клеточная линия эндометриальных мезенхимных стволовых клеток человека (эМСК, линия 2804), выделенная из десквамированного эндометрия, была получена и охарактеризована (Zemel’ko et al., 2012) в Институте цитологии РАН (Санкт-Петербург, Россия). Клетки обладают свойствами, типичными для мезенхимных стволовых клеток, включая фибробластоподобную морфологию, мультипотентность и экспрессию соответствующих поверхностных маркеров (Dominici et al., 2006; Zemel’ko et al., 2012). Клетки культивировали согласно стандартному протоколу в среде DMEM/F12 (Gibco, США), содержащей 10% эмбриональной бычьей сыворотки (HyClone, США, или BioSera, Франция), 1% антибиотика гентамицина и 1% GlutaMAX (Gibco, США). В экспериментах использовали эМСК на 9–13 пассажах. Клеточную линию культивировали в стандартных условиях в инкубаторе (37°С и 5% СО2). Подсчет клеток при пересеве и перед экспериментами проводили с помощью автоматического счетчика клеток Thermo Fisher Countess 2 (Thermo Fisher Scientific, США).
Полимеразная цепная реакция (ПЦР) с обратной транскрипцией (ОТ-ПЦР). Для выделения общей (тотальной) РНК брали 3 чашки (диаметр 60 мм) с монослоем эМСК. РНК выделяли с использованием коммерческого набора RNeasy Mini Kit (Qiagen, США). Синтезирование первой цепи кДНК производили с помощью коммерческого набора OT-1 (Синтол, Россия). Реакцию обратной транскрипции проводили при смешении 1 мкг РНК с 0.5 мкг случайных гексапраймеров, 100 ед. обратной транскриптазы (ревертазы) MMLV и 2.5-кратной реакционной смеси в общем объеме 25 мкл и инкубировании при 37°С в течение 1 ч. Для отрицательного контроля (ОТ−) использовали ПЦР-смесь без MMLV ревертазы. Полученную концентрированную кДНК разводили до рабочей концентрации 100 нг/мкл. Праймеры для ПЦР были разработаны с использованием программного обеспечения GeneRunner v5.0.59 (www.generunner.net). Последовательности праймеров для hTRPV4: 5' AAG-CAC-CCA-TGG-ACT-CAC-T 3' (прямой), 5' CCA-CGA-GAA-GTT-CCA-CGT-A 3' (обратный). Согласно расчету в программе BLAST (https://www.ncbi.nlm.nih.gov/tools/ primer-blast/), ожидаемый размер продукта реакции составляет 474 пар нуклеотидов (п.н.). ПЦР проводили в объеме 15 мкл с использованием 1.5 мкл разбавленной кДНК, 0.3 мкМ каждого праймера, 200 мкМ dNTP, 2 мМ MgCl2, 1 ед. Hot-Taq полимеразы и 1 × Hot-Taq полимеразного буфера (Силекс, Россия). ПЦР проводили по следующей схеме: 9 мин и 30 с при 94°C, 35 циклов по 40 с при 94°С, 30 с при 60°С и 30 с при 72°С, 5 мин при 72°С. Для определения присутствия продукта, полученного в ходе ПЦР, 10 мкл ПЦР-реакции подвергали электрофорезу в 6%-ном полиакриламидном геле. Затем гель окрашивали ДНК-связывающим красителем GelRed (1 : 10 000, Biotium, США). Результаты реакции визуализировали в ультрафиолетовом свете с помощью системы гель-документирования E-Gel Imager System (Thermo Fisher Scientific, США).
Миграция. Для оценки миграционного потенциала эМСК использовали силиконовые 2-х луночные культуральные вставки Ibidi Culture inserts (Ibidi, Германия), позволяющие сформировать межклеточный промежуток стабильных размеров (500 ± 50 мкм) между двумя клеточными монослоями и, тем самым, моделировать экспериментальную рану. Перед экспериментом вставки устанавливали в 4-луночные планшеты (Jet Biofil, Китай) в стерильных условиях. Клетки трипсинизировали (0.25% трипсином с ЭД-ТА; Thermo Fisher Scientific, США), переводили в суспензию в полной культуральной среде, далее производили их подсчет и высевали во вставки по 30 тыс. с каждой стороны от силиконового разделителя (рис. 1). Далее клетки культивировали в течение 20–24 ч до их распластывания и образования монослоя, затем вставки убирали и промывали клетки фосфатно-солевым буферным раствором (PBS). После промывки к клеткам добавляли полную культуральную среду, содержащую 10 мкМ Yoda1 (Tocris, США), 10 мкМ Yoda1 и 5 ед. апиразы (Sigma-Aldrich, Германия) или 10 мкМ Yoda1 и 300 нМ НС067047 (Sigma-Aldrich, Германия). Структурные формулы реагентов представлены на рис. 2. В качестве контролей использовали культуральную среду с добавлением DMSO (растворитель для Yoda1 и HC067047), сверхчистой воды (растворитель для апиразы, Arium Ultrapure water, Sartorius, Германия) или их комбинации (вода + DMSO) в количествах, соответствующих разведениям используемых реагентов.
Рис. 1.
Схема процедуры формирования промежутка между монослоями эМСК (экспериментальной раны) с использованием двухлуночных вставок Ibidi (см. Материалы и Методику). Адаптировано с сайта производителя (Ibidi, Германия, www.ibidi.com).
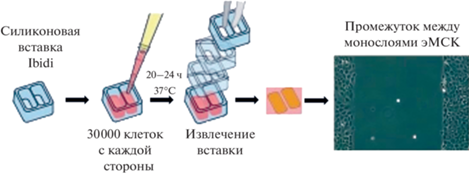
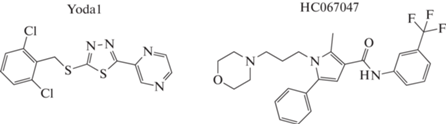
Рис. 2.
Структурные формулы селективного активатора каналов Piezo1 низкомолекулярного соединения Yoda1 (2-(5-{[(2,6-Дихлорофенил)метил]сульфанил}-1,3,4-тиадиазол-2-ил)пиразин) и ингибитора каналов TRPV4 реагента HC067047 (2-метил-1-(3-морфолин-4-илпропил)-5-фенил-N-[3-(трифлуорометил)фенил]пиррол-3-карбоксамид).
Далее клетки помещали в стандартные условия культивирования на 48 ч. Фотосъемку экспериментальных ран производили сразу после добавления реагентов (0 ч) и через 24 и 48 ч после начала экспериментов. Изображения получали на инвертированном микроскопе Биомед (Биомед, Россия) в фазовом контрасте (объектив 10×) с помощью цифровой камеры ToupCam 5.1 MP (ToupTek Photonics, Китай) под управлением специализированной программы ToupView (ToupTek Photonics, Китай). Площадь экспериментальных ран измеряли в программе ImageJ (National Institute of Health, США), пользуясь функцией обведения ран вручную (freehand selection). Площади ран через 24 и 48 ч после начала эксперимента нормализованы на соответствующие значения площади исходных ран (0 ч). Обработку числовых значений, их статистический анализ и построение графиков проводили в программе GraphPad Prism 8.0 (GraphPad Software, США). Динамика зарастания ран представлена на столбчатых диаграммах как средняя площадь раны (в %) и среднеквадратичное отклонение; все экспериментальные значения показаны на графиках (рис. 4–6). Перед статистическими сравнениями данные проверяли на соответствие нормальному распределению (критерий Шапиро−Уилка), отсутствие выбросов (критерий ROUT) и равенство дисперсий (F-тест). После этого данные сравнивали с применением двустороннего (two-tailed) t-критерия Стьюдента (t-тест), уровень различий P < 0.05 считали достоверным.
Рис. 3.
Результаты ПЦР с обратной транскрипцией (ОТ), демонстрирующие присутствие мРНК белков TRPV4 в эМСК (а) и иммунофлуоресцентное окрашивание эМСК специфическими антителами против белков TRPV4 (б). а – Расчетный продукт амплификации – 474 п.н. (показан стрелкой); ОТ(−) – отрицательный контроль (ПЦР-реакция без обратной MMLV транскриптазы; М – маркер длин фрагментов). б – Красный цвет – белки TRPV4, синий – окраска ядер DAPI; масштабная линейка – 50 мкм.
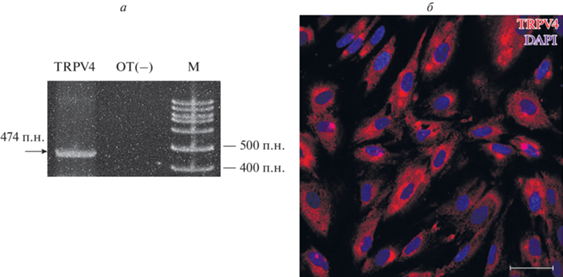
Рис. 4.
Влияние селективного активатора каналов Piezo1 (Yoda1, 10 мкМ) и его комбинации с ингибитором каналов TRPV4 соединением HC067047 (300 нМ) на миграционный потенциал эМСК с помощью метода зарастания экспериментальной раны. а – Репрезентативные изображения исходных ран (0 ч) и ран через 24 и 48 ч после культивирования клеток с реагентами; масштабная линейка – 100 мкм. б – Здесь и на рис. 5–6 представлены средние значения площадей оставшихся ран (в % от исходной площади) и их среднеквадратические отклонения через 24 и 48 ч после начала эксперимента; точки на диаграмме – все экспериментальные значения в каждом из наборов данных. (*) – различие достоверно при P < 0.05, # – нет статистически значимых различий (двусторонний t-критерий Стьюдента).

Рис. 5.
Селективный ингибитор каналов TRPV4 вещество HC067047 не влияет на зарастание экспериментальной раны эМСК. а – Репрезентативные изображения исходных ран (0 ч) и ран через 24 ч в контроле и после культивирования клеток с 300 нМ HC067047. б – Средние значения размеров оставшихся ран через 24 ч. Масштабная линейка – 100 мкм. # – нет статистически значимых различий (двусторонний t-критерий Стьюдента).
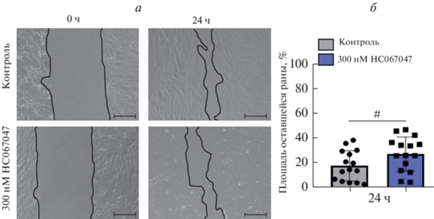
Рис. 6.
Присутствие в культуральной среде апиразы не влияет на ингибирующее действие Yoda1 при зарастании экспериментальных ран эМСК. а – Репрезентативные изображения исходных ран (0 ч) и ран через 24 и 48 ч культивирования клеток с реагентами. Масштабная линейка – 100 мкм. б – Средние значения размеров оставшихся ран через 24 и 48 ч. # – нет статистически значимых различий (двусторонний t-критерий Стьюдента, P < 0.05).

Иммунофлюоресцентная микроскопия. Для проведения иммунофлюоресцентного окрашивания эМСК, предварительно высеянные на покровные стекла (за 2–3 сут до экспериментов, итоговая конфлюэнтность 70–80%), фиксировали 4%-ным раствором параформальдегида в течение 10 мин. Затем клетки обрабатывали 0.25%-ным Tween-20 (10 мин) и инкубировали с 10% козьей сыворотки 1 ч для блокирования неспецифического присоединения антител к клеткам. Окраску первичными антителами к белкам TRPV4 (№ ACC-034; Alomone Labs, Израиль, разведение 1 : 100) проводили согласно стандартному протоколу (20–24 ч, 4°С). Далее клетки инкубировали с вторичными антителами, конъюгированными с флуоресцентным красителем Cy3 (Goat-Anti-Rabbit-Cy3; Santa Cruz, США, 1 : 200, 1 ч в темноте), ядра окрашивали DAPI (0.05 мкг/мл, 15 мин в темноте). Между всеми этапами окраски препараты промывали PBS. Все процедуры проводили при комнатной температуре, если не указано иное. После окрашивания препараты монтировали на предметных стеклах с использованием реагента, препятствующего выгоранию флуоресцентных красителей (Vectashield; Vector Labs, США). Для получения изображений использовали конфокальный микроскоп Olympus FV3000 с объективом 40×/NA1.3 (Olympus, Япония), доступный через Центр коллективного пользования Института цитологии РАН. Возбуждение флуоресценции производили лазерами с длинами волн 405 (для DAPI) и 568 нм (для Cy3). В качестве контроля использовали клетки, инкубированные только со вторичными антителами (Goat-Anti-Rabbit-Cy3, Santa Cruz, США, 1 : 200, 1 ч в темноте); в этих условиях флуоресценцию не наблюдали. Обработку изображений проводили с помощью плагина Olympus Viewer для программы ImageJ (NIH, США).
РЕЗУЛЬТАТЫ
В качестве первого шага мы решили проверить, экспрессируется ли мРНК гена hTRPV4 в эМСК. Мы провели реакцию ОТ-ПЦР и выявили продукт амплификации, соответствующий расчетному размеру для подобранных праймеров (рис. 3а, 474 п.н.), в клеточных лизатах, полученных из эМСК. Далее мы провели иммунофлуоресцентное окрашивание специфическими антителами, что позволило подтвердить присутствие белков TRPV4 в эМСК (рис. 3б). Таким образом, мы получили предварительные аргументы для дальнейшей проверки нашей первой рабочей гипотезы, основанной на данных о взаимодействии каналов Piezo1 и TRPV4 (Servin-Vences et al., 2017; Yoneda et al., 2019; Swain, Liddle, 2021).
Для проверки предположения о роли Piezo1-зависимой активации TRPV4 в подавлении миграционного потенциала стволовых клеток мы провели эксперименты по оценке клеточной подвижности эМСК с помощью метода зарастания экспериментальной раны (см. раздел “Материал и Методика”). В этих экспериментах мы исследовали действие селективного химического активатора механочувствительных каналов Piezo1 вещества Yoda1 (Syeda et al., 2015), селективного ингибитора каналов TRPV4 вещества HC067047 (Everaerts et al., 2010), а также их комбинации на миграцию эМСК.
В наших экспериментах присутствие в среде 10 мкМ Yoda1 приводило к ингибированию зарастания раны (рис. 4), как и было описано нами ранее (Chubinskiy-Nadezhdin et al., 2022). В то же время, добавление к клеткам 300 нМ HC067047 в присутствии Yoda1 не отменяло торможения миграции эМСК через 24 ч и при этом еще и замедляло зарастание раны через 48 ч (рис. 4а, б). Вещество HC067047 в используемой концентрация (300 нМ), согласно данным литературы, должно ингибировать >90% активности каналов TRPV4 (Everaerts et al., 2010). При этом добавление в культуральную среду только блокатора каналов TRPV4 само по себе не влияло на процесс зарастания раны (рис. 5) по сравнению с контролем (нет статистически значимых различий через 24 ч, и раны полностью зарастали в течение 48 ч). Таким образом, полученные экспериментальные данные (рис. 3–5) указывают на то, что, несмотря на присутствие в эМСК каналов TRPV4, их селективное ингибирование не отменяет эффекта Yoda1 на клеточную подвижность. Результаты позволяют нам, вероятно, исключить рабочую гипотезу, согласно которой подавление миграционного потенциала эМСК при химической стимуляции Piezo1 обусловлено последующей активацией каналов TRPV4. При этом полученные нами данные не исключают возможного взаимодействия каналов Piezo1 и TRPV4 в эМСК.
Наша вторая рабочая гипотеза базировалась на концепции, предлагаемой в работе из литературы (Mousawi et al., 2020), согласно которой селективная активация Piezo1 приводит к выбросу АТФ из клеток во внеклеточную среду, что, в свою очередь, запускает каскады пуринергического сигналлинга, которые и опосредуют влияние Yoda1 на клеточную подвижность МСК. Следует еще раз подчеркнуть, что в этой работе (Mousawi et al., 2020), проведенной на МСК, выделенных из пульпы зуба (hDP-MSCs), селективная химическая активация Piezo1 его агонистом Yoda1 ускоряла процессы заживления экспериментальной раны клеток hDP-MSC, в то же время, в аналогичных экспериментах мы наблюдали торможение миграции эМСК (Chubinskiy-Nadezhdin et al., 2022) и трансформированных фибробластов линии 3T3B-SV40 (Chubinskiy-Nadezhdin et al., 2019b) в присутствии Yoda1. Тем не менее, разнонаправленность эффектов Yoda1 может быть теоретически объяснена некоторой разницей в Piezo1-зависимых сигнальных путях в различных типах клеток, при общности механизмов Piezo1-зависимого выброса АТФ. Кроме того, обнаруженное подавление миграции эМСК при добавлении в среду АТФ (Semenova et al., 2020) свидетельствует в пользу предположений о роли внеклеточного АТФ в Yoda1-индуцированном ингибировании клеточной подвижности.
В уже упомянутой работе (Mousawi et al., 2020) присутствие в культуральной среде фермента апиразы, катализирующей гидролиз АТФ, отменяло действие Yoda1 на клеточную подвижность клеток hDP-MSC. Мы решили повторить экспериментальные протоколы, представленные в этой работе, и исследовать процессы клеточной подвижности эМСК при добавлении к клеткам апиразы совместно с Yoda1. Проведенные эксперименты показали, что эффект ингибирования клеточной подвижности эМСК при культивировании клеток с Yoda1 (10 мкМ) не отменяется в присутствии апиразы (5 ед.) (рис. 6а, б). В текущей работе и более ранней (Chubinskiy-Nadezhdin et al., 2022) мы использовали концентрацию Yoda1 на порядок выше (10 мкМ), чем цитируемые авторы (1 мкМ; Mousawi et al., 2020), что могло бы приводить к тому, что апираза не успевала катализировать расщепление большего количества АТФ, которое, теоретически, высвобождается при большей концентрации Yoda1. Учитывая такую возможность, мы использовали на порядок более высокую концентрацию (5 ед.) апиразы (по сравнению с 0.3 ед. в работе Mousawi et al., 2020) и, при этом, мы не наблюдали достоверного влияния апиразы на Yoda1-зависимое ингибирование подвижности эМСК.
Следует отметить, что концентрация апиразы, выбранная для экспериментов (Mousawi et al., 2020), была основана на измерениях уровня внеклеточного АТФ при Yoda1-зависимом выбросе из hDP-МСК (происходит высвобождение порядка 300 наномоль АТФ при действии 1 мкМ Yoda1: Mousawi et al., 2020). Относительно эффективности действия апиразы на АТФ принято, что 1 ед. апиразы катализирует расщепление 1 мкМ АТФ за 1 мин при 30°С (Molnar, Lorand, 1961). Использование нами высокой концентрации апиразы (5 ед., которая теоретически способна расщепить 5 мкМ АТФ за 1 мин) должно было хотя бы частично “отменить” действие Yoda1 (в случае действительной зависимости Yoda1-ингибирующего действия на подвижность эМСК от выброса АТФ во внеклеточную среду), чего мы не наблюдали ни через 24, ни через 48 ч.
Таким образом, совокупность проведенных независимых миграционных тестов с селективным ингибитором каналов TRPV4 (веществом HC067047) и АТФ-расщепляющим ферментом (апиразой) позволяет исключить существенный вклад механизмов, связанных с активацией TRPV4 или выбросом АТФ, в Piezo1-зависимое подавление миграционного потенциала эМСК.
ОБСУЖДЕНИЕ
В настоящее время существуют единичные экспериментальные работы, в которых было исследовано влияние селективной химической активации механочувствительных каналов Piezo1 на клеточную подвижность и миграционный потенциал МСК (Mousawi et al., 2020), при этом одна из работ – работа нашего научного коллектива (Chubinskiy-Nadezhdin et al., 2022). В упомянутых статьях задокументированы разнонаправленные эффекты Yoda1 – как повышение скорости миграции МСК из пульпы зуба (hDP-МСК, Mousawi et al., 2020), так и снижение миграционного потенциала МСК эндометрия человека (Chubinskiy-Nadezhdin et al., 2022). Разница в эффектах может быть объяснена, в частности, различием источников происхождения МСК, из-за чего функциональная активность Piezo1 может быть сопряжена с различными сигнальными каскадами, в зависимости от типа клеток. Стоит отметить, что повышение подвижности эМСК, вероятно, сопряжено с развитием таких патологий, как эндометриоз, в частности аденомиоз (Sudarikova et al., 2020).
Mousawi с соавторами (Mousawi et al., 2020) была предложена и проверена цепочка сигнальных событий, в ходе которых химическая активация Piezo1 приводит к выбросу АТФ с последующей активацией пуринергической системы, а расщепление АТФ апиразой отменяет стимулирующий эффект Yoda1 на миграцию hDP-МСК. Ранее было показано, что внеклеточный АТФ, напротив, дозозависимо тормозит миграцию эМСК, и этот эффект не опосредован участием рецепторов P2X7 (несмотря на их присутствие в эМСК), так как селективный ингибитор P2X7 не отменял действие АТФ на клеточную подвижность (Semenova et al., 2020). Вероятно, следует рассмотреть и возможное вовлечение других P2-рецепторов в наблюдаемое АТФ-зависимое подавление клеточной миграции эМСК, однако уровень их экспрессии и степень участия в физиологических реакциях эМСК в данное время остаются неизученными. В дополнение, АТФ существенно снижал пролиферацию эМСК через 48 ч действия (Semenova et al., 2020), сходный эффект наблюдали и в присутствии Yoda1 в культуральной среде (Chubinskiy-Nadezhdin et al., 2022). При этом не было отмечено гибели клеток, что свидетельствует о том, что наблюдаемое влияние АТФ и Yoda1 на пролиферацию эМСК, скорее всего, не связано со снижением их жизнеспособности.
Таким образом, результаты двух наших работ, вкупе с механизмом, предложенным Mousawi et al., (2020) позволяли рассматривать гипотезы о вероятном участии АТФ в Yoda1-зависимом подавлении миграции эМСК. Однако присутствие апиразы (катализующей быстрое расщепление АТФ) в культуральной среде не отменяло ингибирующего действия агониста Yoda1 на подвижность эМСК (рис. 6). Подводя итоги, можно заключить, что непротиворечивая гипотеза об участии внеклеточного АТФ в замедлении клеточной подвижности эМСК при селективной активации каналов Piezo1, по-видимому, не находит своего подтверждения. Возникает важный вопрос о том, вызывает ли Yoda1 выброс АТФ из эМСК, что может быть выявлено при прямых измерениях ее концентраций во внеклеточной среде, и который является адекватной и релевантной задачей для будущих исследований.
В то же время, не исключается и участие внутриклеточных и (или) мембранно-ассоциированных путей, которые могут модулироваться активностью механочувствительных каналов Piezo1 как в эМСК, так и в других экспериментальных объектах. В частности, интересно отметить, что селективная химическая активация Piezo1 при помощи Yoda1 приводила к дифференцировке МСК из костного мозга в остеогенном направлении и при этом ингибировала адипогенное направление дифференцировки. В качестве механизма было показано повышение экспрессии гена BMP2 (bone morphogenetic protein), то есть участие внутриклеточных механизмов регуляции экспрессии генов (Sugimoto et al., 2017). Учитывая возможность эМСК дифференцироваться в указанных направлениях (Zemel’ko et al., 2012), вполне вероятно, что Yoda1 мог бы схожим образом влиять и на дифференцировку эМСК, что формирует еще одно направление для дальнейших исследований.
Ранее нами было показано дозозависимое снижение миграционного потенциала трансформированных фибробластов мыши 3T3B-SV40 в присутствии различных концентраций агониста Yoda1. Более того, было выявлено, что селективная химическая активация Piezo1 приводит к поляризации клеток и частичной реверсии трансформированного фенотипа, включая интенсивное формирование стресс-фибрилл и сборку F-актина, что и может лежать в основе ингибирования миграции клеток 3T3B-SV40 (Chubinskiy-Nadezhdin et al., 2019b). В наших предварительных экспериментах не было обнаружено сборки F-актина в эМСК, несмотря на сходный эффект подавления их подвижности, как и в трансформированных фибробластах. Таким образом, имеющиеся данные не подтверждают предположения о роли перестроек цитоскелета в опосредовании эффекта подавления миграции клеток при гиперактивации Piezo1.
В наших экспериментах впервые показана экспрессия TRPV4 на уровне мРНК и белка в стволовых клетках эндометрия. В настоящее время данные литературы о роли и участии TRPV4 в физиологических процессах стволовых клеток крайне ограничены. В недавней работе было показано, что TRPV4 является ключевым участником механотрансдукции МСК, опосредуя быстрое увеличение концентрации внутриклеточных ионов кальция и индукцию экспрессии генов остеогенной дифференцировки при действии ламинарного потока жидкости (shear stress; Corrigan et al., 2018). Показано также участие каналов TRPV4 в процессах метастазирования раковых клеток, в том числе их инвазии и миграции. При этом селективное ингибирование каналов TRPV4 фармакологическим агентом HC067047, снижало скорость миграции и инвазии нескольких клеточных линий колоректального рака (Zhang et al., 2021). В наших экспериментах добавление ингибитора HC067047, само по себе, не влияло на скорость миграции эМСК (рис. 5). В то же время, одновременное присутствие HC067047 и Yoda1 в культуральной среде не только не приводило к отмене Yoda1-зависимого ингибирования клеточной подвижности, но и еще более замедляло ее через 48 ч (рис. 4). Полученные нами результаты свидетельствуют в пользу гипотез о функциональной активности TRPV4 в плазматической мембране эМСК, не исключая и возможное взаимодействие каналов Piezo1 и TRPV4, ранее показанное в нескольких типах клеток (Servin-Vences et al., 2017; Yoneda et al., 2019; Swain et al., 2020). Можно предположить Piezo1-опосредованный механизм, согласно которому TRPV4 может реагировать на механические раздражители, при этом не нуждаясь в собственной механочувствительности (Swain et al., 2020), которая постулируется в ряде работ (Scheraga et al., 2016; Lu et al., 2021). В еще одной работе (Yoneda et al., 2019) также было продемонстрировано, что селективный агонист каналов Piezo1 (Yoda1) индуцирует кальциевый ответ, который включает компоненту, опосредованную активацией TRPV4. Полученные нами данные не позволяют сказать, сопряжена ли активность Piezo1 и TRPV4 в плазматической мембране эМСК; ответ могли бы дать, в частности, измерения динамики изменений концентрации внутриклеточного кальция при добавлении ингибитора каналов TRPV4. Проведенные нами миграционные тесты однозначно свидетельствуют, что наблюдаемое подавление миграционного потенциала эМСК при химической стимуляции Piezo1 не обусловлено возможной активацией каналов TRPV4 (рис. 4).
Важно отметить, что ранее нами был обнаружен феномен сопряженной активации двух типов катионных каналов – Са2+-проницаемых механочувствительных (вероятный коррелят Piezo1) и Са2+-зависимых калиевых каналов большой проводимости (BK; Chubinskiy-Nadezhdin et al., 2017, Chubinskiy-Nadezhdin et al., 2019a). Возможно, что активация калиевых каналов может лежать в основе Yoda1-индуцированного подавления миграции эМСК, и это предположение должно быть проверено в ходе решения наших будущих экспериментальных задач. Кроме того, можно допустить, что подавление пролиферации и миграции клеток, наблюдаемое при продолжительном действии агониста Yoda1 может быть обусловлено массированным поступлением кальция из внеклеточной среды в цитозоль вследствие гиперактивности каналов Piezo1 (Chubinskiy-Nadezhdin et al., 2022). В пользу такого предположения свидетельствуют недавние данные об индукции апоптоза, обусловленного повышением концентрации внутриклеточных ионов кальция, триггером которого служит активация механочувствительных каналов Piezo1 (Hope et al., 2019).
Список литературы
Земелько В.И., Гринчук Т.М., Домнина А.П., Арцыбашева И.В., Зенин В.В., Кирсанов А.А., Бичевая Н.К., Корсак В.С., Никольский Н.Н. 2011. Мультипотентные мезенхимные стволовые клетки десквамированного эндометрия. Выделение, характеристика и использование в качестве фидерного слоя для культивирования эмбриональных стволовых линий человека. Цитология. Т. 53. № 12. С. 919–929. (Zemel’ko V.I., Grinchuk T.M., Domnina A.P., Artsybasheva I.V., Zenin V.V., Kirsanov A.A., Bichevaia N.K., Korsak V.S., Nikol’skii N.N. 2012. Multipotent mesenchymal stem cells of desquamated endometrium: Isolation, characterization, and application as a feeder layer for maintenance of human embryonic stem cells. Cell Tiss. Biol. V. 6. P. 1–11.)
Сударикова А.В., Шилина М.А., Чубинский-Надеждин В.И., Гринчук Т.М., Морачевская Е.А., Негуляев Ю.А. 2019. Повышенная миграционная способность эндометриальных мезенхимных стволовых клеток при аденомиозе. Цитология. Т. 61. № 12. С. 964–970. (Sudarikova A.V., Shilina M. A., Chubinskiy-Nadezhdin V.I., Grinchuk T.M., Morachevskaya E.A., Negulyaev Y.A. 2020. Increased migration ability of adenomyosis-derived endometrial mesenchymal stem cells. Cell Tiss. Biol. V. 14. P. 190.)
Banu S.K., Lee J., Speights V.O. Jr., Starzinski-Powitz A., Arosh J.A. 2008. Cyclooxygenase-2 regulates survival, migration, and invasion of human endometriotic cells through multiple mechanisms. Endocrinol. V. 149. P. 1180.
Chen L., Qu J., Cheng T., Chen X., Xiang C. 2019. Menstrual blood-derived stem cells: Toward therapeutic mechanisms, novel strategies, and future perspectives in the treatment of diseases. Stem Cell Res. Ther. V. 10. P. 406.
Chubinskiy-Nadezhdin V. I., Sudarikova A.V., Shilina M.A., Vasileva V.Y., Grinchuk T.M., Lyublinskaya O.G., Nikolsky N.N., Negulyaev Y.A. 2019a. Cell cycle-dependent expression of BK channels in human mesenchymal endometrial stem cells. Sci. Rep. V. 9. P. 4595.
Chubinskiy-Nadezhdin V.I., Vasileva V.Y., Pugovkina N.A., Vassilieva I.O., Morachevskaya E.A., Nikolsky N.N., Negulyaev Y.A. 2017. Local calcium signalling is mediated by mechanosensitive ion channels in mesenchymal stem cells. Biochem. biophys. Res. Commun. V. 482. P. 563.
Chubinskiy-Nadezhdin V.I., Vasileva V.Y., Vassilieva I.O., Sudarikova A.V., Morachevskaya E.A., Negulyaev Y.A. 2019b. Agonist-induced Piezo1 activation suppresses migration of transformed fibroblasts. Biochem. biophys. Res. Commun. V. 514. P. 173.
Chubinskiy-Nadezhdin V., Semenova S., Vasileva V., Shatrova A., Pugovkina N., Negulyaev Y. 2022. Store-Operated Ca2+ Entry Contributes to Piezo1-Induced Ca2+ Increase in Human Endometrial Stem Cells. Int. J. Mol. Sci. V. 23. P. 3763.
Corrigan M.A., Johnson G.P., Stavenschi E., Riffault M., Labour M.N., Hoey D.A. 2018. TRPV4-mediates oscillatory fluid shear mechanotransduction in mesenchymal stem cells in part via the primary cilium. Sci. Rep. Vol. 8. P. 3824.
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop D.J., Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytother. V. 8. P. 3157.
Everaerts W., Zhen X., Ghosh D., Vriens J., Gevaert T., Gilbert J.P., Hayward N.J., McNamara C.R., Xue F., Moran M.M., Strassmaier T., Uykal E., Owsianik G., Vennekens R., De Ridder D. et al. 2010. Inhibition of the cation channel TRPV4 improves bladder function in mice and rats with cyclophosphamide-induced cystitis. Proc. Natl. Acad. Sci. USA. V. 107. P.19084.
Hope J.M., Lopez-Cavestany M., Wang W., Reinhart-King C.A., King M.R. 2019. Activation of Piezo1 sensitizes cells to TRAIL-mediated apoptosis through mitochondrial outer membrane permeability. Cell Death Dis. V. 10. P. 837.
Lu Q., Zemskov E.A., Sun X., Wang H., Yegambaram M., Wu X., Garcia-Flores A., Song S., Tang H., Kangath A., Cabanillas G.Z., Yuan J.X., Wang T., Fineman J.R., Black S.M. 2021. Activation of the mechanosensitive Ca2+ channel TRPV4 induces endothelial barrier permeability via the disruption of mitochondrial bioenergetics. Redox Biol. V. 38. P.101785.
Molnar J., Lorand L. 1961. Studies on apyrases. Arch. Biochem. Biophys. V. 93. P. 353.
Mousawi F., Peng H., Li J., Ponnambalam S., Roger S., Zhao H., Yang X., Jiang L.H. 2020. Chemical activation of the Piezo1 channel drives mesenchymal stem cell migration via inducing ATP release and activation of P2 receptor purinergic signaling. Stem Cells. V. 38. P. 410.
Scheraga R.G., Abraham S., Niese K.A., Southern B.D., Grove L.M., Hite R.D., McDonald C., Hamilton T.A., Olman M.A. 2016. TRPV4 Mechanosensitive ion channel regulates lipopolysaccharide-stimulated macrophage phagocytosis. J. Immunol. V. 196. P. 428.
Semenova S., Shatrova A., Vassilieva I., Shamatova M., Pugovkina N., Negulyaev Y. 2020. Adenosine-5'-triphosphate suppresses proliferation and migration capacity of human endometrial stem cells. J. Cell Mol. Med. V. 24. P. 4580.
Servin-Vences M.R., Moroni M., Lewin G.R., Poole K. 2017. Direct measurement of TRPV4 and PIEZO1 activity reveals multiple mechanotransduction pathways in chondrocytes. Elife. V. 6. P. e21074. https://doi.org/10.7554/eLife.21074
Sugimoto A., Miyazaki A., Kawarabayashi K., Shono M., Akazawa Y., Hasegawa T., Ueda-Yamaguchi K., Kitamura T., Yoshizaki K., Fukumoto S., Iwamoto T. 2017. Piezo type mechanosensitive ion channel component 1 functions as a regulator of the cell fate determination of mesenchymal stem cells. Sci. Rep. V. 7. P. 17696.
Swain S.M., Liddle R.A. 2021. Piezo1 acts upstream of TRPV4 to induce pathological changes in endothelial cells due to shear stress. J. Biol. Chem. Vol. 296. P. 100171. https://doi.org/10.1074/jbc.RA120.015059
Swain S.M., Romac J.M., Shahid R.A., Pandol S.J., Liedtke W., Vigna S.R., Liddle R.A. 2020. TRPV4 channel opening mediates pressure-induced pancreatitis initiated by Piezo1 activation. J. Clin. Invest. V. 130. P. 2527.
Syeda R., Xu J., Dubin A.E., Coste B., Mathur J., Huynh T., Matzen J., Lao J., Tully D.C., Engels I.H., Petrassi H.M., Schumacher A.M., Montal M., Bandell M., Patapoutian A. 2015. Chemical activation of the mechanotransduction channel Piezo1. Elife. V. 22. P. 4. e07369. https://doi.org/10.7554/eLife.07369
Wang Y., Chi S., Guo H., Wang Y., Chi S., Guo H., Li G., Wang L., Zhao Q., Rao Y., Zu L., He W., Xiao B. 2018. A lever-like transduction pathway for long-distance chemical- and mechano-gating of the mechanosensitive Piezo1 channel. Nature communications. V. 9. P. 1300.
Yoneda M., Suzuki H., Hatano N., Nakano S., Muraki Y., Miyazawa K., Goto S., Muraki K. 2019. PIEZO1 and TRPV4, which are distinct mechano-sensors in the osteoblastic MC3T3-E1 cells, modify cell-proliferation. Int. J. Mol. Sci. V. 20. P. 4960. https://doi.org/10.3390/ijms20194960
Zhang P., Xu J., Zhang H., Liu X.Y. 2021. Identification of TRPV4 as a novel target in invasiveness of colorectal cancer. BMC Cancer. V. 21. P. 1264.
Дополнительные материалы отсутствуют.


