Цитология, 2022, T. 64, № 6, стр. 573-580
Распределение клеток меланомы B16 по фазам клеточного цикла под воздействием дакарбазина
Е. З. Лапкина 1, А. Р. Есимбекова 1, В. Д. Беленюк 2, А. А. Савченко 2, Т. Г. Рукша 1, *
1 Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого
660022 Красноярск, Россия
2 Научно-исследовательский институт медицинских проблем Севера
660022 Красноярск, Россия
* E-mail: tatyana_ruksha@mail.ru
Поступила в редакцию 07.07.2022
После доработки 21.07.2022
Принята к публикации 31.08.2022
- EDN: GTJXMI
- DOI: 10.31857/S0041377122060074
Аннотация
Одним из механизмов развития лекарственной устойчивости опухолевых клеток является обратимый переход в фазу покоя (G0) клеточного цикла. В эксперименте был использован цитостатический препарат дакарбазин, которым воздействовали на клетки меланомы линии B16 для изучения распределения клеток по фазам клеточного цикла и способности переходить в фазу G0 с помощью методов иммуноцитохимии и проточной цитометрии с использованием окрашивания клеток для выявления белка Ki-67. Показано, что при воздействии дакарбазином на клетки меланомы B16 увеличивается пул G0-положительных клеток, а также происходит снижение доли клеток в фазах G1 и G2 клеточного цикла.
Меланома – злокачественное новообразование кожи, развивающееся из меланоцитов, клеток нейронального происхождения (McConnell, Zon, 2021). Несмотря на внедрение в клиническую практику BRAF-ингибиторов и модуляторов контрольных точек иммунного ответа опухолевых клеток, терапия меланомы остается сложной задачей для онкологов из-за высокой инвазивности и быстрой диссеминации опухоли, что, в свою очередь, обусловлено рядом факторов (Gyrylova et al., 2014). В данном контексте репарация ДНК рассматривается как важный процесс приобретения опухолевыми клетками лекарственной устойчивости (Mattia et al., 2018). Повреждение ДНК может индуцироваться целым рядом стрессовых агентов, в том числе противоопухолевыми препаратами, что вызывает остановку клеточного цикла, инициацию процессов репарации ДНК или гибель клетки. В зависимости от нахождения клетки в той или иной фазе клеточного цикла и активности контрольных точек клеточного цикла может меняться чувствительность к химиотерапевтическому агенту (Shah, Schwartz, 2001). Репарация ДНК опухолевых клеток зависит от функционирования контрольных точек в фазах S и G2 клеточного цикла.
В выборе стратегии противоопухолевой терапии наиболее привлекательной терапевтической мишенью является таргетное воздействие на контрольную точку фазы G2, так как контрольная точка S-фазы способствует лишь замедлению клеточного цикла. Клетка с поврежденной ДНК может пройти контрольную точку S-фазы до остановки в G2. Арест G2 не позволяет включаться механизмам репарации ДНК, в результате чего клетки переходят в состояние апоптоза (Xu, McArthur, 2016). Опухолевая трансформация меланоцитов сопровождается увеличением пролиферации, что связано с изменениями регуляции клеточного цикла, опосредуемыми многочисленными молекулами. При переходе G1/S ключевыми белками-регуляторами клеточного цикла являются pRb, p16INK4a (p16), циклин D1, p27Kip1 (p27), p53 и p21Waf1/Цип1 (p21) (Li et al., 2006). В реализации апоптоза опухолевых клеток участвует сигнальный каскад киназ МАPK, регулирующий активность контрольных точек клеточного цикла, особенно при переходе G2/M (Manke et al., 2005). Известно, что в основе геномной нестабильности и прогрессирования меланомы лежат дефекты реакции на повреждение ДНК, при этом около 50–75% меланом имеют мутации в гене BRAF, кодирующем компонент сигнального каскада МАРК (Cheng et al., 2018). Экспрессия проонкогенного BRAF может негативно влиять на функциональную активность контрольной точки G2 в клетках с дефектами p16 и p53, тем самым усиливая нестабильность генома в клетках с повреждением ДНК.
Одним из недавно идентифицированных процессов, который вносит вклад в развитие лекарственной устойчивости клеток меланомы, является переход клеток в дормантное (дремлющее) состояние – обратимый переход в фазу покоя (G0) клеточного цикла (Ruksha, 2019). Показано, что дормантные клетки, устойчивые к действию противоопухолевых агентов, могут избегать апоптоз-индуцирующих стимулов и ответа со стороны системы иммунобиологического надзора (Risson et al., 2020). Таким образом, изучение механизмов инициации перехода опухолевых клеток в фазу покоя клеточного цикла, характеризация фенотипа пула покоящихся клеток имеет потенциальную клиническую значимость в онкологии. Ранее нами было показано, что свойством инициации дормантности обладает в отношении клеток меланомы вемурафениб (Николаева, 2020). Дакарбазин является стандартным химиотерапевтическим средством при диссеминированных формах меланомы, который оказывает противоопухолевое действие в основном за счет алкилирования ДНК, вызывающее остановку клеточного цикла с последующим развитием апоптоза или некроза клеток. К сожалению, лечение дакарбазином неэффективно у большинства пациентов (85–90%) (Huncharek et al., 2001). Только 2% из всех пациентов с метастатической меланомой, получающих это лечение, демонстрируют значительный ответ и только 11.2% демонстрируют частичный ответ (Lui et al., 2007). Устойчивость к дакарбазину связана с активацией антиапоптотических механизмов, аутофагией и репарацией ДНК в опухолевых клетках (Al-Qatati et al., 2017). Несмотря на свои умеренные эффекты, дакарбазин продолжает оставаться стандартным методом лечения метастатической меланомы, поскольку ни одно другое химиотерапевтическое лечение не показало более выраженного эффекта (Domingues et al., 2018). Помимо этого, дакарбазин используется как референсный метод терапии при разработке новых способов лечения диссеминированной формы опухоли (Chapman et al., 2011). Известно, что дакарбазин способен вызывать арест клеточного цикла в фазах S и G2/M клеток меланомы (Olszewska-Słonina et al., 2005).
В связи со сказанным выше, вероятно, что низкая эффективность дакарбазина может быть обусловлена, в том числе, обратимым переходом клеток меланомы в состояние G0 в качестве механизма избегания апоптоза и в дальнейшем приводить к прогрессии заболевания.
Таким образом, цель настоящей работы заключалась в изучении влияния дакарбазина на распределение клеток меланомы линии B16 по фазам клеточного цикла и способности клеток переходить в дормантное состояние (фазу покоя G0).
МАТЕРИАЛ И МЕТОДИКА
Клеточные линии и условия их культивирования. Использовали клеточную линию меланомы B16, любезно предоставленную НИИ клинической иммунологии (Новосибирск, Россия). Клетки культивировали в среде RPMI-1640 (ПанЭко, Москва, Россия), содержащей 10% эмбриональной телячьей сыворотки (FBS) (HyClone, GmbH, Parsching, Австрия) и 1% антибиотика/антимикотика (Gibco Life Technologies, Гранд-Айленд, США). Клетки культивировали в инкубаторе при 37°С и 5% СО2 (Sanyo MSO-5AC, Осака, Япония).
МТТ-тест. Концентрацию полумаксимального ингибирования (IC50) и максимального ингибирования (2 × IC50) активности клеточного метаболизма на 50 и 100% соответственно противоопухолевым агентом дакарбазин (Sigma-Aldrich, Сент-Луис, США) оценивали для клеточной линии меланомы B16 с помощью реакции восстановления соли тетразолия (МТТ-тест). В стерильные 96-луночные планшеты высевали 2 × 104 кл./мл. Через 24 ч меняли питательную среду на среду, содержащую дакарбазин в диапазоне конечных концентраций 0–1000 мкг/мл, и клетки культивировали при 37°C и 5% CO2 в течение 72 ч. Клетки без добавления препарата служили контролем. Затем клетки промывали фосфатно-солевым буферным раствором (PBS), добавляли питательную среду с 5 мг/мл реагента МТТ-бромида (Invitrogen, Thermo Fisher Scientific, Inc., Нидерланды) в каждую лунку, инкубировали еще 4 ч, затем среду осторожно удаляли и добавляли по 100 мкл ДМСО (Helicon, Москва, Россия) в каждую лунку для растворения образовавшихся кристаллов МТТ-формазана. Оптическую плотность (ОП) измеряли при длине волны 560 нм на спектрофотометре Эфос-9305 (Фотосистемы Швабе, Москва, Россия). Значения IC50 определяли по калибровочной зависимости метаболической активности от концентрации препарата.
В дальнейшем клетки подвергали воздействию дакарбазином в течение 72 ч в концентрациях, соответствующих 1 × IC50 и 2 × IC50. После этого культуральную среду, содержащую дакарбазин, заменяли стандартной (указанной выше). Клетки культивировались дополнительно 48 ч с целью преимущественной элиминации апоптотических клеток (согласно данным из литературы о превалирующем развитии апоптоза в первые 48 ч после воздействия повреждающим агентом (Mhaidat et al., 2007)).
Иммуноцитохимия. Клетки, культивируемые в 24‑луночных планшетах в течение 72 ч в присутствии дакарбазина и далее в течение 48 часов в RPMI с FBS, 1% антибиотика/антимикотика, но без дакарбазина, в дальнейшем промывали PBS, фиксировали 10%-ным формалином и пермеабилизировали 0.5% Triton X100 (Biotechnik GmbH, Гайберг, Германия) в течение 10 мин при комнатной температуре. Затем клетки инкубировали в культуральной среде в течение ночи при 4°С с первичными кроличьими моноклональными антителами к Ki-67 (ab15580; Abcam, США) в разведении 1 : 100 в присутствии 10% FBS. В качестве вторичных антител использовали козьи антикроличьи антитела Alexa Fluor 488 IgG (H+L) в разведении 1 : 200 (Invitrogen, Thermo Fisher Scientific, США) при комнатной температуре в темноте в течение 1 ч. Ядра окрашивали DAPI (1 мкг/мл; AppliChem GmbH, Дармштадт, Германия) в течение 15 мин. Клетки считали не менее чем в 10 полях зрения с использованием станции визуализации клеток Floid (Thermo Fisher Scientific, Карлсбад, США). Ядра пролиферирующих клеток окрашивались в зеленый цвет, тогда как ядра непролиферирующих живых клеток окрашивались в синий цвет. Результаты выражали средними значениями количества клеток (%) на стадии G0.
Анализ распределения клеток по фазам клеточного цикла с помощью антител к Ki-67 методом проточной цитометрии. Влияние на распределение фаз клеточного цикла клеток меланомы оценивали с помощью проточной цитометрии. Клетки меланомы В16 культивировали во флаконах объемом 25 см2 и подвергали воздействию дакарбазином в течение 72 ч при 37°С; определяли (IC50, 2 × IC50 ). Через 72 ч клетки промывали PBS (Хеликон, Москва, Россия), помещали в свежую питательную среду и культивировали еще 48 ч. Затем клетки промывали PBS, фиксировали 10%-ным формалином, пермеабилизировали 0.1%-ным Тритоном X100 и инкубировали с моноклональными антителами к Ki-67 (SolA15), FITC, eBioscience (Invitrogen, Thermo Fisher Scientific, Карлсбад, США) в концентрации 1 : 100 и 100 мкг/мл окрашивающего раствора йодистого пропидия (PI) (Invitrogen, Thermo Fisher Scientific, Карлсбад, США). Долю клеток в каждой фазе определяли с помощью проточного цитометра Cytomics FC-500 (Beckman Coulter, Inc.) с использованием программного обеспечения Navios Software v. 1.2 и Kaluza v. 2.1.1 (версия 2.2; Beckman Coulter, Квебег, Канада), используя лазер с длиной волны 488 нм и необходимые фильтры. Полоса пропускания для FITC составляла 530/30 нм и для PI – 610/20 нм. В каждой пробе анализировали не менее 50 тыс. клеток. Гейтирование клеток, находящихся на разных стадиях клеточного цикла, осуществляли в логарифмическом режиме. Клетки, находящиеся в фазе G0, являются негативными по Ki-67 и имеют низкие уровни PI, их гейтирование осуществляли в диапазоне значений до 100 отн. ед. по шкале флуоресценции Ki67−FITC (отрицательный результат) и в диапазоне значений флуоресценции PI 0.7–1.3 отн. ед. Анализ распределения клеток по фазам клеточного цикла методом проточной цитометрии проводили в Центре коллективного пользования КНЦ СО РАН.
Статистическая обработка. Все эксперименты повторяли трижды. Полученные значения представлены как средние значение из трех повторностей и их стандартные отклонения. Различия считали статистически значимыми при Р < 0.05. Статистическую обработку проводили с помощью U-критерия Манна–Уитни в программе Statistica 7.0 (StatSoft, Россия). Статистические результаты получены с использованием GraphPad Prism (GraphPad Software, USA).
РЕЗУЛЬТАТЫ
Определение значений IC50 и 2 × IC50 дакарбазина для клеток меланомы проводили на основании МТТ-теста. Результат снижения метаболической активности клеток может являться как следствием их апоптоза, так и перехода в фазу покоя. После воздействия дакарбазина на клетки меланомы B16 наблюдали снижение активности метаболизма при увеличении его концентрации. В ходе анализа МТТ-теста определили ингибирующие клетки B16 концентрации IC50 и 2 × IC50 дакарбазина, которые составили соответственно 1.86 и 3.73 мМоль/л (рис. 1).
Рис. 1.
Изменение активности метаболизма клеток меланомы B16 в зависимости от концентрации дакарбазина после 72-часового воздействия. Результаты МТТ-теста представлены в виде средних значений.

При микроскопическом исследовании культуры клеток после воздействия дакарбазином наблюдали изменения их морфологиии: звездчатая форма клеток с соединяющими клетки ламеллоподиями изменялась на веретенообразную удлиненную форму без ламеллоподий с упорядоченным столбчатым расположением (рис. 2). Отмечали большое количество клеток с крупными ядрами, что может косвенно свидетельствовать об увеличении плоидности клеток меланомы B16.
Рис. 2.
Клетки меланомы B16 в контроле (а) и после воздействия дакарабазина в концентрации полумаксимального ингибирования (1.86 ммоль/л; б) в течение 72 ч.

Для разделения клеток в фазах G0/G1 и выявления доли G0-положительных (покоящихся) клеток в дальнейшем, при изучении распределения клеток по фазам клеточного цикла с помощью проточной цитометрии использовали окрашивание клеток моноклональными антителами к Ki-67, которые позволяют визуализировать клетки, находящиеся во всех фазах клеточного цикла за исключением G0.
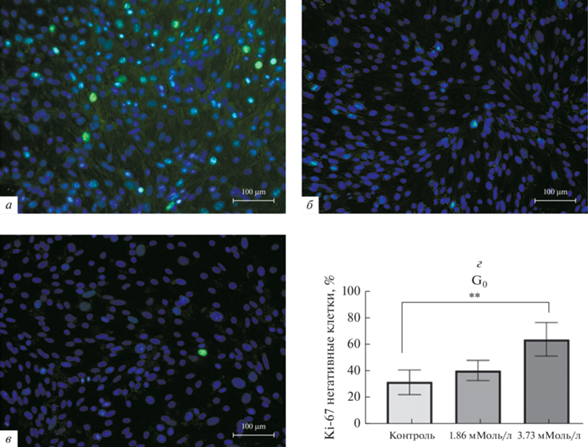
По результатам иммуноцитохимического окрашивания доля Ki-67-негативных, G0-позитивных, клеток увеличивалась в 2 раза при воздействии дакарбазином в концентрации 3.73 мМоль/л, соответствующей 2 × IC50 (рис. 3).
Рис. 3.
Клетки меланомы линии B16, окрашенные флуоресцентно мечеными антителами к Ki-67 через 48 ч после прекращения действия дакарбазина. а – Контроль (К), б – дакарбазин в концентрации 1.86 мМоль/л (IC50), в – дакарбазин (Д) в концентрации 3.73 мМоль/л (2 × IC50); ядра Ki-67-положительных клеток окрашены в зеленый цвет, ядра Ki-67-негативных (G0-позитивных) клеток – в синий (окраска DAPI). г – Графическое отображение полученных результатов; указана концентрация дакарбазина; (**) – различия между контролем и действием 3.73 мМоль/л дакарбазина достоверны при Р ≤ 0.05.
При воздействии на клетки меланомы дакарбазином в концентрации 340 мкг/мл, соответствующей IC50, по результатам проточной цитометрии отмечали увеличение доли клеток в фазах G0 и в S в 1.95 и в 2.44 раза соответственно, а доли клеток, находящихся в фазах G1 и G2 снижались в 1.44 и 3.22 раза соответственно. В негативной популяции присутствовали клетки с содержанием ДНК, превышающем значения, характерные для фаз G0/G1, что, может быть также связано с дефектом митотической сегрегации и повышением доли анеуплоидных клеток под действием препарата, описанным ранее (Reyes-Reyes et al., 2013). После воздействия дакарбазином на клетки меланомы B16 в концентрации 680 мкг/мл, что соответствовало 2 × IC50, отмечали увеличение доли клеток в фазаз G0 и S в 3.43 и 2.50 раза соответственно, снижение в 2.58 раза доли клеток в фазе G1 и в 1.70 раза в фазе G2 (рис. 4).
Рис. 4.
Распределение клеток меланомы B16 по фазам клеточного цикла через 48 ч после прекращения действия дакарбазина. Проточная цитометрия. По горизонтали и вертикали – интенсивность флуоресценции йодида пропидия (PI) и анти-Ki-67 моноклональных антител соответственно. G0-позитивные клетки находятся в нижнем квадранте. а – Контроль (без воздействия), б – 1.86 мМоль/л (IC50) дакарбазина, в – 3.73 мМоль/л (2 × IC50) дакарбазина. г – Процентное распределение клеток по фазам клеточного цикла до и после воздействия дакарбазина; показаны средние значения и их ошибки; различия между контролем и действием 1.86 мМоль/л (*) или 3.73 мМоль/л (**) дакарбазина достоверны при Р ≤ 0.05.

Таким образом, установлено увеличение пула G0-положительных клеток при воздействии цито-статическим препаратом дакарабазин.
ОБСУЖДЕНИЕ
Поскольку в литературе есть данные о присутствии в гетерогенной популяции опухолевых клеток G0-позитивных клеток, а также о возможности перехода опухолевых клеток в фазу покоя под воздействием разнообразных стрессовых факторов (Cappel et al., 2018), мы осуществили культивирование клеток меланомы в присутствии противоопухолевого препарата дакарбазин с последующей оценкой доли покоящихся (G0-позитивных) опухолевых клеток и динамики ее изменений.
Алкилирующие агенты, к которым относится дакарбазин, широко применяются в терапии злокачественных новообразований, в том числе меланомы кожи, на протяжении нескольких десятков лет. Установлено, что дакарбазин вызывает остановку клеточного цикла преимущественно в фазах G2/M с последующим развитием клеточного старения и апоптоза. Однако ранее выполненные нами исследования показали, что определенная доля клеток меланомы (10–15%) сохраняет жизнеспособность после воздействия дакарбазина, что, в свою очередь, может быть связано с развитием лекарственной устойчивости (Tyumentseva et al., 2021). Известно, что дакарбазин характеризуется низкой эффективностью в отношении меланомы, хотя точные механизмы этого остаются до сих пор неясными.
В первую очередь, при воздействии дакарбазином на клетки мышиной меланомы В16 наблюдали очевидные визуальные изменения морфологии клеток. В частности, клетки приобретали веретенообразную форму с отсутствием ламеллоподий. Действительно, целый ряд публикаций указывает на то, что алкилирующие агенты вызывают изменения цитоскелета в опухолевых клетках, связывая это с меняющейся способностью к миграции и инвазии опухолевых клеток (Wang et al., 2016; Avci et al., 2020).
В ряде работ по исследованию влияния дакарбазина на клеточный цикл есть сведения об эффектах дакарбазина на процессы некроза, апоптоза клеток меланомы и остановку клеточного цикла в фазах S и G2/М (Huang et al., 2017). Дакарбазин и другие алкилирующие агенты продемонстрировали способность индуцировать блок клеточного цикла в фазах G1 и G2. Установлено, что клетки после блока G2/M более восприимчивы к индукции апоптоза по сравнению с более устойчивыми клетками после остановки клеточного цикла в фазе G1, которые способны обратимо выходить из клеточного цикла, переходить в фазу G0 или развивать стресс эндоплазматического ретикулума, что приводит к деградации поврежденных белков и сохранению жизнеспособности опухолевых клеток (Hill et al., 2014; Beaumont et al., 2016). Наши результаты проточной цитометрии подтверждают способность дакарбазина снижать долю клеток в фазах G1 и G2 клеточного цикла с параллельным повышением доли клеток в фазе G0 клеточного цикла.
Часто генетическим и эпигенетическим изменениям при онкологических заболеваниях подвергаются регуляторы клеточного цикла, такие как циклин D1/CDK4/pRb. Известно, что сигнальный каскад циклин D/p16–CDK4/6-Rb нарушен в 90% меланом и, следовательно, является очевидной терапевтической мишенью для этого заболевания. Основным результатом активации CDK4 является фосфорилирование Rb. Кроме того, CDK4 непосредственно фосфорилирует другие белки, которые способствуют прогрессии клеточного цикла и ингибируют клеточное старение и апоптоз (Sheppard, McArthur, 2013). Основываясь на роли CDK4 и CDK1 в развитии клеточного цикла, можно предположить, что их ингибирование под воздействием химиотерапевтических препаратов может вызывать остановку клеток в G1 или G2 (Joshi et al., 2007).
Для определения доли G0-положительных клеток меланомы B16 после воздействия дакарбазином мы использовали маркер пролиферации опухолевых клеток Ki-67. Распределение Ki-67 резко меняется во время прогрессии клеточного цикла, что связано с различными его функциями. Во время интерфазы он необходим для распределения гетерохроматиновых антигенов и ядрышковой ассоциации гетерохроматина, а во время митоза – для формирования перихромосомного слоя, рибонуклеопротеиновой оболочки, покрывающей хромосомы. В фазе G0 клетки становятся отрицательными по антигену Ki-67, в то время как во всех других фазах клеточного цикла этот антиген присутствует (Sun et al., 2018).
Как отмечалось выше, арест клеточного цикла, переход клеток в G0 с последующим развитием апоптоза наблюдается через 72 ч культивирования в присутствии дакарбазина (Mhaidat et al., 2007; Sun et al., 2018; Pawlowska, 2018). Мы оценивали распределение клеток меланомы по фазам клеточного цикла после воздействия дакарбазином через 5 сут с помощью проточной цитометрии (72 ч культивирования с дакарбазином и 48 ч культивирования в стандартной среде после элиминации апоптических клеток). Повышение доли G0-положительных клеток может рассматриваться как механизм перепрограммирования опухолевых клеток под действием повреждающего фактора, которым в данном случае является дакарбазин, накопления мутаций и транскрипционного перепрофилирования, позволяющего обеспечить выживаемость опухолевых клеток.
Увеличение доли клеток в фазе G0 под воздействием дакарбазина может свидетельствовать о снижении активности сигнального пути MAPK−ERK1/2 и PI3K/AKT (Ossowski et al., 2010). Регуляция хода клеточного цикла осуществляется соотношением сигнальных путей киназ ERK1/2 и p38. Высокий уровень активности ERK1/2 способствуют пролиферации, тогда как повышенная активность MAP-киназы p38 активирует ответ каскада белков, способствуя аресту клеточного цикла и сохранению жизнеспособности клеток (Fares et al., 2020).
При иммуноцитохимическом анализе было также выявлено увеличение доли G0-положительных клеток после воздействия дакарбазином, что соотносится с результатами проточной цитометрии. В митотических клетках Ki-67 локализуется в области перихромосомного слоя, что выражено характерным ярким зеленым окрашиванием. При вступлении клеток в раннюю фазу G1 наблюдается фокальный характер экспрессии Ki-67 в ядрах клеток, что при иммунофлуоресцентной микроскопии выражено в виде единичных зеленоватых вкраплений (Matheson, Kaufman, 2017).
Таким образом, при воздействии дакарбазином на клетки меланомы B16 в клеточном цикле увеличивается доля G0-положительных клеток, а также происходит снижение доли клеток в фазах G1 и G2. С учетом сохраняющейся способности покоящихся G0-положительных клеток к пролиферации, феномен перехода в G0, в равной степени как и сама популяция таких клеток, может быть целенаправленным объектом в рамках противоопухолевой терапии. Помимо этого, ранее мы наблюдали схожие изменения в клетках меланомы после воздействия таргетным препарата вемурафениб, ингибитора белка BRAF (Николаева, 2020), что может указывать на универсальность подобных изменений вне зависимости от действующего лекарственного средства, и подчеркивает необходимость разработки целенаправленных стратегий в отношении G0-положительных клеток.
Список литературы
Зинченко И.С., Палкина Н.В., Рукша Т.Г. 2022. Изменение профиля микроРНК в клетках меланомы, резистентных к действию дакарбазина. Цитология. Т. 64. № 1. С. 26. (Zinchenko I.S., Palkina N.V., Ruksha T.G. 2022.Changes in miRNA profile in melanoma cells resistant to dacarbazine. Tsitologiya. V. 64. № 1. S. 26.)
Николаева Е.Д., Дубовцева И.Ю., Белоногов Р.Н., Наркевич А.Н., Мошев А.В., Савченко А.А., Рукша Т.Г. 2020. Вемурафениб индуцирует повышение уровня дормантных (Ki-67-негативных) клеток при BRAF-негативном статусе меланомы. Цитология. V. 62. № 11. С. 793. (Nikolaeva E.D., Dubovtseva I.Yu., Belonogov R.N., Narkevich A.N., Moshev A.V., Savchenko A.A., Ruksha T.G. 2020. Vemurafenib induces an increase in dormant (Ki-67-negative) cells in BRAF-negative melanoma. Tsitologiya. V.62. № 11. P. 793.)
Al-Qatati A., Aliwaini S. 2017. Combined pitavastatin and dacarbazine treatment activates apoptosis and autophagy resulting in synergistic cytotoxicity in melanoma cells. Oncol. Letters. V. 14. P. 7993.
Avci N.G., Ebrahimzadeh-Pustchi S., Akay Y.M., Esquenazi Y., Tandon N., Zhu J.J., Akay M. 2020. NF-κB inhibitor with Temozolomide results in significant apoptosis in glioblastoma via the NF-κB(p65) and actin cytoskeleton regulatory pathways. Sci. Rep. V. 10. P. 13352.
Beaumont K.A., Hill D.S., Daignault S.M., Lui G., Sharp D.M., Gabrielli B., Weninger W., Haass N.K. 2016. Cell cycle phase-specific drug resistance as an escape mechanism of melanoma cells. J. Invest. Dermatol. V. 136. P. 1479.
Cappel S.D., Mark K.G., Garbett D., Pack L.R., Rape M., Meyer T. 2018. EMI1 switches from being a substrate to an inhibitor of APC/CCDH1 to start the cell cycle. Nature. V. 7709. P. 313
Chapman P.B., Hauschild A., Robert C., Haanen J.B., Ascierto P., Larkin J., Dummer R., Garbe C., Testori A., Maio M., Hogg D., Lorigan P., Lebbe C., Jouary T., Schadendorf D. et al. 2011. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. New England J. Med. V. 364. P. 2507.
Cheng L., Lopez-Beltran A., Massari F., MacLennan G.T., Montironi R. 2018. Molecular testing for BRAF mutations to inform melanoma treatment decisions: a move toward precision medicine. Mod. Pathol. V. 31. P. 24.
Domingues B., Lopes J.M., Soares P., Populo H. 2018. Melanoma treatment in review. Immunotargets Ther. V. 7. P. 35−49.
Fares J., Fares M.Y., Khachfe H.H., Salhab H.A., Fares Y. 2020. Molecular principles of metastasis: a hallmark of cancer revisited. Signal Transd. Targeted Ther. V. 5. P. 28.
Gyrylova S.N., Aksenenko M.B., Gavrilyuk D.V., Palkina N.V., Dyhno Y.A., Ruksha T.G., Artyukhov I.P. 2014. Melanoma incidence mortality rates and clinico-pathological types in the Siberian area of the Russian Federation. Asian Pac. J. Cancer Prev. V. 15. P. 2201.
Huncharek M., Caubet J.F., McGarry R. 2001. Single-agent DTIC versus combination chemotherapy with or without immunotherapy in metastatic melanoma: a meta-analysis of 3273 patients from 20 randomized trials. Melanoma Res. V. 11. P. 75.
Huang X., He J.X., Zhang H.T., Sun K., Yang J., Wang H.J., Zhang H.X., Guo Z.Z., Zha Z.G., Zhou C.R. 2017. Effect of dacarbazine on CD44 in live melanoma cells as measured by atomic force microscopy-based nanoscopy. Int. J. Nanomed. V. 12. P. 8867.
Hill D.S., Lovat P.E., Haass N.K. 2014. Induction of endoplasmic reticulum stress as a strategy for melanoma therapy: is there a future? Melanoma Manag. V. 2. P. 127.
Joshi K.S., Rathos M.J., Mahajan P., Wagh V., Shenoy S., Bhatia D., Sharma S. 2007. P276-00, a novel cyclin-dependent inhibitor induces G1–G2 arrest, shows antitumor activity on cisplatin-resistant cells and significant in vivo efficacy in tumor models. Mol. Cancer Ther. V. 6. P. 926.
Li W., Sanki A., Karim R.Z., Thompson J.F., Lee C.S., Zhuang L.Q., Zhuang L., McCarthy S.W., Scolyer R.A. 2006. The role of cell cycle regulatory proteins in the pathogenesis of melanoma. Pathol. V. 38. P. 287.
Lui P., Cashin R., Machado M., Hemels M., Corey-Lisle P.K., Einarson T.R. 2007. Treatments for metastatic melanoma: synthesis of evidence from randomized trials. Cancer Treat. Rev. V. 33. P. 665.
Manke I.A., Nguyen A., Lim D., Stewart M.Q., Elia A.E., Yaffe M.B. 2005. MAPKAP kinase-2 is a cell cycle checkpoint kinase that regulates the G2/M transition and S phase progression in response to UV irradiation. Mol. Cell. V. 17. P. 37.
Mattia G., Puglisi R., Ascione B., Malorni W., Carè A., Matarrese P. 2018. Cell death-based treatments of melanoma: conventional treatments and new therapeutic strategies. Cell Death Dis. V. 9. P. 112.
Matheson T.D., Kaufman P.D. 2017. The p150N domain of chromatin assembly factor-1 regulates Ki-67 accumulation on the mitotic perichromosomal layer. Mol. Biol. Cell. V. 28. P. 21.
McConnell A.M., Zon L.I. 2021. Dissecting melanocytes to predict melanoma. Nat. Cell Biol. V. 23. P. 930.
Mhaidat N.M., Zhang X.D., Jiang C.C., Hersey P. 2007. Docetaxel-induced apoptosis of human melanoma is mediated by activation of c-Jun NH2-terminal kinase and inhibited by the mitogen-activated protein kinase extracellular signal-regulated kinase 1/2 pathway. Clin. Cancer Res. V. 13. P. 1308.
Olszewska-Słonina D.M., Styczyńisk J., Drewa T.A., Olszewski K.J., Czajkowski R. 2005. B16 and cloudman S91 mouse melanoma cells susceptibility to apoptosis after dacarbazine treatment. Acta Pol. Pharm. V. 62. P. 473.
Oliferenko S., Kaverina I., Small J.V., Huber L.A. 2000. Brief report hyaluronic acid (HA) binding to CD44 activates Rac1 and induces lamellipodia outgrowth. J. Cell Biol. V. 148. P. 1159.
Ossowski L., Aguirre-Ghiso J.A. 2010. Dormancy of metastatic melanoma. Pigment Cell Melanoma Res. V. 23. P. 41.
Pawlowska E., Szczepanska J., Szatkowska M., Blasiak J. 2018. An interplay between senescence, apoptosis and autophagy in glioblastoma multiforme-role in pathogenesis and therapeutic perspective. Int. J. Mol. Sci. V. 19. P. 889.
Reyes-Reyes E.M., Jin Z., Vaisberg A.J., Hammond G.B., Bates P.J. 2013. Physangulidine A, a withanolide from Physalis angulata, perturbs the cell cycle and induces cell death by apoptosis in prostate cancer cells. J. Nat. Prod. V. 1. P.2.
Ruksha T.G. 2019. MicroRNAs’ control of cancer cell dormancy. Cell Div. V. 14. P. 11.
Risson E., Nobre A.R., Maguer-Satta V., Aguirre-Ghiso J.A. 2020. The current paradigm and challenges ahead for the dormancy of disseminated tumor cells. Nat. Cancer. V. 7. P. 672.
Ralhan R., Kaur J. 2007. Alkylating agents and cancer therapy. Expert Opin. Ther. Path. V. 17. P. 1061.
Shah M.A., Schwartz G.K. 2001. Cell cycle-mediated drug resistance: an emerging concept in cancer therapy. Clin. Cancer Res. V. 7. P. 2168.
Sheppard K.E., McArthur G.A. 2013. The cell-cycle regulator CDK4: an emerging therapeutic target in melanoma. Clin Cancer Res. V. 19. P. 5320.
Sun X., Kaufman P.D. 2018. Ki-67: more than a proliferation marker. Chromosoma. V. 127. P. 175.
Tyumentseva A., Averchuk A., Palkina N., Zinchenko I., Moshev A., Savchenko A., Ruksha T. 2021. Transcriptomic profiling revealed plexin A2 downregulation with migration and invasion alteration in dacarbazine-treated primary melanoma cells. Front. Oncol. V. 11. P. 732501.
Xu W., McArthur G. 2016. Cell cycle regulation and melanoma. Curr. Oncol. Rep. V. 18. P. 34.
Wang H., Feng W., Lu Y., Li H., Xiang W., Chen Z., He M., Zhao L., Sun X., Lei B., Qi S., Liu Y. 2016. Expression of dynein, cytoplasmic 2, heavy chain 1 (DHC2) associated with glioblastoma cell resistance to temozolomide. Sci. Rep. V. 6. P. 28948.
Дополнительные материалы отсутствуют.


