Цитология, 2020, T. 62, № 12, стр. 880-893
Изменения кариотипа устойчивых к апоптозу клеток крысы линии HindIIIG при длительном культивировании после действия ионизирующего облучения
Н. М. Ярцева 1, *, Ж. В. Шитикова 2, Т. В. Быкова 1, С. Г. Зубова 1, Е. Ю. Кочеткова 1, В. А. Поспелов 1, Т. В. Поспелова 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Женевский университет
1205 Женева, Швейцария
* E-mail: ya.ya-natm27951@yandex.ru
Поступила в редакцию 08.08.2020
После доработки 12.09.2020
Принята к публикации 14.09.2020
Аннотация
Нестабильность генома, выражающаяся во множественных перестройках, способствует приобретению опухолевыми клетками новых свойств, в том числе, устойчивости к терапии. Структурные перестройки хромосом могут происходить при повреждении ДНК, например, ионизирующим облучением. В работе исследованы изменения кариотипа псевдодиплоидной линии HindIIIG-1, полученной в результате облучения устойчивых к апоптозу трансформированных клеток крысы HindIIIG. Линия HindIIIG-1 возникла в результате полиплоидизации, связанной с нарушением блока клеточного цикла на границе фаз G2/M, и последующей деполиплоидизации. Исходная линия HindIIIG до облучения была представлена в основном псевдодиплоидной популяцией с нормальным числом хромосом 42 и тетраплоидной фракцией, составляющей 14%. Кариотип клеток включал две численные и одну специфическую структурную перестройку хромосомы (СПХ) – der(14). Облучение вызывает формирование полиплоидов и множественную фрагментацию хромосом. В процессе культивирования стала преобладать псевдодиплоидная популяция клеток с кариотипом, подобным кариотипу необлученных клеток, но с увеличенным числом клональных и неклональных СПХ. На поздних пассажах кариотип клеток HindIIIG-1 вновь становится идентичным кариотипу клеток до облучения и не содержит новых клональных СПХ. Обсуждается роль неклональных и клональных СПХ в процессе выживания облученных клеток и образования новых клеточных популяций.
Хромосомная нестабильность является одной из ключевых характеристик опухолевых клеточных линий. Популяция опухолевых клеток гетерогенна по клональными и неклональными численным и структурным перестройкам хромосом (СПХ). Неклональные СПХ способствуют адаптации клеток к изменяющейся окружающей среде, в то время как клональные СПХ приводят к измененной экспрессии множества генов, включая онкогены и опухолевые супрессоры (Mitelman et al, 2007; Ohgaki, Kleihues, 2009).
На хромосомную нестабильность влияют повреждающие ДНК агенты, в том числе ионизирующее излучение, вызывая одно- и двухцепочечные разрывы ДНК (ДР-ДНК). Нарушение репликации ДНК или прохождение через митоз после коллапса вилки репликации также могут приводить к ДР-ДНК, которые способствуют появлению СПХ (Jeggo and Löbrich, 2006; Kakarougkas et al., 2014).
В полиплоидных опухолевых клетках после облучения или в результате противоопухолевой терапии часто наблюдается фрагментация хромосом, которая приводит к изменению профиля экспрессии многих генов (Crasta et al., 2012; Zhang et al., 2015; Ly, Cleveland, 2017; Pellestor, 2019; Ye et al., 2019). В частности, мутации опухолевого супрессора р53 (TP53) приводят к изменениям или потере его функций, связанных с изменением жизнеспособности клеток (Mardin et al., 2015; Zhang et al., 2015).
Ранее нами было показано, что устойчивые к апоптозу эмбриональные фибробласты крысы, трансформированные районом HindIIIG аденовируса 5 типа человека, преодолевали процесс клеточной гибели за счет специфических механизмов (Chitikova et al., 2014). Облучение клеток HindIIIG привело к образованию гигантских клеток большой плоидности из-за репликации ДНК при сохранении блока G2/M клеточного цикла. Выживание облученной популяции в конечном итоге обеспечивалось клетками HindIIIG-1 с размером и содержанием ДНК, близким к необработанным клеткам HindIIIG (Chitikova et al., 2014) .
В настоящей работе проанализирована динамика хромосомных перестроек в клетках HindIIIG-1, возникающих после облучения и приводящих в процессе длительного культивирования к возвращению псевдодиплоидных пролиферирующих клеток, которые обеспечивают жизнеспособность клеточной популяции.
МАТЕРИАЛ И МЕТОДИКА
Клеточные линии. Линия HindIIIG получена из эмбриональных фибробластов крысы с помощью ко-трансфекции раннего района HindIIIG аденовируса 5 типа человека (E1A+E1B 19 кДа) плазмидой pSV2neo, несущей ген устойчивости к генетицину. Клетки HindIIIG культивировали в среде Дальбекко в модификации Игла, содержащей 10% фетальной сыворотки крупного рогатого скота и 0.1 мг/мл гентамицина при 37°C, в присутствии 5% СО2.
Облучение. Клетки HindIIIG подвергали рентгеновскому облучению в дозе 6 Гр на аппарате Axiom Iconos R200 (Siemens, Германия). В течение 27 сут после облучения клетки HindIIIG не пересевали, а культивировали до появления монослоя. Выжившие после рентгеновского облучения клетки HindIIIG после начала пересева получили название HindIIIG-1. Клетки HindIIIG-2 были получены после вторичного облучения клеток HindIIIG-1 в той же дозе.
Кариотипический анализ. Для получения метафазных пластинок в культуральную среду вводили колхицин в конечной концентрации 0.06 мкг/мл на 1–1.5 ч. Далее проводили гипотоническую обработку 0.55%-ным раствором KCl (ICN Biomedical Inc., США) при 37°C в течение 12–15 мин, затем клетки фиксировали смесью метанола и ледяной уксусной кислоты (3 : 1) по 15 мин с двукратной сменой фиксатора. Суспензию фиксированных клеток наносили на предметные стекла над водяной баней при 52–55°C до полного высыхания. Для идентификации хромосом препараты окрашивали с помощью метода окрашивания хромосом на G-диски (GTG-метод) (Ozkinay et al., 1979). Кариотип новой линии HindI-IIG-1, полученной из выживших после облучения клеток, исследовали на пассажах 8, 17, 22 и 34.
Для выявления районов метафазных хромосом, несущих рибосомные гены, использовали окрашивание 50%-ным азотнокислым серебром (AgNO3; Sigma, CША) (Howell, Black, 1980). Далее препараты обрабатывалии 2%-ным раствором желатина в течение 8–10 мин при 56°C, отмывали в воде и обезвоживали этиловым спиртом. Окрашивание проводили стандартным методом с помощью красителя Гимза. Идентифицировали хромосомы согласно идиограммам хромосом крысы Rattus norvegicus на 300 дисков (bands) (Satoh et al., 1989). Описывали кариотип в соответствие с Интернациональной номенклатурой цитогенетики человека (Shaffer et al., 2009).
РЕЗУЛЬТАТЫ
Кариотип трансформированных клеток линии Hin-dIIIG. Анализ кариотипа клеток линии HindIIIG до облучения показал, что это в основном псевдодиплоидная и гетерогенная по составу клеточная популяция. Доля митотических полиплоидных клеток в популяции HindIIIG до облучения составляла 14%, из которых 2% имели плоидность более 4n.
Число хромосом (ЧХ) варьирует от 40 до 44, модальный класс с ЧХ равным 42, наблюдали только в 38% клеток. Во всех исследованных клетках линии HindIIIG выявлена одна СПХ, вероятно, дупликация района q21-q22.1 длинного плеча хромосомы 14 с делецией теломерного района q22-qter. Только две клетки имели кариотип 42,XX,der(14)dup(14)(q21q22.1)del(14)(q22qter),–15,+20 с моносомией хромосомы 15, трисомией хромосомы 20 и перестройкой хромосомы 14 (рис. 1). В остальных клетках, кроме этих постоянных клональных перестроек хромосом, наблюдали другие клональные и неклональные СПХ, или изменение ЧХ. В клетках с ЧХ 43 обнаружены два гомолога хромосомы 15. В 10% клеток с ЧХ 41 наблюдали хромосому 3 с увеличенным локусом р12 короткого плеча и с амплификацией рибосомных генов (АРГ) (рис. 2а–в). Кроме того, эти клетки имели перестроенную хромосому 16 der(16)t(8;16)(q13;р12) и в них отсутствовал третий нормальный гомолог хромосомы 20.
Рис. 1.
Кариотип клетки линии HindIIIG до облучения с модальным числом хромосом без дополнительных численных и структурных перестроек хромосом (СПХ). Окрашивание на G-диски; стрелка указывает на постоянную структурную перестройку хромосомы 14: 42,ХХ,der(14)?dup(14)(q21q22.1)del(14)(q22qter),–15,+20.

Рис. 2.
Амплификация рибосомных генов в коротком плече хромосомы 3 в клетках линии HindIIIG до и после облучения. а – Кариотип клетки линии HindIIIG до облучения с АРГ в локусе р12 хромосомы 3, а также другими клональными и неклональными численными и структурными перестройками хромосом 41,ХХ,der(1)t(1;8)(q43;11.2)der(3)amp(3)(p12)t(3;?20)(p13;?q11),add(4)(q42),+der(8) t(8?;17)(q?11.2;p12),der(14)?dup(14)(q21q22.1)del(14)(q22qter),–15,der(16)t(8;16)(q13;p12), +16−17; стрелки указывают на перестроенные хромосомы. б – Структурные изменения хромосомы 3 из трех разных клеток HindIIIG-1 после облучения на 17-м пассаже; левый гомолог – нормальный гомолог хромосомы 3, правый – с АРГ в локусе р12. в – АРГ в локусе р12 хромосомы 3, стрелки указывают на хромосомы 11, 12 и 3 с функционально активными АРГ. а, б – окрашивание на G-диски, в – окрашивание AgNO3.

Анализ кариотипа клеток HindIIIG после облучения проводили на 1-, 4- и 27-е сут (до первого пассажа стабильной линии). Через 1 сут после облучения митотические клетки с плоидностью больше 4n не выявлялись (табл. 1), а доля тетраплоидных клеток составляла 17.7%. На 4-е сут после облучения почти все клетки становились полиплоидными с плоидностью больше 4n.
Таблица 1.
Распределение хромосом по числу в клетках линий HindIIIG до и после облучения
| Линия | Число хромосом | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 4n ( ≥ 4n), % | |
| HindIIIG до облучения | – | – | 3 | 11 | 38 | 17 | 6 | – | 14 (2) |
| HindIIIG, 1 сут ПО | – | Не исследовано | 17.7 (0) | ||||||
| HindIIIG, 4 сут ПО | – | Нет диплоидных митозов | ≥ 4n (100) | ||||||
| HindIIIG, 13 сут ПО | – | Не исследовано | 10.8 (4.4) | ||||||
| HindIIIG через 27 сут ПО | – | – | 6 | 24 | 30 | 23 | 7 | – | 2 (0) |
| HindIIIG-1 (пассаж 8) | 4 | 2 | 5 | 52 | 25 | 1 | 3 | 1 | Не исследовано |
| HindIIIG-1 (пассаж 17) | – | 2 | 3 | 35 | 44 | 8 | 2 | 1 | 6.7 (0.3) |
| HindIIIG-1 (пассаж 22) | – | 1 | – | 17 | 66 | 11 | – | 2 | 5.6 (0.6) |
| HindIIIG-1 (пассаж 34) | – | 3 | 2 | 17 | 47 | 15 | 4 | 1 | 9.7 (0.2) |
| HindIIIG-2 (пассаж 12) | – | 1 | 6 | 26 | 50 | 12 | 1 | 1 | 6.3 (0.5) |
Через 1 и 4 сут после облучения наблюдали фрагментацию ядер гигантских полиплоидных клеток и скопление вокруг них микроядер (рис. 3), а также метафазные пластинки с хромосомами, имеющими одно- и двухроматидные разрывы (рис. 4). Кроме того, в 9.3% клеток через 4 сут после облучения обнаружены метафазы большой плоидности, в которых одновременно с целыми метафазными хромосомами содержались множественные хромосомные фрагменты (рис. 5). На поздних сроках культивирования число таких метафазных пластинок снижалось. Следует обратить внимание на уменьшение числа метафаз с фрагментацией хромосом, которое совпадает по времени с уменьшением числа метафаз с плоидностью больше 4n. На более поздних сроках после облучения наблюдали тетраплоидные и псевдодиплоидные метафазные пластинки с фрагментацией одной или нескольких хромосом одновременно (рис. 6).
Рис. 3.
Фрагментация гигантского полиплоидного ядра с образованием многочисленных микроядер (а, б) на 4 сут после облучения в клетках HindIIIG.

Рис. 4.
Метафазная пластинка клеток HindIIIG с множественными однохроматидными (а) и двухроматидными (б) разрывами хромосом (стрелки) с неполной конденсацией хроматина через 4 сут после облучения.

Рис. 5.
Полиплоидные метафазы в клетках HindIIIG с выраженной фрагментацией хромосом и наблюдаемыми одновременно целыми метафазными хромосомами на 4-м пассаже после облучения. а – Сильно выраженная фрагментация; б – фрагментация, выраженная в меньшей степени, с лежащим рядом микроядром.

Рис. 6.
Метафазная пластинка и кариотип клетки линии HindIIIG-1 с фрагментацией нескольких хромосом. Пассаж 22; mar – маркерная хромосома; стрелки указывают на перестроенные хромосомы и фрагментацию хромосом.

Анализ кариотипа клеток HindIIIG на 27-е сут после облучения выявил только 2% тетраплоидных митотических клеток. Однако одновременно увеличивалась гетерогенность клеточной популяции по сравнению с линией HindIIIG до облучения за счет увеличения доли клеток с ЧХ 41и увеличения числа неклональных СПХ (табл. 1, 2), которые обнаружены в 12 клетках из 13 исследованных (92%). Число хромосом, вовлеченных в неклональные СПХ в кариотипе клеток, увеличилось более чем в 2 раза по сравнению с необлученными клетками. Изменения затрагивают разные хромосомы, но чаще хромосомы 6 и 17 (рис. 7). Перестроенная хромосома 14 выявлена во всех исследованных клетках линии HindIIIG до и после облучения, моносомию хромосомы 15 наблюдали так же, как и до облучения в 9 из 13 исследованных клеток. Хромосома 3 с амплификацией в локусе р12 не обнаружена (табл. 2).
Таблица 2.
Структурные перестройки хромосом в клетках линий HindIIIG до и после облучения
| Линиия | Число клеток без новых СПХ | Число клеток с ампли- фикацией хромосомы 3, % |
Число
клеток с der(5) |
Число клональных перестроек хромосом ≤ 10% | Число неклональных СПХ |
Суммарное число точек разрывов хромосом |
|---|---|---|---|---|---|---|
| HindIIIG до облучения | 2 из 15 | 10 | Нет | 1 | 6 | 14 |
| HindIIIG 27-й день ПО | 1 из 12 | Нет | Нет | 3 | 14 | 24 |
| HindIIIG-1 (пассаж 8) | 2 из 27 | 60 | Нет | 2 | 14 | 25 |
| HindIIIG-1 (пассаж 17) | 2 из 20 | 32.6 | 17.5 | 6 | 34 | 74 |
| HindIIIG-1 (пассаж 22) | 13 из 17 | 1 | 1 | Нет | 6 | 18 |
| HindIIIG-1 (пассаж 34) | 5 из 20 | Нет | 1 | Нет | 14 | 25 |
| HindIIIG-2 (пассаж 12) | 4 из 20 | 32 | 15.4 | 3 | 18 | 35 |
Рис. 7.
Схема, демонстрирующая точки разрывов структурно перестроенных хромосом в клетках линии HindIIIG до и после облучения и новых линий – HindIIIG-1на разных сроках после облучения и HindGIII-2. Цветом показаны точки разрывов хромосом: красный – в необлученных клетках HindIIIG; синий – через 27 сут после облучения клеток HindIIIG; зеленый, сиреневый и коричневый – после облучения HindIIIG-1 на пассаже 17, 22 и 34 соответственно; темно-фиолетовый – клетки после повторного облучения HindIIIG-1 (клетки HindIIIG-2), пассаж 12. Точки: кружки – разрывы хромосом в клональных СПХ; цветные квадраты – разрывы в клональных СПХ, составляющие меньше 10%; цветные треугольники – разрывы хромосом в неклональных СПХ; белые квадраты – точки разрывов в СПХ, ставших неклональными на последующих сроках культивирования; белые треугольники – разрывы, в которых наличие структурных перестроек вызывает сомнение; квадратная скобка – районы разрыва хромосом, которые не могут быть точно идентифицированы.

Кариотип клеток линии HindIIIG-1. Кариотип новой линии HindIIIG-1, полученной из выживших после облучения клеток, исследовали на пассажах 8, 17, 22 и 34. Доля тетраплоидных клеток в процессе пассирования уменьшалась по сравнению с необлученными клетками HindIIIG, а на поздних пассажах клетки с плоидностью больше 4n составляли менее 1% (табл. 1). Почти вся популяция клеток HindIIIG-1 стала псевдодиплоидной.
Анализ клеток линии HindIIIG-1 на 17-м пассаже показал дальнейшее увеличение гетерогенности клеточной популяции HindIIIG-1 по сравнению с популяцией клеток HindIIIG через 27 сут после облучения. Модальный класс клеток по числу хромосом не был выражен, преобладали два типа клеток с ЧХ 41 и 42 (табл. 1). В 18 клетках из 20 (90%) наблюдали перестройки хромосом: клональные или неклональные, численные или структурные. Моносомия хромосомы 15 была обнаружена уже во всех клетках. Число новых неклональных СПХ увеличилось более чем в 2 раза по сравнению с кариотипом клеток HindIIIG на 27-е сут после облучения (табл. 2). Клеток с АРГ в коротком плече хромосомы 3 было в 3 раза больше, чем до облучения в клетках HindIIIG. Кроме того, в кариотипе HindIIIG-1 в 17.5% клеток популяции обнаружена новая СПХ, дериват хромосомы 5 – der(5)t(1;5;8)(q22?q34;q36;q22), в состав которого входят хромосомы 1 и 8. В этих клетках кроме der(5) выявлены еще несколько других хромосом с измененной структурой (рис. 8а).
Рис. 8.
Кариотипы клеток новых псевдодиплоидных линий HindIIIG-1 и HindIIIG-2. а – Кариотип клетки Hi-ndIIIG-1 на 17-м пассаж после облучения с новыми численными и структурными перестройками хромосом: 41,Х,–Х,–4;der(5) t(1;5;8)(q22;?q34q36;q22),der(7)t(X;7)(q12; q32),+8,der(8) (q22)add(q22;?),der(14)?dup(14)(q21q22.1)del(14)(q22qter),–15, +20,+mar(?;7)(?cen;q32); mar – маркерная хромосома. б – Кариотип клетки HindIIIG-2 (после второго облучения клеток HindIIIG-1) на 12-м пассаже: 41,Х,–Х,‒4;der(5)t(1;5;8) (q22?;q34q36;q22),der(7)t(X;7)(q12;q32),+8,der(8)-(q22)add (q22;?),der(14)?dup(14)(q21q22.1)del(14)(q22qter),–15,+20, +mar(?;7)(?cen;q32), цифры у der(5) указывают локусы разрыва хромосомы, стрелки указывают на перестроенные хромосомы.
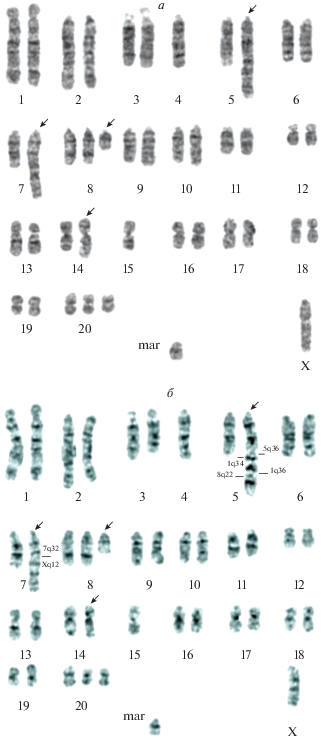
На 22-м пассаже культивирования клетки Hind-IIIG-1 имели самый стабильный кариотип с четко выраженным модальным классом, составляющим 66% популяции, представленный клетками с числом хромосом равным 42. Кариотип 42,XX,der(14)dup(14)-(q21q22.1)del(14)(q22qter),–15,+20 без неклональных СПХ наблюдали в 13 клетках из 17 исследованных (76.5% клеток), и только в 4-х клетках, кроме der(14), обнаружены новые неклональные СПХ. Клональные перестройки хромосом 3 и 5 выявлены только в 1% клеток (табл. 2). Кариотипический анализ клеток HindIIIG-1 на 34 пассаже показал некоторое увеличение нестабильности кариотипа: доля тетраплоидных клеток стала больше, как и число клеток с неклональными СПХ, новых клональных СПХ также не наблюдали. Тем не менее, модальный класс клеток с ЧХ 42 был выражен четко (табл. 1 и 2).
Перестройку хромосомы 14 в клетках HindIIIG-1 выявляли на всех сроках наблюдения после облучения (как и в исходных клетках HindIIIG), которая представляет собой постоянную специфическую структурную перестройку в этих линиях. Постоянными для клеток линии HindIIIG-1 также являлись моносомия хромосомы 15, обнаруженная во всех клетках после облучения, в отличие от необлученных клеток HindIIIG, и трисомия хромосомы 20.
Все хромосомы кариотипа подвергались структурным клональным или неклональным изменениям. Чаще других это были хромосомы Х, 1, 2, 3, 4, 6, 8, 10 (6 и больше точек разрывов на хромосому), а разрывы хромосом происходили чаще в локусах 1q32, 1q34, 4q42, 5q36, 11q22 и 20р12 (5 и больше разрывов на локус) (рис. 7).
Таким образом, анализ кариотипа псевдодиплоидной линии клеток HindIIIG-1 (полученной при длительном культивировании клеток HindIIIG после облучения) показал, что клетки на поздних пассажах имеют четко выраженный модальный кариотип с ЧХ равным 42, а доля полиплоидных клеток уменьшилась больше чем в 2 раза по сравнению с необлученными клетками HindIIIG. Несмотря на множественные СПХ, наблюдавшиеся после облучения на 17-м пассаже, новые клональные численные и СПХ в кариотипе клеток линии HindIIIG-1 на последующих пассажах не обнаружены. Число неклональных СПХ на 22-м пассаже после облучения стало равным их числу до облучения в линии Hind IIIG.
На 22 и 34-м пассажах обнаружены клетки, в которых наряду с нормально конденсированными метафазными хромосомами наблюдали профазные недоконденсированые хромосомы (рис. 9). Это происходит, вероятно, в двуядерных клетках, ядра которых не синхронно входят в митоз, и в запаздывающем ядре происходит преждевременная конденсация хроматина.
Рис. 9.
Тетраплоидная метафазная пластинка в линии HindIIIG-1, имеющая метафазные и одновременно профазные недоконденсированные хромосомы. Пассаж 34.

Повторное облучение клеток HindIIIG-1 (клетки HindIIIG-2). Для понимания закономерностей становления диплоидности в устойчивых к апоптозу клетках HindIIIG и выявления особенностей изменений кариотипа после облучения было проведено повторное облучение клеток линии HindIIIG-1 на 8-м пассаже. Линию, полученную из выживших клеток HindIIIG-1 после повторного облучения, назвали HindIIIG-2. В этих клетках тоже обнаружены метафазные пластинки (0.6%) с увеличенной плоидностью и наличием фрагментированных хромосом одновременно с целыми метафазными хромосомами. Анализ кариотипа клеток HindIIIG-1 на 8-м пассаже до облучения показал четкий модальный класс с ЧХ 41 (52% клеток), тогда как клетки с ЧХ 42 составляли всего 25%. После повторного облучения анализ кариотипа клеток HindIIIG-2 был проведен на 12-м пассаже. Выявлен четкий модальный класс с ЧХ 42 и две субпопуляции клеток с ЧХ 41 и 43 (табл. 1). Кариотип 42,XX,der(14)dup(14)(q21q22.1)del(14)(q22qter),–15,+20 без новых СПХ в клетках HindIIIG-2 обнаружен только в 4-х клетках, а на 8-м пассаже в клетках HindIIIG-1 – в 2-х. Другие исследованные клетки HindIIIG-2, наряду с der(14), имели новые клональные и неклональные СПХ. Два клона, составляющие больше 10% популяции, имели те же самые СПХ, что и клетки HindIIIG-1 на пассаже 17. Первый клон имел АРГ в локусе р12 хромосомы 3 и транслокацию t(8;16)(8q13;16p12) (рис. 2а). Кариотип клеток второго клона содержал der(5)t(1;5;8)(q22q?34;q36;q22), der(7) и der(8) (рис. 8б). Количество клеток с этими перестройками по сравнению с однократно облученными клетками HindIIIG-1 на 17-м пассаже отличалось незначительно (табл. 2). Общее число неклональных СПХ и точек разрывов хромосом в клетках линии HindIIIG-2 меньше, чем в клетках HindIIIG-1 на пассаже 17 после первого облучения.
Таким образом, показано, что рентгеновское облучение клеток HindIIIG в дозе 6 Гр приводит к полиплоидизации популяции и перестройке всего генома: фрагментации гигантских полиплоидных ядер, образованию множества микроядер, фрагментации хромосом в полиплоидных клетках. Становление новой популяции псевдодиплоидных клеток сопровождается появлением большого числа неклональных СПХ и появлением заново СПХ der(5) и der(7), а также увеличением количества клеток с СПХ amp(3) и der(8).
ОБСУЖДЕНИЕ
Ранее нами показано, что в клетках HindIIIG нарушена сверочная точка на границе фаз G2/M клеточного цикла, в результате чего происходит непрекращающаяся репликация ДНК, и в отсутствие цитотомии количество ДНК в клетках достигает 110 С и более (Chitikova et al., 2014). Через 4 сут после облучения клеток HindIIIG обнаружены метафазные пластинки очень большой плоидности с множественными хромосомными фрагментами и одновременно наблюдались неповрежденные метафазные хромосомы. Фрагментация хромосом приводит к геномному хаосу в клетках и кариотипической гетерогенности. Из всех вариантов клеток селективно отбираются клетки с обновленным геномом, наиболее адаптированные к новым условиям (Liu et al., 2014; Ye et al., 2019). В нашей работе клетки HindIIIG не погибли после облучения в дозе 6 Гр и, более того, стали псевдодиплоидными и пролиферирующими клетками. В части клеток была обнаружена экспрессия маркеров стволовых клеток Nanog и Oct3/4 (Chitikova et al., 2014).
Кариотип клеток линии HindIIIG-1, сформировавшийся после облучения, на всех пассажах сохраняет клональные СПХ, типичные для исходной линии HindIIIG: перестроенную хромосому 14 – der(14)dup(14)(q21q22.1)del(14)(q22qter)), предположительно, с частичной дупликацией района q21-q22.1, моносомию хромосомы 15, а также трисомию хромосомы 20. В результате моносомии хромосомы 15 в этих клетках присутствует всего одна копия гена Rb1, который локализован в локусе q12 ее длинного плеча. Белок RB1 участвует в прохождении контрольной точки G1/S клеточного цикла, предотвращая вступление клеток в цикл с аномальными хромосомами. В результате трисомии хромосомы 20, которая содержит гены Itgb2, Notch4, Cdk1, Cdkn1b, Srpk1, Vegfa, Rab11b, Tnf, Hsp70-1, Ras3, Rps18 (согласно базе данных генома крысы (RGD): http://rgd/mcv/edu), в геноме клеток HindIIIG и Hind IIIG-1 эти гены находятся в трех копиях.
На 17-м пассаже линии HindIIIG-1 выявлен клон клеток с перестроенной хромосомой 5 – der(5)t(1;5;8)(q22?q34;q36;q22), состоящей из фрагментов 3-х хромосом (согласно разрешающей способности GTG-метода). Хромосома 5 рвется в локусе q36, который чаще подвержен перестройкам в клетках линии HindIIIG-1 и его вовлечение в перестройки неслучайно. В этом локусе, согласно базе данных генома крысы RGD, выявлены гены, связанные с развитием рака и поддержанием опухолевого фенотипа: Casp9, Kif1b, Pax7, Pik3r3, Prkaα2, Rragc, Runx3, Wnt4.
Кроме того, в линии HindIIIG-1 на пассаже 17 обнаружено увеличение до 30% доли клеток с АРГ в локусе р12 хромосомы 3, как и в клетках HindIIIG-2 (32%), по сравнению с клетками HindIIIG до облучения. Шитиковой с сотрудниками (Chitikova et al., 2014) было показано возобновление пролиферации клеток этих линий, что, по-видимому, сопряжено с увеличением числа клеток с АРГ. Количество копий и активность рибосомных генов важны для процессов пролиферации, дифференцировки, старения и апоптоза, а также поддержания гомеостаза клетки (Grummt, 2013; Orsolic et al., 2015). При опухолевой трансформации клеток и опухолевой прогрессии происходит изменение как количества копий рибосомных генов, так и их перемещение внутри хромосомы или на другие хромосомы (Мамаева, 1996, 2000).
Появление клеток с der(5) и увеличение числа клеток с АРГ в хромосоме 3 в популяциях клеток HindIIIG-1 и Hind IIIG-2 на 17-м и 12-м пассажах соответственно, вероятно, способствует выживанию после облучения всей клеточной популяции этих линий.
На 17 пассаже линии HindIIIG-1 почти во всех клетках (в 25 из 30 клеток) кариотип содержал большое число клональных и неклональных СПХ – до 6 перестроек в сумме в одной клетке, в которые вовлекались разные хромосомы. Чаще других хромосом подвергались изменениям хромосомы: 1, 2, 4, 5, 8 и 11. Всего обнаружено 75 точек разрывов хромосом, при этом локус 11q22 хромосомы 11 чаще других подвергался разрывам. Наличие такого количество клеток с СПХ и сохранение их длительное время после облучения может происходить в результате замедленной во времени репарации ДР-ДНК, что было показано Шитиковой с сотрудниками (Chitikova et al., 2014). Отсутствие или нарушение репарации ДР-ДНК приводит к возникновению перестроек хромосом.
Мы наблюдали перестроенные хромосомы в метафазных пластинках уже с первого по четвертый день после облучения. Такие клетки должны стареть или подвергаться апоптозу, но клетки HindIIIG при наличии ДР-ДНК выживают в результате инактивации программы апоптоза, блокированного высоким уровнем экспрессии антиапоптотического гена Е1В19кД (Han et al., 1995).
На 22-м пассаже клетких HindIIIG-1 не приобрели новые клональные СПХ и не сохранили неклональные СПХ, выявленные на 17-м пассаже. Отсутствие клеток HindIIIG-1 с неклональными СПХ на более поздних пассажах, которые встречались на 17-м пассаже, возможно, связано с неспособностью аномальных хромосом правильно сегрегировать в дочерние клетки в результате неактивной или дефектной центромеры и которые затем могут подвергаться фрагментации и аутофагии. На пассаже 22 мы наблюдали метафазные пластинки с отдельными мелкими хромосомными фрагментами, вероятно, фрагментами одной или нескольких перестроенных хромосом (рис. 6). Клетки могут приобретать второй гомолог хромосомы взамен утраченного вследствие механизма униродительской диссомии (uniparental disomy), в результате чего появляются два гомолога хромосомы от одного предка (Tuna et al., 2009). Возможно, эти хромосомы могут быть с генетическими нарушениями, определяющими новые свойства клеток HindIIIG-1.
В настоящее время уделяется большое внимание неклональным СПХ, которые создают эволюционный потенциал популяции, и количество которых отражает степень нестабильности генома. Неклональные СПХ увеличивают гетерогенность и пластичность клеточной популяции. Это позволяет клеткам адаптироваться к изменениям условий существования и выживать при генотоксическом стрессе (Liu et al., 2014; Heng et al., 2016, 2018; Ye et al., 2018; Frias et al., 2019). Так, например, при переводе клеток трансформированной линии крысы LRec-1 в среду без сыворотки в кариотипе появились 4 новые клональные СПХ, которые способствовали клеткам адаптироваться к измененным условиям среды (Ярцева с сотр., 2007). В то же время, клеточные популяции, по-видимому, обладают стабильной кариотипической структурой и определенной вероятностью возвращения к исходному стабильному состоянию, как было показано для популяций клонов и субклонов клеток линии СНО-К1 китайского хомячка (Полянская с сотр., 1981). Увеличение неклональных и клональных СПХ в популяции клеток HindIIIG-1 и HindIIIG-2 необходимо только для выживания клеток в период стресса после облучения. На более поздних пассажах после облучения кариотипическая гетерогенность уменьшается. Клетки HindIIIG имеют необходимый и достаточный и в тоже время пластичный геном, позволяющий клеткам выжить после повреждающего действия облучения и создать новую популяцию псевдодиплоидных клеток, напоминающих стволовые (Chitikova, 2014).
Возникновение новой популяции быстро пролифелирующих клеток определяется не новыми клональными СПХ, а, по-видимому, эпигеномными изменениями, создающими измененный фенотип клеток после облучения.
Список литературы
Мамаева С.Е. 1996. Закономерности кариотипической эволюции клеток в культуре. Цитология. Т. 38. № 8. С.787. (Mamaeva S.E. 1996. Regularities of cell karyotypic evolution in culture. Tsitologiya. V. 38. P. 787).
Мамаева С.Е. 2002. Хромосомы постоянных клеточных линий человека. В кн: Атлас хромосом постоянных клеточных линий человека и животных. М.: Научный мир. С. 36. (Mamaeva S.E. 2002. Cnromosomes of human permanent cell lines. In: Atlas of chromosomes of human and animal cell lines. M.: Scientific world. P. 36).
Полянская Г.Г., Абрамян Д.С., Глебов О.К. 1981. Кариотипическая структура клоновых популяций клеток китайского хомячка при длительном культивировании. Цитология. Т. 23. № 7. С. 818. (Polyanskaya G.G., Abramyaqn D.S., Glebov O.K. 1981. The karyotypic structura of clonal population of Chinese hamster cells during a prolonged cultivation. Tsitologiya. V. 23. P. 818).
Ярцева Н.М., Федорцева Р.Ф., Арцыбашева И.В. 2007. Перестройки хромосом и их роль в спотанной иммортализации и трансформации эмбриональных клеток крысы in vitro. Цитология. Т. 49. № 4. С. 311. (Yartseva N.M., Fedortseva R.F., Artsybasheva I.V. 2007. Chromosomal rearrangements and their effects in spontaneous immortalization and transformation of rat embryo cells in vivo. Tsitologiya. V. 49. P. 311).
Chitikova Z.V., Gordeev S.A., Bykova T.V., Zubova S.G., Pospelov V.A., Pospelova T.V. 2014. Sustained activation of DNA damage response in irradiated apoptosis-resistant cells induces reversible senescence associated with mTOR downregulation and expression of stem cell markers. Cell Cycle. V. 13. C. 1424. https://doi.org/10.4161/cc.28402
Crasta K., Ganem N.J., Dagher R., Lantermann A.B., Ivanova E.V., Pan Y., Nezi L., Protopopov A., Chowdhury D., Pellma B. 2012. DNA breaks and chromosome pulverization from errors in mitosis. Nature. V. 482. P. 53. https://doi.org/10.1038/nature10802
Frias S., Ramos S., Salas C., Molina B., Rivera-Luna S.S.R. 2019. Nonclonal chromosome aberrations and genome haos in somatic and germ cells from patients and survivors of Hodgkin lymphoma. Genes. V. 10. P. 1. https://doi.org/10.3390/genes10010037
Grummt I. 2013. The nucleolus – guardian of cellular homeostasis and genome integrity. Chromosoma. V. 122. P. 487.
Han J., Sabbatini P., Perez D., Rao L., Modha D., White E. 1996. The E1B 19K protein blocks apoptosis by interacting with and inhibiting the p53-inducible and death-promoting Bax protein. Genes Dev. V. 10. P. 461. https://doi.org/10.1101/gad.10.4.461
Heng H.H.Q., Regan S.M., Liu G., Ye C.J. 2016. Why it is crucial to analyze non clonal chromosome aberrations or NCCAs? Mol. Cytogen. V. 9. P. 15. https://doi.org/10.1186/s13039-016-0223-2
Heng H.H., Horne S.D., Chaudhry S., Regan S.M., Liu G., Abdallah B.Y., Ye C.J. 2018. A postgenomic perspective on molecular cytogenetics. Curr. Genomics. V. 19. P. 227.
Howell W., Black D.A. 1980. Controller silver staining of nucleolus organizer regions with protective colloidal developer: a one-step method. Experientia. V. 36. P. 1014.
Jeggo P.A., Löbrich M. 2006. Radiation-induced DNA damage responses. Radiat. Prot. Dosimetry. V. 122. P. 124.
Kakarougkas A., Ismail A., Chambers A.L., Riballo E., Herbert A.D., Künzel J., Löbrich M., Jeggo P.A., Downs J.A. 2014. Requirement for PBAF in transcriptional repression and repair at DNA breaks in actively transcribed regions of chromatin. Mol. Cell. V. 55. P. 723.
Liu G., Stevens J.B., Horne S.D., Abdallah B.Y., Ye K.J., Bremer S.W., Ye C.J., Chen D.J. Heng H.H. 2014. Genome chaos. Survival straregy during crisis. Cell Cycle. V. 13. P. 528. https://doi.org/10.4161/cc.27378
Ly P., Cleveland D.W. 2017. Rebuilding chromosomes after catastrophe: emerging mechanisms of chromothripsis. Trends Cell Biol. V. 27. P. 917. https://doi.org/10.1016/j.tcb.2017.08.005
Mardin B.R., Drainas A.P., Waszak S.M., Weischenfeldt J., Isokane M., Stütz A M., Raeder B., Efthymiopoulos T., Buccitelli C., Segura-Wang M., Northcott P., Pfister S.M., Lichter P., Ellenberg J., Korbel1 J.O. 2015. A cell-based model system links chromothripsis with hyperploidy. Mol. Syst. Biol. V. 11. P. 828. https://doi.org/10.15252/msb.20156505
Mitelman F. 2000. Recurrent chromosome aberrations in cancer. Mutat. Res. V. 462. P. 247.
Mitelman F., Johansson B., Mertens F. 2007. The impact of translocations and gene fusions on cancer causation. Nature Rev. Cancer. V. 7. P. 233.
Ohgaki H., Kleihues P. 2009. Genetic alterations and signaling pathways in the evolution of gliomas. Cancer Sci. V. 100. P. 2235.
Orsolic I., Jurada D., Pullen N., Oren M., Eliopoulos A.G., Volarevic S. 2015. The relationship between the nucleolus and cancer: Current evidence and emerging paradigms. Semin Cancer Biol. pii: S1044-579X(15)30004-3. https://doi.org/. 2015.12.004https://doi.org/10.1016/j.semcancer
Ozkinay C., Mitelman F. 1979. A simple trypsin-Giemsa technique producing simultaneous G- and C-banding in human chromosomes. Hereditas. V. 90. P. 1.
Pellestor F.C. 2019. Chromoanagenesis: cataclysms behind complex chromosomal rearrangements. Mol. Cytogenet. V. 12. P. 6. https://doi.org/10.1186/s13039-019-0415-7
Satoh H., Yoshida M.S., Sasaki M. 1989. Resolution chromosome banding in the Norway rat, Rattus norvegicus. Cytogenet. Cell Genet. V. 50. P. 151.
Shaffer., M.L. Slovak., L.G. Cambell (eds); S. Karger, Basel, 2009. An International System for Human Cytogenetic Nomenclature.
Tuna M., Knuutila S., Mills G. B. 2009. Uniparental disomy in cancer. Trends in Molecular Medicine. V. 15. P. 120 .
Yartseva N.M., Bykova T.V., Zubova S.G., Pospelov V.A., Pospelova T.V. 2019. Chromosomal instability and evolution of transformed phenotypein cell lines selected from senescent rat embryonic fibroblasts with rapamycin. Cell Tissue Biol., V. 13. P. 18. https://doi.org/10.1134/S1990519X19010103
Ye C.J., Regan S., Liu G., Alemara S., H. Heng H. 2018. Understanding aneuploidy in cancer through the lens of system inheritance, fuzzy inheritance and emergence of new genome systems. Mol. Cytogen. V. 11. P. 31. https://doi.org/10.1186/s13039-018-0376-2
Ye C.J., Sharpe Z., Alemara S., Mackenzie S., Liu G. Abdallah B., Horne S., Regan S., Heng H.H., 2019. Micronuclei and genome chaos: changing the system inheritance. Genes. V. 10. P. 366. https://doi.org/10.3390/genes10050366
Zhang C.Z., Spektor A., Cornils H., Francis J.M., Jackson E K., Liu S., Meyerson M., Pellman D. 2015. Chromothripsis from DNA damage in micronuclei. Nature. V. 522. P. 179. https://doi.org/10.1038/nature14493
Дополнительные материалы отсутствуют.


