Цитология, 2020, T. 62, № 12, стр. 894-902
Влияние убихинола на состояние церебральных эндотелиоцитов в различных структурах головного мозга крыс
Н. С. Шаповал 1, *, Н. А. Малиновская 2, А. В. Моргун 2, А. Б. Салмина 2, О. Н. Оболенская 1, Н. А. Медведева 1, О. С. Медведев 1, 2
1 Московский государственный университет им. М.В. Ломоносова
119192 Москва, Россия
2 Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого Минздрава России
660022 Красноярск, Россия
* E-mail: natali31193@mail.ru
Поступила в редакцию 31.08.2020
После доработки 09.09.2020
Принята к публикации 10.09.2020
Аннотация
Способность перспективного антиоксидантного и нейропротекторного препарата коэнзима Q10 (убихинона) проникать через гематоэнцефалический барьер (ГЭБ) делает его потенциальным агентом, который может оказывать влияние на митохондриальный метаболизм клеток головного мозга. Особый интерес представляет его восстановленная форма (убихинол), способная влиять на структурно-функциональную активность клеток, формирующих ГЭБ. Однако механизмы проникновения, действия препарата на клетки головного мозга и его эффекты до конца не изучены. Целью нашей работы явилось изучение влияния убихинола на молекулы, регулирующие проницаемость ГЭБ и процессы апоптоза в различных структурах головного мозга крыс. Оценивали влияния коэнзима Q10 на количество клеток, иммунопозитивных по CD31, Pgp, CLDN5, и уровень апоптоза в срезах разных участков мозга крыс после однократного внутривенного введения убихинола в дозе 30 мг на 1 кг веса крысы. Результаты свидетельствуют о том, что убихинол вызывает увеличение количества клеток, несущих маркер CD31, в энторинальной коре в течение 2–24 ч после воздействия с последующим нарастанием CLDN5 в течение 96–192 ч после воздействия. Примечательно, что в миндалине головного мозга увеличение CD31 сопровождалось отсроченным снижением CLDN5, а в гиппокампе мы зарегистрировали лишь снижение CLDN5. Полученные нами данные о снижении интенсивности апоптоза не позволяют сказать о том, какой вклад в этот эффект вносят церебральные эндотелиоциты, однако обнаруженные признаки интенсификации ангиогенеза и регион-специфические изменения целостности ГЭБ при действии убихинола позволяют рассматривать его в качестве перспективного агента для коррекции дисфункции ГЭБ при заболеваниях головного мозга.
Коэнзим Q10 (СоQ10, убихинон) является перспективным препаратом c антиоксидантными и нейропротекторными свойствами. Он играет важную роль в митохондриальном дыхании и антиоксидантной защите (Tatsuta et al., 2017). Известно, что его восстановленная форма (убихинол, CoQ10H2) эффективно ингибирует окислительный стресс и замедляет старение (Huo et al., 2018). Особый интерес представляет влияние убихинола на структурно-функциональную активность клеток, формирующих гематоэнцефалический барьер (ГЭБ), который является важным селективным барьером между кровеносной системой и головным мозгом.
ГЭБ представляет сложную сеть специализированных микрососудов с высокой экспрессией плазматических мембранных переносчиков лекарственных средств. Особый интерес в контексте ГЭБ представляют клетки церебральных микрососудов, участвующих в различных транспортных процессах в составе нейроваскулярной единицы головного мозга: эндотелиоциты, перициты, периваскулярные астроциты, нейроны и, по мнению ряда авторов, микроглия (Abbott et al., 2010; Кувачева и др., 2013).
Эндотелий является основой ГЭБ и представляет собой слой клеток, выстилающих кровеносные сосуды (Kallmann et al., 2002), располагающийся на базальной мембране стенки сосудов и участвующей в регуляции трансцеллюлярного и парацеллюлярного транспорта.
Уникальность клеток церебрального эндотелия определяется такими особенностями, как наличие плотных, щелевых и адгезивных контактов, отсутствием фенестраций, высоким трансэндотелиальным электрическим сопротивлением и низкой пиноцитозной активностью, а также высокой плотностью митохондрий (Sanchez-Covarrubias et al., 2014; Gastfriend et al., 2018). Межэндотелиальные соединения могут регулировать проницаемость ГЭБ посредством двух разных типов белковых комплексов: адгезивных соединений и плотных контактов (Kluger et al., 2013).
Плотные контакты между эндотелиальными клетками образуют структурную основу барьера с низкой проницаемостью (Engelhardt, 2003; Hawkins, Davis, 2005). Одним из белков, отвечающим за формирование контакта между соседними клетками, является клаудин (Campbell et al., 2017). В частности, в церебральных эндотелиальных клетках плотные контакты организованы вокруг белков клаудинов, наиболее распространенным из которых является клаудин-5 (CLDN5) (Anderson, Van Itallie, 2009). Плотные контакты ограничивают парацеллюлярный транспорт гидрофильных молекул в мозг (Hawkins, Davis, 2005), что важно для поддержания химического гомеостаза в тканях центральной нервой системы (Kallmann et al., 2002).
Другой важной функцией эндотелия является его способность к адгезии (DeLisser et al., 1997). CD31 располагается в нескольких основных типах клеток, связанных с сосудистым компартментом. CD31 в качестве молекулы адгезии эндотелия сосудистой стенки обеспечивает множественные и важные межклеточные взаимодействия с участием тромбоцитов, лейкоцитов и эндотелиальных клеток в процессах формирования, функционирования и регенерации сосудистого русла, а также в развитии самых ранних этапов дисфункции эндотелия. Таким образом, СD31 может представлять потенциальную мишень для новых терапевтических агентов, направленных на различные патологические состояния (DeLisser et al., 1994; Smith, 2008).
Установлено, что в церебральном эндотелии экспрессия АТФ-зависимых кассетных транспортеров (ABC-транспортеры) дополнительно препятствует прохождению ксенобиотиков из кровотока в мозг (Miller et al., 2000). P-гликопротеин (Pgp/Abcb1) является основным переносчиком оттока, расположенным на просветной стороне эндотелия сосудов мозга (More et al., 2017). Считается, что транспортеры оттока на ГЭБ могут регулироваться разными стимулами, включая окислительный стресс, воспалительный ответ, нейродегенерацию, фосфолипиды и ксенобиотики (Miller, Cannon, 2014).
Функциональная активность церебрального эндотелия определяется эффективностью гликолитической и митохондриальной продукции АТФ (Salmina et al., 2015). Митохондрии, которых в церебральном эндотелии содержится в 5–6 раз больше, чем в эндотелиальных клетках других органов и тканей (Kluge, 2013), являются главным внутриклеточным источником активных форм кислорода (АФК) и их мишенью. АФК в определенных концентрациях могут вызывать апоптоз путем изменения проницаемости мембран митохондрий и высвобождения цитохрома C. Исследования последних лет показали, что митохондрии играют ключевую роль в ранней фазе апоптоза (Sena, Chandel, 2012; Arakawa et al., 2015; Zhang et al., 2018).
Как было показано ранее, коэнзим Q10 проникает через ГЭБ (Matthews et al., 1998; Isobe et al., 2010; Tatsuta et al., 2017; Kalenikova et al., 2018). Способность коэнзима Q10 проникать через ГЭБ делает его потенциальным агентом, который может оказывать влияние на митохондриальный метаболизм клеток головного мозга. Однако механизмы проникновения, действия на клетки и его эффекты в головном мозге до конца не изучены.
Цель настоящей работы заключалась в изучении влияния убихинола на белки эндотелия, регулирующие проницаемость ГЭБ, и процесс апоптоза в различных структурах головного мозга крыс.
МАТЕРИАЛ И МЕТОДИКА
Протокол эксперимента. Работу проводили на крысах-самцах Wistar (n = 25) с массой тела 300–350 г, полученных из питомника Столбовая НЦБМТ ФМБА России, в соответствии с приказом Минздрава России от 01.04.2016 № 199н “Об утверждении Правил надлежащей лабораторной практики” и разрешением комитета по биоэтике МГУ им. М.В. Ломоносова. Животных содержали в отдельном виварии в условиях 12-часового режима день/ночь, с неограниченным доступом к еде и воде. Перед всеми манипуляциями животных выдерживали на карантине как минимум 7 сут.
Для внутрибрюшинного наркоза использовали хлоралгидрат (ХИММЕД, Россия) в дозе 300 мг на 1 кг веса животного. Экспериментальной группе животных вводили 1% раствор убихинола (CoQ10H2) однократно внутривенно в дозе 30 мг/кг с использованием полипропиленового катетера, вживленного в бедренную вену животного. Контрольной группе (К) вводили физиологический раствор. Образцы головного мозга брали у животных, которым вводили препарат, через 2, 24, 96 и 192 ч после его введения (Shapoval et al., 2018), используя по 5 животных на каждую временную точку. Перед проведением декапитации проводили эвтаназию животных с помощью передозировки наркоза (хлоралгидрат, внутрибрюшинно). Мозг извлекали и помещали в 10% формалин.
Оценка наличия антигенов CD31, Pgp, CLDN5. Оценку проводили на свободно-плавающих срезах по стандартной методике одновременного комбинированного окрашивания препарата (протоколы для свободно-плавающих срезов фирмы Abcam, Великобритания). Срезы мозга делали на микротоме толщиной 100 мкм.
Окраску проводили в 24-луночных планшетах, все этапы окраски и промывки проводили с использованием шейкера. Антитела в лунку планшета добавляли в объеме 300 мкл, промывали в растворе фосфатного буфера (PBS) объемом 500 мкл. До блокады неспецифической активности проводили демаскирование срезов, которое состояло из двух этапов. Сначала срезы обрабатывали протеиназой К в финальной концентрации 50 мкг/мл (100 мкл маточного раствора разводили в 10 мл PBS) и инкубировали в течение 5 мин в термостате при температуре 37°С. Затем срезы нагревали в микроволновой печи, поместив в контейнер с дистиллированной водой, в течение еще 5 мин.
Неспецифическую активность блокировали 2-часовой инкубацией при комнатной температуре в промывочном растворе (0.2% Тритона X-100 в PBS). Инкубацию срезов с первичными антителами проводили в течение ночи при 4°С в растворе PBS, содержащем 0.2% Тритона X-100 и 3% BSA (АВ-раствор); затем продолжали инкубацию 2 ч при комнатной температуре. Использовали антитела против СD31в разведении 1 : 200 (550300, Becton Dickinston, США), моноклональные анти-AntiP-Glycoprotein (MDR) Pgp в разведении 1 : 200 (R7965, Sigma-Aldrich, США) и против CLDN5 (H-52) в разведении 1 : 100 (SC-28670, Santa Cruz Biotechnology, США). Инкубацию с вторичными антителами Alexa Flour 488 и A-lexa Flour 555 (ab150117 и ab150134 соответственно; Abcam, Великобритания) в разведении 1 : 2500 проводили в AB-растворе 2 ч при комнатной температуре. На всех этапах осуществляли 2–3-кратную промывку образцов в течение 5 мин промывочным раствором. Завершающим этапом был перенос срезов на стекло и нанесение на срез 15 мкл монтирующей жидкости (50% глицерин в PBS, содержащий краситель DAPI в концентрации 2 мкг/мл). Препарат накрывали покровным стеклом и микроскопировали.
Исследуемыми участками головного мозга были зубчатая извилина гиппокампа (участок, отвечающий за долговременную память, а также нейрогенез), базолатеральная часть миндалины (отвечающая за эмоциональную память) и энторинальная кора (связующее звено между ассоциативными областями неокортекса и гиппокампом) (Tatsuta et al., 2017).
Оценка апоптоза. Использовали метод TUNEL при помощи набора реактивов 17-141 TUNEL Apoptosis Detection Kit (Abcam, Великобритания) в соответствии со стандартным протоколом фирмы-производителя. Метод позволяет распознать разрывы нитей ДНК (связывание 3'-ОН-концов с мечеными нуклеотидами с помощью фермента TdT). Срезы инкубировали в реакционной смеси раствора (200–300 мкл) с TdT и нуклеотидами, меченными авидин-FITC. Ядра клеток окрашивали йодистым пропидием (PI) в присутствии ДНКазы в течение 15 мин при комнатной температуре. Окраску проводили в 24-луночных планшетах (200–300 мкл смеси в лунке), все этапы окраски и промывки проводили с использованием шейкера. Срезы промывали двумя сменами PBS объемом 500 мкл по 2 мин, переносили срезы на стекла, препарат накрывали покровным стеклом и микроскопировали.
Микроскопия образцов. Использовали флуоресцентный микроскоп ZOE (Bio-Rad, США) и полностью автоматизированный конфокальный лазерный сканирующий микроскоп Olympus FV10i-W (Olympus, Япония). При анализе фотоснимков использовали программу ImageJ (версия 1.52р). Считали относительное количество клеток (в %), имеющих соответствующие антигены, от общего числа клеток в поле зрения. Во всех случаях анализировали не менее 5 полей зрения.
Статистическая обработка данных. Использовали программу Prism 7 (GraphPad Software, США) и методы непараметрической статистики. Для сравнения показателей в независимых выборках применяли критерий Краскела−Уоллиса с последующими попарными сравнениями. Различия принимали значимыми при уровне значимости p ≤ 0.05. Результаты представлены средне арифметическими значениями и их ошибкой.
РЕЗУЛЬТАТЫ
Влияние убихинола на количество эндотелиальных белков (CD31, Pgp, и CLDN5) в срезах разных участков мозга крыс. По результатам иммуногистохимического анализа (рис. 1) через 2 ч после введения убихинола наблюдали увеличение относительного количества CD31-иммунопозитивных (CD31+) клеток в энторинальной коре головного мозга до 24.8% (р = 0.0232) по сравнению с группой К, в которой этот показатель составил 19.1% , а в миндалине – до 26.8% (р = 0.0235) по сравнению с группой К (18.4%). Через 24 ч после введения убихинола в энторинальной коре наблюдали увеличение экспрессии СD31 до 25.9% (p = 0.0222) по сравнению с группой К (19.1%). Количество Pgp-иммунопозитивных (Pgp+) клеток в гиппокампе повышалось через 96 ч до 34.1% (p = 0.0114) по сравнению с группой К (21%) и значимо снижалось в миндалине через 192 ч до 21% относительно группы К, где составляло 29.6% (p = = 0.0428). В энторинальной коре через 96 ч действия убихинола было зафиксировано повышение относительного количества СLDN5-иммунопозитивных (CLDN5+) клеток до 34.5% , а через 192 ч –до 34.9% по сравнению с группой К, где оно составляло 22.3% (p = 0.0362 и p = 0.0271 соответственно). В гиппокампе через 192 ч после введения убихинола количество CLDN5+-клеток снижалось до 14.55% (p = 0.0325) относительно К ( 26.5%), а в миндалине – до 14.2% (p = 0.0236) по сравнению с К (25.1%).
Рис. 1.
Влияние однократного внутривенного введения убихинола на количество клеток (%), несущих антиген CD31 (верхний ряд гистограмм), Pgp (средний ряд) и CLDN5 (нижний ряд) в структурах головного мозга крыс: энторинальной коре (а), гиппокампе (б), миндалине (в). Звездочкой показаны статистически значимые отличия от контроля (К) (p ≤ 0.05; тест Краскела–Уоллиса).

Таким образом, убихинол повышает количество CD31+-клеток в миндалине и энторинальной коре, увеличивает количество Pgp+-клеток с маркером в гиппокампе и снижает в миндалине, а также повышает количество CLDN5+-клеток в энторинальной коре, но снижает в гиппокампе и миндалине.
Апоптоз в ткани головного мозга крыс после однократного внутривенного введения убихинола (TUNEL-анализ). В нашей работе мы проводили оценку апоптоза в различных структурах головного мозга крыс после однократного внутривенного введения убихинола (рис. 2). По результатам оценки апоптоза было установлено, что убихинол влияет на апоптоз, снижая процентную долю TUNEL+-клеток в головном мозге крыс. Так, в энторинальной коре через 96 и через 192 ч после внутривенного введения убихинола происходит снижение количества апоптотических клеток в 2 раза (р = 0.0045, р = 0.0154 соответственно) по сравнению с группой К, в которой его значение составляло 4.7 (рис. 3).
Рис. 2.
Влияние убихинола на уровень апоптоза в различных структурах головного мозга крыс: энторинальной коре (а), гиппокампе (б), миндалине (в). Звездочкой показаны статистически значимые отличия от контроля (К) при *p ≤ 0.05, **p ≤ 0.01, ***p ≤ 0.001, ****p ≤ 0.0001 (тест Краскела–Уоллиса). По вертикали – количество апоптотических клеток, % (отношение количества клеток с меткой FITC к общему числу клеток в поле зрения, ядра клеток окрашены PI).
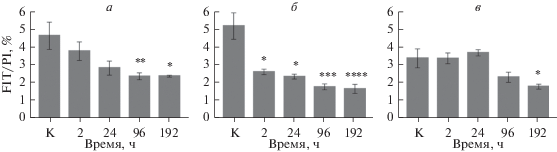
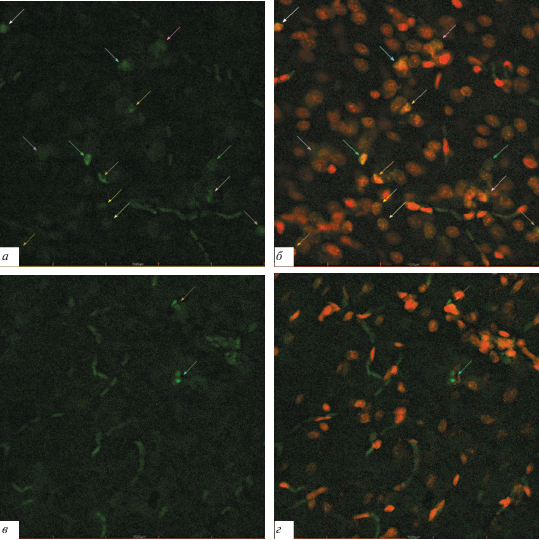
Рис. 3.
Апоптоз в клетках энторинальной коры головного мозга, зарегистрированный с использованием метода TUNEL. а – Клетки контрольной группы (К), в которых произошел апоптоз, окрашенные FITC; б – эти же клетки с ядрами, окрашенными PI (совмещение с изображением а); в – клетки через 96 ч после однократного внутривенного введения убихинола в дозе 30 мг/кг, окрашенные FITC; г – эти же клетки с ядрами, окрашенными PI (совмещение с изображением в). Стрелками показаны клетки в апоптозе. Увел. об.: 60×.
В гиппокампе наблюдается двукратное снижение апоптотических клеток уже через 2 ч (р = 0.0390) и сохраняется примерно на том же уровне в течение 24 ч (р = 0.0230) по сравнению с К (5.2%). Через 96 ч в гиппокампе уровень апоптоза снижается в 3 раза (р = 0.0001) и остается приблизительно на том же уровне через 192 ч (р < 0.0001).
В миндалине снижение апоптоза в 2 раза зафиксировано через 192 ч после введения убихинола (р = = 0.0209) относительно группы К (3.3%).
ОБСУЖДЕНИЕ
Полученные нами результаты свидетельствуют о том, что убихинол через 2–24 ч после воздействия вызывает увеличение количества CD31+-клеток в энторинальной коре с последующим нарастанием количества CLDN5+-клеток в период 96–192 ч после воздействия. Примечательно, что в миндалине головного мозга увеличение присутствия CD31 на клетках церебрального эндотелия сопровождалось отсроченным снижением CLDN5, а в гиппокампе мы зарегистрировали лишь снижение CLDN5+-клеток.
Молекула CD31 (PECAM-1) участвует в регуляции ангиогенеза, воспаления и активации клеточной адгезии и рассматривается как прогностический маркер ангиогенеза (Buckley et al., 1996). Важность маркера CLDN5 для контроля проницаемости эндотелиальных клеток была продемонстрирована в экспериментах на мышах с дефицитом клаудина-5. В мозге этих мышей развитие и морфология кровеносных сосудов не изменялись, не было кровотечений или отеков. Однако эксперименты с трейсером и магнитно-резонансная томография показали, что у этих мышей избирательно затрагивалась проницаемость ГЭБ для малых молекул (Nitta et al., 2003). Таким образом, логично предположить, что в энторинальной коре при действии убихинола инициируются процессы неоангиогенеза, ассоциированные с барьерогенезом, тогда как в гиппокампе и миндалине головного мозга в отдаленные сроки после введения убихинола можно прогнозировать снижение структурной целостности ГЭБ.
Через 96 ч после действия убихинола увеличивалась экспрессия Pgp в гиппокампе. Известно, что Pgp − это мембранный эффлюксный АТФ-зависимый белок-транспортер с широким спектром эндогенных и экзогенных субстратов. Он выводит из клеток ксенобиотики и эндогенные метаболиты (Sharom, 2008). Тот факт, что увеличение экспрессии Рgp после введения убихинола было характерным только для гиппокампа, позволяет предположить, что именно в этом регионе головного мозга ГЭБ является максимально экипирован для выведения потенциально токсичных соединений из ткани мозга в кровь, что косвенно подтверждается более выраженным, по сравнению с другими отделами мозга, уровнем снижения интенсивности спонтанного апоптоза в гиппокампе.
Следует упомянуть, что Pgp активен в отношении широкого спектра субстратов: от небольших молекул, таких, как органические катионы, углеводы, аминокислоты и некоторые антибиотики до макромолекул, таких как полисахариды и белки (Zhou, 2008; Martins et al., 2019). Известно, что низкая биодоступность убихинола частично ассоциирована с его взаимодействием с Pgp, вызывающим отток лекарственного средства (Hirano, Iseki, 2008; Davis et al., 2017). Поскольку в нашей работе было установлено, что через 96 ч после введения убихинола экспрессия Pgp увеличивается в гиппокампе, можно предположить, что изменение экспрессии Pgp имеет индуцибельный характер.
По результатам исследования (Sun et al., 2019), в котором на мышах оценили действие убихинола при митохондриальной дисфункции, вызванной диабетической нефропатией, было установлено, что препарат снижает уровень апоптоза, который повышается при этой патологии за счет митохондриальных аномалий, таких как дефектная митофагия, образование митохондриальных АФК и снижение митохондриального мембранного потенциала. Убихинол, как эффективный антиоксидант в митохондриях, оказывал благотворное влияние на диабетическую нефропатию через митофагию, восстанавливая передачу сигналов Nrf2/ARE (Sun et al., 2019).
Авторы другой работы, в которой изучали защитный эффект коэнзима Q10 против высокого, индуцированного глюкозой, окислительного стресса в эндотелиальных клетках пупочной вены человека (HUVEC), сделали вывод, что коэнзим Q10 предотвращает апоптоз, вызванный АФК, путем ингибирования митохондриально-зависимого пути через каспазу 3 (Tsuneki et al., 2007). Более подробное исследование (Tsai et al., 2016) установило механизм снижения апоптоза, который включает подавление каспазы 3, усиление Bcl-2 и увеличение мембранного потенциала митохондрий. Кроме того, обработка CoQ10 снижала количество АФК, повышала активность eNOS/Akt и увеличивала экспрессию гемоксигеназы-1 в эндотелиальных клетках-предшественниках, обработанных глюкозой в высокой дозе (Tsai et al., 2016).
В работе, в которой эндотелиальные клетки H-UVEC обрабатывали пероксидом водорода, изучали защитный эффект убихинола против старения, окислительного повреждения и снижения активности клеточных функций. Сообщается, что убихинол заметно снижает количество β-галактозидаза-позитивных клеток, связанных со старением, и подавляет экспрессию ассоциированных со старением секреторных фенотип-ассоциированных генов в клетках HUVEC, подавляя образование внутриклеточных АФК; кроме того, убихинол предотвращал апоптоз и снижение митохондриальной функции, задерживая старение сосудов (Huo et al., 2018).
Полученные нами данные о снижении интенсивности апоптоза не позволяют сказать о том, какой вклад в этот эффект вносят церебральные эндотелиоциты, однако обнаруженные признаки интенсификации ангиогенеза и регион-специфические изменения целостности ГЭБ при действии убихинола позволяют рассматривать его в качестве перспективного агента для коррекции дисфункции ГЭБ при заболеваниях головного мозга.
Список литературы
Кувачева Н.В., Салмина А.Б., Комлева Ю.К., Малиновская Н.А., Моргун А.В., Пожиленкова Е.А., Замай Г.С., Яузина Н.А., Петрова М.М. 2013. Проницаемость гематоэнцефалического барьера в норме, при нарушении развития головного мозга и нейродегенерации. Журн. неврол. и психиатрии им. С.С. Корсакова. Т. 113. № 4. С. 80. (Kuvacheva N.V., Salmina A.B., Komleva Y.K., Malinovskaya N.A., Morgun A.V., Pozhilenkova E.A., Zamai G.S., Yauzina N.A., Petrova M.M. 2013. Permeability of the hematoencephalic barrier in normalcy, brain development pathology and neurodegeneration. S.S. Korsakov J. Neurol. Psychiatry. V. 113. № 4. P. 80.)
Abbott N.J., Patabendige A., Dolman D., Yusof S.R., Begley D.J. 2010. Structure and function of the blood–brain barrier. Neurobiol. Disease. V. 37. P. 13.
Anderson J.M., Van Itallie C.M. 2009. Physiology and function of the tight junction. Cold Spring HarbPerspect.Biol.1, a002584. https://doi.org/10.1101/cshperspect.a002584
Arakawa S., Nakanomyo I., Kudo-Sakamoto Y., Akazawa H., Komuro I., Shimizu S. 2015. Identification of a novel compound that inhibits both mitochondria-mediated necrosis and apoptosis. Biochem. Biophys. Res. Commun. V. 467. P. 1006.
Buckley C.D., Doyonnas R., Newton J.P., Blystone S.D., Brown E.J., Watt S.M., Simmons D.L. 1996. Identification of αvβ3 as a heterotypic ligand for CD31/PECAM-1. J. Cell Sci. V. 109. P. 437.
Campbell H.K., Maiers J.L., DeMali K.A. 2017. Interplay between tight junctions and adherens junctions. Exper. Cell Res. V. 358. P. 39.
Davis B.M., Tian K., Pahlitzsch M., Brenton J., Ravindran N., Butt G., Malaguarnera G., Normando E.M., Guo L., Cordeiro M.F. 2017. Topical coenzyme Q10 demonstrates mitochondrial-mediated neuroprotection in a rodent model of ocular hypertension. Mitochondrion. V. 36. P. 114.
DeLisser H.M., Christofidou-Solomidou M., Strieter R.M., Burdick M.D., Robinson C.S., Wexler R.S., Kerr J.S., Garlanda C., Merwin J.R., Madri J.A., Albelda S.M. 1997. Involvement of endothelial PECAM-1/CD31 in angiogenesis. Am. J. Pathol. V. 151. P. 671.
DeLisser H.M., Newman P.J., Albelda S.M. 1994. Molecular and functional aspects of PECAM-1/CD31. Immunol. Today. V. 15. P. 490.
Engelhardt B. 2003. Development of the blood-brain barrier. Cell Tiss. Res. V.314. P.119.
Gastfriend B.D., Palecek S.P., Shusta E.V. 2018. Modeling the blood-brain barrier: Beyond the endothelial cells. Curr. Opin. Biomed. Eng. V. 5. P. 6.
Hawkins B.T., Davis T.P. 2005. The blood-brain barrier/neurovascular unit in health and disease. Pharmacol. Rev. V. 57. P. 173.
Hirano T., Iseki K. 2008. Interaction of coenzyme Q10 with the intestinal drug transporter P-glycoprotein. J. Agric. Food Chem. V. 56. P. 6923.
Huo J., Xu Z., Hosoe K., Kubo H., Miyahara H., Dai J., Mori M., Sawashita J., Higuchi K. 2018. Coenzyme Q10 prevents senescence and dysfunction caused by oxidative stress in vascular endothelial cells. Oxid. Med. Cell Longev. 3181759. https://doi.org/10.1155/2018/3181759
Isobe C., Abe T., Terayama Y. 2010. Levels of reduced and oxidized coenzyme Q-10 and 8-hydroxy-2'-deoxyguanosine in the CSF of patients with Alzheimer’s disease demonstrate that mitochondrial oxidative damage and/or oxidative DNA damage contributes to the neurodegenerative process. J. Neurol. V. 257. P. 399.
Kalenikova E.I., Gorodetskaya E.A., Obolenskaya O.N., Shapoval N.S., Makarov V.G., Medvedev O.S. 2018. Tissue-level dynamics and redox state of coenzyme Q10 in rats after intravenous injection of ubiquinol. Pharm. Chem. J. V. 52. P. 690.
Kallmann B.A., Wagner S., Hummel V., Buttmann M., Bayas A., Tonn J.C., Rieckmann P. 2002. Characteristic gene expression profile of primary human cerebral endothelial cells. FASEB J. V. 16. P.589.
Kluge M.A., Fetterman J.L., Vita J.A. 2013. Mitochondria and endothelial function. Circ. Res. V. 112. P. 1171.
Kluger M.S., Clark P.R., Tellides G., Gerke V., Pober J.S. 2013. Claudin-5 controls intercellular barriers of human dermal microvascular but not human umbilical vein endothelial cells. Arterioscler. Thromb. Vasc. Biol. V. 33. P. 489.
Martins E., Silva V., Lemos A., Palmeira A., Puthongking P., Sousa E., Rocha-Pereira C., Ghanem C.I., Carmo H., Remião F., Silva R. 2019. Newly Synthesized oxygenated xanthones as potential p-glycoprotein activators: In vitro, ex vivo, and in silico studies. Molecules. V. 24. P. 707.
Matthews R.T., Yang L., Browne S., Baik M., Beal M.F. 1998. Coenzyme Q10 administration increases brain mitochondrial concentrations and exerts neuroprotective effects. Proc. Natl. Acad. Sci. USA. V. 95. P. 8892.
Miller D.S., Cannon R.E. 2014. Signaling pathways that regulate basal ABC transporter activity at the blood-brain barrier. Curr. Pharm. Des. V. 20. P. 1463.
Miller D.S., Nobmann S.N., Gutmann H., Toeroek M., Drewe J., Fricker G. 2000. Xenobiotic transport across isolated brain microvessels studied by confocal microscopy. Mol. Pharmacol. V. 58. P. 1357.
More V.R., Campos C.R., Evans R.A., Oliver K.D., Chan G.N., Miller D.S., Cannon R.E. 2017. PPAR-α, a lipid-sensing transcription factor, regulates blood-brain barrier efflux transporter expression. J. Cereb. Blood Flow Metab. V. 37. P. 1199.
Nitta T., Hata M., Gotoh S., Seo Y., Sasaki H., Hashimoto N., Furuse M., Tsukita S. 2003. Size-selective loosening of the blood-brain barrier in claudin-5-deficient mice. J. Cell Biol. V. 161. P. 653.
Salmina A.B., Kuvacheva N.V., Komleva Y.K., Pozhilenkova E.A., Lopatina O.L., Gorina Y.V., Petrova L.L., Morgun A.V., Taranushenko T.E. 2015. Glycolysis-mediated control of blood-brain barrier development and function. Int. J. Biochem. Cell Biol. V. 64. P. 174.
Sanchez-Covarrubias L., Slosky L.M., Thompson B.J., Davis T.P., Ronaldson P.T. 2014. Transporters at CNS barrier sites: obstacles or opportunities for drug delivery? Current Pharm. Design. V. 20. P. 1422.
Sena L.A., Chandel N.S. 2012. Physiological roles of mitochondrial reactive oxygen species. Molecular Cell. V. 48. P. 158.
Shapoval N., Obolenskaia O., Kalenikova E., Gorodetskaya E., Medvedev O. 2018. Tissue distribution and redox status of coenzyme Q10 after intravenous administration of ubiquinol to rat. J. Hypertension. V. 36. P. 149.
Sharom F.J. 2008. ABC multidrug transporters: Structure, function and role in chemoresistance. Pharmacogenomics. V. 9. P. 105.
Smith C.W. 2008. Adhesion molecules and receptors. J. Allergy Clin. Immunol. V. 121. P. 375.
Sun J., Zhu H., Wang X., Gao Q., Li Z., Huang H. 2019. CoQ10 ameliorates mitochondrial dysfunction in diabetic nephropathy through mitophagy. J Endocrinol. JOE-18-0578.R1. https://doi.org/10.1530/JOE-18-0578
Tatsuta Y., Kasai K., Maruyama C., Hamano Y., Matsuo K., Taira S. 2017. Imaging mass spectrometry analysis of ubiquinol localization in the mouse brain following short-term administration. Sci. Reports. V. 7. P. 1.
Tsai H.Y., Lin C.P., Huang P.H., Fan Y., Deng X. 2016. Coenzyme Q10 attenuates high glucose-induced endothelial progenitor cell dysfunction through AMP-activated protein kinase pathways. J. Diabetes Res. 6384759. https://doi.org/10.1155/2016/6384759
Tsuneki H., Sekizaki N., Suzuki T., Kobayashi S., Wada T., Okamoto T., Kimura I., Sasaoka T. 2007. Coenzyme Q10 prevents high glucose-induced oxidative stress in human umbilical vein endothelial cells. Eur. J. Pharmacol. V. 566. P. 1.
Zhang H., Chang Z., Mehmood K., Abbas R. Z., Nabi F., Rehman M.U., Wu X., Tian X., Yuan X., Li Z., Zhou D. 2018. Nano copper induces apoptosis in PK-15 cells via a mitochondria-mediated pathway. Biol. Trace. Elem. Res. V. 181. P. 62.
Zhou S.F. 2008. Structure, function and regulation of p-glycoprotein and its clinical relevance in drug disposition. Xenobiotica. V. 38. P. 802.
Дополнительные материалы отсутствуют.


