Журнал аналитической химии, 2020, T. 75, № 4, стр. 291-315
Пористый графитированный углерод для разделения и концентрирования гидрофильных веществ
Е. Н. Гончарова a, М. А. Статкус a, Г. И. Цизин a, b, *, Ю. А. Золотов a, b
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119992 Москва, Ленинские горы, 1, стр. 3, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119071 Москва, Ленинский просп., 31, Россия
* E-mail: tsisin@analyt.chem.msu.ru
Поступила в редакцию 25.06.2019
После доработки 06.09.2019
Принята к публикации 07.11.2019
Аннотация
В обзоре обсуждены способы получения, структура, а также особенности и перспективы применения углеродных сорбентов, прежде всего пористого графитированного углерода, для разделения и концентрирования гидрофильных органических веществ, находящихся в водных растворах. Рассмотрены механизмы сорбции таких веществ, возможности применения пористого графитированного углерода в экстремальных условиях, приведены многочисленные примеры решения конкретных задач.
Углеродные материалы давно и широко используют для создания средств химического анализа, в том числе в качестве сорбентов для разделения веществ в жидких и газовых средах. Общепризнано, что углеродные сорбенты – активные угли, графитированные материалы, нанотрубки, фуллерены, наноалмазы и др. – характеризуются свойствами, существенно отличающимися от свойств других сорбентов, неорганических и органополимерных. Эти свойства могут быть использованы, например, для решения сложных задач концентрирования/разделения полярных органических веществ в водных растворах.
Активированные (активные) угли, несомненно, были одними из первых материалов, используемых для извлечения органических соединений из водных и газовых сред [1]. Эти материалы, в зависимости от способа получения, содержат 87–97% углерода, в их составе всегда содержатся также кислород и водород. Поры в активированном угле имеют разные размеры; обычно их делят на три группы – микропоры (менее 0.7 нм), мезо- и макропоры (более 50 нм). Макропоры выполняют главным образом транспортную функцию, а сорбция в основном проходит в микро- и мезопорах. Свойства углей как сорбентов в большой степени определяются наличием и химическими формами кислорода на поверхности угля. Для увеличения содержания кислорода, изменения его форм и, соответственно, функций активированные угли модифицируют [2]. К сожалению, в силу полифункциональности поверхности, а также наличия нанопор сорбция многих аналитов, в том числе гидрофильных органических веществ, часто необратима. В связи с этим такие сорбенты практически не используют в качестве неподвижной фазы в жидкостной хроматографии и для обратимого концентрирования веществ. Однако их можно применять для сорбции элементов и анализировать твердый концентрат. Такие сорбенты целесообразно использовать для удаления сопутствующих, мешающих определению веществ, т.е. в тех случаях, когда не требуется обратимость сорбции. В этом варианте угли применяли, например, для отделения мешающих компонентов при определении некоторых пестицидов в экстрактах из фруктов и овощей [3].
В последнее время для концентрирования и разделения органических веществ все чаще применяют углеродные наноматериалы: углеродные нанотрубки (УНТ), графены, наноалмазы, фуллерены и др. Рассмотрим некоторые примеры применения таких материалов для концентрирования. Углеродные нанотрубки и графен являются аллотропными модификациями углерода и имеют сетчатую структуру из sp2-гибридизованных атомов углерода [4]. Это – родственные материалы: УНТ можно представить себе в виде цилиндра, образованного путем склеивания в трубку плоских графеновых листов, а графен – в виде развернутой в плоский лист нанотрубки. Углеродные нанотрубки могут состоять из одного или нескольких графеновых слоев. Расстояние между слоями составляет 0.34 нм, как и у графита. Параметры самой нанотрубки, такие как длина, диаметр и др., зависят от способа получения данного материала.
Сложность синтеза и часто недостаточная стабильность УНТ вначале затрудняли внедрение этих материалов в практику химического анализа. Однако в последние годы предложены альтернативные методы синтеза УНТ, которые обеспечивают стабильность и высокую прочность частиц [5]. Так, УНТ нашли применение для концентрирования веществ, твердофазной микроэкстракции в составе мембран, хроматографического разделения компонентов смесей (в газовой и жидкостной хроматографии), для препаративного выделения веществ, а также в электрофорезе. Например, УНТ использовали для концентрирования при определении кобаламинов, в качестве неподвижной фазы для разделения пептидов [5].
Материалы на основе графена из-за потенциально большой площади поверхности (2630 м2/г [6]), высокой адсорбционной способности, химической и термической стабильности достаточно широко применяют в хроматографии [7]. Однако в большинстве случаев реальная площадь поверхности полученных графеновых материалов меньше, чем других материалов на основе углерода. Разработка монодисперсных однослойных графеновых материалов до сих пор является важной проблемой.
Фуллерены представляют собой полиэдрические углеродные “сферы”, в которых sp2-гибридизованные атомы углерода образуют пятичленные и шестичленные кольца [8]. Они имеют общую формулу C20 + m, (m – целое число) и образуют обширную группу изомеров и гомологов. Фуллерены хорошо подходят для целей разделения и концентрирования органических веществ, благодаря гидрофобной поверхности, высоким отношениям поверхности к объему, возможности функционализации для увеличения селективности взаимодействия с аналитами [9]. Установлено, что фуллерены сорбируют многие органические вещества (например, N-метилкарбаматы, фенолы, полициклические ароматические углеводороды, амины). Эти материалы использовали также для предварительного концентрирования N-нитрозаминов [10]. Фуллерены и УНТ обладают превосходной термической и химической стабильностью, что делает их привлекательными в качестве стационарной фазы для хроматографии. Однако оба этих углеродных материала обладают ограниченной диспергируемостью в водных и органических растворителях, что обусловливает затруднения при заполнении хроматографических колонок [8].
Наноалмазами называют углеродные наноструктуры с размером от 1 до 10 нм и с кристаллической решеткой алмаза. В зависимости от метода синтеза, способов очистки и обработки наноалмазы могут содержать различные функциональные группы на поверхности, что сильно влияет на их сорбционные и хроматографические свойства [11]. Наноалмазы, имеющие на поверхности функциональные группы, объединяются в агрегаты, которые характеризуются удельной площадью поверхности 250–350 м2/г, объемом пор – от 0.3 до 1 см3/г, размер частиц агрегатов составляет 50–100 нм [12]. Наноалмазы механически и термически стабильны и устойчивы в широком диапазоне pH. Эти свойства позволяют применять их в качестве стационарных фаз в ВЭЖХ и газовой хроматографии. Так, наноалмазы хорошо удерживают ароматические углеводороды и показали высокую селективность к геометрическим изомерам [13]. Однако отмечено, что и при заполнении, и при эксплуатации колонки с данным сорбентом происходит уплотнение частиц и возникает большое сопротивление потоку элюента, что ведет к существенному повышению давления в системе [14].
Графитированная термическая сажа (ГТС) представляет собой непористый, инертный и устойчивый к высокой температуре углеродный сорбент, который используют для концентрирования и разделения полярных органических веществ. Ее получают нагреванием обычной сажи до 3000°С в отсутствие кислорода и других окислителей. В процессе графитирования происходит рост кристаллов до размера ~500 нм, а также удаление летучих веществ. При этом доля водорода и кислорода, содержащихся на поверхности сажи, падает до 0.4%. Графитированную термическую сажу применяли для извлечения из водных растворов малополярных аналитов, таких как хлорорганические инсектициды [15], а также умеренно полярных, таких как триазины и феноксикислоты [16, 17]. Интерес к этому сорбенту возрос, когда была продемонстрирована его высокая способность удерживать полярные молекулы, в том числе с растворимостью в воде более 0.1 г/л [18]. Эти вещества трудно извлечь из водных растворов с использованием других обращенно-фазовых сорбентов.
Показано, что после окисления ГТС содержит на поверхности различные функциональные группы [17], которые обеспечивают ГТС в том числе ионообменные свойства. Например, этот сорбент применяли для извлечения аклилбензолсульфонатов [19], нафталинсульфонатов [20] и различных пестицидов кислотной природы [21] из водных растворов. Установлено, что поверхность ГТС содержит гидрохиноновые группы, способные вызывать необратимую хемосорбцию аналитов (так, наблюдали частичную необратимую сорбцию гербицидов метрибузина и хлоридазона [22]). Однако графитированные сажи не обладают достаточной механической прочностью, поэтому почти не используются для разделения веществ в жидкостной хроматографии.
Позднее был разработан сорбент с химическими свойствами, подобными свойствам ГТС – пористый графитированный углерод (ПГУ), который обладает большей механической прочностью по сравнению с ГТС. Этот сорбент применяли как для концентрирования, так и для разделения веществ методом ВЭЖХ, поскольку аналиты сорбируются обратимо. Эффективность извлечения (удерживания) веществ, особенно полярных, существенно выше, чем при использовании других обращенно-фазовых сорбентов. Сочетание высокой сорбционной способности и обратимости извлечения полярных аналитов из водных сред открывает перспективы использования этого материала в качестве сорбента. Этот аспект применения ПГУ подробно будет рассмотрен ниже.
ОСОБЕННОСТИ ПОРИСТОГО ГРАФИТИРОВАННОГО УГЛЕРОДА
Получение сорбента. Описаны многочисленные способы получения ПГУ и отмечено, что все они приводят к получению материалов с разными характеристиками [23]. Все способы включают четыре основные стадии: гомогенизацию, карбонизацию, удаление неорганических примесей и графитизацию.
Для получения углеродной фазы используют кремнезем (силикагель), пропитанный гомогенной смесью фенола и гексамина. Полученный продукт нагревают до 80–160°С для быстрой полимеризации [23]. Выбором кремнеземной матрицы (ее порами и морфологией) определяется размер и пористость получаемых частиц углерода. Затем полимер подвергают пиролизу в инертной атмосфере азота или аргона при 1000°С. Таким образом получается высокопористый аморфный углерод, который называют “сажей” (рис. 1a). Силикагелевую матрицу удаляют растворением в горячем водном растворе гидроксида калия. Данную стадию назвали гомогенизацией – она включает операции, обеспечивающие однородность структуры углеродного материала.
Рис. 1.
Электронные микрофотографии высокого разрешения аморфного углерода, полученного при 1000°С (a) и пористого графитированного углерода после графитизации при 2340°С (б) [24].
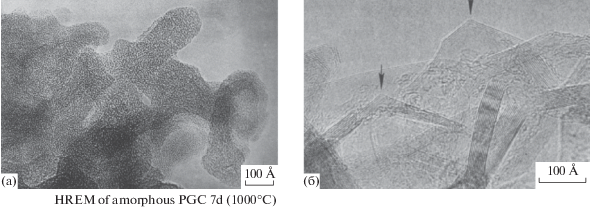
Полученный материал выдерживают при 1000°С и инертный газ заменяют на водород. Это приводит к реакции между водородом и свободными радикалами, которые могут присутствовать на углеродной поверхности при высоких температурах. В результате получается пористый графитированный углерод (рис. 1б). Данную стадию назвали карбонизацией – она включает ряд процессов, в том числе обугливание. Карбонизация также способствует образованию пор.
Таблица 1.
Коммерчески доступные пористые графитированные углеродные сорбенты
| Название | Производитель | Средний размер частиц, мкм | Средний диаметр пор, нм | Объем пор, м3/г | Пористость, % | Форма частиц | Содержание углерода, % | Площадь поверхности, м2/г | Применение |
|---|---|---|---|---|---|---|---|---|---|
| Hypercarb | Thermo Scientific* | 3, 5, 7** | 25 | 0.7 | 75 | Сфер. | 100 | 120 | ВЭЖХ |
| Hypercarb Hypersil | 30 | H/д | ТФЭ | ||||||
| ENVI-Carb | Sigma Aldrich | 37–125 | 30 | 0.8 | 70 | Сфер. | 100 | 100 | ТФЭ |
Полученный продукт характеризуется высокой сорбционной способностью, однако он может содержать неорганические примеси, такие как сера и кремнезем. Их удаляют нагревом при 1500–2000°С. Этот процесс сопровождается образованием большого количества дефектов, разупорядочением углеродных слоев и образованием микропор.
На заключительной стадии проводят графитизацию нагревом материала при 2000–3500°С в атмосфере аргона. Графитизация приводит к удалению дефектов и формированию трехмерной упорядоченной графитированной структуры [23], а также способствует запайке микропор.
В табл. 1 приведены сведения о коммерчески доступных пористых графитированных углеродных сорбентах. Сообщается также о пористых углеродных сорбентах Carbonex со средним размером частиц 7 мкм (производитель Tonen), BTR carbon со средним размером частиц 3.5 мкм (BioTech Research) и TSKgel Carbon (Nippon Carbon/Tosoh), однако в открытых литературных источниках нет более подробной информации о физических и химических параметрах данных сорбентов.
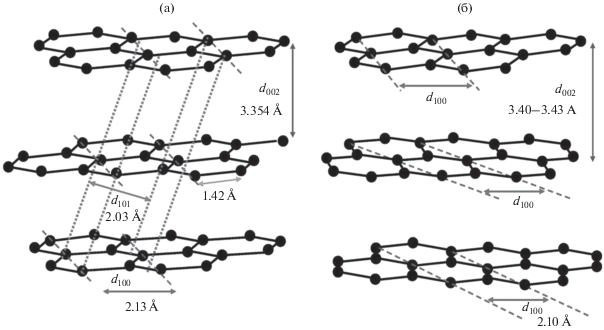
Структура пористого графитированного углерода. ПГУ представляет собой проводящий кристаллический материал из переплетенных графитовых лент (рис. 1б). Графитированные листы состоят из sp 2-гибридизованных атомов углерода, находящихся в гексагональном расположении. В листах атомы углерода связаны ковалентной связью. Листы удерживаются вместе с помощью Ван-дер-Ваальсовых взаимодействий. Такая структура придает ПГУ механическую стабильность [24]. Пористый графитированный углерод отличается от трехмерного графита (рис. 2а), поскольку его слои не ориентированы регулярно (рис. 2б). Таким образом, он является “двумерным” графитом.
Рис. 2.
Кристаллические структуры графита: (а) – трехмерный графит со структурой Берналя, (б) – двумерный графит со структурой Уоррена [24].
Пористый графитированный углерод хорошо извлекает полярные соединения из водных растворов. Существовало несколько версий, объясняющих это явление. Первая предполагала, что, несмотря на специфический способ получения материала, на поверхности графита остаются гетероатомные функциональные группы. Вторая версия заключалась в том, что растворенные вещества могут взаимодействовать как с поверхностью, так и со сторонами графитовых лент, где, возможно, остаются активные центры [25, 26]. Также предполагалось, что атомы углерода, расположенные по краям листов, взаимодействуют с кислородом (на воздухе или в растворе), образуя различные функциональные группы. Однако спектры рентгеновской фотоэлектронной спектроскопии показали, что в ПГУ очень низкое содержание поверхностного кислорода (0.14 ат. %). При этом кислород в основном распределен по фенольным, карбонильным, лактоновым и хиноидным группам [8]. Однако, по мнению большинства исследователей, термическая обработка обеспечивает высокую однородность поверхности, сводя к минимуму наличие кислородсодержащих дефектов [27].
Свойства пористого графитированного углерода. Механизмы сорбции. Дисперсионные взаимодействия. Обнаружено изменение коэффициентов удерживания в зависимости от состава подвижной фазы и увеличение удерживания соединений с удлинением содержащихся в них углеводородных цепей. Это свидетельствуют о поведении сорбента как обращенной фазы, аналогичной неполярным фазам [28]. Независимо от состава водно-органической фазы наблюдали более высокую селективность ПГУ (сорбенты Hypercarb (Shandon Scientific, Великобритания) и Carbonex (Tonen, Япония)) к метиленовой группе в алкильном радикале молекулы аналита, чем октадецилсиликагеля (ОДС) [29–31]. Сила дисперсионных взаимодействий связана с поляризуемостью растворенного вещества и поверхности неподвижной фазы, а также с расстоянием между ними. Сделано предположение, что плоская поверхность ПГУ благоприятствует контакту с ней растворенного аналита, а поляризуемость поверхности ПГУ дополнительно усиливает дисперсионные взаимодействия.
Размер, геометрия и поляризуемость молекул растворителя также влияет на удерживание веществ на ПГУ [32]. Так, селективность ПГУ к метиленовой группе в алкильном радикале молекулы аналита зависит от элюирующей силы классических растворителей: воды, метанола, ацетонитрила, этилацетата, тетрагидрофурана, метиленхлорида и хлороформа [32]. Изучение удерживания серии гомологов метиловых эфиров жирных кислот или бензойной и фенольной кислот показало, что Hypercarb (5 мкм) является сильноудерживающим сорбентом, элюирование с которого может быть затруднено при использовании водно-органических подвижных фаз.
Полярные взаимодействия. Цель синтеза ПГУ – получение сорбента, состоящего из чистого углерода, абсолютно неполярного и лишенного остаточных силанольных групп, содержащихся в фазах ОДС. Таким образом, можно было ожидать, что хроматографическое разделение веществ на ПГУ будет аналогично разделению на ОДС с высоким содержанием углерода. Однако свойства ПГУ сильно отличаются от свойств классических неполярных фаз.
Тот факт, что при сорбции веществ на ПГУ реализуется несколько типов взаимодействий, впервые отмечен в работе [33]. Авторы указывают, что для объяснения удерживания веществ на ПГУ следует учитывать не только размер молекул аналита, но и электронодонорные свойства растворителя [33]. Они связали удерживание с параметрами, характеризующими полярность фрагментов молекул аналита, и выдвинули гипотезу о том, что за удерживание ответственны локализованные полярные сегменты аналитов.
В работе [30] сравненили удерживание ряда веществ на фазах ПГУ (сорбенты Hyprcarb и Carbonex) и ОДС [30]. Установлено, что любой дополнительный заместитель в структуре аналита, полярный или неполярный, вызывает увеличение удерживания вещества на ПГУ, в отличие от ОДС. Отмечено, что удерживание увеличивает поляризуемость аналита и возможность реализации плоской конформации аналита.
Данные по удерживанию на сорбенте Hypercarb (7 мкм) фенольных соединений [34–37], производных анилина [38], барбитуратов [39, 40], стероидов [41], ингибиторов моноаминооксидазы [42] и хлорфеноксиуксусной кислоты [43] также указывают на то, что поверхность графита чувствительна к электронной плотности аналитов, к электронодонорному или электроноакцепторному характеру функциональных групп аналитов, к их числу, положению и стерическим ограничениям в молекуле. Для описания таких закономерностей удерживания даже введен специальный термин “polar retention effect on graphite” (эффект полярного удерживания на графите) [8].
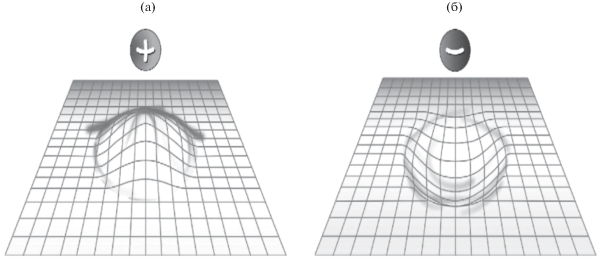
При объяснении механизма взаимодействия аналит–ПГУ обычно в первую очередь рассматривают делокализацию электронов на больших графитовых лентах, определяющую высокую поляризуемость поверхности [44–46]. Считают, что при приближении к поверхности ПГУ полярное вещество индуцирует поляризацию поверхности. Схематически это иллюстрирует рис. 3. Появление наведенного диполя на сорбенте зависит от поляризуемости поверхности, распределения заряда в аналите, расстояния между молекулой аналита и поверхностью. Сила взаимодействия также зависит от ориентации полярных функциональных групп аналита по отношению к поверхности графита.
Рис. 3.
Схематическое представление взаимодействия положительного (a) и отрицательного (б) зарядов на молекуле аналита с поверхностью графита [8].
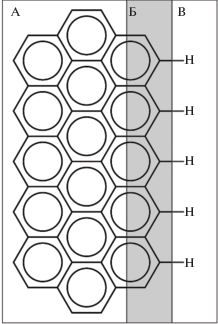
Существуют и другие гипотезы, объясняющие взаимодействие веществ с поверхностью ПГУ. Сделано предположение [47], что электронная плотность перераспределяется на графитовых лентах ПГУ таким же образом, как в молекулах многоядерных ароматических углеводородов (рис. 4). Центральная часть графитовых лент, по мнению авторов, является электронно-дефицитной и имеет небольшой положительный заряд, близкий к нейтральному, тогда как на краях плоскостей имеется избыток электронов и, соответственно, отрицательный заряд (рис. 4). Благодаря этому молекулы неполярных веществ взаимодействуют с более или менее нейтральным центром графитовых лент, в то время как полярные молекулы взаимодействуют с краями тех же лент [48].
Рис. 4.
Распределение электронной плотности на краю многоядерного ароматического углеводорода. Приведен фрагмент молекулы вблизи ее края. Зона В (периферийная) представляют собой область с избытком электронов и, соответственно, имеет отрицательный заряд; зона Б – нейтральная область; зона А является электронодефицитной и имеет небольшой положительный заряд, близкий к нейтральному (адаптировано из [47]).
Уникальные хроматографические качества ПГУ делают его подходящей фазой для разделения как полярных, так и неполярных веществ. При разделении полярных веществ ПГУ показал себя идеальной альтернативой классическим малополярным фазам, которые часто не способны хорошо удерживать полярные аналиты с низкой липофильностью [49, 50].
Установлено, что на сорбенте Hypercarb (размер частиц 5 и 7 мкм) также могут удерживаться ионы (анионы [51–54] и катионы [55, 56]). В некоторых работах, например [57], считают, что поверхность ПГУ (или ее часть) положительно заряжена, что обеспечивает ПГУ свойства слабого анионобменника, тогда как катионообменная способность ПГУ незначительна. Однако в другой работе [58], посвященной использованию сорбента Hypercarb (5 мкм) в электрохроматографии, показано, что поверхность ПГУ отрицательно заряжена, поскольку частицы ПГУ притягиваются к положительно заряженному электроду. На этом, в частности, основан способ определения фенилмочевины методом капиллярной электрохроматографии с помощью ПГУ [59].
При разделении неорганических катионов или аминокислот методом ВЭЖХ на сорбенте Hypercarb (5 мкм) [60] в некоторых случаях вводили ион-парные реагенты [55, 61–63], а при разделении/определении ряда неорганических и небольших органических анионов [64–69] добавляли конкурирующие агенты – соли, такие как хлорид натрия, дигидрофосфат калия и др.
Из-за планарного характера лент ПГУ геометрическая форма молекулы аналита, в частности, его способность принимать плоскую конформацию, может существенно влиять на удерживание. Изучение термодинамики сорбции [70] и применение расчетных методов [71] подтвердили это предположение. При этом влиянием возможной “кривизны” графитовых лент обычно пренебрегали, поскольку считали, что на молекулярном уровне эту кривизну можно не учитывать.
В том случае, если аналит содержит алкильные заместители, их расположение на поверхности ПГУ не всегда очевидно, особенно в случае коротких алкильных цепей. Будут ли они принимать “растянутую” конформацию и контактировать с максимально возможной площадью поверхности углерода или будут “свернуты”, что уменьшит возможную площадь контакта, неизвестно [72]. Как правило, при увеличении длины алкильного радикала увеличивается удерживание аналита на сорбенте. Этот эффект менее выражен в случае молекул аналитов с разветвленными заместителями [31]. Это свойство использовали для разделения изомеров нефлавоноидных полифенолов [73].
При сорбции плоских ароматических молекул естественно предположить, что они расположены параллельно поверхности, если это позволяет наличие и положение заместителей. Объемный заместитель (например, трет-бутильная группа), расположенный близко к ароматическому кольцу, будет нарушать тесный контакт между ароматическим кольцом аналита и поверхностью ПГУ [25]. Так, установлено, что порядок элюирования изомерных ксилолов с сорбента Hypercarb противоположен наблюдаемому в классической обращенно-фазовой ВЭЖХ, что можно объяснить только вариациями площади контакта между ароматическим кольцом и плоской поверхностью ПГУ: более низкое удерживание мета-ксилола связано с меньшим числом точек контакта между этим изомером и поверхностью (три точки контакта, в отличие от четырех для орто- и пара-изомеров) [25].
В молекулах бифенилов возможно вращение ароматических колец относительно друг друга. В этом случае возможна реализация конформаций, обеспечивающих тесный контакт с поверхностью ПГУ, особенно в том случае, когда энергия адсорбции больше энергии вращательной деформации [74]. Однако это взаимодействие резко ослабляется при наличии объемного заместителя в орто-положении. На этом основан способ разделения полихлорбифенилов на сорбенте Hypercarb (7 мкм) [74].
Удерживание полярных веществ на ПГУ связано с расположением полярной группы в молекуле и уменьшается при наличии стерических препятствий при контакте этой группы с поверхностью [27]. Так, при разделении соединений, относящихся к одному изомерному ряду, наблюдали, что снижение числа и объема заместителей вблизи полярной группы приводило к увеличению удерживания на сорбенте Hypercarb (7 мкм) [31, 67]. Таким образом, механизм удерживания веществ на ПГУ не может быть описан с помощью подхода Снайдера, разработанного для адсорбционной хроматографии с использованием нормальной фазы [43], поскольку этот подход предполагает удерживание полярных аналитов за счет вытеснения адсорбированных молекул элюента с поверхности сорбента полярной частью молекулы.
Устойчивость пористого графитированного углерода в экстремальных условиях. ПГУ более устойчив и химически стабилен по сравнению с сорбентами на основе диоксида кремния. Подтверждена его устойчивость в широком интервале кислотности (от 10 М растворов кислот до 10 М щелочных растворов) [75], хотя производители утверждают, что данный сорбент способен работать только в диапазоне pH от 1 до 14. Это свойство позволяет сорбировать и разделять вещества в нейтральной форме: основные – при высоких значениях рН [76] или кислые – при низких [75, 77].
Пористый графитированный углерод устойчив при высоких температурах, что обеспечивает его использование, например, в высокотемпературной жидкостной хроматографии (ВТ-ВЭЖХ), сорбции, хроматографии с применением субкритических жидкостей и сверхкритических флюидов. Исследования показали, что он является стабильным до 200–250°C [78–80]. При эксплуатации в этих условиях эффективность колонки со временем несколько снижалась, однако авторы работы [81] связали это с уплотнением сорбента Hypercarb (5 мкм) в колонке из-за различий в коэффициентах теплового расширения углеродного материала и материала корпуса колонки (нержавеющей стали) при многих циклах нагрев–охлаждение [82].
Окислительно-восстановительные свойства пористого графитированного углерода. На электронную структуру ПГУ могут влиять процессы окисления и восстановления. В исходном состоянии ПГУ обладает некоторой окислительной активностью, что согласуется с рассчитанным локальным электронным дефицитом [83]. Однако до конца неясно, являются ли некоторые наблюдаемые реакции окисления в присутствии ПГУ (например, окисление двухвалентного кобальта в трехвалентный) результатом только действия ПГУ, или же действием растворенного в подвижной фазе кислорода, тогда как ПГУ при этом выступает в роли катализатора [84]. По оценке [85] окислительно-восстановительный потенциал ПГУ (BTR carbon 3.5 мкм, Япония) варьируется в диапазоне приблизительно от –0.2 до 0.5 В, в то время как другое исследование показало, что потенциал суспензии частиц сорбента Hypercarb (5 мкм) составляет 0.35 В [83]. В обоих случаях использовали хлоридсеребряный электрод сравнения.
При обработке восстановителем (например, если восстанавливающий агент в виде сульфита натрия присутствует в подвижной фазе), ПГУ приобретает восстановительную активность [57, 84, 85]. После обработки ПГУ (сорбент BTR carbon 3.5 мкм, Япония) окислителем его исходные хроматографические свойства восстанавливаются. Это свойство ПГУ позволило разработать способ on-line дериватизации пирокатехина, тирозина, гидрохинона и резорцина. При хроматографическом разделении на колонку подают напряжение, что переводит соединения из молекулярной формы в ионизированное состояние. Этот прием позволяет увеличить времена удерживания некоторых аналитов и улучшить разделение [86, 87].
Следует отметить, что эффект окислительно-восстановительной обработки ПГУ не зависит от марки и производителя; аналогичную картину наблюдали для Hypercarb®, BRT Carbon® и TSK-gel Carbon 500®.
Электропроводящие свойства. Как и многие другие углеродные материалы, ПГУ обладает электропроводящими свойствами. Эти свойства ПГУ применяли в жидкостной хроматографии с электрическим модулированием (EMLC), где стационарную фазу используют не только для разделения веществ, но и в качестве рабочего электрода. Путем изменения приложенного потенциала к стационарной фазе можно регулировать потенциал ее поверхности и, следовательно, удерживание аналитов, причем не только ионов, но и нейтральных молекул. Такой способ применен для разделения неорганических анионов, ионов бензолсульфоната и стероидов на сорбенте Hypercarb (5 мкм) [88–90]. Также была продемонстрирована возможность разделения бензодиазепинов [91, 92].
Электропроводящие свойства могут быть и недостатком. Отмечено, что из-за проводящих свойств ПГУ при сочетании ВЭЖХ и масс-спектрометрии (МС) с электрораспылением необходимо заземление между хроматографической колонкой и входом в распылительную камеру. В противном случае возможно возникновение электрического потенциала на неподвижной фазе, что влияет на параметры разделения веществ [93]. Этот негативный эффект исчезает при наличии заземления.
Модифицирование поверхности пористого графитированного углерода. В ряде случаев с целью снижения удерживания некоторых аналитов или для повышения селективности их разделения или концентрирования проводят модификацию поверхности ПГУ, обычно нековалентную. Описана модификация поверхности ПГУ осаждением на его поверхности другой углеродной фазы – так называемого “стеклообразного углерода” [94]. Отмечено, что эта процедура снижает дисперсионные взаимодействия, но не влияет на разделение компонентов [95].
Ковалентная функционализация поверхности ПГУ долгое время считалась сложной задачей, поскольку традиционные приемы, используемые для модифицирования диоксида кремния, неприменимы для введения функциональных групп в состав углеродных материалов. При этом нековалентная иммобилизация реагентов возможна и достаточно широко применяется для получения новых сорбентов на основе ПГУ. Как и при нековалентной иммобилизации реагентов на других матрицах с целью получения хроматографических неподвижных фаз, необходимо, чтобы реагент-модификатор достаточно сильно удерживался на поверхности ПГУ в процессе эксплуатации, но при этом обеспечивались условия для периодической регенерации поверхности [96].
Установлено, что снизить способность ПГУ к удерживанию полярных веществ можно обработкой полиэтиленгликолем [97] или неионными поверхностно-активными веществами [98]. Обработкой поверхности ПГУ полимерами и ионными соединениями получали новые ионообменные стационарные фазы [99–101].
Наибольшее число работ по модификации ПГУ посвящено закреплению хиральных селекторов для разделения энантиомеров [98, 102–105]. Отмечено, что в качестве фрагмента молекулы хирального селектора, ответственного за взаимодействие с поверхностью углеродного материала, арильный фрагмент более эффективен, чем алкильный [102]. Неподвижные фазы, полученные таким путем, иногда более селективны, чем аналогичные фазы на основе кремнеземов, поскольку сам ПГУ может принимать участие в хиральном разделении. Для разделения веществ использовали как предварительно модифицированный Hypercarb (7 мкм) [102], так и исходный немодифицированный, вводя хиральный селектор в состав подвижной фазы [103]. В последнем случае хиральное распознавание может происходить как в подвижной, так и на неподвижной фазе после сорбции хирального селектора.
Описаны немногочисленные примеры ковалентной иммобилизации функциональных групп. Так, например, якорные группировки можно ввести на поверхность сорбента Hypercarb (7 мкм) путем электровосстановления или химического восстановления солей арендиазония [106, 107]. Этот способ часто используют для модификации поверхности угольных электродов [107], хотя он также применим для получения хроматографических стационарных фаз с ковалентно закрепленными группами. Такие фазы более устойчивы в агрессивных средах, чем аналогичные на основе кремнеземов.
Сравнение пористого графитированного углерода с другими сорбентами для разделения/концентрирования. Сорбционные свойства ПГУ существенно отличаются от свойств классических обращенно-фазовых сорбентов, особенно при концентрировании и разделении полярных веществ [37].
Сорбенты HILIC, полярные октадецилсиликагели. Поскольку ПГУ обладает способностью удерживать полярные соединения, его в первую очередь сравнивают с сорбентами, специально разработанными для решения аналогичных задач, например гидрофильными фазами HILIC [108], полярными сорбентами на основе ОДС [109] и стационарными фазами смешанного типа [110]. Показано, что некоторые аналиты, например нейротрансмиттеры, лучше удерживаются и делятся на сорбенте Hypercarb (5 мкм), чем на полярно-внедренных и содержащих полярные концевые группы ОДС [111]. Сравнение с HILIC не дало однозначного ответа: в некоторых работах предпочтение отдают HILIC (при определении тирозина, норадреналина, адреналина, серотонина, допамина) [112], в других показано, что полярные вещества лучше удерживаются на сорбенте Hypercarb (5 мкм) (при определении акриламида) [113]. Присутствие в пищевых продуктах акриламида широко обсуждалось в литературе [113]. В этом случае ПГУ, по-видимому, является единственным сорбентом, обеспечивающим достаточное удерживание этого полярного соединения для его количественного определения.
Помимо селективности разделения аналитов на ПГУ, важный вклад в общую эффективность анализа вносит сочетание разделения с последующим детектированием. Например, состав элюента может оказать сильное влияние на эффективность ионизации аналитов при использовании ВЭЖХ-МС с электрораспылением или с другими источниками ионизации при атмосферном давлении. Обычные подвижные фазы для обращенно-фазовой ВЭЖХ (смеси воды с ацетонитрилом или метанолом) подходят для масс-спектрометрического детектирования аналитов. В этом случае относительно большое (по сравнению с разделением на ОДС) содержание органического растворителя, необходимое для элюирования полярных соединений с колонки ПГУ, даже способствует увеличению чувствительности при использовании электрораспыления [114].
Другим преимуществом использования ПГУ для разделения в сочетании с МС-детектированием, является устойчивость при контакте с подвижными фазами, содержащими высокие концентрации муравьиной или трифторуксусной кислот [112].
Электронно-обогащенные стационарные фазы. Как уже упоминалось выше, ПГУ является материалом с делокализованными электронами, обеспечивающими электропроводящие свойства. Делокализованные электроны преимущественно находятся в приповерхностном слое, поэтому неподвижные фазы с такими характеристиками можно называть “электронно-обогащенными”. В этом плане интересно сравнить свойства ПГУ и сорбента, полученного термической обработкой глины [115]. Поверхность последнего состоит из слоя силоксановых и силанольных звеньев с адсорбированными катионами натрия и молекулами воды. Такая поверхность, как и поверхность ПГУ, обогащена электронами. Показано несомненное сходство этих двух сорбентов по отношению к сильно- и среднеполярным аналитам (фенолу, толуолу, пара-крезолу, нитробензолу и изомерам динитробензола, хлорбензолу и изомерам дихлорбензола); на термически обработанной глине так же, как и на ПГУ удерживание регулируется стерическими и электронными эффектами.
Диоксид циркония, покрытый углеродом. Производство ПГУ длительно и затратно, поэтому актуален интерес к аналогичным, но более дешевым материалам, таким как диоксид циркония, покрытый углеродом (carbon clad zirconia, CCZ). Его получают двумя способами: высокотемпературной графитизацией органических полимеров, покрывающих подложку из диоксида циркония [95], или химическим осаждением углерода из паровой фазы на диоксиде циркония. Последний метод более распространен и заключается в том, что летучие органические соединения пропускают над частицами диоксида циркония при высокой температуре (700°С) и при пониженном давлении [116]. Соединения разлагаются с образованием тонкого слоя атомов углерода на поверхности диоксида циркония. Установлено, что “химия” поверхностей CCZ и ПГУ сопоставима. Частицы CCZ также обладают высокими механической прочностью и химической стабильностью.
Показано, что, несмотря на различие в способах получения сорбентов, ПГУ и CCZ проявляют близкие хроматографические свойства [81, 95]. Это сходство может показаться удивительным, так как ПГУ характеризуется высокой степенью графитизации, в то время как на поверхности CCZ присутствует лишь монослой углерода, который, вероятно, не графитизирован, а может быть образован монокристаллическими структурами [117]. Установлено, что поверхность CCZ не является однородной, часть ее не покрыта углеродом. Доля поверхности с углеродным покрытием обычно составляет от 60 до 95% [118]. На остальной поверхности присутствуют остаточные группы диоксида циркония, проявляющие кислотные свойства (аналогично остаточным силанольным группам на поверхности модифицированных кремнеземов) [119]. Наличие таких участков, отсутствующих у ПГУ, может вызывать уширение хроматографических пиков и появление “хвостов”, а иногда и необратимую сорбцию аналитов. Этим объясняют различия, наблюдаемые при использовании соответствующих хроматографических колонок [120]. Кроме того, CCZ менее устойчив к высоким температурам, чем ПГУ [109, 117].
Ароматические стационарные фазы. Расстояние между соседними атомами углерода в одной и той же плоскости графита составляет 0.142 нм и примерно соответствует расстоянию между атомами углерода в полициклических ароматических углеводородах (ПАУ). В принципе, ПГУ можно рассматривать как ПАУ, состоящий из 105 атомов углерода [121]. В некоторых исследованиях наблюдали подобное поведение при разделении веществ на ПГУ и кремнеземах с закрепленными фенильными, нафтильными или пиренилными группами [30]. Таким образом, специфичные свойства ПГУ могут быть связаны и с его “псевдоароматическим” строением.
Углеродные наноматериалы. Как уже обсуждалось, углеродные наноматериалы (нанотрубки, наноалмазы, фуллерены) используют для разделения и концентрирования веществ. Отмечено, что разделение веществ на ПГУ и наноалмазах сильно различается, так как последние содержат в своем составе функциональные группы – карбоксильные, гидроксильные, эфирные, нитрогруппы [122–124].
Установлено сходство в поведении полярных веществ при сорбции на ПГУ и фуллеренах [8]. При увеличении полярности аналитов их удерживание увеличивалось. В отличие от поверхности ПГУ, поверхность других углеродных материалов характеризуется локальной изогнутостью, поэтому предположили, что последние будут проявлять большее, чем у ПГУ, сродство к непланарным конформациям молекул [8].
Для улучшения механических свойств УНТ включали в монолитную стационарную фазу органического полимера или наносили на внешнюю поверхность частиц диоксида кремния [8]. Характеристики удерживания полученной стационарной фазы близки к характеристикам ПГУ.
ПРИМЕНЕНИЕ ПОРИСТОГО ГРАФИТИРОВАННОГО УГЛЕРОДА В ХИМИЧЕСКОМ АНАЛИЗЕ
Сочетание хороших механических свойств и высокого сродства к полярным веществам обеспечивает ПГУ широкое применение в химическом анализе как для разделения, так и для концентрирования аналитов.
Разделение веществ с использованием пористого графитированного углерода. Обращенно-фазовые сорбенты обычно не обеспечивают достаточного удерживания полярных веществ. Чтобы повысить их удерживание, используют различные приемы: в подвижную фазу добавляют ион-парные реагенты, повышают гидрофильность неподвижной фазы выбором соответствующих сорбентов (например, HILIC) или вообще переходят от обращенно-фазовой к ионообменной хроматографии (для тех задач, где это возможно). Подвижные фазы, применяемые в ионообменной и ион-парной хроматографии, часто несовместимы с такими методами детектирования, как МС и ELSD (детектирование по светорассеянию). Пористый графитированный углерод в наибольшей степени подходит для решения таких задач. Использованию таких сорбентов в ВЭЖХ посвящено большое число оригинальных статей и обзоров, например [8, 125], особое внимание уделяли разделению/определению нуклеотидов и нуклеозидов, аминокислот и пептидов, углеводов, маркеров применения химического оружия и взрывчатых веществ, а также разделению изомеров, включая диастереомеры.
Разделение полярных ароматических соединений. Исследовано поведение шести групп ароматических кислот на сорбенте Hypercarb (7 мкм) [126]. Установлено, что порядок элюирования варьируется в зависимости от типа заместителей, однако не может быть предсказан на основании структур изомеров. Значения рН подвижной фазы изменяли от 2 до 9.4, и удерживание веществ коррелировало со степенью их диссоциации, причем хуже всего удерживались наиболее диссоциированные вещества. Отмечено, что важно учитывать ориентацию полярных молекул относительно плоской поверхности графита. Сравнительное исследование удерживания изомеров ароматических молекул на ПГУ и октадецилсиликагеле [127] показало, что ПГУ проявляет более высокую селективность по отношению к позиционным изомерам, чем ОДС, что можно объяснить большей дискриминирующей способностью, обусловленной плоской поверхностью ПГУ.
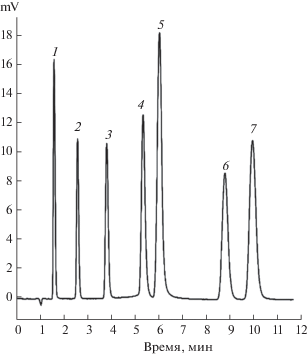
Hyprcarb (3 мкм) применяли для разделения изомеров метаболитов крезола в образцах мочи [128] (рис. 5).
Рис. 5.
Разделение метаболитов крезола на пористом графитированном углероде [128]. Условия разделения: колонка – Hypercarb 3 мкм, 100 × 4.6 мм; подвижная фаза — вода–метанол (1 : 1) + 0.1%-ная трифторуксусная кислота; скорость потока — 1 мл/мин; УФ-детектирование при 240 нм. Аналиты (кислоты): миндальная (1), 2-метилгиппуровая (2), гиппуровая (3), фенилгилоксиловая (4), 4-гидроксибензойная (5, внутренний стандарт), 3-метилгиппуровая (6), 4-метилгиппуровая кислота (7).
При разделении смеси п-нонилфенолов на сорбенте Hypercarb (7 мкм) зарегистрировано 12 пиков, каждый из которых соответствовал группе изомеров [129]. Известно, что п-нонилфенол, продукт деградации нонилфенолполиэтоксилатных поверхностно-активных веществ, образует множество структурных изомеров. Как правило, при разделении методом ВЭЖХ п-нонилфенолов на колонках с октадецилсиликагелем регистрируют один широкий пик, использование же ПГУ позволило разделить все вещества.
На сорбенте Hypercarb (5 мкм) разделяли позиционные изомеры монозамещенного сульфобутилового эфира β-циклодекстрина [130]. Эти изомеры не могут быть разделены на обычных обращенно-фазовых сорбентах, но хорошо делятся на ПГУ. Авторы работы [130] предположили, что эти гидрофильные и анионные соединения удерживаются по обращенно-фазовому механизму, а электронные взаимодействия играют второстепенную роль. Методика с использованием ПГУ обеспечила хорошее разделение при анализе неочищенной смеси монозамещенного сульфобутилового эфира β-циклодекстрина и позволила быстро определить количество каждого изомера. Возможность разделения смеси в изократических условиях (элюент – смесь водного раствора ацетата аммония с ацетонитрилом) допускает возможность простого масштабирования до полупрепаративного хроматографического разделения таких синтетических смесей.
Алкалоиды пиперидинового типа с антивирусной активностью – изомеры шуманифицина и N-метилсульмантинина – разделяли на колонке с сорбентом Hypercarb (7 мкм) [131]. На капиллярной колонке с сорбентом Hypercarb (5 мкм) методом ВЭЖХ-МС разделяли смеси алкалоидов тропана из коры растения Schizanthus grahamii (Solanaceae) [132]. Разработан быстрый и простой метод разделения четырех изомеров эфиров тропана (гидроксипропановых эфиров). При 60°С достигнута исключительная селективность разделения всех изученных алкалоидов.
Изомеры гормонов – эквилин-3-сульфат и D-8,9-дегидроэстон-3-сульфат, строение которых различается только положением олефиновой связи в стероидном кольце, как правило, не разделяются на колонках с октадецилсиликагелем или другими алкилированными силикагелями. Частичное разделение с разрешением 1.5 наблюдали только на дифенильной фазе, тогда как на колонке с сорбентом Hypercarb (5 мкм) достигнуто разделение с разрешением 19 [133]. Найдены также условия разделения более сложных смесей изомеров гормонов: эквилин-3-сульфата, D-8,9-дегидроэстон-3-сульфата, эстрон-3-сульфата, 17α-дигидроэквилин-3-сульфата.
С помощью сорбента Hypercarb (5 мкм) разделяли и другие изомеры – разветвленные олигосахариды, полученные ферментативной деградацией, лейцин, изолейцин, алло-изолейцин и гидроксипролин [125], цис-транс-изомерные родственные вещества ненуклеозидного ингибитора обратной транскриптазы для лечения ВИЧ-инфекций [134].
Многие фенольные соединения весьма гидрофильны и их разделение/определение с использованием традиционных обращенно-фазовых сорбентов затруднено. Пористый графитированный углерод больше подходит для решения таких задач. Предложено ВЭЖХ-МС-определение ванилина, протокатехиновой, кофеиновой, кумариновой, галловой и сиреневой кислот (сорбент Hypercarb (5 мкм)) [135]. Аналиты разделяли в условиях градиента концентрации тетрагидрофурана (ТГФ) в подвижной фазе, который редко используют в ВЭЖХ-МС. Найдено, что при химической ионизации при атмосферном давлении и режиме регистрации отрицательных ионов присутствие ТГФ не ухудшало сигналы аналитов. Отмечена высокая селективность предложенного способа.
Углеводы. Разделение смесей углеводов является сложной задачей из-за большого разнообразия структур и высокой растворимости веществ в воде, что затрудняет их удерживание на модифицированных кремнеземах и полимерных фазах. В отличие от последних, ПГУ широко использовали для анализа смесей олигосахаридов [95], циклодекстринов [136], алкилгликозидов [72], разветвленных олигосахаридов [137], фосфатов сахара [138], N-гликанов и O-гликанов [139], гликопротеинов и гликопептидов [140]. Предложен ВЭЖХ-МС/МС-метод определения ключевых гликолитических промежуточных продуктов, сахаров и фосфатов сахара из растений с использованием стационарной фазы ПГУ (сорбент Hypercarb 5 мкм) и подвижными фазами, совместимыми с МС (вода, ацетонитрил, 15%-ная муравьиная кислота) [79].
Разработан метод ВЭЖХ-МС одновременного определения акриламида, аспарагина, фруктозы, глюкозы и сахарозы в экстрактах хлеба с использованием способности ПГУ удерживать сильно полярные аналиты (сорбент Hypercarb 5 мкм) [113].
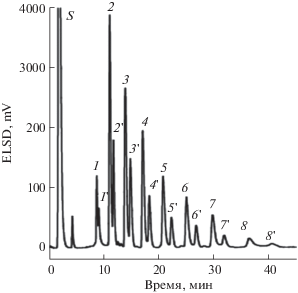
Установлено, что использование ПГУ для разделения каррагинанов – сульфатированных полисахаридов, извлекаемых из водорослей – имеет преимущества перед ионообменным хроматографическим разделением, поскольку одновременно реализуемые механизмы гидрофобного и электронного взаимодействия позволяют лучше регулировать разрешение между пиками, особенно при использовании водно-органического элюента [141] (рис. 6). Предложен ВЭЖХ-МС-метод разделения/определения ферментативно расщепленных олигосахаридов k-каррагинана [142]. Его особенность состоит в том, что подвижная фаза (раствор гидрокарбоната аммония в смеси вода–ацетонитрил), используемая для разделения, одновременно позволяет детектировать аналиты в виде депротонированных ионов (даже для олигосахаридов с более чем шестью сульфатными группами), что дает информацию о положении сульфатной группы в структуре олигосахарида. Отмечено, что это является существенным преимуществом по сравнению с разделением/определением аналитов с помощью ион-парной ВЭ-ЖХ-МС с электрораспылением.
Рис. 6.
Разделение олигомеров k-каррагинана на колонке с пористым графитированным углеродом [141]. Подвижная фаза: А – вода, Б – 700 мМ ацетат аммония в 15%-ном ацетонитриле; градиент: увеличение концентрации Б в элюенте от 0 до 70% за 45 мин. В работе [141] пики аналитов не идентифицировали, цифровые обозначения пиков указывают на предполагаемое авторами число мономерных звеньев в олигомере; штрихи обозначают аномеры основных аналитов.
Особенность ПГУ – его плоская на микроуровне поверхность – улучшает разделение близких по структуре соединений. При ВЭЖХ-разделении углеводов на удерживание влияет не только размер, но и “плоскостность” молекулы [125]. Отмечено, что большой интерес к использованию ПГУ в этой области основан на его долговременной стабильности, позволяющей долго использовать колонки с сорбентом без снижения воспроизводимости для эффективного разделения как нейтральных, так и анионных олигосахаридов. Особенная способность графита к разделению изомеров также является важным параметром, способствующим успешному использованию ПГУ.
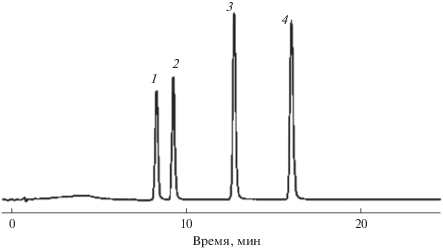
Нуклеотиды, нуклеозиды. Показано, колонки ПГУ эффективно разделяют смеси нормальных и модифицированных нуклеотидов, нуклеозидов, а также веществ, полученных в результате ферментативного гидролиза фотоокисленных олигонуклеотидов, определение которых важно при изучении окислительного повреждения ДНК [143]. Предложен метод одновременного определения гипоксантина, ксантина, гуанина и аденина в образцах тканей моллюсков (сорбент Hypercarb 7 мкм) [75]. Метод включает изократическое элюирование, характеризуется простотой и экспрессностью. Его предложено использовать в качестве альтернативы общепринятым методам контроля качества употребляемых в пищу морепродуктов. Отмечено, что условия разделения смесей нуклеозидов, их моно-, ди- и трифосфатов с использованием стационарной фазы ПГУ (сорбент Hypercarb 5 мкм) подходят для масс-спектрометрического детектирования [144]. Предложены различные водно-органические элюенты и модификаторы для градиентного разделения смеси 16 нуклеозидов и нуклеотидов. Показано, что на колонках с кремнеземными сорбентами эти смеси не разделяются. Рис. 7 иллюстрирует разделение некоторых циклических монофосфатных нуклеотидов.
Рис. 7.
Разделение циклических 3',5'-монофосфатов нуклеотидов [144]. Колонка — Hypercarb (3 мкм, 100 × 0.32 мм). Подвижная фаза: А – 20 мМ раствор ацетата аммония, pH 5.5; Б – ацетонитрил; градиент — от 10 до 30% фазы Б за 15 мин; скорость потока 6 мкл/мин; УФ-детектирование при 254 нм. Аналиты: 3',5'-циклический цитидин монофосфат (1); 3',5'-циклический уридин монофосфат (2); 3',5'-циклический гуанозин монофосфат (3); 3',5'-циклический аденозин монофосфат (4).
Разработан метод одновременного ВЭЖХ-определения урацила и дигидроурацила в плазме крови с использованием сорбента Hypercarb (5 мкм) [145]. Эти соединения плохо удерживаются на колонках с сорбентами на основе октадецилсиликагеля даже в водном элюенте, в то время как ПГУ обеспечил их хорошее удерживание и разделение. Этот метод в настоящее время используется в клинической практике. Предложен метод ВЭЖ-Х-МС/МС-определения 5-фторурацила (перорального лекарственного препарата Ftorafur, используемого при лечении рака желудка), 5-фторурацила и 5-фтор-5,6-дигидроурацила в плазме крови человека для фармакокинетических исследований (сорбент Hypercarb 5 мкм) [146].
Аминокислоты и пептиды. Предложен метод определения 20 аминокислот без применения высаливания с разделением на колонке с сорбентом Hypercarb (5 мкм) в виде ионных ассоциатов с неофторопентановой кислотой и детектированием по светорассеянию [147]. Эта система характеризуется меньшим временем уравновешивания колонки, чем при применении колонки с ОДС. Порядок элюирования аналитов при использовании ПГУ иной, чем в случае ОДС, что делает эти хроматографические системы взаимодополняющими при определении следовых количеств аминокислот. Сорбент Hypercarb (5 мкм) также применяли для разделения небольших пептидов (ди-, три-, тетрапептидов), аналиты детектировали по светорассеянию [148]. Предложен способ одновременного определения таурина, гипотаурина и тиотаурина в тканях морских беспозвоночных методом ВЭЖХ-МС/МС с электрораспылением (сорбент Hypercarb 5 мкм) [149]. Разделение аналитов на ПГУ возможно в изократических условиях (элюент – водный 10 мМ раствор ацетата аммония, рН 9.3). Время разделения этих метаболитов – менее 10 мин, дериватизация не требуется.
Изучено удерживание 14 пептидов на сорбенте Hypercarb (7 мкм) с использованием подвижной фазы ацетонитрил–вода [150]. Удерживание уменьшалось с увеличением концентрации ацетонитрила, достигало минимума и снова увеличивалось с увеличением концентрации ацетонитрила в области его высоких содержаний. Установлено, что пептиды удерживаются по смешанному механизму, имеют место гидрофобные и электронные взаимодействия, большую роль в удерживании играют структурные особенности аналитов.
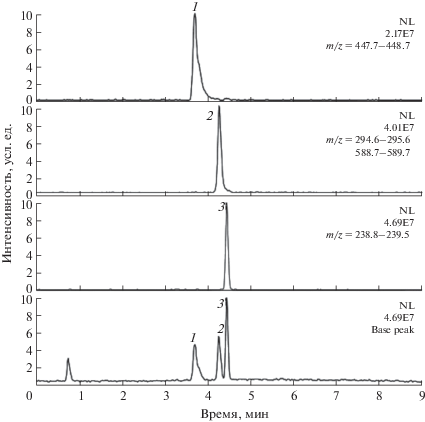
Моно-, ди-, три-, тетрапептиды и фосфопептиды слабо удерживаются на обычных обращенно-фазовых сорбентах, их разделение в этом случае проблематично. Сорбент Hypercarb (7 мкм) позволяет решить задачу определения этих аналитов [150] (рис. 8).
Рис. 8.
Разделение гидрофильных пептидов [150]. Колонка: Hypercarb (5 мм, 50 × 2.1 мм). Подвижная фаза: А – 0.1%-ная муравьиная кислота в воде, Б – 0.1%-ная муравьиная кислота в ацетонитриле; градиент: увеличение содержания фазы Б от 5 до 100% в течение 10 мин; скорость потока 0.2 мл/мин; температура колонки 30°С. Аналиты: Arg–Gly–Glu–Ser (1), Asp–Ser–Asp–Pro–Arg (2), Gly–Tyr (3).
Алкилфосфоновые и О-алкилалкилфосфоновые кислоты. Эти вещества являются маркерами применения боевых химических отравляющих веществ, таких как зарин, зоман, VX. Они весьма гидрофильны и слабо удерживаются на большинстве обращенно-фазовых сорбентов. Режим HILIC также не позволяет решить эту проблему. Обычно эти вещества определяют с применением дериватизации. Показано, что без дериватизации они хорошо удерживаются на ПГУ из водных растворов [151].
Так, для разделения изомеров изопропил-, н-пропил- и этилметилфосфоновых кислот на ПГУ Hypercarb предложен оригинальный ступенчатый градиентный режим элюирования, включающий промывку хроматографической колонки деионизованной водой перед инжектированием и дальнейшее разделение аналитов раствором муравьиной кислоты. Предложенный прием обеспечивает увеличение времен удерживания всех слабоудерживаемых аналитов, их разделение, а также позволяет улучшить симметрию пиков на хроматограммах [152–155]. С использованием предложенного приема разработаны способы экспрессного ВЭЖХ-МС-определения алкилфосфоновых, О-алкилметилфосфоновых кислот, а также глифосата, аминометилфосфоновой кислоты и глюфосината в водных растворах и природных водах. Показано, что разработанные способы позволяют определять аналиты на уровне 2–13 нг/мл при использовании трехквадрупольного масс-спектрометра.
Разделение веществ при экстремальных температурах. В отличие от большинства обращенно-фазовых сорбентов, ПГУ выдерживает воздействие высоких температур, что обеспечивает возможность его применения в высокотемпературной жидкостной хроматографии (ВТ-ВЭЖХ).
Хотя анализы методом ВЭЖХ обычно проводят при комнатной температуре или немного выше комнатной, отмечен ряд преимуществ, которые достигаются при более высоких температурах [156]. Среди них – уменьшение продолжительности анализа при сохранении скорости подачи подвижной фазы, снижение вязкости подвижной фазы, открывающее возможность использования более высоких скоростей потока с ограниченным противодавлением без снижения эффективности разделения, повышение симметрии пиков [157]. К сожалению, самые распространенные хроматографические колонки на основе диоксида кремния неустойчивы при температурах выше 60°С, поскольку гидролиз силоксановых связей усиливается при высоких температурах.
Сорбент Hypercarb (5 мкм) использовали для определения лекарственного препарата Циклоспорин в липосомах [158], при этом исследовали влияние температуры на разделение аналитов в диапазоне температур от –13 до +95°C. Увеличение температуры позволило улучшить симметрию пиков и разделение аналитов. ПГУ также использовали для разделения смесей стеринов во фруктовых соках при температурах от 25 до 150°C. Сравнивали результаты, полученные с помощью колонок с сорбентом Hypercarb (5 мкм), с ОДС и нанесенным на диоксид циркония углеродом. Отмечено, что при повышенной температуре колонка с ПГУ позволят достичь наибольших коэффициентов емкости. Повышение температуры также позволило значительно снизить продолжительность анализа и определять стерины во фруктовых соках менее чем за 1 мин [159]. Исследовали влияние температуры на разделение этоксилатов октилфенола на разных стационарных фазах, в том числе на Hypercarb (5 мкм), в диапазоне температур от 20 до 100°С [160]. Установлено, что механизм сорбции аналитов не зависит от температуры. При этом малоразмерные олигомеры элюируются раньше, чем крупные. Повышение температуры приводит также к снижению продолжительности анализа, порядок элюирования аналитов такой же, что и при использовании сорбентов на основе силикагеля, диоксида циркония и сшитого полистирол-дивинилбензола. Показано, что при использовании сорбента Hypercarb (5 мкм) симметрия пиков при разделении фармацевтических соединений (дифенгидрамина, хинина, кодеина, пропранолола, хлорпрокаина) улучшается при высоких температурах [161]. Отмечено также, что при высоких температурах увеличивается интенсивность сигналов веществ в масс-спектрах.
Hypercarb (5 мкм) использовали и для разделения липидов в условиях высокотемпературной ВЭЖХ [162]. Увеличение коэффициентов диффузии и снижение вязкости в этих условиях позволили сократить продолжительность анализа за счет увеличения скорости подачи подвижной фазы.
Среди методов ВТ-ВЭЖХ особое место занимает хроматография с использованием субкритической воды. Интерес к чистой воде в качестве подвижной фазы, помимо очевидного сокращения затрат, связан с ее экологической безопасностью, а также возможностью использования ее с универсальными детекторами, например пламенно-ионизационным [163]. “Перегретая” вода менее полярна, чем обычная, что увеличивает ее элюирующую силу в обращенно-фазовом варианте разделения веществ. Число работ, посвященных использованию ПГУ в сочетании с субкритическим водным элюентом, в последнее время увеличивается. Так, например, с помощью субкритической воды на сорбенте Hypercarb (5 мкм) разделяли триазиновые гербициды [82], компоненты фармацевтических препаратов (сорбент Hypercarb 7 мкм) [164].
Изомеры ароматических веществ разделяли на сорбенте Hypercarb (5 мкм) водным субкритическим элюентом [165]. Исследовали влияние модификаторов подвижной фазы (метанола, ацетонитрила, ТГФ, этанола, пропиловых спиртов, гексана), при этом наблюдали два типа поведения аналитов. Первый связан со стерическим распознаванием, второй – с обычным для ПГУ взаимодействием между полярными группами аналитов и неподвижной фазой. Разработанный способ применен для разделения и определения бензола, толуола, этилбензола, ксилолов и других ароматических веществ.
Недостатком методов ВТ-ВЭЖХ является то, что стабильность аналитов в достаточно агрессивных условиях (высокая температура, гидролитическое действие воды, возможность окисления растворенным кислородом) должна оцениваться не только до анализа [166], но и в процессе анализа, поскольку стационарные фазы могут действовать как катализаторы деградации [110]. К сожалению, стационарные фазы на основе углерода могут проявлять каталитические свойства в таких процессах.
Использование пористого графитированного углерода со сверхкритическими жидкостями и подвижными фазами повышенной текучести. Как и другие сорбенты, ПГУ применяли в сверхкритической флюидной хроматографии.
Исследовано разделение толуола, фенола, п/o-нитрофенола, 2,4-динитрофенола, нитротолуола, бензилового спирта, метилбензоата, диметилфталата, бифенила, дигептилового эфира, циклогексанона и некоторых других веществ в среде диоксида углерода без добавок на ПГУ (получен в университете Эдинбурга) в сверхкритических условиях. Наблюдали симметричные пики, однако отмечены и чрезмерно большие времена удерживания полярных аналитов [167].
Показано, что добавление модификатора (лимонной кислоты в ацетонитриле или метаноле) к диоксиду углерода снижает удерживание полярных аналитов (фенола, о/п-крезола, о-нитротолуола, 3,5-ксилола в метилене и фенилсульфоксида, фенилдисульфида, фенилсульфида, бензотиафена и др. в ацетоне) и улучшает форму хроматографических пиков при использовании сорбента Hypercarb [168, 169]. Сделано предположение, что молекулы большого объема с высокой поляризуемостью и плоской структурой удерживаются на ПГУ по тем же механизмам, что и в ВЭЖХ. В дальнейших исследованиях авторы расширили круг модификаторов (за счет уксусной кислоты, ацетона, хлороформа, 1,4-диоксана и др.), добавляемых в малых концентрациях (1 мас. %) в сверхкритический диоксид углерода [170]. Снижение удерживания аналитов объяснили конкуренцией с модификатором при адсорбции, так как взаимодействия между компонентами подвижной фазы в сверхкритической флюидной хроматографии считаются пренебрежимо малыми. По мнению авторов, использование модификаторов слабоосновного характера с большими молекулярным объемом и дипольным моментом увеличивает элюирующую силу диоксида углерода.
Полярный характер растворенного вещества, особенно кислотный, и наличие π-электронов, неподеленных пар электронов способствуют существенному увеличению удерживания полярных аналитов (бензилового спирта, изофталевой кислоты, анизола, бензальдегида, ацетофенона, нитробензола, хлорбензола, бромбензола, фенола, о-хлорфенола, о-аминофенола, изомеров диметилфенола, резорцинола, o/м/п-крезола, o/м/п-нитрофенола) на сорбенте Hypercarb (5 мкм) [171, 172]. Исследовали влияние содержания метанола в интервале от 5 до 40% на удерживание аналитов. При этом наблюдали сорбцию модификаторов на стационарной фазе и сольватацию аналитов в подвижной фазе.
Установлено, что в сверхкритической флюидной хроматографии ион-парные реагенты, так же как и в обычной ВЭЖХ, могут быть полезными при разделении соединений в ионной форме [173, 174], а изомеры можно разделить с очень хорошим разрешением [175], учитывая способность сверхкритического диоксида углерода обеспечивать высокую площадь контакта подвижной и стационарной фаз [165].
Применение пористого графитированного углерода в двумерной хроматографии. Существенные различия в удерживании веществ на ПГУ и других стационарных фазах эффективно использовали в двумерных ВЭЖХ-системах, чаще всего в сочетании с обращенно-фазовой или ионообменной хроматографией. Так, колонка с сорбентом Hypercarb (5 мкм) применена в паре с ионообменной колонкой для разделения нейротрансмиттеров [113], а также фосфоновых кислот – продуктов разложения химических отравляющих веществ. Hypercarb (5 мкм) использовали в качестве второй неподвижной фазы после колонки с ОДС, а также после катионообменной колонки для определения пищевых красителей [175]. В сочетании с октадецилсиликагелем Hypercarb (7 мкм) использовали для разделения/определения полихлорированных бифенилов [74], полифенолов [176].
Концентрирование гидрофильных веществ на пористом графитированном углероде. Требования к сорбентам для концентрирования веществ иные, чем требования к сорбентам для ВЭЖХ. Сорбенты для концентрирования могут не быть монодисперсными, размер частиц обычно составляет 30 мкм и более, что позволяет снизить противодавление, создаваемое колонкой с сорбентом, так как при концентрировании веществ в динамических условиях, как правило, применяют насосы низкого давления. Для решения таких задач предложены более дешевые, чем для ВЭЖХ, модификации ПГУ. Так, HyperSep Hypercarb – пористый графитированный углерод для “твердофазной экстракции” аналогичный неподвижной фазе Hypercarb для ВЭЖХ, характеризуется однородной упорядоченной структурой и удельной поверхностью около 120 м2/г. Как и Hypercarb, частицы поверхности состоят из графитовых листов, удерживаемых вместе слабыми Ван-дер-Ваальсовыми силами. Заявленные производителем отличия от “хроматографического” Hypercarb заключаются в размере и форме частиц. Он также характеризуется высокой сорбционной способностью по отношению к полярным аналитам, причем более высокой, чем у алкилсиликагелей и органополимерных сорбентов [177]. Во многих работах показано, что на этом сорбенте из водных растворов извлекаются как неполярные, так весьма полярные аналиты [177–179]. Наблюдали высокое сродство этого ПГУ по отношению к плоским молекулам, содержащим несколько полярных групп. При использовании колонки, заполненной 200 мг сорбента, степень извлечения аналитов из 250 мл раствора превышала 90%, кроме трех наиболее полярных, для извлечения которых из этого объема образца требовалось 500 мг сорбента [178]. Предложен сорбционно-ВЭЖХ-МС (с электрораспылением) метод определения малых количеств атразина и его шести основных продуктов разложения [179].
Приведены данные о сорбционном концентрировании некоторых пестицидов (оксанила, метомила, метамитрона, фенурона, метоксурона, симазина, метрибузина, атразина, 3,5-дихлорфенола, 2,4,5-трихлорфенола, пентахлорфенола, антрацена и др.) на сорбенте Hypercarb (7 мкм) [180]. Отмечено сильное удерживание ряда полярных аналитов даже в органических растворителях (ТГФ), что приводит к затруднениям при их десорбции. Десорбция в противотоке частично решает эту проблему.
Пестициды паракват, дикват и дифензокват концентрировали на ПГУ-сорбентах Hypersep Hypercarb и Supelclean Envi-Carb [181]. Показано, что дифензокват сорбируется лучше остальных аналитов на обоих сорбентах, причем на Envi-Carb лучше, чем на Hypercarb. Паракват и дикват лучше извлекается на Hypercarb, чем на Envi-Carb.
Колонку с Thermo Hypercarb (с размером частиц 5 мкм, 100 × 4.6 мм) применяли для концентрирования и разделения органических и неорганических соединений селена (селенита, селената, селенометионина, селеноцистина и селеноэтионина). Аналиты извлекали на колонке с указанным сорбентом, затем разделяли на стадии десорбции и детектировали селен методом МС с индуктивно связанной плазмой (ИСП) [182]. При десорбции раствором муравьиной кислоты наблюдали уширение пиков. Для решения этой проблемы в анализируемый раствор вводили трифторуксусную или гептафтормасляную кислоту; при этом увеличивался объем до проскока на стадии сорбции. Аналогичный прием применяли при концентрировании и разделении селеноцистамина, селеноэтионина, селенометионина и селеноцистина: в анализируемый раствор вводили трифторуксусную или азотную кислоту [183]. Селен определяли методом атомно-эмиссионной спектрометрии с ИСП.
Полярные фенольные соединения (фенол, ди- и тригидроксибензол, аминофенол и др.) также концентрировали на сорбенте Hypercarb (с размером частиц 7 мкм, 100 × 4.6 мм) из водных образцов [184]. Для выбора условий концентрирования сравнивали удерживание аналитов на ПГУ и на полимерном сорбенте PRP-1. Показано, что при хроматографическом разделении коэффициенты емкости аналитов в зависимости от состава подвижной фазы изменяются на этих сорбентах аналогичным образом, но сами соединения элюируются в обратном порядке. При изучении удерживания в воде коэффициент емкости самого полярного аналита (1,3,5-тригидроксибензола) при использовании Hypercarb составил порядка 1 × 103, однако этот аналит вообще не удерживался на октадецилсиликагеле и плохо удерживался на PRP-1 (k' = 3 в воде). Hypercarb также применяли для концентрирования пирокатехина, резорцина и флороглуцинола [184].
Проточное сорбционно-ВЭЖХ-определение веществ с использованием пористого графитированного углерода. Как правило, при использовании ПГУ для разделения аналитов методом ВЭЖХ целесообразно применять углеродный сорбент на стадии концентрирования. Этот сорбент может представлять собой как ПГУ, так и графитированную сажу. Например, гербициды дикват, паракват и дифензокват селективно определяли проточным сорбционно-ВЭЖХ-методом [185] в водных объектах с использованием графитированной сажи Carbograph для концентрирования и ПГУ для последующего разделения. Для концентрирования применяли колонки c графитированной сажей Carbograph и с ПГУ [186], а для разделения аналитов использовали Hypercarb [187]. Продемонстрировано использование ПГУ для извлечения олигосахаридов (или их производных) из растворов, содержащих один или несколько следующих загрязнителей: анионы (включая гидроксид, ацетат, фосфат), моносахариды, детергенты (додецилсульфат натрия и Triton X-100), белок (включая ферменты) и реагенты для высвобождения олигосахаридов из гликоконъюгатов (такие как гидразин и борогидрид натрия) [186]. В дальнейших исследованиях показано, что десорбция в противотоке улучшает удерживание аналитов [187].
Предложена проточная двухколоночная система для определения продуктов трансформации антрацена в грунтовых водах; обе колонки (для концентрирования и разделения) были наполнены сорбентом Hypercarb [184] (рис. 9). Установлено, что диизопропилатразан элюируется после диэтилатразина, и время удерживания велико (может составлять 40 мин), что позволяет отделить диизопропилатразан от сопутствующих компонентов. Объем до проскока также большой, что обеспечивает высокий коэффициент концентрирования и низкие пределы обнаружения (на уровне 100 нг/мл) [184].
Рис. 9.
Определение диэтилатразина (DEA) и диизопропилатразана (DIA) в грунтовых водах [185]. Аналиты концентрировали из 100 мл образца без добавки (а), с добавкой 0.5 мкг/л DEA и DIA (б). Колонка для концентрирования: Hypercarb (Shandon, 10 × 4.6 мм); хроматографическая колонка: Hypercarb (Shandon, 100 × 4.6 мм); скорость потока 1 мл/мин; УФ-детектирование при 220 нм. Подвижная фаза: А – 0.005 М фосфатный буферный раствор с pH 7, Б – ацетонитрил; градиент фазы Б от 15 до 35% за 40 мин.
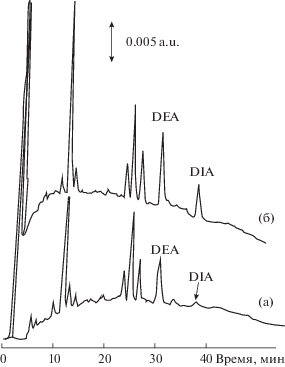
Гибридная проточная система предложена также для определения полярных пестицидов — диизопропилатразана, диэтилатразина и их метаболитов [18] с использованием колонки с Hypercarb (с размером частиц 5 мкм, 100 × 4.6 мм). Авторы разработали on-line процедуру концентрирования и ВЭЖХ-определения с использованием колонки для концентрирования и хроматографической колонки, заполненных ПГУ, специально для определения гидрофильных полярных пестицидов. Разработанный способ применен для анализа грунтовых вод, продемонстрирована возможность обнаружения следовых количеств пестицидов.
Хлортиазины (атразин, симазин, пропазин, аметрин и тербутрин) разделяли на сорбенте Hypercarb (с размером частиц 5 мкм, 100 × 2.1 мм), в том числе при повышенных температурах [82]. Несмотря на то, что хлортиазины в условиях субкритической воды частично разлагаются, проточное сорбционно-ВЭЖХ-определение характеризуется экспрессностью и высокой чувствительностью. Весь концентрат направляли в хроматографическую колонку.
Разработаны способы определения фенола, 4-нитрофенола, 2-хлорфенола, 2,4-динитрофенола, 2-нитрофенола, 2,4-диметилфенола, 4-хлор-3-метилфенола, 2,4-дихлорфенола, 2-метил-4,6-динитрофенола, а также фталевой кислоты, монометилфталата, моноэтилфталата и монобутилфталата в потоке, включающие сорбцию аналитов на колонке Hypersep Hypercarb, их десорбцию субкритической водой, вырезание зоны концентрата в дозирующую петлю, фокусирование и ВЭЖХ-разделение/определение [188–190]. Показана возможность определения аналитов в морской воде.
Этил-, изопропил- и пинаколилметилфосфоновые кислоты определяли в водопроводной воде с помощью времяпролетного масс-спектрометра после концентрирования и ВЭЖХ-разделения в on-line режиме [191]. Аналиты концентрировали из растворов на колонке для концентрирования (Hypercarb c размером частиц 5 мкм, 2.1 × 10 мм), а разделяли на колонке HILIC (ZIC-HILIC, 1 ×150 мм, 3.5 мкм). В выбранных условиях этилметилфосфоновая кислота количественно не извлекалась (степень извлечения составила 80–91%), но это не мешало достигать низких пределов обнаружения (4–7 нг/мл). Установлено, что для надежного определения аналитов необходимо предварительно удалять из образца основные неорганические анионы.
Для определения полярных хлорзамещенных анилинов, циануровой кислоты и аминофенола в природных водах применяли двухколоночную систему, обе колонки были наполнены сорбентом Hypercarb. Использовали хроматографическую колонку с размером частиц 5 мкм, 100 × 4.6 мм. При on-line процедуре колонку для концентрирования наполняли сорбентом Hypercarb PGC с размером частиц 10–15 мкм, а при off-line процедуре – тем же сорбентом с размером частиц 40–60 мкм [192]. В связи с сильным удерживанием аналитов на первой колонке и вызванной этим необходимостью использовать для десорбции сильные элюенты, отмечена невозможность последующего эффективного разделения этими элюентами веществ на колонке для разделения с ОДС. В связи с этим для разделения веществ также выбрана колонка с ПГУ. Предложенная система рекомендована для мониторинга природных вод.
ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ ПГУ
Использование в микросистемах. Общей тенденцией в развитии многих методов химического анализа и способов пробоподготовки является их миниатюризация. Одно из направлений – разработка микрофлюидных систем, в том числе хроматографических микрочипов, необходимых для анализа малых объемов уникальных образцов, таких какиологические жидкости.
Фирмы Agilent (США) и SGE (Австралия) разработали ВЭЖХ-микрочипы, включающие разделительную колонку с сорбентом Hypercarb, предназначенные для определения олигосахаридов и пептидов, продемонстрировано их успешное применение для анализа образцов гликопротеина, молока человека или ткани яичников [8]. Отмечено, что такие микросистемы иногда позволяют обнаружить вещества, не детектируемые с использованием обычных колонок для ВЭЖХ за счет сужения пиков аналитов. Следует отметить, что воспроизводимость характеристик систем разделения при переходе от чипа к чипу недостаточна [8]. Вероятно, это связано с трудностью достижения равномерной упаковки сорбента в небольших каналах микрочипов (иногда менее 100 мкм). Возможным способом решения этой проблемы является синтез стационарной фазы in situ – непосредственно в канале микрочипа [193].
Препаративные системы. В качестве неподвижной фазы для препаративной хроматографии ПГУ используют редко. Это объясняется высокой стоимостью углеродного материала. Однако ПГУ может обеспечить выделение веществ с высокой стоимостью и, возможно, с высокими коэффициентами разделения, которые недостижимы на других стационарных фазах [194]. Разработка более простых и дешевых способов получения ПГУ может обеспечить возможность создания новых препаративных приемов.
Уменьшение размера частиц. В настоящее время наименьший размер частиц коммерчески доступных образцов ПГУ составляет 3 мкм. Разработка технологий получения 2-микронных и более мелких частиц даст возможность применения ПГУ в быстро развивающемся направлении ВЭЖХ – ультраВЭЖХ. Этот углеродный сорбент обладает высокой механической прочностью и может быть использован для разделения полярных веществ при высоких давлениях [125].
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 18-03-00289).
Список литературы
Davini P. Absorprion and desorption of SO2 on active carbon: The effect of surface basic groups // Carbon. 1990. V. 28. № 4. P. 565.
Ahmedna M. Granular activated carbon from agricultural by- products: Carbon properties and their relationship to sugar decolorization potential. P.H.D. (9922045) / Ahmedna Mohamed, Louisiana State University. Louisiana, 1998. 115 p.
Bursic V., Yukovic G., Zeremski T., Marinkovic D., Gvozdenac S., Popovic A., Petrovic A. Advantages and disadvantages of active carbon in QuEChERS sample preparation method for pesticide residues // Biotechnology. 2016. V. 20. P. 191.
Valcarcel M., Cardenas S., Simonet B.M., Moliner-Mart́ınez Y., Lucena R. Carbon nanostructures as sorbent materials in analytical processes // Trends Anal. Chem. 2008. V. 27. № 1. P. 34.
Pérez-López B., Merkoçi A. Carbon nanotubes and graphene in analytical sciences // Microchim. Acta. 2012. V. 179. P. 1.
Stoller M.D., Park S., Zhu Ya., An J., Ruoff R.S. Graphene-based ultracapacitors // Nano Lett. 2008. V. 8. № 10. P. 3498.
Płotka-Wasylka J., Szczepanska N., de la Guardia M., Namiesnik J. Modern trends in solid phase extraction: New sorbent media // Trends Anal. Chem. 2016. V. 77. P. 23.
West C., Elfakir C., Lafosse M. Porous graphitic carbon: A versatile stationary phase for liquid chromatography // J. Chromatogr. A. 2010. V. 1217. P. 3201.
Постнов В.Н., Родинков О.В., Москвин Л.Н., Новиков А.Г., Бугайченко А.С., Крохина О.А. От углеродных наноструктур к высокоэффективным сорбентам для хроматографического разделения и концентрирования // Успехи химии. 2016. Т. 85. № 2. С. 115.
Jurado-Sánchez B., Ballesteros E., Gallego M. Fullerenes for aromatic and non-aromatic N-nitrosamines discrimination // J. Chromatogr. A. 2009. V. 1216. P. 1200.
Spitsyn B.V., Denisov S.A., Skorik N.A., Chopurova A.G., Parkaeva S.A., Belyakova L.D., Larionov O.G. The physical–chemical study of detonation nanodiamond application in adsorption and chromatography // Diam. Relat. Mater. 2010. V. 19. P. 123.
Долматов В.Ю. Детонационные наноалмазы: синтез, строение, свойства и применение // Успехи химии. 2007. Т. 76. № 4. С. 375.
Nesterenko P.N., Fedyanina O.N. Properties of microdispersed sintered nanodiamonds as a stationary phase for normal-phase high performance liquid chromatography // J. Chromatogr. A. 2010. V. 1217. P. 498.
Hung C.H., Wiest L.A., Singh B., Diwan A., Valentim M.J.C., Christensen J.M., Davis R.C., Miles A.J., Jensen D.S., Vail M.A., Dadson A.E., Linford M.R. Improved efficiency of reversed-phase carbon/nanodiamond/polymer core–shell particles for HPLC using carbonized poly(divinylbenzene) microspheres as the core materials // J. Sep. Sci. 2013. V. 36. P. 3821.
Mangani F., Crescentini G., Bruner F. Sample enrichment for determination of chlorinated pesticides in water and soil by chromatographic extraction // Anal. Chem. 1981. V. 53. P. 1627.
Battista M., Di Corcia A., Marchetti M. Extraction and isolation of triazine herbicides from water and vegetables by a double trap tandem system // Anal. Chem. 1989. V. 61. P. 935.
Di Corcia A., Marcomini A., Samperi R., Stelluto S. Graphitized carbon black extraction cartridges for monitoring polar pesticides in water // Anal. Chem. 1993. V. 65. P. 907.
Hennion M.C. Solid-phase extraction: method development, sorbents, and coupling with liquid chromatography // J. Chromatogr. A. 1999. V. 856. P. 3.
Di Corcia A., Marchetti M., Samperi R. Liquid chromatographic determination of linear alkylbenzenesulfonates in aqueous environmental samples // Anal. Chem. 1991. V. 63. P. 1179.
Altenbach B., Giger W. Determination of benzene- and naphthalenesulfonates in wastewater by solid-phase extraction with graphitized carbon black and ion-pair liquid chromatography with UV detection // Anal. Chem. 1995. V. 67. P. 2325.
Di Corcia A., Marchese S., Samperi R. Evaluation of graphitized carbon black as a selective adsorbent for extracting acidic organic compounds from water // J. Chromatogr. A. 1993. V. 642. P. 163.
Di Corcia A., Marchetti M. Multiresidue method for pesticides in drinking water using a graphitized carbon black cartridge extraction and liquid chromatographic analysis // Anal. Chem. 1991. V. 63. P. 580.
Knox J.H., Unger K.K., Mueller H. Prospects for carbon as packing material in high-performance liquid chromatography // J. Liq. Chromatogr. 1983. V. 6. P. 1.
Knox J.H., Kaur B., Millward G.R. Structure and performance of porous graphitic carbon in liquid chromatography // J. Chromatogr. A. 1986. V. 352. P. 3.
Burg P., Abraham M.H., Cagniant D. Methods of determining polar and non-polar sites on carbonaceous adsorbents. The contribution of the linear solvation energy relationship approach // Carbon. 2003. V. 41. P. 867.
Laine N.R., Vastola F.J., Walker Jr.P.L. The importance of active surface area in the carbon-oxygen reaction // J. Phys. Chem. 1963. V. 67. P. 2030.
Lepont C., Gunatillaka A. D., Poole F. Retention characteristics of porous graphitic carbon in reversed-phase liquid chromatography with methanol–water mobile phases // Analyst. V. 126. 2001. P. 1318.
Coquart V., Hennion M.-C. Trace-level determination of polar phenolic compounds in aqueous samples by high-performance liquid chromatography and on-line preconcдentration on porous graphitic carbon // J. Chromatogr. A. 1992. V. 600. № 2. P. 195.
Möckel H.J., Braedikow A., Melzer H., Aced G. A comparison of the retention of homologous series and other test solutes on an ods column and a Hypercarb carbon column // J. Liq. Chromatogr. 1991. V. 14. № 13. P. 2477.
Tanaka N., Tanigawa T., Kimata K., Hosoya K., Arai T. Selectivity of carbon packing materials in comparison with octadecylsilyl- and pyrenylethylsilylsilica gels in reversed- phase liquid chromatography // J. Chromatogr. A. 1991. V. 549. P. 29.
Kriz J., Adamcova E., Knox J.H., Hora J. Characterization of adsorbents by high-performance liquid chromatography using aromatic hydrocarbons Porous graphite and its comparison with silica gel, alumina, octadecylsilica and phenylsilica // J. Chromatogr. A. 1994. V. 663. № 2. P. 151.
Gaudin K., Chaminade P., Baillet A. Eluotropic strength in non-aqueous liquid chromatography with porous graphitic carbon // J. Chromatogr. A. 2002. V. 973. № 1-2. P. 61.
Kaliszan R., Osmiaewski K., Bassler B.J., Hartwick R.A. Mechanism of retention in high-performance liquid chromatography on porous graphitic carbon as revealed by principal component analysis of structural descriptors of solutes // J. Chromatogr. A. 1990. V. 499. P. 333.
Forgacs E., Valko K., Cserhati T. Influence of physicochemical parameters of some ring-substituted phenol derivatives on their retention on a porous graphitized carbon column // J. Liq. Chromatogr. 1991. V. 14. № 19. P. 3457.
Forgacs E., Cserhati T., Valko K. Retention behaviour of some ring-substituted phenol derivatives on a porous graphitized carbon column // J. Chromatogr. A. 1992. V. 592. № 1–2. P. 75.
Forgacs E., Cserhati T., Bordas B. Comparison of the retention behaviour of phenol derivatives on porous graphitized and octadecylsilica columns // Chromatographia. 1993. V. 36. № 1. P. 19.
Kanya Z., Cserhati T., Forgacs E. Using principal component analysis for the study of the retention behaviour of phenol derivatives under reversed-phase conditions // Chromatographia. 2003. V. 57. № 7–8. P. 451.
Forgacs E., Cserhati T. Retention of some ring-substituted aniline derivatives by porous graphitized carbon. Dependence on physico-chemical parameters // Chromatographia. 1992. V. 33. № 7–8. P. 356.
Forgacs E., Cserhati T. Dependence of the retention of some barbituric acid derivatives on a porous graphitized carbon column on their physicochemical parameters // J. Pharm. Biomed. Anal. 1992. V. 10. № 10–12. P. 861.
Forgacs E., Cserhati T. Use of cluster and principal component analysis in quantitative structure-retention relationship study // Anal. Chim. Acta. 1997. V. 348. № 1–3. P. 481.
Forgacs E., Cserhati T. Separation of steroidal drugs on porous graphitized carbon column // J. Pharm. Biomed. Anal. 1998. V. 18. № 1–2. P. 15.
Forgacs E., Cserhati T. Effect of physiochemical parameters on the retention of some monoamine oxidase inhibitory drugs on a porous graphitized carbon column // J. Chromatogr. B: Biomed. Sci. App. 1996. V. 681. № 1. P. 197.
Cserhati T., Forgacs E. Separation of some chlorophenoxyacetic acid congeners on a porous graphitized carbon column // J. Chromatogr. A. 1993. V. 643. № 1–2. P. 331.
Bassler B.J., Kaliszan R., Hartwick R.A. Retention mechanisms on metallic stationary phases // J. Chromatogr. A. 1989. V. 461. P. 139.
Polyakova Yu., Row K.H. HPLC of some polar compounds on a porous graphitized carbon HypercarbTM column // J. Liq. Chromatogr. Relat. Technol. 2005. V. 28. № 20. P. 3157.
Polyakova Yu., Row K.H. Retention of some five-membered heterocyclic compounds on a porous graphitized carbon, Hypercarb // Chromatographia. 2007. V. 65. № 1–2. P. 59.
Hanai T. Separation of polar compounds using carbon columns // J. Chromatogr. A. 2003. V. 989. № 2. P. 183.
Hanai T. Analysis of the mechanism of retention on graphitic carbon by a computational chemical method // J. Chromatogr. A. 2004. V. 1030. № 1–2. P. 13.
Elfakir C., Lafosse M. Porous graphitized carbon and octadecyl-silica columns in the separation of some alkylglycoside detergents // J. Chromatogr. A. 1997. V. 782. № 2. P. 191.
Chaimbault P., Elfakir C., Lafosse M. Comparison of the retention behavior of polyethoxylated alcohols on porous graphitic carbon and polar as well as apolar bonded-silica phases // J. Chromatogr. A. 1998. V. 797. № 1–2. P. 83.
Cantu R., Evans O., Magnuson M.L. Rapid analysis of cyanuric acid in swimming pool waters by high performance liquid chromatography using porous graphitic carbon // Chromatographia. 2001. V. 53. № 7–8. P. 454.
Mazan S., Cretier G., Gilon N., Mermet J.-M., Rocca J.-L. Porous graphitic carbon as stationary phase for LC–ICPMS separation of arsenic compounds in water // Anal. Chem. 2002. V. 74. № 6. P. 1281.
Mazan S., Gilon N., Cretier G., Rocca J.L., Mermet J.M. Inorganic selenium speciation using HPLC-ICP-hexapole collision / reaction cell-MS // J. Anal. Atom. Spectrom. 2002. V. 17. P. 366.
Ponton L.M., Porter M.D. Electrochemically modulated liquid chromatographic separations of inorganic anions // J. Chromatogr. A. 2004. V. 1059. P. 103.
Merlya C., Lyncha B., Ross P., Glennon J.D. Selective ion chromatography of metals on porous graphitic carbon // J. Chromatogr. A. 1998. V. 804. № 1–2. P. 187.
Chin E.T., Papac D.I. The use of a porous graphitic carbon column for desalting hydrophilic peptides prior to matrix-assisted laser desorption/ionization time-of-flight mass spectrometry // Anal. Biochem. 1999. V. 273. № 2. P. 179.
Shibukawa M., Terashima H., Nakajima H., Saitoh K. Evaluation of the surface charge properties of porous graphitic carbon stationary phases treated with redox agents // Analyst. 2004. V. 129. № 7. P. 623.
Rifafi R.A., Demesmay C., Rocca J.L. Ability of porous graphitic carbon to support electroosmotic flow in capillary electrochromatography // J. Chromatogr. A. 2002. V. 973. № 1–2. P. 177.
Rifaï R.A., Demesmay C., Rocca J.L. Separation of phenylureas by capillary electrochromatography on porous graphitic carbon // Chromatographia. 2003. V. 57. № 3–4. P. 197.
O'Connell M. P., Treacy J., Merly C., Smith C.M.M., Glennon J.D. Selective preconcentration and ion chromatography of trace lead(II) in environmental samples using a porous graphitic carbon column // Anal. Lett. 1999. V. 32. P. 185.
Emery M.F., Lim C.K. Separation of cationic technetium-99m amine complexes on porous graphitic carbon // J. Chromatogr. A. 1989. V. 479. P. 212.
Okamoto T., Isozaki A., Nagashima H. Studies on elution conditions for the determination of anions by supressed ion-interaction chromatography using a graphitized carbon column // J. Chromatogr. A. 1998. V. 800. № 2. P. 239.
Desportes C., Charpentier M., Duteurtre B., Maujean A., Duchiron F. Liquid chromatographic fractionation of small peptides from wine // J. Chromatogr. A. 2000. V. 893. № 2. P. 281.
Gu G., Lim C.K. Separation of anionic and cationic compounds of biomedical interest by high-performance liquid chromatography on porous graphitic carbon // J. Chromatogr. A. 1990. V. 515. P. 183.
Elfakir C., Dreux M. Simultaneous analysis of intact and desulfated glucosinolates with a porous graphitized carbon column // J. Chromatogr. A. 1996. V. 727. № 1. P. 71.
Elfakir C., Chaimbault P., Dreux M. Determination of inorganic anions on porous graphitic carbon using evaporative light scattering detection: Use of carboxylic acids as electronic competitors // J. Chromatogr. A. 1998. V. 829. № 1–2. P. 193.
Takeuchi T., Kojima T., Miwa T. Ion chromatography of inorganic anions on graphitic carbon as the stationary phase // J. High Resolut. Chromatogr. 2000. V. 23. P. 590.
Lindemann T., Hintelmann H. Identification of selenium-containing glutathione S-conjugates in a yeast extract by two-dimensional liquid chromatography with inductively coupled plasma MS and nanoelectrospray MS/MS detection // Anal. Chem. 2002. V. 74. № 18. P. 4602.
Tak V., Pardasani D., Kanaujia P.K., Dubey D.K. Liquid–liquid–liquid microextraction of degradation products of nerve agents followed by liquid chromatography–tandem mass spectrometry // J. Chromatogr. A. 2009. V. 1216. № 20. P. 4319.
Zhang Y., McGuffin V.L. Thermodynamic and kinetic characterization of porous graphitic carbon in reversed-phase liquid chromatography // Liq. Chromatogr. Relat. Technol. 2007. V. 30. № 11. P. 1551.
Hanai T. Chromatography in silico, basic concept in reversed-phase liquid chromatography // Anal. Bioanal. Chem. 2005. V. 382. № 3. P. 708.
Jackson P.T., Schure M.R., Weber T.P., Carr P.W. Intermolecular interactions involved in solute retention on carbon media in reversed-phase high-performance liquid chromatography // Anal. Chem. 1997. V. 69. № 3. P. 416.
Casado F.J., Montaño F., Carle R. Contribution of peptides and polyphenols from olive water to acrylamide formation in sterilized table olives // LWT – Food Sci. Technol. 2014. V. 59. P. 376.
Sawatsubashi T., Tsukahara C., Baba K., Ohi E., Shinoda A., Miura N. Development of new-type rapid analysis technology of polychlorinated biphenyls by using liquid chromatographic clean-up material (polyvinyl alcohol gel) // J. Chromatogr. A. 2008. V. 1177. P. 138.
Monser L. Liquid chromatographic determination of four purine bases using porous graphitic carbon column // Chromatographia. 2004. V. 59. P. 455.
Barrett D.A., Pawula M., Knaggs R.D., Shaw P.N. Retention behavior of morphine and its metabolites on a porous graphitic carbon column // Chromatographia. 1998. V. 47. P. 667.
Monser L., Dargouth F. Rapid liquid chromatographic method for simultaneous determination of tetracyclines antibiotics and 6-Epi-doxycycline in pharmaceutical products using porous graphitic carbon column // J. Pharm. Biomed. Anal. 2000. V. 23. № 2–3. P. 353.
Teutenberg T., Tuerk J., Holzhauser M., Kiffmeyer T.K. Evaluation of column bleed by using an ultraviolet and a charged aerosol detector coupled to a high-temperature liquid chromatographic system // J. Chromatogr. 2006. A. V. 1119. № 1–2. P. 197.
Marin S.J., Jones B.A., Dale Felix W., Clark J. Effect of high-temperature on high-performance liquid chromatography column stability and performance under temperature-programmed conditions. // J. Chromatogr. A. 2004. V. 1030. № 1–2. P. 255.
Yamaki S., Isobe T., Okuyama T., Shinoda T. Reversed-phase liquid chromatography on a microspherical carbon column at high temperature // J. Chromatogr. A. 1996. V. 728. № 1–2. P. 189.
Teutenberg T., Tuerk J., Holzhauser M., Giegold S. Temperature stability of reversed phase and normalphase stationary phases under aqueous conditions // J. Sep. Sci. 2007. V. 30. № 8. P. 1101.
Tajuddin R., Smith R.M. On-line coupled extraction and separation using superheated water for the analysis of triazine herbicides in spiked compost samples // J. Chromatogr. A. 2004. V. 1084. № 1–2. P. 194.
Tornkvist A., Markides K.E., Nyholm L. Chromatographic behaviour of oxidised porous graphitic carbon columns // Analyst. 2003. V. 128. P. 844.
Shibukawa M., Unno A., Oyashiki Y., Nagoya A., Oguma K., Miura T. Redox reaction catalyzed by a porous graphite carbon packing and its application to selectivity enhancement of high-performance liquid chromatography separation of metal complexes // Anal. Commun. 1997. V. 34. P. 397.
Shibukawa M., Unno A., Miura T., Nagoya A., Oguma K. On-column derivatization using redox activity of porous graphitic carbon stationary phase: an approach to enhancement of separation selectivity of liquid chromatography // Anal. Chem. 2003. V. 75. № 11. P. 2775.
Saitoh K., Yamada N., Ishikawa E., Nakajima H., Shibukawa M. On-line redox derivatization liquid chromatographyusing double separation columns and onederivatization unit // J. Sep. Sci. 2006. V. 29. № 1. P. 49.
Saitoh K., Koichi K., Yabiku F., Noda Y., Porter M.D., Shibukawa M. On-column electrochemical redox derivatization for enhancement of separation selectivity of liquid chromatography: Use of redox reaction as secondary chemical equilibrium // J. Chromatogr. A. 2008. V. 1180. № 1–2. P. 66.
Keller D.W., Ponton L.M., Porter M.D. Assessment of supporting electrolyte contributions in electrochemically modulated liquid chromatography // J. Chromatogr. A. 2005. V. 1089. № 1–2. P. 72.
Deng H., Berkel G.J. Electrochemically modulated liquid chromatography coupled on-line with electrospray mass spectrometry // Anal. Chem. 2000. V. 72. P. 2641.
Ponton L.M., Porter M.D. High-speed electrochemically modulated liquid chromatography // Anal. Chem. 2004.V. 76. P. 5823.
Wang S., Porter M.D. Enantiomeric separations of benzodiazepines by electrochemically modulated liquid chromatography // J. Chromatogr. A. 1998. V. 828. № 1–2. P. 157.
Ting E.-Y., Porter M.D. Separations of benzodiazepines using electrochemically modulated liquid chromatography: Efficient separations from changes in the voltage applied to a porous graphitic carbon stationary phase // J. Chromatogr. A. 1998. V. 793. № 1. P. 204.
Pabst M., Altmann F. Influence of electrosorption, solvent, temperature, and ion polarity on the performance of LC-ESI-MS using graphitic carbon for acidic oligosaccharides // Anal. Chem. 2008. V. 80. P. 7534.
Rittenhouse C.T., Olesik S.V. High performance liquid chromatographic evaluation of a low-temperature glassy carbon stationary phase // J. Liq. Chromatogr. Relat. Technol. 1996. V. 19. № 17–18. P. 2997.
Poole S.K., Poole C.F. Retention of neutral organic compounds from solution on carbon adsorbents // Anal. Commun. 1997. V. 34. № 9. P. 247.
Poole C.F. Progress in packed column supercritical fluid chromatography: materials and methods // J. Biochem. Biophys. Methods. 2000. V. 43. № 1–3. P. 3.
Schoenmakers P.J., Uunk L.G.M., Janssen H.-G. Comparison of stationary phases for packed-column supercritical fluid chromatography // J. Chromatogr. A. 1990. V. 506. P. 563.
Gyllenhaal O., Karlsson A. Enantioresolution of dihydropyridine substituted acidby supercritical fluid chromatography on Hypercarb with Z-(L)-Arginine as chiral counter ion // Chromatographia . 2000. V. 52. № 5–6. P. 351.
Paull B., Macka M., Haddad P.R. Determination of calcium and magnesium in water samples by high-performance liquid chromatography on a graphitic stationary phase with a mobile phase containing o-cresolphthalein complexone // J. Chromatogr. A. 1997. V. 789. № 1–2. P. 329.
Chaimbault P. Petritis K., Elfakir C., Dreux M. Ion-pair chromatography on a porous graphitic carbon stationary phase for the analysis of twenty underivatized protein amino acids // J. Chromatogr. A. 2000. V. 870. № 1–2. P. 245.
Chambers S.D., Lucy C.A. Surfactant coated graphitic carbon based stationary phases for anion-exchange chromatography // J. Chromatogr. A. 2007. V. 1176. № 1–2. P. 178.
Wan Q.-H., Shaw P.N., Davies M.C., Barrett D.A. Role of alkyl and aryl substituents in chiral ligand exchange chromatography of amino acids study using porous graphitic carbon coated with N-substituted-l-proline selectors // J. Chromatogr. A. 1997. V. 786. № 2. P. 249.
Heldin E., Huhn N.H., Petterson C. (2S,3S)-Dicyclohexyl tartrate as mobile phase additive for the determination of the enantiomeric purity of (S)-atropine in tablets // J. Chromatogr. 1992. V. 592. № 1–2. P. 339.
Zaher M., Ravelet C., Baussanne I., Ravel A., Grosset C., Decout J.-L., Peyrin E. Chiral ligand-exchange chromatography of amino acids using porous graphitic carbon coated with a dinaphthyl derivative of neamine // Anal. Bioanal. Chem. 2009. V. 393. № 2. P. 655.
Wilkins S.M., Taylor D.R., Smith R.J. Enantiomer separations by supercritical fluid chromatography on a chiral stationary phase physically anchored to porous graphitic carbon // J. Chromatogr. A. 1995. V. 697. № 1–2. P. 587.
Harnisch J.A., Gazda D.B., Anderegg J.W., Porter M.D. Chemical modification of carbonaceous stationary phases by the reduction of diazonium salts // Anal. Chem. 2001. V. 73. P. 3954.
Pandurangappa M., Lawrence N.S. Compton R.G. Homogeneous chemical derivatisation of carbon particles: a novel method for funtionalising carbon surfaces // Analyst. 2002. V. 127. P. 1568.
Hemstrom P., Irgum K. Hydrophilic interaction chromatography // J. Sep. Sci. 2006. V. 29. № 12. P. 1784.
Lesellier E., West C., Tchapla A. Classification of special octadecyl-bonded phases by the carotenoid test // J. Chromatogr. A. 2006. V. 1111. № 1. P. 62.
Bicker W., Lammerhofer M., Lindner W. Mixed-mode stationary phases as a complementary selectivity concept in liquid chromatography–tandem mass spectrometry-based bioanalytical assays // Anal. Bioanal. Chem. 2008. V. 390. № 1. P. 263.
Thiébaut D., Vial J., Michel M., Hennion M.-C., Greibrokk T. Evaluation of reversed phase columns designed for polar compounds and porous graphitic carbon in “trapping” and separating neurotransmitters // J. Chromatogr. A. 2006. V. 1122. № 1–2. P. 97.
Bajad S.U., Lu W., Kimball E.H., Yuan J., Rabinowitz J.D. Separation and quantitation of water soluble cellular metabolites by hydrophilic interaction chromatography-tandem mass spectrometry // J. Chromatogr. A. 2006. V. 1125. № 1. P. 76.
Rosén J., Nyman A., Hellenäs K.-E. Retention studies of acrylamide for the design of a robust liquid chromatography–tandem mass spectrometry method for food analysis // J. Chromatogr. A. 2007. V. 1172. № 1. P. 19.
Hsieh Y., Duncan C.J.G., Brisson J.-M. Porous graphitic carbon chromatography/tandem mass spectrometric determination of cytarabine in mouse plasma // Rapid Commun. Mass Spectrom. 2007. V. 21. № 5. P. 629.
Miller K.E., Bruno T.J. Thermally-treated clay as a stationary phase in liquid chromatography // J. Chromatogr. A. 2004. V. 1042. № 1–2. P. 49.
Jackson P.T., Kim T.-Y., Carr P.W. Diastereomeric Selectivity of Carbon-Coated Zirconia Reversed-Phase Liquid Chromatographic Media // Anal. Chem. 1997. V. 69. № 24. P. 5011.
Jackson P.T., Carr P.W. Study of polar and nonpolar substituted benzenes and aromatic isomers on carbon-coated zirconia and alkyl bonded phases // J. Chromatogr. A. 2002. V. 958. № 1–2. P. 121.
Weber T.P., Jackson P.T, Carr P.W. Chromatographic evaluation of porous carbon-clad zirconia microparticles // Anal. Chem. 1995. V. 67. P. 3042.
Trammell B.C., Hillmyer M.A., Carr P.W. A Study of the Lewis acid–base interactions of vinylphosphonic acid-modified polybutadiene-coated zirconia // Anal. Chem. 2001. V. 73. P. 3323.
Weber T.P., Carr P.W. Comparison of isomer separation on carbon-clad microporous zirconia and on conventional reversed-phase high-performance liquid chromatography supports // Anal. Chem. 1990. V. 62. P. 2620.
Hanai T., Homma H. Quantitative in silico analysis of the selectivity of graphitic carbon synthesized by different methods // Anal. Bioanal. Chem. 2007. V. 390. № 1. P. 369.
Nesterenko P.N., Fedyanina O.N., Volgin Y.V., Jones P. Ion chromatographic investigation of the ion-exchange properties of microdisperse sintered nanodiamonds // J. Chromatogr. A. 2007. V. 1155. № 1. P. 2.
Saini G., Yang L., Lee M., Dadson A., Vail M., Linford M.R. Amino-modified diamond as a durable stationary phase for solid-phase extraction // Anal. Chem. 2008. V. 80. P. 6253.
Li Q., Yuan D. Evaluation of multi-walled carbon nanotubes as gas chromatographic column packing // J. Chromatogr. A. 2003. V. 1003. P. 203.
Pereira L. Porous graphitic carbon as a stationary phase in HPLC: Theory and application // J. Liq. Chromatogr. Relat. Technol. 2008. V. 31. P. 1687.
Wan Q., Shaw P., Davies M., Barrett D. Chromatographic behaviour of positional isomers on porous graphitic carbon // J. Chromatogr. A. 1995. V. 697. P. 219.
Wan Q., Shaw P., Davies M., Barret D. Retention behavior of ionizable isomers in reversed-phase liquid chromatography: A comparative study of porous graphitic carbon and octadecyl bonded silica // Anal. Chem. 1996. V. 68. P. 437.
Schlatter J., Astier A. Rapid determination of O- and P-cresol isomers in urine from workers exposed to toluene by high-performance liquid chromatography using a graphitized carbon column // Biomed. Chromatogr. 1995. V. 9. P. 302.
Gundersen J. Separation of isomers of nonylphenol and select nonylphenol polyethoxylates by high-performance liquid chromatography on a graphitic carbon column // J. Chromatogr. A. 2001. V. 914. P. 161.
Jacquet R., Pennanec R., Elfakir C., Lafosse M. Liquid chromatography analysis of monosubstituted sulfobutyl ether-b-cyclodextrin isomers on porous graphitic carbon // J. Sep. Sci. 2004. V. 27. P. 1221.
Houghton P., Woldermariam T. Use of a porous graphitic carbon column to separate isomers of piperidino-type chromone alkaloids // Phytochem. Anal. 1995. V. 6. P. 85.
Bieri S., Varesio E., Munoz O., Veuthey J.-L., Christen P. Use of porous graphitic carbon column for the separation of natural isomeric tropane alkaloids by capillary LC and mass spectrometry // J. Pharm. Biomed. Anal. 2006. V. 40. P. 545.
Reepmeyer J.C., Brower J.F., Ye H. Separation and detection of the isomeric equine conjugated estrogens, equilin sulfate and Δ8,9-dehydroestrone sulfate, by liquid chromatography–electrospray-mass spectrometry using carbon-coated zirconia and porous graphitic carbon stationary phases // J. Chromatogr. A. 2005. V. 1083. № 1–2. P. 42.
Xu J., Aubry A-E. Impurity profiling of non-nucleoside reverse transcriptase inhibitors by HPLC using a porous graphitic carbon stationary phase // Chromatographia. 2003. V. 57. P. 67.
Vialb J., Hennionb M.-C., Agüera A. Use of porous graphitic carbon coupled with mass detection for the analysis of polar phenolic compounds by liquid chromatography // J. Chromatogr. A. 2001. V. 937. № 1–2. P. 21.
Clarot I., Clédat D., Battu S., Cardot P.J. Chromatographic study of terpene derivatives on porous graphitic carbon stationary phase with β-cyclodextrin as mobile phase modifier // J. Chromatogr. A. 2000. V. 903. № 1–2. P. 67.
Okada Y., Semma M., Ito Y., Hamayasu K., Fujita K., Hashimoto H., Koizumi K., Kitahata S. Isolation and structural analyses of positional isomers of 61,6n-di-O-(N-acetyl-β-glucosaminyl)cyclomaltoheptaose (n = 2, 3, and 4) and 6-O-[6-O-(N-acetyl-β-glucosaminyl)-N-acetyl-β-glucosaminyl]-cyclomaltaose // Carbohydr. Res. 2001. V. 336. P. 203.
Antonio C., Larson T., Gilday A., Graham I., Bergström E., Thomas-Oates J. Quantification of sugars and sugar phosphates in Arabidopsis thaliana tissues using porous graphitic carbon liquid chromatography-electrospray ionization mass spectrometry // J. Chromatogr. A. 2007. V. 1172. № 2. P. 170.
Kim Y.-G., Jang K.-S., Joo H.-S., Kim H.-K. Simultaneous profiling of N-glycans and proteins from human serum using a parallel-column system directly coupled to mass spectrometry // J. Chromatogr. B. 2007. V. 850. № 1–2. P. 109.
Itoh S., Kawasaki N., Ohta M., Hyuga M. Simultaneous microanalysis of N-linked oligosaccharides in a glycoprotein using microbore graphitized carbon column liquid chromatography–mass spectrometry // J. Chromatogr. A. 2002. V. 968. № 1–2. P. 89.
Antonopoulos A., Favetta P., Lafosse M., Helbert W. Characterisation of i-carrageenans oligosaccharides with high-performance liquid chromatography coupled with evaporative light scattering detection // J. Chromatogr. A. 2004. V. 1059. P. 83.
Antonopoulos A., Favetta P., Helbert W., Lafosse M. On-line liquid chromatography–electrospray ionisation mass spectrometry for j-carrageenan oligosaccharides with a porous graphitic carbon column // J. Chromatogr. A. 2007. V. 1147. P. 37.
Gasparutto D., Ravanat J.-L., Gerot O., Cadet J. Characterization and chemical stability of photooxidized oligonucleotides that contain 2,2-diamino-4-[(2-deoxy–D-erythro-pentofuranosyl)amino]-5(2H)-oxazolone // J. Am. Chem. Soc. 1998. V. 120. P. 10283.
Xing J., Apedo A.,Tymiak A., Zhao N. Liquidchromatographicanalysisof nucleosides and their mono-, di- and triphosphates using porous graphitic carbon stationary phase coupled with electrospray mass spectrometry // Rapid Comm. Mass Spectrom. 2004. V. 18. P. 1599.
Remaud G., Boisdron-Celle M., Hameline C., Morel A., Gamelin E. An accurate dihydrouracil/uracil determination using improved high performance liquid chromatography method for preventing fluoropyrimidinesrelated toxicity in clinical practice // J. Chromatogr. B. 2005. V. 823. P. 98.
Remaud G., Boisdron-Celle M., Morel A., Gamelin E. Sensitive MS/MS–liquid chromatography assay for simultaneous determination of tegafur, 5-fluorouracil and 5-fluorodihydrouracil in plasma // J. Chromatogr. B. 2005. V. 824. P. 153.
Petritis K., Chaimbault, P., Elfakir C., Dreux M. Parameter optimization for the analysis of underivatized protein amino acids by liquid chromatography and ionspray tandem mass spectrometry // J. Chromatogr. A. 2000. V. 896. P. 253.
Adoubel A., Guenu S., Elfakir C., Dreux M. Separation of underivatized small peptides on a porous graphitic carbon column by ion-pair chromatography and evaporative light scattering detection // J. Liq. Chromatogr. Relat. Technol. 2000. V. 23. P. 2433.
Chaimbault P., Alberic P., Elfakir C., Lafosse M. Development of an LC–MS–MS method for the quantification of taurine derivatives in marine invertebrates // Anal. Biochem. 2004. V. 332. P. 215.
Nemeth-Kiss V., Forgacs E., Cserhati T. Anomalous retention behaviour of peptides on porous graphitized carbon column // J. Chromatogr. A. 1997. V. 776. P. 147.
Merciera J.-P., Morina Ph., Dreuxa M., Tambute A. Liquid chromatography analysis of phosphonic acids on porous graphitic carbon stationary phase with evaporative light-scattering and mass spectrometry detection // J. Chromatogr. A. 1999. V. 849. P. 197.
Статкус М.А., Гончарова Е.Н., Цизин Г.И., Родин И.А., Рыбальченко И.В., Золотов Ю.А. Способ высокоэффективного жидкостно-хроматографического определения концентрации алкилфосфоновых и/или О-алкилалкилфосфоновых кислот в водном растворе. Патент № 2653582 РФ. Заявка от 28.02.2017, опубликован 11.05.2018 .
Гончарова Е.Н., Статкус М.А., Цизин Г.И., Селимов Р.Н. ВЭЖХ-определение глифосата, аминометилфосфоновой кислоты и глюфосината с использованием пористого графитированного сорбента HYPERCARB // Вестн. Моск. ун-та. Серия 2: Химия. 2018. Т. 59. № 6. С. 395 (Goncharova E.N., Statkus M. A., Tsizin G. I., Selimov R. N. HPLC Determination of glyphosate, aminomethylphosphonic acid, and glufosinate using a Hypercarb porous graphite adsorbent // Moscow Univ. Chem. Bull. 2018. V. 73. № 6. P. 265.)
Гончарова Е.Н., Семенова И.П., Статкус М.А., Цизин Г.И. Градиентное ВЭЖХ разделение алкилфосноновых кислот на пористом графитированном сорбенте HYPERCARB с использованием водного раствора муравьиной кислоты в качестве подвижной фазы // Вестн. Моск. ун-та. Серия 2: Химия. 2017. Т. 58. № 6. С. 275. (Goncharova E.N., Semenova I.P., Statkus M.A., Tsysin G.I. Gradient HPLC separation of alkylphosphonic acids on a hypercarb porous graphitic carbon adsorbent with an aqueous formic acid solution as the mobile phase // Moscow Univ. Chem. Bull. 2017. V. 72. № 6. P. 255.)
Statkus M.A., Goncharova E.N., Gorbacheva S.Yu., Tsysin G.I. Solvation characteristics of porous graphitic carbon Hypercarb in subcritical water chromatography // Talanta. 2018. V. 188. P. 365.
Heinisch S., Rocca J.-L. Sense and nonsense of high-temperature liquid chromatography // J. Chromatogr. A. 2009. V. 1216. № 4. P. 642.
Cabooter D., Heinisch S., Rocca J.-L., Clicq D., Desmet G. Use of the kinetic plot method to analyze commercial high-temperature liquid chromatography systems: I: Intrinsic performance comparison // J. Chromatogr. A. 2007. V. 1143. P. 121.
Nazir T., Gould L.A., Marriott C., Martin G.P., Brown M.B. High performance liquid chromatography of a cyclosporin A formulation on a porous graphitic carbon column // Chromatographia. 1997. V. 46. № 11–12. P. 628.
Riddle L.A., Guiochon G. Separation of free sterols by high temperature liquid chromatography // J. Chromatogr. A. 2006. V. 1137. № 2. P. 173.
Vanhoenacker G., Sandra P. High temperature liquid chromatography and liquid chromatography–mass spectroscopy analysis of octylphenol ethoxylates on different stationary phases // J. Chromatogr. A. 2005. V. 1082. № 2. P. 193.
Albert M., Cretier G., Guillarme D., Heinisch S., Rocca J.-L. Some advantages of high temperature for the separation of pharmaceutical compounds with mass spectrometry detection // J. Sep. Sci. 2005. V. 28. № 14. P. 1803.
Hazotte A., Libong D., Chaminade P. High-temperature micro liquid chromatography for lipid molecular species analysis with evaporative light scattering detection // J. Chromatogr. A. 2007. V. 1140. P. 131.
Guillarme D., Heinisch S., Gauvrit J.Y., Lanteri P., Rocca J.-L. Optimization of the coupling of high-temperature liquid chromatography and flame ionization detection. Application to the separations of alcohols // J. Chromatogr. A. 2005. V. 1078. P. 22.
Wilson I.D. Investigation of a range of stationary phases for the separation of model drugs by HPLC using superheated water as the mobile phase // Chromatographia. 2000. V. 52. P. S28.
West C., Lesellier E. Separation of substituted aromatic isomers with porous graphitic carbon in subcritical fluid chromatography // J. Chromatogr. A. 2005. V. 1099. P. 175.
Thompson J.D., Carr P.W. A Study of the critical criteria for analyte stability in high-temperature liquid chromatography // Anal. Chem. 2002. V. 74. P. 1017.
Schoenmakers P.J., Uunk L.G.M., Janssen H.-G. Comparison of stationary phases for packed-column supercritical fluid chromatography // J. Chromatogr. A. 1990. V. 506. P. 563.
Engel T.M., Olesik S.V. Supercritical fluid-solid chromatography using a carbonaceous stationary phase // Anal. Chem. 1990. V. 62. № 15. P. 1554.
Cui Y., Olesik S.V. High-performance liquid chromatography using mobile phases with enhanced fluidity // Anal. Chem. 1991. V. 63. № 17. P. 1812.
Engel T. M., Olesik S.V. Solvent strength model for supercritical fluid chromatography on a porous glassy carbon stationary phase // Anal. Chem. 1991. V. 63. № 17. P. 1830.
West C., Lesellier E., Tchapla A. Retention characteristics of porous graphitic carbon in subcritical fluid chromatography with carbon dioxide–methanol mobile phases // J. Chromatogr. A. 2004. V. 1048. P. 99.
West C., Lesellier E. Effects of modifiers in subcritical fluid chromatography on retention with porous graphitic carbon // J. Chromatogr. A. 2005. V. 1087. P. 64.
Gyllenhaal O., Karlsson A. Packed-column supercritical fluid chromatography for the analysis of isosorbide-5-mononitrate and related compounds in bulk substance and tablets // J. Biochem. Biophys. Methods. 2000. V. 43. P. 135.
Wen D., Olesik S.V. Chromatography of ionizable positional isomers with methanol–water–carbon dioxide mixtures // Anal. Chim. Acta. 2001. V. 449. P. 211.
Moretton C., Crétier G., Nigay H., Rocca J.-L. Heart-cutting two-dimensional liquid chromatography methods for quantification of 2-acetyl-4-(1,2,3,4-tetrahydroxybutyl) imidazole in Class III caramel colours // J. Chromatogr. A. 2008. V. 1198–1199. P. 73.
Leira E., Botana A., Cela R. Resolution of complex mixtures of non-flavonoid polyphenols by column-switching high-performance liquid chromatography using octadecylsilica and graphitized carbon columns // J. Chromatogr. A. 1996. V. 724. P. 67.
Hennion M.-C., Coquart V., Guenu S., Sella C. Retention behaviour of polar compounds using porous graphitic carbon with water-rich mobile phases // J. Chromatogr. A. 1995. V. 712. P. 287.
Guenu S., Hennion M.-C. Evaluation of new polymeric sorbents with high specific surface areas using an on-line solid-phase extraction-liquid chromatographic system for the trace-level determination of polar pesticides // J. Cromatogr. A. 1996. V. 737. P. 15.
Corcia A.D., Crescenzi C., Guerriero E., Samperi R. Ultratrace determination of atrazine and its six major degradation products in water by solid-phase extraction and liquid chromatography–electrospray/mass spectrometry // Environ. Sci. Technol. 1997. V. 31. P. 1658.
Guenu S., Hennion M.-C. Prediction from liquid chromatographic data of obligatory backflush desorption from solid-phase extraction cartridges packed with porous graphitic carbon // J. Chromatogr. A. 1996. V. 725. P. 57.
Nunez O., Moyano E., Galceran M.T. Solid-phase extraction and sample stacking–capillary electrophoresis for the determination of quaternary ammonium herbicides in drinking water // J. Chromatogr. A. 2002. V. 946. P. 275.
Dauthieu M., Bueno M., Darrouzes J., Gilon N., Potin-Gautier M. Evaluation of porous graphitic carbon stationary phase for simultaneous preconcentration and separation of organic and inorganic selenium species in “clean” water systems // J. Chromatogr. A. 2006. V. 1114. P. 34.
Abbas-Ghaleb K., Gilon N., Crétier G., Mermet J.M. Preconcentration of selenium compounds on a porous graphitic carbon column in view of HPLC-ICP-AES speciation analysis // Anal. Bioanal. Chem. 2003. V. 377. P. 1026.
Dupas S., Guenu S., Pichon V., Montiel A., Welte B., Hennion M.-C. Long-term monitoring of pesticides and polar transformation products in ground water using automated online trace-enrichment and liquid chromatography with diode array detection // J. Environ. Anal. Chem. 1996. V. 65. P. 53.
Ibáñez M., Picó Y., Mañes J. On-line determination of bipyridylium herbicides in water by HPLC // Chromatographia. 1997. V. 45. P. 402.
Packer N.H., Lawson M.A., Jardine D.R., Redmond J.W. A general approach to desalting oligosaccharides released from glycoproteins // J. Glycoconjugate. 1998. V. 15. P. 737.
Soriano J.M., Jiménez B., Redondo M.J., Moltó J.C. Comparison of different sorbents for on-line liquid-solid extraction followed by high-performance liquid chromatographic determination of nitrogen-containing pesticides // J. Chromatogr. A. 1997. V. 822. P. 67.
Борисова Д.Р., Статкус М.А., Цизин Г.И., Золотов Ю.А. Проточное сорбционно-жидкостно-хроматографическое определение фенолов, включающее концентрирование на углеродном сорбенте и десорбцию субкритической водой. // Аналитика и контроль. 2012. Т. 16. № 3. С. 224.
Борисова Д.Р., Гончарова Е.Н., Статкус М.А., Цизин Г.И. Проточное сорбционно-ВЭЖХ определение моноэфиров фталевой кислоты, включающее десорбцию субкритической водой // Вестн. Моск. ун-та. Серия 2. Химия. 2015. Т. 56. № 5. С. 42. (BorisovaD.R., Goncharova E.N., Statkus M.A., Tsisin G.I. On-line solid-phase extraction and HPLC determination of phthalic acid monoesters including desorption with subcritical water // Moscow Univ. Chem. Bull. 2015. V. 70. № 5. P. 237.)
Borisova D.R., Statkus M.A., Tsysin G.I., Zolotov Yu.A. On-line coupling of solid-phase extraction of phenols on porous graphitic carbon and LC separation on C18 silica gel column via subcritical water desorption. // Sep. Sci. Technol. 2016. V. 51. № 12. P. 1979.
Røen B.T., Sellevåg S.R., Lundanes E. On-line solid phase extraction-liquid chromatography–mass spectrometry for trace determination of nerve agent degradation products in water samples // Anal. Chim. Acta. 2013. V. 761. P. 109.
Guenu S., Hennion M.-C. On-line sample handling of water-soluble organic pollutants in aqueous samples using porous graphitic carbon // J. Chromatogr. A. 1994. V. 665. P. 243.
Fonverne A., Ricoul F., Demesmay C., Delattre C., Fournier A., Dijon J., Vinet F. In situ synthesized carbon nanotubes as a new nanostructured stationary phase for microfabricated liquid chromatographic column // Sens. Actuators. B. 2008. V. 129. P. 510.
Antonopoulos A., Herbreteau B., Lafosse M., Helbert W. Comparative analysis of enzymatically digested κ-carrageenans, using liquid chromatography on ion-exchange and porous graphitic carbon columns coupled to an evaporative light scattering detector // J. Chromatogr. A. 2004. V. 1023. P. 231.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


