Журнал аналитической химии, 2020, T. 75, № 1, стр. 80-91
Хиральный вольтамперометрический сенсор на основе модифицированного циануровой кислотой пастового электрода для распознавания и определения энантиомеров тирозина
Р. А. Зильберг a, *, В. Н. Майстренко a, Л. Р. Кабирова a, В. Ю. Гуськов a, Э. М. Хамитов a, Д. И. Дубровский a
a Башкирский государственный университет, химический факультет
450076 Уфа, ул. ЗакиВалиди, 32, Россия
* E-mail: ZilbergRA@yandex.ru
Поступила в редакцию 31.08.2018
После доработки 20.06.2019
Принята к публикации 20.06.2019
Аннотация
Для селективного распознавания и определения энантиомеров тирозина (Тир) разработан энантиоселективный вольтамперометрический сенсор на основе пастового электрода из графитированной сажи Carboblack C, модифицированной циануровой кислотой (ЦК). Из-за стерических различий между энантиомерами Тир и нанополостями супрамолекул ЦК сенсор предпочтительно распознает D-Тир. С использованием циклической вольтамперометрии, электрохимической импедансной спектроскопии, сканирующей электронной микроскопии и поляриметрии оптимизированы условия модифицирования Carboblack C циануровой кислотой, изучены электрохимические характеристики сенсора и условия регистрации вольтамперограмм. В условиях дифференциальной импульсной вольтамперометрии оценены аналитические характеристики сенсора. Предложенный сенсор использован для распознавания и определения L- и D-энантиомеров Тир в смеси, в образцах мочи и плазмы крови человека. Методом молекулярно-динамического моделирования рассмотрены особенности взаимодействия энантиомеров Тир с супрамолекулами ЦК.
Тирозин – 2-амино-3-(4-гидроксифенил)пропионовая кислота – является одной из аминокислот, продуцируемых в организме человека. L-энантиомер Тир играет важную роль в синтезе нейротрансмиттеров. Повышенный уровень Тир вызывает болезнь Паркинсона, тогда как пониженное содержание Тир приводит к другим заболеваниям [1, 2]. Тирозин содержится в молоке, яйцах, фасоли, мясе и других пищевых продуктах. Его добавляют также к биологически активным добавкам. Для определения Тир применяют такие методы, как спектрофотометрия [3–5], флуориметрия [6], высокоэффективная жидкостная хроматография [7–10], газовая и жидкостная хроматография в сочетании с масс-спектрометрией [11–13], капиллярный электрофорез [14, 15]. Однако их применение требует использования дорогостоящих приборов и оборудования, длительной пробоподготовки, высокой квалификации персонала. В отличие от перечисленных методов, вольтамперометрия позволяет достаточно быстро и просто определять Тир с меньшими затратами и высокой эффективностью [16–25].
В качестве вольтамперометрических сенсоров для определения Тир из-за простоты изготовления, хорошей возобновляемости поверхности, низкой стоимости, химической инертности, небольших фоновых токов, большого диапазона рабочих потенциалов и возможности модифицирования различными типами модификаторов широко используют угольно-пастовые электроды [26–35]. Введение модификаторов в угольно-пастовых электродах позволяет понизить предел обнаружения и увеличить чувствительность определений, в том числе хиральных соединений [36–39]. Следует отметить, что распознавание и определение таких соединений имеет большое значение, поскольку энантиомеры могут проявлять различную или даже противоположную биологическую активность. Сенсоры для вольтамперометрического распознавания и определения энантиомеров, как правило, основаны на взаимодействиях типа “гость–хозяин” [16, 18, 21, 40], молекулярном импринтинге [41–43], хиральном обмене лигандами [44], высокоупорядоченных самоорганизующихся системах [17, 25, 45, 46] и др.
Недавно обнаружено [46], что ахиральные молекулы циануровой кислоты и другие подобные им при внешнем воздействии способны образовывать супрамолекулярные структуры с хиральными доменами, например, при воздействии поляризованного света, температуры, перемешивании [47–49] и др. В отсутствие внешнего воздействия, как правило, образуются рацематы. Этот эффект наблюдается для органических соединений, молекулы которых образуют две или более водородные связи с другими молекулами с образованием двумерных 2D-структур [49–51]. В частности, ЦК образует двумерную структуру с хиральными полостями размером 1–1.15 нм [47], поэтому супрамолекулы ЦК можно использовать в качестве модификаторов в вольтамперометрических сенсорах, способных к хиральному распознаванию энантиомеров [49].
Согласно теории [52] для вольтамперометрического распознавания энантиомеров Тир необходимо взаимодействие селектора, иммобилизованного на поверхности сенсора, с одним из энантиомеров как минимум в трех точках [53]. Дискриминация энантиомеров основана на термодинамической энантиоселективности, т.е. на различиях в энергиях Гиббса связывания энантиомеров с селектором. Благодаря структуре ароматического кольца Тир и межмолекулярным водородным связям между супрамолекулами ЦК и Тир, для них также должна существовать возможность “трехточечного” контакта [47, 49]. При этом стерические различия между молекулами L- и D-Тир могут быть причиной различий между энергиями Гиббса образования соответствующих комплексов, что отражается на потенциалах пиков и величинах токов энантиомеров на вольтамперограммах [17, 54]. Кроме того, супрамолекулы ЦК могут образовывать нанополости [55, 56]. Стерические различия между энантиомерами Тир и нанополостями ЦК также могут послужить причиной различий между электрохимическими характеристиками энантиомеров. Аналогичные результаты получены для редокс-реакций энантиомеров Тир на золотых электродах [57].
Цель работы состояла в исследовании вольтамперометрической сенсорной платформы на основе пастового электрода из графитированной сажи (ГПЭ), модифицированной супрамолекулами ЦК, для реализации селективного распознавания и вольтамперометрического определения энантиомеров Тир. Предложенная платформа состоит из хиральных супрамолекул ЦК, образующихся при самоорганизации ее ахиральных молекул на поверхности частиц Carboblack C при внешнем воздействии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и реагенты. В работе использовали препараты D- и L-Тирозина ч. д. а. (Sigma-Aldrich). В качестве фонового электролита применяли буферный раствор Бриттона–Робинсона с рН 2.10, полученный смешиванием исходных растворов 0.04 М H3BO3, 0.04 М H3PO4 и 0.04 М CH3COOH с последующим доведением до необходимого значения рН 0.2 М раствором NaOH. Раствор [Fe(CN)6]3–/4– (5 мМ) готовили на фоне 0.1 М KCl и использовали в качестве стандартного при электрохимических измерениях. Для приготовления пастового электрода использовали графитированную сажу Carboblack C (Restek, США) с удельной поверхностью 10 м2/г и размером частиц 60–80 меш, которую смешивали с парафиновым маслом (Merck). Carboblack C – широко распространенный в хроматографии адсорбент с уникальными характеристиками и гладкой однородной поверхностью. Следует отметить, что в литературе [58] описано использование хроматографических стационарных фаз для изготовления пастовых электродов. В качестве модификатора применяли циануровую кислоту (Fluka, 98%), очищенную двойной перекристаллизацией. Другие реактивы и реагенты имели квалификацию ч. д. а., в работе использовали ультрачистую деионированную воду (удельная проводимость 0.1 мкСм/см).
Циклические (ЦВ) и дифференциально-импульсные вольтамперограммы (ДИВ) регистрировали с использованием потенциостата/гальваностата AUTOLAB PGSTAT 204 (Metrohm Autolab Ins., Utrecht, Netherland) с программным обеспечением Nova, как это описано в работе [40]. Электрохимические измерения проводили в трехэлектродной ячейке, состоящей из немодифицированного или модифицированного пастового электрода диаметром 2 мм в качестве рабочего электрода, платиновой проволоки в качестве вспомогательного электрода и хлоридсеребряного электрода в качестве электрода сравнения. Морфологию поверхности частиц Carboblack C, модифицированных ЦК, изучали сканирующей электронной микроскопией (СЭМ) с использованием микроскопа Hitachi SU 8000 (Япония) при ускоряющем напряжении 1 кВ и рабочем расстоянии 2–3 мм. Перед регистрацией изображений немодифицированные и модифицированные частицы Carboblack C помещали на поверхность алюминиевого диска диаметром 25 мм и фиксировали с помощью углеродной скотч-ленты. Поляриметрические исследования взаимодействия энантиомеров тирозина с частицами Carboblack C, модифицированными ЦК, проводили с использованием автоматического поляриметра Atago AP-300 (Япония) при длине волны 589 нм в кювете длиной 200 мм и объемом 10 мл. Спектры электрохимического импеданса регистрировали с помощью импедансметра Elins Z500 Pro (Москва, Россия) в диапазоне частот от 50 кГц до 0.1 Гц с амплитудой сигнала 5 мВ. Для молекулярно-динамического моделирования взаимодействия энантиомеров Тир с супрамолекулами ЦК применяли силовое поле GROMOS96 54a7 [59], реализованное в программном пакете Gromacs [60–63]. Для построения топологических структур использовали программное обеспечение, описанное в работах [64–66]. Величины pH измеряли с помощью pH-метра Seven Compact pH/Ion S220 (Mettler-Toledo AG, Швейцария). Все измерения проводили при 22 ± 0.5°С.
Изготовление пастового электрода на основе графитированной сажи, модифицированной циануровой кислотой. Порошок Carboblack C модифицировали таким образом, чтобы ЦК образовывала самоорганизующиеся супрамолекулярные слои на поверхности адсорбента [50]. Для этого к 50 мл водно-спиртового (3 : 1) раствора, термостатированного при 60°С, добавляли 5 г Carboblack C и перемешивали полученную смесь со скоростью 500 об/мин. В полученную суспензию вводили 30 мл водно-спиртового раствора (3 : 1) 500 мг циануровой кислоты, нагретого до 60°С, и перемешивали при той же температуре до испарения растворителя. Полученный порошок высушивали до постоянной массы при 100–110°С в су-шильном шкафу. На рис. 1 в качестве примера приведены СЭМ-изображения частиц Carboblack С размером ~80–150 нм, модифицированных ЦК. На поверхности Carboblack С осаждаются слои супрамолекул ЦК преимущественно в кето-форме, содержащие шестичленные нанокольца с внутренним диаметром ~1 нм [56, 67]. При этом частицы Carboblack C сохраняют первоначальную однородность, а модификатор равномерно распределен по поверхности, обеспечивая хорошую доступность супрамолекул ЦК для взаимодействия с энантиомерами Тир.
Рис. 1.
Изображения частиц Carboblack C, модифицированных циануровой кислотой, полученные с помощью сканирующей электронной микроскопии: (а) – 2 × 2 мкм, (б) – 300 × 300 нм.

Пастовый электрод из графитированной сажи получали тщательным перемешиванием 0.8 г порошка Carboblack C, модифицированного (или немодифицированного) ЦК, с 0.3 мл парафинового масла в соотношении 2.7 : 1 (по массе). Часть полученной пасты переносили в полость стеклянной трубки (внутренний диаметр 2.0 мм), снабженной платиновой проволокой диаметром 1.8 мм, которую использовали в качестве токоприемника. Перед каждым измерением поверхность электрода обновляли удалением 1–2 мм пасты с последующим выравниванием поверхности электрода на гладкой бумаге (кальке). Поверхность ГПЭ промывали высокоочищенной деионированной водой и стабилизировали электрод сканированием пяти циклических вольтамперограмм в 0.1 М растворе KCl в диапазоне потенциалов от 0.0 до +2.0 В со скоростью 1 В/с.
Методика эксперимента. Стандартные растворы энантиомеров Тир (0.001 М) получали растворением точных навесок (с учетом степени чистоты) соответствующего реагента в 50 мл буферного раствора Бриттона–Робинсона с рН 2.10. Растворы более низких концентраций получали разбавлением исходных растворов. Циклические вольтамперограммы регистрировали в диапазоне потенциалов от 0.8 до 1.4 В со скоростью развертки 100 мВ/с после выдерживания ГПЭ в растворе аналита в течение 30 с при интенсивном перемешивании и потенциале 0.0 В. Дифференциально-импульсные вольтамперограммы регистрировали в диапазоне потенциалов от 0.8 до 1.2 В с амплитудой 50 мВ, интервалом времени 0.25 с, временем модуляции 0.025 с и скоростью развертки 20 мВ/с. Массив данных для каждого образца состоял из четырех параллельных измерений, достаточных для получения воспроизводимых результатов. Каждое параллельное измерение включало регистрацию пяти вольтамперограмм, где каждая вольтамперограмма содержала от 80 (ДИВ) до 120 (ЦВ) мгновенных токов (с шагом 5 мВ) при различных потенциалах.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
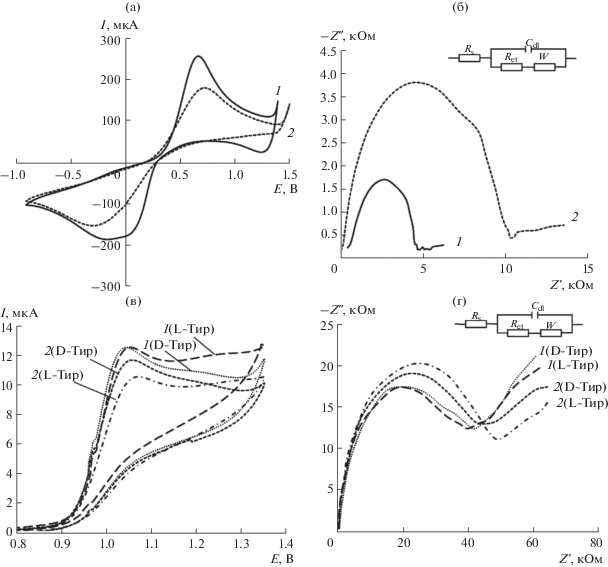
Электрохимические характеристики пастового электрода из графитированной сажи, модифицированного циануровой кислотой. Для изучения свойств ГПЭ, модифицированного ЦК, использовали циклическую вольтамперометрию. На рис. 2а приведены циклические вольтамперограммы 5 мМ раствора [Fe(CN)6]3–/4– (1 : 1) на ГПЭ и ГПЭ/ЦК. Вольтамперограммы редокс-пары [Fe(CN)6]3–/4– описывают обратимый окислительно-восстановительный процесс на обоих электродах. Видно, что после модифицирования поверхности частиц Carboblack C циануровой кислотой токи пиков [Fe(CN)6]3–/4– уменьшаются по сравнению с немодифицированным ГПЭ из-за затруднения переноса электронов через слой модификатора. Однако этот электрод можно использовать в качестве энантиоселективного сенсора в вольтамперометрии для распознавания и определения энантиомеров тирозина. Об этом свидетельствуют данные поляриметрического исследования взаимодействия энантиомеров Тир с частицами Carboblack C, модифицированными ЦК: водные растворы энантиомеров Тир (с концентрацией 4.0 мМ) в 0.01 М HCl помещали в кювету поляриметра и измеряли угол вращения плоскости поляризованного света (α). Значения α для D- и L-Тир составили +0.04 и –0.04 соответственно. Далее растворы помещали в стеклянную колбу емк. 25 мл, добавляли 0.5 г порошка Carboblack C, модифицированного ЦК, интенсивно перемешивали в течение 1 ч и отфильтровывали. Для полученных растворов вновь измеряли α. Обнаружено, что в случае L-Тир он не изменяется, тогда как для D-Тир α становится равным нулю. Можно полагать, что этот факт указывает на специфическое взаимодействие D-Тир с частицами Carboblack C, модифицированными ЦК, по-видимому, вследствие образования хиральных нанополостей [48, 51]. Подчеркнем, что для немодифицированного ГПЭ этот эффект не наблюдается.
Рис. 2.
Циклические вольтамперограммы и диаграммы Найквиста для 5.0 мМ раствора [Fe(CN)6]3–/4– на фоне 0.1 М KCl (а), (б) и для 1.0 мМ растворов D- и L-тирозина (в), (г) на фоне буферного раствора Бриттона–Робинсона с рН 2.10 при $v$ = 100 мВ/с: 1 – ГПЭ, 2 – ГПЭ/ЦК. Вставки: эквивалентные схемы, используемые для моделирования данных импеданса, где Rs и Ret – сопротивление раствора и сопротивление переноса электрона на границе раздела фаз электрод/раствор.
Площадь электроактивной поверхности немодифицированного ГПЭ и ГПЭ, модифицированного ЦК, оценивали методом циклической вольтамперометрии при различных скоростях развертки потенциала в диапазоне от 0.1 до 0.5 В/с с использованием 5.0 мМ K3[Fe(CN)6]. Для обратимого электродного процесса площадь электроактивной поверхности рассчитывали с использованием уравнения Рэндлса–Шевчика [68]:
где Ip – ток пика, A; n – число переносимых электронов; A – площадь поверхности электрода, см2; D – коэффициент диффузии, см2/с; c – концентрация K3[Fe(CN)6], мМ; $v$ – скорость развертки потенциала, В/с.
Известно, что для K3[Fe(CN)6] в 0.1 М растворе KCl n = 1, D = 7.6 × 10−6 см2/с [39, 68]. Эффективная площадь поверхности ГПЭ, модифицированного ЦК, составила 0.111 ± 0.004 см2, что в 1.5 раза меньше, чем для чистого ГПЭ (0.171 ± 0.005 см2). По-видимому, уменьшение эффективной площади поверхности модифицированного циануровой кислотой ГПЭ обусловлено меньшей электронной проводимостью супрамолекулярного слоя ЦК, хотя хиральные нанополости ее супрамолекул также могут затруднять перенос электронов.
Электрохимические свойства ГПЭ и ГПЭ/ЦК изучали также методом электрохимической импедансной спектроскопии. На рис. 2б приведены типичные диаграммы Найквиста для ГПЭ и ГПЭ/ЦК в 5.0 мМ растворе [Fe(CN)6]3–/4–, содержащем 0.1 М KCl. Спектры импеданса довольно хорошо согласуются с эквивалентной электрической схемой, представленной на вставке рис. 2б. Кривые Найквиста показывают, что ГПЭ/ЦК имеет более высокое сопротивление переноса электрона по сравнению с ГПЭ, т.е. модифицирование частиц Carboblack C циануровой кислотой замедляет электродный процесс. Значения Ret для ГПЭ и ГПЭ/ЦК составили 4.4 и 10.0 кОм соответственно. Сопротивление переноса электрона зависит также от соотношения Carboblack C/парафиновое масло в пасте, максимальные токи наблюдали для соотношения 2.7 : 1 (по массе).
Электрохимическое поведение энантиомеров тирозина на модифицированном циануровой кислотой пастовом электроде. Известно, что тирозин окисляется в буферных растворах с рН 2–10 на угольно-пастовом электроде, о чем свидетельствуют анодные пики на вольтамограммах [26–33]. Энантиомеры тирозина в буферном растворе Бриттона–Робинсона с рН 2.10 на ГПЭ/ЦК также необратимо окисляются с образованием соответствующих пиков в исследуемом диапазоне потенциалов при скорости развертки потенциала 100 мВ/с (рис. 2в). Данные ЦВА и электрохимической импедансной спектроскопии (рис. 2) свидетельствуют, что ГПЭ/ЦК проявляет специфическое взаимодействие с D-Tир, обусловленное различиями в стерических препятствиях при проникновении молекул энантиомеров Тир к поверхности электрода через нанополости супрамолекул ЦК [48]. При этом супрамолекулы ЦК являются хиральным селектором для энантиомеров Тир, вольтамперограммы которых отличаются по потенциалам пиков и величинам максимальных токов. Аналогичный эффект наблюдался [25] при распознавании энантиомеров Тир с использованием хиральных электрохимических сенсоров на основе самоорганизующихся систем. Таким образом, специфическое взаимодействие между D-энантиомерами Тир и супрамолекулами ЦК является причиной хиральной дискриминации энантиомеров Тир в условиях вольтамперометрии. Гетерогенные условия протекания редокс-реакции также могут влиять на специфичность взаимодействий энантиомеров Тир с супрамолекулами ЦК, при этом параметры селективности сигнала могут отличаться от характеристик разделения тех же энантиомеров в гомогенных условиях [69].
Аналогичный эффект наблюдали при регистрации дифференциально-импульсных вольтамперограмм энантиомеров Тир на ГПЭ/ЦК (рис. 3). Увеличение тока и смещение потенциала пика для D-Tир по сравнению с L-Tир свидетельствует о том, что молекулы D-Tир легче проникают к поверхности электрода через нанополости в супрамолекулах ЦК. Таким образом, изменение тока и смещение потенциала пика можно использовать для распознавания энантиомеров Тир и оценки стереоселективности ГПЭ/ЦК. Электрохимические характеристики ДИВ энантиомеров Тир на ГПЭ, модифицированном ЦК, приведены в табл. 1. Следует отметить, что ДИВ для энантиомеров Тир на немодифицированном ГПЭ (рис. 3б) отличаются друг от друга незначительно, тогда как на ГПЭ/ЦК (рис. 3а) эти различия более заметны. Это еще раз подтверждает, что супрамолекулы ЦК являются хиральным селектором для энантиомеров тирозина.
Рис. 3.
Дифференциально-импульсные вольтамперограммы 1.0 мМ растворов D- и L-тирозина (1 и 2 соответственно) на фоне буферного раствора Бриттона–Робинсона с рН 2.10 при $v$ = 20 мВ/с на ГПЭ/ЦК (а) и ГПЭ (б).

Таблица 1.
Характеристики дифференциально- импульсных вольтамперограмм 1.0 мМ растворов энантиомеров тирозина, окисляющихся на ГПЭ/ЦК (раствор Бриттона–Робинсона с pH 2.10, скорость развертки потенциала 20 мВ/с)
| Электрод | Ep, В | Ip, мкA | ΔIp/Δc, мкA/мM | cmin, мкM | ||||
|---|---|---|---|---|---|---|---|---|
| L-Тир | D-Тир | L-Тир | D-Тир | L-Тир | D-Тир | L-Тир | D-Тир | |
| ГПЭ | 0.98 | 0.97 | 10.26 | 10.28 | 7.68 | 7.70 | 5.1 | 5.1 |
| ГПЭ/ЦК | 1.02 | 0.97 | 2.75 | 4.92 | 1.91 | 3.81 | 3.9 | 2.0 |
Молекулярно-динамическое моделирование взаимодействий энантиомеров тирозина с супрамолекулами циануровой кислоты. Анализ профилей изменения ΔG взаимодействий атомов азота и кислорода в энантиомерах Тир с супрамолекулами модификатора показывает, что различия ΔG при образовании водородных связей D- и L-Тир с модификатором максимальны для атомов кислорода (1.03 кДж/моль). Атомы азота энантиомеров Тир также участвуют в образовании водородных связей, но не проявляют селективности во взаимодействиях. Судя по длине водородных связей (~0.3 нм), их можно отнести к водородным связям средней силы, преимущественно электростатической природы. Гидрофобное взаимодействие между фенильными группами энантиомеров Тир и нанополостями супрамолекул ЦК незначительно влияет на устойчивость образующихся комплексов. Полное изменение свободной энергии Гиббса при образовании водородных связей между молекулами D- и L-Тир и модификатором составляет ~3.2 кДж/моль.
Данные молекулярно-динамического моделирования свидетельствуют, что более высокие значения токов D-Тир на ГПЭ, модифицированном ЦК, обусловлены главным образом различными стерическими препятствиями при проникновении молекул энантиомеров Тир к электроду через нанополости супрамолекул ЦК. Молекулы D-Тир хорошо вписываются в нанополости супрамолекул ЦК, тогда как проникновение через них молекул L-Тир к поверхности электрода связано со стерическими затруднениями. Этим достигается дискриминация энантиомеров тирозина при регистрации вольтамперограмм на ГПЭ, модифицированном ЦК. Методология моделирования и анализ полученных данных аналогичны использованным ранее [64].
Оптимизация условий эксперимента. Для определения оптимальных условий формирования сигнала изучали влияние рН фонового электролита, скорости развертки потенциала, времени выдерживания электрода в растворе аналита и концентрации энантиомеров Тир на величины максимальных токов пиков и форму вольтамперограмм. Критериями оптимизации служили чувствительность, стандартное отклонение и коэффициенты корреляции градуировочных графиков. Обнаружено, что выдерживание модифицированного ГПЭ в растворе аналита в течение более 30 с не приводит к существенному изменению формы вольтамперограмм и величин токов пиков. Влияние рН на электрохимическое окисление энантиомеров Тир на ГПЭ/ЦК изучали в диапазоне 2–10 в универсальном буферном растворе Бриттона–Робинсона в условиях ДИВ. Чувствительность электрода максимальна в диапазоне рН 2.0–2.5, поэтому оптимум рН в последующих экспериментах составлял 2.10. Отмечено, что с увеличением рН раствора потенциал пика окисления смещается в сторону менее положительных значений, что свидетельствует об участии протонов в электрохимической реакции [68].
Исследование влияния скорости развертки потенциала на величины максимальных токов пиков окисления энантиомеров в 1.0 мМ растворах Тир в диапазоне от 10 до 750 мВ/с свидетельствует о том, что увеличение скорости развертки приводит к увеличению токов пиков наряду со смещением потенциалов в сторону положительных значений. Токи пиков окисления (Ip) линейно зависят от корня квадратного из скорости сканирования (${{v}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$). Таким образом, электродный процесс окисления энантиомеров Тир на ГПЭ, модифицированном ЦК, контролируется диффузией электроактивного вещества к поверхности электрода.
Аналитические характеристики ДИВ 1.0 мМ растворов энантиомеров Тир на “чистом” ГПЭ и модифицированном ЦК представлены в табл. 1. Видно, что токи пиков возрастают линейно с увеличением концентрации энантиомеров Тир в диапазоне от 16 мкМ до 1.0 мМ (рис. 4). Градуировочные графики (вставки на рис. 4) свидетельствуют, что ГПЭ, модифицированный ЦК, проявляет энантиоселективную дискриминацию энантиомеров тирозина в изученном диапазоне концентраций. Таким образом, ГПЭ/ЦК можно использовать для вольтамперометрического определения энантиомеров тирозина. Для оценки аналитических возможностей сенсоров использовали метод введено–найдено. В табл. 2 приведены результаты определения энантиомеров Тир на ГПЭ/ЦК методом ДИВ на фоне буферного раствора Бриттона–Робинсона (рН 2.10) при скорости развертки потенциала 20 мВ/с. Таким образом, предложенный сенсор позволяет правильно определять концентрацию энантиомеров Тир в модельных растворах с sr не более 6.4%. (n = 5, P = 0.95).
Рис. 4.
Дифференциально-импульсные вольтамперограммы растворов L- и D-тирозина (а), (б) на фоне буферного раствора Бриттона–Робинсона с рН 2.10: ${v}$ = 20 мВ/с на ГПЭ/ЦК; концентрация энантиомеров, мМ: 1 – 0.016, 2 – 0.031, 3 – 0.062, 4 – 0.125, 5 – 0.25, 6 – 0.5, 7 – 1.0. Вставки: соответствующие градуировочные графики.

Таблица 2.
Определение энантиомеров тирозина на ГПЭ/ЦК на фоне буферного раствора Бриттона–Робинсона с pH 2.10 с использованием дифференциально-импульсной вольтамперометрии (скорость развертки потенциала 20 мВ/с, n = 5, P = 0.95)
| Введено, мкM | Найдено, мкM | sr, % | |||
|---|---|---|---|---|---|
| L-Тир | D-Тир | L-Тир | D-Тир | L-Тир | D-Тир |
| 20 | 20 | 19 ± 1 | 21 ± 2 | 4.7 | 6.4 |
| 50 | 50 | 48 ± 2 | 46 ± 2 | 2.6 | 3.4 |
| 150 | 150 | 155 ± 4 | 146 ± 3 | 2.1 | 1.6 |
| 350 | 350 | 349 ± 4 | 353 ± 2 | 0.9 | 0.5 |
Как видно из табл. 1, чувствительность и пределы обнаружения (рассчитанные по 3σ-критерию) энантиомеров Тир с помощью ГПЭ, модифицированного ЦК, сопоставимы с другими пастовыми электродами, предложенными в последние годы [27]. Однако большинство пастовых электродов сравнительно редко используются для распознавания и определения как энантиомеров Тир, так и анализа их рацемических смесей из-за близости характеристик соответствующих вольтамперограмм. В общем случае для этих целей используют другие сенсоры, основанные на применении комплексов типа “хозяин–гость” [18], полимеров с молекулярными отпечатками [41] и самоорганизующихся структур [17, 25].
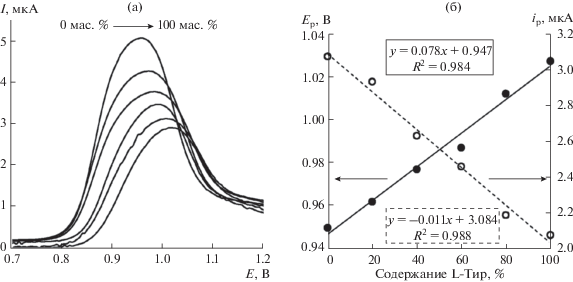
Количественное определение энантиомеров тирозина в смеси. Пастовый электрод из графитированной сажи, модифицированный ЦК, применили для оценки содержания энантиомеров Тир в смеси. На рис. 5а приведены ДИВ при различном содержании L-Тир (0, 20, 40, 60, 80, 100%) в 1 мМ растворах смеси энантиомеров тирозина на ГПЭ/ЦК. Видно, что с ростом концентрации L-Тир потенциалы пиков смещаются в сторону положительных значений, в то время как токи пиков уменьшаются. Потенциалы и токи пиков линейно зависят от соотношения L- и D-энантиомеров Тир в смеси (рис. 5б). Полученные результаты свидетельствуют, что сенсор на основе ГПЭ/ЦК с хорошими аналитическими характеристиками позволяет определять энантиомеры Тир в смеси.
Рис. 5.
(а): Дифференциально-импульсные вольтамперограммы смеси энантиомеров тирозина (1 мМ) на ГПЭ/ЦК в зависимости от содержания L-тирозина. (б): Зависимость потенциала и тока пика в 1 мМ растворе смеси энантиомеров тирозина от содержания L-тирозина. Содержание L-тирозина, мас. %: ~0, 20, 40, 60, 80, 100; $v$ = 20 мВ/с.
Количественное определение энантиомеров тирозина в образцах мочи и плазмы крови человека. Предложенный сенсор успешно применен для количественного определения энантиомеров Тир в реальных объектах – моче и плазме крови человека. Для сбора проб мочи было получено письменное согласие донора, все эксперименты проводили в соответствии с действующими законами. Образцы плазмы крови здорового человека предоставлены Уфимской Республиканской станцией переливания крови. Образцы мочи и плазмы крови объемом 2.5 мл центрифугировали в течение 10 мин и разбавляли в 10 раз буферным раствором Бриттона–Робинсона (рН 2.10). В полученные растворы добавляли известные количества D- и L-Тир (20, 50 и 350 мкМ) и регистрировали вольтамперограммы в дифференциально-импульсном режиме. В табл. 3 приведены результаты определения энантиомеров Тир в моче и плазме крови методом введено–найдено. Величины sr 1.5–10.5 и 1.4–6.5% соответственно (n = 5, P = 0.95) свидетельствуют об удовлетворительной повторяемости результатов определений.
Таблица 3.
Определение энантиомеров тирозина в моче и плазме крови человека на ГПЭ/ЦК на фоне буферного раствора Бриттона–Робинсона с pH 2.10 с использованием дифференциально-импульсной вольтамперометрии (скорость развертки потенциала 20 мВ/с, n = 5, P = 0.95)
| Образец | Введено, мкM | Найдено, мкM | sr, % | |||
|---|---|---|---|---|---|---|
| L-Тир | D-Тир | L-Тир | D- Тир | L-Тир | D-Тир | |
| Моча | 20 | 20 | 18 ± 2 | 21 ± 3 | 9.9 | 10.5 |
| 50 | 50 | 46 ± 6 | 45 ± 6 | 9.7 | 9.8 | |
| 350 | 350 | 342 ± 7 | 347 ± 10 | 1.5 | 2.3 | |
| Плазма | 20 | 20 | 18 ± 1 | 21 ± 2 | 5.9 | 6.5 |
| 50 | 50 | 45 ± 3 | 45 ± 3 | 5.2 | 5.6 | |
| 350 | 350 | 340 ± 6 | 357 ± 8 | 1.4 | 1.9 | |
* * *
Таким образом, для селективного распознавания и определения энантиомеров Тир предложен вольтамперометрический сенсор на основе графитированной сажи (Carboblack C), модифицированной циануровой кислотой. Его преимуществами по сравнению с предложенными ранее хиральными сенсорами являются простота изготовления и модифицирования, высокая чувствительность и хорошая воспроизводимость результатов измерений. Полученные данные свидетельствуют о том, что сенсор на основе ГПЭ/ЦК может быть применен для анализа смеси энантиомеров и является эффективной хиральной платформой для распознавания энантиомеров тирозина в образцах плазмы крови и мочи человека. Рассмотрены теоретические и практические аспекты проблемы для дальнейшего понимания селективности взаимодействий энантиомеров с супрамолекулами ахиральных соединений.
Работа выполнена при поддержке РНФ: грант № 16-13-10257.
Список литературы
Fernstrom M.H., Fernstrom J.D. Acute tyrosine depletion reduces tyrosine hydroxylation rate in rat central-nervous-system // Life Sci. 1995. V. 57. № 9. P. 97.
Fernstrom J.D., Fernstrom. Tyrosine, phenylalanine, and catecholamine synthesis and function in the brain // J. Nutr. 2007. V. 137. № 6. P. 1539S.
Sastry C.S.P., Satyanarayana P., Tummuru M.K. Spectrophotometric determination of tyrosine in proteins // Food Chem. 1985. V. 17. № 3. P. 227. https://doi.org/10.1016/0308-8146(85)90073-1
Azuma Y., Maekawa M., Kuwabara Y., Nakajima T., Taniguchi K., Kanno T. Determination of branched-chain amino-acids and tyrosine in serum of patients with various hepatic diseases and its clinical usefulness // Clin. Chem. 1989. V. 35. № 7. P. 1399.
Solhjoo A., Khajehsharifi H. Multivariate calibration applied to the simultaneous spectrophotometric determination of ascorbic acid, tyrosine and epinephrine in pharmaceutical formulation and biological fluids //Curr. Anal. Chem. 2016. V. 12. № 6. P. 580. https://doi.org/10.2174/1573411012999160401124820
Wang F., Wu Y.Z., Qing Y., Ci Y.X. Spectrofluorometric determination of the substrates based on the fluorescence formation with the peroxidase-like conjugates of hemin with proteins // Anal. Lett. 1992. V. 25. № 8. P. 1469.
Chin J.R.L. Determination of the catecholamines and serotonin, their precursors tyrosine and tryptophan, and their main metabolites in rat-brain using reversed-phase high-performance liquid-chromatography with fluorometric and oxidative amperometric detection in series // J. Chromatogr. Biomed. Appl. 1992. V. 578. № 1. P. 17.
Sanchez-Machado D.I., Chavira-Willys B., Lopez-Cervantes J. High-performance liquid chromatography with fluorescence detection for quantitation of tryptophan and tyrosine in a shrimp waste protein concentrate // J. Chromatogr. 2008. V. 863. № 1. P. 88.
Sa M., Ying L., Guo T.A., Dong X.L., Ping R.Y. Simultaneous determination of tyrosine, tryptophan and 5-hydroxytryptamine in serum of MDD patients by high performance liquid chromatography with fluorescence detection // Clin. Chim. Acta. 2012. V. 413. № 11–12. P. 973. https://doi.org/10.1016/j.cca.2012.02.019
Koga R., Miyoshi Y., Sato Y., Mita M., Konno R., Lindner W., Hamase K. Enantioselective determination of phenylalanine, tyrosine and 3,4-dihydroxyphenylalanine in the urine of D-amino acid oxidaze deficient mice using two-dimensional high-performance liquid chromatography // Chromatography. 2016. V. 37. № 1. P. 14. https://doi.org/10.15583/jpchrom.2015.040
Deng C.H., Deng Y.H., Wang B., Yang X.H. Gas chromatography-mass spectrometry method for determination of phenylalanine and tyrosine in neonatal blood spots // J. Chromatogr. 2002. V. 780. № 2. P. 407.
Orhan H., Vermeulen N.P.E., Tump C., Zappey H., Meerman J.H.N. Simultaneous determination of tyrosine, phenylalanine and deoxyguanosine oxidation products by liquid chromatography-tandem mass spectrometry as non-invasive biomarkers for oxidative damage // J. Chromatogr. 2004. V. 799. № 2. P. 245.
Kim J., Tran T.T.H., Hong S.P., Jeong J.S. A reference measurement procedure for amino acids in blood using isotope dilution ultra-performance liquid chromatography-tandem mass spectrometry // J. Chromatogr. 2017. V. 1055. P. 72.
Колобова Е.А., Карцова Л.А., Бессонова Е.А. Применение ионных жидкостей на основе имидазола при электрофоретическом определении аминокислот в моче // Журн. аналит. химии. 2015. Т. 70. № 11. С. 1179. (Kolobova E.A., Kartsova L.A., Bessonova E.A. Application of ionic liquids based on imidazole to the electrophoretic determination of amino acids in urine // J. Analyt. Chem. 2015. V. 70. № 11. P. 1354.)
Forteschi M., Sotgia S., Assaretti S., Arru D., Cambedda D., Sotgiu E., Zinellu A., Carru C. Simultaneous determination of aromatic amino acids in human blood plasma by capillary electrophoresis with UV-absorption detection // J. Sep. Sci. 2015. V. 38. № 10. P. 1794. https://doi.org/10.1002/jssc.201500038
Quintana C., Suárez S., Hernández L. Nanostructures on gold electrodes for the development of an L-tyrosine electrochemical sensor based on host-guest supramolecular interactions // Sens. Actuators B. 2010. V. 149. № 1. P. 129. https://doi.org/10.1016/j.snb.2010.06.011
Nie R., Bo X., Wang H., Zeng L., Guo L. Chiral electrochemical sensing for tyrosine enantiomers on glassy carbon electrode modified with cysteic acid // Electrochem. Commun. 2013. V. 27. P. 112. https://doi.org/10.1016/j.elecom.2012.11.014
Dong S.Q., Bi Q., Qiao C.D., Sun Y.M., Zhang X., Lu X.Q., Zhao L. Electrochemical sensor for discrimination tyrosine enantiomers using graphene quantum dots and beta-cyclodextrins composites // Talanta. 2017. V. 173. P. 94. https://doi.org/10.1016/j.talanta.2017.05.045
Norouzi P., Salimi H., Tajik S., Beitollahi H., Rezapour M., Larijani B. Biosensing applications of ZnO/graphene on glassy carbon electrode in analysis of tyrosine // Int. J. Electrochem. Sci. 2017. V. 12. № 6. P. 5254. https://doi.org/10.20964/2017.06.79
Tian F.Y., Li H.J., Li M.J., Li C.P., Lei Y.J., Yang B.H. A tantalum electrode coated with graphene nanowalls for simultaneous voltammetric determination of dopamine, uric acid, L-tyrosine, and hydrochlorothiazide // Microchim. Acta. 2017. V. 184. № 6. P. 1611. https://doi.org/10.1007/s00604-017-2154-y
Pang T.T., Zhang X.Y., Xue Y.B. Determination of tyrosine using p-sulfonated calix[n] arene modified electrode // J. Incl. Phen. Macrocycl. Chem. 2017. V. 87. № 3–4. P. 275. https://doi.org/10.1007/s10847-017-0697-5
Chen L., Liu S., Chang F., Xie X., Zhu Z. A gold nanoparticles-enhanced carbon nanotubes electrochemical chiral sensor // Electroanalysis. 2017. V. 29. № 4. P. 955. .https://doi.org/10.1002/elan.201600747
Garcia-Carmona L., Moreno-Guzman M., Sierra T., Gonzalez M.C., Escarpa A. Filtered carbon nanotubes-based electrodes for rapid sensing and monitoring of L-tyrosine in plasma and whole blood samples // Sens. Actuators B. 2018. V. 259. P. 762. https://doi.org/10.1016/j.snb.2017.12.090
Guo Y., Yao R., Wang Z., Zhang Y., Cui M., Zhao Q., Wang H. Novel potential type electrochemical chiral recognition biosensor for amino acid // J. Solid State Electrochem. 2018. V. 22. № 1. P. 41. https://doi.org/10.1007/s10008-017-3719-8
Tao Y., Chu F., Gu X., Kong Y., Lv Y., Deng L. A novel electrochemical chiral sensor for tyrosine isomers based on a coordination-driven self-assembly // Sens. Actuators B. 2018. V. 255. P. 255. https://doi.org/10.1016/j.snb.2017.08.077
Ghoreishi S.M., Behpour M., Jafari N., Golestaneh M. Electrochemical determination of tyrosine in the presence of dopamine and uric acid at the surface of gold nanoparticles modified carbon paste electrode // J. Chin. Chem. Soc. 2012. V. 59. № 8. P. 1015. https://doi.org/10.1002/jccs.201100654
Chitravathi S., Swamy B.E.K., Mamatha G.P., Chandrashekar B.N. Electrocatalytic oxidation of tyrosine at poly(threonine)-film modified carbon paste electrode and its voltammetric determination in real samples // J. Mol. Liquids. 2012. V. 172. P. 130. https://doi.org/10.1016/j.molliq.2012.03.022
D’Souza O.J., Mascarenhas R.J., Satpati A.K., Namboothiri I.N.N., Detriche S., Mekhalif Z., Delhalle J. A multi-walled carbon nanotube/poly-2,6-dichlorophenolindophenol film modified carbon paste electrode for the amperometric determination of L-tyrosine // RSC Adv. 2015. V. 5. № 111. P. 91472. https://doi.org/10.1039/c5ra18329d
Movlaee K., Beitollahi H., Ganjali M.R., Norouzi P. Electrochemical platform for simultaneous determination of levodopa, acetaminophen and tyrosine using a graphene and ferrocene modified carbon paste electrode // Microchim. Acta. 2017. V. 184. № 9. P. 3281. https://doi.org/10.1007/s00604-017-2291-3
Kemmegne-Mbouguen J.C., Ngameni E. Simultaneous quantification of dopamine, acetaminophen and tyrosine at carbon paste electrodes modified with porphyrin and clay // Anal. Methods. 2017. V. 9. № 28. P. 4157. https://doi.org/10.1039/c7ay01173c
Ghoreishi S.M., Malekian M. Curve resolution on overlapped voltammograms for simultaneous determination of tryptophan and tyrosine at carbon paste electrode modified with ZnFe2O4 nanoparticles // J. Electroanal. Chem. 2017. V. 805. P. 1. https://doi.org/10.1016/j.jelechem.2017.09.019
Karami Z., Sheikhshoaie I. rGO/ZnO nanocomposite modified carbon paste electrode as sensor for tyrosine analysis // Anal. Bioanal. Electrochem. 2017. V. 9. № 7. P. 834.
Movlaee K., Beitollahi H., Ganjali M.R., Norouzi P. Strategy for simultaneous determination of droxidopa, acetaminophen and tyrosine using carbon paste electrode modified with graphene and ethyl 2-(4-ferrocenyl-[1,2,3]-triazol-1-yl) acetate // J. Electrochem. Soc. 2017. V. 164. № 6. P. 1407. https://doi.org/10.1149/2.1571706jes
Zhang L.J., Wang G.H., Xiong C., Zheng L., He J.B., Ding Y.S., Lu H.B., Zhang G.B., Cho K., Qiu L.Z. Chirality detection of amino acid enantiomers by organic electrochemical transistor // Biosens. Bioelectron. 2018. V. 105. P. 121. https://doi.org/10.1016/j.bios.2018.01.035
Karimi S., Heydari M. Voltammetric mixure analysis of tyrosine and tryptophan using carbon paste electrode modified by newly synthesized mesoporous silica nanoparticles and clustering of variable-partial least square: efficient strategy for template extraction in mesoporous silica nanoparticle synthesis // Sens. Actuators B. 2018. V. 257. P. 1134. https://doi.org/10.1016/j.snb.2017.11.014
Švancara I., Walcarius A., Kalcher K., Vytřas K. Carbon paste electrodes in the new millennium // Cent. Eur. J. Chem. 2009. V. 7. № 4. P. 598. https://doi.org/10.2478/s11532-009-0097-9
Сидельников А.В., Майстренко В.Н., Зильберг Р.А., Яркаева Ю.А., Хамитов Э.М. Энантиоселективныи вольтамперометрический сенсор для распознавания стереоизомеров пропранолола // Журн. аналит. химии. 2017. Т. 72. № 5. С. 486. (Sidel’nikov A.V., Maistrenko V.N., Zil’berg R.A., Yarkaeva Y.A., Khami-tov E.M. An enantioselective voltammetric sensor for the recognition of propranolol stereoisomers // J. Analyt. Chem. 2017. V. 72. № 5. P. 575.)https://doi.org/10.1134/S1061934817050112
Upadhyay S.S., Kalambate P.K., Srivastava A.K. Enantioselective analysis of moxifloxacin hydrochloride enantiomers with graphene-beta-cyclodextrin-nanocomposite modified carbon paste electrode using adsorptive stripping differential pulse voltammetry // Electrochim. Acta. 2017. V. 248. P. 258. https://doi.org/10.1016/j.electacta.2017.07.141
Wang H.J., Qian D., Xiao X.L., He B., Gao S.Q., Shi H., Liao L.F., Deng J. Enantioselective determination of S-ornidazole by using carbon paste electrode modified with boron-embedded conductive copolymer-polysiloxane-based molecularly imprinted hybrid film // Electrochim. Acta. 2017. V. 246. P. 338. https://doi.org/10.1016/j.electacta.2017.06.064
Zilberg R.A., Maistrenko V.N., Kabirova L.R., Dubrovsky D.I. Selective voltammetric sensors based on composites of chitosan polyelectrolyte complexes with cyclodextrins for the recognition and determination of atenolol enantiomers // Anal. Methods. 2018. V. 10. № 16. P. 1886. https://doi.org/10.1039/c8ay00403j
Liang H., Ling T., Rick J.F., Chou T. Molecularly imprinted electrochemical sensor able to enantioselectivity recognize D and L-tyrosine // Anal. Chim. Acta. 2005. V. 542. № 1. P. 83. https://doi.org/10.1016/j.aca.2005.02.007
Wang Y., Yin X., Shi M., Li W., Zhang L., Kong J. Probing chiral amino acids at subpicomolar level based on bovine serum albumin enantioselective films coupled with silver-enhanced gold nanoparticles // Talanta. 2006. V. 69. № 5. P. 1240. https://doi.org/10.1016/j.talanta.2005.12.060
Terracina J.J., Sharfstein S.T., Bergkvist M. In silico characterization of enantioselective molecularly imprinted binding sites // J. Mol. Recognit. 2017. V. 31. P. e2612.
Bao L., Dai J., Yang L., Ma J., Tao Y., Deng L., Kong Y. Electrochemical recognition of tyrosine enantiomers based on chiral ligand exchange with sodium alginate as the chiral selector // J. Electrochem. Soc. 2015. V. 162. № 7. P. 486. https://doi.org/10.1149/2.0051508jes
Tao Y., Gu X., Yang B., Deng L., Bao L., Kong Y., Chu F., Qin Y. Electrochemical enantioselective recognition in a highly ordered self-assembly framework // Anal. Chem. 2017. V. 89. № 3. P. 1900. https://doi.org/10.1021/acs.analchem.6b04377
Afkhami A., Kafrashi F., Ahmadi M., Madrakian T. A new chiral electrochemical sensor for the enantioselective recognition of naproxen enantiomers using L-cysteine self-assembled over gold nanoparticles on a gold electrode // RSC Adv. 2015. V. 5. № 72. P. 58609. https://doi.org/10.1039/c5ra07396k
Ma J., Yang C., Zhu S., Song J., Fu Y. A new nanomatrix based on functionalized fullerene and porous bimetallic nanoparticles for electrochemical chiral sensing // New J. Chem. 2018. V. 42. № 12. P. 9801. https://doi.org/10.1039/c8nj01599f
Zhang H.M., Xie Z.X., Long L.S., Zhong H.P., Zhao W., Mao B.W., Xu X., Zheng L.S. One-step preparation of large-scale self-assembled monolayers of cyanuric acid and melamine supramolecular species on Au(III) surface // J. Phys. Chem. 2008. V. 112. № 11. P. 4209. https://doi.org/10.1021/jp076916a
Wang Y., Zhou D., Li H., Li R., Zhong Y., Sun X., Sun X. Hydrogen-bonded supercoil self-assembly from achiral molecular components with light-driven supramolecular chirality // J. Mater. Chem. 2014. V. 2. № 31. P. 6402. https://doi.org/10.1039/c4tc00649
Gus’kov V.Y., Sukhareva D.A., Gainullina Y.Y., Hamitov E.M., Galkin Y.G., Maistrenko V.N. Chiral recognition capabilities of melamine and cyanuric acid supramolecular structures // Supramol. Chem. 2018. V. 30. № 11. P. 940. https://doi.org/10.1080/10610278.2018.1489541
Liu M.H., Zhang L., Wang T.Y. Supramolecular chirality in self-assembled systems // Chem. Rev. 2015. V. 115. № 15. P. 7304. https://doi.org/10.1021/cr500671p
Hembury G.A., Borovkov V.V., Inoue Y. Chirality-sensing supramolecular systems // Chem. Rev. 2008. V. 108. № 1. P. 1. https://doi.org/10.1021/cr050005k
Eliel E.L., Wilen S.H., Doyle M.P. Basic Organic Stereochemistry. New York: Wiley, 2001.
Davankov V.A. The nature of chiral recognition: is it a three-point interaction // Chirality. 1997. V. 9. № 2. P. 99. https://doi.org/10.1002/(SICI)1520-636X(1997)9:2<99:: AID-CHIR3>3.0.CO;2-B
Zilberg R.A., Sidelnikov A.V., Maistrenko V.N., Yarkaeva Y.A., Khamitov E.M., Kornilov V.M., Maksutova E.I. A voltammetric sensory system for recognition of propranolol enantiomers based on glassy carbon electrodes modified by polyarylenephthalide composites of melamine and cyanuric acid // Electroanalysis. 2018. V. 30. № 4. P. 619. https://doi.org/10.1002/elan.201700404
Kannappan K., Werblowsky T.L., Rim K.T., Berne B.J., Flynn G.W. An experimental and theoretical study of the formation of nanostructures of self-assembled cyanuric acid through hydrogen bond networks on graphite // J. Phys. Chem. B. 2007. V. 111. № 24. P. 6634. https://doi.org/10.1021/jp0706984
Гуськов В.Ю., Сухарева Д.А., Арсланова И.В., Мусабиров Д.Э. Газохроматографическое разделение энантиомеров 2-хлорбутана и 2-бромбутана на адсорбенте Carboblack C, модифицированном циануровой кислотой // Журн. аналит. химии. 2017. Т. 72. № 10. С. 917. (Gus’kov V.Y., Sukhareva D.A., Arslanova I.V., Musabirov D.E. Gas-chromatographic separation of enantiomers of 2-chlorobutane and 2-bromobutane on a cyanuric acid-modified Carboblack C adsorbent // J. Analyt. Chem. 2017. V. 72. № 10. P. 1089.)https://doi.org/10.1134/S1061934817100069
Zhou J., Chen Q., Wang Y., Han Q., Fu Y. Stereoselectivity of tyrosine enantiomers in electrochemical redox reactions on gold matrices // Electrochim. Acta. 2012. V. 59. P. 45. https://doi.org/10.1016/j.electacta.2011.10.021
Майстренко В.Н., Сапельникова С.В., Кудашева Ф.Х. Концентрирование и вольтамперометрическое определение нитросоединений на модифицированных неподвижными хроматографическими фазами угольно-пастовых электродах // Журн. аналит. химии. 1999. Т. 54. № 5. С. 497. (Maistrenko V.N., Sapel’nikova S.V., Kudasheva F.K. Preconcentration and voltammetric determination of nitro compounds on carbon paste electrodes modified by chromatographic stationary phases // J. Analyt. Chem. 1999. V. 54. № 5. P. 434.)
Schmid N., Eichenberger A.P., Choutko A., Riniker S., Winger M., Mark A.E., Van Gunsteren W.F. Definition and testing of the GROMOS force-field versions 54A7 and 54B7 // Eur. Biophys. J. 2011. V. 40. № 7. P. 843. https://doi.org/10.1007/s00249-011-0700-9
Lindahl E., Hess B., Van der Spoel D. GROMACS 3.0: a package for molecular simulation and trajectory analysis // J. Mol. Mod. 2001. V. 7. № 8. P. 306. https://doi.org/10.1007/s008940100045
Van der Spoel D., Lindahl E., Hess B., Groenhof G., Mark A.E., Berendsen H.J.C. GROMACS: fast, flexible and free // J. Comput. Chem. 2005. V. 26. № 16. P. 1701. https://doi.org/10.1002/jcc.20291
Pronk S., Pall S., Schulz R., Larsson P., Bjelkmar P., Apostolov R., Shirts M.R., Smith J.C., Kasson P.M., Van der Spoel D., Hess B., Lindahl E. GROMACS 4.5: a high-throughput and highly parallel open source molecular simulation toolkit // Bioinformatics. 2013. V. 29. № 7. P. 845. https://doi.org/10.1093/bioinformatics/btt055
Shayakhmetova R.K., Khamitov E.M., Sidelnikov A.V., Maistrenko V.N. Molecular dynamics simulation and density functional theory study of chemisorption of the propranolol optical isomers on the uracil-modified carbon paste electrode // J. Chin. Chem. Soc. 2017. V. 64. № 9. P. 1058. https://doi.org/10.1002/jccs.201700014
Malde A.K., Zuo L., Breeze M., Stroet M., Poger D., Nair P.C., Oostenbrink C., Mark A.E. An automated force field topology builder (ATB) and repository: Version 1.0 // J. Chem. Theory Comput. 2011. V. 7. № 12. P. 4026. https://doi.org/10.1021/ct200196m
Koziara K.B., Stroet M., Malde A.K., Mark A.E. Testing and validation of the automated topology builder (ATB) version 2.0: prediction of hydration free enthalpies // J. Comput.-Aided Mol. Des. 2014. V. 28. № 3. P. 221. https://doi.org/10.1007/s10822-014-9713-7
Elango M., Subramanian V., Sathyamurthy N. Nanoclusters of cyanuric acid // J. Chem. Sci. 2017. V. 129. № 7. P. 873. https://doi.org/10.1007/s12039-017-1259-5
Bard A.J., Faulkner L.R. Electrochemical Methods. Fundamentals and Applications. New York: Wiley, 2004.
Будников Г.К., Евтюгин Г.А., Будникова Ю.Г., Альфонсов В.А. Химически модифицированные электроды с амперометрическим откликом в энантиомерном анализе // Журн. аналит. химии. 2008. Т. 63. № 1. С. 6. (Budnikov G.K., Evtyugin G.A., Budnikova Yu.G., Alfonsov V.A. Chemically modified electrodes with amperometric response in enantioselective analysis// J. Analyt. Chem. 2008. V. 63. № 1. P. 2.)https://doi.org/10.1007/s10809-008-1002-y
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


