Журнал аналитической химии, 2020, T. 75, № 1, стр. 92-96
Свойства нового аналитического реагента 2-гидрокси-3-нитрозонафтальдегида
Н. К. Мадусманова a, *, З. А. Сманова b, **, И. И. Жураев b
a Алмалыкский филиал Ташкентского технического университета имени Ислама Каримова
110111 Ташкентcкая область, Алмалык, ул. Улугбека, Узбекистан
b Национальный университет Узбекистана имени Мирзо Улугбека, химический факультет
700174 Вузгородок, Ташкент, Узбекистан
* E-mail: nazira.imomova@mail.ru
** E-mail: Smanova.chem@mail.ru
Поступила в редакцию 06.07.2018
После доработки 16.09.2018
Принята к публикации 04.04.2019
Аннотация
Синтезировано новое нитрозопроизводное β-нафтола. Изучено его строение методами ПМР- и ИК-спектроскопии. Показана возможность его использования для иммобилизации на волокнистых носителях и применения в качестве специфического аналитического реагента для определения ионов металлов, в частности, ионов кобальта(II). Максимум светопоглощения реагента 490 нм, комплекса с ионами кобальта –690 нм. Предложена методика определения кобальта(II) в сточных водах.
В последнее время особую актуальность приобретает задача экспрессного определения ионов тяжелых и токсичных металлов, которую достаточно просто и успешно можно решить оптическими методами с использованием органических реагентов, иммобилизованных на полимерных сорбентах [1–3]. Многокомпонентность объектов анализа, низкие концентрации загрязнителей-металлов обусловливают необходимость использования комбинированных методов анализа, включающих стадию концентрирования. Сорбционно-фотометрический метод анализа – один из перспективных методов определения металлов в сложных по природе объектах – позволяет совмещать концентрирование металлов с последующим их определением на твердой матрице [4]. Этот прием был использован в данной работе для определения ионов кобальта.
Цель данной работы – целенаправленный синтез нового органического реагента на основе производных нитрозонафтолов, иммобилизация его на волокнистых носителях и улучшение таким образом метрологических характеристик оптических методик определения кобальта, а также разработка методики определения кобальта в природных объектах и промышленных материалах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы, реагенты, сорбенты. Стандартные растворы металлов готовили растворением металлов х. ч. в разбавленных 1 : 1 кислотах с последующим разбавлением бидистиллированной водой [5].
Методика синтеза органического реагента 2-гидрокси-3-нитрозонафтальдегида приведена в [6]; 0.1 М HCl приготовили по [5].
Серию буферных растворов готовили из 1 М растворов CH3COOH, НСI, NaOH, NH3, CH3COONa [7].
Иммобилизацию проводили перемешиванием 50–100 мг сорбента СМА-1 с 5–10 мл раствора реагента с концентрацией 1 × 10–4 М в течение 1–10 мин с последующим промыванием носителей бидистиллированной водой. Иммобилизованный носитель хранили в чашках Петри во влажном состоянии. Влияние рН, концентрации металла, состава буферной смеси, содержания реагента в твердой фазе изучали при скорости потока 5 мл/мин.
Содержание реагента на носителе определяли спектрофотометрически по изменению светопоглощения растворов до и после иммобилизации при 490 нм.
Аппаратура. Электронные спектры поглощения и отражения получали на двухлучевом регистрирующем спектрофотометре UV-Vis SPECORD M-40, оснащенном приставкой диффузного отражения. Инфракрасные спектры реагентов, носителей и иммобилизованных органических реагентов регистрировали на спектрометре Avatar sustem 360 FT-IR (Nikolet, США) с применением методики прессования образцов с бромидом калия. Для точного определения температуры плавления и уточнения агрегатного состояния при превращении комплексов использовали прибор ТУ-25. рН-растворов контролировали на потенциометре И-130. ПМР-спектры синтезированного реагента регистрировали на спектрометре ЯМР типа XL-100 Varian с рабочей частотой 100 МГц в режиме непрерывного прохождения при 34°С. В качестве репера для отсчета химических сдвигов использовали сигнал растворителя (ацетон, 2.04 м. д).
Методика иммобилизации. Носители СМА-1 использовали в форме дисков диаметром 2 см и массой 20–50 мг. Диски промывали 50 мл 0.1 М НCl, затем 10 мл ацетона, далее погружали их на 4–10 мин в стаканы с 10 мл раствора органического реагента с концентрацией 1.0 × 10–5–1.0 × 10–2 М, промывали 50 мл дистиллированной воды и хранили во влажном состоянии в чашках Петри. Влияние рН, концентрации металла, буферной смеси и содержания реагента в твердой фазе изучали при скорости потока раствора 10 мл/мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
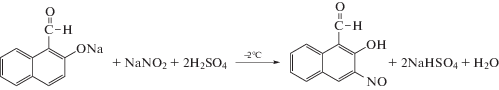
Синтезировали новое производное нитрозонафтолов по аналогии с полученным в работе [8]. Синтез реагента схематично можно описать следующим образом:
Реакция протекала при –2°С в течение 2 ч. Выход продукта составил 62% от теоретического. Полученное вещество имеет коричневый цвет и плавится при 108°С, а при 143°С и выше полностью разлагается. Хорошо растворяется в спиртах и эфирах.
Структура синтезированного реагента доказана данными ИК- и ПМР-спектроскопии.
Изучение ИК-спектров реагента 2-гидрокси-3-нитрозонафтальдегида показало, что в области νС=O = 3023.64–2886.82 см–1; νс=c = 1585.46–1644.83 cм–1; νN=O = 1464.84–1621.56 см–1; νС–N = = 1070.65 cм–1 – проявляются валентные колебания, характерные для групп СО, ароматической С=С, N=O, интенсивная полоса группы C–N соответственно. Также наблюдаются колебания, характерные для ароматических оксимов в области ν = 1644.83 см–1; при 875, 765 см–1 – колебания С–Н связей 1,2,4-замещенных ароматических ядер и полосы νСН = 3003.64–3062 см–1, характерные для аренов [9–11].
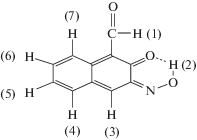
В ПМР-спектре 2-гидрокси-3-нитрозонафтальдегида наблюдали 7 сигналов протонов (м. д) 10.3 (1), 11.8 (2), 5.3 (3), 7.6 (4), 5.75 (5), 7.9 (6), 5.85 (7), которые пронумерованы следующим образом:
Индивидуальность вещества доказана методом тонкослойной хроматографии на пластинке Силуфол в системе этиловый спирт‒ацетон (2 : 1): Rf = 0.67 соответствует монооксиму 2-гидрокси-3-нитрозо-1-нафтальдегида нафтохинона и Rf = 0.58 ‒ непрореагировавшему 2-гидрокси-1-нафтальдегиду.
Синтезированный реагент 2-гидрокси-3-нитрозонафтальдегид взаимодействуют с ионами железа(II, III), меди, кобальта, никеля и хрома. Высокие коэффициенты распределения при оптимизированных условиях сорбции позволяют провести эффективное предварительное концентрирование и выделение следовых количеств определяемых элементов в нейтральной среде.
Иммобилизовали реагент на полимерный волокнистый сорбент – модифицированный гексаметилендиамином и имеющий сильноосновные анионообменные группы (СМА-1). Сорбент СМА-1 представляет собой полимер на основе полиакрилонитрила (промышленное название “нитрон”). Обработкой нитрона гексаметилендиамином получено волокно, содержащее как слабоосновные, так и сильноосновные функциональные группы [12, 13]. Диамины при этом одновременно выполняют функции сшивающего агента и модификатора нитрильных групп. Исходя из результатов потенциометрического титрования и ИК-спектров, фрагмент молекулы СМА-1 можно представить следующим образом [14]:
Волокнистые анионообменные полимерные материалы на основе полиакрилонитрила, иммобилизованные органическим реагентом, при контакте с ионами кобальта в растворе образуют окрашенные комплексы в полимерной фазе. Носитель с иммобилизованным реагентом имеет желтый цвет, после пропускания через диски носителя раствора металла цвет изменяется на буровато-зеленый.
Иммобилизацию комплексов на исследуемых сорбентах проводили из водных растворов в статическом режиме [15]. Количество иммобилизованного реагента определяли по его остаточной концентрации в промывных водах фотометрическим методом на приборе КФК-3 (рис. 1).
Рис. 1.
Спектры светопоглощения органического реагента до (1) и после (2) иммобилизации на волокно СМА-1, а также комплекса с кобальтом(II) (3).
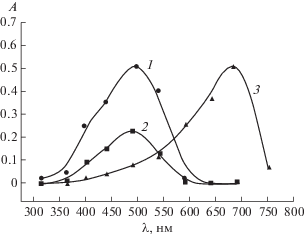
Сравнение спектров иммобилизованного реагента и исходного органического реагента показало, что функционально-аналитические группы, ответственные за комплексообразование в иммобилизованном и нативном реагентах, аналогичны, что указывает на то, что структура реагента сохраняется и в иммобилизованном состоянии (табл. 1).
Таблица 1.
Характеристические частоты и их отнесение в ИК-спектрах реагента и комплекса (см–1)
| Соединение | ν–СOH | ν–N=О | ν–ОH | ν–CN | ν–О–Со |
|---|---|---|---|---|---|
| Реагент | 1085 | 1640 | 3281 | 1628 | – |
| Иммобилизованный реагент | 1226 | 1643 | 3279 | 1630 | – |
| Комплекс | 1212 | 1600 | 3391 | 1632 | 598 |
Сопоставление ИК-спектров комплекса со спектром органического реагента показало, что в спектре комплекса имеется полоса при 598 см–1, отсутствующая в ИК-спектре реагента. Согласно данным [9] она отнесена к валентным колебаниям связи –О–Ме.
Изучено влияние сопутствующих ионов металлов, взаимодействующих с синтезированным реагентом (табл. 2). Видно, что определению кобальта(II) мешают ионы Fe(III), Ni(II), Cu(II) и Cr(III). Мешающее влияние железа меди и хрома устраняют введением фторид ионов, комплекс ионов никеля с иммобилизованным реагентом поглощает свет при 620 нм.
Таблица 2.
Результаты определения ионов кобальта(II) в присутствии посторонних ионов (${{c}_{{{\text{C}}{{{\text{o}}}^{{2 + }}}}}}$ = 30.0 мкг/мл, [Х] – посторонний металл, рН 5.6, n = 3, P = 0.95)
| [Х] | Со2+ : [Х] | Найдено металла, мкг | sr, % |
|---|---|---|---|
| Fe3+ | 1 : 1 | 27.33 | 8.9 |
| Сu2+ | 1 : 1 | 29.12 | 4.2 |
| 1 : 100 | 28.76 | 5.5 | |
| Mn 2+ | 1 : 1 | 29.85 | 0.5 |
| 1 : 500 | 28.60 | 4.7 | |
| Mg2+ | 1 : 1 | 30.02 | 0.09 |
| 1 : 100 | 30.20 | 0.6 | |
| Ca2+ | 1 : 1 | 29.98 | 0.1 |
| 1 : 500 | 29.88 | 0.4 | |
| Cd2+ | 1 : 100 | 29.94 | 0.2 |
| 1 : 500 | 29.86 | 0.5 | |
| Cr3+ | 1 : 100 | 29.00 | 3.4 |
| Zn2+ | 1 : 10 | 29.64 | 1.2 |
| Pb2+ | 1 : 10 | 29.64 | 1.2 |
| 1 : 500 | 29.45 | 1.9 |
Сорбционно-спектроскопический метод определения кобальта применили к анализу модельных смесей (табл. 3) и реальных образцов вод (табл. 4). Как видно, cорбционно-спектроскопическое определение кобальта в модельных смесях с использованием иммобилизованных реагентов дает удовлетворительные результаты: относительное стандартное отклонение (sr), не превышает 0.10, что свидетельствует о правильности и хорошей воспроизводимости разработанной методики.
Таблица 3.
Результаты (мг/л) определения кобальта в модельных растворах по разработанной методике (n = 5, P = 0.95)
| Введено | Найдено | s | sr |
|---|---|---|---|
| 5.00 | 4.87 | 0.08 | 0.016 |
| 10.00 | 9.92 | 0.06 | 0.006 |
| 15.00 | 14.96 | 0.05 | 0.003 |
| 20.00 | 19.94 | 0.05 | 0.003 |
Таблица 4.
Результаты (%) определения кобальта в реальных образцах вод ИМОР (n = 5, P = 0.95)
| Объект анализа | ГОСТ* | Разработанная методика | ||
|---|---|---|---|---|
| найдено | sr | найдено | sr | |
| Ташкент ТТС № 518 | 1.25 | 0.036 | 1.20 | 0.044 |
| Ангрен П-2 | 3.75 | 0.044 | 3.64 | 0.046 |
| Ахангаран П-42 | 1.76 | 0.024 | 1.62 | 0.036 |
| Северный Сурхандарья | 1.22 | 0.018 | 1.16 | 0.050 |
| Китаб-Шахрисабз | 1.18 | 0.032 | 1.14 | 0.024 |
Методика определения кобальта в водах. В мерную колбу емк. 50 мл вводили раствор пробы, содержащей 2–50 мкг металла, добавляли буферный раствор с определенным рН, 1.0 мл маскирующей смеси и пропускали через иммобилизованный реагент на носителе. Содержание металла определяли по градуировочному графику, построенному в координатах коэффициент отражения–концентрация, F = f(с).
* * *
Таким образом, высокая избирательность синтезированного реагента к иону кобальта(II), простота и скорость концентрирования в сочетании с инструментальными методами определения без десорбции металла прямо на поверхности твердого волокнистого сорбента обусловливают экспрессность анализа и возможность использования методики в практике химического анализа при определении ионов кобальта в различных объектах.
Список литературы
Запорожец О.А., Сухан В.В. Иммобилизация аналитических реагентов на поверхности носителей // Успехи химии. 1997. Т. 66. № 7. С. 702.
Саввин С.Б. Модифицированные и иммобилизованные органические реагенты // Журн. аналит. химии. 1996. Т. 51. № 1. С. 49. (Savin S.B. The modified and immobilized organic reagents // J. Analyt. Chem. 1996. V. 51. № 1. P. 49.)
Кочигин О.В. Исследование полимерных хелатных сорбентов // Журн. аналит. химии. 2006. Т. 61. № 2. С. 120. (Kochigin O.V. Research of polymeric helatny sorbents // J. Analyt. Chem. 2006. V. 61. № 2. P. 120).
Моросанова Е.И., Великородный А.А., Никулин И.В. // Ксерогели, модифицированные 1-(2-пиридилазо)-2-нафтолом и ксиленоловым оранжевым. Индикаторные трубки для определения меди(II) и железа(III) в растворах // Журн. аналит. химии. 2000. Т. 55. № 5. С. 539. (Morosanova E.I., Velikorodniy A.A., Nikulin I.V. Xerogels modified 1-(2-pyridylazo)-2-naphthol and xylenol orange Indicator tubec for the determination of copper(II) and iron(III) in solutions // J. Analyt. Chem. 2000. V. 55. № 5. P. 539.)
Коростылев П.П. Приготовление растворов. М.: Мир, 1962. С. 203.
Nurmukhammadov J., Tojmukhamedov H., Inatova M.S. Synthesis new nitrosonaphtols and their application / Analytical Chemistry. The Advanced Science Open Access Journal № 312 // Chem. Eng. 2013. V. 13-18. P. 32.
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1979. 480 с.
Климакова Я.И., Шпенель И., Беляев И.В. Селективные методы синтеза орто, нитро и нитрозофенолов. М.: Мир, 1990. С. 112.
Накамото К. Инфракрасные спектры неорганических и координационных соединений. М.: Мир, 1966. С. 198.
Казицина Л.А., Куплетская Н.Б. Применение УФ-, ИК-, ЯМР-спектроскопии в органической химии. М.: Высшая школа, 1971. С. 214.
Беллами Л. Новые данные по ИК-спектрам сложных молекул. М.: Мир, 1971. 318 с.
Гафурова Д.А., Хакимжонов Б.Ш., Мухамедиев М.Г., Мусаев У.Н. Синтез ионообменных материалов на основе нитрона и их применение // Вестн. ТашГУ. 1999. № 2. С. 27.
Мусаев У.Н., Мухамедиев М.Г., Икрамова М.Э. Синтез модифицированных сорбентов на основе полиакрилонитрильных волокон // Науч. Вестн. НамГУ. 2001. № 2. С. 117.
Гафурова Д.А. Химические превращения полиакрилонитрильных волокон с азотсодержащими основаниями. Автореф. дис. … канд. хим. наук. Ташкент, 2002. 22 с.
Сманова З.А. Геворгян А.М. Иммобилизованные органические реагенты для определения свинца // Узб. хим. журн. 2008. № 2. С. 48.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии