Журнал аналитической химии, 2020, T. 75, № 1, стр. 55-66
Особенности газохроматографического анализа проб в высококипящих растворителях с использованием капиллярных колонок при малом делении потока газа-носителя
И. Г. Зенкевич a, *, Е. Лелеев a
a Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Университетский просп., 26, Россия
* E-mail: izenkevich@yandex.ru
Поступила в редакцию 18.09.2018
После доработки 25.10.2018
Принята к публикации 16.07.2019
Аннотация
Газохроматографический анализ проб в высококипящих полярных органических растворителях характеризуется рядом особенностей. Во-первых, степень разделения компонентов зависит от температуры испарителя (Тисп), которая не должна быть ниже температуры кипения растворителя (Ткип). Во-вторых, индексы удерживания компонентов, элюируемых до зоны полярного растворителя, несколько завышены по сравнению с индексами удерживания компонентов, элюируемых после этой зоны. И, в-третьих, для таких проб проявляются так называемые “эффекты дискриминации”, прежде всего, зависимость абсолютных площадей пиков компонентов от Тисп. Подтверждено, что такая зависимость не влияет на результаты количественного анализа методом внутренней нормализации. Тем не менее, желателен дополнительный контроль возможностей применения этого и других методов, а необходимость выполнения условия Тисп ≥ Ткип – проверки термической стабильности и взаимной совместимости компонентов анализируемых образцов. Указанные особенности установлены в результате анализа как растворов модельных аналитов в 1,3-бутандиоле (Ткип = 207°С), так и реального образца пищевого ароматизатора, представляющего собой раствор сложной смеси компонентов в дипропиленгликоле (Ткип 222–236°С). Причиной отмеченных эффектов являются замедление процесса испарения образцов и динамическая модификация неподвижной фазы хроматографической колонки высококипящими полярными растворителями.
Самый распространенный способ дозирования проб в газовой хроматографии предполагает использование растворов в относительно низкокипящих органических жидкостях [1]. Сравнение свойств нескольких наиболее часто применяемых растворителей [2] показывает, что их температуры кипения соответствуют диапазону приблизительно 40–80°С, а газохроматографические индексы удерживания на стандартных неполярных полидиметилсилоксановых неподвижных фазах составляют ∼400–600. Все такие растворители представляют собой подвижные жидкости с динамическими вязкостями (η, 20°С) приблизительно от 0.2 до 2.0 сантипуаз (сП) и невысокими удельными теплотами испарения. Именно малая вязкость растворителей представляется главным условием точности и воспроизводимости дозирования проб стандартными микрошприцами объемом 1 и 10 мкл.
Однако в хроматографической практике время от времени требуется определение компонентов растворов в высококипящих растворителях. Такой вариант длительное время считали встречающимся достаточно редко, поэтому его особенности не рассмотрены в современных руководствах (см., например, [1, 3–5]). Это требуется, в частности, при хроматографическом определении содержания воды в жидкостях [6] [например, в диметилформамиде (Ткип 152–153°С, η = 0.92 сП при 20°С)] или примесей в пропиленкарбонате [Ткип = 242°С, η = 2.5 сП при 20°С)] [7, 8] как потенциальном электролите для химических источников тока. Отличительной особенностью некоторых полярных растворителей (в том числе многоатомных спиртов и их производных) оказывается высокая вязкость, что может снижать воспроизводимость отбора проб и их дозирования. Например, вязкость даже простейшего представителя диалкилфталатов – диметилфталата – на порядок превышает указанный выше диапазон значений η (Ткип 283–284°С, η = 13.8 сП при 25°С, 17 сП при 20°С) [9]. Сильно зависящая от температуры вязкость следующих гомологов этого ряда существенно выше: ~47 сП у дибутилфталата и ∼80 сП у бис(2-этилгексил)фталата (20°С). Полярные высококипящие растворители применяют при производстве пищевых и косметических ароматических композиций, требующих контроля их состава. Чаще всего используют нетоксичные (в отличие от этиленгликоля) пропиленгликоль [Ткип 186−188°С, вязкость ~40−43 сП (25°С), 57.6 сП (20°С)], дипропиленгликоль [Tкип = = 232°C, вязкость ~75 сП (25°С), 84–98 сП (20°С)], трипропиленгликоль [Ткип = 265°С, вязкость ~ 57 сП (25°С)] и др. Известны примеры определения примесей в этиленгликоле [10] и этиленгликоля в пропиленгликоле [11] путем их прямого дозирования в капиллярные колонки.
В табл. 1 сопоставлены физико-химические и хроматографические свойства некоторых высококипящих вязких полярных гликолей. Диапазон их Ткип составляет 185–245°С, а значений вязкости – 16–98 сП. Дозирование обычным шприцем глицерина с η порядка (1–1.5) × 103 сП, по-видимому, следует признать невозможным. Хроматографические пики таких растворителей в условиях массовой перегрузки колонки маскируют значительные участки хроматограмм (область RI ∼650–1050), что мешает детектированию многих целевых аналитов. По этой причине для определения летучих компонентов в высококипящих растворителях иногда рекомендуют такой прием, как обратная продувка [16–19]. После элюирования целевых компонентов направление потока газа-носителя заменяют обратным с целью элюирования высококипящих растворителей в противоположном направлении.
Таблица 1.
Физико-химические и хроматографические свойства некоторых высококипящих вязких полярных гликолей
| Соединение | Мол. масса, Да | Ткип, °С | Динамическая вязкость, η (Т, °С), сП |
RIнеполярн ± sRI |
|---|---|---|---|---|
| Этиленгликоль | 62 | 197 | 16.2 (25°С) [12] | 672 ± 14 |
| 1,2-Пропандиол | 76 | 186−188 | 57.6 (20°С) [12–15] | 760 ± 17 |
| 1,3-Пропандиол | 76 | 214 | 41 (25°С) | 812 ± 16 |
| 1,2-Бутандиол | 90 | 193 | 37.2 (30°С) [15] | 860 ± 20 |
| 1,3-Бутандиол | 90 | 207 | 98.3 (25°С) [12] | 880 ± 31 |
| 1,4-Бутандиол | 90 | 228−235 | 84.9 (25°С) [15] | 916 ±12 |
| Диэтиленгликоль | 106 | 244−246 | 30.2 (25°С) [12] | 936 ± 12 |
| Дипропиленгликоль* | 134 | 222−236 | 75 (25°С) 84−98 (20°С) [14] | 1012 ± 12 |
| 1039 ± 9 | ||||
| 1056 ± 20 | ||||
| Глицерин (для сравнения) | 92 | 290 | 940−1490 [12] | 1196 ± 28 |
Если содержание целевых аналитов не слишком мало, то при анализе вязких образцов их можно растворять в менее вязких летучих растворителях. Этот способ использован, например, при определении примесей в триэтиленгликоле [20].
Перечисленные выше особенности не исчерпывают проблем, связанных с дозированием проб в высококипящих растворителях. Попадание их относительно больших количеств в хроматографические колонки (динамическая модификация неподвижной фазы) может вызывать дополнительное размывание хроматографических зон отдельных аналитов и, следовательно, снижать эффективность их разделения и влиять на их индексы удерживания. И, наконец, известно, что дозирование проб в капиллярные колонки с делением потока может осложняться так называемыми “эффектами дискриминации” [2, 21], проявления которых могут оказаться весьма “неожиданными”. Такие эффекты достаточно подробно охарактеризованы для образцов, содержащих низкокипящие растворители, тогда как особенности высококипящих растворителей изучены хуже. Между тем, такие сведения необходимы для лучшего понимания сути эффектов дискриминации и выявления возможных способов их нивелирования или компенсации.
Настоящая работа посвящена характеристике особенностей газохроматографического анализа проб в высококипящих вязких растворителях (на примерах модельных растворов в 1,3-бутандиоле и реального образца в дипропиленгликоле), в том числе эффектов дискриминации, проявляющихся в виде зависимостей площадей пиков компонентов от температуры испарителя. Использована короткая капиллярная колонка большого диаметра (типа Megabore) при малых величинах деления потока, то есть условия, в которых по данным [2] эффекты дискриминации выражены в наибольшей степени.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление растворов модельных соединений. Для характеристики эффектов дискриминации выбрали пять компонентов (все квалификации х. ч., для хроматографии) с индексами удерживания на стандартных неполярных полидиметилсилоксановых фазах в интервале ~800–1050, перечисленных в табл. 2 в порядке их элюирования.
Таблица 2.
Физико-химические и хроматографические свойства компонентов модельных растворов (в порядке элюирования), выбранных для характеристики эффектов дискриминации
| Соединение | Ткип, °С | Относительная плотность | RIнеполярн ± sRI | Концентрация в модельных растворах, мкг/мкл |
|---|---|---|---|---|
| Бутилацетат | 126 | 0.878 | 796 ± 3 | 19.5 |
| Циклогексанон | 156 | 0.948 | 871 ±7 | 21.1 |
| Анизол | 154 | 0.995 | 902 ± 6 | 22.1 |
| Бутилбутират | 166 | 0.870 | 978 ± 3 | 19.3 |
| Ацетофенон | 202 | 1.028 | 1042 ± 9 | 22.8 |
Растворы выбранных компонентов в 2-пропаноле (х. ч.) и 1,3-бутандиоле (х. ч., использовали без дополнительной очистки) готовили дозированием 50 мкл каждого из них в 2 мл растворителя во флаконах емк. 10 мл. Для вычисления приведенных в табл. 2 массо-объемных концентраций компонентов использовали справочные значения их относительных плотностей при 20°С.
Образец пищевого ароматизатора на основе дипропиленгликоля предоставлен фирмой “Scentsel Ltd.” (Тель-Авив, Израиль).
Газохроматографический анализ образцов проводили на хроматографе Кристалл 5000.2 с пламенно-ионизационным детектором с использованием кварцевой капиллярной колонки (типа Megabore) с неподвижной фазой ВРХ-1 длиной 10 м, внутренним диаметром 0.53 мм и толщиной пленки неподвижной фазы 2.65 мкм. Температурный режим: линейное программирование температуры от 80 до 220°С со скоростью 5 град/мин. Газ-носитель – азот, объемная скорость 4.9 мл/мин (линейная скорость 42.4 см/с), деление потока 3 : 1. Температуру испарителя варьировали от 120 до 240°С. Для дозирования использовали микрошприц МШ-10, объем проб 0.4 мкл, число параллельных дозирований каждого из образцов в каждом из режимов не менее трех. Дозируемые количества всех аналитов при выбранном делении потока не превышали ранее установленной границы массовой перегрузки используемой колонки (17 ± 4 мкг) [22]. Количество же растворителя в пробах (~100 мкг с учетом деления потока) значительно превышало предел массовой перегрузки используемой колонки, что объясняет существенное уширение пиков и их асимметрию.
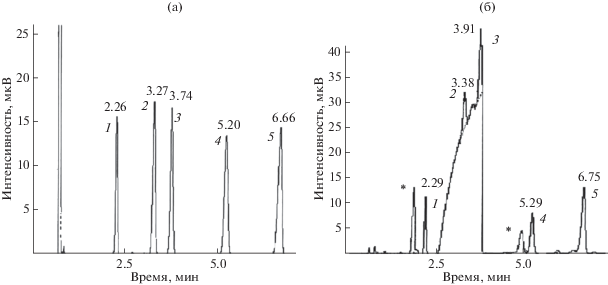
Низкокипящий растворитель (2-пропанол, RI 489 ± 11) не мешает определению всех компонентов образцов. Высококипящий 1,3-бутандиол выходит из колонки широкой зоной в области RI 880 ± 30 и перекрывается с пиками циклогексанона и анизола (табл. 2), что снижает точность определения площадей их пиков. Такой выбор обусловлен тем, что подобное перекрывание весьма вероятно при анализе реальных образцов, содержащих дипропиленгликоль с RI ∼1010–1080. Типичные хроматограммы растворов одних и тех же модельных компонентов в 2-пропаноле и 1,3-бутандиоле приведены на рис. 1. В случае 1,3-бутандиола на хроматограммах дополнительно регистрируются сигналы примесей в 1,3-бутандиоле (основные из них обозначены символом “*”).
Рис. 1.
Типичные хроматограммы растворов модельных компонентов в 2-пропаноле (а) и 1,3-бутандиоле (б). Цифрами обозначены характеризуемые аналиты: 1 – бутилацетат, 2 – циклогексанон, 3 – анизол, 4 − бутилбутират, 5 − ацетофенон; компоненты 2 и 3 перекрываются с пиком 1,3-бутандиола. Звездочками на хроматограмме (б) обозначены пики примесей в 1.3-бутандиоле. Над пиками указаны их времена удерживания (мин).
Хромато-масс-спектрометрический анализ образца пищевого ароматизатора с запахом персика проводили на хромато-масс-спектрометре Shimadzu QP 2010 SE с ИЭ на колонке RTX-5 MS (полидиметилсилоксан, содержащий 5% фенильных групп) длиной 30 м, внутренним диаметром 0.32 мм и толщиной пленки неподвижной фазы 0.25 мкм. Режим анализа: программирование температуры от 80 до 200°С со скоростью 5 град/мин, температура испарителя 240°С, газ-носитель гелий, расход 1.84 мл/мин (линейная скорость 49 см/с), деление потока 1 : 10, объем дозируемых проб 0.5 мкл. Температуры интерфейса и источника ионов 240°С.
Обработка результатов. Статистическую обработку площадей пиков и вычисление их отношений проводили с использованием программного обеспечения Excel (Microsoft Office 2010). Для вычисления параметров регрессионных уравнений и построения графиков дополнительно применяли программное обеспечение Origin (версия 4.1). В качестве источников информации по газохроматографическим индексам удерживания на стандартных неполярных полидиметилсилоксановых неподвижных фазах и соответственно предсказания порядка элюирования компонентов использовали базу данных [23] (версия 2017 г.). Площади пиков интегрировали в стандартном автоматическом режиме; для перекрывающихся с пиками 1,3-бутандиола и дипропиленгликоля компонентов разметку зон интегрирования проводили вручную.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Зависимость эффективности разделения от температуры испарителя. Для характеристики указанной зависимости использовали модельный образец, представляющий собой раствор пяти компонентов (см. табл. 2) в 1,3-бутандиоле (Ткип = = 207°С).
При дозировании в хроматограф проб в низкокипящих органических растворителях условие Тисп$ \gg $ Ткип выполняется практически всегда. В таких условиях их перевод из конденсированной фазы в газовую требует минимального времени и не сказывается на эффективности разделения компонентов проб. Термин “высококипящие растворители” соответствует условию Тисп ~ Ткип, а иногда и Тисп < Ткип. В этом случае испарение проб закономерно требует большего времени, в течение которого присутствие жидкой фазы в испарителе приводит к уширению хроматографических зон целевых аналитов и в итоге к снижению эффективности разделения некоторых из них. Кроме того, попадание относительно больших количеств полярных высококипящих компонентов в колонку может приводить к так называемой “динамической модификации’ неподвижной фазы, что также вызывает уширение хроматографических пиков и влияет на индексы удерживания отдельных аналитов.
Поскольку “традиционная” оценка эффективности разделения числом теоретических тарелок некорректна в режиме программирования температуры, целесообразно использовать степень разделения (R) двух соседних пиков компонентов с минимальными временами удерживания, например, примеси 1,3-бутандиола со временем удерживания tR ∼2.0 мин11 и бутилацетата с tR ~2.3 мин (см. рис. 1). Из нескольких известных эквивалентных соотношений для оценки R (отличаются величинами коэффициента k) используем то (k = 1.18), определение которого автоматически предусмотрено в программном обеспечении “ХромаТек”:
(1)
$R{\text{ }} \approx {\text{ }}k[{{t}_{{{\text{R}}\left( {\text{2}} \right)}}}--{{t}_{{{\text{R}}\left( {\text{1}} \right)}}}\left] / \right[{{w}_{{0.{\text{5}}\left( {\text{1}} \right)}}} + {{w}_{{0.{\text{5}}\left( {\text{2}} \right)}}}],$Сравнение значений R при разных температурах испарителя подтверждает существование отчетливо выраженной зависимости R от Тисп:
График нелинейной возрастающей зависимости R(Tисп) приведен на рис. 2а. Можно полагать, что значения R не увеличиваются неограниченно, а при гипотетическом увеличении Тисп → ∞ стремятся к некоторой предельной величине lim(R). Зависимость R(Tисп) с приемлемой точностью может быть аппроксимирована полиномами второй или третьей степени, однако такие аппроксимации не имеют пределов. Для оценки предельного значения lim(R(Tисп → ∞) при неизвестном виде функциональной зависимости R(T) целесообразно воспользоваться рекуррентной аппроксимацией функции эквидистантных значений аргумента [24, 25]:
Рис. 2.
(а): Нелинейная зависимость степени разделения (R) (средние значения по трем определениям) двух компонентов раствора модельных компонентов в 1,3-бутандиоле от температуры испарителя. (б): Близкая к линейной рекуррентная зависимость R(T + 30°C) = aR(T) + b для вычисления предельного значения lim(R) при гипотетическом условии Т → ∞. Параметры линейной зависимости (б): а = 0.59 ± 0.04, b = 1.14 ± 0.08, R = 0.996, S0= 0.03, limR(T) = 2.8.

График рекуррентной зависимости (2) представлен на рис. 2б; в подписи к рисунку приведены параметры уравнения линейной регрессии. Если коэффициент а зависимости (2) удовлетворяет условию а < 1, то существует предельное значение функции, равное limR(T) = b/(1 – a) [24, 25]. В данном случае limR = 1.14/(1 – 0.59) ≈ 2.8. Таким образом, значения R при температурах испарителя 210 и 240°С (2.5 и 2.6, соответственно) достаточно близки к предельному значению и, следовательно, дальнейшее увеличение Tисп не требуется. Так как Ткип 1,3-бутандиола составляет 207°С, то условие Тисп > Ткип выполнено.
Особенности проявления эффектов дискриминации. Газохроматографический анализ образцов в высококипящих растворителях предполагает варьирование температуры испарителя. В таких условиях возможны “неожиданные” проявления эффектов дискриминации состава проб при их дозировании в капиллярные колонки с делением потока газа-носителя, а именно влияние температуры испарителя S(T) на площади хроматографических пиков [2, 21]. При решении различных задач можно рассматривать как зависимость абсолютных площадей пиков от температуры испарителя (критерий I), так и аналогичную зависимость относительных площадей пиков одних и тех же компонентов в разных растворителях (критерий II). При этом должно соблюдаться следующее условие: относительные площади пиков разных компонентов в одних и тех же растворителях не должны существенно зависеть от температуры испарителя (критерий III). Иными словами, эффекты дискриминации не должны влиять на результаты обработки площадей пиков компонентов в разных растворителях способом внутренней нормализации. Абсолютные значения площадей пиков всех компонентов растворов в двух растворителях при пяти температурах испарителя приведены в табл. 3.
Таблица 3.
Зависимость площадей пиков (S × 10–3, мВ мс, средние значения по трем определениям) компонентов модельных растворов в разных растворителях (I – 2-пропанол, II – 1,3-бутандиол) от температуры испарителя
| Компонент | Растворитель | Температура испарителя, °С | а* | r* | ||||
|---|---|---|---|---|---|---|---|---|
| 120 | 150 | 180 | 210 | 240 | ||||
| Бутилацетат | I | 45.3 | 56.7 | 66.5 | 66.1** | 61.9 | 0.35 ±0.02 | 0.999 |
| II | 33.3 | 37.1 | 40.5 | 40.0 | 39.7 | 0.12 ±0.00 | 0.999 | |
| Циклогексанон | I | 42.2 | 75.5 | 93.5 | 98.4 | 93.1 | 0.86 ±0.15 | 0.986 |
| II | 37.5 | – | 40.1 | 39.6 | 40.9 | 0.03 ±0.01 | 0.924 | |
| Анизол | I | 68.2 | 84.5 | 97.9 | 96.5 | 90.7 | 0.50 ±0.03 | 0.998 |
| II | 39.8 | 45.4 | 51.6 | 69.2 | 76.1 | 0.32 ± 0.04 | 0.978 | |
| Бутилбутират | I | 66.6 | 82.2 | 101.9 | 106.8 | 101.1 | 0.47 ± 0.07 | 0.997 |
| II | 41.2 | 46.2 | 50.3 | 53.4 | 53.8 | 0.11 ± 0.02 | 0.965 | |
| Ацетофенон | I | 75.2 | 90.4 | 117.3 | 126.0 | 121.4 | 0.50 ±0.08 | 0.983 |
| II | 70.5 | 78.8 | 78.1 | 87.5 | 101.4 | 0.24 ± 0.05 | 0.945 | |
Во многих случаях зависимости S(T) можно аппроксимировать уравнением линейной регрессии, S = аТ + b. Однако детали такой аппроксимации могут отличаться для разных компонентов в разных растворителях. Типичные примеры графиков подобных зависимостей приведены на рис. 3. Так, для растворов первых трех компонентов (бутилацетат, циклогексанон и анизол) в 2-пропаноле (Ткип = 82.3°С) они линейны в ограниченном интервале температур испарителя (120–180°С), но для двух остальных (бутилбутират и ацетофенон) линейность наблюдается уже в более широком интервале температур (120−210°С). В случае 1,3-бутандиола (Ткип = 207°С) для бутилацетата линейность ограничена интервалом 120–180°С, тогда как для остальных компонентов зависимость S(T) в первом приближении можно считать линейной во всем диапазоне 120–240°С.
Рис. 3.
Зависимости площадей пиков некоторых аналитов от температуры испарителя (S = аТ + b), обусловленные эффектами дискриминации: (а) − бутилацетат, растворитель 2-пропанол; (б) − ацетофенон, растворитель 1,3-бутандиол.
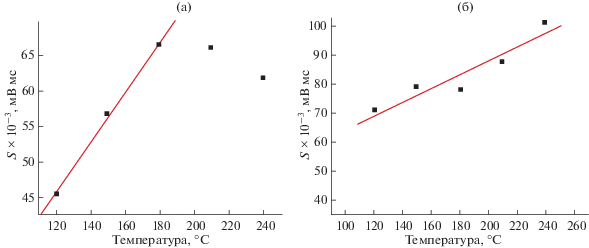
Важной особенностью температурных зависимостей площадей пиков компонентов разных образцов оказываются различия в величинах коэффициентов а уравнений линейной регрессии. Если температуры выражены в градусах Цельсия, а площади пиков представлены с множителем 10–3, то для растворов в 2-пропаноле такие коэффициенты для разных аналитов варьируют в диапазоне 0.35–0.86 (среднее значение 0.54), а для растворов в 1,3-бутандиоле – в диапазоне 0.03–0.33 (среднее значение 0.16), т.е. в три раза меньше. Иными словами, вариации значений Sмакс/Sмин одних и тех же компонентов для растворов в 2-пропаноле составляют 1.44–2.33 (среднее значение 1.70), а в случае 1,3-бутандиола – 1.09–1.91 (среднее значение 1.39). Следовательно, температурные эффекты дискриминации подтверждаются как для растворов в низкокипящем 2-пропаноле, так и в несколько меньшей степени для растворов в высококипящем 1,3-бутандиоле (критерий I).
Вспомогательный критерий II подробно рассмотрен в работе [21] и здесь для сокращения объема обсуждения не использован. Можно только отметить, что его закономерности идентичны выявленным ранее [21]. Так, отношения площадей пиков высоко- и низкокипящих аналитов в более высококипящих растворителях относительно более летучих возрастают при повышении температуры испарителя. Например, для пары ацетофенон/бутилацетат такое возрастание для растворов как в 2-пропаноле, так и в 1,3-бутандиоле для интервала температур 120–240°С составляет ∼1.2. Это меньше, чем, например, для пары тетрахлорметан/1-пентанол в 2-пропаноле и гексане, для которых увеличение отношений площадей пиков составляет 1.8−2.0 в интервале температур 120–210°С [21]. Факторы, определяющие конкретные величины таких отношений, требуют уточнения.
Важной практической задачей представляется нивелирование или компенсация эффектов дискриминации для повышения точности количественных определений. По этой причине целесообразно рассмотреть воспроизводимость относительных площадей пиков (Sотн) компонентов модельных растворов в зависимости от природы растворителя и температуры испарителя (критерий III). Соответствующие данные представлены в табл. 4. Стандартные отклонения средних значений относительных площадей пиков для растворов в 2-пропаноле составляют 0.5–2.5% (среднее значение 1.3%), а в 1,3-бутандиоле – 0.9–3.2% (среднее значение 1.7%) и, следовательно, близки между собой. Пики двух компонентов (циклогексанона и анизола) перекрываются с размытым сигналом 1,3-бутандиола, что снижает точность и воспроизводимость определения их площадей. Действительно, стандартные отклонения относительных площадей этих компонентов составляют 1.7–3.2%, тогда как трех остальных – 0.9–1.3%. Статистически значимые различия относительных площадей пиков (причем разного знака) в разных растворителях зарегистрированы для бутилбутирата и ацетофенона (значения выделены в табл. 4 жирным шрифтом), но детальное установление их причин требует более подробного изучения эффектов дискриминации. Однако в целом можно заключить, что обработка данных газохроматографического анализа модельных образцов в вязких высококипящих растворителях методом внутренней нормализации, несмотря на эффекты дискриминации, возможна и не приводит к существенным погрешностям результатов.
Таблица 4.
Воспроизводимость (%) относительных площадей пиков компонентов модельных растворов от природы растворителя (I – 2-пропанол, II – 1,3-бутандиол) и температуры испарителя
| Компонент | Растворитель | Температура испарителя, °С | Среднее значение ± ± стандартное отклонение | ||||
|---|---|---|---|---|---|---|---|
| 120 | 150 | 180 | 210 | 240 | |||
| Бутилацетат | I | 15.2 | 14.6 | 13.9 | 13.4 | 13.2 | 14.1 ± 0.8 |
| II | 15.0 | – | 15.5 | 13.8 | 12.7 | 14.2 ± 1.3 | |
| Циклогексанон | I | 14.2 | 19.4 | 19.6 | 19.9 | 19.9 | 18.6 ± 2.5 |
| II | 16.9 | – | 15.4 | 13.7 | 13.1 | 14.8 ± 2.7 | |
| Анизол | I | 22.9 | 21.7 | 20.5 | 19.5 | 19.4 | 20.8 ± 1.5 |
| II | 17.9 | – | 19.8 | 23.9 | 24.4 | 21.5 ± 3.2 | |
| Бутилбутират | I | 22.4 | 21.1 | 21.3 | 21.6 | 21.6 | 21.6 ± 0.5* |
| II | 18.5 | – | 19.3 | 18.4 | 17.2 | 18.4 ± 0.9* | |
| Ацетофенон | I | 25.3 | 23.2 | 24.6 | 25.5 | 25.9 | 24.9 ± 1.1** |
| II | 31.7 | – | 30.0 | 30.2 | 32.5 | 31.1 ± 1.2** | |
Объяснение эффектов дискриминации предложено еще в конце 1970-х – начале 1980-х гг. [26]. Если в момент испарения введенной пробы температура хроматографической колонки меньше температуры испарителя, то попадание паров компонентов пробы в колонку оказывается непропорционально бóльшим, чем это предопределено установленной величиной деления потока. Иными словами, наблюдается “«избыточная” конденсация паров компонентов пробы в колонке. Небезынтересно отметить, что первоначально такая зависимость была выявлена в результате варьирования не температуры испарителя при постоянной температуре колонки, а, наоборот, температуры колонки при постоянной температуре испарителя [26]. Однако масштабы проявления этого эффекта и его особенности подробно не охарактеризованы до настоящего времени, особенно для колонок типа Megabore. В рассматриваемом нами случае неожиданным оказалось отчетливое проявление линейной зависимости S(T) для нескольких аналитов в интервале температур испарителя 120–180°С и практически полное ее исчезновение при больших температурах (табл. 3 и рис. За).
Определение состава образца пищевого ароматизатора. Выявленные закономерности дозирования и обработки результатов газохроматографического анализа растворов в вязких высококипящих растворителях использовали при контроле состава пищевого ароматизатора на основе дипропиленгликоля. Поскольку Ткип этого растворителя варьирует в диапазоне 222–236°С (широкий диапазон обусловлен переменным содержанием структурных изомеров), то в соответствии с условием Тисп > Ткип температуру испарителя выбрали равной 240°С. Результаты идентификации 79 компонентов этого образца с относительными содержаниями более 0.01% представлены в табл. 5, а его хроматограмма приведена на рис. 4. Номера некоторых интенсивных пиков на рисунке соответствуют их нумерации в таблице.
Таблица 5.
Результаты хромато-масс-спектрометрического контроля состава образца пищевого ароматизатора с запахом персика
| № | tR, мин | RI | Относительная площадь, % |
Масс-спектрометрические признаки, m/z |
Идентификация | Справочное значение RI |
|---|---|---|---|---|---|---|
| 1 | 1.94 | 792 | 0.05 | 87, 59, 42, 31 | 2-Этил-4-метил-1,3-диоксолан | 778 ± 4 |
| 2 | 2.00 | 800 | 0.27 | н-Алкан С8 | 800 | |
| 3 | 2.04 | 805 | 0.26 | 43, 56 | н-Бутилацетат | 812 ± 4 |
| 4 | 2.10 | 813 | 0.22 | 43, 114 | Не идентифицирован | – |
| 5 | 2.12 | 816 | 0.31 | 43, 114 | Не идентифицирован | – |
| 6 | 2.20 | 826 | 0.08 | 41, 98 | (Е)-2-Гексеналь | 854 ± 3 |
| 7 | 2.29 | 837 | 0.11 | 57, 102 | Этил-2-метилбутират | 849 ± 3 |
| 8 | 2.40 | 850 | 0.36 | 41, 67, 82 | (Z)-3-Гексенол | 857 ± 3 |
| 9 | 2.48 | 859 | 1.7* | 43, 70 | Изоамилацетат | 876 ± 2 |
| 10 | 2.70 | 882 | 0.01 | 104, 103 | Стирол | 893 ± 5 |
| 11 | 2.82 | 894 | 0.01 | 43, 70 | Амилацетат | 911 ± 6 |
| 12 | 3.19 | 929 | 0.01 | 93, 121, 136 | α-Пинен | 937 ± 3 |
| 13 | 3.40 | 947 | 0.40 | 77, 105, 106 | Бензальдегид | 962 ± 3 |
| 14 | 3.70 | 971 | 0.08 | Смесь | Не идентифицированы | – |
| 15 | 3.84 | 981 | 0.04 | 41, 69, 93, 136 | β-Пинен | 979 ± 2 |
| 16 | 4.00 | 993 | 1.3 | 43, 67, 82 | (Z)-3-Гексенилацетат | 1005 ± 2 |
| 17 | 4.10 | 1000 | 2.3 | 43, 61 | Гексилацетат + н-алкан С10 | 1011 ± 4 |
| 18 | 4.50 | 1027 | 1.6 | 68, 93, 136 | Лимонен | 1030 ± 2 |
| 19 | 5.09 | 1063 | 7.7 | 45, 59 | Дипропиленгликоль (суммарная относительная площадь пиков около 30%) | 1030–1080 |
| 20 | 5.40 | 1081 | 7.0 | 59 | ||
| 21 | 5.48 | 1085 | 1.2 | 59 | ||
| 22 | 5.59 | 1091 | 0.29 | Смесь | Изомер дипропиленгликоля + + C10H16O | – |
| 23 | 5.83 | 1104 | 14.1 | Смесь | Изомер дипропиленгликоля + + C10H18O | – |
| 24 | 6.18 | 1121 | 0.35 | 91, 92, 122 | 2-Фенилэтанол | 1116 ± 5 |
| 25 | 6.76 | 1149 | 0.17 | 43, 83, 107, 121. 136, 154 | С10Н18О | – |
| 26 | 7.04 | 1161 | 3.7 | 91, 108, 150 | Бензилацетат | 1164 ± 2 |
| 27 | 7.39 | 1176 | 0.13 | 41, 43, 113 | Аллилгептаноат | 1180 ± 2 |
| 28 | 7.71 | 1190 | 2.5 | 77, 104, 122 | Стираллилацетат | 1194 ± 4 |
| 29 | 7.78 | 1193 | 0.73 | 59, 93, 121 | α-Терпинеол | 1189 ± 2 |
| 30 | 7.96 | 1200 | 0.62 | н-Алкан С12 | 1200 | |
| 31 | 8.70 | 1230 | 0.08 | Смесь | Не идентифицированы | – |
| 32 | 8.76 | 1232 | 2.3 | 69, 95, 123 | Цитронеллол | 1228 ± 3 |
| 33 | 9.15 | 1248 | 0.10 | 41, 54, 67 | Не идентифицирован | – |
| 34 | 9.49 | 1262 | 0.17 | 41, 69 | Гераниаль | 1270 ± 2 |
| 35 | 9.65 | 1269 | 0.10 | 41, 69, 95, 123 | Цитронеллилформиат | 1276 ± 4 |
| 36 | 10.03 | 1285 | 0.09 | 67, 93, 154 | С10Н18О | – |
| 37 | 10.22 | 1292 | 12.5 | 57, 67, 82, 123 | 2-трет-Бутилциклогексилацетат (Vertenex), изомер № 1 | Нет данных |
| 38 | 10.47 | 1303 | 0.04 | Смесь | Не идентифицированы | – |
| 39 | 10.66 | 1311 | 2.0 | 57, 67, 82, 123 | 2-трет-Бутилциклогексилацетат, изомер № 2 | Нет данных |
| 40 | 10.78 | 1316 | 0.38 | 43, 70 | Нонилацетат | 1308 ± 4 |
| 41 | 10.96 | 1323 | 0.07 | 43, 93, 121, 154 | Ацетат спирта С10Н18О | – |
| 42 | 11.11 | 1329 | 1.6 | 57, 67, 123 | (Е)-4-трет-Бутилциклогексилацетат | 1322 |
| 43 | 11.40 | 1341 | 3.1 | 43, 103, 145 | Триацетин | 1344 ± 2 |
| 44 | 11.56 | 1348 | 1.6 | 43, 81, 95, 123 | Цитронеллилацетат | 1354 ± 2 |
| 45 | 11.81 | 1358 | 0.20 | 69, 93, 121 | Нерилацетат | 1364 ± 3 |
| 46 | 1200 | 1366 | 3.5 | 57, 82, 123, 67 | (Z)-4-трет-Бутилциклогексилацетат | 1360 |
| 47 | 12.24 | 1376 | 0.18 | 69, 93, 121 | Геранилацетат | 1382 ± 3 |
| 48 | 12.32 | 1380 | 0.02 | 69, 121, 190 | Дамасценон | 1386 ± 5 |
| 49 | 12.48 | 1387 | 0.02 | 81, 121 | β-Элемен | 1391 ± 2 |
| 50 | 12.80 | 1400 | 0.36 | н-Алкан С14 | 1400 | |
| 51 | 12.88 | 1403 | 0.02 | 43, 71, 109, 137, 152 | Ацетат спирта С10Н16О | – |
| 52 | 12.98 | 1408 | 0.03 | Смесь | Не идентифицированы | – |
| 53 | 13.22 | 1417 | 2.7 | 66, 192 | Дигидроциклопентадиентилацетат (verdyl acetate, cyclacete) | 1407 |
| 54 | 13.51 | 1430 | 0.12 | Смесь | Не идентифицированы | – |
| 55 | 13.66 | 1436 | 0.08 | 43, 115, 133, 176 | Циннамилацетат | 1446 ± 2 |
| 56 | 14.07 | 1454 | 0.04 | 77, 105, 120 | Гексанофенон | 1473 ± 6 |
| 57 | 14.22 | 1460 | 1.8 | 85, 128 | γ-Декалактон | 1470 ± 5 |
| 58 | 14.33 | 1464 | 0.02 | 91, 104, 117, 188 | (Е)-α-Изобутилциннамаль | – |
| 59 | 14.46 | 1470 | 0.19 | 115, 146 | Кумарин | 1441 ± 12 |
| 60 | 14.76 | 1483 | 0.22 | 43, 177, 192 | β-Ионон | 1491 ± 2 |
| 61 | 14.88 | 1488 | 1.1 | 43, 71, 91, 132 | (1,1-Диметил-2-фенилэтил)бутират | 1493 ± 5 |
| 62 | 15.24 | 1503 | 0.03 | 43, 71, 91, 99 | Бензилкапроат (предположительно) | 1493 |
| 63 | 15.42 | 1511 | 0.91 | 43, 115 | (2-Феноксиэтил)изобутират (Phenirat) | 1488 ± 5 |
| 64 | 16.54 | 1558 | 0.04 | 105, 190 | Гептанофенон | 1538 |
| 65 | 16.74 | 1567 | 3.9 | 85, 128 | γ-Ундекалактон | 1576 ± 7 |
| 66 | 17.18 | 1586 | 0.83 | 149, 177 | Диэтилфталат | 1594 ± 9 |
| 67 | 17.52 | 1600 | 0.48 | н-Алкан С16 | 1600 | |
| 68 | 18.14 | 1628 | 0.07 | 43, 59, 85. 113, 131, 202 | Не идентифицирован | – |
| 69 | 18.49 | 1643 | 4.9 | 91, 115, 117, 129, 202 | (Е)-α-Амилциннамаль | 1662 ± 10 |
| 70 | 18.87 | 1661 | 0.33 | 91, 115, 117, 129, 202 | (Z)-α-Амилциннамаль | 1678 ± 7 |
| 71 | 19.06 | 1670 | 0.72 | 85, 128 | γ-Додекалактон | 1678 ± 7 |
| 72 | 20.68 | 1744 | 5.8 | 91, 115, 117, 129, 216 | (Е)-α-Гексилциннамаль | 1755 ± 9 |
| 73 | 21.01 | 1760 | 0.10 | Смесь | Не идентифицированы | – |
| 74 | 21.14 | 1766 | 0.34 | 91, 115, 117, 129, 216 | (Z)-α-Гексилциннамаль | 1755 ± 9 |
| 75 | 21.33 | 1775 | 0.04 | 115, 144, 214 | Нафтилбутират (предположительно, 1-) | 1768 |
| 76 | 21.51 | 1783 | 0.03 | 43, 171, 242 | Не идентифицирован | – |
| 77 | 21.87 | 1800 | 0.26 | н-Алкан С18 | 1800 | |
| 78 | 23.53 | 1879 | 0.30 | 115, 131, 160, 216 | Диэтилацеталь (Е)-α-амилциннамаля | – |
| 79 | 25.68 | 1983 | 0.36 | 115, 131, 160, 230 | Диэтилацеталь (Е)-α-гексилциннамаля | – |
| Сумма, % | 99.67 | |||||
Рис. 4.
Хроматограмма образца пищевого ароматизатора. Указанные для основных пиков номера соответствуют их нумерации в табл. 5.
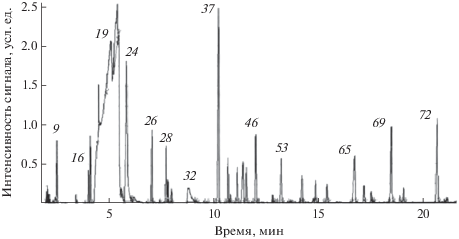
Табл. 5 включает оценки содержания компонентов с относительными площадями пиков не менее 0.01%, полученные методом внутренней нормализации. Среди этих компонентов указаны шесть реперных н-алканов C8–C18 с четным числом атомов углерода в молекуле (суммарное количество около 4%), необходимых для определения индексов удерживания. Кроме того, около 30% суммарной площади пиков приходится на несколько размытых сигналов изомеров дипропиленгликоля в области RI приблизительно от 1060 до 1100. В зависимости от цели анализа и формы представления результатов, такие компоненты могут быть исключены из списка. Для всех компонентов для подтверждения правильности их идентификации указаны экспериментальные и справочные индексы удерживания [23]. Впервые определенные значения RI нескольких компонентов внесены в базу справочных данных.
Восемь минорных сигналов на хроматограмме с относительными интенсивностями 0.04–0.29% принадлежат смесям неидентифицированных компонентов. Относительными площадями пиков более 1% (номера и названия выделены жирным шрифтом) характеризуются 19 компонентов. Более детальное рассмотрение состава образца представляет интерес для специалистов.
Компоненты образца идентифицированы по хромато-масс-спектрометрическим параметрам с использованием баз масс-спектров и индексов удерживания. Однако для повышения надежности и однозначности идентификации использовали еще одно дополнительное условие: выбор ответов проводили не из всего многообразия органических соединений, а только из тех, которые могут входить в число пищевых ароматизаторов (перечни известны). Сочетание всех трех условий существенно снижает неопределенность результатов.
Контроль возможности обработки данных методом внутренней нормализации, термической стабильности и взаимной совместимости компонентов анализируемых образцов. Газохроматографический анализ проб в высококипящих растворителях, как правило, должен сопровождаться дополнительным контролем результатов по нескольким причинам. Во-первых, существование эффектов дискриминации обусловливает целесообразность проверки применимости используемых вариантов количественных определений. Во-вторых, необходимость выполнения условия Тисп > Ткип соответствует дозированию проб при достаточно высоких температурах испарителя, что заставляет контролировать термическую стабильность входящих в состав образцов наиболее лабильных компонентов. Кроме того, известны примеры взаимной несовместимости отдельных компонентов образцов (например, упомянутый выше анализ пропиленкарбоната, содержащего следы воды [7, 8]).
С целью одновременной проверки применимости способа внутренней нормализации и термической стабильности компонентов можно использовать как модельные, так и реальные образцы. Во втором случае нет необходимости контролировать воспроизводимость определения содержания всех компонентов. Достаточно ограничиться несколькими из них, включив в их число как явно устойчивые, так и наиболее лабильные компоненты. В составе характеризуемого образца ароматизатора наиболее термически лабильным представляется компонент № 28 – стираллилацетат С6Н5СН(СН3)ОСОСН3, деструкция которого приводит к стиролу С6Н5СН=СН2 и уксусной кислоте СН3CO2H. Если в дополнение к нему проследить температурные вариации относительных площадей пиков еще четырех перечисленных в табл. 6 компонентов, то на основании отсутствия их отчетливо выраженных вариаций можно сделать вывод как о применимости способа внутренней нормализации, так и о термической стабильности компонентов образца в интервале Тисп 200–270°С.
Таблица 6.
Относительные площади пиков пяти компонентов образца ароматизатора при разных температурах испарителя
| № в табл. 5 | Компонент | Температура испарителя, °С | Средние значения |
||
|---|---|---|---|---|---|
| 200 | 230 | 270 | |||
| 9 | Изоамилацетат | 0.14 | 0.16 | 0.16 | 0.15 ± 0.01 |
| 26 | Бензилацетат | 0.28 | 0.32 | 0.30 | 0.30 ± 0.02 |
| 28 | Стираллилацетат | 0.23 | 0.26 | 0.26 | 0.25 ± 0.02 |
| 37 | 2-трет-Бутилциклогексилацетат № 1 | 1.0 | 1.0 | 1.0 | 1.0 |
| 79 | (Е)-α-Гексилциннамаль | 0.49 | 0.47 | 0.46 | 0.47 ± 0.02 |
Влияние больших количеств полярных растворителей на индексы удерживания аналитов. Последняя из обсуждаемых особенностей газохроматографического анализа образцов в высококипящих растворителях не относится к интенсивно выраженным эффектам, но имеет непосредственное отношение к идентификации по хроматографическим индексам удерживания. Попадающие в колонку относительно большие количества высококипящих полярных органических растворителей могут выполнять функцию дополнительной фазы и, следовательно, изменять свойства неподвижной фазы колонки (динамическая модификация). В рассматриваемом нами случае для подтверждения этого факта без каких-либо дополнительных экспериментов рассмотрим разности экспериментальных и справочных значений RI на стандартных неполярных полидиметилсилоксановых неподвижных фазах, эквивалентных фазам, содержащим 5% фенильных групп (по принятой в базе [23] терминологии их классифицируют как semi-standard). Можно предполагать, что значения RI компонентов, выходящих из хроматографической колонки до зоны полярного растворителя, будут несколько завышены по сравнению со значениями RI компонентов, элюируемых после нее. Действительно, среднее значение ΔRI для 12 компонентов с временами удерживания менее 5 мин составляет +11 ± 8 ед. инд., а 18 компонентов с временами удерживания более 6 мин – +1 ± 6 ед. инд., т.е. на 10 ед. инд. меньше, несмотря на то, что среди них преобладают менее летучие полярные соединения. Эта особенность полностью соответствует эффекту динамической модификации неполярной неподвижной фазы большими количествами полярных органических растворителей.
* * *
Таким образом, газохроматографический анализ проб в высококипящих полярных органических растворителях характеризуется рядом особенностей, обусловленных замедлением процесса перевода образцов в газовую фазу в испарителе хроматографа и динамической модификацией неподвижной фазы колонки. В число этих эффектов входит зависимость степени разделения аналитов от температуры испарителя и завышение индексов удерживания компонентов, элюируемых из колонки до растворителя. Кроме этого, для таких проб проявляются так называемые “эффекты дискриминации”, а именно зависимость абсолютных площадей пиков аналитов от температуры испарителя. Однако существование такой зависимости не влияет на результаты количественного анализа методом внутренней нормализации.
Хроматографический анализ выполнен с использованием оборудования Ресурсного образовательного центра по направлению “Химия” Института химии Санкт-Петербургского государственного университета. Авторы благодарят сотрудников Центра за содействие.
Список литературы
Руководство по газовой хроматографии. В 2-х т. / Под ред. Лейбница Э., Штруппе Х.Г. Пер. с нем. М.: Мир, 1988.
Зенкевич И.Г., Лелеев Е. Особенности дозирования и хроматографического разделения проб в высококипящих вязких органических растворителях с использованием капиллярных колонок при малом делении потока газа-носителя // Аналитика и контроль. 2018. Т. 11. № 3. С. 220.
Тесаржик К., Комарек К. Капиллярные колонки в газовой хроматографии. Пер. с чешского. М.: Мир, 1987. 224 с.
Сандра П. Ввод пробы в капиллярную колонку / Высокоэффективная газовая хроматография. Гл. 3. / Под ред. Хайвер К.. Пер с англ. М.: Мир, 1993. 288 с., С. 59.
Analytical methods to quantify suspected allergens (and isomers) in ready to inject fragrance materials by GC and MS. Brussels: The Int. Fragr. Assoc., Anal. Working Group, 2016. 88 p.
Зенкевич И.Г., Кушакова А.С., Мамедова Ф.Т. Возможности прямого газохроматографического определения содержания основного компонента в жидких органических веществах // Аналитика и контроль. 2009. Г. 13. № 2. С. 106. (Zenkevich I.G., Kushakova A.S., Mamedova F.T. Direct GC determination of principal constituent content in organic liquids // Analytics and Control. 2009. V. 13. № 2. P. 106.)
Зенкевич И.Г., Быстрова Г.И., Иоффе Б.В. Анализ примесей в пропиленкарбонате для химических источников тока // Журн. прикл. химии. 1984. Т. 57. № 4. С. 879. (Zenkevich I.G., Bystrova G.I., Ioffe B.V. Analysis of impurities in propylene carbonate for chemical power elements // Russ. J. Appl. Chem. 1984. V. 57. № 4. P. 879.)
Зенкевич И.Г., Быстрова Г.И. Количественный анализ смесей, нестабильных в условиях хроматографического разделения. Определение примеси пропиленгликоля в пропиленкарбонате // Журн. аналит. химии. 1985. Т. 40. № 9. С. 1686. (Zenkevich I.G., Bystrova G.I. Quantification of mixtures unstable in conditions of chromatographic separation // J. Analyt. Chem. (Russ.) 1985. V. 40. № 9. P. 1868.)
Knezevic-Stevanovic A.B., Smiljanic J.D., Serbanovic S.P., Radovic I.R., Kijevcanin M.L.J. Densities, refractive indices and viscosities of the binary mixtures of dimethyl phthalate or dimethyl adipate with tetrahydrofuran // J. Serb. Chem. Soc. 2014. V. 79. № 1. P. 77.
Analysis of impurities in ethylene glycol with JMS-T100GC AccuTOF GC. JEOL Technical Notes. MS Tips No. 43, 2005. P. 1.
Analysis of impurity ethylene glycol in 1,2-propylene glycol. Technical Note. Wilmington: Agilent Technol., 2010. 2 p.
http://www.accudynetest.com/visc_tablejrint.html (ceн-тябpь 2018 г.).
Khattab I.S., Bandarkar F., Khoubnasabjafari M., Jouyban A. Density, viscosity, surface tension, and molar volume of propylene glycol + water mixtures from 293 to 323 K and correlations by the Jouyban-Acree model // Arab. J. Chem. 2017. V. 10. P. S71.
A guide to glycols. Midland: The Dow Chem. Corp., 2003. 58 p.
Czechowski G., Jarosiewicz P., Rabiega A., Jadzyn J. The viscous properties of diols. IV. 1,2- and 1,3-butanediol in butanol solutions // Z. Naturforsch. 2004 V. 59a. P. 119.
Ragman G., Roeraade J. On-line liquid backflush – a new technique for GC analysis of samples containing nonvolatile material // J. Sep. Sci. 1993. V. 16. № 7. P. 445.
Milner C., Kinghorn R., Klee M.S. The use of automated backflush on the 7890A/5975A GC-MS systems. Application. Wilmington: Agilent Technol. Inc., 2008. 10 p.
Setting up Silflow™ for backflush in your GC. Technical Article. Singapore: SGE Analyt. Sci., 2011. 5 p.
Jakobs M.R., Gras R., Nesterenko P.N., Luong J., Shellie R.A. Back-flushing and heart cut capillary GC using planar microfluidic Deans switching for the separation of benzene and alkylbenzenes in industrial samples // J. Chromatogr. A. 2015. V. 1421. P. 123.
Li R., Miao C., Wang Y. Purity analysis of industrial triethylene glycol by capillary GC // J. Chromatogr. Sci. 1998. V. 36. P. 349.
Зенкевич И.Г., Олисов Д.А. Эффекты дискриминации состава проб при их дозировании в капиллярные газохроматографические колонки с делением потока // Журн. аналит. химии. 2019. Т. 74. № 7. С. S40. (Zenkevich I.G., Olisov D.A. Discrimination effects at split injection of probes into GC columns // J. Analyt. Chem. 2019. V. 74. № 7. P. S760.)
Zenkevich I.G., Pavlovskii A.A. Overloading control of gas chromatographic systems // J. Sep. Sci. 2015. V. 38. P. 2848.
The NIST 17 Mass Spectral Library (NIST17/2017/EPA/NIH). Software/Data Version (NIST17); NIST Standard Reference Database, Number 69, June 2017. National Institute of Standards and Technology, Gaithersburg, MD 20899: http://webbook.nist.gov (ceнтябpь 2018 г.).
Zenkevich I.G. Application of Recurrent Relationships in Chromatography // J. Chemometr. 2009. V. 23. P. 179.
Zenkevich I.G. Application of recurrent relations in chemistry // J. Chemometr. 2010. V. 24. P. 158.
Grab K., Neukom H.P. Dependence of the splitting ratio on column temperature in split injection capillary gas chromatography // J. Chromatogr. A. 1982. V. 236. P. 297.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


