Акустический журнал, 2022, T. 68, № 1, стр. 96-116
Оптоакустика неоднородных биомедицинских сред: конкуренция механизмов и перспективы применения (обзор)
С. В. Егерев a, *, Я. О. Симановский b
a Акустический институт имени Н.Н. Андреева
117449 Москва, ул. Шверника 4, Россия
b Институт общей физики имени А.М. Прохорова Российской академии наук
119991 Москва, ГСП-1, ул. Вавилова 38, Россия
* E-mail: segerev@gmail.com
Поступила в редакцию 12.07.2021
После доработки 09.09.2021
Принята к публикации 22.09.2021
- EDN: QQSRCD
- DOI: 10.31857/S0320791922010026
Аннотация
Приведен обзор достижений и проблем опто(фото)акустики последних лет в области биомедицинских приложений в реальных средах и в реальных режимах оптоакустического (ОА) преобразования. Оптоакустика представляет развитое и конкурентное направление. Имеется существенный прогресс в технике лазерной генерации звука, в технике приема, обработки и интерпретации сигнала. Исследования по проблемам прикладной оптоакустики неоднородных биомедицинских сред – жидких образцов и биологических тканей – развиваются по нескольким направлениям. Это визуализация, детектирование примесей в малых концентрациях, проточная цитометрия, тераностика. В зависимости от условий, вклад в информативный звуковой отклик могут вносить несколько механизмов преобразования. Это линейный и нелинейный термоупругие механизмы, причем приобретающие дополнительные черты при лазерном облучении суспензий, а также неоднородных биологических тканей. Проявляется также совместный вклад термоупругих механизмов и механизма лазерно-индуцированной кавитации, развивающейся на неоднородностях. Прогресс биомедицинских оптоакустических технологий предполагает полный учет условий ОА-преобразования применительно к конкретной задаче. Как выяснилось, публикации по вопросам лазерной генерации звука в реальных средах уже составили большой массив, нуждающийся в структуризации. Нельзя обойти вниманием и предстоящий в недалеком будущем переход к клиническому применению систем ОА-визуализации.
ВВЕДЕНИЕ
Оптоакустический эффект состоит в генерации звука в среде при облучении ее лазерным излучением переменной интенсивности. Стимулом к написанию этого обзора явилось известие о создании Международного консорциума по стандартизации в области оптоакустики (The International Photoacoustic Standardisation Consortium – IPASC) [1]. Консорциум призван объединить усилия представителей промышленности, биомедицинского сообщества, сообщества исследователей-оптоакустиков для унификации, скорейшего внедрения в клиническую практику и вывода на рынок диагностических и терапевтических технологий, основанных на опто(фото)акустическом эффекте. За этим решением стоит общее признание прогресса как в изучении собственно эффекта, так и его потенциальных приложений. Консорциум имеет организационную структуру, декларированные цели, документацию, отраженную на соответствующем сайте. Разработка стандартов визуализации будет проводиться в русле известных решений для уже освоенных биомедицинских технологий – МРТ, КТ и УЗИ – и, в основном, охватывает перспективные системы оптоакустической (ОА) визуализации. В документах Консорциума отмечается, что прогресс методов оптоакустической (ОА) диагностики привел к появлению разнообразных устройств, качество которых трудно сопоставить в отсутствие единого критерия качества и единых методик измерений.
Исследования по проблемам прикладной оптоакустики неоднородных биомедицинских сред – жидких образцов и биологических тканей – развиваются по нескольким направлениям. Это визуализация, детектирование примесей в малых концентрациях, проточная цитометрия, тераностика. Стало очевидно, что как визуализация, так и другие направления ОА-приложений в биологии и медицине завершают этап “feasibility study”. На этом этапе исследования часто имеют целью показать принципиальную возможность решать ту или иную общественно полезную задачу с помощью опто(фото)акустики. В свою очередь, этому этапу предшествовал этап фундаментальных исследований. Сегодня биомедицинская оптоакустика является конкурентной областью, а исследователи активно публикуют свои результаты. Следует отметить обзорные статьи и монографии, важные для понимания современных методов решения задач медицины и биологии. Развитие оптоакустических методов визуализации обобщено в обзорах [2–7]. Практика применения наночастиц в качестве контрастных поглощающих центров для решения различных диагностических задач изложена в [8, 9]. Методы измерений в образцах с использованием ОА-спектроскопии рассмотрены в [10]. Нелинейные механизмы преобразования применительно к биомедицине систематизированы в работе [11]. Развитие совместного использования оптоакустического метода и метода “термолинзы” для выявления сверхмалых концентраций примесей и даже отдельных молекул в малых объемах жидких образцов отражено в монографии [12].
Вклады в информативный звуковой отклик могут вносить несколько механизмов ОА-преобразования. Соотношение вкладов зависит от конкретных условий облучения образца и регистрации отклика. Наиболее известен линейный термоупругий механизм [13]. Применительно к диагностике неоднородных биомедицинских сред его проявления могут не укладываться в простые модели. Так, при ОА-диагностике образцов в малых объемах необходимо учитывать ряд факторов. К ним относятся особенности времяразрешающей регистрации термоупругого отклика в области преобразования, или в непосредственной близости к ней. Помимо линейного механизма, известны нелинейные механизмы термоупругого преобразования, которые проявляются при определенных условиях. Нелинейность отклика часто связана с температурной зависимостью коэффициента объемного теплового расширения образца. Однако изучается влияние и нелинейностей других типов. В неоднородных релаксирующих средах термоупругий механизм преобразования приобретает новые черты, например, связанные с теплообменом частиц и растворителя в суспензии. Активно исследуется еще один механизм генерации звука. Он связан с конкуренцией вклада лазерно-индуцированной кавитации и термоупругих вкладов различной природы. Представляется, что перспективы применения оптоакустических методов связаны и с тем, насколько подробно будут учитываться как конкуренция механизмов, так и их совместное действие в неоднородных средах.
Современные публикации по этой теме уже составили большой массив, нуждающийся в структуризации. В последующих разделах обзора излагаются краткие сведения об особенностях биомедицинских сред, важных с точки зрения ОА-преобразования, обсуждаются особенности выполнения измерений в малых объемах жидких образцов, рассматривается конкуренция “невозмущающих” термоупругих механизмов, обобщаются работы по лазерно-индуцированной кавитации и ее роли в новых диагностических и терапевтических процедурах. И, наконец, в завершающем разделе освещаются новые практики и перспективы ОА-визуализации.
1. НЕОДНОРОДНЫЕ БИОМЕДИЦИНСКИЕ СРЕДЫ
Представляют интерес две группы объектов оптоакустических приложений применительно к неоднородным биомедицинским средам.
К первой группе объектов относятся жидкие среды: растворы, эмульсии и суспензии. Например, кровь является суспензией эритроцитов и других клеток в плазме. К суспензиям относятся и некоторые нерастворимые лекарственные формы. ОА-приложения для этой группы – это, в основном, измерения в разбавленных растворах и суспензиях. Коэффициенты оптического поглощения компонентов и теплофизические параметры образца играют большую роль в формировании звукового отклика. Роль оптического рассеяния для приложений в объектах первой группы относительно невелика. Условие, когда можно пренебречь перераспределением оптической интенсивности из-за рассеяния на частицах, приближенно выражается неравенством ${{N}_{0}}{{\sigma }_{{{\text{sc}}}}}L \ll 1$, где ${{N}_{0}}$ – концентрация частиц, ${{\sigma }_{{{\text{sc}}}}}$ – сечение рассеяния частицы, $L$ – характерный масштаб вдоль направления луча.
Оптическое поглощение отдельной частицей радиуса ${{R}_{0}}$ определяется ее сечением поглощения ${{\sigma }_{0}}$. Для суспензий диэлектрических частиц ${{\sigma }_{0}}$ связано с геометрическим сечением $\pi R_{0}^{2}$ соотношением ${{\sigma }_{0}} = {{k}_{{\text{a}}}}\pi R_{0}^{2}$, где ${{k}_{{\text{a}}}}$ – фактор эффективности поглощения на длине волны $\lambda $, зависящий от оптических постоянных вещества частицы и от соотношения длины волны излучения и радиуса частицы. Для диэлектрических частиц с показателем преломления $n = n{\kern 1pt} '\,\, + in{\kern 1pt} ''$ ($n{\kern 1pt} '$ и $n{\kern 1pt} ''$ – вещественная и мнимая части показателя преломления, соответственно) при $n{\kern 1pt} ' \geqslant \,\,1$ и $n{\kern 1pt} '' < \;1$ значение ${{k}_{{\text{a}}}}$ вычисляют по формуле [14]:
Детектирование следовых концентраций нерастворимых частиц – традиционно популярное in vitro приложение ОА-методов. Например, суспензия макромолекул липополисахаридов (ЛПС) – популярный объект в задачах ОА-детектирования. Диагностика содержания ЛПС – важная задача, поскольку в медицинской практике приходится иметь дело с эндотоксином, вызывающим пирогенный эффект у человека и животных11. Измерения на основе ОА-преобразования используют оптический контраст исследуемой примеси и растворителя. Дополнительная селективность измерений достигается при учете частотных компонент звукового отклика, связанных с теплопередачей от частиц к растворителю. При достижении плотности энергии, достаточной для нагрева частиц выше температуры кипения растворителя, проявляется вклад механизмов преобразования, связанных с фазовыми превращениями в образце. Конкуренция механизмов может представлять помеху, но может и использоваться для увеличения показателей качества диагностики.
В последние годы широкое распространение в биомедицинских приложениях получили неорганические, в том числе, металлические частицы, имеющие размеры от десяти до нескольких сотен нанометров. Металлические частицы с размерами, меньшими длины волны оптического излучения, демонстрируют т.н. “локальный плазмонный резонанс”, который выражается в многократном увеличении сечений рассеяния и поглощения по сравнению с их геометрическим сечением. Резонансная длина волны зависит от формы и размеров частицы и ее структуры. Таким образом, их спектральными характеристиками поглощения можно управлять. Расчет сечения поглощения резонансных частиц более сложен, однако методы моделирования свойств наночастиц в качестве центров поглощения, а также методы конструирования наночастиц с заданными свойствами в ОА-приложениях хорошо освоены [9, 15, 16].
Вклады в звуковой отклик, возбуждаемые (а) при поглощении излучения непосредственно в растворителе и (б) под действием передачи тепла от частиц к растворителю, зависят от величины коэффициента Грюнайзена растворителя, $\Gamma = {{\beta с} \mathord{\left/ {\vphantom {{\beta с} {{{С}_{{\text{p}}}}}}} \right. \kern-0em} {{{С}_{{\text{p}}}}}}$, $\beta $ – коэффициент объемного теплового расширения образца, ${{C}_{{\text{p}}}}$ – удельная теплоемкость образца, $с$ – скорость звука в образце. Модель линейного термооптического преобразования в водных растворах предсказывает обращение $\Gamma $ в ноль в точке максимальной плотности воды, ${{T}_{0}} = $ 4°С. Исходя из этой модели, для подавления фонового отклика воды предлагается и реализуется термостатирование образцов в этой температурной точке. Однако конкуренция механизмов преобразования может снизить эффективность данной меры.
Ко второй группе объектов ОА-приложений относятся биологические ткани организма животных и человека. Учет свойств тканей актуален для развития оптоакустических методов визуализации, проточной цитометрии, тераностики. Роль оптического расcеяния в объектах этой группы очень важна. Ткани человеческого организма рассеивают по-разному [17]. Максимальное светорассеяние характерно для эпидермиса, минимальное – для тканей сердца, легких, печени. Светорассеяние в ткани грудных желез изменяется в широком диапазоне, по-видимому, в зависимости от соотношения долей фиброзной и жировой ткани. Вторичное световое поле, формируемое в результате многократного рассеяния лазерного излучения в биологической ткани, является фактором, влияющим на характеристики звукового отклика. Модель ОА-преобразования в сильнорассеивающих средах дана в работе [18].
Относительное оптическое поглощение биологических тканей влияет на контраст изображения, получаемого в ОА-визуализации. В поглощение ткани вносят вклад как естественные (эндогенные) хромофоры (группы атомов в молекулярной структуре вещества, поглощающие электромагнитное излучение), так и искусственно внесенные (экзогенные) агенты [8, 9]. Эндогенные хромофоры обусловливают поглощение таких компонентов биологических тканей, как вода, гемоглобин, меланин, липиды и некоторые другие вещества. Их вклад в общий коэффициент поглощения биологической ткани неодинаков. Это обстоятельство учитывается для визуализации т.н. “целевых объектов” в тканях. Так, в диапазоне длин волн 650–900 нм коэффициент оптического поглощения гемоглобина на порядок превышает показатели воды, липидов и эластинов [16, 19], что, например, позволяет выполнять ОА-визуализацию сосудистой сети с высоким контрастом [20]. На длине волны 1200 нм становится заметным сильный пик поглощения липидов [21]. Этот пик – основа ОА-визуализации локализованных липидных отложений в сосудах [4]. Биологические ткани характеризуются спектральными “окнами”, в которых наблюдается пониженное эндогенное поглощение. Поэтому обсуждавшиеся выше экзогенные агенты (например, наночастицы) конструируются таким образом, чтобы обеспечить резонансное поглощение на длинах волн, соответствующих этим окнам. Это обеспечивает максимально возможный контраст при ОА-визуализации. Соответственно, требованием к наночастицам является возможность их безвредного внутривенного или внутримышечного введения в организм.
Рассеяние и поглощение света в тканях влияют на показатели качества оптоакустической диагностики и терапии. Транспортная длина свободного пробега фотона, на которой фотон в среднем не изменяет свою траекторию, для биологической ткани составляет величину примерно 1 мм. На расстоянии, превышающем эту величину, световое поле становится диффузным, и освещенность экспоненциально убывает с глубиной c постоянной ${{\mu }_{{{\text{eff}}}}}$. Эта величина – эффективный коэффициент ослабления – учитывает вклад как поглощения, так и рассеяния света [22].
Акустические свойства биологических тканей также определяются присутствием в их составе отдельных компонентов. Скорость продольной звуковой волны в мягких тканях слабо зависит от частоты и – при температуре 35°С – лежит в диапазоне 1550–1650 м/с в зависимости от вида ткани [23]. Соответственно, коэффициент $\Gamma $ для тканей превышает это значение для воды при той же температуре. Затухание акустической волны при распространении в биотканях характеризуется экспоненциальной зависимостью с показателем затухания, пропорциональным частоте волны в широком диапазоне частот. Ткани с бо́льшей долей жира и наличием границ раздела между жировой и “нежировой” структурами характеризуются, в среднем, меньшей скоростью звука и бо́льшими значениями коэффициентов затухания и рассеяния в сравнении с другими мягкими тканями. Таковы, например, ткани молочной железы [24]. Распространение звука в костной ткани характеризуется дисперсией, а скорость звука варьирует в зависимости от ряда факторов (например, наличие или отсутствие остеопороза).
Акустическая неоднородность биологических тканей может проявить себя как мешающий фактор в ходе оптоакустических диагностических и терапевтических процедур, так как приводит к появлению рассеянных фоновых сигналов и искажению профиля звукового отклика. Для повышения качества измерений в рассеивающих звук биологических тканях применяют соответствующую конфигурацию системы или объединяют оптоакустические методы диагностики с более традиционными ультразвуковыми исследованиями [10].
2. ОПТОАКУСТИЧЕСКИЕ ИЗМЕРЕНИЯ В ЖИДКИХ ОБРАЗЦАХ МАЛОГО ОБЪЕМА
Исследования измерительного потенциала оптоакустических методов, в частности, применительно к жидким образцам, восходят к работам [25, 26]. Оптоакустическая диагностика сред является разновидностью калориметрических методов спектроскопии. В ее основе лежит поглощение оптического излучения, с последующей безызлучательной релаксацией и нагревом образца.
Упрощенно, процесс измерений основан на том, что амплитуда звукового отклика пропорциональна коэффициенту оптического поглощения жидкого образца $\alpha $. При измерении малых концентраций примесей в образце используют соотношение $\alpha = {{\alpha }_{0}} + \varepsilon (\lambda )\;C$, где ${{\alpha }_{0}}$ – коэффициент поглощения чистого растворителя, $\varepsilon (\lambda )$ – молярная поглощающая способность растворенного вещества, зависящая от длины волны лазерного луча $\lambda $, $C$ – искомая концентрация примеси, пропорциональная амплитуде давления в звуковом отклике. Степень компенсации амплитуды фонового отклика растворителя, пропорционального величине ${{\alpha }_{0}}$, влияет на качество измерений. Помимо амплитудной версии, популярность получила времяразрешающая ОА-диагностика, предъявляющая более строгие требования к приему отклика. В настоящее время методы оптоакустики применяются в двух областях, вытесняя традиционную абсорбционную спектроскопию. В сочетании с другими процедурами, принятыми в аналитической химии, выполняется определение химического состава исследуемого раствора. Проводится также выявление отдельных примесей в сверхмалых концентрациях.
Характеристики дальнего звукового поля в однородном жидком полупространстве при термоупругой генерации хорошо изучены [13, 27]. Построение измерительной модели линейного термоупругого отклика в области преобразования, или в непосредственной близости к ней, потребовало дополнительных исследований.
Амплитудная ОА-диагностика относительно легко реализуется, если образец помещен в большие кюветы (больше 50 мл). Однако в этих случаях успешно применяются и более традиционные процедуры: электрохимическое обнаружение, титрование, ионометрия. Преимущество ОА-диагностики связано с возможностью проведения измерений именно в малых объемах образцов. Показатели качества измерений зависят от того, в какой степени при регистрации информативного звукового отклика учитывается влияние отражений от стенок кювет, влияние помехи, связанной с прямой “засветкой” приемника давления. При проведении ОА-измерений в рассеивающих, релаксирующих средах, в многофазных средах (например, в жидкостях с пузырьками газа) также приходится учитывать, что процесс преобразования имеет особенности по сравнению с простой моделью термооптического механизма.
При измерениях in vitro ядром измерительной системы обычно является т.н. оптоакустическая ячейка, содержащая образец. ОА-ячейка является компактным и простым устройством, обеспечивающим приемлемую точность и чувствительность. В ячейке происходит генерация и прием звукового измерительного отклика, а показатели качества диагностики зависят от конструкции конкретной ячейки. На рис. 1 обобщенно показаны два исторически первых типа оптоакустических ячеек. Латеральная оптоакустическая ячейка (рис. 1а) удобна для измерений в жидких образцах относительно большого объема (10–100 мл). При прохождении луча через ячейку лазерная энергия лишь частично поглощается в образце [28]. Таким образом, исследуемый образец является оптически “тонким”, т.е. $\alpha L \ll 1$, где $L$ в данном случае – расстояние между входным и выходным окнами. Область преобразования имеет цилиндрическую форму, а радиус поперечного сечения пучка $a$ в режиме “короткого” лазерного импульса удовлетворяет условию $a \gg с\tau ,$ где $\tau $ – длительность лазерного импульса. Звуковой отклик поступает на приемник давления, находящийся в поле расходящейся цилиндрической упругой волны. Амплитуда отклика оценивается согласно работе [26] следующим образом:
Рис. 1.
Распространенные типы оптоакустических измерительных ячеек: (а) – латеральная, (б) – фронтальная. Здесь 1 – входящий лазерный импульс, 2 – исследуемый образец, 3 – окно, 4 – зеркало, 5 – приемник звукового отклика, 6 – согласующий демпфер.

Латеральная ячейка не предназначена для “времяразрешающей” калориметрии, она используется для регистрации амплитуды акустического отклика в относительно низкочастотном диапазоне (до 1 МГц). В случаях, когда требования к чувствительности не являются строгими, в качестве латеральной ячейки может использоваться обычная спектрофотометрическая кювета, установленная непосредственно на приемнике давления. Латеральная ячейка – один из немногих типов устройств, позволяющих проводить измерения в условиях фазовых превращений в образце.
Ячейка второго типа, а именно фронтальная (front-face) ячейка (рис. 1б), была разработана для “времяразрешающих” измерений. Такая ячейка более чувствительна по сравнению с латеральной благодаря более полному использованию спектра сигнала. Луч входит в ячейку через окно, распространяется по жидкому образцу и отражается от зеркала, защищающего приемник звукового отклика. Приемник работает непосредственно в области преобразования. Моделирование работы ячейки такого типа проведено в [29, 30]. Так, обнаружено, что амплитуда отклика обратно пропорциональна толщине слоя образца [29]. Однако при толщине слоя менее 25 мкм чувствительность измерений падает из-за помех различной природы. Так, зеркало, защищающее приемник давления от прямого попадания лазерного луча, само по себе является элементом, поглощающим излучение и генерирующим акустическую помеху. Вторым источником погрешности является помеха из-за прямого воздействия лазерного луча на приемник. Эти факторы ограничивают измерительные возможности фронтальной ячейки. Факторы помех, связанных с лазерной генерацией паразитного сигнала на неоднородностях границ стекол ячейки, активно изучаются [31, 32]. С помощью такой ячейки исследовалась структурная релаксация химических соединений в диапазоне до 20 МГц [29], динамика молекулярной безызлучательной релаксации [33], проводилась диагностика содержания липополисахаридов (ЛПС) в вытяжках одноразовых шприцев [34].
Растет число применений и призматической оптоакустической ячейки, в которой слой образца параллелен пластине приемника, а прямое световое воздействие на приемник звука исключается из-за наклонной траектории лазерного луча (рис. 2а). Схема ячейки очень проста в конструктивном плане [35]. Эта ячейка удовлетворяет условиям анализа образцов малого объема, что и привлекает к ней внимание специалистов в области аналитической химии, экологов, специалистов по санитарии. Лазерный нагрев вызывает рост давления в слое образца, зажатом между верхней и нижней кварцевыми призмами. Толщина слоя образца $L$ определяется толщиной кольца, которую, оценочно, изменяют в пределах от 10 до 45 мкм. При современном уровне развития лазерной техники, освоившей излучение импульсов очень малой длительности, $\tau $ = 10 нс и менее, слой удается поддерживать акустически “широким”. Характерные параметры задачи удовлетворяют условиям ${{d}_{{{\text{th}}}}} \ll c\tau = {{d}_{{{\text{ac}}}}} \ll L \ll {1 \mathord{\left/ {\vphantom {1 \alpha }} \right. \kern-0em} \alpha }$, где ${{d}_{{{\text{th}}}}}$ – длина диффузии тепла, c – скорость звука в образце, ${{d}_{{{\text{ac}}}}}$ – длина пробега звука. Можно предложить простейшую одномерную, но наглядную модель работы призматической ячейки. В приближении задачи с начальными условиями адиабатический подход дает для оценки амплитуды прироста давления следующее выражение (расчетная схема показана на рис. 2б):
Рис. 2.
Призматическая ячейка. (а) – Конструктивная и (б) – расчетная схемы. Здесь 1 – падающий луч, 2 и 3 – верхняя и нижняя кварцевые призмы, соответственно, 4 – согласующий демпфер, 5 – кольцо, задающее толщину слоя образца, 6 – образец, 7 – приемник давления.

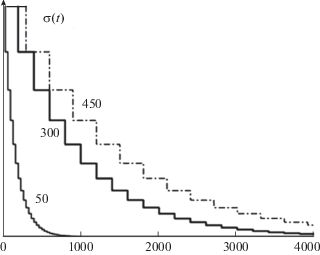
При разгрузке начального избыточного давления ${{p}_{0}}$ в слое жидкого образца возникают импульсы механического напряжения $\sigma (t)$ в материале призмы (кварц):
Рис. 3.
Упругий импульс на входе в призму для значений толщины образца, соответственно, 50, 300, 450 мкм. По горизонтальной оси – время в наносекундах.
Имеем для $G(\omega )$ [30, 37]:
На вход приемника поступает импульс, имеющий спектр $\sigma (\omega ,{{L}_{1}}),$ где ${{L}_{1}}$ – толщина призмы. Влияние $D{\kern 1pt} {\kern 1pt} (\omega ,{{L}_{1}})$ аналогично действию фильтра высоких частот с постоянной времени ${{{{a}^{2}}} \mathord{\left/ {\vphantom {{{{a}^{2}}} {(2{{L}_{1}}{{c}_{1}})}}} \right. \kern-0em} {(2{{L}_{1}}{{c}_{1}})}}$. Регистрация широкополосного импульсного отклика представляет непростую задачу. Подходы к расчету неискажающих широкополосных приемников коротких импульсов давления разработаны в ряде работ, в частности, в [39]. Для определения характеристик приемника в составе призматической ячейки выполним соответствующее моделирование, полагая, что интерфейс “кварц–керамика” акустически согласован. С выхода приемника результирующий электрический сигнал со спектром $U(\omega )$ подается на нагрузку, имеющую импеданс ${{Z}_{{\text{E}}}}(\omega )$. Передаточная функция приемника (спектральная чувствительность) имеет вид $S\left( \omega \right) = {{U(\omega )} \mathord{\left/ {\vphantom {{U(\omega )} {\sigma (\omega ,{{L}_{1}})}}} \right. \kern-0em} {\sigma (\omega ,{{L}_{1}})}}$. Оптимальный режим соответствует активной нагрузке ${{Z}_{{\text{E}}}}(\omega ) = R$, при этом неискажающая регистрация возможна в пределах полосы частот, ограниченной соотношениями $\omega {{\tau }_{{\text{p}}}} \ll 1$ и $\omega {{\tau }_{{{\text{RC}}}}} \gg 1$. Здесь ${{\tau }_{{{\text{RC}}}}} = R{{C}_{{\text{s}}}}$ – постоянная времени, определяемая емкостью ${{C}_{{\text{s}}}}$ преобразователя и сопротивлением нагрузки $R$, ${{\tau }_{{\text{p}}}}$ – время прохождения упругого импульса по толщине пьезокерамической пластины. Спектральную чувствительность с учетом результата работы [39] для активной нагрузки можно представить следующим образом:
Здесь ${{Z}_{{\text{2}}}} = {{\rho }_{{\text{2}}}}{{c}_{2}}$ – акустическое сопротивление пластины пьезокерамического преобразователя, ${{W}_{f}}$ – коэффициент прохождения на границе раздела “кварц–керамика”, ${{\rho }_{{\text{2}}}}$ – плотность, ${{c}_{2}}$ – скорость звука, ${{h}_{{33}}}$ – пьезоэлектрический модуль материала преобразователя. Таким образом, неискажающая регистрация широкополосного импульсного отклика возможна, если использовать “акустически тонкий” пьезокерамический приемник, а постоянную времени ${{\tau }_{{{\text{RC}}}}}$ приемной системы поддерживать относительно большой. В указанном диапазоне чувствительность не зависит от частоты, т.е. $S(\omega ) = S$. Кроме того, значение чувствительности пропорционально толщине приемной пластины. Например, при толщине пластины 0.4 мм и плотности материала ${{\rho }_{{\text{2}}}}$ = 7.5 × 103 кг/м3, ${{c}_{2}}$ = = 4200 м/с и ${{h}_{{33}}}$ = 0.2 × 1010 Кл/Н получаем оценку для S = 6 мкВ/Па. При адекватном приеме отклика можно определить и показатели качества призматической ячейки. Так, при безреагентном детектировании следовых концентраций ЛПС предел обнаружения в призматической ячейке в объемных долях составляет 10–7, что соответствует предельно допустимому содержанию этого вещества. Известны результаты моделирования призматических ячеек применительно к решению задач диагностики фотоактивных сред и детектированию малых концентраций опасных веществ [40, 41].
3. “НЕВОЗМУЩАЮЩЕЕ” ОПТОАКУСТИЧЕСКОЕ ПРЕОБРАЗОВАНИЕ. КОНКУРЕНЦИЯ МЕХАНИЗМОВ
3.1. Нелинейное термоупругое преобразование
Из числа различных нелинейных эффектов, сопровождающих “невозмущающее” оптоакустическое преобразование, наиболее часто встречается трансформация профиля отклика, вызванная температурной зависимостью теплофизических параметров образца [13]. Так, при использовании водного раствора в качестве образца температурная зависимость теплофизических характеристик, в частности, коэффициента объемного теплового расширения ${\kern 1pt} \beta \,(T)$, приводит к изменению условий генерации звука в среде за время тепловыделения и, соответственно, к изменениям звукового отклика. Например, тепловая нелинейность отчетливо проявляется при большой плотности термализованной энергии в средах с заметным оптическим поглощением [42].
Освоение методов оптоакустической томографии показало, что переход в режим тепловой нелинейности может значительно улучшить разрешение изображения [43]. Учет тепловой нелинейности важен и при проведении измерений в тканях, термостатированных в точке максимальной плотности воды ${\kern 1pt} {{T}_{0}}$ = 4°С в целях минимизации фонового отклика. Предполагается, что в соответствии с простыми линейными моделями фоновый отклик раствора в этой точке минимален в силу смены в ней знака величины ${\kern 1pt} \beta \,(T)$ [44]. Однако по данным экспериментов значение точки обращения отклика оценивается различными авторами неодинаково, а согласно, например, работе [45] отклик наблюдается при любой температуре. При одном и том же значении плотности термализованной энергии вклад тепловой нелинейности в звуковой отклик может быть неодинаковым. В точках температурных аномалий, а также при определенных условиях межфазного теплообмена даже весьма скромное тепловыделение стимулирует эффект тепловой нелинейности.
Суммарный профиль акустического отклика ${\kern 1pt} p\,(t)$ в температурной точке ${\kern 1pt} {{T}_{0}}$ представляет суперпозицию линейной составляющей ${\kern 1pt} {{p}_{{\text{L}}}}\,(t)$ и “нелинейной” добавки ${\kern 1pt} {{p}_{{\text{N}}}}\,(t)$, пропорциональной параметру тепловой нелинейности ${\kern 1pt} N$:
Как показано выше, в измерительных схемах, использующих латеральную оптоакустическую ячейку, длительность звукового отклика велика по сравнению с длительностью лазерного импульса $\tau $. Составляющие отклика ${\kern 1pt} {{p}_{{\text{L}}}}\,(t)$ и ${\kern 1pt} {{p}_{{\text{N}}}}\,(t)$ имеют схожие профили и могут компенсировать друг друга, если у них противоположные знаки. При этом термостатирование может эффективно подавлять фоновый сигнал. И, наоборот, если условия генерации и приема отклика таковы, что давление в звуковом отклике успевает следовать за изменениями ${\kern 1pt} \beta \,(T)$ (например, таковы времяразрешающие измерения во фронтальной ячейке), ${\kern 1pt} {{p}_{{\text{L}}}}\,(t)$ и ${\kern 1pt} {{p}_{{\text{N}}}}\,(t)$ имеют различающиеся профили и не могут компенсировать друг друга, а точка обращения фазы сигнала отсутствует [46].
Для характеристики роли тепловой нелинейности при ОА-преобразовании в некоторых биологических тканях оценивают не только зависимость ${\kern 1pt} \beta \,(T)$, но и применяют более общий подход – обращаются к анализу температурной зависимости коэффициента Грюнайзена ${\kern 1pt} \Gamma \,(T)$. Если для дистиллированной воды при комнатной температуре он легко рассчитывается (${\kern 1pt} \Gamma \, = 0.11$), то применительно к некоторым другим средам величина ${\kern 1pt} \Gamma \,(T)$ и его температурная зависимость часто остаются неизвестными. Для корректного моделирования влияния температурной зависимости ${\kern 1pt} \Gamma \,(T)$ используют образец с умеренным или сильным оптическим поглощением. Так, точная калибровка образцов возможна на основе зависимости ${\kern 1pt} \Gamma \,(T)$, полученной в нескольких температурных точках [47]. Известен еще один измерительный метод, “двухимпульсная релаксационная оптоакустическая микроскопия Грюнайзена”. В основу метода положена совместная температурная зависимость входящих в параметр Грюнайзена параметров образцов биологических тканей [48]. Первый (из двух) лазерный импульс генерирует акустический отклик в ансамбле поглощающих на данной длине волны частиц. Через короткое время второй лазерный импульс дополнительно возбуждает эти поглотители. Интервал между импульсами уступает времени тепловой релаксации поглотителей. Благодаря температурной зависимости параметра Грюнайзена возникает второй звуковой отклик, более заметный, чем первый.
В биомедицинской оптоакустической практике используются и другие нелинейные эффекты. Например, в некоторых биологических тканях имеет место насыщение коэффициента оптического поглощения с ростом плотности энергии в лазерном импульсе. Факт нелинейной зависимости амплитуды акустического отклика от плотности энергии лазерного импульса используется для количественного определения степени насыщения кислородом тканей in vivo [49]. Этот вид нелинейности проявляется благодаря разнице времен тепловой релаксации оксигенированных и дезоксигенированных молекул гемоглобина. Приводящий к нелинейному звуковому отклику эффект фотообесцвечивания флюорофоров при ОА-преобразовании использован для существенного повышения пространственного разрешения в диагностике биологических образцов [50]. Эффекты нелинейности в биомедицинской оптоакустической практике рассмотрены в обзоре [11]. Показано, что учет даже таких нелинейных ОА-эффектов, которые представляются подчас экзотическими, не только позволяет подавить различные виды помехи при измерениях, но и создает предпосылки для создания новых диагностических инструментов.
3.2. Оптоакустическое преобразование в неоднородных жидкостях
В этом разделе рассматриваются особенности “невозмущающего” ОА-преобразования в суспензиях. В экспериментах советских авторов 1980-х гг., по-видимому, было впервые обнаружено влияние взвешенных частиц на ОА-преобразование в слабопоглощающих жидких средах [51, 52]. Эти исследования обогатили развитые ранее “идеальные” модели термоупругого механизма. Лазерная генерация звукового отклика, вызванного присутствием частиц, проявляется и при весьма умеренных значениях термализованной оптической энергии, когда пороги фазовых превращений еще не достигнуты. С появлением широко цитируемых работ [53, 54] этот отклик, характерный для преобразования в суспензиях, коллоидных растворах, эмульсиях, привлек широкое внимание.
В зависимости от задачи, микроскопические неоднородности в образце – частицы, макромолекулы – могут представлять помеху, а могут и сами представлять объект ОА-диагностики. Стимулом к развитию моделей невозмущающего термоупругого преобразования в неоднородных искусственных и реальных средах явились задачи детектирования взвесей в малых концентрациях. Накоплен определенный опыт решения с помощью оптоакустических измерений задач биологии, медицины и аналитической химии. Это: (а) детектирование следовых концентраций макромолекул ЛПС; (б) контроль производства суспензий полистироловых микросфер; (в) диагностика эмульсий в биологической и экологической практике.
Модели ОА-преобразования в неоднородных средах развиты, в частности, в работах [55–57]. Были развиты принципы ОА-томографии оптически неоднородных сред и впервые решена задача о детектировании отдельной неоднородности в светорассеивающей среде [57]. Дана модель преобразования, учитывающая перекрытие температурных волн соседних частиц [56]. Температурные поля отдельных частиц перекрываются, если, например концентрация суспензии значительна. При этом ОА-преобразование происходит (с точностью до небольшой добавки) так же, как и в однородной жидкости. Условия “микрооднородной” жидкости характеризуются соотношением ${{N}_{0}} \gg 4{{(\chi \tau )}^{{3/2}}}$ [57]. В этой ситуации возможности оптоакустического детектирования частиц сокращаются.
По отдельности рассматривают случаи термически больших (длина диффузии тепла за время лазерного импульса значительно меньше размера частицы) и термически малых частиц. Известные модели несколько различаются с точки зрения количественных характеристик отклика. Однако есть и общее: звуковой отклик представлен суммой трех слагаемых: вклада источника термоупругих возмущений собственно в растворителе, вклада источника, связанного с передачей тепла от частиц в жидкость (“тепловой поршень”), а также вклада, связанного с собственным расширением нагретых частиц (“механический поршень”).
При облучении суспензии наносекундными лазерными импульсами выравнивание температуры по объему микронной частицы происходит за время, существенно бо́льшее длительности лазерного импульса ${{\tau }_{R}} = {{R_{0}^{2}} \mathord{\left/ {\vphantom {{R_{0}^{2}} \chi }} \right. \kern-0em} \chi } \gg \tau $, где $\chi $ – температуропроводность вещества частицы, $R{{_{0}^{{}}}_{{}}}$ – радиус частицы. На динамику теплопередачи от частиц к жидкости влияет соотношение их коэффициентов тепловой активности, ${{\Psi }_{{{\text{P,L}}}}} = (\kappa \rho {{C}_{{\text{P}}}})_{{{\text{P,L}}}}^{{1/2}}$, где $\kappa $ – коэффициент теплопроводности, $\rho $ – плотность, а индексы Р, L, соответственно, относятся к частице и жидкости. Для диэлектрических частиц выполняется соотношение ${{\Psi }_{{\text{L}}}} \gg {{\Psi }_{{\text{P}}}}$. В этих условиях ${{\tau }_{{\text{R}}}}$ представляет длительность действия теплового поршня, и длительность суммарного отклика увеличивается. Относительная роль вклада теплового поршня оценочно определяется соотношением $B = {{{{N}_{0}}{{k}_{{\text{a}}}}\pi R_{0}^{2}} \mathord{\left/ {\vphantom {{{{N}_{0}}{{k}_{{\text{a}}}}\pi R_{0}^{2}} \alpha }} \right. \kern-0em} \alpha }$, ${{N}_{0}}$ – числовая концентрация частиц. В отсутствие частиц взвеси $B = 0$ и звуковой отклик связан с ОА-преобразованием в растворителе. Значение $B = 1$ отвечает равному вкладу термоупругих источников двух видов. Этому значению $B$ при $R_{0}^{{}}$ = 2 мкм, ${{k}_{{\text{a}}}}$ = 1, $\alpha $ =10–4 см–1 соответствует ${{N}_{0}}$ = 103 см–3 (объемная доля взвеси 10-8). Дополнительный механизм оптоакустического преобразования, связанный с передачей тепла от частиц к растворителю, приводит к увеличению амплитуды общего отклика пробы и его затягиванию. Последнее обстоятельство сближает рассматриваемую задачу с задачами импульсной оптоакустики релаксирующих сред. При $B > 1$ анализ отклика в полосе низких частот дает возможность количественного определения содержания взвеси. При $B \gg 1$ доминирует вклад “теплового поршня”. Третий вклад (“механический поршень”) представляет малую добавку по отношению к другим составляющим.
Появление низкочастотных компонент в отклике используется для повышения селективности ОА-диагностики. В эксперименте [58] образец, содержащий макромолекулы ЛПС в водном растворе, помещался в пьезокерамический цилиндр. Лазерный луч на длине волны, соответствующей полосе поглощения макромолекул – (275–305) нм – проходил через образец соосно с цилиндром. В качестве измерительного параметра принято соотношение амплитуд откликов на частотах кольцевого и толщинного резонансов цилиндра. В однородном водном образце отклик возбуждался преимущественно на частоте 900 кГц (частота толщинного резонанса цилиндра), а с ростом концентрации ЛПС в образце возрастала и амплитуда отклика на частоте кольцевого резонанса цилиндра – 80 кГц.
При преобразовании в водных суспензиях проявляются особенности эффекта тепловой нелинейности. В классических опытах в точке максимальной плотности воды экспериментально наблюдался т.н. “трехполярный” звуковой импульс. Простая модель нелинейного преобразования в неоднородных средах объясняет такой профиль отклика [55]. Учет вклада тепловой нелинейности в суспензиях важен при выявлении звукового отклика неоднородностей на фоне отклика растворителя. Нелинейность отклика циркулирующих в крови отдельных и грозящих метастазами клеток меланомы используется в эксперименте [59] для выявления этого отклика на фоне сигнала помехи, связанного с ОА-преобразованием в эритроцитах, а также для перехода к детектированию единичных аномальных клеток.
Современные модели оптоакустического преобразования в суспензиях восходят к работам [60, 61], давшим строгое решение задачи излучения звука одиночной нагретой сферической частицей в жидкости. Оценена и степень влияния эффектов акустической релаксации в эмульсиях и суспензиях на этапе распространения отклика.
3.3. Оптоакустика и суспензии наночастиц
Как отмечалось выше, ОА-преобразование в суспензиях наночастиц изучается в целях разработки новых диагностических и терапевтических методов. Биологические ткани имеют слабое поглощение в оптическом диапазоне, что ограничивает эндогенный контраст при визуализации. Контраст изображения может быть повышен при введении внешних, экзогенных контрастных веществ, в качестве которых и выступают наночастицы [8, 9]. Распространение получили наночастицы сложного состава. Например, золотые наночастицы с диэлектрическим покрытием из диоксида кремния используются как для предотвращения их разрушения при высокой плотности энергии в лазерном импульсе, так и для увеличения эффективности ОА-преобразования. Такая структура затрудняет теплопередачу “золото–вода” и предотвращает перегрев слоя воды.
Наночастицы с эффектом плазмонного резонанса, применяемые in vivo, конструируются для обеспечения эффективного поглощения света на длине волны в пределах от 600 до 900 нм. За редким исключением, для применения in vivo допускают только режимы преобразования, при которых удается избежать парообразования на поверхности перегретых частиц. В этих условиях тепловая нелинейность часто вносит доминирующий вклад. Соответственно, основу практического применения составляет модель нелинейного теплового ОА-преобразования [62]. При том, что амплитуда звукового отклика в линейном режиме хорошо предсказывается моделью точечного источника, введенной в работе [60], результаты [62] показывают, что модель [60] значительно завышает амплитуду звукового отклика в нелинейном режиме. Модель [62] дает количественные оценки т.н. критической энергии, определяемой как поглощенная энергия, необходимая для того, чтобы линейный и нелинейный вклады в звуковой отклик были равны.
Характеристики звукового отклика в суспензиях металлических наночастиц хорошо изучены и в экспериментальном плане. Так, получены зависимости амплитуды звукового отклика в суспензиях от длины волны облучения, а также от размеров (в пределах 8–90 нм), формы и состава наночастиц [16, 44]. В подобных опытах для предотвращения фазовых переходов на частицах и образования пузырьков плотность оптической энергии в импульсе ограничивается величиной 5 мДж/см2. Используются лазерные импульсы с длительностью не больше нескольких единиц наносекунд. Такое же значение пороговой плотности оптической энергии – 5 мДж/см2 – эмпирически определено и в работе [63]. В этой же работе исследуются и перспективы применения суспензии золотых наночастиц различной формы для невозмущающей ОА-визуализации in vivo. Например, интерес вызывают золотые “наностержни” с покрытием.
Термостатирование образцов суспензий при различных температурах проводится для разделения вкладов линейного и нелинейного термоупругих механизмов. Например, ОА-измерения проводятся в проточном капилляре, подвешенном в термостатированной ванне при температуре ${\kern 1pt} {{T}_{0}}$ = 4°С [44]. В этой температурной точке реализуются различные сценарии излучения звукового отклика суспензиями наночастиц [64, 65]. В эксперименте [66] исследуется ОА-преобразование в суспензиях как золотых наночастиц, так и содержащих краситель полистироловых наночастиц при различных концентрациях и в трех температурных точках (4, 20 и 37°С). При температуре ${\kern 1pt} {{T}_{0}}$ = 4°С амплитуда отклика отличается от нулевых значений и увеличивается с ростом размера частиц (в особенности, полистироловых), что также согласуется с простыми моделями начала 1990-х гг. Действительно, известные нелинейные модели предсказывают различную степень успеха гашения отклика, например, в зависимости от конфигурации приемной системы.
В настоящее время исследования направлены на оптимизацию типа наночастиц для конкретного биомедицинского применения (визуализация, селективное детектирование в потоке). Суспензии наночастиц уже используются для проведения различных медицинских диагностических и терапевтических процедур, например, в цитометрии.
3.4. Оптоакустика неоднородных сред в задачах проточной цитометрии
Одним из востребованных приложений оптоакустики неоднородных сред является проточная цитометрия. Это современная технология измерения характеристик клеток, их органелл и происходящих в них процессов. Исследуемые клетки вводятся в высокоскоростной ламинарный искусственный поток, в котором они выстраиваются одна за другой и перемещаются через область фокусировки лазерного излучения. В стандартной оптической версии проточной цитометрии измерения основаны на регистрации рассеянного лазерного излучения или лазерно-индуцированной флюоресценции. Параметры рассеяния света позволяют количественно оценить свойства циркулирующих клеток. Эта процедура in vitro применяется для изучения воздействия различных факторов на здоровые и аномальные человеческие клетки. Соответственно, она пригодна и для ранней диагностики заболеваний [67]. Версия in vitro предполагает извлечение клеток из живой системы, что может изменить их свойства. В этом смысле оказался перспективным неинвазивный in vivo метод проточной оптоакустической цитометрии [68]: клетки крови или лимфы облучаются через кожу сфокусированным на кровеносном или лимфатическом сосуде лазерным пучком. Доставка излучения к объекту обычно осуществляется с помощью микроскопа или оптического волокна с фокусирующим наконечником. Доминирует рассмотренный выше вклад “теплового поршня”: при поглощении излучения клетками в области фокусировки в окружающую жидкость передается тепло. В жидкости генерируются звуковые отклики, которые регистрируются с помощью приемника, находящегося в контакте с кожей. По оценке [67] метод проточной ОА-цитометрии имеет преимущество перед традиционной оптической версией метода при исследовании глубоко залегающих сосудов in vivo (до 1–3 см). Обеспечивается высокая чувствительность, достаточная для обнаружения одиночных циркулирующих клеток за счет их собственного поглощения или поглощения излучения прикрепленными к ним сильно поглощающими характеристическими метками.
Развитие ОА-цитометрии идет по пути адаптации длины волны лазерного излучения и параметров оптического поглощения меток-мишеней, образующих комплексы с аномальными клетками. Так, комбинация двух типов наночастиц в качестве меток используется для детектирования клеток рака молочной железы в потоке [69]. Первый тип – это углеродные нанотрубки с золотой оболочкой, а второй – наночастицы с магнитными свойствами, состоящие из ядра (оксид железа) и полимерной оболочки. Магнитные свойства этих частиц использовались для концентрирования комплексов “метка-мишень” под сильным постоянным магнитом в целях увеличения амплитуды сигнала, а также для последующего уничтожения этого скопления. Применены два лазера с длинами волн 900 и 639 нм, излучающих импульсы с небольшим временным сдвигом для раздельной регистрации откликов каждой из групп частиц. Это позволило улучшить селективность метода. В другом показательном эксперименте система проточной ОА-цитометрии, использующая лазеры с высокой частотой следования импульсов на длинах волн 532, 671 и 820 нм, продемонстрировала идентификацию и подсчет эритроцитов, инфицированных малярией [70].
Развитие этой технологии требует экспериментального и математического моделирования. Так, показана возможность оптоакустической дискриминации оксигенированных и дезоксигенированных эритроцитов в модельных суспензиях [71].
4. КАВИТАЦИОННЫЕ ПРОЦЕССЫ ПРИ ОА-ПРЕОБРАЗОВАНИИ
Звуковой отклик “кавитационной” природы при лазерном облучении образцов используется in vitro для детектирования следовых концентраций частиц или in vivo для терапевтических и хирургических приложений [72]. Зародышами кавитации являются частицы взвеси природного или искусственного происхождения или другие неоднородности. Если при облучении суспензии локальная плотность энергии достигает некоего порогового значения, температура частицы может превысить температуру кипения растворителя. На поверхности перегретых частиц развивается фазовый переход. Расширяющийся и схлопывающийся пузырек является эффективным излучателем звука. Амплитуду первого звукового отклика отдельной “кавитационной” частицы можно принять пропорциональной превышению плотности энергии над пороговым значением, $p(\varepsilon )\; \sim \;(\varepsilon - {{\varepsilon }_{{{\text{th}}}}})$. В определенном интервале плотностей энергии, при $\varepsilon > {{\varepsilon }_{{{\text{th}}}}}\;$ кавитационный механизм сосуществует с линейным и нелинейным термоупругим механизмами ОА-преобразования.
При наличии в образце только фоновых, как правило, диалектрических частиц нижний предел этого интервала плотности энергии ${{\varepsilon }_{{{\text{th}}}}}$ дается выражением [73]:
Различают “начальный” по энергии и/или по концентрации частиц режим кавитации и режим развитой кавитации. Начальный режим охватывает отдельные частицы и отличается слабой повторяемостью амплитуды звукового отклика суспензии в серии от одного импульса облучения к другому. Для начального режима кавитации в неоднородных жидкостях при малом поглощении растворителя характерно ОА-преобразование по типу т.н. комбинированного механизма преобразования. А именно, серия звуковых откликов представляет, в основном, термоупругие отклики постоянной амплитуды от нагретых растворителя и частиц. Эти отклики чередуются с редкими импульсами большой амплитуды “кавитационного” происхождения [74, 75]. Статистические эффекты, проявляющиеся при обработке записей серий флуктуирующего звукового отклика, могут быть использованы при детектировании следовых концентраций примесей. В частности, можно дискриминировать вклады в отклик от фоновых частиц и регистрировать вклады только от искусственно введенных контрастных частиц [72].
На рис. 4 показана запись амплитуд откликов в серии импульсного облучения воды в режиме начальной кавитации [75]. Объект облучения – дистиллированная вода, прошедшая двойную фильтрацию (диаметр природных частиц, оставшихся в образце после фильтрации, менее 300 нм). Плотность оптической энергии незначительно превышает порог кавитации. Сосуществование механизмов состоит в том, что наиболее часто в серии встречаются звуковые отклики термоупругого происхождения, а средняя амплитуда в серии определяется редкими, но интенсивными импульсами кавитационного характера.
Рис. 4.
Пример записи серии 2000 амплитуд звуковых откликов, зарегистрированных в латеральной конфигурации [75]. Перепечатано с разрешения © The Optical Society.

При обработке записей отклики группируют или ранжируют по амплитуде. Второй вариант предпочтительнее – он позволяет работать с относительно небольшими выборками, например, использовать серии всего в несколько сотен записей. На рис. 5 обобщенно показаны результаты обработки 200 записей в виде диаграммы “ранг $r$–амплитуда ${{p}_{{\text{m}}}}$” в двойных логарифмических координатах для четырех образцов – исходного образца воды и образцов водных суспензий золотых наночастиц трех различных концентраций. Плотность лазерной энергии поддерживалась постоянной от импульса к импульсу. Графики на рисунке получены следующим образом. Звуковому отклику, имеющему максимальную амплитуду, присваивается ранг 1. И, наоборот, самое маленькое значение амплитуды – у отклика, получившего ранг 200. Для суспензий малой концентрации и умеренных значений оптической плотности ранговое распределение амплитуд откликов соответствует эмпирическому степенному закону Ципфа–Мандельброта
Рис. 5.
Ранговое распределение амплитуд звуковых откликов как результат обработки записей четырех экспериментальных серий облучения жидких образцов по 200 импульсов в серии [75]. Перепечатано с разрешения © The Optical Society.

Режим начальной кавитации исследуется в целях развития методов детектирования примесей in vitro или для уточнения величины опасных пороговых плотностей энергии при облучении биологических тканей in vivo. Действительно, при достижении порога кавитации расширяющиеся парогазовые пузырьки и импульсы давления большой амплитуды повреждают ткани. Например, этого эффекта избегают при микрокоагуляции сетчатки глаз. Переход к режиму развитой кавитации достигается не только увеличением концентрации частиц одинакового размера в суспензии, но и повышением плотности оптической энергии. Режим развитой кавитации составляет основу процедур точечного механического разрушения клеток и лежит в основе перспективных методов противоопухолевой терапии. Признано, что лазерное облучение суспензии наночастиц с “кавитационным” продолжением эффективно для селективного разрушения аномальных клеток и тканей [76].
Разработаны модели лазерно-индуцированной кавитации в коллоидных растворах, использующие теорию Ми, уравнение состояния газа, уравнение Рэлея–Плессета. Модели подробно описывают коллективный звуковой отклик суспензии. Численное моделирование динамики пузырька дает основу для оптимизации параметров облучения в медицинских приложениях. Например, пытаются найти оптимальный диаметр пузырька на максимуме расширения для наиболее эффективного разрушения аномальных клеток [77]. Предполагается, что максимальный радиус пузырька пропорционален корню квадратному “надпорогового” значения плотности энергии [80].
В целом, модели хорошо согласуются с экспериментальными результатами. В биомедицинской практике экспериментально хорошо отработаны различные по энерговкладу режимы облучения суспензии сферических золотых наночастиц с диаметрами 10–100 нм [79, 80]. Эксперименты также показывают, что при облучении на длине волны 532 нм наиболее эффективное ОА-преобразование соответствует диаметру частиц 70 нм [81]. Экспериментально измеренное максимальное давление в коллективном звуковом отклике суспензии линейно возрастает с увеличением плотности оптической энергии, что качественно совпадает и с более простыми моделями для режима развитой кавитации [75].
Плотность энергии, необходимая для достижения режима развитой кавитации, как правило, превышает максимально допустимую лазерную экспозицию, допустимую для биомедицинского применения. Например, для длины волны 800 нм пороговая экспозиция задается величиной 30 мДж/см2 [82], а воздействие, приводящее к устойчивому образованию пузырьков на золотых частицах диаметром 90 нм в водной среде при облучении на “резонансной” длине волны 532 нм, близко к 60 мДж/см2. Применение специально подобранного покрытия наночастиц, оптимизирующего теплопередачу растворителю, либо наложение внешнего ультразвукового поля, может способствовать возникновению развитой кавитации при меньших значениях плотности оптической энергии [68].
Сегодня быстро развивается т.н. тераностика – медицинская технология, предполагающая одновременное применение диагностики и терапии. Так, при выявлении раковых клеток их сразу уничтожают. Оптоакустический вариант тераностики, использующий кавитацию, представляется перспективным. В экспериментах in vitro потенциал ОА-тераностики был проверен: на первом этапе проводился десятиминутный мониторинг свободно циркулирующих клеток меланомы при малой плотности оптической энергии с регистрацией звукового отклика. На втором этапе клетки в течение часа циркулировали при повышенной плотности энергии в режиме лазерно-индуцированной кавитации. Происходило их разрушение. На третьем этапе мониторинг клеток повторялся. В различных опытах содержание клеток после процедуры снижалось в 3–11 раз [83].
5. ОПТОАКУСТИЧЕСКАЯ ВИЗУАЛИЗАЦИЯ В БИОМЕДИЦИНЕ
Визуализация, основанная на генерации звука в биологических тканях короткими лазерными импульсами, – быстро развивающееся приложение оптоакустики [3]. Растет число разрабатываемых инструментов и алгоритмов реконструкции изображений. Предпринимаются усилия для стандартизации процедур и для скорейшего перехода к клинической практике.
Методы ОА-визуализации основаны на приеме звукового отклика, возникающего при передаче тепла в окружающую среду от поглощающих эндогенных тканевых хромофоров или экзогенных контрастных агентов, либо при их собственном расширении. Генерация звукового отклика соответствует, как правило, линейному термоупругому механизму. Регистрация отклика широкополосными приемниками давления обеспечивает спектральную селективность и контраст изображения, а также высокое пространственное разрешение, характерное для более традиционной ультразвуковой визуализации [5]. Исследователи, используя времяразрешающую регистрацию звукового отклика при поглощении в биологической ткани рентгеновского или СВЧ-излучения или потоков проникающих заряженных частиц, получили информацию о внутренней структуре тканей. В начале 2000-х гг. были получены ОА-изображения достаточно высокого качества in vivo [84]. История развития методов ОА-визуализации изложена в [85]. В обзоре [3] было отмечено незначительное на момент его публикации число исследований оптоакустической визуализации in vivo. Указано и на недостаток опыта получения и интерпретации ОА-изображений в целях медицинской диагностики. За прошедшие со времени публикации этого обзора годы достигнут значительный прогресс в развитии методов, выполнены многочисленные исследования приложений in vivo, появились прототипы систем визуализации для клинической практики. Опубликованы обзоры общего характера [5–7] и обзоры профильные, обобщающие опыт ОА-визуализации в онкологии, неврологии, офтальмологии [86, 87].
Системы ОА-визуализации не свободны от недостатков. Многоэлементные акустические приемники и многоканальные системы регистрации откликов – сложные и дорогие устройства. Лазерные источники также дороги и сложны в обслуживании. Переход к простым и недорогим источникам типа диодных лазеров еще предстоит.
В числе методов ОА-визуализации выделяются три группы [88, 89]. Это ОА-томография, ОА-микроскопия и минимально инвазивная ОА-визуализация.
5.1. Оптоакустическая томография
В ОА-томографии проводится регистрация звукового отклика многоэлементными решетками или несколькими пространственно разнесенными антеннами. При обработке отклика реконструируется изображение поглощающих неоднородностей биологической ткани [88]. Технология реконструкции основана на том, что временной профиль звукового отклика содержит информацию о распределении начального давления, которое можно восстановить, решив обратную задачу ОА-томографии [3]. Пространственное распределение коэффициента оптического поглощения биологической ткани реконструируется с использованием параметра Грюнайзена и параметров распределения плотности лазерного излучения в среде.
Методы регистрации звукового отклика и конфигурации томографических систем применительно к различным биомедицинским приложениям рассмотрены в обзорах [2, 3]. Описаны основные методы решения обратной задачи ОА-томографии, рассмотрено влияние различных факторов, связанных с регистрацией отклика, на точность реконструкции22 изображения. Пространственное разрешение, т.е. минимальный размер поглощающей неоднородности, звуковой отклик от которой может быть зарегистрирован без искажений, оценивается как $\delta = {с \mathord{\left/ {\vphantom {с {\Delta {\kern 1pt} f}}} \right. \kern-0em} {\Delta {\kern 1pt} f}}$, где $с$ – скорость звука в биологической ткани, $\Delta {\kern 1pt} f$ – ширина частотной полосы приемника [3]. В силу частотно зависимого поглощения звука в биологической ткани [24] ширина спектра акустического отклика $\Delta {\kern 1pt} {{f}_{{\text{s}}}}$, дошедшего до приемника, может оказаться меньше, чем $\Delta {\kern 1pt} f$. В этом случае разрешение метода будет определяться величиной $\Delta {\kern 1pt} {{f}_{{\text{s}}}}$. Достижимая глубина изображения в ОА-томографии определяется, главным образом, глубиной проникновения лазерного излучения. Так, на длине волны $\lambda = 700\;{\text{нм}}$ характерное значение эффективного коэффициента ослабления лазерного излучения ${{\mu }_{{{\text{eff}}}}} = 0.13\,\,{\text{м}}{{{\text{м}}}^{{ - 1}}}$ [4]. Соответственно, глубина проникновения излучения составляет величину ${1 \mathord{\left/ {\vphantom {1 {{{\mu }_{{{\text{eff}}}}}}}} \right. \kern-0em} {{{\mu }_{{{\text{eff}}}}}}} \cong 8\,\,{\text{мм}}$. Пространственное разрешение масштабируется с глубиной изображения в ткани, причем соотношение глубины и разрешения остается приблизительно постоянным на уровне порядка 1/200 [5].
Разрешение лежит в диапазоне от нескольких десятков мкм при глубине изображения в несколько мм до нескольких сотен мкм при глубине изображения в несколько см [4, 71]. Для расширения полосы приема сигнала и повышения разрешающей способности прибегают к оптической схеме регистрации ультразвука на основе прозрачного эталона Фабри‑Перо из полимерной пленки, зажатой между парой зеркал. Сканирование считывающего лазерного луча по поверхности эталона создает виртуальный массив приемников и обеспечивает регистрацию звукового отклика в полосе частот до нескольких десятков мегагерц. Этим методом получены изображения подкожной сосудистой сети на глубине примерно 4 мм [4].
Специальные методы реконструкции ОА-изображения, компенсирующие влияние как неоднородности скорости звука [90], так и акустического затухания [91], предназначены для улучшения качества изображения в акустически неоднородных биологических тканях. В условиях значительной акустической неоднородности параллельно используется ультразвуковая диагностика области распространения сигнала. При выполнении количественной ОА-томографии оптическая неоднородность исследуемой биологической ткани обусловливает использование нескольких последовательных приближений для корректного расчета оптического поля [10].
Предлагается улучшить разрешение изображения в ОА-томографии за счет “включения” нелинейных механизмов генерации звукового отклика [43]. Показано, что в условиях, когда проявляется тепловая нелинейность, профиль звукового отклика оказывается результатом естественного вейвлет-преобразования от пространственного распределения тепловых источников, соответственно, фильтрация полезного сигнала из шума происходит более эффективно. Механизм тепловой нелинейности может быть использован для повышения качества изображения ОА-томографии при плотности энергии излучения, удовлетворяющей требованиям санитарных норм.
Так как глубина изображения в ОА-томографии составляет несколько сантиметров, метод хорошо отработан в ходе исследований на мелких лабораторных животных [92]. Более дешевой альтернативой ОА-томографии в некоторых приложениях является ОА-микроскопия [4].
5.2. Оптоакустическая микроскопия
ОА-микроскопия основана на последовательном сканировании целевого объекта широкополосным фокусирующим акустическим приемником при подсветке объекта, как правило, сфокусированным лазерным излучением. Область фокусировки лазерного излучения и фокальная зона приемника совмещаются в целевом объекте для достижения максимальной чувствительности. На рис. 6 обобщенно показаны две популярные конфигурации ОА-микроскопов. В ОА-микроскопе с акустическим разрешением (рис. 6а) лазерное излучение направляется к объекту с помощью оптической системы, создающей полый конус слабо сфокусированного света и состоящей из конической линзы и кольцевого зеркала. Фокусирующий акустический приемник размещается внутри этого конуса. Диаметр поперечного сечения фокальной зоны приемника звука определяет латеральную разрешающую способность микроскопа. Продольное разрешение определяется полосой частот принимаемого звукового отклика сигнала или характеристиками приемника и находится в диапазоне 10–100 мкм [89]. ОA-микроскоп с акустическим разрешением используют для получения изображений на глубине нескольких сантиметров, при этом глубина изображения масштабируется при изменении ширины полосы пропускания и фокусного расстояния приемника давления [4]. ОA-микроскоп с акустическим разрешением (поле зрения 8 × 8 мм, шаг сканирования 20 мкм) был применен для реконструкции изображений дермальной и подкожной сосудистой сети, а также для визуализации доброкачественного пигментного поражения кожи и для демонстрации возможности выявления меланом по их морфологии и составу [93]. ОА-микроскопы этого типа использовались в доклинических исследованиях микрососудов мозга [94] и кожи [95].
Рис. 6.
Схемы ОА-микроскопов: (а) – микроскоп с акустическим разрешением, (б) – микроскоп с оптическим разрешением. Здесь 1 – лазерное излучение, 2 – коническая линза, 3 – кольцевое зеркало, 4 – акустический приемник, 5 – звуковой пучок, 6 – область фокусировки лазерного излучения, совмещенная с фокальной зоной приемника в объекте, 7 – фокусирующая оптическая линза, 8 – коррегирующая линза, 9 – призмы, 10 – слой силиконового масла, 11 – акустическая линза.

В ОА-микроскопе с оптическим разрешением (рис. 6б) для локализации области поглощения оптического излучения в биологической ткани используется фокусировка оптического излучения. Лазерное излучение проходит через две прямоугольные призмы. Между призмами находится тонкий слой оптически прозрачного силиконового масла, выполняющий роль акустического отражателя. Звуковой отклик, возбуждаемый в результате поглощения лазерного излучения в ткани, проходит через акустическую линзу и – после отражения от слоя силиконового масла – регистрируется приемником давления. Латеральное разрешение микроскопа этого типа определяется ограниченным дифракцией диаметром поперечного сечения сфокусированного лазерного луча и составляет единицы мкм. В этом отношении устройство существенно превосходит ОА-микроскоп с акустическим разрешением. Высокое латеральное разрешение, достигнутое в этой версии, позволило реконструировать изображения отдельных капилляров и даже отдельных эритроцитов (диаметр 7–10 мкм) в ухе мыши [96]. Значение продольного разрешения, также, как и в ОА-томографии, и в ОА-микроскопии с акустическим разрешением, ограничено акустическим затуханием или полосой пропускания приемника давления. Эта величина уступает значению латерального разрешения и составляет величину примерно 10 мкм [4].
5.3. Минимально инвазивные и комбинированные схемы ОА-визуализации
Минимально инвазивная ОА-визуализация, в отличие от неинвазивных томографии и микроскопии, предполагает введение оптического волокна в организм, что обеспечивает самую большую по сравнению с другими методами глубину изображения (более 10 см) [89]. Главным стимулом к ее развитию является стремление преодолеть ограничения, которые накладывает на клиническое применение малая глубина проникновения в рассеивающих и поглощающих оптическое излучение биологических тканях. Применяются два варианта: ОА-эндоскопия (оптическое излучение и приемник давления совместно вводятся в тело) [4] и интервенционная ОА-визуализация (излучение вводится в тело, а приемник находится снаружи в контакте с поверхностью) [89].
Существует несколько потенциальных клинических применений оптоакустики, в которых доступ к исследуемой области можно получить только путем введения миниатюрного эндоскопического зонда. Это, например, диагностика ишемической болезни сердца, рака простаты и патологий желудочно-кишечного тракта. Для этих приложений были разработаны прототипы ОА-эндоскопических устройств (в том числе и внутрисосудистых), подобных обычным ультразвуковым эндоскопам [97]. Интервенционная ОА-визуализация – перспективный инструмент контроля при выполнении небольших хирургических и диагностических процедур.
Близки к внедрению в клиническую практику комбинированные устройства, совмещающие неинвазивную ОА-визуализацию и ультразвуковое (УЗ) исследование объекта [98]. ОА-изображение позволяет выявить структуру сосудистой сети, а УЗ-изображение дает информацию о морфологии окружающей ткани на основе ее механических свойств. В этих устройствах использована схема ОА-микроскопии, и они созданы на основе стандартных УЗ-сканеров, к которым с помощью оптических волокон подведено лазерное излучение. Облучение биологической ткани проводилось непосредственно под приемником давления. С помощью такого сканера оценивалось качество донорской почки. Была количественно определена степень фиброзного поражения почки, а также выявлены вариации содержания коллагена [99]. Описана также схема объединения коммерчески доступного диагностического УЗ-приемника с двумя пучками оптических волокон, доставляющих лазерное излучение к целевому объекту [100]. Эта схема обеспечивает совместную реконструкцию двумерных ОА- и УЗ-изображений и позволяет обнаруживать сторожевые лимфатические узлы глубокого залегания в процедурах маммографии.
Хорошие результаты в экспериментах in vivo по наблюдению доставки меченого лекарства при инъекции в мышь показала комбинированная схема ОА- и УЗ-визуализации, описанная в работе [101]. В отличие от варианта [100] она использует компактный маломощный лазер с высокой частотой повторения импульсов (до 1 кГц), а также коммутатор, который поочередно направляет излучение в одно из 20 волокон, окружающих УЗ-матрицу. При этом для каждого лазерного импульса выполняется реконструкция фрагмента ОА-изображения. Полное изображение формируется путем когерентного суммирования фрагментов с частотой получения изображений 50 Гц. Имеется возможность быстрой перестройки длины волны в диапазоне 715–875 нм с шагом 20 нм. Этот режим позволяет более надежно различать хромофоры биологической ткани и контрастные агенты.
ЗАКЛЮЧЕНИЕ
В настоящем обзоре удалось охватить относительно небольшую часть публикаций, касающихся особенностей оптоакустического преобразования в неоднородных биомедицинских средах. Было показано, что учет этих особенностей позволяет купировать помехи и повысить показатели качества диагностики сред. С учетом конкуренции механизмов преобразования открываются новые возможности решения диагностических и терапевтических задач.
Среди других направлений в последнее десятилетие наиболее быстрое развитие получила оптоакустическая визуализация. Достигнут значительный прогресс в решении различных диагностических задач in vivo. Повысилось качество изображений (разрешение и контрастность), сократилось время получения изображений, и увеличилась доступная глубина. На пороге клинического применения находятся ручные малогабаритные сканеры, реализованные по схемам ОА-микроскопии и допускающие комплексирование с системами ультразвуковой визуализации. Оптоакустика показала хорошие результаты в доклинических исследованиях динамики заболеваний, новых препаратов и методик лечения, для которых раньше требовалось большое число мелких лабораторных животных. Сегодня расход лабораторных животных во многих случаях уменьшился.
Быстрое развитие оптоакустических методов имеет не только положительные стороны. Так, применительно к биомедицинской визуализации, разнообразие предложенных решений чревато угрозой потери общего консенсуса. Вновь созданный Международный консорциум по стандартизации в области оптоакустики призван этот консенсус обеспечить. Определены четыре ближайшие цели Консорциума. Это: (а) установление единообразия фантомов для тестирования систем ОА-визуализации на доклиническом и клиническом уровнях; (б) согласование условий применения фантомов для количественного сравнения различных систем визуализации; (в) создание опорного массива данных для тестирования алгоритмов спектральной обработки и реконструкции данных; (г) обеспечение возможности верификации уже опубликованных результатов тестами, разработанными для новых систем визуализации.
Исследование выполнено при финансовой поддержке РФФИ в рамках проекта № 20-12-50131.
Список литературы
Bohndiek S.E., Cox B., Joseph J. et al. IPASC: A community-driven consensus-based initiative towards standardisation in photoacoustic imaging // 2020 IEEE International Ultrasonics Symposium (IUS). IEEE, 2020. P. 1–4. https://www.ipasc.science/ipasc.science/ (дата обращения 06.07.2021 г.)
Xu M., Wang L.V. Photoacoustic imaging in biomedicine // Rev. Sci. Instrum. 2006. V. 77. № 4. P. 041101.
Хохлова Т.Д., Пеливанов И.М., Карабутов А.А. Методы оптико-акустической диагностики биотканей // Акуст. журн. 2009. Т. 55. № 4–5. С. 672–683.
Beard P. Biomedical photoacoustic imaging // Interface Focus. 2011. V. 1. № 4. P. 602–631.
Wang L.V., Hu S. Photoacoustic tomography: in vivo imaging from organelles to organs // Science. 2012. V. 335. № 6075. P. 1458–1462.
Taruttis A., Ntziachristos V. Advances in real-time multispectral optoacoustic imaging and its applications // Nat. Photon. 2015. V. 9. № 4. P. 219–227.
Omar M., Aguirre J., Ntziachristos V. Optoacoustic mesoscopy for biomedicine // Nat. Biomed. Eng. 2019. V. 3. № 5. P. 354–370.
Liopo A.V., Oraevsky A.A. Nanoparticles as contrast agents for optoacoustic imaging / Nanotechnology for biomedical imaging and diagnostics: from nanoparticle design to clinical applications. Hoboken, NJ.: John Wiley & Sons. 2015. P. 111–149.
Gellini C., Feis A. Optothermal properties of plasmonic inorganic nanoparticles for photoacoustic applications // Photoacoustics. 2021. V. 23. P. 100281.
Haisch C. Photoacoustic spectroscopy for analytical measurements // Meas. Sci. Technol. 2011. V. 23. № 1. P. 012001.
Gao R., Xu Z., Ren Y., Song L., Liu C. Nonlinear mechanisms in photoacoustics – powerful tools in photoacoustic imaging // Photoacoustics. 2021. V. 22. P. 100243.
Bialkowski S.E., Astrath N.G., Proskurnin M.A. Photothermal Spectroscopy Methods. Hoboken, NJ: John Wiley & Sons, 2019. 485 p.
Гусев В.Э., Карабутов А.А. Лазерная оптоакустика. М.: Наука, 1991. 304 с.
Шифрин K.C. Расчеты радиационных характеристик облаков // Труды Гос. Геофиз. Обсерватории. М.: ГГО, 1961. С. 179–190.
Хлебцов Н.Г. Оптика и биофотоника наночастиц с плазмонным резонансом // Квантовая электроника. 2008. Т. 38. № 6. С. 504–529.
Feis A., Gellini C., Salvi P.R., Becucci M. Photoacoustic excitation profiles of gold nanoparticles // Photoacoustics. 2014. V. 2. № 1. P. 47–53.
Jacques S.L. Optical properties of biological tissues: a review // Phys. Med. Biol. 2013. V. 58. № 11. P. R37–R61.
Грашин П.С., Карабутов А.А., Ораевский А.А., Пеливанов И.М., Подымова Н.Б., Саватеева Е.В., Соломатин В.С. Распределение интенсивности лазерного излучения в сильно рассеивающих средах: моделирование методом Монте-Карло, теоретический анализ и результаты оптико-акустических измерений // Квантовая электроника. 2002. Т. 32. № 10. С. 868–874.
Hale G.M., Querry M.R. Optical constants of water in the 200-nm to 200-μm wavelength region // Appl. Opt. 1973. V. 12. № 3. P. 555–563.
Wang X., Xie X., Ku G., Wang L.V., Stoica G. Noninvasive imaging of hemoglobin concentration and oxygenation in the rat brain using high-resolution photoacoustic tomography // J. Biomed. Opt. 2006. V. 11. № 2. P. 024015.
Anderson R.R., Farinelli W., Laubach H. et al. Selective photothermolysis of lipid-rich tissues: A free electron laser study // Lasers Surg. Med. 2006. V. 38. № 10. P. 913–919.
Тучин В.В. Оптика биологических тканей. М.: Физматлит, 2012. 812 с.
Дубровский В.И., Федорова В.Н. Биомеханика. М.: Владос-Пресс, 2003. 672 с.
Ультразвук в медицине. Физические основы применения. Под ред. Хилла К., Бэмбера Дж.С., тер Хаар Г. М.: Физматлит, 2008. 535 с.
Cahen D., Bults G., Garty H., Malkin S. Photoacoustics in life sciences // J. Biochem. Biophys. Methods. 1980. V. 3. № 5. P. 293–310.
Patel C.K.N., Tam A.C. Pulsed optoacoustic spectroscopy of condensed matter // Rev. Mod. Phys. 1981. V. 53. № 3. P. 517–553.
Новиков Б.К., Руденко О.В., Тимошенко В.И. Нелинейная гидроакустика. Ленинград: Судостроение, 1981. 264 с.
Жаров В.П., Летохов В.С. Лазерная оптико-акустическая спектроскопия. М.: Наука, 1984. 280 с.
Arnaut L.G., Caldwell R.A., Elbert J.E., Melton L.A. Recent advances in photoacoustic calorimetry: theoretical basis and improvements in experimental design // Rev. Sci. Instrum. 1992. V. 63. № 11. P. 5381–5389.
Puchenkov O.V., Malkin S. Photoacoustic cell for dynamic measurements with nanosecond time resolution // Rev. Sci. Instrum. 1996. V. 67. № 3. P. 672–680.
Wu B., Frez C., Diebold G.J. Photoacoustic transients produced by laser generated, ultrahigh thermal gradients // Appl. Phys. Lett. 2013. № 103. № 12. P. 124105-1–124105-4.
Liu L., Huan H., Zhang X., Zhang L., Shao X., Mandelis A., Dong L. Laser induced thermoelastic contributions from windows to signal background in a photoacoustic cell // Photoacoustics. 2021. V. 22. P. 100257.
Schaberle F.A., Nunes R.M., Barroso M., Serpa C., Arnaut L. Analytical solution for time-resolved photoacoustic calorimetry data and applications to two typical photoreactions // Photochem. Photobiol. Sci. 2010. V. 9. № 6. P. 812–822.
Филимонова Т.А., Сенюта В.В., Проскурнин М.А., Егерев С.В. Оценка метрологических характеристик оптоакустического определения c фронтальным датчиком на примере модельной системы // Вестн. Моск. Универ. Сер. 2. Химия. 2011. Т. 52. № 3. С. 209–213.
Autrey T., Foster N., Klepzig K. Nanojoules, nanoliters and nanosecond calorimetry // J. Photochem. Photobiol. A. 1999. V. 125. № 1–3. P. 13–19.
Карабутов А.А., Матросов М.П., Подымова Н.Б., Пыж В.А. Импульсная акустическая спектроскопия с лазерным источником звука // Акуст. журн. 1991. Т. 37. № 2. С. 311–323.
Khan M.I., Sun T., Diebold G.J. Photoacoustic waves generated by absorption of laser radiation in optically thin layers // J. Acoust. Soc. Am. 1993. V. 93. № 3. P. 1417–1425.
Виноградова М.Б., Руденко О.В., Сухоруков А.П. Теория волн. М.: Наука, 1990. 432 с.
Hayward G., MacLeod C.J., Durrani T.S. A system model of the thickness mode piezoelectric transducer // J. Acoust. Soc. Am. 1984. V. 76. № 2. P. 369–382.
Foster N.S., Amonette J.E., Autrey S.T. In situ detection of chromate using photoacoustic spectroscopy // Appl. Spectrosc. 1999. V. 53. № 6. P. 735–740.
Foster N.S., Autrey S.T., Amonette J.E., Small J.R., Small E.W. Laser photoacoustic spectroscopy: A versatile absorption-spectroscopic technique // Am. Lab. 1999. V. 31. № 2–5. P. 96S–108S.
Салихов Т.Х. Тепловая нелинейность в оптоакустике. Часть I. Тепловая нелинейность в оптоакустическом спектре воды // Изв. АН Республики Таджикистан. Отд. физ.-мат., хим., геолог. и техн. наук. 2011. Т. 4. С. 79–85.
Ошурко В.Б. Визуализация тепловых полей в нелинейной фотоакустике // Письма в ЖТФ. 2006. Т. 32. № 16. С. 1–9.
Chen Y.S., Frey W., Aglyamov S., Emelianov S. Environment-dependent generation of photoacoustic waves from plasmonic nanoparticles // Small. 2012. V. 8. № 1. P. 47–52.
Воловик В.Д., Петренко В.В., Попов Г.Ф. Радиационно-акустические взаимодействия. М.: 1978. (Препр. / ИЯИ АН СССР, П0092.)
Sigrist M. Laser generation of acoustic waves in liquids and gases // J. Appl. Phys. 1986. V. 60. № 7. P. 83–121.
Petrova E., Ermilov S., Su R., Nadvoretskiy V., Conjusteau A., Oraevsky A. Using optoacoustic imaging for measuring the temperature dependence of Grüneisen parameter in optically absorbing solutions // Opt. Express. 2013. V. 21. № 21. P. 25077–25090.
Wang L., Zhang C., Wang L.V. Grueneisen relaxation photoacoustic microscopy // Phys. Rev. Lett. 2014. V. 113. № 17. P. 174301.
Danielli A., Maslov K., Favazza C.P. Nonlinear photoacoustic spectroscopy of hemoglobin // Appl. Phys. Lett. 2015. V. 106. № 20. P. 203701.
Yao J., Kaberniuk A.A., Li L., Shcherbakova D.M., Zhang R., Wang L., Li G., Verkhusha V.V., Wang L.V. Multiscale photoacoustic tomography using reversibly switchable bacterial phytochrome as a near-infrared photochromic probe // Nat. Methods. 2016. V. 13. № 1. P. 67–73.
Голубничий П.И., Давыдов А.А., Корчиков С.Д., Прогнимак А.Б. О генерации звука импульсами ОКГ в жидкостях со взвешенными частицами // Акуст. журн. 1985. Т. 31. № 5. С. 698–700.
Давыдов А.А., Корчиков С.Д. Нелинейный акустический эффект, возникающий при распространении лазерного пучка в жидкости с поглощающими частицами // Акуст. журн. 1990. Т. 36. № 5. С. 9. 46–948.
Diebold G.J., Westervelt P.J. The photoacoustic effect generated by a spherical droplet in a fluid // J. Acoust. Soc. Am. 1988. V. 84. № 6. P. 2245–2251.
Kitamory T., Fujii M., Sawada T., Gohshi Y. Phase shift of photoacoustic signals from microparticles in liquids // J. Appl. Phys. 1985. V. 58. № 4. P. 1456–1459.
Егерев С.В., Пашин А.Е. Оптоакустическая диагностика микронеоднородных жидких сред // Акуст. журн. 1993. Т. 39. № 1. С. 86–91.
Зозуля О.М., Пученков О.В. К теории оптоакустического эффекта в жидких дисперсных системах // Акуст. журн. 1993. Т. 39. № 1. С. 92–99.
Karabutov A.A., Podymova N.B., Letokhov V.S. Time-resolved laser optoacoustic tomography of inhomogeneous media // Appl. Phys. B. 1996. V. 63. № 6. P. 545–563.
Egerev S.V., Zozulya O.M., Pashin A.E., Puchenkov O.V. Laser optoacoustic probing of biopolymer solutions // Photoacoust. and Phototherm. Phenomena III. Berlin: Springer-Verlag. 1992. P. 50–52.
Sarimollaoglu M., Nedosekin D.A., Menyaev Y.A., Juratli M.A., Zharov V.P. Nonlinear photoacoustic signal amplification from single targets in absorption background // Photoacoustics. 2014. V. 2. № 1. P. 1–11.
Calasso I.G., Craig W., Diebold G.J. Photoacoustic point source // Phys. Rev. Lett. 2001. V. 86. № 16. P. 3550–3553.
Inkov V.N., Karabutov A.A., Pelivanov I.M. A theoretical model of the linear thermo-optical response of an absorbing particle immersed in a liquid // Laser Phys. 2001. V. 11. № 12. P. 1283–1291.
Prost A., Poisson F., Bossy E. Photoacoustic generation by a gold nanosphere: from linear to nonlinear thermoelastics in the long-pulse illumination regime // Phys. Rev. B. 2015. V. 92. № 11. P. 115450.
Dixon A.J., Hu S., Klibanov A.L., Hossack J.A. Oscillatory dynamics and in vivo photoacoustic imaging performance of plasmonic nanoparticle-coated microbubbles // Small. 2015. V. 11. № 25. P. 3066–3077.
Shinto H., Fukasawa T., Aoki H., Ito S., Ohshima M. Acoustic pressure pulses from laser-irradiated suspensions containing gold nanospheres in water: experimental and theoretical study // Colloids Surf. A. 2013. V. 430. P. 51–57.
Fukasawa T., Shinto H., Aoki H. Size-dependent effect of gold nanospheres on the acoustic pressure pulses from laser-irradiated suspensions // Adv. Powder Technol. 2014. V. 25. № 2. P. 733–738.
Fukasawa T., Noguchi S., Shinto H., Aoki H., Ito S., Ohshima M. Effects of physicochemical properties of particles and medium on acoustic pressure pulses from laser-irradiated suspensions // Colloids Surf. A. 2015. V. 487. P. 42–48.
Tuchin V.V., Tárnok A., Zharov V.P. In vivo flow cytometry: a horizon of opportunities // Cytometry Part A. 2011. V. 79. № 10. P. 737–745.
Galanzha E.I., Zharov V.P. Photoacoustic flow cytometry // Methods. 2012. V. 57. № 3. P. 280–296.
Galanzha E.I., Shashkov E.V., Kelly T., Kim J.W., Yang L., Zharov V.P. In vivo magnetic enrichment and multiplex photoacoustic detection of circulating tumour cells // Nat. Nanotechnol. 2009. V. 4. № 12. P. 855–860.
Cai C., Carey K.A., Nedosekin D.A., Menyaev Y.A., Sarimollaoglu M., Galanzha E.I., Stumhofer J.S., Zharov V.P. In vivo photoacoustic flow cytometry for early malaria diagnosis // Cytometry Part A. 2016. V. 89. № 6. P. 531–542.
Кравчук Д.А., Старченко И.Б., Орда-Жигулина Д.В., Воронина К.А. Исследование оптоакустических сигналов на моделях эритроцитов в жидкости с контрастными наноагентами // Акуст. журн. 2021. Т. 67. № 3. С. 345–348.
Autrey T., Egerev S., Foster N.S., Fokin A., Ovchinnikov O. Counting particles by means of optoacoustics: potential limits in real solutions // Rev. Sci. Instrum. 2003. V. 74. № 1. P. 628–631.
Alimpiev S.S., Simanovskii Ya.O., Egerev S.V., Pashin A.E. Optoacoustic detection of microparticles in liquids at laser fluences below the optical breakdown threshold // Laser Chem. 1995. V. 16. № 2. P. 63–73.
Wilson K., Homan K., Emelianov S. Biomedical photoacoustics beyond thermal expansion using triggered nanodroplet vaporization for contrast-enhanced imaging // Nat. Commun. 2012. V. 3. № 1. P. 1–10
Egerev S., Ermilov S., Ovchinnikov O., Fokin A., Guzatov D., Klimov V., Kanavin A., Oraevsky A. Acoustic signals generated by laser-irradiated metal nanoparticles // Appl. Opt. 2009. V. 48. № 7. P. C38–C45.
Leszczynski D., Pitsillides C.M., Pastila R.K. Laser-beam-triggered microcavitation: a novel method for selective cell destruction // Radiat. Res. 2001. V. 156. № 4. P. 399–407.
Kitz M., Preisser S., Wetterwald A., Jaeger M., Thalmann G.N., Frenz M. Vapor bubble generation around gold nano-particles and it’s application to damaging of cells // Biomed. Opt. Express. 2011. V. 2. № 2. P. 291–304.
Brujan E.A. Numerical investigation on the dynamics of cavitation nanobubbles // Microfluid. Nanofluid. 2011. V. 11. № 5. P. 511–517
González M.G., Liu X., Niessner R., Haisch C. Strong size-dependent photoacoustic effect on gold nanoparticles by laser-induced nanobubbles // Appl. Phys. Lett. 2010. V. 96. № 17. P. 174104.
McLaughlan J.R., Roy R.A., Ju H., Murray T.W. Nanoparticle-targeted photoacoustic cavitation for tissue imaging // Proc. SPIE. 2010. V. 7564. P. 756415.
Gao R., Fu R., Jiao W. et al. Opto-acoustic effect of Au nanoparticles in water under irradiation of pulse laser // Optik. 2020. V. 202. P. 163512.
Cavigli L., Micheletti F., Tortoli P., Centi S., Lai S., Borri C., Rossi F., Ratto F., Pini R. Light activated microbubbles for imaging and microsurgery // Proc. SPIE 2017. V. 10064. P. 1006457.
Galanzha E.I. In vivo liquid biopsy using Cytophone platform for photoacoustic detection of circulating tumor cells in patients with melanoma // Sci. Transl. Med. 2019. V. 11. № 496. P. 1–13.
Wang X., Pang Y., Ku G., Xie X., Stoica G., Wang L.V. Noninvasive laser-induced photoacoustic tomography for structural and functional in vivo imaging of the brain // Nat. Biotechnol. 2003. T. 21. № 7. P. 803–806.
Karabutov A.A., Savateeva E.V., Oraevsky A.A. Optoacoustic tomography: New modality of laser diagnostic systems // Laser phys. 2003. V. 13. № 5. P. 711–723.
McNally L.R., Mezera M., Morgan D.E., Frederick P.J., Yag E.S., Eltoum I.E., Grizzle W.E. Current and emerging clinical applications of multispectral optoacoustic tomography (MSOT) in oncology // Clin. Cancer Res. 2016. V. 22. № 14. P. 3432–3439.
Razansky D., Klohs J., Ni R. Multi-scale optoacoustic molecular imaging of brain diseases // Eur. J. Nucl. Med. Mol. Imaging. 2021. P. 1–19.
Турчин И.В. Методы оптической биомедицинской визуализации: от субклеточных структур до тканей и органов // Успехи физ. наук. 2016. Т. 186. № 5. С. 550–567.
Zhao T., Desjardins A.E., Ourselin S., Vercauteren T., Xia W. Minimally invasive photoacoustic imaging: current status and future perspectives // Photoacoustics 2019. V. 16. P. 100146.
Hristova Y., Kuchment P., Nguyen L. Reconstruction and time reversal in thermoacoustic tomography in acoustically homogeneous and inhomogeneous media // Inverse Probl. 2008. V. 24. № 5. P. 055006.
Treeby B.E., Zhang E.Z., Cox B.T. Photoacoustic tomography in absorbing acoustic media using time reversal // Inverse Probl. 2010. V. 26. № 11. P. 115003.
Wang L.V., Yao J. A practical guide to photoacoustic tomography in the life sciences // Nat. Methods. 2016. V. 13. № 8. P. 627–638.
Favazza C.P., Jassim O., Cornelius L.A., Favazza C.P., Wang L.V., Jassim O.W., Cornelius L.A. In vivo photoacoustic microscopy of human cutaneous microvasculature and a nevus // J. Biomed. Opt. 2011. V. 16. № 1. P. 016015.
Stein E.W., Maslov K., Wang L.V. Noninvasive, in vivo imaging of the mouse brain using photoacoustic microscopy // J. Appl. Phys. 2009. V. 105. № 10. P. 102027.
Zhang H.F., Maslov K., Stoica G., Wang L.V. Functional photoacoustic microscopy for high-resolution and noninvasive in vivo imaging // Nat. Biotechnol. 2006. V. 24. № 7. P. 848–851.
Hu S., Maslov K., Wang L.V. Second generation optical-resolution photoacoustic microscopy with improved sensitivity and speed // Opt. Lett. 2011. V. 36. № 7. P. 1134–1136.
Guo H., Li Y., Qi W., Xi L. Photoacoustic endoscopy: A progress review // J. Biophotonics 2020. V. 13. № 12. P. e202000217.
Aguirre A., Ardeshirpour Y., Sanders M.M., Brewer M., Zhu Q. Potential role of coregistered photoacoustic and ultrasound imaging in ovarian cancer detection and characterization // Translational oncology. 2011. V. 4. № 1. P. 29–37.
Hysi E., He X., Fadhel M.N. et al. Photoacoustic imaging of kidney fibrosis for assessing pretransplant organ quality // JCI insight 2020. V. 5. № 10. P. e136995.
Kim C., Erpelding T., Jankovic L., Pashley M.D., Wang L. Deeply penetrating in vivo photoacoustic imaging using a clinical ultrasound array system // Biomed. Opt. Exp. 2010. V. 1. № 1. P. 278–284.
Jeng G., Li M., Kim M., Yoon S.J., Pitre J.J., Li D.S., Pelivanov I., O’Donnell M. Real-time interleaved spectroscopic photoacoustic and ultrasound (PAUS) scanning with simultaneous fluence compensation and motion correction // Nature communications. 2021. V. 12. № 1. P. 1–12.
Дополнительные материалы отсутствуют.
Инструменты
Акустический журнал


