ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 7, с. 1099-1108
Памяти В. И. Галкина
УДК 544.77.022
ВЗАИМОДЕЙСТВИЕ БЫЧЬЕГО СЫВОРОТОЧНОГО
АЛЬБУМИНА С КАТИОННЫМИ ИМИДАЗОЛИЕВЫМИ
ПАВ, СОДЕРЖАЩИМИ МЕТОКСИФЕНИЛЬНЫЙ
ФРАГМЕНТ
© 2022 г. Д. А. Кузнецоваa,*, Д. М. Кузнецовa, В. М. Захаровb, Л. Я. Захароваa
a Институт органической и физической химии имени А. Е. Арбузова, Федеральный исследовательский центр
«Казанский научный центр Российской академии наук», ул. Арбузова 8, Казань, 420088 Россия
b Казанский национальный исследовательский технологический университет, Казань, 420015 Россия
*e-mail: Dashyna111@mail.ru
Поступило в редакцию 31 марта 2022 г.
После доработки 5 мая 2022 г.
Принято к печати 10 мая 2022 г.
Физико-химическими методами анализа (тензиометрия, флуоресцентная спектроскопия, динамическое и
электрофоретическое рассеяние света) изучена способность имидазолиевых ПАВ с метоксифенильным
фрагментом к комплексообразованию с модельным белком - бычьим сывороточным альбумином. Добав-
ление белка к ПАВ приводит к снижению порогов агрегации систем в 1.5-2 раза. Имидазолиевые ПАВ
образуют с белком устойчивые комплексы. Связывание компонентов происходит преимущественно по
тирозиновому аминокислотному фрагменту с участием водородных связей и ван-дер-ваальсовых взаимо-
действий. Методом динамического и электрофоретического рассеяния света установлен дополнительный
вклад электростатических сил и гидрофобного эффекта в системах ПАВ-альбумин.
Ключевые слова: катионные ПАВ, бычий сывороточный альбумин, комплексы ПАВ-белок
DOI: 10.31857/S0044460X22070149, EDN: CRNNRW
Поверхностно-активные вещества (ПАВ), бла-
В свою очередь, амфифильные соединения могут
годаря амфифильной природе, находят широкое
заметно влиять на конформационное поведение
применение во многих высокоэффективных тех-
белков [11]. Одним из наиболее изученных и ис-
нологиях. В частности, их используют для увели-
пользуемых на практике белков является бычий
чения растворимости гидрофобных соединений
сывороточный альбумин (BSA). Его структура и
[1-3], для создания переносчиков нуклеиновых
физико-химические свойства хорошо охарактери-
кислот [4-6], модификации липидных носителей
зованы и известно, что он состоит из 583 аминокис-
[7], а также для формирования комплексов ПАВ-
лотных остатков, имеет 17 дисульфидных связей и
белок [8-9]. В связи с тем, что белки участвуют
при нейтральном рН заряжен отрицательно (изо-
в большинстве важных биологических процессов,
электрическая точка 4.7). Он водорастворимый и
исследования взаимодействий катионных ПАВ с
его структура очень похожа на человеческий сыво-
белками привлекают большое внимание исследо-
роточный альбумин (HSA) [12,13]. Показано, что в
вателей [10]. Добавление белков к растворам ПАВ
зависимости от структуры амфифилов связывание
может значительно изменять свойства адсорбци-
ПАВ с BSA может проходить по нескольким ме-
онного слоя на границе раздела фаз жидкость/газ.
ханизмам: электростатическое связывание, гидро-
1099
1100
КУЗНЕЦОВА и др.
фобное взаимодействие, водородное связывание и
Схема 1.
π-π-стекинговое взаимодействие (с ароматически-
ми фрагментами белка) [14-17]. Однако несмотря
на то, что в литературе имеется значительный объ-
N CnH2n+1
N
ем работ по взаимодействию белка с ПАВ, важно
дальнейшее изучение этой области, поскольку нет
Br
O
четких закономерностей, контролирующих эффек-
1
тивность комплексообразования в таких системах.
В наших более ранних работах было показа-
n = 10, 12, 14, 16.
но, что мономерные амфифилы с имидазолие-
вой головной группой стабилизируют белковые
структуры [18-20], в то время как аммонийные
ческое действие амфифилов. Кроме того, наличие
ПАВ могут приводить к денатурации белковых
метоксифенильного фрагмента в головной группе
структур [21-22]. Подобное поведение объясня-
ПАВ может изменить геометрию амфифильной
лось способностью имидазолиевых ПАВ всту-
платформы с точки зрения способа упаковки при
пать в дополнительные π-π-стекинговые взаимо-
агрегации, тем самым предсказывая появление не-
действия с триптофановым фрагментом BSA, что
обычных механизмов связывания при комплексо-
повышало стабильность комплексов. В данной
образовании ПАВ с BSA. Все исследования про-
работе продолжены исследования по оценке вза-
водились при фиксированной концентрации белка
имодействия имидазолиевых амфифилов с BSA,
(0.05 мас%) и варьируемой концентрации амфифи-
на примере имидазолиевых ПАВ с метоксифе-
лов. Выбор данной концентрации был обусловлен
нильным фрагментом (1, n = 10, 12, 14. 16). Вы-
тем, что при ней наблюдается наибольший синер-
бор этих амфифилов обусловлен тем, что биосо-
гетический эффект при взаимодействии компо-
вместимые ПАВ, содержащие в головной группе
нентов [19]. Структурная формула используемых
различные природные фрагменты (пиримидин,
ПАВ приведена на схеме 1.
аминокислотные фрагменты, имидазолий), явля-
Агрегационные характеристики систем ПАВ-
ются перспективными строительными блоками
BSA оценивали методом тензиометрии (рис. 1).
для формирования различных типов наноконтей-
Для бинарных систем ПАВ-белок поверхностное
неров [23-25]. Данные ПАВ обеспечивают рас-
натяжение ниже, чем для индивидуальных систем
ширенный спектр межмолекулярных и компле-
ПАВ, что, вероятно, обусловлено поверхностной
ментарных взаимодействий при самосборке, тем
самым сочетая высокую эффективность с мень-
активностью самого BSA [31]. Для индивидуаль-
ных ПАВ на зависимостях поверхностного на-
шей токсичностью. Имидазолиевые ПАВ привле-
кают большое внимание из-за наличия в структуре
тяжения от концентрации амфифилов наблюда-
имидазолиевого кольца. Это кольцо присутствует
лось наличие только одного перегиба. Удлинение
в гистидине и может обеспечивать дополнитель-
алкильного радикала на два углеродных атома
ные π-π-стекинговые взаимодействия в системах.
приводило к уменьшению критической концен-
Поэтому наличие имидазолиевого кольца очень
трации мицеллообразования (ККМ) примерно в
важно с биологической точки зрения [26]. Важ-
2.5-3.5 раза. Величины ККМ для индивидуальных
ным с биологической точки зрения является и на-
ПАВ 1 составляли: 6.8 (п = 10), 2.6 (п = 12), 0.95
личие метоксифенильного фрагмента. Соединения
(п = 14) и 0.35 мМ. (п = 16) [30]. Для бинарных
с метоксифенильным фрагментом являются инги-
систем ПАВ 1-BSA на соответствующих изотер-
биторами белка тубулина, которые обладают мощ-
мах поверхностного натяжения наблюдали нали-
ным цитотоксическим действием и препятствуют
чие двух перегибов. Первый перегиб в области
делению раковых клеток [27-29]. В работе [30]
низких концентраций ПАВ (ККА1) соответствует
было показано, что введение метоксифенильного
насыщению межфазной поверхности молекулами
фрагмента в структуру имидазолиевых ПАВ уси-
амфифила, которые прикреплены к полимерной
ливает антимикробную активность и цитотокси-
цепи белковой макромолекулы, и при этой же кон-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
ВЗАИМОДЕЙСТВИЕ БЫЧЬЕГО СЫВОРОТОЧНОГО АЛЬБУМИНА
1101
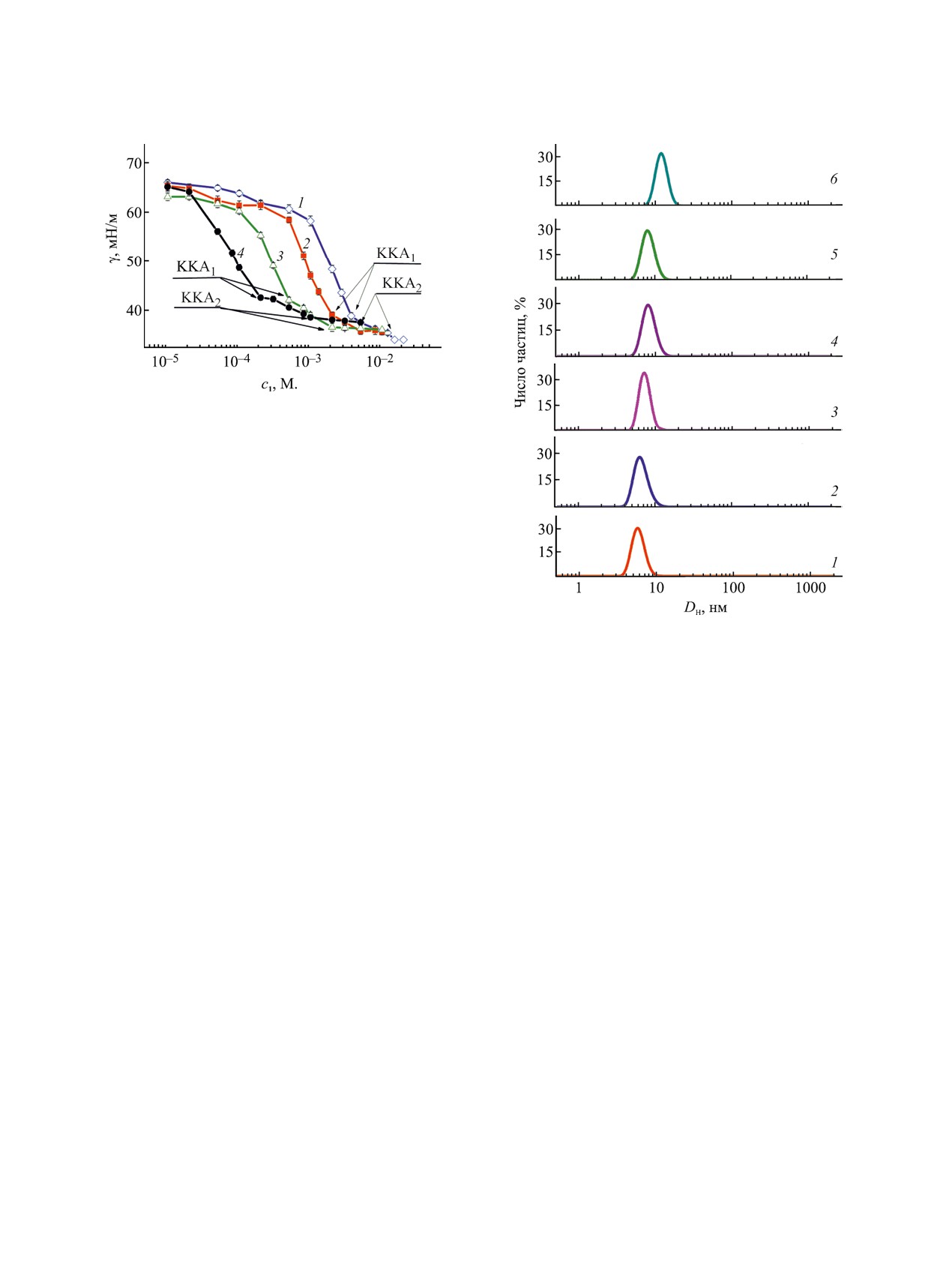
Рис. 1. Изотермы поверхностного натяжения для
бинарных систем ПАВ 1-BSA, n = 10 (1), 12 (2),
14 (3), 16 (4), при фиксированной концентрации BSA
(0.05 мас%) при 25°С.
центрации начинается формирование комплек-
сов ПАВ-белок. Второй перегиб в области высо-
ких концентраций ПАВ, вероятно, как и в случае
классических полимер-коллоидных комплексов,
отвечает насыщению макромолекул белка молеку-
Рис. 2. Распределение агрегатов по размерам, усред-
лами ПАВ и соответствует началу формирования
ненное по числу частиц, для водных растворов ПАВ 1
свободных мицелл ПАВ (ККА2) [6, 32]. Данные
(п = 10)-BSA при 25°С при концентрации ПАВ: 0 (1,
по значениям порога агрегации для систем ПАВ 1
содержание BSA - 0.05 мас%), 0.01 (2), 0.1 (3), 1 (4),
5 (5), 10 мМ. (6).
и ПАВ 1-BSA объединены в табл. S1 (см. Допол-
нительные материалы). Видно, что формирование
смешанных агрегатов ПАВ-BSA начинается при
концентрации в 1.5-2 раза ниже, чем формирова-
для высших гомологов формировались мелкие ми-
ние индивидуальных агрегатов ПАВ.
целлоподобные агрегаты с гидродинамическим
Методом динамического рассеяния света опре-
диаметром 2-4 нм. В случае ПАВ 1 (п =10) про-
делены размеры комплексов, образующихся в би-
исходило образование более крупных агрегатов
нарных системах ПАВ 1-BSA (рис. 2, S1). Пока-
с гидродинамическим диаметром примерно 40-
зано, что размер индивидуальных агрегатов BSA
100 нм [30]. На рис. 2 для примера приведено рас-
составляет примерно 6-7 нм. Добавка ПАВ в раз-
пределение агрегатов, усредненное по числу ча-
личных концентрациях не оказывает значительно-
стиц, для водных растворов ПАВ 1 (п =10)-BSA.
го влияния на размер полипептида, и размеры ком-
Для оценки зарядовых характеристик в систе-
плексов ПАВ 1-BSA находятся в диапазоне 6-9 нм.
мах ПАВ 1-BSA применяли метод электрофорети-
Незначительное увеличение размеров комплексов
ческого рассеяния света (рис. 3). Макромолекула
наблюдается только для системы ПАВ 1 (п =10)-
BSA заряжена отрицательно, поэтому добавление
BSA при высокой концентрации ПАВ (10 мМ.).
в систему катионного ПАВ позволяет ожидать
Размеры смешанных агрегатов при этом состав-
связывания компонентов по электростатическому
ляют около 10-12 нм. Это, вероятно, может отра-
механизму. Это подтверждают эксперименталь-
жать частичную денатурацию белковой молекулы.
ные данные, согласно которым при увеличении
Стоит отметить, что для индивидуальных систем
концентрации ПАВ в системе во всех случаях на-
ПАВ во всем диапазоне концентраций после ККМ
блюдается увеличение дзета-потенциала, сопрово-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1102
КУЗНЕЦОВА и др.
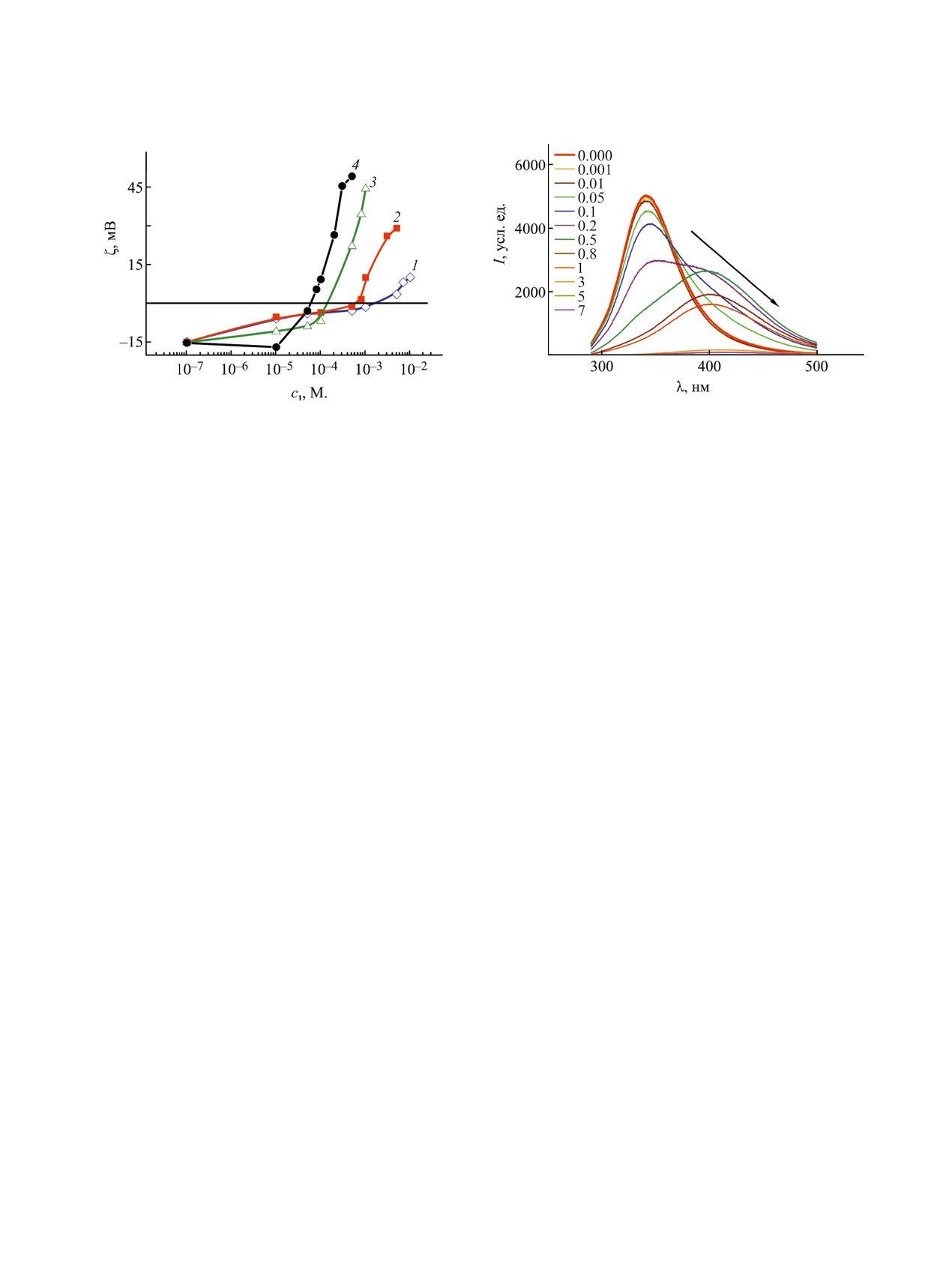
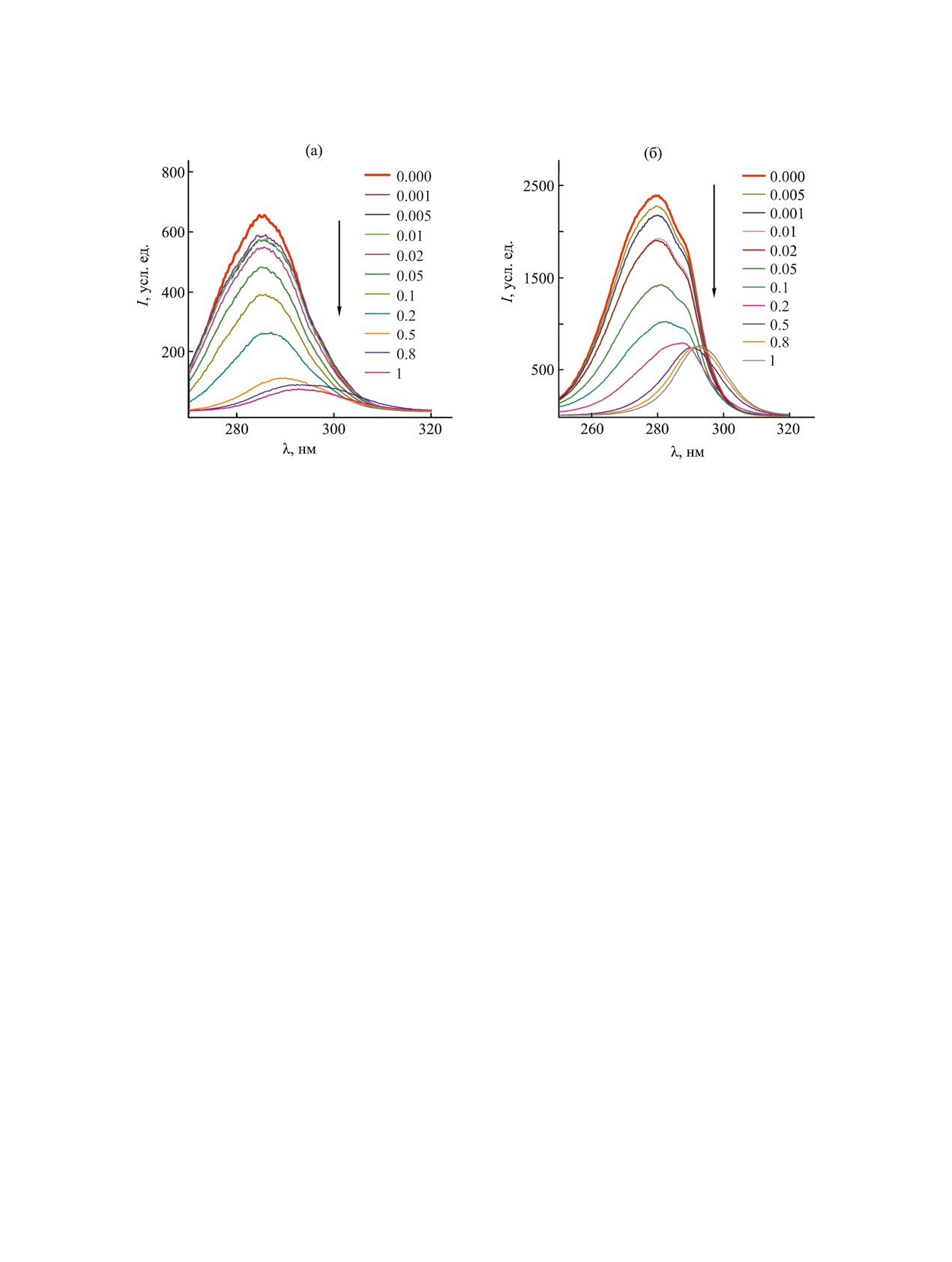
Рис. 4. Эмиссионные спектры флуоресценции би-
Рис. 3. Зависимость электрокинетического потенциала
нарной системы ПАВ 1 (п = 10)-BSA при варьиро-
бинарных систем ПАВ 1-BSA, n = 10 (1), 12 (2), 14 (3),
вании концентрации ПАВ (мМ.), содержание BSA -
16 (4), от концентрации ПАВ при 25°С.
0.05 мас%.
ждающееся переходом значений из отрицательной
Обычно при формировании смешанных комплек-
области в положительную. При этом наблюдается
сов наблюдается гипсохромный сдвиг [18-20, 31].
закономерность: чем больше длина углеводород-
Тем не менее, авторы работы [34], показали, что
ного радикала, тем при более низкой концентра-
батохромное смещение эмиссионного максимума
ции достигается изоэлектрическая точка. Это,
вместе с уменьшением интенсивности флуорес-
вероятно свидетельствует о значительном вкладе
ценции BSA указывает на изменение микроокру-
гидрофобных взаимодействий при формировании
жения вокруг остатков триптофана, которое может
комплексов.
быть обусловлено увеличением микрополярно-
Далее оценку эффективности взаимодействия
сти среды. Кроме того, для всех систем в различ-
ном концентрационном диапазоне наблюдается
ПАВ 1 с BSA проводили с использованием раз-
наличие изобестических точек, которые могут
личных флуоресцентных методик. BSA содержит
указывать на существование связанного и несвя-
три ароматические аминокислоты, которые могут
занного ПАВ в равновесии [35-36]. Для ПАВ 1
вносить вклад в флуоресценцию белка, а именно
(п =10)/BSA изобестическая точка достигается
тирозин (Tyr), триптофан (Trp) и фенилаланин
при 376 нм, для ПАВ 1 (п =12)-BSA при 374 нм,
(Phe). Поскольку излучение Phe имеет низкий
для ПАВ 1 (п =14)-BSA при 367 нм, для ПАВ 1
квантовый выход, его вкладом обычно пренебре-
(п =16)-BSA при 364 нм. Следует отметить, что
гают [33]. Поэтому можно считать, что флуорес-
чем короче длина углеводородного радикала ам-
центные свойства белка обусловлены остатками
фифила, тем при более высокой концентрации
тирозина и триптофана. Индивидуальный раствор
ПАВ наступает состояние равновесия. Данное яв-
BSA демонстрирует сильный пик флуоресценции
ление также может косвенно свидетельствовать о
при 340 нм. Регистрация спектров флуоресценции
вкладе гидрофобных взаимодействий при форми-
комплексов показала, что во всех случаях введе-
ровании комплексов. На рис. 4 для примера при-
ние ПАВ к BSA приводит к тушению флуоресцен-
ведены эмиссионные спектры флуоресценции для
ции, и батохромному сдвигу, т. е. смещению мак-
бинарной системы ПАВ 1 (п =10)-BSA.
симума полосы флуоресценции в длинноволновую
область (рис. 4, S2). Тушение флуоресценции, как
На основании флуоресцентных данных можно
правило, обусловлено связыванием компонентов.
получить ряд количественных параметров вза-
Однако, батохромный сдвиг явление не типич-
имодействия систем ПАВ 1-BSA. В частности,
ное при взаимодействии катионных ПАВ с BSA.
используя уравнение Штерна-Фольмера (1), гра-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
ВЗАИМОДЕЙСТВИЕ БЫЧЬЕГО СЫВОРОТОЧНОГО АЛЬБУМИНА
1103
Таблица 1. Значения констант Штерна-Фольмера KSV, констант связывания компонентов Ka, бимолекулярных кон-
стант скорости тушения Kq и количество участков связывания BSA и ПАВ N, изменения энтальпии ΔH°, энтропии
ΔS° и свободной энергии Гиббса ΔG° для исследуемых систем при варьировании температуры
KSV×103,
Ka×103,
Kq×1010,
ΔH°,
ΔS°,
ΔG°,
ПАВ 1-BSA
Т, K
N
л/моль
л/моль
л/(моль·с)
кДж/моль
Дж/(моль·K)
кДж/моль
298
9.8
8.70
98
1
-22.95
303
5.7
6.30
57.4
1
-20.97
n = 10
-141.38
-397.41
308
4.3
1.10
43.1
0.8
-18.99
313
3.8
0.76
37.8
0.76
-16.99
298
6.3
15.85
62.6
1
-23.97
303
6.4
7.94
63.8
1
-23.01
n = 12
-80.95
-191.22
308
6.5
5.49
64.6
1
-22.05
313
6.4
5.01
63.8
1
-21.10
298
13.5
15.85
135.3
1
-24.1
303
12.0
15.14
119.2
1
-23.8
n = 14
-41.8
-59.3
308
11.9
8.13
119.0
1
-23.5
313
10.8
7.94
108.2
1
-23.2
298
15.5
1023.29
155.3
1.2
-34.6
303
14.9
870.96
149.2
1.4
-34.3
n = 16
-51.43
-56.2
308
13.9
794.33
139.9
1.4
-34.0
313
11.7
346.74
117.5
1.6
-33.7
(2)
фическим способом рассчитывали коэффициен-
ты Штерна-Фольмера для различных температур
Так, если значение kq меньше 2×1010 л/(моль·с),
[37]:
то преобладает динамический механизм тушения,
если больше 2×1010 л/(моль·с), то преобладает
(1)
статический механизм тушения. Данные при раз-
личных температурах приведены в табл. 1. Видно,
- интенсивность флуоресценции в отсут-
где F0
что значения KSV для всех систем уменьшаются с
ствие тушителя, F - интенсивность флуоресцен-
повышением температуры. Более того, вычислен-
ции в присутствии тушителя при заданной его кон-
ные значения kq на один или два порядка превы-
- константа Штерна-Фольмера,
центрации, KSV
шают максимальную константу скорости тушения
- бимоле-
[Q] - концентрация тушителя (ПАВ), kq
при столкновениях при динамическом тушении
- среднее
кулярная константа скорости тушения, τ0
[2×1010 л/(моль·с)]. Это указывает на то, что при
время жизни флуорофора (BSA) в возбужденном
формировании комплексов ПАВ 1-BSA имеет ме-
состоянии, равное 10-8 с [37].
сто статический механизм тушения флуоресцен-
Константа Штерна-Фольмера позволяет опре-
ции, вероятней всего предполагающий, что ПАВ и
делить бимолекулярную константу скорости ту-
BSA образуют нековалентно связанный комплекс
шения (kq), которая, в свою очередь, позволяет
за счет адсорбции молекул ПАВ на гидрофобных
сделать вывод о преимущественном механизме ту-
доменах белка [17].
шения в данных системах. Тушение флуоресцен-
Для расчета констант связывания ПАВ с BSA
ции может происходить по разным механизмам
(Kа), количества участков связывания компонен-
и обычно классифицируется как динамическое и
тов (N) и термодинамических характеристик ис-
статическое тушение. Бимолекулярную константу
следуемых систем на основании первичных флуо-
скорости тушения можно вычислить из уравнения
ресцентных данных применяли уравнения (3)-(5)
(2) [37]:
[38]:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1104
КУЗНЕЦОВА и др.
разовании комплексов ПАВ-BSA доминируют те
или иные межмолекулярные взаимодействия [38]:
(1) ΔH° < 0 и ΔS° < 0 - преобладает водородное
связывание и ван-дер-ваальсовы взаимодействия;
(2) ΔH° > 0 и ΔS° > 0 - преобладают гидрофобные
взаимодействия; (3) ΔH° < 0 и ΔS° > 0 - преоблада-
ют электростатические взаимодействия.
Согласно полученным данным, при формиро-
вании комплексов ПАВ 1-BSA преобладают во-
дородное связывание компонентов и ван-дер-ва-
альсовы взаимодействия. Со стороны ПАВ в
образовании водородной связи могут принимать
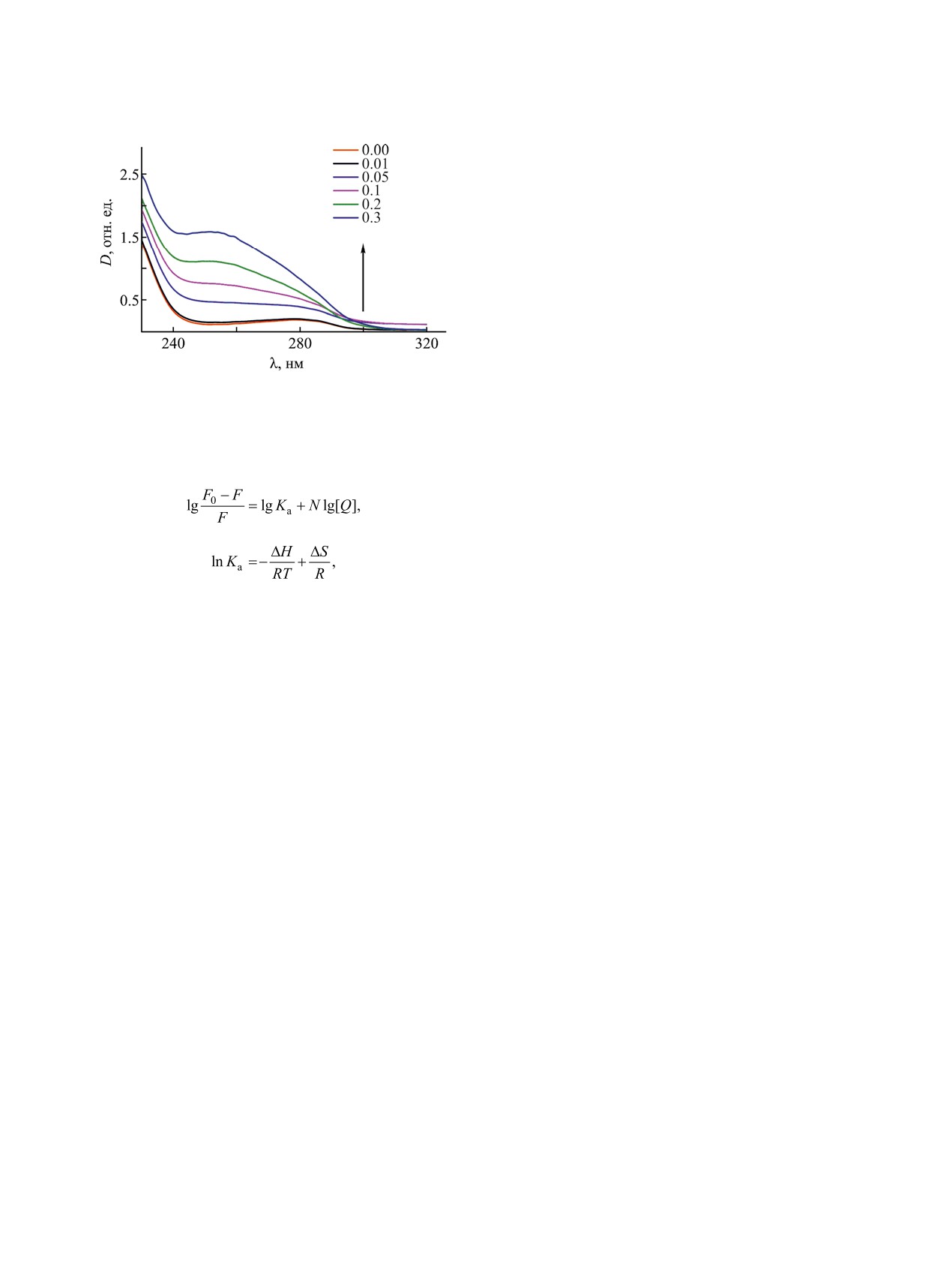
Рис. 5. Спектры поглощения BSA в отсутствие и в
присутствии ПАВ 1 (п = 16) при 25°С, содержание
участие атомы кислорода и азота, имеющие непо-
BSA - 0.05 мас%. Концентрация ПАВ указана в мМ.
деленную электронную пару, тогда как донорами
протонов являются карбоксильные и в меньшей
степени гидроксильные группы аминокислотных
остатков. Учитывая тот факт, что триптофан со-
(3)
держит только одну карбоксильную группу, а ти-
розин гидроксильную и карбоксильную, можно
предположить, что связывание по тирозину будет
(4)
сильнее. Отрицательные значения энергии Гиббса
свидетельствуют о термодинамической выгодно-
ΔG° = ΔН° - TΔS°,
(5)
сти формирования комплексов ПАВ-BSA и само-
произвольности процесса.
где ΔН° - изменение энтальпии системы, ΔS° -
УФ видимая спектроскопия представляет собой
изменение энтропии системы, R - универсальная
простой и широко доступный метод исследования
газовая постоянная, равная 8.314 Дж/(моль·K),
образования комплексов ПАВ-белок. В отличие от
Т - температура проведения эксперимента, ΔG° -
флуоресцентной спектроскопии, которая отражает
свободная энергия Гиббса системы. Все данные
переходы электронов из возбужденного состояния
представлены в табл. 1. Полученные результаты
в основное, УФ видимая спектроскопия регистри-
свидетельствуют о том, что с повышением тем-
рует переходы электронов из основного состояния
пературы во всех системах константы связывания
в возбужденное. Для изучения белков, содержа-
уменьшаются, что обусловлено снижением устой-
щих остатки тирозина (Tyr) или триптофана (Trp)
чивости комплексов [12]. Однако следует отме-
используется измерение УФ поглощения при 280
тить, что между компонентами достигается доста-
нм. Поглощение УФ света в этой области проис-
точно сильное связывание, которое усиливается
ходит за счет n-π*-переходов в аминокислотах Tyr
с увеличением длины углеводородного радикала
и Trp [39]. Поэтому влияние различных количеств
ПАВ. Значения N для комплексов ПАВ 1-BSA, на-
ПАВ на структурные изменения BSA изучали на
ходятся в основном в пределах единицы, что ука-
примере одной системы ПАВ 1 (п = 16)-BSA по
зывает на наличие одного сайта связывания в BSA
спектрам поглощения (рис. 5). Видно, что добав-
для ПАВ при их взаимодействии. С использова-
ление ПАВ 1 (п = 16) к BSA и возрастание кон-
нием значений констант связывания компонентов
центрации ПАВ в системе приводит к увеличе-
Ka были получены значения изменений энтальпии
нию интенсивности поглощения и значительному
ΔH°, энтропии ΔS° и свободной энергии Гиббса
гипсохромному сдвигу. Наблюдаемое изменение
ΔG° при формировании комплексов ПАВ-BSA для
оптической плотности свидетельствует в пользу
исследуемых систем [уравнения (3-5), табл. 1].
механизма статического тушения флуоресценции
Известно, что в зависимости от характера измене-
BSA в присутствии ПАВ [40], поскольку известно,
ния термодинамических функций ΔH° и ΔS° в об-
что динамический процесс влияет исключительно
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
ВЗАИМОДЕЙСТВИЕ БЫЧЬЕГО СЫВОРОТОЧНОГО АЛЬБУМИНА
1105
Рис. 6. Синхронные спектры флуоресценции BSA в присутствии различных концентраций ПАВ (мМ.) для бинарной системы
ПАВ 1 (п = 14)-BSA при 25°С. Δλ = 20 (а), 60 нм (б).
на возбужденное состояние молекулы, не вызывая
статочно эффективно. Но чтобы оценить с каким
при этом никаких изменений в спектрах поглоще-
фрагментом ПАВ
1 взаимодействует сильнее,
ния [41]. Полученные результаты соответствуют
можно проанализировать снижение степени ин-
опубликованным данным о формировании ком-
тенсивности флуоресценции при добавлении ПАВ
плекса между компонентами в рамках механизма
[16]. Снижение степени интенсивности флуорес-
статического тушения флуоресценции. Смещение
ценции для Δλ = 20 сильнее, чем для Δλ = 60 для
максимума поглощения в данном случае также вы-
всего гомологического ряда ПАВ. Это указывает
на то, что молекулы амфифилов в большей степе-
звано изменением микроокружения вокруг остат-
ни взаимодействуют с остатками тирозина, чем с
ков тирозина и триптофана [40].
остатками триптофана. Интересно отметить, что
Для получения информации о том, какой из
в случае нефункционализированных имидазолие-
аминокислотных фрагментов (тирозин или трипто-
вых ПАВ, связывание ПАВ с белком происходило
фан) принимает участие во взаимодействии с мо-
преимущественно по триптофану [18, 19].
лекулами ПАВ, используется техника синхронной
Таким образом, комплексом физико-химиче-
флуоресцентной съемки с заданными значениями
ских методов изучена способность амфифилов с
разницы длин волн Δλ : Δλ = 20 нм, характеризу-
имидазолиевой головной группой с метоксифе-
ющая связывание по тирозиновому фрагменту, и
нильным фрагментом и различной длиной углево-
Δλ = 60 нм, определяющая связывание по трипто-
дородного радикала к взаимодействию с бычьим
фановому фрагменту (рис. 6, S3).
сывороточным альбумином. Показано формиро-
На рис. 6 и S3 видно, что добавление ПАВ к
вание устойчивых комплексов с гидродинамиче-
BSA во всех случаях приводит к тушению флуо-
ским диаметром 6-9 нм. Методом флуоресцент-
ресценции тирозина и триптофана. При этом для
ной спектроскопии выявлено, что связывание
обоих фрагментов наблюдается батохромный
компонентов происходит по триптофановому и по
сдвиг максимума полосы эмиссии. Отсюда мож-
тирозиновому аминокислотным фрагментам, но
но сделать вывод, что присутствие ПАВ в рас-
преобладает связывание по тирозину. Интересно
творе приводит к увеличению полярности вокруг
отметить, что в случае незамещенных имидазоли-
остатков и тирозина и триптофана, причем ПАВ,
евых ПАВ связывание амфифилов с белком проис-
вероятно, связывается с обоими фрагментами до-
ходило по триптофану, а связывания по тирозину
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1106
КУЗНЕЦОВА и др.
не наблюдалось. Установлено, что доминирующи-
рассеянного света на основе уравнения Стокса-
ми механизмами при формировании комплексов
Эйнштейна (6) для сферических частиц:
ПАВ-BSA являются водородное связывание ком-
D = kT/6πηR,
(6)
понентов и ван-дер-ваальсовы взаимодействия.
Однако, методом динамического и электрофоре-
где k - константа Больцмана, Т - абсолютная тем-
тического рассеяния света доказано наличие элек-
пература, η - вязкость растворителя, R - гидроди-
тростатических и гидрофобных взаимодействий,
намический радиус. Электрофоретическая под-
которые выражены в меньшей степени. Следует
вижность в каждом образце была преобразована
отметить, что не наблюдается существенной раз-
в значение дзета-потенциала с использованием
ницы при формировании комплексов ПАВ-BSA
соотношения Смолуховского (7):
при варьировании длины углеводородного ради-
ζ = μη/ε,
(7)
кала. Вероятно, ключевым фактором, отвечающим
за механизмы формирования комплексов в данном
где ζ - дзета-потенциал, η - динамическая вяз-
случае, является природа головной группы ПАВ.
кость жидкости, μ - электрофоретическая подвиж-
ность частиц и ε - диэлектрическая проницаемость
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
среды.
Имидазолиевые ПАВ с метоксифенильным
ИНФОРМАЦИЯ ОБ АВТОРАХ
фрагментом и различной длиной углеводородного
радикала получали по реакции 1-(4-метоксифенил)-
Кузнецова Дарья Александровна, ORCID:
имидазола с соответствующим алкилбромидом в
ацетонитриле с последующей очисткой целевых
Кузнецов Денис Михайлович, ORCID: https://
продуктов реакции в диэтиловом эфире [30]. В ра-
orcid.org/0000-0002-9572-3708
боте использовали бычий сывороточный альбумин
Захаров Валерий Михайлович, ORCID: https://
(99%, Sigma-Aldrich). В качестве растворителя для
orcid.org/0000-0002-3982-2277
приготовления растворов ПАВ и белка использова-
Захарова Люция Ярулловна, ORCID: https://
ли воду, очищенную с помощью системы Milli-Q.
orcid.org/0000-0002-2981-445X
Поверхностное натяжение растворов определя-
ли с помощью тензиометра Krűss K06 (Германия),
ФИНАНСОВАЯ ПОДДЕРЖКА
методом отрыва кольца. Регистрацию спектров
Работа выполнена при финансовой поддерж-
флуоресценции бинарных смесей ПАВ-BSA про-
ке Российского научного фонда (грант № 21-73-
водили с помощью спектрофлуориметра Hitachi
00033).
F-7100 (Hitachi High-Tech Corporation, Япония)
при температуре 25, 30, 35 и 40°С. Длина волны
КОНФЛИКТ ИНТЕРЕСОВ
возбуждения составляла 280 нм. Спектры испу-
скания регистрировали в диапазоне 290-450 нм со
Авторы заявляют об отсутствии конфликта
скоростью сканирования 1200 нм/мин. Для изме-
интересов.
рений использовали кювету толщиной 1 см. Спек-
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
тры синхронной флуоресценции регистрировали в
диапазоне 200-500 нм со скоростью сканирования
Дополнительные материалы для этой статьи
1200 нм/мин с двумя фиксированными разностя-
доступны по doi
10.31857/S0044460X22070149
ми длин волн излучения и возбуждения Δλ = 20 и
для авторизованных пользователей.
60 нм [42]. Измерение размера и дзета-потенци-
CПИСОК ЛИТЕРАТУРЫ
ала комплексов ПАВ-BSA проводили на харак-
теризаторе наночастиц ZetaSizer Nano (Malvern,
1. Гайнанова Г.А., Валеева Ф.Г., Кушназарова Р.А.,
Великобритания). Измерения выполняли при угле
Бекмухаметова А.М., Захаров С.В., Миргород-
рассеяния 173°. Обработку полученных сигналов
ская А.Б., Захарова Л.Я. // ЖФХ. 2018. Т. 92. № 7.
проводили на основе частотно-фазового анализа
С. 1158; Gaynanova G.A., Valeeva F.G., Kushnazaro-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
ВЗАИМОДЕЙСТВИЕ БЫЧЬЕГО СЫВОРОТОЧНОГО АЛЬБУМИНА
1107
va R.A., Bekmukhametova A.M., Zakharov S.V.,
Luminescence. 2015. Vol. 3. P. 1233. doi 10.1002/
Mirgorodskaya A.B., Zakharova L.Ya // Russ. J. Phys.
bio.2886
Chem. (A). 2018. Vol. 92. N 7. P. 1400. doi 10.1134/
15.
Hoque M.A., Ahmed F., Halim M.A., Molla M.R.,
S0036024418070129
Rana S., Rahman M.A., Rub M.A. // J. Mol. Liq. 2018.
2.
Lalthlengliani J., Gurung J., Pulikkal A.K. // J.
Vol. 260. N 15. P. 121. doi 10.1016/j.molliq.2018.03.069
Mol. Liq. 2022. Vol. 354. 118823. doi 10.1016/j.
16.
Zhou T., Ao M., Xu G., Liu T., Zhang J. // J. Colloid
molliq.2022.118823
Interface Sci. 2013. Vol. 389. P. 175. doi 10.1016/j.
3.
Gabdrakhmanov D.R., Samarkina D.А., Krylova E.S.,
jcis.2012.08.067
Kapitanov I.V., Karpichev Y., Latypov Sh.K., Seme-
17.
Kuznetsova D.A., Gabdrakhmanov D.R., Lukashen-
nov V.E., Nizameev I.R., Kadirov M.K., Zakharova L.Ya. //
ko S.S., Faizullin D.A., Zuev Y.F., Nizameev I.R.,
J. Surfact. Deterg. 2019. Vol. 22. N 4. P. 865. doi
Kadirov M.K., Kuznetsov D.M., Zakharova L.Ya. //
10.1002/jsde.12257
J. Mol. Liq. 2020. Vol. 307. 113001. doi 10.1016/j.
4.
St. John P.M., Westervelt K., Rimawi A., Kawakita T. //
molliq.2020.113001
Biophys. Chem. 2022. Vol. 281. 106734. doi 10.1016/j.
18.
Samarkina D.A., Gabdrakhmanov D.R., Lukashen-
bpc.2021.106734
ko S.S., Nizameev I.R., Kadirov M.K., Zakharova L.Ya. //
5.
Gabdrakhmanov D., Samarkina D., Semenov V.,
J. Mol. Liq. 2019. Vol. 275. P. 232. doi 10.1016/j.
Syakaev V., Giniyatullin R., Gogoleva N., Zakharo-
molliq.2018.11.082
va L. // Colloids Surf. (A). 2015. Vol. 480. P. 113. doi
19.
Самаркина Д.А., Габдрахманов Д.Р., Лукашенко С.С.,
10.1016/j.colsurfa.2014.10.036
Хаматгалимов А.Р., Захарова Л.Я. // ЖОХ. 2017.
6.
Kuznetsova D.A., Gabdrakhmanov D.R., Kuznetsov D.M.,
Т. 87. № 12. С. 2009; Samarkina D.A., Gabdrakhma-
Lukashenko S.S., Zakharov V.M., Sapunova A.S.,
nov D.R., Lukashenko S.S., Khamatgalimov A.R.,
Amerhanova S.K., Lyubina A.P., Voloshina A.D.,
Zakharova L. Ya // Russ. J. Gen. Chem. 2017. Vol. 87.
Salakhieva D.V., Zakharova // Molecules. 2021.
N 12. P. 2826. doi 10.1134/S1070363217120118
Vol. 26. P. 2363. doi 10.3390/molecules26082363
20.
Kuznetsova D.A., Gabdrakhmanov D.R., Lukashen-
7.
Kuznetsova D.A., Vasileva L.A., Gaynanova G.A.,
ko S.S., Voloshina A.D., Sapunova A.S., Kashapov R.R.,
Pavlov R.V., Sapunova A.S., Voloshina A.D., Sibgatulli-
Zakharova L.Ya. // Chem. Phys Lipids. 2019. Vol. 223.
na G.V., Samigullin D.V., Petrov K.A., Zakharova L.Ya.,
104791. doi 10.1016/j.chemphyslip.2019.104791
Sinyashin O.G. // J. Mol. Liq. 2021. Vol. 330. 115703.
21.
Misra P.K., Dash Um., Maharan S. // Colloids Surf., A.
doi 10.1016/j.molliq.2021.115703
2015. Vol. 483. P. 36. doi 10.1016/j.colsurfa.2015.06.052
8.
Ud din Parray M., Maurya N., Ahmad Wani F.,
22.
Gabdrakhmanov D.R., Valeeva F.G., Samarkina D.A.,
Borse M.S., Arfin N, Malik M.A., Patel R. // J.
Lukashenko S.S., Mirgorodskaya A.B., Zakharo-
Mol. Struct. 2019. Vol. 1175. P. 49. doi 10.1016/j.
va L.Ya. // Colloids Surf. (A). 2018. Vol. 558. P. 463. doi
molstruc.2018.07.078
10.1016/j.colsurfa.2018.09.008
9.
Власова И.М., Власов А.А., Грапендаал Г.Р.,
23.
Joondan N., Jhaumeer Laulloo S., Caumul P. // J.
Салецкий А.М. // ЖФХ. 2018. Т. 92. № 4. С. 604;
Dispers. Sci. Technol. 2018. Vol. 39. P. 1550. doi
Vlasova I.M., Vlasov A.A., Grapendaal G.R.,
10.1080/01932691.2017.1421085
Saletskii A.M. // Russ. J. Phys. Chem. (A). 2018.
24.
Kashapov R., Gaynanova G., Gabdrakhmanov D.,
Vol. 92. N 4. P. 714. doi 10.1134/s0036024418040325
Kuznetsov D., Pavlov R., Petrov K, Zakharova L.,
10.
Fatma I., Sharma V., Thakur R.C., Kumar A. // J.
Sinyashin O. // Int. J. Mol. Sci. 2020. Vol. 21. P. 6961.
Mol. Liq. 2021. Vol. 341. 117344. doi 10.1016/j.
doi 10.3390/ijms21186961
molliq.2021.117344
25.
Gabdrakhmanov D.R., Kuznetsova D.A., Saifina L.F.,
11.
Kuznetsov D.M., Kuznetsova D.A., Gabdrakhma-
Shulaeva M.M., Semenov V.E., Zakharova L.Ya. //
nov D.R., Lukashenko S.S., Nikitin Y.N., Zakha-
Colloids Surf. (A). 2020. Vol. 599. P. 124853. doi
rova L.Ya. // Surf. Innovations. Article 2100044. doi
10.1016/j.colsurfa.2020.124853
10.1680/jsuin.21.00044
26.
Kumar H., Kaur G. // Front. Chem. 2021. Vol. 9.
12.
Shalaeva Y.V., Morozova J.E., Shumatbaeva A.M.,
P. 667941. doi 10.3389/fchem.2021.667941
Nizameev I.R., Kadirov M.K., Antipin I.S. // J.
27.
Álvarez R., Álvarez C., Mollinedo F., Sierra B.G.,
Mol. Liq. 2019. Vol. 286. 110879. doi 10.1016/j.
Medarde M., Peláez R. // Bioorg. Med. Chem. 2009.
molliq.2019.110879
Vol. 17. P. 6422. doi 10.1016/j.bmc.2009.07.012
13.
Karush F. // J. Am. Chem. Soc. 1950. Vol. 72. P. 2705.
28.
Magalhães H.I.F., Bezerra D.P., Cavalcanti B.C.,
doi 10.1021/ja01162a099
Wilke D.V., Rotta R., Lima D.P., Beatriz A.,
14.
Patel R., Mir M.U.H., Maurya J.K., Singh U.K.,
Alves A.P.N.N., Bitencourt F. S., Figueiredo I.S.T.,
Maurya N., Parray M. ud din, Khan A.B., Ali A. //
Alencar N.M.N., Costa-Lotufo L.V., Moraes M.O.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1108
КУЗНЕЦОВА и др.
Pessoa C. // Cancer Chemother. Pharmacol. 2011.
35. He W., Li Y., Xue C., Hu Z., Chen X., Sheng F. // Bioorg.
Vol. 68. P. 45. doi 10.1007/s00280-010-1446-2
Med. Chem. 2005. Vol. 13. P. 1837. doi 10.1016/j.
29.
Magalhães H.I.F., Cavalcanti B.C., Bezerra D.P.,
bmc.2004.11.038
Wilke D.V., Paiva J.C.G., Rotta R., Lima D.P., Beatriz A.,
36. Joondan N., Laulloo S.J., Caumul P. // J. Dispers.
Burbano R.R., Costa-Lotufo L.V., Moraes M.O.,
Sci. Technol. 2018. Vol. 39. P. 1550. doi 10.1016/j.
Pessoa C. // Toxicol. In Vitro. 2011. Vol. 25. P. 2048.
jphotochem.2006.06.015
doi 10.1016/j.tiv.2011.08.007
37. Wang Y., Jiang X., Zhou L. // Colloids Surf. (A). 2013.
30.
Kuznetsova D.A., Kuznetsov D.M., Amerhanova S.K.,
Vol. 436. P. 1159. doi 10.1016/j.colsurfa.2013.08.045
Buzmakova E.V., Lyubina A.P., Syakaev V.V., Nizame-
38. Suryawanshi V.D., Walekar L.S., Gore A.H.,
ev I.R., Kadirov M.K., Voloshina A.D., Zakharova L.Ya.
// Langmuir. 2022. doi 10.1021/acs.langmuir.2c00299
Anbhule P.V., Kolekar G.B. // J. Pharm. Anal. 2016.
31.
Mir M.A., Khan J.M., Khan R.H., Rather G.M., Dar A.A.
Vol. 6. P. 56. doi 10.1016/j.jpha.2015.07.001
// Colloids Surf. (B). 2010. Vol. 77. P. 54. doi 10.1016/j.
39. Li Y., Lee J.S. // Anal. Chim. Acta. 2019. Vol. 1063.
colsurfb.2010.01.005
P. 18. doi 10.1016/j.aca.2019.02.024
32.
Кузнецова Д.А., Габдрахманов Д.Р., Кузнецов Д.М.,
40. Kaur N., Kaur G., Kaur H., Chaudhary G.R. // J.
Лукашенко С.С., Захарова Л.Я. // ЖФХ. 2020. Т. 94.
Mol. Liq. 2022. Vol. 345. P. 117818. doi 10.1016/j.
№ 11. С. 1692; Kuznetsova D.A., Gabdrakhmanov D.R.,
molliq.2021.117818
Kuznetsov D.M., Lukashenko S.S., Zakharova L.Ya. //
41. Lala H., Akrama M., Kabir-ud-Din // Colloids
Russ. J. Phys. Chem. (A). 2020. Vol. 94. N 11. P. 2337.
Surf. (A). 2022. Vol. 646. P. 128944. doi 10.1016/j.
doi 10.1134/S0036024420110199
colsurfa.2022.128944
33.
Yin T., Qin M., Shen W. // Colloids Surf. (A). 2014.
Vol. 461. P. 22. doi 10.1016/j.colsurfa.2014.07.012
42. Singh I., Luxami V., Paul K. // Spectrochim. Acta
34.
Ojha B., Das G. // J. Phys. Chem. (B). 2010. Vol. 114.
(A). 2020. Vol. 235. N 5. 118289. doi 10.1016/j.
P. 3979. doi 10.1021/jp907576r
saa.2020.118289
Interaction of Bovine Serum Albumin
with Cationic Imidazolium Surfactants Containing
a Methoxyphenyl Fragment
D. A. Kuznetsovaa,*, D. M. Kuznetsova, V. M. Zakharovb, and L. Ya. Zakharovaa
aArbuzov Institute of Organic and Physical Chemistry, Federal Research Center
“Kazan Scientific Center of the Russian Academy of Sciences”, Kazan, 420088 Russia
b Kazan National Research Technological University, Kazan, 420015 Russia
*e-mail: Dashyna111@mail.ru
Received March 31, 2022; revised May 5, 2022; accepted May 10, 2022
Complexation ability of the imidazolium surfactants with a methoxyphenyl fragment with bovine serum albumin
(BSA) was investigated by various physico-chemical methods (tensiometry, fluorescence spectroscopy, dynam-
ic and electrophoretic light scattering). The addition of BSA leads to a decrease in the aggregation thresholds
of surfactants by 1.5-2 times. It was established that the surfactants with the protein forms stable complexes,
which is confirmed by the static character of the quenching of BSA fluorescence. The mechanism of interaction
between BSA and surfactants in an aqueous solution was studied, the quantitative parameters of the binding of
the components were calculated. It was revealed that the binding of the components occurs mainly at the tyrosine
amino acid fragment with the participation of hydrogen bonds and van der Waals interactions. The method of
dynamic and electrophoretic light scattering established an additional contribution of electrostatic forces and
the hydrophobic effect in surfactant-BSA systems, which is expressed to a lesser extent.
Keywords: cationic surfactants, bovine serum albumin, surfactant-protein complexes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022