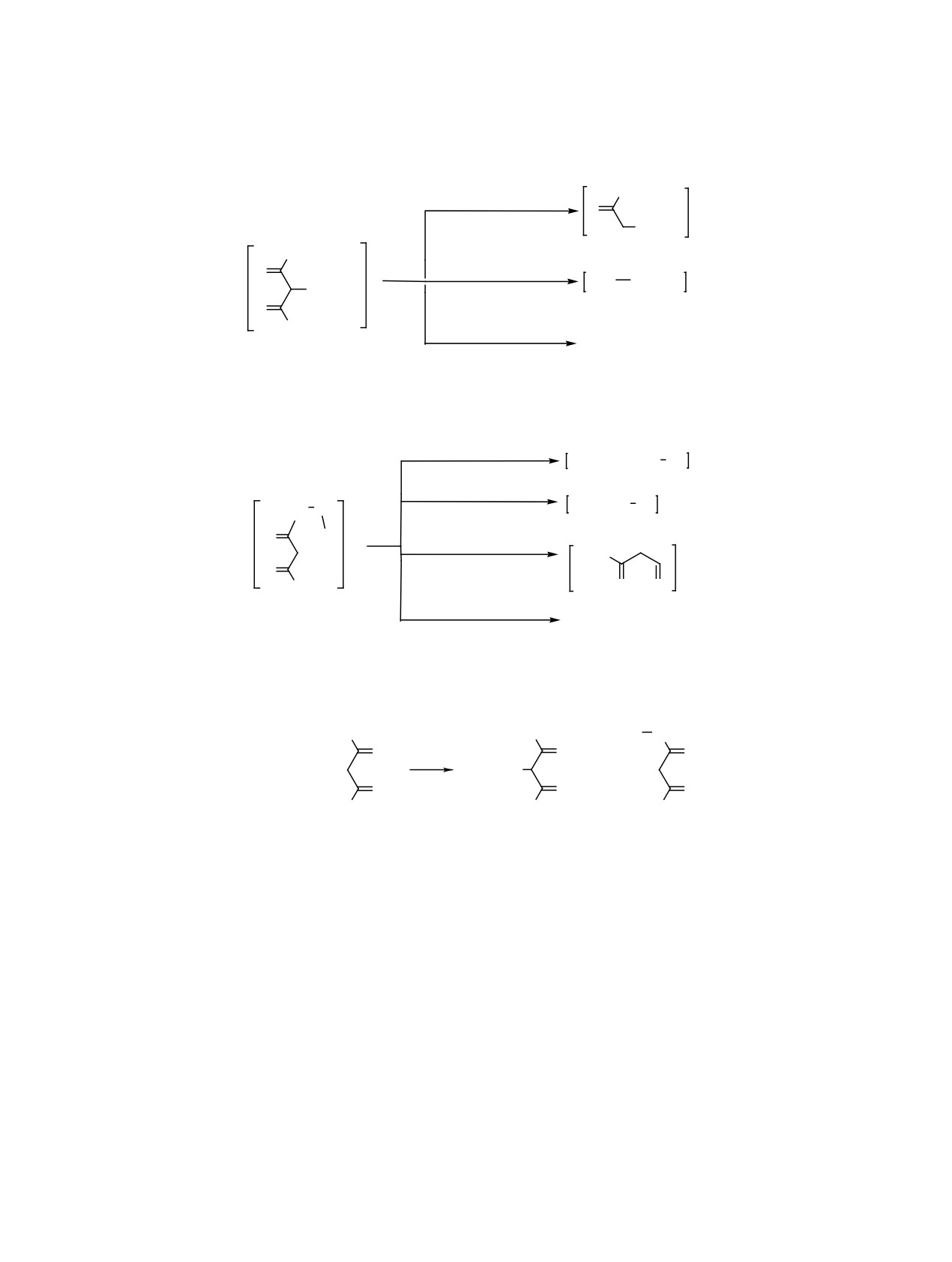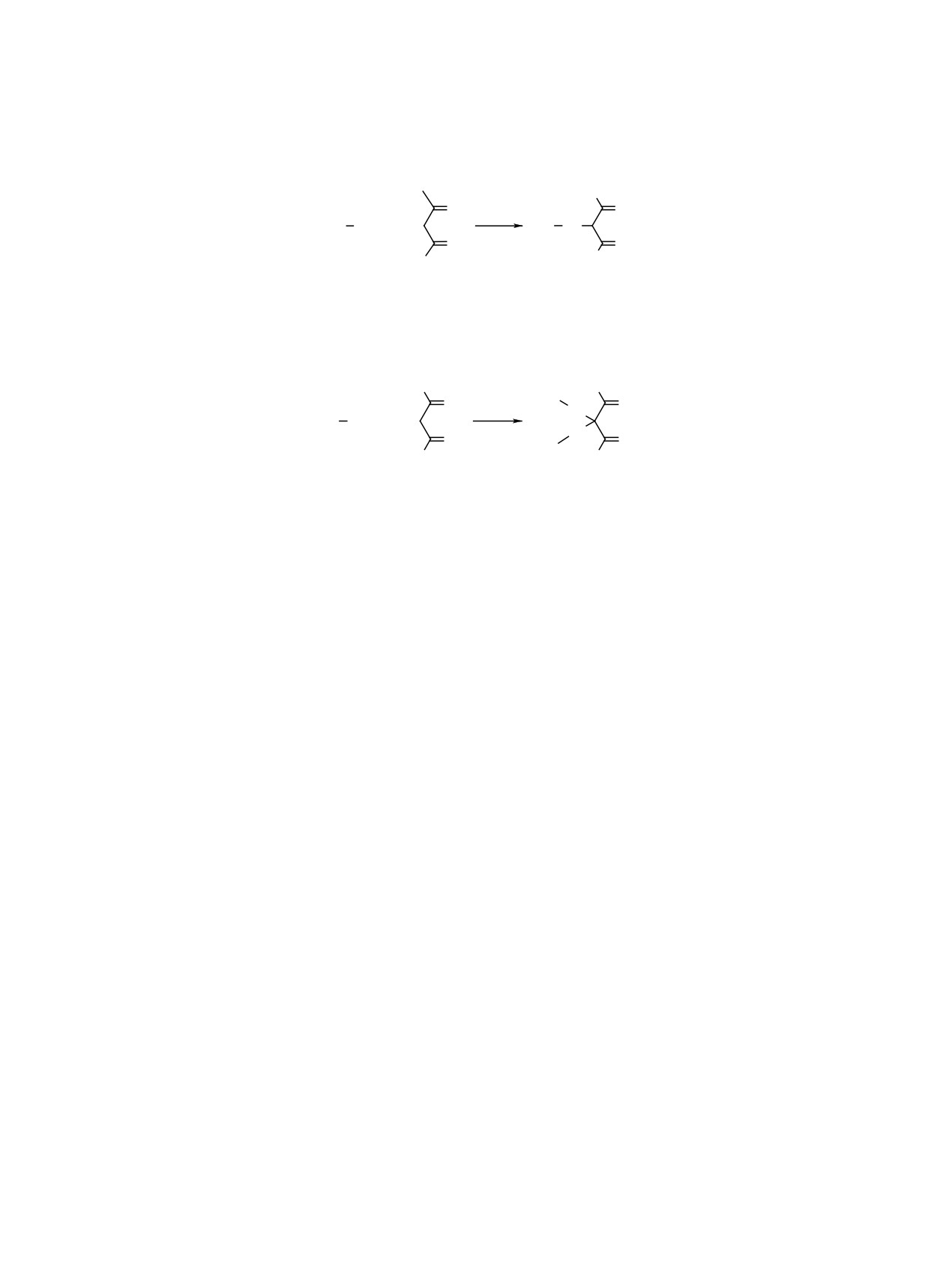ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 6, с. 894-907
УДК 547.1:546.23:546.22
ВЗАИМОДЕЙСТВИЕ СЕЛЕНИЛХЛОРИДОВ
С β-ДИКЕТОНАМИ
© 2022 г. И. В. Свистуноваa,*, Г. О. Третьяковаa,b, З. Н. Пузырьковa
aДальневосточный федеральный университет, Владивосток, п. Аякс 10, 690922 Россия
bИнститут химии Дальневосточного отделения Российской академии наук, Владивосток, 690922 Россия
*e-mail: irasvist@gmail.com
Поступило в редакцию 2 февраля 2022 г.
После доработки 5 марта 2022 г.
Принято к печати 10 марта 2022 г.
При взаимодействии фенилселенилхлорида с дикетонами, имеющими два реакционных центра (один
при центральном атоме углерода, другой - в боковой цепи), происходит образование обоих возможных
изомеров вследствие изомеризации первоначально образующегося продукта с группой PhSe у централь-
ного атома углерода. Изомеризация в присутствии образующегося хлороводорода обусловлена высокой
электрофильной активностью группы PhSe, испытывающей влияние двух рядом расположенных электро-
ноакцепторных (карбонильных/карбоксильных) групп. Проведение реакции в условиях, исключающих
образование хлороводорода, например с натриевыми солями дикетонов, позволяет получить изомер с
группой PhSe у центрального атома углерода без примеси второго изомера.
Ключевые слова: селенилхлорид, ацетилацетон, ацетоуксусный эфир, замещение, изомеризация
DOI: 10.31857/S0044460X22060099, EDN: CMTDGZ
Соединения селена применяются в качестве
Ранее были исследованы реакции сульфенил-
катализаторов [1-3], полупроводниковых матери-
и селенилхлоридов, включающих в качестве
алов и покрытий [4-6], участвуют в окислитель-
заместителя ацетилацетонат дифторида бора
но-восстановительных реакциях, легко вступают
(F2BacacSCl, F2BacacSeCl 1), с кетонами и дике-
в различные взаимодействия, в том числе со сво-
тонами [21] и получены ожидаемые соединения
бодными радикалами. Они обладают биологиче-
(схема 1).
ской активностью, прежде всего антиоксидантной,
Однако в реакциях селенилхлорида 1 с ацети-
так как селен в качестве микроэлемента входит в
лацетоном и ацетоуксусным эфиром были получе-
состав ферментов, участвующих в окислитель-
ны соединения, в которых группировка F2BacacSe
но-восстановительных процессах [7-9]. В связи с
присоединена не к центральному атому углерода,
этим разрабатываются методы синтеза биодоступ-
а к атому углерода терминальной метильной груп-
ных форм селена [10-12]. Аминокислоты, включа-
пы, но, при этом, с бензоилацетоном, в котором
ющие атом селена, обладают иммуностимулиру-
так же имеется терминальная метильная группа,
ющей активностью; обсуждается использование
взаимодействие прошло по центральному атому
органических соединений селена в терапии он-
углерода (схема 2).
кологических заболеваний [13-15]. Селеноорга-
нические соединения зарекомендовали себя как
Неясно, обусловлен ли полученный резуль-
ценные полупродукты органического синтеза, по-
тат природой заместителя, связанного с атомом
зволяющие проводить реакции в мягких условиях
селена, или подобное протекание реакции явля-
[16-20]. Поэтому изучение особенностей реакций
ется общим для всех селенилхлоридов. Описаны
органических соединений селена - современная и
отдельные примеры реакций селенилхлоридов с
актуальная задача.
дикетонами или их солями [22, 23], однако систе-
894
ВЗАИМОДЕЙСТВИЕ СЕЛЕНИЛХЛОРИДОВ С β-ДИКЕТОНАМИ
895
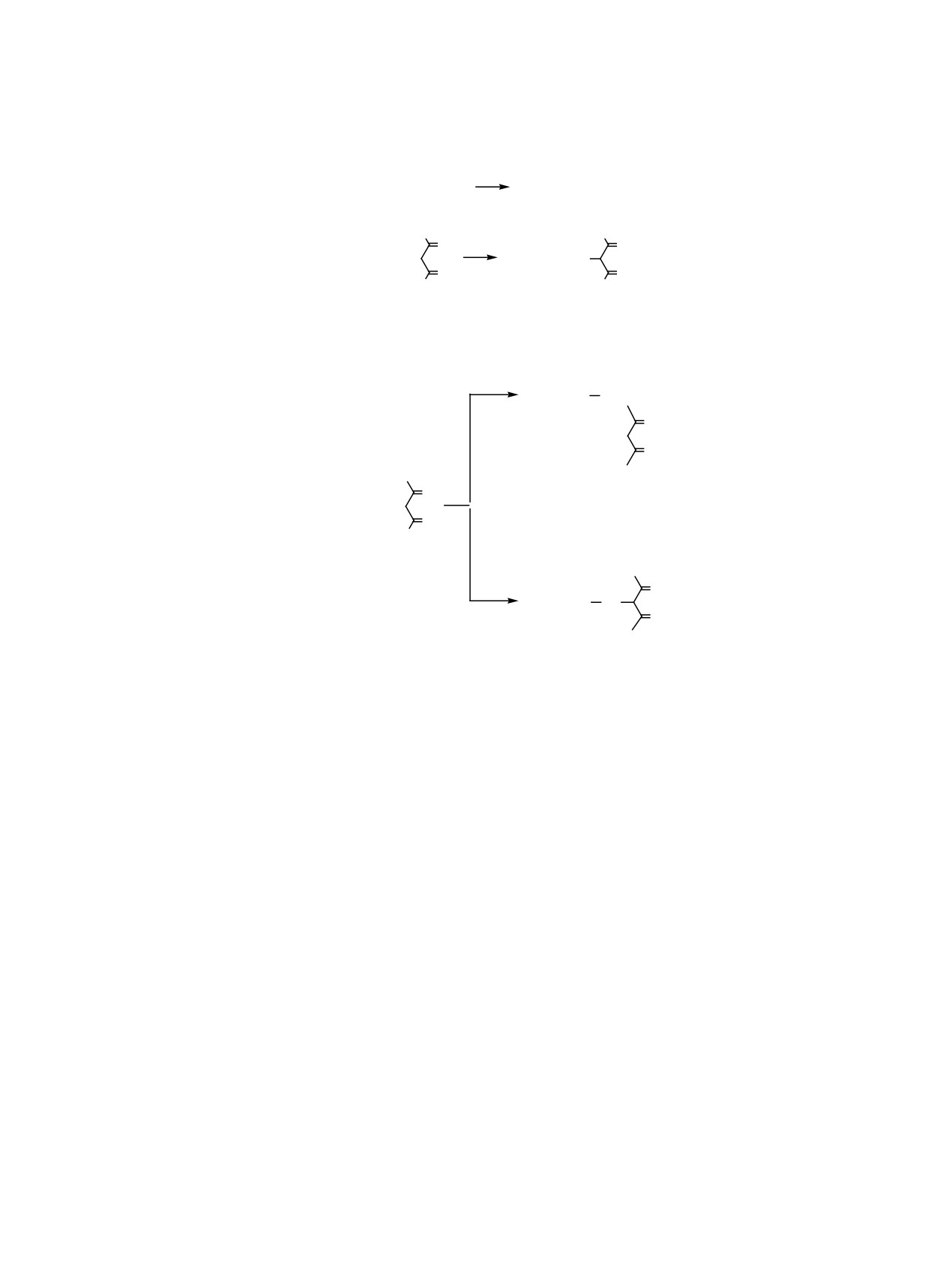
Схема 1.
F2B(acacSeCl) + CH3COCH3
F2B(acacSeCH2COCH3)
H3C
H3C
O
O
F2B(acacSCl) +
F2Bacac S
O
O
H3C
H
3C
Схема 2.
F2Bacac
SeCH2
O
O
H3C
R
O
R = CH3,OEt
F2B(acacSeCl) +
O
R
H3C
O
F2Bacac
Se
O
R
R = Ph
матическое исследование подобных реакций не
масс-спектрах которых присутствуют молекуляр-
проводилось. В частности, отсутствуют работы
ные ионы, соответствующие формуле HacacSePh.
по взаимодействию селенилхлоридов с дикетона-
Фрагментация в масс-спектрах этих соединений
ми, имеющими, кроме основного реакционного
позволяет утверждать, что первым элюируется
изомер (схема 3), в котором группа PhSe связана
центра при центральном атоме углерода, дополни-
с центральным атомом углерода (изомер А), а за-
тельный реакционный центр в заместителе.
тем изомер, в котором группа PhSe присоединена
Поэтому мы исследовали взаимодействие се-
к терминальному углероду (изомер Б). Наиболее
ленилхлорида с дикетонами, имеющими при кар-
информативна фрагментация изомера Б (схема 4):
бонильной группе хотя бы одну метильную (или
распад с выбросом ацетона и образованием
метиленовую) группу. В качестве реагента ис-
PhSe-замещенного кетенового иона, а также рас-
пользовали фенилселенилхлорид PhSeCl 2 - про-
пад с отщеплением терминальной группы и заме-
стейший органилселенилхлорид с ароматическим
стителя PhSe могли произойти только для дикето-
заместителем. Ожидалось, что для исследования
на с заместителем PhSe при терминальной группе.
образующихся соединений можно будет использо-
Изомеры А и Б разделены методом жидкостной
вать методы газовой хроматографии.
хроматографии, их структура подтверждена мето-
При исследовании взаимодействия фенилсе-
дом ЯМР 1H. В спектре изомера, элюирующегося
ленилхлорида 2 с ацетилацетоном в хлороформе
в условиях ГХ-МС первым, присутствуют сигна-
методом хромато-масс-спектрометрии (ГХ-МС)
лы енольного протона (17.39 м. д., 1H), аромати-
было установлено образование двух веществ, в
ческого заместителя (7.15-7.30 м. д., 5Н), а также
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
896
СВИСТУНОВА и др.
Схема 3.
• +
CH3
O
-O=C=CH2
Se Ph
• +
214
CH3
O
+
CH2
Se Ph
Se Ph
-O=C=CH2; -[(O)CCH3]•
171
O
CH3
[SePh]+
256
−[CC(O)CHC(O)CH3]•
157
Схема 4.
• +
O=C=CH Se Ph
-CH3C(O)CH3
198
• +
• +
H3C Se Ph
H2C
Se
-CH3C(O)CH=C=O
172
O
Ph
+
H3C
-[CH2SePh]•
O
CH3
O
O
85
256
[SePh]+
-[CH3C(O)CH2C(O)CH2]•
157
Схема 5.
H3C
H3C
Ph Se
CH2
O
O
O
PhSeCl
+
Ph Se
+
O
O
O
H3C
H3C
H3C
A
Б
сигнал двух метильных групп (2.42 м. д., 6H). Ре-
образованием обоих возможных изомеров А и Б
гистрация двух эквивалентных метильных групп,
(схема 5).
а также отсутствие сигнала протонов, связанных
Относительное количество изомеров А и Б в
с центральным атомом углерода в енольной фор-
реакционной смеси зависит от условий реакции и,
ме ацетилацетонатного фрагмента, подтверждают
в первую очередь, от ее длительности. Сначала в
структуру изомера А. В спектре соединения, ко-
реакционной смеси преобладает изомер А. Со вре-
торое элюируется вторым, присутствуют сигналы
менем его доля понижается, а количество изомера
метильной (2.01 м. д.) и метиленовой (3.51 м. д.)
Б возрастает.
групп, а также сигнал протона при центральном
Аналогично протекают реакции фенилселе-
атоме углерода ацетилацетонатного фрагмента
нилхлорида 2 с гептан-3,5-дионом и бензоилаце-
(5.45 м. д.), что соответствует структуре изомера Б.
тоном. В реакционных смесях присутствуют по
Таким образом, взаимодействие фенилселе-
два изомера. Фрагментация веществ, которые в ус-
нилхлорида 2 с ацетилацетоном сопровождается
ловиях ГХ элюируются первыми, протекает в со-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
ВЗАИМОДЕЙСТВИЕ СЕЛЕНИЛХЛОРИДОВ С β-ДИКЕТОНАМИ
897
ответствии со схемой 3, т. е. они имеют структуру
Попытки заменить хлористый водород другими
изомера А. Фрагментация веществ, которые элюи-
более удобными в обращении кислотами (толуол-
руются вторыми, соответствует изомеру Б. После
сульфокислота или трифторуксусная кислота) ока-
выделения изомеров их строение было подтверж-
зались неудачными.
дено методом ЯМР 1H. Как и в случае с ацетила-
Обработка изомера А HacacSePh большим из-
цетоном, сначала в реакционной смеси преоблада-
бытком гептан-3,5-диона (в присутствии HCl)
ет изомер А, который постепенно превращается в
приводит к тому, что в первые несколько минут в
изомер Б.
реакционной смеси присутствуют небольшое ко-
При взаимодействии фенилселенилхлорида 2
личество исходного вещества, а в качестве основ-
с ацетоуксусным эфиром методом ГХ-МС удается
ных компонентов - оба изомера HdprmSePh, со-
зафиксировать только один изомер. Фрагментация
отношение изомеров А:Б = 0.25:1. Через полчаса
этого изомера проходит в соответствии со схемой
в реакционной смеси наблюдается только изомер
3, поэтому его структура соответствует изомеру А.
Б. Аналогичный опыт с бензоилацетоном дает тот
Выделить продукт реакции в чистом виде и под-
же результат, хотя реакция протекает со значитель-
твердить его строение методом ЯМР нам не уда-
но меньшей скоростью: постепенно из HacacSePh
лось. Второй изомер на хроматограмме (ГХ-МС)
(А) образуется HbzacSePh (А), а затем появляется
отсутствует. По-видимому, в условиях газовой
изомер HbzacSePh (Б). После длительного стояния
хроматографии он разлагается, так как на хромато-
реакционной смеси изомер Б преобладает. В ходе
граммах в значительных количествах присутству-
реакции изомер HacacSePh (А) расходуется полно-
ют PhSeCH2C(O)CH3 и Ph2Se2. Это соединение
стью и качестве минорного продукта в реакцион-
ной смеси появляется изомер HacacSePh (Б).
удалось выделить методом жидкостной хромато-
графии и с помощью ЯМР 1H установлено, что
В аналогичные реакции изомеризации вступа-
его строение соответствует изомеру Б. В спектре
ют PhSe-замещенные производные других дикето-
присутствуют два синглетных сигнала равной ин-
нов, например, гептан-3,5-диона (схема 6).
тенсивности при 3.64 (2Н) и 3.73 м. д. (2Н), отно-
Изомер HacacSePh (А) в присутствии HCl реа-
сящиеся к протонам метиленовой группы, находя-
гирует не только с дикетонами, но и вступает в ре-
щейся между карбонильной и фенилселенильной
акции с кетонами, диэтилфосфористой кислотой,
группами, и метиленовой группы, находящейся
непредельными соединениями (циклогексеном)
между карбонильной и этоксикарбонильной груп-
(схема 7). Продукты реакций идентифицированны
пами.
методом ГХ-МС. Реакции с ацетофеноном и диэ-
С целью определения условий, в которых про-
тилфосфористой кислотой протекают с практиче-
исходит превращение изомеров, мы провели ряд
ски полным расходованием исходного соединения.
экспериментов с индивидуальными изомерами,
Изомеры Б в аналогичных условиях также под-
полученными в результате хроматографического
вергаются изомеризации. Например, обработка
выделения. Результаты этих опытов приведены в
изомера HacacSePh (Б) большим избытком HacacH
табл. 1.
(в присутствии HCl) приводит к образованию сме-
Эксперименты с индивидуальным изомером
си изомеров А и Б примерно в том же соотношении
HacacSePh (А) показали, что он превращается
(1:7). Таким образом, изомеры Б с группой PhSe в
в изомер Б только в присутствии хлористого во-
терминальном заместителе в присутствии дикето-
дорода и свободного ацетилацетона. В использо-
на и хлористого водорода также изомеризуются,
ванных условиях изомеризация идет не до конца.
но скорость превращения ниже, чем у изомеров А,
Равновесие устанавливается при соотношении
а в реакционной смеси, как правило, присутствует
большое количество исходного изомера. Изомеры
изомеров А:Б ~ 1:7. При длительном стоянии про-
исходит постепенное разложение изомеров с обра-
Б реагируют с ацетофеноном и с диэтилфосфори-
зованием нескольких соединений, главное из кото-
стой кислотой аналогично изомерам А.
рых Ph2Se2. Увеличение количества ацетилацетона
Из проведенных реакций следует, что по своим
приводит к увеличению скорости изомеризации.
свойствам дикетон с группой PhSe в присутствии
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
898
СВИСТУНОВА и др.
Таблица 1. Реакции индивидуальных изомеров PhSe-замещенных дикетоновa
HacacSePh (A) + HacacH + HCl
Продукты реакции
HacacSePh (А)
HacacSePh (Б)
Ph2Se2
5 мин
3.64
0.04
0.32
1 ч 15 мин
1.33
1.22
0.54
60 ч
0.14
0.94
1.68
HacacSePh (A) + HdprmH + HCl
Продукты реакции
HacacSePh (A)
HdprmSePh (Б)
HdprmSePh (A)
Ph2Se2
5 мин
0.09
0.66
2.52
0.35
25 мин
-
-
3.73
0.34
HacacSePh (A) + HbzacH + HCl
Продукты реакции
HacacSePh (A)
HacacSePh (Б)
Ph2Se2
5 мин
1.69
-
0.87
1.03
1 ч 40 мин
0.21
0.14
0.33
1.44
60 ч
-
0.09
-
1.64
HacacSePh (A) + CH3C(O)Ph + HCl
Продукты реакции
HacacSePh (A)
PhSeCH2C(O)Ph
Ph2Se2
5 мин
0.18
9.04
0.27
60 ч
-
3.45
1.82
HacacSePh (A) + HP(O)(OEt)2 + HCl
Продукты реакции
HacacSePh (A)
PhSeP(O)(OEt)2
Ph2Se2
5 мин
3.64
1.19
0.24
60 ч
-
9.59
0.01
HacacSePh (A) + C6H10б + HCl
Продукты реакции
HacacSePh (A)
PhSeC6H10Cl
Ph2Se2
5 мин
2.52
0.15
1.00
2 ч 45 мин
2.30
0.14
1.49
24 чв
0.50
0.82
2.57
HdprmSePh (A) + HacacH + HCl
Продукты реакции
HacacSePh (А)
HacacSePh (Б)
HdprmSePh (А)
Ph2Se2
5 мин
1.12
-
-
0.65
2 ч 45 мин
0.05
0.34
0.11
0.70
HасасSePh (Б) + HacacH + HCl
Продукты реакции:
HacacSePh (А)
HacacSePh (Б)
Ph2Se2
5 мин
-
2.24
0.17
17 ч
0.05
1.64
0.74
24 ч
0.19
1.37
1.03
HacacSePh (Б) + HdprmH + HCl
Продукты реакции
HacacSePh (Б)
HdprmSePh (Б)
Ph2Se2
5 мин
2.19
-
0.12
17 ч
0.06
2.20
0.23
HacacSePh (Б) + CH3C(O)Ph + HCl
Продукты реакции:
HacacSePh (Б)
PhSeCH2C(O)Ph
Ph2Se2
5 мин
2.39
0.11
0.12
17 ч
0.11
5.34
0.14
HacacSePh (Б) + HP(O)(OEt)2 + HCl
Продукты реакции:
HacacSePh (Б)
PhSeP(O)(OEt)2
Ph2Se2
5 мин
2.55
-
0.08
2 ч 45 мин
2.55
3.43
0.12
24 чв
-
8.51
0.13
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
ВЗАИМОДЕЙСТВИЕ СЕЛЕНИЛХЛОРИДОВ С β-ДИКЕТОНАМИ
899
Таблица 1. (продолжение)
HdprmSePh (Б) + CH3C(O)Ph + HCl
Продукты реакции:
HdprmSePh (Б)
PhC(O)CH2SePh
Ph2Se2
5 мин
1.59
0.22
0.07
17 ч
0.07
3.17
0.33
PhSeCH2C(O)CH3 + CH3C(O)Ph
Продукты реакции:
PhSeCH2C(O)CH3
PhSeCH2C(O)Ph
Ph2Se2
20 мин
1.02
4.79
0.20
45 мин
0.68
4.41
0.24
13 ч
0.56
3.51
1.03
а Приведены относительные количества отдельных компонентов реакционной смеси.
б C6H10 - циклогексен.
в Через 20 ч к реакционной смеси добавляли 200 мкл раствора хлороводорода.
HCl подобен PhSeCl. Уходящая группа - дикето-
замещенного дикетона к незамещенному. Однако
натный фрагмент. Изомеры А реагируют быстрее,
равновесие для изомера с группой PhSe в терми-
чем изомеры Б.
нальном заместителе сдвинуто в сторону конеч-
Таким образом, взаимодействие PhSeCl с ди-
ных продуктов сильнее, чем для изомера с заме-
стителем у центрального атома углерода (схема 8).
кетоном, имеющим два реакционных центра - у
Подобное соотношение приводит к постепенному
центрального атома углерода и в терминальном
накоплению в реакционной смеси изомера с груп-
заместителе, происходит по обоим направлениям,
при этом преимущественно реализуется первое
пой PhSe в терминальном заместителе.
направление. В присутствии выделяющегося хло-
Ранее подобные реакции были описаны, напри-
ристого водорода реакция обратима, и в реакци-
мер, реакция бромирования ацетоуксусного эфира
онной смеси устанавливается динамическое рав-
[24]. При длительном стоянии реакционной сме-
новесие, при котором группа PhSe переходит от
си (с неудаленным бромистым водородом) перво-
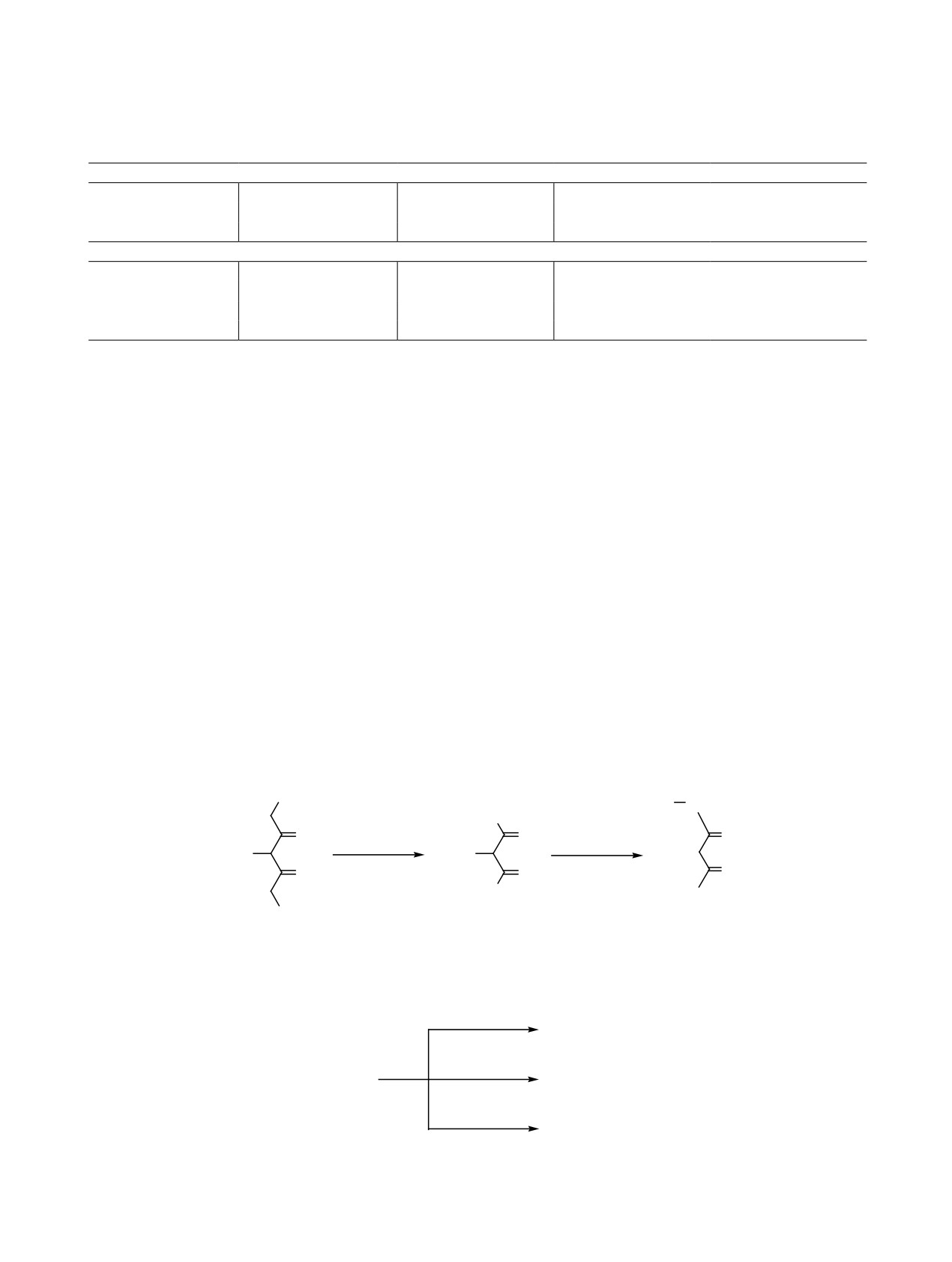
Схема 6.
CH3
SePh
CH2
H3C
O
O
O
HacacH
HacacH
SePh
SePh
HCl
HCl
O
O
O
H3C
H3C
CH3
Схема 7.
CH3C(O)Ph
PhSeCH2C(O)Ph
HP(O)(OEt)2
HCl
HacacSePh
PhSeP(O)(OEt)
2
A
C6H
10
PhSeC6H10Cl
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
900
СВИСТУНОВА и др.
Схема 8.
H3C
H3C
Ph Se
CH2
O
O
O
HCl
HCl
Ph
Se
PhSeCl
+
O
O
O
R
R
R
A
Б
Схема 9.
H3C
H3C
H3C
O
Ph Se
O
O
+
H
Ph Se H
+
H+
C
PhSe+
H
O
H
OH
O
H3C
H3C
H3C
Схема 10.
H3C
Ph
CH3
Ph
HCl
SePh
SePh
+
O
O
O
начально образовавшийся 2-бромацетоуксусный
Специальными опытами было установлено, что
эфир превращается в изомер с атомом брома у ато-
даже одна карбонильная группа значительно поля-
ма С4. Предполагается, что в 2-бромацетоуксусном
ризует связь Se-C, придавая атому селена электро-
эфире атом брома под влиянием двух близко рас-
фильные свойства (схема 10).
положенных электроноакцепторных групп (кар-
Нами исследована возможность протекания ре-
бонильной и этоксикарбонильной) приобретает
акций, подобных показанной на схеме 8, для ди-
электрофильные свойства и вступает в реакцию
кетонов с сероорганическим заместителем. При
бромирования со свободными молекулами ацето-
длительном выдерживании смеси 3-(фенилсульфа-
уксусного эфира, что приводит к установлению
нил)пентан-2,4-диона с
10-кратным избытком
динамического равновесия. Бромирование сопро-
HacacH (или с HdprmH) в присутствии HCl не
вождается образованием небольшого количества
было зафиксировано образования новых соеди-
С4-замещенного изомера, в котором атом брома
нений. Очевидно, что даже присутствие двух ак-
находится под влиянием только одной близкорас-
цепторных групп не приводит к появлению значи-
положенной электроноакцепторной группы. Этот
тельного положительного заряда на атоме серы и
изомер менее активно участвует в реакциях бро-
не придает ему электрофильных свойств.
мирования, что и приводит к его накоплению в ре-
акционной смеси. По-видимому, описанная схема
Учитывая, что образование изомеров с груп-
распространяется и на селенозамещенные дикетоны.
пой PhSe в терминальном заместителе происходит
только в кислых условиях, мы предположили, что
Необходимость присутствия хлористого водо-
рода (или бромистого водорода), указывает на то,
проведение реакции в условиях, исключающих
что на первой стадии реакции происходит прото-
образование кислоты, позволит разработать метод
нирование субстрата. Мы предполагаем, что пер-
получения изомеров А без примеси изомеров Б.
воначально протон присоединяется к атомам кис-
В результате ГХ-МС исследования реакционных
лорода, и реакция протекает по схеме 9.
смесей было установлено, что при обработке фе-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
ВЗАИМОДЕЙСТВИЕ СЕЛЕНИЛХЛОРИДОВ С β-ДИКЕТОНАМИ
901
Схема 11.
R1
R1
O
O
AcONa
Ph SeCl
+
Ph Se
AcOH
O
O
R2
R2
R1 = R2 = CH3, C2H5; R1 = CH3, R2 = Ph.
Схема 12.
EtO
EtO
Ph
O
O
AcONa
Se
Ph SeCl
+
AcOH
Se
O
O
Ph
H3C
H3C
нилселенилхлоридом 2 суспензии NaacacH или
Cu(O2CCH3)2, его промывание холодным мета-
NadprmH в инертном растворителе происходит
нолом или гексаном и последующая регенерация
образование изомеров А HacacSePh и HdprmSePh
дикетона разбавленной кислотой. При использо-
без примеси изомеров Б. В качестве основного
вании любого метода очистки в конечном продук-
побочного продукта реакции во всех пробах при-
те реакции присутствует небольшое количество
сутствовал Ph2Se2. Исследование показало, что
Ph2Se2 и совершенно отсутствует примесь изомера
подобный метод синтеза неудовлетворителен: вы-
Б. Примесь Ph2Se2 наблюдается в спектрах ЯМР
ходы продуктов реакций невысоки и невоспроиз-
1Н соединений по слабому мультиплету при 7.60-
водимы. Они сильно зависят от качества соли ди-
7.62 м. д. Другие сигналы Ph2Se2 (мультиплет в
кетона и от растворителя, в качестве которого мы
области 7.22-7.26 м. д., 6Н) перекрываются сигна-
использовали смеси хлороформ-диэтиловый эфир
лами PhSe заместителя дикетона. Примесь Ph2Se2
или бензол-диэтиловый эфир. Эфир - обязатель-
регистрируется методом ГХ-МС (3-7%, нормали-
ный компонент, по всей вероятности, он способ-
зация по площадям).
ствует частичному растворению солей дикетонов.
Попытка получить по схеме
11 изомер А
Однако в чистом эфире выход продуктов реакций
HacEtacSePh оказалась неудачной, из реакционной
ничтожен. Попытка заменить эфир на ТГФ приве-
смеси было выделено соединение с двумя группа-
ла к тому, что в реакционной смеси фиксировался
ми PhSe у центрального атома углерода (схема 12).
только Ph2Se2 и небольшое количество не иденти-
Очевидно, изомер А на основе ацетоуксусного
фицированных веществ (метод ГХ-МС).
эфира не очень устойчив и при выделении разла-
Удовлетворительные результаты получены при
гается. По всей вероятности, изомеры А любых
использовании в качестве растворителя уксусной
дикетонов склонны к разложению. В хроматогра-
кислоты (схема 11). Соли дикетонов получали при
фически чистом изомере А HacacSePh при дли-
смешивании расчетных количеств дикетона и аце-
тельном хранении наблюдалось образование при-
тата натрия.
меси с двумя группами PhSe у центрального атома
Примесь Ph2Se2 препятствует получению чи-
углерода.
стого образца. Для его отделения можно исполь-
Проведенные исследования показывают, что
зовать методы адсорбционной хроматографии
получение «аномально» замещенных продуктов
(колоночной или препаративной ТСХ). Другой ис-
при взаимодействии ацетилацетона и ацетоуксус-
пользованный нами способ - перевод селенилза-
ного эфира c бор-хелатным селенилхлоридом 1
мещенного дикетона в хелат меди при добавлении
[21] обусловлено условиями проведения реакций:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
902
СВИСТУНОВА и др.
Схема 13.
CH3
H3C
CH3H3C
O
O
O
O
F
AcONa
F
B
SeCl
+
B
Se
F
AcOH
F
O
O
O
O
CH3
R
CH3
R
R = CH3, OC2H5.
Схема 14.
CH3
H3C
CH3
O
O
O
F
F
B
SeCl
+
B
Se
F
F
O
O
O
O
CH3
Ph
CH3
O
Ph
присутствием выделяющегося в ходе взаимодей-
Таким образом, в результате проведенного ис-
ствия хлороводорода, значительным избытком
следования установлено, что при взаимодействии
дикетона и длительностью взаимодействия (как
селенилхлоридов с дикетонами, имеющими два
правило, 1 сут). Получение изомера А из бензоила-
реакционных центра - при центральном атоме
цетона, обусловлено тем, что селенозамещенные
углерода и при терминальной метильной груп-
производные этого дикетона изомеризуются мед-
пе, - происходит образование обоих возможных
леннее и изомеризация F2BacacSebzacH не успеает
изомеров. Соотношение образующихся изомеров
произойти, вероятно, из-за частичного удаления из
определяется природой дикетона, характером за-
реакционной смеси образующегося хлороводоро-
местителя, связанного с атомом селена, а также
да вследствие выветривания, а также из-за малого
условиями проведения реакции.
избытка бензоилацетона [21].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Мы рассчитывали, что проведение реакций
селенилхлорида 1 с ацетилацетоном и ацетоук-
ИК спектры в области 4000-550 см-1 получены
сусным эфиром в условиях, исключающих обра-
на приборе Infralum FT-801 в таблетках KBr или
зование хлороводорода, позволит получить ра-
в тонком слое. Спектры ЯМР 1H регистрировали
нее недоступные изомеры А F2BacacSeacacH и
на приборе Bruker WH 400 с рабочей частотой
F2BacacSeacEtacH. При обработке ацетилацетона
400 МГц в дейтерохлороформе относительно ТМС.
и ацетоуксусного эфира в среде уксусной кисло-
Газохроматографические и масс-спектрометриче-
ты селенилхлоридом 1 были получены ожидаемые
ские исследования выполнены на хроматографе
изомеры (схема 13).
Agilent 6890N с масс-селективным детектором
Для получения изомера Б F2BacacSebzacH мы
Agilent 5973N. Условия хроматографического ана-
повторили опыт [21], увеличив избыток дикетона
лиза: колонка HP-5ms, 30 м × 0.250 мм × 0.25 мкм;
до 4-кратного, использовали в качестве раствори-
газ-носитель - гелий; режим постоянного пото-
теля вместо хлорофорома дихлорэтан (который
ка; объемная скорость в колонке - 0.7 мл/мин.
лучше растворяет хлороводород) и увеличили вре-
Температура инжектора 280°С, деление потока
мя реакции до 3 сут. В результате был получен изо-
1:30. Температурная программа: 1 мин при 100°С,
мер Б (схема 14).
подъем температуры до
280°С
(20 град/мин),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
ВЗАИМОДЕЙСТВИЕ СЕЛЕНИЛХЛОРИДОВ С β-ДИКЕТОНАМИ
903
20 мин при 280°С. Режим работы масс-селектив-
бой густые желтые жидкости. Фракция 1 (изомер
ного детектора: температура узла сопряжения
А), 120 мг, tR 7.69 мин. ИК спектр, ν, см-1: 3067,
280°С, ионизация электронным ударом (70 эВ),
1577, 1475, 1437, 1408, 1067, 1020, 998, 908, 734,
режим полного сканирования в диапазоне m/z от
689. Спектр ЯМР 1H, δ, м. д.: 2.42 с (6H, CH3),
30 до 450, задержка детектирования 2.5 мин. ТСХ
7.15-7.30 м (5H, C6H5), 17.39 с (1H, OH-енол).
и ПТСХ выполняли на пластинах Sorbfil ПТСХ-А-
Масс-спектр, m/z (Iотн, %): 256 (100) [M]+, 214 (57)
УФ. Детектирование при УФ облучении (254 нм).
[CH3C(O)CH2SePh]+, 195 (15) [(CH)2CSePh]+, 171
Для колоночной хроматографии использовали си-
(56) [PhSeCH2]+, 157 (29) [PhSe]+, 132 (42), 77 (36),
ликагель 100-160 мкм.
43 (84).
Хлороформ, дихлорэтан и эфир перед исполь-
Фракция 2 (изомер Б), 55 мг, tR 8.33 мин. ИК
зованием очищали перегонкой над пятиокисью
спектр, ν, см-1: 3055, 1701, 1605, 1577, 1476, 1437,
фосфора. Другие растворители использовали без
1417, 1250, 1021, 913, 736, 690. Спектр ЯМР 1H, δ,
дополнительной очистки. Коммерческие реакти-
м. д.: 2.01 с (3H, CH3CO), 3.51 c (2H, SeCH2CO),
вы SO2Cl2, ацетилацетон, ацетоуксусный эфир пе-
5.45 c (1H, COCHCO), 7.26-7.34 м, 7.56 м (5H,
ред использованием перегоняли, а затем хранили
C6H5), 15.10 с (1H, OH-енол). Масс-спектр, m/z
в холодильнике. Селенилхлорид ацетилацетоната
(Iотн, %): 256 (77) [М]+, 214 (7) [CH3C(O)CH2SePh]+,
дифторида бора 1 и гептан-3,5-дион получены по
198 (41) [O=C=CHSePh]+, 172 (72) [CH3SePh]+, 157
известным методикам [25, 26].
(50) [PhSe]+, 91 (69), 85 (100) [CH3C(O)CH2C(O)]+,
77 (39), 43 (50).
Фенилселенилхлорид (2). К раствору 100 мг
Ph2Se2 (0.32 ммоль) в 1 мл хлороформа в один
Взаимодействие PhSeCl 2 с гептан-3,5-ди-
прием добавляли раствор 45-47 мг SO2Cl2 (0.33-
оном. К раствору
147.3 мг гептан-3,5-диона
0.35 ммоль, 1.03-1.09-кратный избыток) в 1 мл
(1.15 ммоль, 3.6-кратный избыток) в 1 мл хлоро-
хлороформа. Реакционная смесь становилась чер-
форма при перемешивании в один прием добав-
но-красной. Через 0.5-1 ч раствор использовали
ляли раствор соединения 2 (получено из 49.9 мг
без выделения продукта реакции. При необходи-
Ph2Se2 в 1.5 мл хлороформа). Протекание реакции
мости проводить дальнейшие синтезы в ином рас-
контролировали методом ГХ-МС. Через 10 мин
творителе (например, в уксусной кислоте) реакци-
(когда соотношение изомеров А и Б стало при-
онную смесь упаривали в вакууме при комнатной
мерно одинаковым) реакционную смесь отмывали
температуре. Оранжевый остаток использовали
водой и обрабатывали, как описано выше. Полу-
без дополнительной очистки.
чили две фракции, которые представляли собой
густые желтые жидкости. Фракция 1 (изомер А),
Взаимодействие PhSeCl 2 с ацетилацетоном.
22 мг, tR 8.60 мин. ИК спектр, ν, см-1: 2977, 2937,
К раствору 681.0 мг ацетилацетона (6.81 ммоль,
1721, 1577, 1475, 1437, 1296, 1190, 1065, 1020, 735,
5.3-кратный избыток) в 4 мл хлороформа при пе-
690. Спектр ЯМР 1H, δ, м. д.: 1.10 т (6H, CH3CH2,
ремешивании по каплям быстро прибавляли рас-
J 7.4 Гц), 2.80 к (4H, CH3CH2, J 7.4 Гц, 7.15-7.30
твор соединения 2 (получено из 201.3 мг Ph2Se2 в
м (5H, C6H5), 17.55 с (1H, OH-енол). Масс-спектр,
4 мл хлороформа). Через 25 мин раствор промы-
вали водой, сушили MgSO4 и упаривали в вакууме
m/z (Iотн, %): 284 (56) [М]+, 255 (15) [C2H5C(O)
CH(SePh)C(O)]+,
228
(59)
[C2H5C(O)CH2SePh]+,
при комнатной температуре. Остаток выдержива-
179 (13), 171 (56) [PhSeCH2]+, 157 (39) [PhSe]+, 128
ли в вакууме до полного удаления ацетилацетона
(16), 99 (29), 77 (32), 57 (100).
(контроль по изменению веса). По данным ГХ-
МС, в реакционной смеси в качестве основных
Фракция 2 (изомер Б) 40 мг, tR 8.91 мин. ИК
продуктов реакции присутствовали два изомера
спектр, ν, см-1: 3057, 2974, 2926, 1720, 1696, 1616,
HacacSePh и Ph2Se2. Полученный остаток раз-
1437, 1327, 1208, 1065, 741, 692. Спектр ЯМР 1H,
деляли на 6 г силикагеля в гексане. После выхо-
δ, м. д.: 1.08 т (3H, CH3CH2, J 7.58 Гц), 1.55 д [3H,
да Ph2Se2 (желтая зона) проводили ступенчатое
CH3CH(SePh), J 7.1 Гц], 2.25 к (2H, CH3CH2, J
элюирование смесью гексан-этилацетат. Выход
7.6 Гц), 3.75 к [1H, CH3CH(SePh), J 7.1 Гц], 5.34 с
соединений контролировали методом ГХ-МС.
(1H, COCHCO), 7.31 м и 7.57 м (5H, C6H5), 15.08
Получили две фракции, которые представляли со-
с (1H, OH-енол). Масс-спектр, m/z (Iотн, %): 284
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
904
СВИСТУНОВА и др.
(67) [M]+, 212 (21) [O=C=C(CH3)SePh]+, 185 (41)
преобладают: PhSeCH2C(O)CH3 (tR
6.55 мин),
[PhSe(CH3)CH]+, 157 (39) [PhSe]+, 127 (23), 105
соединение, масс-спектр которого соответству-
(51), 99 (100) [C2H5C(O)CH2C(O)]+, 77 (27), 57 (27).
ет изомеру А {tR 8.46 мин, масс-спектр, m/z (Iотн,
%): 286 (67) [M]+, 244 (100) [EtOC(O)CH2SePh]+,
При продолжительности реакции 1 ч в реакци-
198 (24) [O=C=CHSePh]+, 170 (56) [PhSeCH]+, 169
онной смеси остается только изомер Б, который
(53) [PhSeC]+, 163 (90), 157 (62) [PhSe]+, 135 (85),
может быть выделен с выходом 60-64%.
107 (35), 91 (34), 77 (53), 51 (19), 43 (53)}, Ph2Se2
Взаимодействие PhSeCl 2 с бензоилацетоном
(tR 9.62 мин), O=C(CH2SePh)2 (или изомер с геми-
(получение изомера Б). К раствору 185.9 мг бен-
нальным расположением заместителей SePh, tR
зоилацетона (1.15 ммоль, 3.6-кратный избыток) в
12.49 мин). Разделение продуктов реакции про-
4 мл дихлорэтана при перемешивании в один при-
водили методом ПТСХ в системе гексан-этила-
ем добавляли раствор соединения 2 (получено из
цетат, 10:1. Были выявлены: (1) желтая зона, Rf
50.0 мг Ph2Se2 в 1 мл дихлорэтана). Реакционную
0.76 (Ph2Se2); (2) бесцветная зона, Rf 0.45; (3) бес-
смесь оставляли при комнатной температуре на
цветная зона, Rf 0.34; (4) бесцветная зона, Rf 0.03.
3 сут, затем упаривали в вакууме при комнатной
Вещества, выделенные из 2- и 4-й зон, по данным
температуре, а остаток выдерживали в вакууме
ТСХ и ЯМР 1H, не индивидуальны. Из 3-й зоны
(2-4 мм рт. ст.) при температуре бани 50°С в кол-
получили 33 мг густой светло-коричневой жид-
бе, снабженной пальчиковым холодильником (при
кости, на хроматограмме которой (ГХ-МС) при-
необходимости холодильник очищали от конден-
сутствуют пики PhSeCH2C(O)CH3 и Ph2Se2. ИК
сировавшихся кристаллов бензоилацетона). Оста-
спектр, ν, см-1: 3057, 2982, 2936, 1741, 1708, 1627,
ток (36 мг) разделяли методом ПТСХ в системе
1578, 1477, 1437, 1406, 1318, 1240, 1182, 1024, 740,
гексан-бензол-этилацетат, 9:3:1. Получили 28 мг
691. Спектр ЯМР 1H, δ, м. д.: 1.26 т (3H, CH3CH2O,
густой светло-коричневой жидкости, tR 11.72 мин.
J 7.2 Гц), 3.64 с (2H, PhSeCH2CO), 3.73 с (2H,
ИК спектр, ν, см-1: 3057, 1600, 1573, 1477, 1437,
COCH2CO2), 4.17 к (2H, CH3CH2O, J 7.2 Гц), 7.31
1274, 1203, 1072, 1022, 769, 738, 690. Спектр ЯМР
м и 7.52 м (5H, C6H5).
1H, δ, м. д.: 3.65 с (2H, PhSeCH2CO), 6.08 c (1H,
Реакции индивидуальных изомеров PhSe-
COCHCO), 7.28-7.92 м [10H, SeC6H5, C(O)Ph],
замещенных дикетонов (общая методика). В
15.73 c (1H, OH-енол). Масс-спектр, m/z (Iотн, %):
опытах использовали хлороформ, насыщенный
318 (21) [M]+, 237 (5), 198 (14) [O=C=CHSePh]+,
хлористым водородом при 0°С. В соответствии
172 (40) [CH3SePh]+, 157 (19) [PhSe]+, 147 (100)
с титриметрическим определением 100 мкл рас-
[PhC(O)CH2C(O)]+, 105 (92) [PhC(O)]+, 91 (38), 77
твора содержалось 0.0377 ммоль хлористого во-
(94), 69 (63), 51 (33).
дорода. Для контроля за изменением количества
Получить описанным методом достаточно
отдельных компонентов в реакционную смесь
чистый образец изомера А не удалось. Он может
добавляли внутренний стандарт - гексадекан (tR
быть получен при проведении реакции в среде ук-
7.10 мин), 100 мг гексадекана смешивали с 10 мл
сусной кислоты, см. далее.
хлороформа. К 10 мг (0.039 ммоль) HacacSePh
Взаимодействие PhSeCl
2 с ацетоуксус-
(или иного дикетона) добавляли раствор
40-
ным эфиром (получение изомера Б). К раствору
50 мг реагента (использовали ~5-кратный избы-
400.1 мг ацетоуксусного эфира
(3.08 ммоль,
ток по молям) в 100 мкл стандартного раствора и
4.8-кратный избыток) в 2 мл хлороформа при пе-
100 мкл раствора хлороводорода. Протекание ре-
ремешивании в один прием добавляли раствор
акции контролировали, отбирая пробы объемом
соединения 2 (получено из 100.2 мг Ph2Se2 в 2 мл
10 мкл, которые разбавляли 1 мл хлороформа и
хлороформа). Реакционную смесь оставляли при
вводили в хроматограф. Соединения идентифици-
комнатной температуре на 1 ч, затем упаривали
ровали по масс-спектрам и временам удерживания.
в вакууме при комнатной температуре, а оста-
Масс-спектры дикетонов с селенофенильными
ток выдерживали в вакууме (2-4 мм рт. ст.) при
заместителями совпадают со спектрами веществ,
температуре бани 50°С (для удаления ацетоук-
описанными выше. Относительное количество от-
сусного эфира). На ГХ-МС реакционной смеси
дельных соединений в реакционных смесях оце-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
ВЗАИМОДЕЙСТВИЕ СЕЛЕНИЛХЛОРИДОВ С β-ДИКЕТОНАМИ
905
нивали по соотношению площади пика компонен-
вали раствором соляной кислоты (2 мл воды +
та к площади внутреннего стандарта.
200 мкл HCl, 1:1), водой, сушили MgSO4 и упа-
ривали в вакууме при комнатной температуре.
Взаимодействие PhSeCH2C(O)CH3
3
c
Получили 106 мг вязкой светло-коричневой жид-
CH3C(O)Ph. К раствору соединения 2, полученно-
кости. Выход 64%. Спектры изомера А совпадали
му из 49.1 мг Ph2Se2 в 1 мл хлороформа, добавляли
со спектрами, описанными выше. Найдено, %: C
0.5 мл ацетона. Через 5 мин реакционную смесь
упаривали при комнатной температуре в вакууме.
51.70; H 4.65. C11H12O2Se. Вычислено, %: C 51.78;
H 4.74.
Получили 65 мг вязкой желтой массы. На хромато-
грамме продукта реакции присутствует один пик
б. HdprmSePh получали аналогично. Выход
со временем удерживания 6.55 мин, масс-спектр
60%. Для отделения Ph2Se2 медный комплекс про-
которого соответствует PhSeCH2C(O)CH3 3, m/z
мывали метанолом. Спектры изомера совпадают
(Iотн, %): 214 (100) [M]+, 171 (58) [PhSeCH2]+, 157
со спектрами, описанными выше. Найдено, %: C
(35) [PhSe]+, 91 (95). К 10 мг (0.047 ммоль) соеди-
54.84; H 5.41. C13H16O2Se. Вычислено, %: C 55.13;
нения 3 добавляли 15.2 мг (0.127 ммоль, 2.7-крат-
H 5.69.
ный избыток) ацетофенона и хлористый водород,
в. HbzacSePh получали аналогично. Выход
как описано выше. На хроматограмме появилось
51%. Избыток бензоилацетона удаляли из реакци-
новое соединение, масс-спектр которого соответ-
онной смеси возгонкой на пальчиковый холодиль-
ствует PhSeCH2C(O)C6H5, m/z (Iотн, %): 276 (25)
ник в вакууме при температуре бани 50°С. Для
[M]+, 157 (7) [PhSe]+, 105 (100) [PhCO]+, 91 (18),
отделения Ph2Se2 медный комплекс промывали
77 (37).
метанолом. ИК спектр, ν, см-1: 3059, 2925, 1703,
Реакции HacacSPh. Взаимодействие HacacSPh
1671, 1595, 1578, 1476,1438, 1356, 1224, 1183,
с ацетилацетоном и с гептан-3,5-дионом проводи-
1021, 1000, 740, 690. Спектр ЯМР 1H, δ, м. д.: 2.38
ли в условиях, описанных выше. При выдержива-
с (3H, CH3), 5.38 с [1H, COCH(SePh)CO], 7.27-7.65
нии реакционных смесей в течение 20 ч образова-
м (10H, C6H5). Масс-спектр, m/z (Iотн, %): 318 (13)
ния новых соединений зарегистрировано не было
[M]+, 276 (5) [PhC(O)CH2SePh]+, 161 (19) [PhC(O)
(ГХ-МС).
CHC(O)CH3]+, 105 (100) [PhC(O)]+, 77 (33), 51 (9),
43 (7). Найдено, %: C 60.27; H 4.31. C16H14O2Se.
Получение изомеров А PhSe-замещенных
дикетонов. а. HасасSePh. К раствору 97.2 мг аце-
Вычислено, %: C 60.58; H 4.45.
тилацетона (0.972 ммоль, 1.5-кратный избыток) и
Взаимодействие соединения 2 с ацетоуксус-
80.3 мг безводного ацетата натрия (0.979 ммоль)
ным эфиром в среде уксусной кислоты. К рас-
в 2 мл уксусной кислоты при перемешивании по
твору 48.1 мг ацетоуксусного эфира (0.37 ммоль,
каплям прибавляли раствор соединения 2 (получе-
1.1-кратный избыток) и 31.0 мг безводного ацетата
но из 100.9 мг Ph2Se2) в 5 мл уксусной кислоты.
натрия (0.38 ммоль) в 2 мл уксусной кислоты при
Реакционную смесь перемешивали 5 мин, затем
перемешивании добавляли раствор соединения
добавляли 30 мл хлороформа, отмывали водой, су-
2 в 2 мл уксусной кислоты (получено из 52.1 мг
шили MgSO4 и упаривали в вакууме при комнат-
Ph2Se2). Через 5 мин перемешивания к реакцион-
ной температуре. Остаток выдерживали в вакууме
ной смеси добавляли 5 мл хлороформа, промыва-
до удаления ацетилацетона. Остаток растворяли в
ли водой, сушили MgSO4, упаривали при пони-
4 мл метанола и добавляли к нему теплый раствор
женном давлении при комнатной температуре и
71 мг Cu(OOCCH3)2∙H2O в 3 мл воды, подкис-
выдерживали в вакууме при 50°С (для удаления
ленной 50 мкл уксусной кислоты; сразу выпадал
ацетоуксусного эфира). Полученный остаток раз-
серый осадок. Реакционную смесь дополнитель-
деляли на 3 г силикагеля в гексане с последующим
но разбавляли равным объемом воды и отделяли
ступенчатым элюированием смесью гексан-этила-
осадок. После высушивания на воздухе осадок
цетат (как описано выше). Выход отдельных сое-
промывали гексаном, смешивали с 10 мл хло-
динений контролировали методом ТСХ (гексан-
роформа, 2 мл воды и 200 мкл соляной кислоты
этилацетат, 12:1), отбирая фракции с продуктом
(1:1) и интенсивно встряхивали несколько минут.
реакции, Rf 0.28. Получили 30 мг желтой густой
Органический слой отделяли, еще 2 раза промы-
жидкости, на хроматограмме которой (ГХ-МС)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
906
СВИСТУНОВА и др.
присутствовали пики PhSeCH2C(O)CH3 и Ph2Se2.
вывали из смеси бензол-петролейный эфир. Вы-
ИК спектр, ν, см-1: 3057, 2983, 2935, 1719, 1704,
ход 60% (232 мг), светло-коричневые кристаллы,
1577, 1229, 1181, 1038, 1023. Спектр ЯМР 1H, δ,
т. пл. 142-144°С (после повторной перекристалли-
м. д.: 1.12 т (3H, CH3CH2O, J 7.2 Гц), 2.37 c [3H,
зации). ИК спектр, ν, см-1: 1623, 1613, 1573, 1548,
CH3C(O)], 4.03 к (2H, CH3CH2O, J 7.2 Гц), 7.35 м,
1465, 1422, 1343, 1210, 1090, 1036, 772. Спектр
7.43 м и 7.71 м (10H, C6H5).
ЯМР 1H, δ, м. д.: 2.64 с (6H, CH3, BF2acacSe), 3.37
F2B(acacSeасасH) (изомер А). К раствору
с (2H, COCH2Se), 6.10 с (1H, COCHCO, bzac), 7.47
146 мг ацетилацетона (1.46 ммоль, 1.5-кратный
м, 7.56 м и 7.88 м (5H, C6H5), 15.73 с (1H, OH-е-
избыток) и 120 мг (1.46 ммоль) безводного аце-
нол). Найдено, %: C 46.98. C15H15BF2O4Se. Вычис-
тата натрия в 3 мл уксусной кислоты при переме-
лено, %: C 46.55.
шивании добавляли раствор 262 мг (1.00 ммоль)
ИНФОРМАЦИЯ ОБ АВТОРАХ
соединения 1 в 3 мл уксусной кислоты. После
5 мин перемешивания к реакционной смеси добав-
Свистунова Ирина Валентиновна, ORCID:
ляли 6 мл хлороформа, промывали водой, сушили
MgSO4, упаривали при пониженном давлении при
Третьякова Галина Олеговна, ORCID: https://
комнатной температуре. Остаток перекристалли-
orcid.org/0000-0002-2321-5405
зовывали из смеси хлороформ-гексан. Выход 53%
(174 мг), бесцветные кристаллы, т. пл. 105-107°С.
КОНФЛИКТ ИНТЕРЕСОВ
ИК спектр, ν, см-1: 2982, 1692, 1548, 1476, 1355,
Авторы заявляют об отсутствии конфликта
1279, 1202, 1154, 1090, 1017. Спектр ЯМР 1H,
интересов.
δ, м. д.: 2.35 с [6H, CH3 (SeacacH)], 2.63 с [6H,
CH3 (BF2acacSe)],
4.37 с
[1H, COCH(Se)CO
СПИСОК ЛИТЕРАТУРЫ
(SeacacH)]. Найдено, %: C 37.03. C10H13BF2O4Se.
Вычислено, %: C 36.96.
1. Santi C. Organoselenium Chemistry Between Synthesis
and Biochemistry. Sharjah: Bentham Science Publishers,
F2B(acacSeасEtасH) (изомер А) получали
2014. 429 p. doi 10.2174/97816080583891140101
аналогично из 268 мг (1.02 ммоль) соединения 1.
2. Santoro S., Azeredo J.B., Nascimento V., Braga A.L.,
Из массы, полученной после промывания водой
Sancineto L., Santi C. // RSC Adv. 2014. Vol. 4. N 60.
и упаривания, продукт реакции экстрагировали
P. 31521. doi 10.1039/c4ra04493b
3. Santi C., Santoro S., Battistelli B. // Curr. Org.
смесью диэтиловый эфир-пентан, 1:1. Получили
Chem.
2010. Vol.
14. N
20. P.
2442. doi
190 мг вязкого светло-коричневого вещества.
10.2174/138527210793358231
Выход 52%. ИК спектр, ν, см-1: 2987, 1710, 1548,
4. Иванов Д.К., Позняк С.К., Осипович Н.П., Стрель-
1469, 1348, 1184, 1092, 1041, 1029. Спектр ЯМР
цов Е.А. // Электрохимия. 2004. Т. 40. № 10. С. 1212;
1H, δ, м. д.: 1.29 т (CH3CH2O, J 7.2 Гц), 2.36 с (3H,
Ivanov D.K., Strel’tsov E.A., Poznyak C.K., Osipo-
CH3, acEtac), 2.66 с [6H, CH3, BF2acacSe), 4.21 к
vich N.P. // Russ. J. Electrochem. 2004. Vol. 40. N 10.
P. 1044. doi 10.1023/B:RUEL.0000046489.81407.ff
(2H, CH3CH2O, J 7.2 Гц), 4.36 с (1H, SeCH, acEtac).
5. Атаева С.У., Исаев А.И., Мехтиева С.И. // Физика
Найдено, %: C 37.50. C11H15BF2O5Se. Вычислено,
и химия стекла. 2015. Т. 41. № 3. С. 366; Ataeva S.U.,
%: C 37.22.
Isayev A.I., Mekhtieva S.I. // Glass Phys. Chem. 2015.
F2BacacSebzacH (изомер Б). Раствор 860 мг
Vol. 41. N 3. P. 272. doi 10.1134/S1087659615030037
6. Григорьев А.М. // Фотоника. 2021. Т. 15. № 4. С. 308.
бензоилацетона (5.31 ммоль, 4.0-кратный избы-
7. Fairweather-Tait S.J., Bao Y., Broadley M.R., Collings R.,
ток) в 5 мл дихлорэтана добавляли к раствору
Ford D., Hesketh J.E., Hurst R. // Antioxidants and
346 мг соединения 1 (1.32 ммоль) в 5 мл дихлор-
Redox Signal. 2011. Vol. 14. P. 1337. doi 10.1089/
этана. После 3 сут стояния при комнатной темпера-
ars.2010.3275
туре светло-коричневая реакционная смесь имела
8. Родионова Л.В., Шурыгина И.А., Сухов Б.Г., По-
пова Л.Г., Шурыгин М.Г., Артемьев А.В., Пого-
сильный запах хлороводорода. После упаривания
даева Н.Н., Кузнецов С.В., Гусарова Н.К., Тро-
в вакууме остаток три раза промывали гексаном
фимов Б.А. // ЖОХ. 2015. Т. 85. Вып. 2. С. 314;
(60°С, перемешивание) (гексановые растворы
Rodionova L.V., Shurygina I.A., Sukhov B.G., Popo-
использовали для регенерации избытка бензои-
va L.G., Shurygin M.G., Artem’ev A.V., Pogodaeva N.N.,
лацетона). Промытый остаток перекристаллизо-
Kuznetsov S.V., Gusarova N.K., Trofimov B.A. // Russ.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022
ВЗАИМОДЕЙСТВИЕ СЕЛЕНИЛХЛОРИДОВ С β-ДИКЕТОНАМИ
907
J. Gen. Chem. 2015. Vol. 85. N 2. P. 485. doi 10.1134/
17. Amosova S.V., Filippov A.A., Makhaeva N.A., Alba-
S1070363215020218
nov A.I., Potapov V.A. // Beilstein J. Org. Chem. 2020.
9.
Варламова Е.Г., Мальцева В.Н. // Биофизика. 2019.
Vol. 16. P. 515. doi 10.3762/bjoc.16.47
Т. 64. № 4. C. 646; Varlamova E.G., Maltseva V.N. //
18. Мусалов М.В., Якимов В.А., Потапов В.А., Амосо-
Biophysics. 2019. Vol. 64. N 4. P. 510. doi 10.1134/
ва С.В., Зинченко С.В. // ЖОрХ. 2019. Т. 55. Вып. 8.
S0006302919040021
С. 1247; Musalov M.V., Yakimov V.A., Potapov V.A.,
10.
Minkkila A., Myllymaki M.J., Saario S.M., Castillo-
Amosova S.V., Zinchenko S.V. // Russ. J. Org.
Mendez J.A., Koskinen A.M.P., Fowler C.J., Leppa-
Chem. 2019. Vol. 55. N 8. P. 1153. doi 10.1134/
nen J., Nevalainen T. // Eur. J. Med. Chem. 2009.
Vol. 44. P. 2994. doi 10.10016/j.ejmech.2009.01.007
S0514749219080147
11.
Ихлев М., Петров М.Л., Певзнер Л.М., Поня-
19. Amosova S.V., Filippov A.S., Potapov V.A., Penzik M.V.,
ев А.И. // ЖОХ. 2018. Т. 88. Вып. 1. С. 159;
Makhaeva N.A., Albanov A.I. // Synthesis. 2019. Vol. 51.
Yekhlef M., Petrov M.L., Pevzner L.M., Ponyaev A.I. //
N 8. P. 1832. doi 10.1055/s-0037-1610683
Russ. J. Gen. Chem. 2018. Vol. 88. N 1. P. 151. doi
20. Zhili C., Fangli H., Shengli H., Zhengxing Z.,
10.1134/S0044460X19060199
Hui M., Wenling Q. // J. Org. Chem. 2019. Vol. 84. N 12.
12.
Ягунов С.Е., Хольшин С.В., Кандалинцева Н.В.,
P. 8100. doi 10.1021/acs.joc.9b00973
Просенко А.Е. // Изв. АН. Сер. хим. 2018. № 8.
21. Svistunova I.V., Tretyakova G.O., Gaivoronskaya K.A. //
С. 1452; Yagunov S.E., Kholshin S.V., Kandalintse-
Phosphorus, Sulfur, Silicon, Relat. Elem. 2017. Vol. 192.
va N.V., Prosenko A.E. // Russ. Chem. Bull. 2018.
N 11. P. 1177. doi 10.1080/10426507.2017.1354210
Vol. 67. N 5. P. 844. doi 10.1007/s11172-018-2148-x
13.
Варламова Е.Г., Гольтяев М.В., Фесенко Е.Е. //
22. Shahzad S.A., Wirth T. // Angew. Chem. Int. Ed. 2009.
Докл. АН.
2019. Т.
488.
№ 2. С. 212;
Vol. 48. N 14. P. 2588. doi 10.1002/anie.200806148
Varlamova E.G., Goltyaev M.V., Fesenko E.E. //
23. Potaczek P., Kloc K., Młochowski J. // Synth. Commun.
Doklady Doklady Biochem. Biophys.
2019.
2005. Vol. 35. N 8. P. 1077. doi 10.1081/SCC-
Vol. 488. N 1. P. 300. doi 10.1134/S1607672919050065
200054209
14.
Varlamova E.G., Goltyaev M.V., Kuznetsova J.P. //
24. Фьюзон Р. Реакции органических соединений. М.:
Mol. Biol. 2018. Vol. 52. N 3. P. 446. doi 10.7868/
Мир, 1966. С. 131.
S0026898418030151
25. Свистунова И.В., Шапкин Н.П., Зязева М.Ю. //
15.
Ansar S., Abudawood M., Hamed S.S., Aleem M.M. //
ЖОХ. 2010. Т. 80. Вып. 12. С. 1968.; Svistunova I.V.,
Biol. Trace Elem. Res. 2017. Vol. 175. N 1. P. 161. doi
Shapkin N.P., Zyazeva M.Y. // Russ. J. Gen. Chem. 2010.
10.1007/s12011-016-0759-3
16.
Ионова В.А., Темирбулатова С.И., Великородов А.В.,
Vol. 80. N 12. P. 2430. doi 10.1134/S1070363210120054
Титова О.Л., Мелентьева Е.А. // Изв. вузов. Сер.
26. Фишер Г., Орт Г. Химия пиррола. Л.: ОНТИ-ХИМ-
Хим. и хим. технол. 2013. Т. 56. № 8. С. 18.
ТЕОРЕТ, 1937. Т. 1. С. 454.
Reaction of Selenyl Chlorides with β-Diketones
I. V. Svistunovaa,*, G. O. Tretyakovaa,b, and Z. N. Puzyrkova
a Far Eastern Federal University, Vladivostok, 690922 Russia
b Institute of Chemistry, Far Eastern Branch of the Russian Academy of Sciences, Vladivostok, 690022 Russia
*e-mail: irasvist@gmail.com
Received February 2, 2022; revised March 5, 2022; accepted March 10, 2022
It has been established that the reaction of phenylselenyl chloride with diketones having two reaction centers -
at the central carbon atom and in the side substituent - leads to the formation of both possible isomers. The
reason for this is the isomerization of the initially formed product containing the PhSe group at the central car-
bon atom, which occurs in the presence of the formed hydrogen chloride. The isomerization is due to the high
electrophilic activity of the PhSe group, which is under the action of two adjacent electronoacceptor (carbonyl/
carboxyl) groups. Carrying out the reaction under conditions excluding the formation of hydrogen chloride, for
example, with sodium salts of diketones, makes it possible to obtain an isomer containing a PhSe group at the
central carbon atom, without impurities of the second isomer.
Keywords: selenyl chloride, acetylacetone, acetoacetic ester, substitution, isomerization
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 6 2022