ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 12, с. 1859-1867
К 145-летию со дня рождения А. Е. Арбузова
УДК 547.1’:541.67
КОНФОРМАЦИОННЫЙ АНАЛИЗ
БИС[N-АЛКИЛ-N-(2-ДИФЕНИЛФОСФОРИЛЭТИЛ)]-
АМИДОВ ДИГЛИКОЛЕВОЙ КИСЛОТЫ
© 2022 г. А. А. Кузнецоваa, Д. В. Чачковb, К. В. Царьковаc,d, О. И. Артюшинe,
Н. А. Бондаренкоc,d, Я. А. Верещагинаa,*
a Казанский (Приволжский) федеральный университет, ул. Кремлевская 18, Казань, 420008 Россия
b Казанское отделение Межведомственного суперкомпьютерного центра Российской академии наук -
филиал Федерального государственного учреждения «Федеральный научный центр
«Научно-исследовательский институт системных исследований Российской академии наук»,
Казань, 420111 Россия
c Институт химических реактивов и особо чистых химических веществ Национального исследовательского
центра «Курчатовский институт», Москва, 107076 Россия
d Национальный исследовательский центр «Курчатовский институт», Москва, 123182 Россия
e Институт элементоорганических соединений имени А. Н. Несмеянова Российской академии наук,
Москва, 119991 Россия
*e-mail: yavereshchagina@gmail.com
Поступило в редакцию 5 октября 2022 г.
После доработки 26 октября 2022 г.
Принято к печати 30 октября 2022 г.
Осуществлен конформационный анализ бис[N-алкил-N-(2-дифенилфосфорилэтил)]амидов дигликоле-
вой кислоты методами дипольных моментов, ИК спектроскопии и квантовой химии DFT B3PW91/6-
311++G(df,p). В растворе N,N-диметил-, N,N-дибутил- и N,N-диоктилзамещенные диамиды дигликолевой
кислоты существуют в виде равновесия двух групп симметричных или несимметричных конформеров,
в некоторых из них возможны внутримолекулярные контакты с участием атомов водорода алкильных
заместителей и атомов кислорода эфирного мостика или карбонильных групп.
Ключевые слова: бис[N-алкил-N-(2-дифенилфосфорилэтил)]амиды дигликолевой кислоты, конформа-
ционный анализ, дипольные моменты, ИК спектроскопия, квантово-химические расчеты
DOI: 10.31857/S0044460X2212006X, EDN: MTXJNT
Диамиды дигликолевой кислоты востребованы
колевой кислоты) лигандов является N,N,N′,N′-
в качестве экстрагентов для разделения, концен-
тетраоктиламид дигликолевой кислоты [11-13].
трирования и извлечения редкоземельных элемен-
Известно, что увеличение количества коорди-
нирующих групп способствует повышению экс-
тов и актиноидов из растворов неорганических
тракционной способности лигандов [14], поэтому
кислот и применяются при переработке радиоак-
недавно были предложены новые полидентатные
тивных отходов [1-7], используются при модифи-
бис[N-алкил-N-(2-дифенилфосфорилэтил)]амиды
кации композиционных материалов для колоноч-
дигликолевой кислоты [15]. По результатам спек-
ной хроматографии [8-10].
троскопии ЯМР 1H, 13C и 31P удалось обнаружить
Одним из распространенных (наиболее изучен-
существование двух форм, однако детализирован-
ных и широко используемых среди амидов дигли-
ная информация о строении этих фосфорилиро-
1859
1860
КУЗНЕЦОВА и др.
ты 3 (схема 1) методами дипольных моментов, ИК
Схема 1.
спектроскопии и квантовой химии DFT B3PW91/6-
311++G(df,p).
O
O
O
O
Экспериментальные полярности фосфорили-
Ph P
N C O C N P Ph
рованных диамидов дигликолевой кислоты 1-3
Ph
R
R
Ph
впервые определены в растворе бензола (табл. 1),
R = Me (1), Bu (2), Oct (3).
их величины высоки, что хорошо согласуется с из-
вестными данными для соединений четырехкоор-
динированного фосфора, содержащих фосфориль-
ванных диамидов дигликолевой кислоты не была
ные, карбонильные и эфирные группы.
получена [15]. Следует отметить, что в литературе
Для соединений 1-3 были построены все воз-
недостаточно внимания уделяется изучению стро-
можные конформации путем вращения частей
ения подобных свободных лигандов: имеются дан-
молекул относительно простых связей. На пер-
ные о строении в кристалле нескольких простей-
вом этапе проведены расчеты с использованием
ших диамидов дигликолевой кислоты [16-18], и
метода DFT B3PW91 и простого базисного на-
преимущественно описано строение металлоком-
бора 6-31G(d). Были оптимизированы все задан-
плексов [19-23].
ные структуры и рассчитаны их относительные
Для подробного изучения реакционной и ком-
энергии и теоретические дипольные моменты. В
плексообразующей способности этих соединений
результате были отброшены вырожденные струк-
необходимо определить их строение в растворе,
туры и конформеры с высокими значениями от-
именно конформационная подвижность поли-
носительной энергии. На втором этапе были про-
дентатных лигандов определяет их свойства и
ведены расчеты в расширенном базисном наборе
позволяет объяснить эффективность комплексо-
6-311++G(df,p) и отобраны предпочтительные
образования в растворе [24, 25] Например, с по-
конформеры с энергиями менее 7 кДж/моль.
мощью DFT-моделирования было предсказано,
По данным DFT-расчетов, для диамида 1 было
что тридентатные O,N,O-донорные циклические
найдено более двадцати конформеров с относи-
дилактамы являются гораздо более селективными
тельными энергиями менее 7 кДж/моль, однако
и эффективными экстрагентами для разделения
сопоставление теоретических результатов с экс-
лантаноидов и актиноидов, чем пиридин-2,6-ди-
периментальными данными (дипольные моменты,
карбоксамиды с открытой структурой, что соот-
ветствует экспериментальным данным [26, 27].
ИК и ЯМР спектроскопия) позволило значительно
сократить количество возможных конформеров,
В настоящей работе мы осуществили экс-
в частности, были исключены конформеры с вы-
периментальный и теоретический конформа-
сокими энергиями Гиббса (более 7 кДж/моль) и
ционный анализ бис[N-метил-N-(2-дифенил-
имеющие заниженные или завышенные значения
фосфорилэтил)]амида дигликолевой кислоты 1,
теоретических и вычисленных по аддитивной схе-
бис[N-бутил-N-(2-дифенилфосфорилэтил)]амида
ме дипольных моментов.
дигликолевой кислоты 2 и бис[N-октил-N-(2-ди-
фенилфосфорилэтил)]амида дигликолевой кисло-
В результате было отобрано четыре предпоч-
тительных конформера 1а-1г (табл. 2, рис. 1), в
которых атомы фосфора имеют пирамидальное
строение, фенильные заместители цис-ориенти-
Таблица 1. Коэффициенты расчетных уравнений, ори-
ентационные поляризации и экспериментальные ди-
рованы, а этильные мостики гош-ориентированы
польные моменты соединений 1-3
относительно фосфорильной группы, амидные
фрагменты плоские.
Соединение
α
γ
Рор, см3
µ, Д
В конформерах 1а и 1б (рис. 1) эфирный
1
5.049
0.228
558.851
5.20
атом кислорода копланарен одной из амид-
2
4.140
0.208
518.376
5.01
ных плоскостей, вторая карбонильная груп-
3
3.590
0.153
525.615
5.04
па расположена гош относительно эфирного
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
КОНФОРМАЦИОННЫЙ АНАЛИЗ
1861
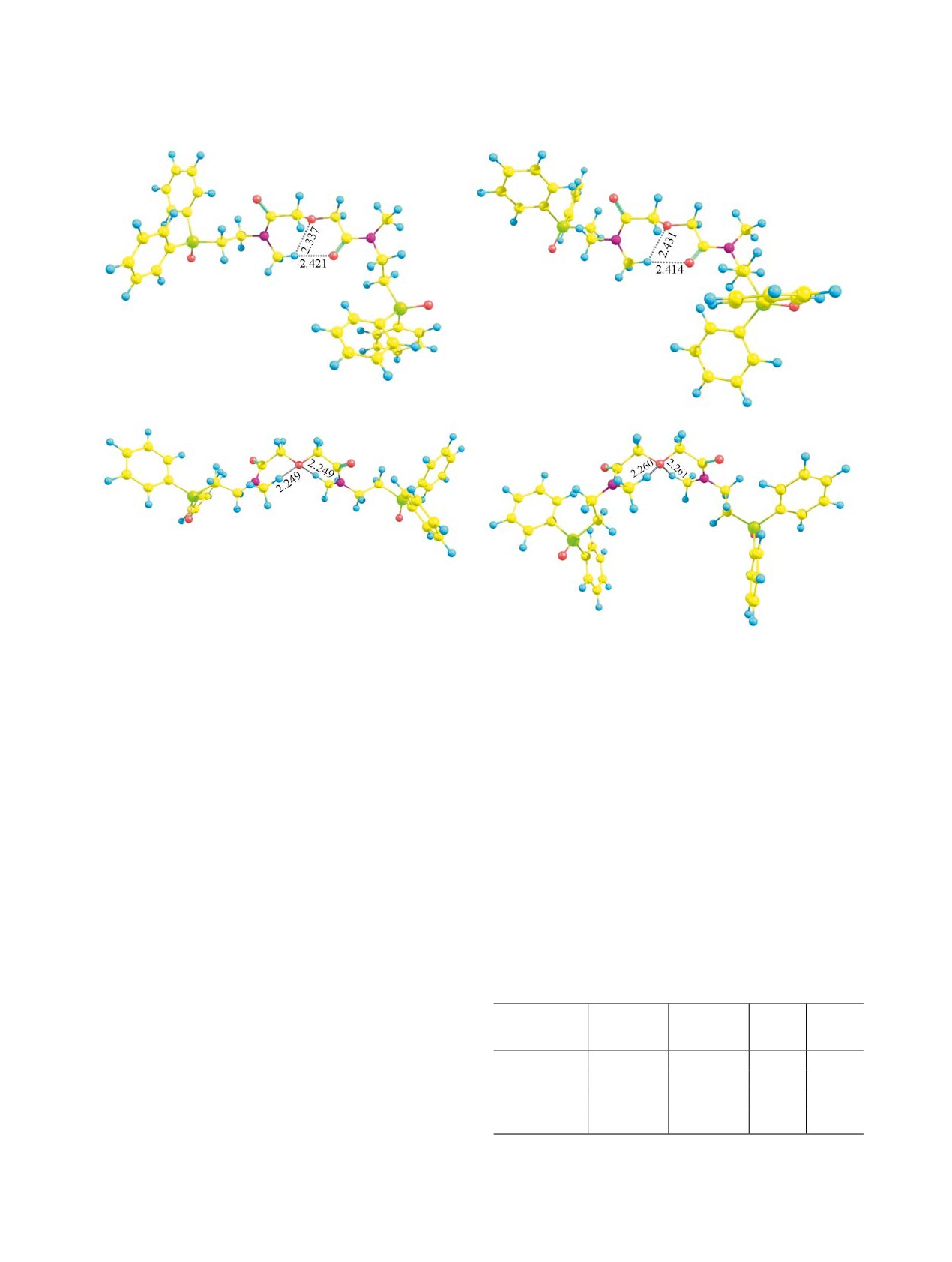
1а
1б
1в
1г
Рис. 1. Структуры конформеров 1а-г по данным DFT B3PW91/6-311++G(df,p).
фрагмента. Отличие конформеров 1а и 1б за-
Сsp3-H…O-Сsp3 составляет 2.249-2.261 Å). При-
ключается в инвертированном расположении ди-
мечательно, что структуры центрального дигли-
фенилфосфорилэтильных фрагментов. В формах
кольамидного фрагмента в конформерах 1в и 1г
1а и 1б возможны внутримолекулярные водо-
и такого же фрагмента в кристалле N,N′-бис(4-
родные контакты между атомом водорода одно-
метоксифенил)амида дигликолевой кислоты (дан-
го из метильных радикалов и атомом кислорода
ные РСА [18]) подобны.
карбонильной группы или эфирного фрагмен-
Сопоставление ИК спектров соединения 1 в
та (расстояния Сsp3-H…O=С и Сsp3-H…O-Сsp3
индивидуальном состоянии (масло) и в растворе
равны 2.337 и 2.421 Å для конформера 1а, 2.341
и 2.414 Å для формы 1б). Конформеры 1в и 1г
симметричные (рис. 1), обе карбонильные группы
Таблица 2. Относительные энергии, энергии Гиббса,
имеют гош-расположение относительно эфирного
теоретические и вычисленные по аддитивной схеме ди-
фрагмента, при этом амидные плоскости практи-
польные моменты соединения 1
чески перпендикулярны друг другу. В конформере
ΔE,
ΔG,
1г дифенилфосфорилэтильные фрагменты инвер-
Конформер
μтеор, Д
μвыч, Д
кДж/моль
кДж/моль
тированы по сравнению с формой 1в. По резуль-
1а
0.0
0.0
3.17
2.68
татам расчетов, в обоих конформерах возможны
1б
1.1
0.6
4.00
4.13
внутримолекулярные взаимодействия между од-
1в
6.0
3.1
5.36
6.50
ним из атомов водорода метильных заместите-
1г
6.7
3.7
2.35
3.29
лей и эфирным атомом кислорода (расстояние
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
1862
КУЗНЕЦОВА и др.
Таблица 3. Относительные энергии, энергии Гиббса,
В случае N,N-дибутилзамещенного диамида
теоретические и вычисленные по аддитивной схеме ди-
2 (табл. 3, рис. S2, см. Дополнительные материа-
польные моменты соединения 2
лы) конформеры 2а и 2б аналогичны по строению
ΔE,
ΔG,
конформерам 1а и 1б. Структура конформеров 2в,
Конформер
μтеор, Д
μвыч, Д
кДж/моль
кДж/моль
2ж и 2к подобна форме 2а, а конформеров 2д и
2а
0.0
0.5
3.78
2.57
2е - форме 2б, отличия в них обусловлены вра-
2б
1.6
3.1
4.44
4.14
щением бутильных заместителей относительно
2в
1.8
3.7
3.54
2.64
связей N-Cбутил. В конформерах 2а и 2б с более
2г
2.5
0.0
2.53
3.74
низкими относительными энергиями бутильные
2д
2.7
0.0
4.13
3.65
заместители и дифенилфосфорилэтильные фраг-
2е
3.0
4.4
4.27
3.91
менты имеют анти-расположение относитель-
2ж
3.2
2.1
3.75
2.52
но амидных плоскостей, в конформерах 2в, 2д и
2з
3.7
0.9
0.36
1.21
2ж одна пара имеет син-расположение, а в слу-
2и
3.7
3.3
2.47
3.58
чае форм 2е и 2к обе пары заместителей имеют
2к
5.1
4.4
3.47
2.42
син-конфигурацию. В остальных конформерах
2л
5.7
4.0
0.42
1.25
атом кислорода копланарен обеим амидным пло-
скостям, которые практически перпендикулярны
друг другу. Отличия возникают в расположении
дифенилфосфорилэтильных фрагментов: в парах
бензола свидетельствует о наличии конформаци-
конформеров 2г, 2з и 2и, 2л эти фрагменты пред-
онной неоднородности (рис. S1, см. Дополнитель-
ставляют зеркальные формы. Конформеры 2г и
ные материалы). Максимумы полос поглощения
2з симметричные, оба бутильных заместителя и
карбонильных и фосфорильных групп смещены
дифенилфосфорилэтильные фрагменты имеют
[в индивидуальном состоянии: ν(C=O) 1650 см-1,
анти-расположение относительно амидных пло-
ν(P=O) 1174 см-1; в растворе: ν(C=O) 1663 см-1,
скостей, тогда как в конформерах 2и и 2л одна
ν(P=O) 1198 см-1]. Полосы поглощения, соответ-
пара заместителей имеет син-конфигурацию. В
ствующие этим группам, являются составными.
конформерах 2г, 2з, 2и и 2л возможны внутримо-
Мы полагаем, что в растворе N,N-диметил-
лекулярные водородные контакты между атомами
замещенный диамид 1 существует в виде двух
кислорода карбонильных групп и атомами водоро-
групп конформеров: к первой группе относятся
да метильных мостиков, а в конформерах 2б, 2д-ж
несимметричные конформеры 1а и 1б, структура
и 2к - между атомом водорода одного из бутиль-
которых соответствует минорной форме, найден-
ных заместителей и эфирным атомом кислорода
ной по данным спектроскопии ЯМР [15]. Вторую
(рис. S2, см. Дополнительные материалы). Заме-
группу составляют симметричные конформе-
тим, что строение центрального дигликольамид-
ры 1в и 1г, соответствующие мажорной форме
ного фрагмента в группе конформеров 2г, 2з, 2и,
в спектрах ЯМР [15], причем конформационное
2л идентично таковому в более простом диамиде
равновесие сдвинуто в сторону более полярного
дигликолевой кислоты (данные РСА [17]).
конформера 1в. Подобное конформационное по-
ИК спектры диамида 2 в индивидуальном со-
ведение установлено и для схожих по строению
стоянии (масло) и в растворе бензола практически
N-алкил-N-[(2-дифенилфосфорил)этил]амидов
совпадают. Для карбонильной группы в растворе
дифенилфосфорилуксусной кислоты [28].
наблюдается расщепление максимума полосы по-
По данным расчетов для N,N-дибутил- и
глощения (1648 и 1654 см-1) по сравнению со спек-
N,N-диоктилзмещенных диамидов 2 и 3 количе-
тром индивидуального соединения (1652 см-1).
ство конформеров увеличивается за счет вращения
Максимумы полос поглощения фосфорильных
алкильных заместителей, для каждого соединения
групп наблюдаются при 1181-1182 см-1. Полосы
найдено по одиннадцать предпочтительных кон-
поглощения, соответствующие валентным колеба-
формеров.
ниям карбонильной и фосфорильной групп, име-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
КОНФОРМАЦИОННЫЙ АНАЛИЗ
1863
ют уширенную составную форму, что указывает
Таблица 4. Относительные энергии, энергии Гиббса,
на существование конформационного равновесия.
теоретические и вычисленные по аддитивной схеме ди-
польные моменты соединения 3
Анализ экспериментальных и теоретических
данных свидетельствует о том, что соединение
ΔE,
ΔG,
Конформер
μтеор, Д
μвыч, Д
2 существует в растворе в виде двух групп кон-
кДж/моль
кДж/моль
формеров: несимметричные конформеры 2а, 2б,
3а
0.0
0.1
3.87
2.64
2в, 2д, 2е и 2ж соответствуют минорной форме в
3б
1.9
3.4
4.51
4.28
спектрах ЯМР [15], содержащей магнитно неэкви-
3в
2.2
1.5
3.62
2.73
валентные протоны, остальные конформеры обра-
3г
2.6
2.5
2.29
3.51
зуют вторую группу, соответствующую мажорной
3д
3.3
3.1
4.44
3.82
3е
3.6
2.6
3.70
2.49
форме.
3ж
3.7
0.0
4.04
3.58
Для фосфорилированного диамида с октиль-
3з
3.9
0.9
0.21
0.97
ными заместителями наблюдается такая же кон-
3и
4.5
3.6
2.43
3.55
формационная картина, как в случае бутильного
3к
5.5
7.2
3.41
2.52
производного. Установлено соответствие строения
3л
6.1
6.3
0.35
1.05
предпочтительных конформеров N,N-диоктилза-
мещенного диамида 3 (табл. 4, рис. S3, см. Допол-
нительные материалы) и диамида 2: формы 3а-3г
и 3ж-3л подобны конформерам 2а-2г и 2ж-2л,
расположением амидных плоскостей и несимме-
3д-2е и 3е-2д, т. е. удлинение N-алкильных заме-
тричных, в которых эфирный атом кислорода ко-
стителей в случае соединений 2 и 3 не приводит к
планарен одной из амидных плоскостей, а вторая
значительным изменениям их конформационного
карбонильная группа имеет гош-ориентацию от-
поведения. В конформерах 3в, 3г, 3з, 3и, 3л воз-
носительно эфирного фрагмента. N,N-Дибутил- и
можны внутримолекулярные водородные контак-
N,N-диоктилзамещенные диамиды дигликолевой
ты с участием атомов кислорода карбонильных
кислоты существуют в растворе в виде двух групп
групп и атомов водорода метильных мостиков, а
в конформерах 3д-ж и 3к - с участием эфирного
конформеров, эфирный атом кислорода в которых
копланарен одной или двум амидным плоскостям
атома кислорода и атома водорода одного из ок-
тильных заместителей (рис. S3, см. Дополнитель-
(схема 2). В некоторых предпочтительных кон-
ные материалы).
формерах возможно образование внутримолеку-
лярных водородных контактов между атомами
В ИК спектре N,N-диоктилзамещенного диами-
водорода алкильных радикалов амидной части мо-
да 3 (масло) наблюдаются признаки конформаци-
лекулы и эфирным атомом кислорода или атомами
онного равновесия. Валентные колебания карбо-
водорода метильных мостиков и атомами кислоро-
нильной (1183 см-1) и фосфорильной (1652 см-1)
да карбонильных групп.
групп проявляются в виде уширенных составных
полос.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Анализ теоретических и вычисленных соглас-
но аддитивной схеме дипольных моментов пред-
Бис[N-алкил-N-(2-дифенилфосфорилэтил)]-
почтительных конформеров соединений 1-3 пока-
амиды дигликолевой кислоты 1-3 получены по ме-
зал хорошее согласие их величин.
тодике [15].
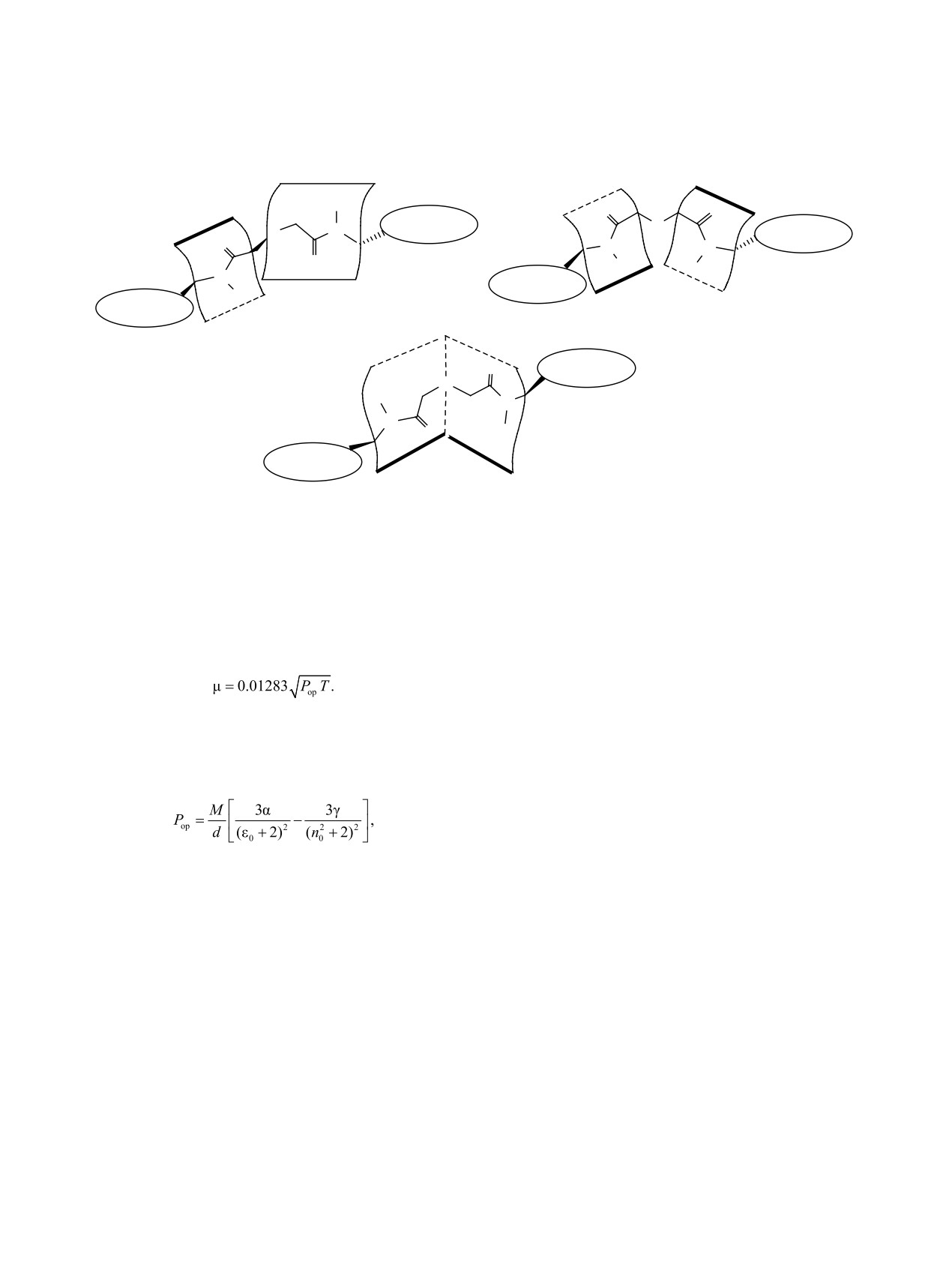
Таким образом, можно заключить, что в рас-
Экспериментальные дипольные моменты были
творе бис[N-метил-N-(2-дифенилфосфорилэтил)]-
определены по второму методу Дебая [29]. Физи-
амид дигликолевой кислоты существует в виде
ческие свойства диамидов дигликолевой кислоты
равновесия двух групп конформеров (схема 2):
1-3 определяли в бензоле при 25°С. Диэлектриче-
симметричных с гош-расположением обеих карбо-
ские проницаемости растворов соединений 1-3 из-
нильных групп относительно эфирного фрагмен-
меряли на приборе BI-870 (Brookhaven Instruments
та и практически перпендикулярным взаимным
Corporation), точность измерения ±0.01. Показате-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
1864
КУЗНЕЦОВА и др.
Схема 2.
R
O
O
CH2P(O)Ph2
O
O
N
CH2P(O)Ph2
O
N
N
O
R
R
N
Ph2P(O)CH2
R
Ph2P(O)CH2
несимметричные конформеры
симметричные конформеры
O
R = Me, Bu, Oct.
CH2P(O)Ph2
O
R
N
N
O
R
конформеры с ортогональными
амидными плоскостями
Ph2P(O)CH2
ли преломления растворов определяли на рефрак-
лен из μэксп C6H5CH3 [29]; m(C=>О) 1.94 Д [31];
тометре RA-500 (Kyoto Electronics), точность из-
m(N→Csp2) 0.94 Д, вычислен из μэксп CH3C(O)NH2
мерения ±0.0001. Экспериментальные дипольные
[29]; m(Csp3→N) 0.53 Д, вычислен из μэксп Me3N
моменты были рассчитаны по формуле Дебая (1)
[29]; m(Csp3→O) 0.97 Д, вычислен из μэксп Me2O
[29].
[29]; m(H→ Csp3) 0.28 Д [32].
ИК спектры образцов 1-3 получены с помощью
(1)
Фурье-спектрометра Bruker Vertex 70 (диапазон
600-4000 см-1), оснащенного оптической при-
Ориентационные поляризации определяли по
ставкой НПВО с элементом из германия (MIRacle,
формуле Гуггенгейма-Смита (2) [29].
PIKE Technologies). Спектры растворов образцов
в бензоле регистрировали в кюветах толщиной
0.2 мм из KBr. Концентрации образцов варьирова-
(2)
ли от 0.025 до 0.1 моль/л.
Квантово-химические расчеты проводили в
где М - молекулярная масса вещества, d - плот-
рамках теории функционала плотности (DFT)
ность растворителя, α и γ - тангенсы углов на-
с использованием гибридного функционала
-wi; εi, ni и
клона прямых на графиках εi-wi и ni2
B3PW91 [33, 34] и расширенного базисного на-
wi - диэлектрическая проницаемость, показатель
бора 6-311++G(df, p) [35] с помощью программы
преломления и весовая доля растворенного веще-
GAUSSIAN 09 [36] с полной оптимизацией гео-
ства i-раствора соответственно.
метрии. Соответствие найденных стационарных
При вычислении моментов по векторно-адди-
точек энергетическим минимумам доказывали ме-
тивной схеме были использованы геометрические
тодом расчета вторых производных по координа-
параметры из данных квантово-химических расче-
там атомов; при этом все равновесные структуры,
тов, а также следующие моменты связей и групп:
m(CPh→P) 1.09 Д, вычислен из μэксп (C6H5)3P [30],
соответствовавшие точкам минимума на поверх-
m(Csp3→Р) 0.83 Д [30]; m(Р=>О) 2.94 Д, вычислен
ностях потенциальной энергии, имели только по-
из μэксп C6H5P=O [30]; m(Csp3→Csp2) 0.75 Д, вычис-
ложительные значения частот.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
КОНФОРМАЦИОННЫЙ АНАЛИЗ
1865
ИНФОРМАЦИЯ ОБ АВТОРАХ
4.
Аляпышев М.Ю., Бабаин В.А., Устынюк Ю.А. //
Усп. хим. 2016. Т. 85. № 9. С. 943; Alyapyshev M.Y.,
Кузнецова Анастасия Андреевна, ORCID:
Babain V., Ustynyuk Y.A. // Russ. Chem. Rev. 2016.
Vol. 85. N 9. P. 943. doi 10.1070/rcr4589
Чачков Денис Владимирович, ORCID: https://
5.
Werner E.J., Biros S.M. // Org. Chem. Front. 2019.
orcid.org/0000-0002-0073-3672
Vol. 6. N 12. P. 2067. doi 10.1039/c9qo00242a
6.
Ansari S.A., Pathak P.N., Manchanda V.K., Husain M.,
Царькова Ксения Валерьевна, ORCID: https://
Prasad A.K., Parmar V.S. // Solv. Extr. Ion Exch. 2005.
orcid.org/0000-0001-8730-0521
Vol. 23. N 4. P. 463. doi 10.1081/SEI-200066296
7.
Liu Y., Liu Z., Zhao C., Zhou Y., Gao Y., He H. //
org/0000-0001-6333-5973
Prog. Chem. 2020. Vol. 32. N 2-3. P. 219. doi 10.7536/
Бондаренко Наталья Александровна, ORCID:
PC190824
8.
Ansari S.A., Mohapatra P.K. // J. Chromatogr. (A).
2017. Vol. 1499. P. 1. doi 10.1016/j.chroma.2017.03.035
Верещагина Яна Александровна, ORCID:
9.
Momen M.A., Healy M.R., Tsouris C., Jansone-Popova S.,
Depaoli D.W., Moyer B.A. // Ind. Eng. Chem. Res. 2019.
Vol. 58. N 43. P. 20081. doi 10.1021/acs.iecr.9b04528
БЛАГОДАРНОСТЬ
10.
Flores R., Momen M.A., Healy M.R., Jansone-Popova S.,
Теоретические расчеты выполнены в Межве-
Lyon K.L., Reinhart B., Cheshire M.C., Moyer B.A.,
домственном суперкомпьютерном центре Россий-
Bryantsev V.S. // Solv. Extr. Ion Exch. 2022. Vol. 40.
N 1-2. P. 6. doi 10.1080/07366299.2021.1956121
ском федеральном университете.
11.
Sasaki Y., Sugo Y., Suzuki S., Tachimori S. // Solv. Extr.
Ion Exch. 2001. Vol. 19. N 1. P. 91. doi 10.1081/SEI-
ФИНАНСОВАЯ ПОДДЕРЖКА
100001376
12.
Gelis A.V., Lumetta, G.J. // Ind. Eng. Chem. Res. 2014.
Работа выполнена при поддержке Российского
Vol. 53. N 4. P. 1624. doi 10.1021/ie403569e
фонда фундаментальных исследований (проект
13.
Carrott M., Bell K., Brown J., Geist A., Gregson C.,
№ 20-03-00119) и частично с использованием на-
Hères X., Maher C., Malmbeck R., Mason C., Modolo G.,
учного оборудования Центра коллективного поль-
Müllich U., Sarsfield M. // Solv. Extr. Ion Exch. 2014.
зования Национального исследовательского цен-
Vol. 32. N 5. P. 447. doi 10.1080/07366299.2014.896580
тра «Курчатовский институт»-ИРЕА.
14.
Розен A.M., Крупнов Б.B. // Усп. хим. 1996. Т. 65.
№ 11. С. 1052; Rozen A.M., Krupnov B.V. // Russ.
КОНФЛИКТ ИНТЕРЕСОВ
Chem. Rev. 1996. Vol. 65. N 11. P. 973. doi 10.1070/
RC1996v065n11ABEH000241
Авторы заявляют об отсутствии конфликта /ин-
15.
Бондаренко Н.А., Царькова К.В., Белусь С.К.,
тересов.
Артюшин О.И., Перегудов А.С. // ЖОХ. 2021. Т. 91.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Вып. 2. С. 221; Bondarenko N.A., Tcarkova K.V.,
Belus’ S.K., Artyushin O.I., Peregudov A.S. // Russ. J.
Дополнительные материалы для этой статьи
Gen. Chem. 2021. Vol. 91. N 2. P. 181. doi 10.1134/
доступны по doi 10.31857/S0044460X2212006X
S1070363221020055
для авторизованных пользователей.
16.
Yin S., Cui Y., Wu G., You Q., Sun G. // Acta Crystallogr.
(E). 2009. Vol. 65. N 7. o1654. doi 10.1107/
СПИСОК ЛИТЕРАТУРЫ
S1600536809022806
17.
Zhang Y.-L., Wang Y.-W., Li Y.-Z., Liu W.-S., Yu K.-B.,
1. Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev.
Wang L.-F. // Acta Crystallogr. (E). 2001. Vol. 57. N 6.
2017. Vol. 46. N 23. P. 7229. doi 10.1039/c7cs00574a
2. Whittaker D., Geist A., Modolo G., Taylor R., Sars-
P. o483. doi 10.1107/S1600536801006274
field M., Wilden A. // Solv. Extr. Ion Exch. 2018. Vol. 36.
18.
Wen Y.-H., Wen H.-L., Zhang S.-S., Li X.-M., Zhang K. //
N 3. P. 223. doi 10.1080/07366299.2018.1464269
Acta Crystallogr. (E). 2006. Vol. 62. N 2. P. o682. doi
3. Ansari S.A., Pathak P., Mohapatra P.K., Manchan-
10.1107/S160053680600198X
da V.K. // Chem. Rev. 2012. Vol. 112. N 3. P. 1751. doi
19.
Tian G., Teat S.J., Rao L. // Inorg. Chem. Commun.
10.1021/cr200002f
2014. Vol. 44. P. 32. doi 10.1016/j.inoche.2014.02.050
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
1866
КУЗНЕЦОВА и др.
20.
Kawasaki T., Okumura S., Sasaki Y., Ikeda Y. // Bull.
31.
Ишмаева Э.А., Зимин М.Г., Галеева Р.М.,
Chem. Soc. Japan. 2014. Vol. 87. N 2. P. 294. doi
Пудовик А.Н. // Изв. АН СССР. Сер. хим. 1971. Т. 20.
10.1246/bcsj.20130259
№ 3. С. 473; Ishmaeva E.A., Zimin M.G., Galeeva R.M.,
21.
Kou F., Yang S., Zhang L., Teat S.J., Tian G. // Inorg.
Pudovik A.N. // Russ. Chem. Bull. 1971. Vol. 20. N 3.
Chem. Commun. 2016. Vol. 71. P. 41. doi 10.1016/j.
P. 473. doi 10.1007/bf00852033
inoche.2016.06.035
32.
Грибов, Л.А. Попов Е.М. // Докл. АН СССР. 1962.
22.
Farger P., Haidon B., Roussel P., Arab-Chapelet B.,
Т. 145. № 4. С. 761.
Rivenet M. // Inorg. Chem. Vol. 58. N 2. P. 1267. doi
33.
Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7. P. 5648.
10.1021/acs.inorgchem.8b02744
doi 10.1063/1.464913
23.
Ansari S.A., Wadawale A.P., Verboom W., Mohapat-
34.
Perdew J.P., Burke K., Wang Y. // Phys. Rev.
ra P.K. // New J. Chem. 2022. Vol. 46. N 3. P. 950. doi
(B). 1996. Vol. 54. N 23. P. 16533. doi 10.1103/
10.1039/D1NJ05760J
PhysRevB.54.16533
24.
Mitrofanov A., Andreadi N., Matveev P., Zakirova G.,
35.
McLean A.D., Chandler G.S. // J. Chem. Phys. 1980.
Borisova N., Kalmykov S., Petrov V. // J. Mol. Liq. 2021.
Vol. 72. N 10. P. 5639. doi 10.1063/1.438980
Vol. 325. P. 115098. doi 10.1016/j.molliq.2020.115098
36.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
25.
Борисова Н.Е., Решетова М.Д. // Изв. АН. Сер. xим.
2015. № 8. С. 1882; Borisova N.E., Reshetova M.D.
Robb M.A., Cheeseman J.R., Montgomery, Jr. J.A.,
// Russ. Chem. Bull. 2015. Vol. 64. N 8. P. 1882. doi
Vreven T., Kudin K.N., Burant J.C., Millam J.M.,
10.1007/s11172-015-1088-y
Iyengar S.S., Tomasi J., Barone V., Mennucci B.,
26.
Ustynyuk Yu.A., Gloriozov I.P., Kalmykov S.N.,
Cossi M., Scalmani G., Rega N., Petersson G.A.,
Mitrofanov A.A., Babain V.A., Alyapyshev M.Yu.,
Nakatsuji H., Hada M., Ehara M., Toyota K., Fukuda R.,
Ustynyuk N.A. // Solv. Extr. Ion Exch. 2014. Vol. 32.
Hasegawa J., Ishida M., Nakajima T., Honda Y.,
N 5. P. 508. doi 10.1080/07366299.2014.915666
Kitao O., Nakai H., Klene M., Li X., Knox J.E.,
27.
Lavrov H.V., Ustynyuk N.A., Matveev P.I., Glorio-
Hratchian H.P., Cross J.B., Adamo C., Jaramillo J.,
zov I.P., Zhokhov S.S., Alyapyshev M.Yu., Tkachen-
Gomperts R., Stratmann R.E., Yazyev O., Austin A.J.,
ko L.I., Voronaev I.G., Babain V.A., Kalmykov S.N.,
Cammi R., Pomelli C., Ochterski J.W., Ayala P.Y.,
Ustynyuk Yu.A. // Dalton Trans. 2017. Vol. 46. N 33.
Morokuma K., Voth G.A., Salvador P., Dannen-
P. 10926. doi 10.1039/c7dt01009e
berg J.J., Zakrzewski V.G., Dapprich S., Daniels A.D.,
28.
Kuznetsova A.A., Chachkov D.V., Artyushin O.I.,
Strain M.C., Farkas O., Malick D.K., Rabuck A.D.,
Bondarenko N.A., Vereshchagina Y.A. // Molecules.
Raghavachari K., Foresman J.B., Ortiz J.V., Cui Q.,
2021. Vol. 26. N 16. P. 4832. doi 10.3390/
Baboul A.G., Clifford S., Cioslowski J., Stefanov B.B.,
molecules26164832
Liu G., Liashenko A., Piskorz P., Komaromi I.,
29.
Осипов О.А., Минкин В.И., Гарновский А.Д. Справоч-
Martin R.L., Fox D.J., Keith T., Al-Laham M.A.,
ник по дипольным моментам. М.: ВШ, 1971. 414 с.
30.
Ишмаева Э.А., Тимошева А.П., Тимошева Н.В.,
Peng C.Y., Nanayakkara A., Challacombe M.,
Верещагина Я.А. Справочник по дипольным мо-
Gill P.M.W., Johnson B., Chen W., Wong M.W.,
ментам фосфорорганических соединений. Казань:
Gonzalez C., Pople J.A. Gaussian 09, Pittsburgh PA:
Казанск. унив., 1998. 120 с.
Gaussian Inc. 2009.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
КОНФОРМАЦИОННЫЙ АНАЛИЗ
1867
Conformational Analysis of Diglycolic Acid
Bis[N-alkyl-N-(2-diphenylphosphorylethyl)]amides
A. A. Kuznetsovaa, D. V. Chachkovb, K. V. Tcarkovac,d, O. I. Artyushine,
N. A. Bondarenkoc,d, and Ya. A. Vereshchaginaa,*
a Kazan (Volga region) Federal University, Kazan, 420008 Russia
b Kazan Department of Joint Supercomputer Center of Russian Academy of Sciences - Branch of Federal State Institution
“Scientific Research Institute for System Analysis of the Russian Academy of Sciences”, Kazan, 420111 Russia
c Institute of Chemical Reagents and High Purity Chemical Substances of National Research Centre “Kurchatov Institute”,
Moscow, 107076 Russia
d National Research Centre “Kurchatov Institute”, Moscow, 123182 Russia
e A.N. Nesmeyanov Institute of Organoelement Compounds of the Russian Academy of Sciences, Moscow, 119991 Russia
*e-mail: yavereshchagina@gmail.com
Received October 5, 2022; revised October 26, 2022; accepted October 30, 2022
The conformational analysis of bis[N-alkyl-N-(2-diphenylphosphorylethyl)]amides of diglycolic acid was carried
out by the methods of dipole moments, IR spectroscopy and quantum chemistry DFT B3PW91/6-311++G(df,p).
In solution, N,N-dimethyl-, N,N-dibutyl- and N,N-dioctylsubstituted diamides of diglycolic acid exist as an equi-
librium of two groups of symmetrical or unsymmetrical conformers, in some of them intramolecular contacts
with the participation of the hydrogen atoms of alkyl substituents and the oxygen atoms of the ether bridge or
carbonyl groups are possible.
Keywords: bis[N-alkyl-N-(2-diphenylphosphorylethyl)]amides of diglycolic acid, conformational analysis,
dipole moments, IR spectroscopy, quantum chemical calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022