Почвоведение, 2022, № 8, стр. 975-980
Анализ молекулярных механизмов трансформации компостных органических отходов с помощью комбинации электрофореза, эксклюзионной хроматографии и абсорбционной спектроскопии
О. А. Трубецкой a, О. Е. Трубецкая b, *
a Институт фундаментальных проблем биологии РАН
142290 Пущино, Московской обл., ул. Институтская, 2, Россия
b Филиал Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
142290 Пущино, Московской обл., ул. Институтская, 2, Россия
* E-mail: trub@bibch.ru
Поступила в редакцию 08.12.2021
После доработки 12.01.2022
Принята к публикации 24.02.2022
- EDN: XEVSBX
- DOI: 10.31857/S0032180X22080147
Аннотация
Гуминоподобные вещества из компоста в начале и через 130 дней компостирования исследовали с помощью комплекса аналитических методов, включающих аналитический электрофорез в 10%-ном полиакриламидном геле в присутствии денатурирующих агентов, абсорбционную спектроскопию и эксклюзионную хроматографию на сефадексе G-75. Показано, что трансформация органических остатков в процессе компостирования сопровождается уменьшением весовой доли фракций наибольшего молекулярного размера и формированием значительного количества фракций наименьшего молекулярного размера с одновременным увеличением доли ароматических компонентов в препарате компостных гуминоподобных веществ. Использованный комплекс аналитических методов можно применять для оценки эффективности различных процессов компостирования органических бытовых и промышленных отходов. Одновременно такой подход может быть полезным при решении задач восстановления почвенного плодородия.
ВВЕДЕНИЕ
На современном этапе развития цивилизации во всех странах (особенно с развитой экономикой) интенсивное возделывание почв приводит к заметной потере плодородия. В то же время в процессе человеческой деятельности существенно увеличивается количество отходов различного происхождения, в том числе органических [20, 24]. Утилизация отходов – одна из наиболее острых экологических проблем, с которыми столкнулось человечество в XXI в. Промышленные и бытовые органические отходы несут серьезную опасность для экосистем и здоровья человека, поэтому требуются эффективные методы их переработки. Наиболее перспективным решением настоящих проблем является природоподобная (зеленая) технология переработки методами бытового или промышленного компостирования органических отходов в продукт с повышенным содержанием минеральных компонентов: калия, фосфора и азота. В процессе компостирования наряду с активной минерализацией происходит гумификация некоторой части органических отходов, приводящая к образованию компостных гуминоподобных веществ (КГВ) [24]. Внесение продукта компостирования в почву позволяет частично восстановить в ней содержание минеральных компонентов и органического вещества. Несмотря на широкое использование компостов в сельском хозяйстве, вопрос о молекулярных механизмах формирования КГВ остается открытым. Объяснение этих механизмов создаст теоретическую основу для разработки оптимальных экологически чистых технологий компостирования и, безусловно, может внести вклад в решение задач восстановления почвенного плодородия и охраны окружающей среды.
Формирование КГВ происходит в течение значительно более короткого периода времени по сравнению с почвенными гуминовыми веществами [1, 3, 5, 7, 24, 26]. Для оценки качества КГВ предложено множество методов, таких как элементный и функциональный групповой анализ, исследование спектров поглощения и флуоресценции, эксклюзионная хроматография, а также 1H- и 13С-ЯМР [3, 7, 9, 14, 16, 22, 25, 29, 30]. Для сравнения КГВ различных сроков созревания также применяются электрофоретические методы: изоэлектрофокусирование [6, 12] и электрофорез в полиакриламидном геле (ЭПАГ), основанный на разделении смеси ГВ по таким важнейшим параметрам, как электрический заряд, молекулярный размер и пространственная конфигурация [19, 28]. Быстрые, эффективные и сравнительно дешевые аналитические электрофоретические методы разделяют КГВ различного происхождения на несколько четких естественно окрашенных зон, позволяя использовать электрофореграммы в качестве фингерпринтов [6, 8, 12, 15, 17–19, 23]. Однако такой фингерпринт способен демонстрировать лишь наличие/отсутствие качественных изменений органического вещества в процессе компостирования, но не позволяет получить количественную информацию о молекулярных механизмах трансформации КГВ. Необходим комплексный подход, отражающий не только качественные, но и количественные различия КГВ в процессе их созревания. Ранее нами был разработан эффективный метод фракционирования почвенных гуминовых кислот, основанный на сочетании препаративной эксклюзионной хроматографии (ЭХ) на колонке с сефадексом G-75 с аналитическим ЭПАГ [28]. Фракционирование почвенных гуминовых кислот осуществляли с помощью ЭХ, затем хроматографический профиль тестировали ЭПАГ, на основе которого вели отбор индивидуальных стабильных электрофоретических фракций. Сочетание ЭХ–ЭПАГ впервые позволило получить из почвенных гуминовых кислот различного генезиса препаративные количества фракций, существенно различающихся по молекулярному размеру, электрофоретической подвижности, оптическим свойствам и другим физико-химическим характеристикам [4].
Цель работы – применение комплексного подхода, включающего сочетание ЭХ–ЭПАГ, для исследования молекулярных механизмов формирования КГВ в процессе созревания с параллельным анализом спектров поглощения.
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследования были препараты КГВ, выделенные из компостной смеси в начале (КГВ-0) и после 130 дней созревания (КГВ-130). Компостирование смеси муниципальных органических остатков (50% канализационных отходов + 25% виноградных косточек и 25% растительных отходов после обрезки насаждений в парках и скверах округа Эмилия-Романия, Италия) проводили при температуре +60°С с постоянным перемешиванием на промышленной фирме “Кавиро”, специализирующейся на переработке органических отходов различного происхождения в сельскохозяйственные удобрения. Сухие препараты КГВ-0 и КГВ-130, выделенные однократной экстракцией 0.5 М раствором NaOH с последующим осаждением соляной кислотой, были любезно предоставлены сельскохозяйственным факультетом университета г. Болоньи.
Элементный состав образцов КГВ-0 и КГВ-130 в пересчете на сухое беззольное вещество представлен в табл. 1. Элементный состав определяли на приборе Carlo Erba Model EA 1108 Elemental Analyzer (Italy) в трех повторностях. Спектры поглощения в УФ и видимой областях света получали на спектрофотометре Cary 3 (Varian) в кварцевой кювете длиною 1 см. Препараты компостных ГВ растворяли в 0.1 М NaOH до концентрации 100 мг/л для расчета коэффициента цветности Е4/Е6, представляющего соотношение поглощений при 465 и 665 нм. Для получения спектра поглощения в УФ и видимой областях света растворы разбавляли до концентрации 20 мг/л. Коэффициенты удельной экстинкции ($E_{{270}}^{{0.002\% }}$ и $E_{{465}}^{{0.002\% }}$) на длинах волн 270 и 465 нм для КГВ-0 и КГВ-130, а также коэффициенты цветности Е4/Е6 приведены в табл. 1.
Таблица 1.
Элементный состав (мас. %) в пересчете на сухое беззольное вещество, коэффициенты удельной экстинкции на длинах волн 270 ($E_{{270}}^{{0.002\% }}$) и 465 нм ($E_{{465}}^{{0.002\% }}$) и цветности (E4/E6) компостных ГВ в начале (КГВ-0) и через 130 дней созревания (КГВ-130). Показаны средние значения после трех измерений ± стандартные отклонения
| Препарат | Элементный состав, % | Оптические свойства | ||||
|---|---|---|---|---|---|---|
| С | Н | N | $E_{{270}}^{{0.002\% }}$ | $E_{{465}}^{{0.002\% }}$ | E4/E6 | |
| КГВ-0 | 44.5 ± 0.8 | 5.8 ± 0.2 | 5.9 ± 0.1 | 0.27 ± 0.01 | 0.031 ± 0.002 | 5.7 |
| КГВ-130 | 44.2 ± 0.7 | 5.5 ± 0.1 | 5.1 ± 0.1 | 0.39 ± 0.01 | 0.046 ± 0.003 | 8.3 |
Cочетание препаративной ЭХ низкого давления на колонке с сефадексом G-75 в 7 М мочевине с аналитическим ЭПАГ в 10%-ном полиакриламидном геле использовали для получения стабильных электрофоретических фракций из препаратов КГВ-0 и КГВ-130 согласно ранее разработанной методике [28]. По 10 мг компостных гуминовых веществ растворяли в 1 мл 7 М мочевины и наносили на стеклянную колонку (1.5 × 100 см) с сефадексом G-75 (Pharmacia, Швеция), уравновешенным тем же раствором. Свободный и общий объем колонки составлял 42 и 158 мл соответственно. Элюент с колонки собирали в виде аликвот по 2 мл, каждую третью аликвоту анализировали с помощью ЭПАГ. Аликвоты, формирующие индивидуальные электрофоретические зоны в матрице полиакриламидного геля с аналогичной электрофоретической подвижностью, объединяли, диализовали против дистиллированной воды в течение 7 дней в диализных мешках с номинальным размером пор 10 кДа, лиофилизировали и взвешивали на аналитических весах. Из каждого образца получили по три индивидуальных стабильных электрофоретических фракций, названных А (объем элюции 42–54 мл), В (55–80 мл) и C + D (105–150 мл), а также смесь фракций В и C + D (81–104 мл). На основании времени выхода фракций из колонки и калибровки колонки с помощью стандартных глобулярных белков определяли номинальный молекулярный размер (МР) фракций: МР фракции А < 100 кДа, фракции В находится в пределах 100–30 кДа, фракции C + D – 30–10 кДа, то есть МРА > МРВ > МРC + D. Для каждого образца КГВ провели по три независимых фракционирования, в трех повторностях разброс выхода одноименных фракций не превышал 10%. Средние значения весового содержания фракций для исследованных образцов КГВ представлены в табл. 2.
Таблица 2.
Весовое соотношение (%) полученных сочетанием ЭХ-ЭПАГ фракций А, В и C + D различного МР в компостных ГВ в начале (КГВ-0) и через 130 дней созревания (КГВ-130), %
| Препарат | Фракция А наибольшего МР | Фракция В среднего МР | Смесь фракций В и C + D | Фракция C + D наименьшего МР |
|---|---|---|---|---|
| КГВ-0 | 51 ± 4.9 | 19 ± 1.8 | 25 ± 2.2 | 3 ± 0.2 |
| КГВ-130 | 27 ± 2.5 | 17 ± 1.6 | 43 ± 3.6 | 14 ± 1.1 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлены электрофореграммы образцов КГВ-0 и КГВ-130, выделенных из компоста в начале и после 130 дней его созревания. Компостные гуминовые вещества различного срока созревания образуют в полиакриламидном геле три узкие естественно окрашенные коричневые зоны, сходные по электрофоретической подвижности и обозначенные А (стартовая зона, не входящая в поры 10% полиакриламидного геля), В (узкая зона в середине геля) и С + D (зона в нижней части геля, состоящая из нескольких полос с близкими электрофоретическими подвижностями). Следует отметить, что после 130 дней созревания интенсивность естественной окраски электрофоретических зон В и С + D в образце КГВ-130 стала более яркой по сравнению с образцом КГВ-0, выделенным в начале процесса компостирования, а интенсивность окраски стартовой зоны А снизилась. Таким образом, аналитический электрофорез в 10%-ном полиакриламидном геле позволяет зафиксировать трансформацию КГВ уже через 130 дней созревания компоста. Следует отметить, что элементный состав КГВ меняется незначительно после 130 дней созревания и соответственно не может служить надежным критерием изменений КГВ в процессе компостирования.
Рис. 1.
Электрофорез в 10% полиакриламидном геле 0.2 мг компостных ГВ в начале (КГВ-0) и через 130 дней созревания (КГВ-130).

Спектры поглощения исследованных компостных препаратов гуминовых веществ монотонно убывают по мере увеличения длины волны и не имеют четких максимумов поглощения, однако содержат небольшое спектральное плечо в области 260–280 нм (рис. 2). После 130 дней компостирования оптическая плотность КГВ увеличилась приблизительно в 1.5 раза как в УФ, так и в видимой областях. В табл. 1 представлены коэффициенты удельной экстинкции в УФ и видимой областях света ($E_{{270}}^{{0.002\% }}$ и $E_{{465}}^{{0.002\% }}$ соответственно) и цветности (E4/E6) компостных препаратов КГВ-0 и КГВ-130. Увеличение коэффициента удельной экстинкции $E_{{465}}^{{0.002\% }}$ препарата КГВ-130 в видимой области спектра по сравнению с КГВ-0 соответствует увеличению интенсивности естественной окраски электрофоретических зон В и С + D.
Рис. 2.
Спектры поглощения в УФ и видимой областях света компостных ГВ в начале (КГВ-0) и через 130 дней созревания (КГВ-130).
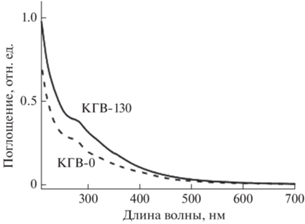
Сравнивая данные 13С-ЯМР и коэффициент удельной экстинкции на длинах волн 260–280 нм, некоторыми авторами показано, что увеличение этого коэффициента коррелирует с увеличением содержания ароматических компонентов в составе гуминовых веществ различного генезиса [4, 21, 27], так как в этом районе находятся максимумы поглощения основных ароматических компонентов (лигнинов, фенолов и др.). Основываясь на увеличении в 1.5 раза коэффициента $E_{{270}}^{{0.002\% }}$ препарата КГВ-130 по сравнению с КГВ-0 можно предположить, что уже в первые 130 дней трансформация компостных гуминовых веществ происходит в направлении увеличения содержания ароматических компонентов.
Другой вывод о направлении трансформации КГВ следует из увеличения значений коэффициента цветности E4/E6 с 5.7 до 8.3 в процессе созревания компоста. Соотношение E4/E6 связано не только с изменением цвета [2], но и с изменением среднего МР препаратов гуминовых веществ различного происхождения. Рядом авторов показана обратная зависимость между значениями E4/E6 и средним МР [10, 11, 13, 30]. Таким образом, обнаруженное увеличение значения E4/E6 после 130 дней созревания компоста с большой долей вероятности отражает уменьшение среднего МР препарата КГВ в процессе компостирования. Для экспериментального доказательства данного предположения нами впервые был применен метод ЭХ-ЭПАГ с анализом весового соотношения электрофоретических фракций различного МР в препаратах КГВ-0 и КГВ-130. Из образцов КГВ-0 и КГВ-130 получены препаративные количества стабильных электрофоретических фракций А, В и C + D. Согласно времени выхода фракций с хроматографической колонки, их МР уменьшаются в последовательности МРА > МРВ > МРC + D. В табл. 2 представлены данные о весовом содержании каждой фракции в препаратах КГВ-0 и КГВ-130. Оказалось, что в процессе созревания компоста наряду с почти двукратным уменьшением весового содержания фракции А наибольшего МР происходит почти пятикратное увеличение весовой доли фракции C + D наименьшего МР и в 1.5 раза увеличивается весовая доля смеси фракций В и C + D, подтверждая достоверное снижение среднего МР компостного ГВ после 130 дней созревания. Таким образом, с помощью нескольких независимых аналитических методов удалось экспериментально показать, что процесс трансформации органического вещества в компостные ГВ в первые 130 дней происходит в направлении уменьшения среднего МР и увеличения содержания ароматических компонентов.
ЗАКЛЮЧЕНИЕ
Совокупность данных, полученных с применением комплекса аналитических методов, включающих ЭПАГ в присутствии денатурирующих агентов, сочетание препаративной ЭХ и ЭПАГ и исследование спектров поглощения в УФ и видимой областях, впервые позволила экспериментально выявить некоторые молекулярные механизмы трансформации органических остатков в гуминоподобные вещества в процессе компостирования. Показано, что трансформация органических остатков сопровождается уменьшением весовой доли фракций наибольшего МР и формированием значительного количества фракций наименьшего МР с одновременным увеличением доли ароматических компонентов в препарате КГВ. Использованный в настоящей работе комплекс аналитических методов можно с успехом применять для оценки эффективности различных процессов компостирования. С другой стороны, такой подход может быть полезным при решении задач восстановления почвенного плодородия и охраны окружающей среды.
Список литературы
Гамзиков Г.П., Сулейменов С.З. Азотоминерализующая способность серой лесной почвы Новосибирского Приобья при компостировании и паровании растительных остатков // Почвоведение. 2021. № 5. С. 582–591. https://doi.org/10.31857/S0032180X21050087
Кононова М.М. Органическое вещество почв. М.: Изд-во АН СССР, 1963. 314 с.
Пукальчик М.А., Терехова В.А., Якименко О.С., Кыдралиева К.А., Акулова М.И. Метод триад для оценки ремедиационного действия гуминовых препаратов на урбаноземы // Почвоведение. 2015. № 6. С. 751–760. https://doi.org/10.7868/S0032180X15060088
Трубецкой О.А., Трубецкая О.Е. Обратно-фазовая высокоэффективная жидкостная хроматография стабильных электрофоретических фракций почвенных гуминовых кислот // Почвоведение. 2015. № 2. С. 166–174. https://doi.org/10.7868/S0032180X15020124
Христева Л.А. Об участии гуминовых кислот и других органических веществ в питании высших растений // Почвоведение. 1953. № 10. С. 46–59.
Цыпленков Б.П. Использование изоэлектрофокусирования при сравнительной характеристике гумусовых соединений почв // Вестник ЛГУ. 1983. № 15. С. 106–108.
Canellas L.P., Piccolo A., Dobbss L.B., Spaccini R., Olivares F.L., Zandonadi D.B., Façanha A.R. Chemical composition and bioactivity properties of size-fractions separated from a vermicompost humic acid // Chemosphere. 2010. V. 78. P. 457–466.
Cavani L., Ciavatta C., Trubetskaya O.E., Reznikova O.I., Afanas’eva G.V., Trubetskoj O.A. Capillary zone electrophoresis of soil humic acid fractions obtained by coupling SEC-PAGE // J. Chromatography A. 2003. V. 983. P. 263–270.
Chen H., Dou J., Xu H. Remediation of Cr (VI)-contaminated soil with co-composting of three different biomass solid wastes // J. Soils Sediments 2017.https://doi.org/10.1007/s11368-017-1811-4
Chin Y., Aiken G., O’Loughlin E. Molecular weight, polydispersity, and spectroscopic properties of aquatic humic substances // Environ. Sci. Technol. 1994. V. 28. P. 1853−1858.
Christl I., Knicker H., Kogel-Knabner I., Kretzschmar R. Chemical heterogeneity of humic substances: characterisation of size fractions obtained by hollow-fibre ultrafiltration // Eur. J. Soil Sci. 2000. V. 51. P. 617–625.
De Nobili M., Ciavatta C., Sequi P. Evaluation of organic matter stabilisation during composting by means of humification parameters and electrofocusing // Compost: Production and Use. Proceeding of the International Symposium. San Michele all’Adige. Italy, 1989. P. 328–342.
Duarte M.B.O., Santos E.B.H., Duarte A.C. Spectroscopic characteristics of ultrafiltration fractions of fulvic and humic acids isolated from an eucalyptus bleached Kraft pulp mill effluent // Water Res. 2003. V. 37. P. 4073–4080.
Fedoseeva E., Stepanov A., Yakimenko O., Patsaeva S., Freidkin M., Khundzhua D., Terekhova V. Biodegradation of humic substances by microscopic filamentous fungi: chromatographic and spectroscopic proxies // J. Soils Sediments. 2019. V. 19. P. 2676–2687. https://doi.org/10.1007/s11368-018-2209-7
Filip Z., Trubetskoj O., Alberts J. Electrophoretic comparison of humic substances derived from natural and anthropogenic environments // The Role of Humic Substances in the Ecosystems and in Environmental Protection. 1997. Wroclaw, Poland. P. 115–120.
Francioso O., Sanchez-Cortes S., Tugnoli V., Ciavatta C., Gessa C. Characterization of peat fulvic acid fractions by means of FT-IR, SERS and 1H- 13C-NMR spectroscopy // Appl. Spectros. 1998. V. 52. P. 270–277.
Jiménez M.S., Gomez M.T., Rodriguez L., Velarte R., Castillo J.R. Characterization of metal–humic acid complexes by polyacrylamide gel electrophoresis–laser ablation-inductively coupled plasma mass spectrometry // Anal. Chim. Acta 2010. V. 676. P. 9–14. https://doi.org/10.1016/j.aca.2010.07.022
Karim S., Okuyama Y., Aoyama M. Separation and characterization of the constituents of compost and soil humic acids by two-dimensional electrophoresis // Soil Sci. Plant Nutr. 2013. V. 59. P. 130–141. https://doi.org/0.1080/00380768.2012.750230
Kazuki M., Matsumoto A., Nakano S., Shibukawa M., Saito T., Haraga T., Saito S. Advanced gel electrophoresis techniques reveal heterogeneity of humic acids based on molecular weight distributions of kinetically inert Cu2+-humate complexes // Environ. Sci. Technol. 2019. V. 53. P. 14507–14515.https://doi.org/10.1021/acs.est.9b05169
Marmo L. Towards a European strategy for biodegradable waste management // Ricicla (L. Morselli, a cura di). Maggioli Editore, Rimini, 2000. P. 21–30.
Peuravuori J., Pihlaja K. Molecular size distribution and spectroscopic properties of aquatic humic substances // Anal. Chim. Acta. 1997. V. 337. P. 33–149.
Richard C., Guyot G., Trubetskaya O., Trubetskoj O., Grigatti M., Cavani L. Fluorescence of humic-like acids extracted from composts: influence of maturity and fractionation // Environ. Chem. Lett. 2009. V. 7. P. 61–65.
Saiz-Jimenez C., Trubetskoj O.A., Trubetskaya O.E., Hermosin B. Polyacrylamide gel electrophoresis of soil humic acids, lignins, model phenolic polymers, and fungal melanins // Commun. Soil Sci. Plant Anal. 1999. V. 30. P. 345–352.
Sardarmehni M., Levis J.W., Barlaz M.A. What is the best end use for compose derived from the organic fraction of municipal solid waste? // Environ. Sci. Technol. 2021. V. 55. P. 73–81. https://doi.org/10.1021/acs.est.0c04997
Senesi N., Brunetti G. Chemical and physico-chemical parameters for quality evaluation of humic substances produced during composting // The Science of Composting. London, 1996. P. 195–212.
Scaglia B., Nunes R.R., Tambone F., Rezende M.O.O., Adani F. Investigating organic molecules responsible of auxin-like activity of humic acid fraction extracted from vermicompost // Sci. Total Environ. 2016. V. 562. P. 289–295.
Traina S.J., Novak J., Smeck N.E. An ultraviolet absorbance method of estimating the percent aromatic carbon content of humic acids // J. Environ. Qual. 1990. V. 19(1). P. 151−153.
Trubetskoj O.A., Trubetskaya O.E., Afanas’eva G.V., Reznikova O.I., Saiz-Jimenez C. Polyacrylamide gel electrophoresis of soil humic acid fractionated by size exclusion chromatography and ultrafiltration // J. Chromatography A. 1997. V. 767. P. 285–292.
Vig A.P., Singh J., Wani S.H., Dhaliwal S.S. Vermicomposting of tannery sludge mixed with cattle dung into valuable manure using earthworm Eisenia fetida (Savigny) // Bioresour. Technol. 2011. V. 102. P. 7941–7945.
Yakimenko O., Khundzhua D., Izosimov A., Yuzhakov V., Patsaeva S. Source indicator of commercial humic products: UV-Vis and fluorescence proxies // J. Soils Sediments. 2018. V. 18. P. 1279–1291.https://doi.org/10.1007/s11368-016-1528-9
Дополнительные материалы отсутствуют.


