Коллоидный журнал, 2023, T. 85, № 6, стр. 768-780
Изучение криоструктурирования полимерных систем. 66. Свойства и микроструктура криогелей поливинилового спирта, сформированных в замороженном диметилсульфоксиде с добавками мочевины и далее гидратированных замещением органической среды на воду
Д. А. Мичуров 1, О. Ю. Колосова 1, В. И. Лозинский 1, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119334 Москва,
ул. Вавилова, 28, стр. 1, Россия
* E-mail: loz@ineos.ac.ru
Поступила в редакцию 20.07.2023
После доработки 15.08.2023
Принята к публикации 15.08.2023
- EDN: YHQJFV
- DOI: 10.31857/S0023291223600669
Аннотация
Криогенной обработкой (замораживание при –21.6°C в течение 12 ч, а затем оттаивание нагреванием до 20°C со скоростью 0.03°C/мин) раствора поливинилового спирта (ПВС; 100 г/л) в диметилсульфоксиде (ДМСО) без и с добавками проявляющей в такой среде космотропные свойства мочевины в концентрации 2 или 4 моль/л, получены “первичные” криогели ПВС. Их последующая гидратация замещением ДМСО на воду вызывала уменьшение объема и массы образцов, а также приводила к существенному росту модуля упругости получаемых “вторичных” криогелей. Абсолютная величина таких эффектов зависела как от концентрации мочевины в исходном растворе ПВС, так и от соотношения объемов гелевых образцов и водного экстрагента при их гидратации. С помощью оптической микроскопии установлено, что присутствие мочевины в исходном ДМСО-растворе полимера в концентрации, близкой к пределу ее растворимости в такой среде, индуцирует формирование крупнопористой морфологии образующейся гелевой матрицы. Поскольку высокомодульные “вторичные” криогели ПВС представляют большой интерес в качестве материалов биомедицинского назначения, в работе была оценена возможность их функционирования в качестве носителей систем доставки лекарственных веществ. Как модельное лекарственное соединение использовалась натриевая соль ибупрофена. С помощью анализа в рамках функции Вейбулла кинетики высвобождения этого вещества показано, что динамическое водородное связывание его карбоксилатных групп с гидроксильными группами ПВС приводит к замедлению высвобождения лекарства из полимерного носителя, т.е. способствует пролонгированию процесса высвобождения. При этом скорость процесса зависит от содержания мочевины в исходном растворе полимера, что, скорее всего, связано с неодинаковой микроструктурой полимерной фазы стенок макропор криогелевой матрицы.
ВВЕДЕНИЕ
Криогели поливинилового спирта (КГПВС) – макропористые гелевые материалы кристаллизационного типа, формируемые последовательным замораживанием растворов этого полимера, их инкубацией в замороженном состоянии и далее размораживанием [1–7]. Физико-химические свойства криогелей ПВС и их макропористая структура зависят от характеристик самого ПВС (молекулярная масса полимера, тактичность цепей, количество неомыленных О-ацильных группировок) и его концентрации в исходном растворе, используемого растворителя, наличия низкомолекулярных или высокомолекулярных добавок, а также от режимов криогенной обработки [3, 4, 8–15]. Благодаря таким особенностям криогелей ПВС, как хорошие механические, диффузионные и теплофизические свойства, нетоксичность и биосовместимость, эти гелевые объекты представляют значительный прикладной интерес в различных областях, особенно как материалы биотехнологического [3, 16–23] и медицинского [2, 3, 24–44] назначения.
Достаточно подробно изучены криогели ПВС, сформированные криогенной обработкой водных растворов полимера [1–7], но также известны КГПВС, полученные в результате криотропного гелеобразования ПВС в среде замороженного диметилсульфоксида (ДМСО) [8, 45–50]. Обычно криогели ПВС, образовавшиеся в такой органической среде, менее жесткие и теплостойкие, чем КГПВС, приготовленные на основе водных растворов той же концентрации по полимеру [46, 47]. Указанные различия обусловлены тем, что ДМСО является более термодинамически выгодным растворителем для ПВС, чем вода, т.е. сродство ДМСО к данному полимеру выше по сравнению со сродством воды к ПВС [51], а это снижает эффективность гелеобразования полимера в среде ДМСО из-за конкуренции взаимодействий полимер–растворитель и полимер–полимер. Взаимодействия последнего типа при криотропном гелеобразовании ПВС за счет водородного связывания гидроксильных группировок соседних цепей индуцируют формирование зон микрокристалличности, выполняющих функцию физических узлов надмолекулярной сетки в КГПВС [52–54]. Таким образом, используемый растворитель или же дополнительно вводимые в исходную систему растворимые добавки, отрицательно (хаотропные вещества) или положительно (космотропные вещества) влияющие на эффективность образования межмолекулярных водородных связей цепей ПВС, будут определять комплекс физико-химических свойств получаемых криогелей [3]. Например, в работе [55] было найдено, что для КГПВС, сформированных из водных растворов полимера с добавками мочевины или гуанидин гидрохлорида, которые в воде проявляют сильную хаотропную активность, характерна пониженная жесткость и теплостойкость. Однако, неожиданно выяснилось, что в случае криотропного гелеобразования ПВС в среде ДМСО данные добавки вызывали эффекты, противоположные наблюдаемым в воде – значения модулей упругости и температуры плавления криогелей ПВС наоборот повышались с ростом концентрации добавок [49]. Иными словами, образование криогелей ПВС промотировалось, а не ингибировалось. Проведенные исследования показали, что такие эффекты наиболее выражены для криогелей ПВС, образующихся в среде ДМСО в присутствии мочевины. Данный результат достигается за счет вызываемого мочевиной снижения сольватирующей способности ДМСО по отношению к ПВС, поскольку мочевина образует водородные связи с ДМСО, в результате чего имеет место конкуренция за растворитель.
Для применения в медико-биологических областях криогелей ПВС, полученных в среде ДМСО, необходимо произвести замену органического растворителя на воду. В свою очередь, это приводит к вымыванию из массы КГПВС и ДМСО, и добавок, вследствие чего жесткость и теплостойкость образцов резко возрастают за счет образования новых водородных связей в гелевой сетке [49]. Более того, после смены растворителя наблюдалось уменьшение объема криогелей, а, значит, повышение концентрации полимера в единице объема соответствующих образцов КГПВС. Однако, характер изменения при этом их физико-химических свойств ранее изучен не был.
В этой связи целью данной работы являлось исследование особенностей изменения характеристик первоначально сформированных в ДМСО криогелей ПВС в ходе проведения замены в них органической жидкой среды на воду. Также в задачи работы входило изучение динамики высвобождения лекарственного вещества, в данном случае натриевой соли ибупрофена (Na-ИБПФ), из образцов КГПВС, предварительно насыщенных водным раствором Na-ИБПФ. Эти исследования мы рассматривали как моделирование функциональных возможностей основанных на криогелях ПВС так называемых “депо-форм” систем доставки лекарств, применяемых, например, в виде временных мягких имплантатов [44].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе без дополнительной очистки использовали следующие вещества: поливиниловый спирт с молекулярной массой 86 кДа и степенью дезацетилирования 99–100% (AcrosOrganics, США), диметилсульфоксид (хч) (Компонент Реактив, РФ), мочевина, натриевая соль ибупрофена и краситель Конго красный (все Sigma-Aldrich, США), желатин марки “фото”, фенол (ч. д. а.) и глицерин (ч. д. а.) (все ООО “Реахим”, РФ). Для работы с водными системами использовали деионизированную воду.
При получении растворов полимера его сухой порошок диспергировали в расчетном объеме ДМСО для достижения концентрации ПВС, равной 100 г/л. Смесь выдерживали 18 ч при комнатной температуре для набухания полимера, а затем нагревали 1 ч на кипящей водяной бане при перемешивании до полного растворения ПВС. При приготовлении растворов, содержащих добавки мочевины, необходимое ее количество растворяли в растворе полимера при комнатной температуре. Полученные растворы обрабатывали ультразвуком в течение 20 мин при комнатной температуре в ультразвуковой ванне UNITRA (Unitra, Польша) для удаления пузырьков воздуха.
Для формирования криогелей растворы ПВС без и с добавками мочевины дозировали в разборные цилиндрические дуралюминовые контейнеры (внутренний диаметр 15 мм, высота 10 мм), которые помещали в камеру прецизионного программируемого криостата FP 45 HP (Julabo, Германия), где образцы замораживали и инкубировади при ‒21.6°C в течение 12 ч, а затем оттаивали, нагревая до 20°C со скоростью 0.03°C/мин, регулируемой микропроцессором криостата. Полученные по этой схеме образцы КГПВС далее мы будем называть “первичными” криогелями.
Значения модуля Юнга (Е) образцов КГПВС измеряли с помощью автоматического анализатора текстуры TA-Plus (Lloyd Instruments, Великобритания) в режиме одноосного сжатия по линейному участку зависимости напряжения от деформации при скорости приложения нагрузки 0.2 мм/мин до степени деформации 30%. Значения E измеряли для трех параллельных образцов; образцы готовили в 3–5 независимых экспериментах, а полученные результаты усредняли в программе Excel 2010.
Измерения проводили как для “первичных” криогелей, сформированных в среде ДМСО, так и для образцов, в которых органическая жидкая фаза была заменена чистой водой. В последнем случае образцы криогелей инкубировали при комнатной температуре в стеклянных стаканах, каждый из которых содержал или 30, или 90 мл деионизированной воды. Воду заменяли свежей порцией каждый день, предварительно измеряя характеристики образцов. Такие КГПВС, т.е. гидратированные гелевые препараты, далее мы будем называть “вторичными” криогелями.
Массу образцов КГПВС определяли с помощью аналитических весов Adventurer AX224 (Ohaus Corporation, США). Геометрические размеры (диаметр и высоту) образцов криогелей измеряли с помощью штангенциркуля, после чего рассчитывали их объем по формуле для цилиндра.
Микроструктуру КГПВС изучали после замены в них ДМСО на воду, поскольку в наших предыдущих исследованиях было найдено [49, 50], что препараты “первичных” криогелей ПВС для микроскопии не удавалось контрастировать для выявления их микроструктуры. Тонкие (10 мкм) срезы “вторичных” криогелей готовили согласно ранее описанной методике [11, 12] с помощью криомикротома SM-1900 (Leica, Германия) в направлении, перпендикулярном оси цилиндра, а затем контрастировали обработкой раствором Конго красного и герметизировали в фиксирующую среду (раствор 1 г желатины марки “Фото” в 12 мл 50%-ного водного глицерина с добавкой 0.2 г фенола в качестве бактериостатика). Исследование окрашенных таким образом срезов проводили с использованием оптического микроскопа Eclipse 55i (Nikon, Токио, Япония), оснащенного электронной системой записи изображения.
Для насыщения гидратированных, т.е. “вторичных” КГПВС, модельным лекарственным веществом каждый цилиндрический образец криогеля помещали во флакон с 5 мл водного раствора натриевой соли ибупрофена (Na-ИБП) концентрацией 1 мг/мл. Далее в течение 4 дней с интервалом в 24 ч с помощью UV/VIS-спектрофотометра T70 (PG Instruments Ltd., Великобритания) записывали УФ-спектры жидкой фазы, чтобы зафиксировать достижение равновесия распределения растворенного вещества в системе гель–жидкость.
При исследовании динамики высвобождения Na-ИБП из насыщенных им образов “вторичных” КГПВС каждый образец криогеля погружали в 5 мл 0.05 М Na-фосфатного буферного раствора (рН 7.4) и инкубировали при комнатной температуре в течение определенных промежутков времени, когда измеряли оптическое поглощение супернатанта при 264 нм, а образец криогеля помещали в свежую порцию (5 мл) буферного раствора. Эти операции повторялись необходимое количество циклов. Содержание аналита в жидкой фазе определяли, используя предварительно построенный калибровочный график.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Формирование “первичных” КГПВС и изменение их осмотических и физико-механических характеристик в ходе трансформации во “вторичные” криогели
Как указано в экспериментальной части, схема формирования “первичных” и далее “вторичных” криогелей ПВС включала три (“а”, “б” и “в”) основные стадии:
а) Приготовление исходных растворов полимера в ДМСО ([ПВС] = 100 г/л) без введения мочевины или с ее добавками в концентрациях 2.0 и 4.0 моль/л.
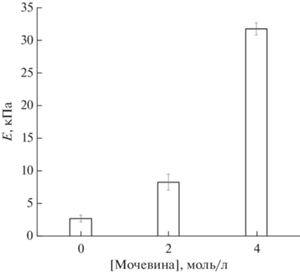
б) Замораживание таких растворов, их инкубацию в замороженном состоянии и последующее оттаивание. Температура криогенной обработки во всех случаях была одинаковой –21.6°C, что на 40 градусов ниже (ΔТ = –40°) относительно точки кристаллизации чистого ДМСО (Т0 = +18.4°C) [56]. В предварительных опытах было найдено, что в этих условиях растворы всех вышеуказанных составов гарантированно замерзали, тогда как при более высоких отрицательных температурах, в частности, при ΔТ в диапазоне от –20 до ‒10°C, образцы с 4-молярным содержанием мочевины часто не кристаллизовались из-за эффектов переохлаждения. В свою очередь, в случае замораживания исходных растворов при ΔТ = –40°C результатом последовательных операций “а” и “б” являлось образование “первичных” КГПВС, значения модуля упругости которых приведены на рис. 1. Эта диаграмма свидетельствует, что образцы, сформированные на основе ДМСО-растворов полимера с добавками мочевины, как уже указывалось выше, проявляющей в этом растворителе по отношению к ПВС космотропные свойства и способствующей криотропному гелеобразованию данного полимера [49], являются более упругими по сравнению с криогелями без мочевины.
Рис. 1.
Зависимость компрессионного модуля Юнга образцов “первичных” КГПВС от концентрации мочевины в исходных ДМСО-растворах полимера.
в) Замещение органической среды на воду осуществляли инкубацией образцов “первичных” криогелей в избытке водного экстрагента с периодической его заменой на свежую порцию. Результатом этой стадии процесса являлась трансформация “первичных” КГПВС во “вторичные”. В ходе такой трансформации мы измеряли текущие значения объема (Vi), массы (mi) и компрессионного модуля Юнга (Ei) соответствующих гелевых образцов (рис. 2–4), чтобы оценить характер изменений данных показателей, вызываемых сменой среды, сольватирующей трехмерную надмолекулярную сетку ПВС. После помещения всех образцов “первичных” КГПВС в воду уже через сутки наблюдалось существенное уменьшение их геометрических размеров. И далее, обычно после третьей смены воды, величина подобного эффекта отбухания (de-swelling) практически стабилизировалась. Данный эффект иллюстрируется диаграммами рис. 2 и 3 как выраженное в процентах отношение, соответственно, объема и массы цилиндрических образцов – текущего (Vi и mi) и исходного (V0 и m0). При этом абсолютное значение параметров Vi/V0 и mi/m0 зависело от концентрации мочевины, введенной в начальный ДМСО-раствор полимера. В наименьшей степени сокращение объема и массы криогелей ПВС в результате замещения в них ДМСО на воду происходило для образцов КГПВС, приготовленных без добавок мочевины (рис. 2а и 3а). Более выражен данный эффект был для криогелей, полученных с 2-х молярным содержанием мочевины (рис. 2б и 3б), и в наибольшей степени – в случае образцов, сформированных из растворов ПВС с содержанием мочевины 4.0 моль/л (рис. 2в и 3в). При этом абсолютная величина сокращения геометрических размеров и массы образцов в некоторой степени еще зависела и от объема воды, куда был погружен соответствующий криогель, т.е. зависела от соотношения его объема и объема внешнего жидкого экстрагента. Так, для цилиндрических КГПВС, полученных на основе ДМСО-растворов полимера без добавок мочевины, показатель Vi/V0 у образцов, инкубировавшихся в сменяемых 30-мл-порциях воды, оказался примерно на 5%, а отношение mi/m0 – на ~7% ниже, чем для аналогичных криогелей, но обработанных 90-мл-порциями такого же экстрагента (рис. 2а и 3а). Можно предположить, что из-за меньшей степени разбавления ДМСО в первом варианте процесс отбухания надмолекулярной сетки ПВС протекал медленнее, т.е. в более равновесных условиях, и поэтому с несколько большей эффективностью по сравнению со вторым вариантом, когда сродство растворителя к полимеру снижалось быстрее в менее равновесном режиме. Иначе говоря, в более равновесном режиме образование дополнительных межмолекулярных контактов (новых водородных связей) приводило к большему уплотнению надмолекулярной сетки КГПВС в ходе замещения ДМСО на воду.
Рис. 2.
Относительное изменение объема цилиндрических образцов криогелей ПВС, помещенных в различные объемы жидкости для замещения ДМСО на воду (неокрашенный столбик – объем криогеля до гидратации, черный столбик – объем воды 30 мл, серый столбик – 90 мл; n – число циклов смены воды).
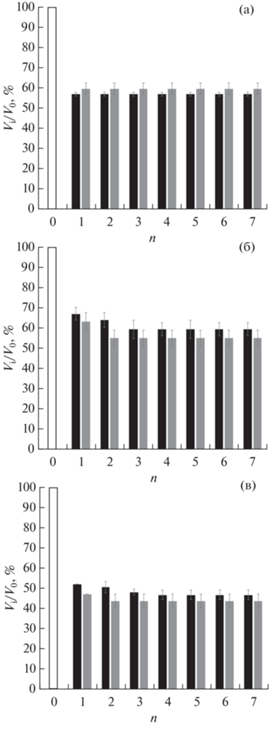
Рис. 3.
Относительное изменение массы цилиндрических образцов криогелей ПВС, помещенных в различные объемы жидкости для замещения ДМСО на воду (неокрашенный столбик – масса криогеля до гидратации, черный столбик – объем воды 30 мл, серый столбик – 90 мл; n – число циклов смены воды).
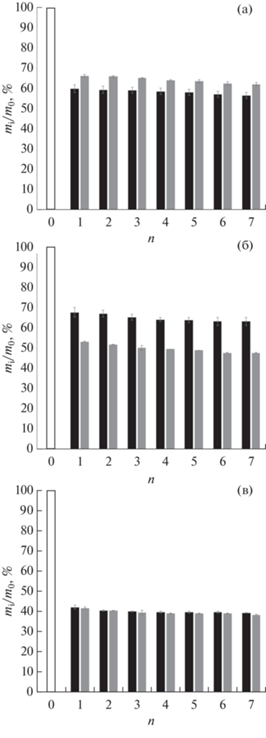
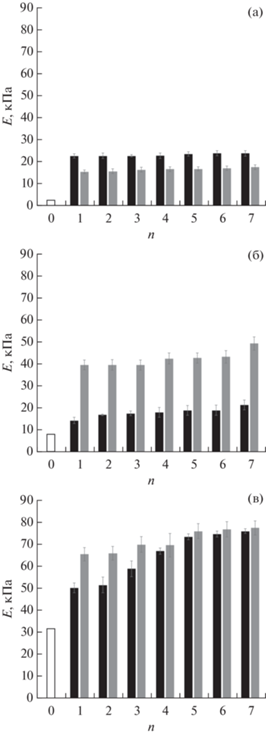
Рис. 4.
Изменение компрессионного модуля Юнга образцов криогелей ПВС, помещенных в различные объемы жидкости для замещения ДМСО на воду (неокрашенный столбик – значение Е криогеля до гидратации, черный столбик – объем воды 30 мл, серый столбик – 90 мл; n – число циклов смены воды).
Когда же криогели формировались в присутствии добавок мочевины, способствовавшей в ДМСО водородному связыванию цепей ПВС и, как результат, повышению упругости образующихся криогелей (рис. 1), то при замене органической среды на воду количество действующих на систему факторов возрастало. С одной стороны, уже обсуждавшееся понижение термодинамического сродства растворителя к полимеру по мере разбавления ДМСО водой индуцировало процесс отбухания надмолекулярной сетки криогеля. С другой стороны, в водной среде, даже несмотря на постепенное разбавление мочевины, “вступали в силу” ее хаотропные свойства, наоборот, способствующие дополнительной сольватации цепей ПВС [55] и, как следствие, вызывающие повышение набухаемости полимерной сетки. Таким образом, имела место конкуренция разнонаправленных факторов. При этом абсолютная величина наблюдаемых в результате эффектов при замещении ДМСО на воду и отмывании мочевины из объема образцов КГПВС зависела от содержания мочевины в исходном растворе ПВС. В частности, объем и масса криогелей, сформированных при 2-молярной концентрации этой добавки (рис. 2б и 3б), убывали в меньшей степени, чем те же показатели для образцов, приготовленных при концентрации мочевины 4 моль/л (рис. 2в и 3в). Причем различия в значениях Vi/V0 и mi/m0 для КГПВС, экстрагируемых 30- и 90-мл порциями воды, именно в случае криогелей, сформированных при концентрации мочевины 2 моль/л, оказались наиболее выраженными (рис. 2б и 3б). Эти данные свидетельствуют о принципиальном влиянии концентрации мочевины в исходном ДМСО-растворе ПВС на те структурные особенности формируемых криогелей, скорее всего даже и на молекулярном уровне, которые определяют осмотическое поведение КГПВС на макроскопическом уровне при замещении диметилсульфоксида на воду. Несомненно, что выяснение тонких механизмов процессов, “работающих” в ходе такой замены жидкой среды, требует дальнейшего изучения.
В этом контексте весьма показательны данные об изменении физико-механических характеристик, полученных в этой работе КГПВС при замещении в них ДМСО на воду (рис. 4).
Прежде всего, сравнение значений Е для “первичных” и “вторичных” (7 циклов смены воды) криогелей, полученных без добавок мочевины, показывает, что в результате замещения ДМСО на воду модуль упругости соответствующих образцов возрастал от 2.8 (рис. 1) до 23.9 кПа (рис. 4), т.е. примерно в 8.5 раз, что являлось следствием уплотнения гелевой матрицы и повышения концентрации ПВС в единице объема при отбухании надмолекулярной полимерной сетки. Характерно, что гидратация действием сменяемых 30-мл порций воды, т.е. в обсуждавшемся выше более равновесном режиме, приводила к примерно в 1.4 раза более упругим образцам КГПВС, чем при использовании 90-мл порций водного экстрагента (рис. 4а). Такой результат хорошо согласуется с данными по сокращению объема (рис. 2а) и массы (рис. 3а) аналогичных криогелей в ходе замещения в них ДМСО на воду, т.е., чем в большей степени при этом сжимался соответствующий образец, тем выше у него оказывался модуль упругости.
В случае криогелей ПВС, полученных в среде замороженного ДМСО с добавками мочевины, а затем отмытых водой, их жесткость после гидратации также существенно возрастала (рис. 4б, 4в). При этом в большей степени этот эффект наблюдался, как и в отношении параметров Vi/V0 (рис. 2б, 2в) и mi/m0 (рис. 3б, 3в), когда образцы КГПВС обрабатывались 90-мл порциями экстрагента, т.е. в менее равновесных условиях замещения ДМСО на воду. Особенно явно это имело место в случае криогелей, сформированных при 2-х молярной концентрации мочевины (рис. 4б). В целом, характер изменения осмотических (рис. 2, 3) и физико-механических (рис. 4) свойств криогелей ПВС при гидратации образцов, сформированных из ДМСО-растворов полимера в отсутствие и с добавками мочевины разной концентрации, мог свидетельствовать об определенных различиях не только микроструктуры полимерной фазы таких гетерофазных гелевых матриц, но и их макропористой морфологии. В этой связи нами с помощью оптической микроскопии было проведено изучение тонких срезов соответствующих криогелей.
Структурно-морфологические особенности “вторичных” КГПВС
Как отмечалось в экспериментальной части, в данной работе исследование макропористой морфологии гелевых образцов осуществлялось для “вторичных” КГПВС, поскольку тонкие срезы “первичных” ДМСО-содержащих криогелей не окрашивались Конго красным, тогда как после замещения органической среды на воду контрастирование по хорошо себя ранее зарекомендовавшей методике [11, 12, 44, 49, 50, 55] позволило получить препараты, пригодные для изучения. Так, на рис. 5 приведены изображения микроструктуры образцов “вторичных” КГПВС, формирование которых происходило в среде замороженного ДМСО без добавок мочевины (рис. 5а) и при ее 2-молярной (рис. 5б) или 4-молярной (рис. 5в) концентрации в исходном растворе полимера. На этих микрофотографиях темные области – полимерная фаза, т.е. гелевые стенки макропор, светлые участки – макропоры, заполненные водой.
Рис. 5.
Оптические микрофотографии окрашенных Конго красным тонких срезов образцов “вторичных” КГПВС, сформированных в среде замороженного ДМСО без добавок мочевины (а) и при ее концентрации в исходном растворе полимера 2 (б) и 4 (в) моль/л.

Даже на качественном уровне хорошо прослеживаются различия в макропористой морфологии этих образцов. Характер структуры криогелей, полученных без мочевины (рис. 5а) и при 2-молярном содержании этой добавки (рис. 5б), в основном был близким и включал чередующиеся анизометричные поры и их гелевые стенки. Скорее всего, малое (1–3 мкм) поперечное сечение самих пор в этих “вторичных” КГПВС обусловлено сжатием образцов при замещении ДМСО на воду (рис. 2а, 2б). Практически аналогичная картина наблюдалась ранее для КГПВС без добавок, полученного из ДМСО раствора такого же полимера, но при более высокой (–11.6°C), чем в настоящем исследовании, температуре криогенной обработки [57]. По-видимому, такая макропористая морфология является характерной особенностью подобных криогелей, приготовленных в замороженном ДМСО и затем после оттаивания промытых водой. При исходной концентрации мочевины 2 моль/л макропористая морфология полученного КГПВС претерпела некоторую модификацию (рис. 5б): структурные элементы увеличились, а текстура криогеля стала более неоднородной. В свою очередь, повышение до 4 моль/л содержания мочевины в исходном ДМСО-растворе ПВС кардинальным образом трансформировало морфологию получающегося криогеля с образованием системы очень крупных пор размером от ~50 до ~350 мкм (рис. 5в). Можно предположить, что этот эффект является следствием ограниченной растворимости мочевины в ДМСО. Согласно справочным данным [58], при +25°C предельная концентрация мочевины в такой органической среде составляет 292 г в 1 л раствора, т.е. около 4.9 моль/л. Поэтому замораживание раствора ПВС с 4-молярным содержанием мочевины должно сопровождаться ее частичной кристаллизацией как вследствие ухудшения растворимости при понижении температуры, так и из-за эффектов криоконцентрирования растворенного вещества при вымерзании большей части растворителя. Дальнейшее образование криогеля ПВС вокруг частиц закристаллизовавшейся мочевины, а затем размораживание системы приводят к получению КГПВС с очень крупными порами, а при последующем вымывании водой ДМСО-раствора мочевины из объема криогеля силы поверхностного натяжения будут округлять форму этих крупных пор. Отсюда следует, что вещества ограниченной растворимости, такие как мочевина в ДМСО, в ходе криотропного гелеобразования ПВС будут действовать в качестве порогенов (как мочевины при ее 4-молярной концентрации в ДМСО-растворе этого полимера), дополнительных к поликристаллам замороженного растворителя. Количество и размер крупных пор, сформированных подобным дополнительным порообразователем в объеме КГПВС, конечно будет определяться химической природой вещества, его концентрацией, растворимостью в зависимости от температуры и режимами проведения стадий замораживания–оттаивания.
Динамика насыщения “вторичных” КГПВС лекарственным веществом и последующего его высвобождения из полимерного носителя
Поскольку различные криогели ПВС, что отмечалось нами выше, в настоящее время рассматриваются как очень перспективные материалы биомедицинского назначения, например, при их применении в качестве носителей для систем доставки лекарственных веществ [15, 30, 39, 41, 43, 44], то в этом аспекте представлялось целесообразным оценить функциональные возможности полученных в нашей работе “вторичных” КГПВС, приобретающих повышенную жесткость после экстрации водой “первичных” криогелей. Для этой цели как модель лекарственного вещества была использована водорастворимая натриевая соль ибупрофена (Na-ИБПФ) (рис. 6), концентрацию которой в растворах легко определять фотометрически. Также выбор этого вещества был обусловлен наличием в его молекуле карбоксилатной функциональной группы, способной к водородному связыванию с ОН-группами ПВС, чтобы выяснить влияние данного фактора на кинетику высвобождения агента из криогелей ПВС, сформированных в среде замороженного ДМСО с добавками мочевины в разной концентрации.
Как указано в экспериментальной части, насыщение образцов “вторичных” КГПВС сорбатом, т.е. Na-ИБПФ, осуществлялось из его водного раствора, не содержащего других растворенных веществ, чтобы минимизировать влияние подобных примесей, в частности, каких-либо низкомолекулярных солей на процесс насыщения. В свою очередь, характер высвобождения Na-ИБПФ из гелевой матрицы был исследован нами в среде Na-фосфатного буфера при рН 7.4, отвечающем значению кислотности, моделирующему физиологические условия.
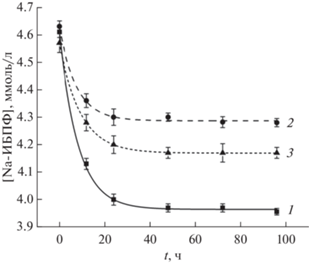
Кинетические кривые рис. 7 отображают характер изменения концентрации Na-ИБПФ в растворе, контактирующем с образцами “вторичных” КГПВС в ходе их насыщения этим лекарством. Во всех случаях концентрация Na-ИБПФ примерно через сутки переставала изменяться, т.е. достигалось примерное равновесие в содержании этого вещества в соответствующем образце криогеля и окружающем его растворе. При этом больше всего Na-ИБПФ поглощалось сформированными из ДМСО-раствора ПВС без добавок мочевины и затем отмытыми водой “вторичными” криогелями (1, рис. 7), а в наименьшей степени – образцами “вторичных” КГПВС, полученных из растворов полимера с 2-молярной концентрацией мочевины (2, рис. 7). В свою очередь, “вторичные” криогели, для формирования которых использовался ДМСО-раствор ПВС с содержанием мочевины 4 моль/л и которые в результате приобретали принципиально иную макропористую морфологию (рис. 5в), при насыщении раствором Na-ИБПФ поглощали это вещество (3, рис. 7) меньше, чем первые (1, рис. 7) из перечисленных КГПВС, но больше, чем вторые (2, рис. 7). Мы полагаем, что такие различия могут быть обусловлены неодинаковой плотностью собственно гелевой фазы этих гетерофазных криогелей, т.е. стенок их макропор, и разным соотношением объемов полимерной и жидкой фаз у образцов КГПВС, сформированных без добавок мочевины и при ее концентрации в исходном растворе 2 или 4 моль/л.
Рис. 7.
Динамика изменения концентрации Na-ИБПФ в жидкой фазе при насыщении лекарственным веществом “вторичных” КГПВС, сформированных в среде замороженного ДМСО без добавок мочевины (кривая 1) и при ее 2- (кривая 2) и 4-молярной (кривая 3) концентрации в исходном растворе полимера.
В этом плане важно было получить ответ на вопрос: будут ли такие неодинаковые “сорбционные” свойства обсуждаемых криогелей отражаться на характере высвобождения (release) Na-ИБПФ из нагруженных этим лекарством соответствующих полимерных носителей?
И действительно, оказалось, что подобные различия в динамике высвобождения Na-ИБПФ во внешний буферный раствор (см. Экспериментальную часть) наблюдаются. Полученные экспериментальные данные были обработаны нами с использованием функции Вейбулла [60]:
где Mt/M∞ – доля растворенного вещества, выделившаяся из матрицы за время t; параметры a и b являются константами, численные значения которых были определены с помощью программы ORIGIN PRO внесением в нее формулы (1) и экспериментальных данных. Уравнение Вейбулла является известным инструментом для анализа особенностей высвобождения лекарственных веществ из различных полимерных матриц [61], а полученные в результате такой обработки кинетические кривые для объектов нашего исследования приведены на рис. 8.Рис. 8.
Экспоненциальные кривые в координатах уравнения Вейбулла кинетических профилей высвобождения Na-ИБПФ из насыщенныx лекарственным веществом “вторичных” КГПВС, сформированных в среде замороженного ДМСО без добавок мочевины (кривая 1; b = 0.50) и при ее 2- (кривая 2; b = 0.21) и 4‑молярной (кривая 3; b = 0.11) концентрации в исходном растворе полимера.
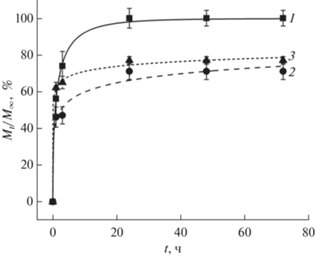
Этот график показывает, что наблюдалась положительная корреляция в кинетике насыщения образцов КГПВС и высвобождения Na-ИБПФ из них. Быстрее всего оба процесса протекали в случае криогелей, сформированных без добавок мочевины (кривые 1, рис. 7 и 8), несколько медленнее это происходило в случае гелевых образцов, полученных в присутствии мочевины в концентрации 4 моль/л (кривые 3, рис. 7 и 8), и еще медленнее для КГПВС, сформированных с 2-молярной добавкой мочевины (кривые 2, рис. 7 и 8). Поскольку наблюдавшиеся кинетические различия при насыщении таких “вторичных” криогелей раствором Na-ИБПФ (рис. 7) были, как отмечалось выше, скорее всего обусловлены существенной разницей в микроструктуре данных гелевых матриц, то эти же факторы должны были влиять и на кинетику высвобождения лекарственного вещества из соответствующих полимерных носителей.
В этой связи определенную информацию дает анализ величин параметра b уравнения Вейбулла, значения которых для исследованных нами объектов приведены в подписи к рис. 8. Как известно [61], данный параметр связан с микроструктурой носителя. В частности, когда b < 0.35, то это свидетельствует о диффузии растворенного вещества в пространстве сильно неупорядоченной матрицы. Когда же значения параметра b находятся в пределах от 0.39 до 0.69, то считается, что диффузия протекает во фрактальном или неупорядоченном пространстве, а значения параметра b выше 0.7 свидетельствуют о механизме фактически свободной диффузии растворенного вещества из объема носителя. Кроме того, параметр b отражает не только структурные особенности матрицы, но он чувствителен и к взаимодействию диффузанта собственно с полимерным веществом носителя. Например, в работе [62] была показана связь значений b с гидрофобными взаимодействиями между карбоцепным каркасом ПВС в объеме криогеля на его основе и высвобождающихся из такого носителя аминокислот общей формулы H2N–(CH2)n–COOH, когда с возрастанием числа метиленовых групп в таких молекулах, а, следовательно, и с повышением их гидрофобности, значения параметра b снижались. В свою очередь, в рассматриваемом в настоящем исследовании случае высвобождения Na-ИБПФ из серии “вторичных” криогелей ПВС параметр b имел низкие (0.11–0.50) значения (см. подписи к рис. 8), несмотря на макропористую морфологию таких носителей (рис. 5), размер пор в которых на несколько порядков превышал гидродинамический диаметр молекул лекарственного вещества, т.е. архитектура матрицы не могла стерически как-то препятствовать его свободной диффузии. Вместе с тем хорошо известен механизм образования сильно поляризованных водородных связей между гидроксильными и карбоксилатными группами соответствующих веществ в водных средах [63]. Отсюда следует, что именно такое, причем обратимое, водородное связывание ионизованной карбоксильной группы соли ибупрофена (рис. 6) и ОН-функций макромолекул ПВС являлось причиной замедления высвобождения Na-ИБПФ из матрицы “вторичных” КГПВС. Различия же в кинетике высвобождения лекарства (рис. 8) между носителями, сформированными без добавок мочевины и в ее присутствии, скорее всего, были, как и при нагружении таких же криогелей солью ибупрофена (рис. 7), обусловлены уже неодинаковой микроструктурой полимерной фазы стенок их макропор, тем самым влияющей на эффективность протекания обсуждаемых процессов водородного связывания. Вполне очевидно, что тонкие механизмы такого влияния еще предстоит выяснить.
ЗАКЛЮЧЕНИЕ
В настоящей работе были получены и исследованы криогели поливинилового спирта, формируемые криогенной обработкой растворов данного полимера в диметилсульфоксиде без и с добавками мочевины, проявляющей в такой среде космотропные свойства, что приводит к повышению жесткости образующихся криогелей. Последующая гидратация этих “первичных” криогелей замещением в них ДМСО на воду вызывала уменьшение объема и массы образцов, а также приводила к существенному росту модуля упругости получаемых “вторичных” криогелей. Абсолютная величина таких эффектов зависела как от концентрации мочевины в исходном растворе ПВС, так и от соотношения объемов гелевых образцов и водного экстрагента при их гидратации. С помощью оптической микроскопии изучены структурные особенности “вторичных” криогелей и установлено, что присутствие мочевины в исходном ДМСО-растворе полимера в концентрации, близкой к пределу ее растворимости в такой среде, индуцирует формирование крупнопористой морфологии образующейся гелевой матрицы. Поскольку высокомодульные “вторичные” криогели ПВС представляют большой интерес в качестве материалов биомедицинского назначения, в работе была оценена возможность их функционирования в качестве носителей систем доставки лекарственных веществ, когда как модельное лекарственное соединение использовалась натриевая соль ибупрофена. Показано, что динамическое водородное связывание карбоксилатных групп этого вещества с гидроксильными группами ПВС приводит к замедлению высвобождения лекарства из полимерного носителя, т.е. способствует пролонгированию процесса высвобождения. Полученные в этом исследовании экспериментальные данные ранее известны не были, т.е. являются новыми как в отношении сформированных в среде замороженного ДМСО без и с добавками мочевины криогелей ПВС и характера изменения их физико-химических свойств при последующей гидратации, так и в плане демонстрации потенциальной возможности разработки на основе таких материалов гидрогелевых носителей для средств доставки лекарственных веществ.
Список литературы
Nambu M. Rubber-like poly(vinyl alcohol) gel // Kobunshi Ronbunshu. 1990. V. 47. P. 695–703 (In Japanese). https://doi.org/10.1295/koron.47.695
Peppas N.A., Stauffer S.R. Reinforced uncrosslinked poly(vinyl alcohol) gels produced by cyclic freezing-thawing processes: A short review // J. Control. Release. 1991. V. 16. № 3. P. 305–310. https://doi.org/10.1016/0168-3659(91)90007-Z
Лозинский В.И. Криотропное гелеобразование растворов поливинилового спирта // Успехи химии. 1998. Т. 67. № 7. С. 641–655.
Hassan C.M., Peppas N.A. Structure and applications of poly(vinyl alcohol) hydrogels produced by conventional crosslinking or by freezing/thawing methods // Adv. Polym. Sci. 2000. V. 153. P. 37–65. https://doi.org/10.1007/3-540-46414-X_2
Gutiérrez M.C., Aranaz I., Ferrer M.L., del Monto F. Production and properties of poly(vinyl alcohol) cryogels: Recent developments // In: Macroporous Polymers: Production, Properties and Biological/Biomedical Applications. Mattiasson B., Kumar A., Galaev I. Eds. CRC Press: Boca Raton, FL, USA, 2010. P. 83–115. https://doi.org/10.1201/9781420084627
Gun’ko V.M., Savina I.N., Mikhalovsky S.V. Cryogels: Morphological, structural and adsorption characterization // Adv. Coll. Interface Sci. 2013. V. 187–188. P. 1–46. https://doi.org/10.1016/j.cis.2012.11.001
Adelnia H., Ensandoost R., Moonshi S.S., Gavgani J.N., Vasafi E.I., Ta H.T. Freeze/thawed polyvinyl alcohol hydrogels: Present, past and future // Eur. Polym. J. 2022. V. 164. P. 110974. https://doi.org/10.1016/j.eurpolymj.2021.110974
Рогожин С.В., Лозинский В.И., Вайнерман Е.С., Домотенко Л.В., Мамцис А.М., Иванова С.А., Штильман М.И., Коршак В.В. Нековалентное криоструктурирование в полимерных системах // Докл. АН СССР. 1984. Т. 278. № 1. С. 129–133.
Lozinsky V.I., Vainerman E.S., Domotenko L.V., Mamtsis A.M., Titova E.F., Belavtseva E.M., Rogozhin S.V. Study of cryostructurization of polymer systems. VII. Structure formation under freezing of poly(vinyl alcohol) aqueous solutions // Coll. Polym. Sci. 1986. V. 264. P. 19–24. https://doi.org/10.1007/BF01410304
Mori Y., Tokura H., Yoshikawa M. Properties of hydrogels synthesized by freezing and thawing aqueous po-ly(vinyl alcohol) solutions and their applications // J. Mater. Sci. 1997. V. 32. P. 491–496. https://doi.org/10.1023/A:1018586307534
Лозинский В.И., Дамшкалн Л.Г., Шаскольский Б.Л., Бабушкина Т.А., Курочкин И.Н., Курочкин И.И. Изучение криоструктурирования полимерных систем. 27. Физико-химические свойства криогелей поливинилового спирта и особенности их макропористой морфологии // Колоидн. журн. 2007. Т. 69. № 6. С. 798–816.
Лозинский В.И., Дамшкалн Л.Г., Курочкин И.Н., Курочкин И.И. Изучение крио-структурирования полимерных систем. 28. Физико-химические свойства и морфология криогелей поливинилового спирта, сформированных многократным замораживанием-оттаиванием // Коллоидн. журн. 2008. Т. 70. № 2. С. 212–222.
Zhang H., Zhang F., Wu J. Physically crosslinked hydrogels from polysaccharides prepared by freeze–thaw technique // React. Func. Polym. 2013. V. 73. № 7. P. 923–928. https://doi.org/10.1016/j.reactfunctpolym.2012.12.014
Lozinsky V.I., Okay O. Basic principles of cryotropic gelation // Adv. Polym. Sci. 2014. V. 263. P. 49–101. https://doi.org/10.1007/978-3-319-05846-7_2
Lozinsky V.I. Cryostructuring of polymeric systems. 55. Retrospective view on the more than 40-years studies performed in the A.N. Nesmeyanov Institute of Organoelement Compounds with respect of the cryostructuring processes in polymeric systems // Gels. 2020. V. 6. № 3. P. 29. https://doi.org/10.3390/gels6030029
Лозинский В.И., Вакула А.С., Зубов А.Л. Применение криогелей поливинилового спирта в биотехнологии. IV. Обзор литературных данных // Биотехнология. 1992. № 4. С. 5–14.
Varfolomeev S.D., Rainina E.I., Lozinsky V.I. Cryoimmobilized enzymes and cells in organic synthesis // Pure Appl. Chem. 1992. V. 64. № 8. P. 1193–1196. https://doi.org/10.1351/pac199264081193
Lozinsky V.I., Plieva F.M. Poly(vinyl alcohol) cryogels employed as matrices for cell immobilization. 3. Overview of recent research and developments // Enzyme Microb. Technol. 1998. V. 23. № 3–4. P. 227–242. https://doi.org/10.1016/S0141-0229(98)00036-2
Lozinsky V.I., Plieva F.M., Galaev I.Y., Mattiasson B. The potential of polymeric cryogels in bioseparation // Bioseparation. 2001. V. 10. P. 163–188. https://doi.org/10.1023/A:1016386902611
Lozinsky V.I., Galaev I.Y., Plieva F.M., Savina I.N., Jungvid H., Mattiasson B. Polymeric cryogels as promising materials of biotechnological interest // Trends Biotechnol. 2003. V. 21. № 10. P. 445–451. https://doi.org/10.1016/j.tibtech.2003.08.002
Lozinsky V.I. What new opportunities the use of diverse polymeric cryogels opens for the immobilization of molecules and cells // Hemijska Industrija. 2004. V. 58. P. 111–115.
Mattiasson B. Cryogels for biotechnological applications // Adv. Polym. Sci. 2014. V. 263. P. 245–282. https://doi.org/10.1007/978-3-319-05846-7_7
Berillo D., Al-Jwaid A., Caplin J. Polymeric materials used for immobilisation of bacteria for the bioremediation of contaminants in water // Polymers. 2021. V. 13. № 7. P. 1073. https://doi.org/10.3390/polym13071073
Lazzeri L. Progress in bioartificial polymeric materials // Trends Polym. Sci. 1996. V. 4. № 8. P. 249–252.
Chu K.C., Rutt B.K. Poly(vinyl alcohol) cryogel: An ideal phantom material for MR studies of arterial flow and elasticity // Magn. Reson. Med. 1997. V. 37. № 2. P. 314–319. https://doi.org/10.1002/mrm.1910370230
Hoskins P.R. Simulation and validation of arterial ultrasound imagining and blood flow // Ultrasound Med. Biol. 2008. V. 34. № 5. P. 693–517. https://doi.org/10.1016/j.ultrasmedbio.2007.10.017
Ghanbari H., Viatage H., Kidane A.G., Burriesci G., Tavakoli M., Seifalian A.M. Polymeric heart valves: New materials, emerging hopes // Trends Biotechnol. 2009. V. 27. № 6. P. 359–367. https://doi.org/10.1016/j.tibtech.2009.03.002
Alves M.H., Jensen B.E.B., Smith A.A.A., Zelikin A.N. Poly(vinyl alcohol) physical hydrogels: New vista on a long serving biomaterial // Macromol. Biosci. 2011. V. 11. № 10. P. 1293–1313. https://doi.org/10.1002/mabi.201100145
Baker M.I., Walsh S.P., Schwatz Z., Boyan B.D. A review of polyvinyl alcohol and its uses in cartilage and orthopedic applications // J. Biomed. Mater. Res. B. 2012. V. 100. № 5. P. 1451–1457. https://doi.org/10.1002/jmb.b32694
Gajra B., Pandya S.S., Vidyasagar G., Rabari H., Dedania R.R., Rao S. Poly(vinyl alcohol) hydrogel and its pharmaceutical and biomedical applications: A review // Int. J. Pharm. Res. 2012. V. 4. № 2. P. 20–26.
Maiolo A.S., Amado M.N., Gonzalez J.S., Alvarez V.A. Development and characterization of poly (vinyl alcohol) based hydrogels for potential use as an articular cartilage replacement // Mater. Sci. Eng. C. 2012. V. 32. № 6. P. 1490–1495. https://doi.org/10.1016/j.msec.2012.04.030
Iatridis J.C., Nicoll S.B., Michalek A.J., Walter B.A., Gupta M.S. Role of biomechanics in intervertebral disc degeneration and regenerative therapies: What needs repairing in the disc and what are promising biomaterials for its repair? // Spine J. 2013. V. 13. № 3. P. 243–262. https://doi.org/10.1016/j.spinee.2012.12.002
Wan W., Bannerman A.D., Yang L., Mak H. Poly(vinyl alcohol) cryogels for biomedical applications // Adv. Polym. Sci. 2014. V. 263. P. 283–321. https://doi.org/10.1007/978-3-319-05846-7_8
Teixeira L.S.M., Patterson J., Luyten F.P. Skeletal tissue regeneration: Where can hydrogels play a role? // Int. Orthopaedics. 2014. V. 38. P. 1861–1876. https://doi.org/10.1007/s00264-014-2402-2
Beddoes C.M., Whitehouse M.R., Briscoe W.H., Su B. Hydrogels as a replacement materials for damaged articular hyaline cartilage // Materials. 2016. V. 9. № 6. P. 443. https://doi.org/10.3390/ma9060443
Kumar A., Han S.S. PVA-based hydrogels for tissue engineering: A review // Int. J. Polym. Mater. Polym. Biomater. 2017. V. 66. № 4. P. 159–182. https://doi.org/10.1080/00914037.2016.1190930
Timofejeva A., D’Este M., Loca D. Calcium phosphate/polyvinyl alcohol composite hydrogels: A review on the freeze-thaw synthesis approach and applications in regenerative medicine // Eur. Polym. J. 2017. V. 95. P. 547–565. https://doi.org/10.1016/j.eurpolymj.2017.08.048
Teodorescu M., Bercea M., Morariu S. Biomaterials of poly(vinyl alcohol) and natural polymers // Polym. Revs. 2018. V. 58. № 2. P. 247–287. https://doi.org/10.1080/15583724.2017.1403928
Memic A., Colombani T., Eggermont L.J., Rezaeeyazdi M., Steingold J., Rogers Z.J., Navare K.J., Mohammed H.S., Bencherif S.A. Latest advances in cryogel technology for biomedical applications // Adv. Therapeutics. 2019. V. 2. № 4. P. 1800114. https://doi.org/10.1002/adtp.201800114
Xiang J., Shen L., Hong Y. Status and future scope of hydrogels in wound healing: Synthesis, materials and evaluation // Eur. Polym. J. 2020. V. 130. P. 109609. https://doi.org/10.1016/j.eurpolymj.2020.109609
Rivera-Hernández G., Antunes-Ricardo M., Martínez-Morales P., Sánchez L. Polyvinyl alcohol based-drug delivery systems for cancer treatment // Internat. J. Pharmaceutics. 2021. V. 600. P. 120478. https://doi.org/10.1016/j.ijpharm.2021.120478
Aderibigbe B.A. Hybrid-based wound dressings: Combination of synthetic and biopolymers // Polymers. 2022. V. 14. № 18. P. 3806. https://doi.org/10.3390/polym14183806
Kolosova O.Yu., Shaikhaliev A.I., Krasnov M.S., Bondar I.M., Sidorskii E.V., Sorokina E.V., Lozinsky V.I. Cryostructuring of polymeric systems. 64. Preparation and properties of poly(vinyl alcohol)-based cryogels loaded with antimicrobial drugs and assessment of the potential of such gel materials to perform as the gel implants for treatment of infected wounds // Gels. 2023. V. 9. № 2. P. 113. https://doi.org/10.3390/gels9020113
Omidian H., Chowdhury S.D., Babanejad N. Cryogels: Advancing biomaterials for transformative biomedical applications // Pharmaceutics. 2023. V. 15. № 7. P. 1836. https://doi.org/10.3390/pharmaceutics15071836
Hyon S.H., Cha W.I., Ikada Y. Preparation of transparent poly(vinyl alcohol) hydrogel // Polym. Bull. 1989. V. 22. P. 119–122. https://doi.org/10.1007/BF00255200
Trieu H.H., Qutubuddin S. Polyvinyl alcohol hydrogels I. Microscopic structure by freeze-etching and critical point drying techniques // Colloid Polym. Sci. 1994. V. 272. P. 301–309. https://doi.org/10.1007/BF00655501
Trieu H.H., Qutubuddin S. Poly(vinyl alcohol) hydrogels. 2. Effects of processing parameters on structure and properties // Polymer. 1995. V. 36. № 13. P. 2531–2539. https://doi.org/10.1016/0032-3861(95)91198-G
Masri C., Chagnon G., Favier D. Influence of processing parameters on the macroscopic mechanical behavior of PVA hydrogels // Mater. Sci. Eng. Part C. 2017 V. 75. P. 769–776. https://doi.org/10.1016/j.msec.2017.02.045
Lozinsky V.I., Kolosova O.Y., Michurov D.A., Dubo-vik A.S., Vasil’ev V.G., Grinberg V.Y. Cryostructuring of polymeric systems. 49. Unexpected “kosmotropic-like” impact of organic chaotropes on freeze–thaw-induced gelation of PVA in DMSO // Gels. 2018. V. 4. № 4. P. 81. https://doi.org/10.3390/gels4040081
Бакеева И.В., Орлова М.А., Лозинский В.И. Криогели поливинилового спирта, сформированные из растворов полимера в диметилсульфоксиде с добавками тетраметоксисилана // Тонкие химические технологии. 2019. Т. 14. № 2. С. 41–50.
Pritchard J.G. Poly(vinyl alcohol): Basic Properties and Uses // Gordon & Breach Science Publish: London, UK, 1970. P. 139.
Masuda K., Horii F. CP/MAS 13C NMR analyses of the chain conformation and hydrogen bonding for frozen poly(vinyl alcohol) solutions // Macromolecules. 1998. V. 31. № 17. P. 5810–5817. https://doi.org/10.1021/ma9801265
Ricciardi R., Auriemma F., Rosa C.D., Laupretre F. X-ray diffraction analysis of poly(vinyl alcohol) hydrogels obtained by freezing and thawing techniques // Macromolecules. 2004. V. 37. № 5. P. 1921–1927. https://doi.org/10.1021/ma035663q
Ricciardi R., Auriemma F., Gaillet C., Rosa C.D., Laupretre F. Investigation of the crystallinity of freeze/thaw poly(vinyl alcohol) hydrogels by different techniques // Macromolecules. 2004. V. 37. № 25. P. 9510–9516. https://doi.org/10.1021/ma048418v
Kolosova O.Yu., Kurochkin I.N., Kurochkin I.I., Lozinsky V.I. Cryostructuring of polymeric systems. 48. Influence of organic non-ionic and ionic chaotropes or kosmotropes on the cryotropic gel-formation of aqueous poly(vinyl alcohol) solutions, as well as on the properties and microstructure of the resultant cryogels // Eur. Polym. J. 2018. V. 102. P. 169–177. https://doi.org/10.1016/j.eurpolymj.2018.03.010
Гордон А., Форд Р. Спутник химика. Пер. с англ. М.: Мир, 1976. С. 14.
Лозинский В.И., Леонова И.М., Иванов Р.В., Бакеева И.В. Изучение криоструктурирования полимерных систем. 46. Физико-химические свойства и микроструктура криогелей поливинилового спирта, сформированных из растворов полимера в смесях диметилсульфоксида с низкомолекулярными спиртами // Коллоидн. журн. 2017. Т. 79. № 6. С. 756–765. https://doi.org/10.7868/S0023291217060088
Dimethyl Sulfoxide Solubility Data. Gaylord Chemical Company, LLC, Slidell, LA, USA. 2014, Bulletin 102.
https://pubchem.ncbi.nlm.nih.gov/compound/Ibuprofen-sodium.
Weibull W. A statistical distribution function of wide applicability // J. Appl. Mechanics. 1951. V. 18. P. 293–297.
Papadopoulou V., Kosmidis K., Vlachou M., Macheras P. On the use of the Weibull function for the discernment of drug release mechanisms // Int. J. Pharm. 2006. V. 309. № 1–2. P. 44–50. https://doi.org/10.1016/j.ijpharm.2005.10.044
Kolosova O.Yu., Karelina P.A., Vasil’ev V.G., Grinberg V.Ya., Kurochkin I.I., Kurochkin I.N., Lozinsky V.I. Cryostructuring of polymeric systems. 58. Influence of the H2N–(CH2)n–COOH-type amino acid additives on formation, properties, microstructure and drug release behaviour of poly(vinyl alcohol) cryogels // React. Funct. Polym. 2021. V. 167. P. 105010. https://doi.org/10.1016/j.reactfunctpolym.2021. 105010
Пиментел Дж., Мак-Клеллан О. Водородная связь. Пер. с англ. М.: Мир, 1964. 464 с.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал



