Коллоидный журнал, 2023, T. 85, № 5, стр. 619-628
Наноэмульсии и твердые липидные наночастицы с инкапсулированным доксорубицином и тимохиноном
Е. В. Мищенко 1, *, А. М. Гилёва 2, Е. А. Марквичева 2, М. Ю. Королева 1, **
1 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва,
Миусская пл., д. 9, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина
и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, д. 16/10, Россия
* E-mail: mishchenkoek@list.ru
** E-mail: m.yu.kor@gmail.com
Поступила в редакцию 06.07.2023
После доработки 30.07.2023
Принята к публикации 04.08.2023
- EDN: DHRIGE
- DOI: 10.31857/S002329122360058X
Аннотация
Наноэмульсии (НЭ) и твердые липидные наночастицы (ТЛН) являются перспективными системами доставки лекарственных соединений. В данной работе были исследованы НЭ из парафинового масла и ТЛН из стеариновой кислоты, стабилизированные Tween 60 и Span 60. НЭ со средним диаметром капель ~50 нм и суспензии ТЛН со средним размером ~30 нм были устойчивы к агрегации более 90 сут. Скорость проникновения липидных частиц в раковые клетки (С6 и MCF-7) зависела от их размера. Липидные наночастицы размером ~50 нм через 1 ч инкубирования проникали внутрь клеток, распределялись в их внутреннем пространстве и концентрировались в ядрах. Цитотоксичность нагруженных доксорубицином или тимохиноном НЭ и ТЛН была выше, чем у данных лекарственных соединений в индивидуальном виде в отношении клеточных линий MCF-7 и HTC 116. При этом ненагруженные НЭ и ТЛН проявляли низкую цитотоксичность. Полученные результаты демонстрируют перспективность использования НЭ с парафиновым маслом и ТЛН из стеариновой кислоты в качестве носителей липофильных и амфифильных лекарственных соединений, в том числе доксорубицина и тимохинона. Накопление липидных наночастиц размером менее 100 нм в ядрах клеток является преимуществом таких систем при доставке противораковых лекарственных соединений, т.к. это будет приводить к остановке репликации ДНК и последующему апоптозу клеток.
1. ВВЕДЕНИЕ
Липофильные лекарственные соединения характеризуются низкой биодоступностью. Поэтому для их доставки требуются носители, в качестве которых могут выступать липидные наночастицы [1]. Липидные наночастицы являются биосовместимыми и биоразлагаемыми наноразмерными системами доставки, которые обладают повышенной проницаемостью и способностью долговременного удерживания лекарственных соединений. Кроме того, инкапсулирование лекарственных соединений в липидных наночастицах экранирует их от внешнего воздействия, защищает от разложения [2].
Для применения в качестве систем доставки лекарственных соединений липидные наночастицы должны обладать долговременной устойчивостью к агрегации и седиментации. НЭ и ТЛН являются термодинамически нестабильными системами, для которых характерно укрупнение капель дисперсной фазы и частиц с течением времени. При эффективной стабилизации НЭ и ТЛН могут сохранять кинетическую стабильность в течение длительного времени [3]. Липидные наночастицы для биомедицинского применения, как правило, стабилизируют низкотоксичными неионогенными поверхностно-актив-ными веществами (ПАВ). Из-за отсутствия высокого поверхностного заряда в суспензиях ТЛН протекает их агрегация. Основными механизмами деградации НЭ являются агрегация, коалесценция и оствальдово созревание [4, 5]. Устойчивость липидных наночастиц в существенной степени зависит от фазового состояния поверхностного слоя. В работах [6–8] показано, что при образовании твердообразной оболочки из адсорбированных молекул ПАВ на поверхности липидных наночастиц их устойчивость к агрегации существенно повышается.
Использование липидных наночастиц в качестве наноносителей способно решить проблему доставки липофильных лекарственных веществ, снизить побочные эффекты, особенно при доставке противораковых соединений.
В данной работе основное внимание было уделено инкапсулированию в липидные наночастицы таких соединений, как тимохинон и доксорубицин. Доксорубицин известен достаточно давно и используется в составе различных липосомальных фармацевтических препаратов [9–11]. Однако, несмотря на инкапсулирование доксорубицина во внутренней полости липосом, при использовании таких носителей проявляются побочные эффекты [12]. Противоопухолевые свойства тимохинона активно исследуются в последнее время [12–15], в том числе было показано, что тимохинон повышает противоопухолевую активность доксорубицина [16].
Инкапсулирование доксорубицина проводили в твердые липидные частицы, состоящие из глицерил моностеарата c диаметром (d), равным 96 [17], 84–163 [18] и 240 нм [19]; глицерил капрата (d = 199 нм) [20]; глицерил бегената (d = 74–80 нм) [21], пальмитиновой (d = 278 нм), стеариновой (d = 289 нм), арахиновой (d = 303 нм) и бегеновой кислоты (d = 305 нм) [22], масла какао и пальмитиновой кислоты (d = 141–174 нм) [23]; масла какао и стеариновой кислоты (d = 200–250 нм) [24]; стеариновой кислоты (d = 80 нм) [25].
Количество исследований по инкапсулированию тимохинона в липидные наночастицы значительно меньше. Описано получение твердых липидных частиц с инкапсулированным тимохиноном из стеариновой кислоты (d = 172 нм) [26], Gelucire 44/14 и Capmul MCM (d = 84 нм) [27], глицерил моностеарата (d = 84 нм) [28], а также наноструктурированных липидных носителей, содержащих масляный раствор тимохинона (d = 84–87 нм) [29], и НЭ с миндальным маслом, стабилизированных Tween 80 (d = 65–320 нм) [30].
Практически во всех публикациях подчеркивается, что цитотоксичность липидных носителей с доксорубицином или тимохиноном выше по сравнению с лекарственной формой в виде раствора доксорубицина или суспензии тимохинона. По-видимому, основным механизмом проникновения липидных наночастиц в клетки является эндоцитоз [31–34]. При этом в некоторых исследованиях показано, что липидные частицы способны проникать в ядра клеток. Так, в статье [33] обнаружено, что твердые липидные частицы из цетил пальмитата размером 230 нм, стабилизированные Tween 80, через 4 ч инкубирования с клетками MCF-7 проникали в ядра. Эффект накопления в ядрах был особенно заметен для липидных частиц с привитой к поверхности фолиевой кислотой. Твердые липидные частицы из стеариновой кислоты, также имевшие размер 230 нм, стабилизированные Pluronic F68 и содержащие протамин, проникали в ядра фибробластов клеточной линии COS через 12 ч инкубирования [35]. Липидные частицы глицерил моностеарата размером 160–245 нм, стабилизированные Tween 80 и Span 20, проникали в ядра келоидных фибробластов через 1 ч инкубирования [36]. Капли НЭ диаметром 20–50 нм, содержащие Nigēlla satīva эфирное масло и стабилизированные Tween 80, не только проникали в клетки MCF-7, но и приводили к фрагментации ядер [37].
Однако липидные наночастицы не всегда проникают в клеточные ядра. Например, капли НЭ, содержащие пальмитат ретинола и α-токоферол, стабилизированные оксиэтилированными ПАВ, с диаметром капель 26–73 нм проникали в эпителиальные клетки и концентрировались вокруг ядер [38]. Капли НЭ диаметром 190 нм, состоящие из Miglyol 812N и стабилизированные фосфолипидами Epikuron 170, Span 80 и Poloxamer 188, не проникали в ядра клеток Candida albicans и Candida tropicalis [39].
Следует отметить, что факт накопления липидных носителей в ядрах клеток является положительным при доставке противораковых соединений, однако время проникновения не должно быть слишком большим.
В данной работе была исследована дисперсность и агрегативная устойчивость НЭ с дисперсной фазой из парафинового масла и ТЛН из стеариновой кислоты. Были исследованы скорости проникновения и локализация липидных наночастиц в раковых клетках, цитотоксичность НЭ и ТЛН, ненагруженных и нагруженных доксорубицином или тимохиноном.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Реактивы и материалы
Для получения НЭ и ТЛН использовали следующие реактивы: парафиновое масло (Britol 20 USP, puriss), стеариновую кислоту (Sigma-Aldrich, ≥95%) полиоксиэтиленсорбитан моностеарат Tween 60, (Sigma‑Aldrich, ≥95%) сорбитанмоностеарат Span 60 (Sigma‑Aldrich, ≥95%), NaCl (Merck, extra pure). В качестве лекарственных соединений использовали доксорубицин (Pharmachemie B.V.) и тимохинон (Sigma‑Aldrich, ≥98%). В качестве флуоресцентных красителей применяли Nil-eRed (Sigma‑Aldrich), Neuro-DiO (Biotium), Hoechst 33258 (Thermo Fisher Scientific).
Все реактивы дополнительной очистке не подвергали. Для получения НЭ и ТЛН использовали бидистиллированную воду.
2.2. Получение НЭ и ТЛН
НЭ и ТЛН получали методом температурной инверсии фаз [40]. Доля органической фазы составляла 25 об. %. Для стабилизации использовали смесь ПАВ Tween 60 и Span 60 в мольном соотношении 0.76 [8]. Концентрация ПАВ в НЭ была равной 12.5 об. %, в ТЛН − 15 об. %.
Стеклянный сосуд, содержащий парафиновое масло или стеариновую кислоту, смесь ПАВ Tween 60/Span 60 и водный раствор NaCl с концентрацией 0.15 М, нагревали до температуры, превышающей температуру инверсии фаз. Затем смесь охлаждали в ледяной бане с температурой 0°С при интенсивном перемешивании.
При получении нагруженных НЭ и ТЛН лекарственное вещество предварительно растворяли в парафиновом масле или расплаве стеариновой кислоты при 80°С. Далее НЭ и ТЛН получали по описанной выше методике. Концентрация доксорубицина или тимохинона в НЭ и суспензии ТЛН составляла 15 мас. %.
2.3. Определение размеров капель НЭ и ТЛН
Для определения размера липидных частиц использовали лазерный анализатор Zetasizer Nano ZS (Malvern Instruments). Анализатор оснащен He-Ne лазером, работающим при длине волны 633 нм, с регистрацией рассеянного света под углом 173°. Распределения по размерам были получены с использованием алгоритма Multiple Narrow Modes. Измерения проводили при 25°C. По результатам не менее трех измерений каждого образца рассчитывали средние значения диаметров наночастиц.
2.4. Исследование проникновения и локализации НЭ и ТЛН в раковых клетках
Изучение проникновения НЭ и ТЛН в раковые клетки проводили на клеточных линиях глиомы головного мозга крысы (С6) и аденокарциномы молочной железы человека (MCF-7). Для визуализации НЭ и ТЛН окрашивали Ni-leRed (0.1 мг/мл). Для окрашивания мембран и цитоплазмы раковых клеток использовали Ne-uro-DiO (5 мкг/мл, фосфатный буферный раствор), ядер клеток − Hoechst 33258 (5 мкг/мл, фосфатный буферный раствор).
Проникновениe НЭ и ТЛН в клетки детектировали с помощью конфокального инвертированного микроскопа Nikon TE‑2000, снабженного конфокальной лазерной системой C1, лазерами Kr (408 нм), Ar (488 нм), G-NeHe (543 нм).
2.5. Исследование цитотоксичности НЭ и ТЛН in vitro
Исследование цитотоксичности НЭ и ТЛН проводили с использованием МТТ‑теста на клеточных линиях аденокарциномы молочной железы человека (MCF-7) и рака толстой кишки человека (HCT-116).
В 96-луночный планшет вносили по 100 мкл раковых клеток (~7500 клеток на лунку), затем планшет помещали в СО2-инкубатор. Через 24 ч среду в лунках заменяли средой, содержащей разбавленные НЭ или суспензии ТЛН (разбавление в 40, 50, 80, 100, 160, 320 и 640 раз). Разведение образцов осуществляли средой DMEM с добавлением 10% фосфатного буферного раствора. Клетки, находящиеся в среде с НЭ или ТЛН, инкубировали в течение 24 и 48 ч. Затем из каждой лунки удаляли питательную среду и добавляли 100 мкл среды DMEM без сыворотки, содержащий раствор МТТ (0.5 мг/мл, фосфатный буферный раствор), и оставляли в СО2-инкубаторе на 3 ч. Затем удаляли раствор МТТ, в каждую лунку добавляли по 100 мкл диметилсульфоксида и помещали на шейкер (S-4 Elmi) на 10 мин. Поглощение измеряли на многоканальном спектрофотометре (Flow Laboratories) на длинах волн 540/690 нм.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1. Дисперсность и устойчивость НЭ и суспензий ТЛН
Применение маслорастворимых лекарственных соединений ограниченно из-за их низкой растворимости в водных средах. Для увеличения биодоступности таких соединений целесообразно использовать в качестве носителей липидные наночастицы, такие как НЭ и ТЛН.
В данной работе были исследованы НЭ с дисперсной фазой, состоящей из парафинового масла, и ТЛН из стеариновой кислоты, стабилизированные смесью ПАВ Tween 60 и Span 60. На рис. 1 приведены распределения по размерам капель дисперсной фазы в НЭ и ТЛН. Распределения по размерам являются мономодальными. Средний диаметр капель дисперсной фазы в НЭ с парафиновым маслом составляет 50 ± 2 нм (PDI = 0.18), размер ТЛН из стеариновой кислоты − 30 ± 1 нм (PDI = 0.11). При этом размер липидных наночастиц практически не изменялся в течение 90 сут. Это свидетельствует о высокой устойчивости полученных липидных наночастиц к агрегации. Кинетическая стабильность НЭ и суспензий ТЛН обусловлена тем, что оболочка из адсорбированных молекул ПАВ Tween 60 и Span 60 на поверхности липидных наночастиц была твердообразной [6] и препятствовала их агрегации.
3.2. Скорость проникновения и локализация НЭ и твердых липидных частиц в раковых клетках
Оценку скорости проникновения и эффективности накопления липидных наночастиц в раковых клетках исследовали in vitro методом конфокальной микроскопии. Как известно, скорость проникновения носителей лекарственных соединений в клетки зависит от их размера и состава [41], а также от структуры поверхностного слоя частиц. Поэтому в данной работе была проведена сравнительная оценка скорости проникновения в раковые клетки липидных частиц разного размера, но с одинаковой структурой поверхности [6]. Исследовали НЭ со средним диаметром капель парафинового масла 50 нм, аналогичные рассмотренным в разделе 3.1. Твердые липидные частицы из стеариновой кислоты были существенно крупнее, их средний размер составлял ~200 нм. И капли масла в НЭ, и твердые липидные частицы были стабилизированы смесью ПАВ Tween 60 и Span 60, т.е. были покрыты оболочкой с одинаковой структурой.
Инкубирование НЭ и твердых липидных частиц с клетками C6 проводили в течение 15 мин и 1 ч. На рис. 2 в качестве примера представлены микрофотографии клеток С6 после 15 мин инкубирования с НЭ и твердыми липидными частицами. За это время капли НЭ диаметром 50 нм проникали в клетки и накапливались в цитоплазме и внутриклеточных органоидах, предположительно в эндосомах и лизосомах, за исключением ядра. При этом более крупные липидные частицы стеариновой кислоты за это время распределялись во внеклеточном матриксе и адсорбировались на клеточной мембране.
Рис. 2.
Клетки C6 после 15 мин инкубирования с НЭ (верхний ряд) и твердыми липидным частицами (нижний ряд). Диаметр капель в НЭ – 50 нм, размер твердых липидных частиц – 200 нм. НЭ и твердые липидные частицы окрашены в красный цвет NileRed, цитоплазма и внутриклеточные мембраны окрашены в зеленый цвет Neuro-DiO, ядра окрашены в синий цвет Hoechst 33258.
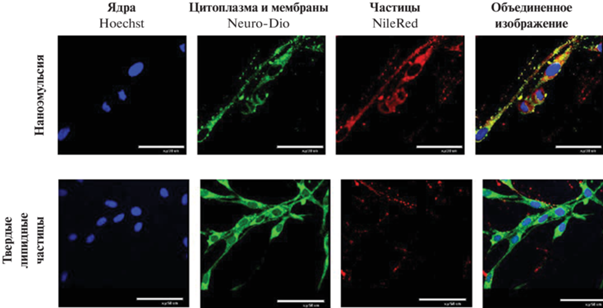
Через 1 ч инкубирования капли НЭ распределялись внутри клеток С6 и накапливались в ядрах. Твердые липидные частицы к этому времени проникали в раковые клетки и распределялись во внутриклеточном матриксе. Различие в скорости проникновения в данном случае было обусловлено разницей в размерах липидных частиц. Так как размер капель НЭ был меньше, чем размер твердых липидных частиц, то скорость их проникновения в клетки оказалась выше.
Аналогичные результаты были получены при контактировании НЭ и твердых липидных частиц с клетками MCF-7. Через 1 ч после начала инкубирования капли НЭ и твердые липидные частицы проникали в клетки (рис. 3). При этом капли НЭ распределялись внутри клеток и накапливались в ядрах. В то время как твердые липидные частицы находились в органеллах, но отсутствовали в ядрах клеток.
Рис. 3.
Клетки MCF-7 после 1 ч инкубирования с НЭ и твердыми липидными частицами. Диаметр капель в НЭ − 50 нм, размер твердых липидных частиц – 200 нм. НЭ и твердые липидные частицы окрашены NileRed, ядра окрашены Hoechst 33258.
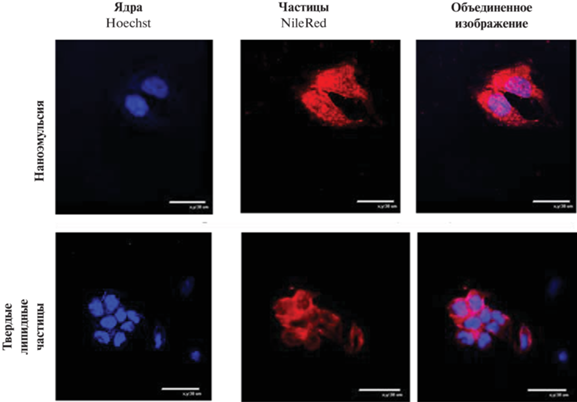
Следует отметить, что накопление липидных наночастиц в ядрах клеток является достоинством при доставке противораковых лекарственных соединений, т.к. это будет приводить к остановке репликации ДНК и последующему апоптозу клеток.
3.3. Цитотоксичность НЭ и ТЛН
Как показали исследования по проникновению в раковые клетки, липидные частицы нанометрового размера через 1 ч не только проникают в клетки, но и накапливаются в ядрах. Поэтому была проведена оценка цитотоксичности НЭ со средним диаметром капель парафинового масла 50 нм и ТЛН из стеариновой кислоты со средним размером 30 нм, аналогичных описанным в разделе 3.1. Оценку цитотоксичности проводили на клеточных линиях MCF-7 и HTC 116. Ненагруженные НЭ и ТЛН инкубировали с клетками MCF-7 и HTC 116 в течение 24 и 48 ч. На рис. 4 представлены дозозависимые кривые для НЭ и ТЛН, по которым были определены IC50 (табл. 1). Из представленных результатов видно, что ТЛН с размером частиц 30 нм проявляли большую цитотоксичность по сравнению с НЭ с размером капель 50 нм. При этом цитотоксичность и НЭ, и ТЛН была низкой, что делает возможным их использование в качестве систем доставки лекарственных соединений.
Рис. 4.
Зависимости доли выживших клеток MCF-7 (а, в) и HTC 116 (б, г) от концентрации НЭ (а, б) и ТЛН (в, г). Диаметр капель в НЭ – 50 нм, ТЛН – 30 нм.
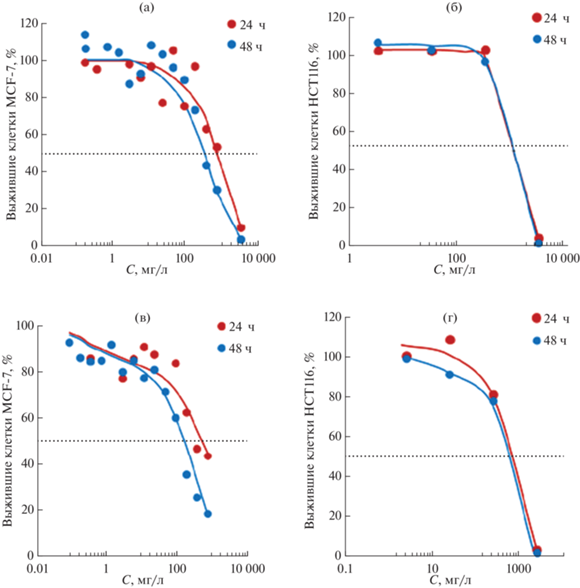
Таблица 1.
IC50 при инкубировании раковых клеток с лекарственными соединениями, НЭ и ТЛН
| Тип липидных наночастиц и лекарственного соединения | Время инкубирования, ч | Тип раковых клеток | IC50, мг/л |
|---|---|---|---|
| НЭ | 24 | MCF-7 | 760 ± 38 |
| HTC 116 | ~1200 | ||
| 48 | MCF-7 | 380 ± 19 | |
| HTC 116 | ~1200 | ||
| ТЛН | 24 | MCF-7 | 525 ± 21 |
| HTC 116 | 655 ± 33 | ||
| 48 | MCF-7 | 157 ± 7 | |
| HTC 116 | 590 ± 37 | ||
| Доксорубицин | 24 | MCF-7 | 1.30 ± 0.06 |
| HTC 116 | 0.60 ± 0.03 | ||
| 48 | MCF-7 | 0.17 ± 0.01 | |
| HTC 116 | 0.14 ± 0.01 | ||
| НЭ + доксорубицин | 24 | MCF-7 | 0.52 ± 0.03 |
| HTC 116 | 0.39 ± 0.02 | ||
| 48 | MCF-7 | 0.16 ± 0.01 | |
| HTC 116 | 0.10 ± 0.01 | ||
| НЭ + тимохинон | 24 | MCF-7 | 7.00 ± 0.50 |
| HTC 116 | 7.00 ± 0.50 | ||
| 48 | MCF-7 | 6.00 ± 0.50 | |
| HTC 116 | 5.00 ± 0.40 | ||
| ТЛН + доксорубицин | 24 | MCF-7 | 0.35 ± 0.02 |
| HTC 116 | 0.34 ± 0.02 | ||
| 48 | MCF-7 | 0.14 ± 0.01 | |
| HTC 116 | 0.08 ± 0.01 | ||
| ТЛН + тимохинон | 24 | MCF-7 | 5.00 ± 0.40 |
| HTC 116 | 5.00 ± 0.40 | ||
| 48 | MCF-7 | 6.00 ± 0.50 | |
| HTC 116 | 5.00 ± 0.40 |
Также в данной работе была исследована цитотоксичность НЭ и ТЛН, нагруженных противоопухолевыми соединениями доксорубицином и тимохиноном. При инкапсулированнии данных лекарственных соединений размер липидных наночастиц практически не изменялся и различался в пределах погрешности измерений.
Тимохинон является липофильным лекарственным соединением и может быть доставлен в клетки только с помощью липидных носителей. Поскольку у него чрезвычайно низкая растворимость в водных средах, определить его цитотоксичность затруднительно. При этом в литературе имеются данные об IC50 тимохинона для клеточной линии MCF-7, которая составляет 16.43 мг/л при инкубировании в течение 24 ч и 6.77 мг/л для 48 ч [42, 43].
Октанольное число доксорубицина по литературным данным составляет от 0.04 до 1.85 [44–47], это свидетельствует о том, что данное соединение, вероятнее всего, распределяется между органической и водной фазами в дисперсиях липидных наночастиц. При этом доксорубицин является амфифильным и адсорбируется на межфазной поверхности липидных наночастиц.
Для определения цитотоксичности доксорубицина были получены дозозависимые кривые для препарата, растворенного в 0.15 М растворе NaCl. При инкубировании в течение 24 ч IC50 доксорубицина составила 1.30 ± 0.06 и 0.60 ± 0.03 мг/л в отношении клеточных линий MCF-7 и HTC 116 соответственно. При инкубировании в течение 48 ч IC50 была равной 0.17 ± 0.01 и 0.14 ± 0.01мг/л для клеточных линий MCF-7 и HTC 116 соответственно (табл. 1).
Цитотоксичность НЭ и ТЛН, нагруженных доксорубицином, была выше, чем у растворенного в физиологическом растворе лекарственного агента. IC50 для НЭ составляла 0.52 ± 0.03 и 0.39 ± 0.02 мг/л при инкубировании 24 ч в отношении клеточных линий MCF-7 и HTC 116 соответственно. IC50 для ТЛН была равной 0.35 ± 0.02 и 0.34 ± 0.02 мг/л при инкубировании 24 ч в отношении клеточных линий MCF-7 и HTC 116 соответственно. Так как при использовании НЭ и ТЛН для гибели раковых клеток требовались более низкие концентрации действующего вещества по сравнению со свободным доксорубицином, растворенным в водной среде, это косвенно подтверждает то, что данное лекарственное соединение доставлялось в клетки в том числе и в составе липидных наночастиц. Таким образом, для достижения необходимого терапевтического эффекта будет требоваться меньшее количество доксорубицина, что будет способствовать уменьшению побочных эффектов.
Цитотоксичность НЭ и ТЛН, нагруженных тимохиноном, была ниже по сравнению с цитотоксичностью липидныx наночастиц с доксорубицином. Это соответствует литературным данным о разной цитотоксичности данных соединений. IC50 для НЭ составляла 7.0 ± 0.5 мг/л при инкубировании 24 ч в отношении клеточных линий MCF-7 и HTC 116 (табл. 1). IC50 для ТЛН составляла 5.0 ± 0.4 при инкубировании в течение 24 ч в отношении клеточных линий MCF-7 и HTC 116.
Следует отметить, что цитотоксичность ТЛН, нагруженных лекарственными соединениями, была немного выше, чем цитотоксичность нагруженных НЭ. Это обусловлено тем, что размер ТЛН из стеариновой кислоты был немного меньше, чем размер капель парафинового масла в НЭ.
4. ЗАКЛЮЧЕНИЕ
Доставка липофильных лекарственных соединений, в том числе и тимохинона, возможна только при инкапсулировании их в липидных наночастицах. Применение амфифильного доксорубицина, растворенного в водной среде, сопровождается большим количеством побочных эффектов. Использование НЭ и ТЛН в качестве систем доставки позволяет не только увеличить биодоступность лекарственных соединений, но и снизить их отрицательное воздействие на здоровые ткани.
Исследования показали, что НЭ с размером капель масла ~50 нм и суспензии ТЛН размером ~30 нм, стабилизированные Tween 60 и Span 60, являются устойчивыми к агрегации в течение длительного времени.
Скорость проникновения таких липидных частиц с одинаковой структурой поверхностного слоя в раковые клетки зависит от их размера. Более крупные липидные частицы со средним размером ~200 нм через 1 ч инкубирования проникают внутрь клеток и распределялются во внутриклеточной цитоплазме, более мелкие со средним размером ~50 нм за тот же интервал времени концентрируются в ядрах раковых клеток. Установленный факт накопления липидных наночастиц размером менее 100 нм в ядрах клеток является преимуществом таких систем при доставке противораковых лекарственных соединений, т.к. это будет приводить к остановке репликации ДНК и последующему апоптозу клеток.
Исследования показали, что ненагруженные липидные наночастицы проявляют низкую цитотоксичность. В то время как цитотоксичность нагруженных доксорубицином или тимохиноном НЭ и ТЛН выше, чем у неинкапсулированных лекарственных соединений. Полученные результаты демонстрируют перспективность использования НЭ с парафиновым маслом и ТЛН из стеариновой кислоты, стабилизированных Tween 60 и Span 60, в качестве носителей липофильных и амфифильных лекарственных соединений, в том числе доксорубицина и тимохинона.
Список литературы
McClements D.J., Decker E.A., Weiss J. Emulsion-based delivery systems for lipophilic bioactive components // J. Food Sci. 2007. V. 72. № 8. P. 109–124. https://doi.org/10.1111/j.1750-3841.2007.00507.x
Salah E., Abouelfetouh M.M., Pan Y., Chen D., Xie S. Solid lipid nanoparticles for enhanced oral absorption: A review // Colloids Surf. B. 2020. V. 196. 111305. https://doi.org/10.1016/j.colsurfb.2020.111305
Koroleva M.Y., Yurtov E.V. Nanoemulsions: The properties, methods of preparation and promising applications // Russ. Chem. Rev. 2012. V. 81. № 1. P. 21–43. https://doi.org/10.1070/RC2012v081n01ABEH004219
Koroleva M., Nagovitsina T., Yurtov E. Nanoemulsions stabilized by non-ionic surfactants: Stability and degradation mechanisms // PCCP. 2018. V. 20. P. 10369–10377. https://doi.org/10.1039/C7CP07626F
Mirgorodskaya A.B., Koroleva M.Y., Kushnazarova R.A., Mishchenko E.V., Petrov K.A., Lenina O.A., Vyshtakalyuk A.B., Voloshina A.D., Zakharova L.Y. Microemulsions and nanoemulsions modified with cationic surfactants for improving the solubility and therapeutic efficacy of loaded drug indomethacin // Nanotechnology. 2022. V. 33. 155103. https://doi.org/10.1088/1361-6528/ac467d
Koroleva M., Portnaya I., Mischenko E., Abutbul-Ionita I., Kolik-Shmuel L., Danino D. Solid lipid nanoparticles and nanoemulsions with solid shell: Physical and thermal stability // J. Colloid Interface Sci. 2022. V. 610. № 3. P. 61–69. https://doi.org/10.1016/j.jcis.2021.12.010
Мищенко Е.В., Тимофеева Е.Е., Артамонов А.С., Портная И.Б., Королева М.Ю. Наноэмульсии и нанокапсулы с олеиновой кислотой // Коллоид. журн. 2022. Т. 81. № 1. С. 67–73. https://doi.org/10.31857/S0023291222010086
Koroleva M.Yu., Tokarev A.M., Yurtov E.V. Simulations of emulsion stabilization by silica nanoparticles // Mendeleev Communications. 2017. V. 27. № 5. P. 518–520. https://doi.org/10.1016/j.mencom.2017.09.030
O’Shaughnessy J.A. Pegylated liposomal doxorubicin in the treatment of breast cancer // Clin. Breast Cancer. 2003. V. 4. P. 318−328. https://doi.org/10.3816/cbc.2003.n.037
Perez A.T., Domenech G.H., Frankel C., Vogel C.L. Pegylated liposomal doxorubicin (Doxil) for metastatic breast cancer: the Cancer Research Network, Inc., experience // Cancer Invest. 2002. V. 20. P. 22–29. https://doi.org/10.1081/cnv-120014883
Symon Z., Peyser A., Tzemach D., Lyass O., Sucher E., Shezen E., Gabizon A. Selective delivery of doxorubicin to patients with breast carcinoma metastases by stealth liposomes // Cancer. 1999. V. 86. P. 72–78.
Ballout F., Habli Z., Rahal O.N., Fatfat M., Gali-Muhtasib H. Thymoquinone-based nanotechnology for cancer therapy // Drug Discov. Today. 2018. V. 23. № 5. P. 1089–1098. https://doi.org/10.1016/j.drudis.2018.01.043
Salem A.A., El Haty I.A., Abdou I.M., Mu Y. Interaction of human telomeric G-quadruplex DNA with thymoquinone: A possible mechanism for thymoquinone anticancer effect // Biochimica Biophysica Acta. 2015. V. 1850. № 2. P. 329–342. https://doi.org/10.1016/j.bbagen.2014.10.018
Alaaeldin E., Mostafa M., Mansour H.F., Soliman G.M. Spanlastics as an efficient delivery system for the enhancement of thymoquinone anticancer efficacy: Fabrication and cytotoxic studies against breast cancer cell lines // J. Drug Delivery Sci. Technol. 2021. V. 65. 102725. https://doi.org/10.1016/j.jddst.2021.102725
Afrose S.S., Junaid M., Akter Y., Tania M., Zheng M., Khan M. A. Targeting kinases with thymoquinone: a molecular approach to cancer therapeutics // Drug Discovery Today. 2020. V. 25. № 12. P. 2294–2306. https://doi.org/10.1016/j.drudis.2020.07.019
Fatfat M., Fakhoury I., Habli Z., Mismar R., Gali-Muhtasib, H. Thymoquinone enhances the anticancer activity of doxorubicin against adult T-cell leukemia in vitro and in vivo through ROS-dependent mechanisms // Life Sci. 2019. V. 232. P. 116628. https://doi.org/10.1016/j.lfs.2019.116628
Zheng G., Zheng M., Yang B., Fu H., Li Y. Improving breast cancer therapy using doxorubicin loaded solid lipid nanoparticles: Synthesis of a novel arginine-glycine-aspartic tripeptide conjugated, pH sensitive lipid and evaluation of the nanomedicine in vitro and in vivo // Biomed. Pharmacotherapy. 2019. V. 116. P. 109006. https://doi.org/10.1016/j.biopha.2019.109006
Ying X.Y., Cui D., Yu L., Du Y.Z. Solid lipid nanoparticles modified with chitosan oligosaccharides for the controlled release of doxorubicin // Carbohydrate Polym. 2011. V. 84. P. 1357–1364. https://doi.org/10.1016/j.carbpol.2011.01.037
Jain A., Kesharwani P., Garg N.K., Jain A., Jain S.A., Jain A.K., Jain A.K., Nirbhavane P., Ghanghoria R., Tyagi R.K., Katare O.P. Galactose engineered solid lipid nanoparticles for targeted delivery of doxorubicin // Colloids Surf. B. 2015. V. 134. P. 47–58. https://doi.org/10.1016/j.colsurfb.2015.06.027
Subedi R.K., Kang K.W., Choi H.K. Preparation and characterization of solid lipid nanoparticles loaded with doxorubicin // Eur. J. Pharm. Sci. 2009. V. 37. № 3. P. 508–513. https://doi.org/10.1016/j.ejps.2009.04.008
Oliveira M.S., Aryasomayajula B., Pattni B., Mussi S.V., Ferreira L.A.M., Torchilin V.P. Solid lipid nanoparticles co-loaded with doxorubicin and α-tocopherol succinate are effective against drug-resistant cancer cells in monolayer and 3-D spheroid cancer cell models // Int. J. Pharm. 2016. V. 512. № 1. P. 202–300. https://doi.org/10.1016/j.ijpharm.2016.08.049
Battaglia L., Gallarate M., Peira E., Chirio D., Muntoni E., Biasibetti E., Capucchio M.T., Valazza A., Panciani P.P., Lanotte M., Schiffer D., Annovazzi L., Caldera V., Mellai M., Riganti C. Solid lipid nanoparticles for potential doxorubicin delivery in glioblastoma treatment: Preliminary in vitro studies // J. Pharm. Sci. 2014. V. 103. № 7. P. 2157–2165. https://doi.org/10.1002/jps.24002
Kuo Y.C., Lee I.H. Delivery of doxorubicin to glioblastoma multiforme in vitro using solid lipid nanoparticles with surface aprotinin and melanotransferrin antibody for enhanced chemotherapy // J. Taiwan Institute Chem. Eng, 2016. V. 61. P. 32–45. https://doi.org/10.1016/j.jtice.2015.12.012
Kuo Y.C., Liang C.T. Catanionic solid lipid nanoparticles carrying doxorubicin for inhibiting the growth of U87MG cells // Colloids Surf. B. V. 85. № 2. P. 131–137. https://doi.org/10.1016/j.colsurfb.2011.02.011
Miglietta A., Cavalli R., Bocca C., Gabriel L., Gasco R.M. Cellular uptake and cytotoxicity of solid lipid nanospheres (SLN) incorporating doxorubicin or paclitaxel // Int. J. Pharm. 2000. V. 210. № 1–2. P. 61–67. https://doi.org/10.1016/s0378-5173(00)00562-7
Ramachandran S., Thangarajan S. A novel therapeutic application of solid lipid nanoparticles encapsulated thymoquinone (TQ-SLNs) on 3-nitroproponic acid induced Huntington’s disease-like symptoms in wistar rats // Chem. Biol. Interact. 2016. V. 256. P. 25–36. https://doi.org/10.1016/j.cbi.2016.05.020
Ali A., Ali S., Aqil M., Imam S.S., Ahad A., Qadir A. Thymoquinone loaded dermal lipid nano particles: Box Behnken design optimization to preclinical psoriasis assessment // J. Drug Delivery Sci. Technol. 2019. V. 52. P. 713–721. https://doi.org/10.1016/j.jddst.2019.05.041
Alam M., Zameer S., Najmi A.K., Ahmad F.J., Imam S.S., Akhtar M. Thymoquinone loaded solid lipid nanoparticles demonstrated antidepressant-like activity in rats via indoleamine 2,3-dioxygenase pathway // Drug Research. 2020. V. 70. № 5. P. 1131–7793. https://doi.org/10.1055/a-1131-7793
Qizilbash F.F., Ashhar M.U., Zafar A., Qamar Z., Annu A.J., Baboota S., Ghoneim M.M. Alshehri S., Ali A. Thymoquinone-enriched naringenin-loaded nanostructured lipid carrier for brain delivery via nasal route: In vitro prospect and in vivo therapeutic efficacy for the treatment of depression // Pharm. 2022. V. 14. № 3. P. 656. https://doi.org/10.3390/pharmaceutics14030656
Radwan M.F., El-Moselhy M.A., Alarif W.M., Orif M., Alruwaili N.K., Alhakamy N.A. Optimization of thymoquinone-loaded self-nanoemulsion for management of indomethacin-induced ulcer // Dose-Response. 2021. V. 19. № 1. 15593258211013655. https://doi.org/10.1177/15593258211013655
Desai J., Thakkar H. Enhanced oral bioavailability and brain uptake of Darunavir using lipid nanoemulsion formulation // Colloids Surf. B. 2018. V. 175. P. 143–149. https://doi.org/10.1016/j.colsurfb.2018.11.057
Chawla J.S., Amiji M.M. Biodegradable poly(ε-caprolactone) nanoparticles for tumor-targeted delivery of tamoxifen // Int. J. Pharm. 2002. V. 249. № 1–2. P. 127–138. https://doi.org/10.1016/s0378-5173(02)00483-0
Granja A., Nunes C., Sousa C.T., Reis S. Folate receptor-mediated delivery of mitoxantrone-loaded solid lipid nanoparticles to breast cancer cells // Biomed. Pharmacotherapy. 2022. V. 154. P. 113525. https://doi.org/10.1016/j.biopha.2022.113525
Parvez S., Karole A., Mudavath S.L. Transport mechanism of hydroxy-propyl-beta-cyclodextrin modified solid lipid nanoparticles across human epithelial cells for the oral absorption of antileishmanial drugs // BBA. 2022. V. 1866. № 8. P. 130157. https://doi.org/10.1016/j.bbagen.2022.130157
Vighi E., Montanari M., Ruozi B., Tosi G., Magli A., Leo E. Nuclear localization of cationic solid lipid nanoparticles containing Protamine as transfection promoter // Eur. J. Pharm. Biopharm. 2010. V. 76. № 3. P. 384–393. https://doi.org/10.1016/j.ejpb.2010.07.012
Gao Y., Cheng X., Wang Z., Wang J., Gao T., Li P., Kong M., Chen X. Transdermal delivery of 10,11-methylenedioxycamptothecin by hyaluronic acid based nanoemulsion for inhibition of keloid fibroblast // Carbohydr. Polym. 2014. V. 112. P. 376–386. https://doi.org/10.1016/j.carbpol.2014.05.026
Periasamy V.S., Athinarayanan J., Alshatwi, A.A. Anticancer activity of an ultrasonic nanoemulsion formulation of Nigella sativa L. essential oil on human breast cancer cells // Ultrason. Sonochem. 2016. V. 31. P. 449–455. https://doi.org/10.1016/j.ultsonch.2016.01.035
Miyake M., Kakizawa Y., Tobori N., Kurioka M., Tabuchi N., Kon R., Shimokawa N., Tsujino, Y., Takagi M. Membrane permeation of giant unilamellar vesicles and corneal epithelial cells with lipophilic vitamin nanoemulsions // Colloids Surf. B. 2018. V. 169. P. 444–452. https://doi.org/10.1016/j.colsurfb.2018.05.052
Rodrigues G.B., Brancini G.T.P., Pinto M.R., Primo F.L., Wainwright M., Tedesco A.C., Braga G.Ú.L. Photodynamic inactivation of Candida albicans and Candida tropicalis with aluminum phthalocyanine chloride nanoemulsion // Fungal Biology. 2020. V. 124. № 5. P. 297–303. https://doi.org/10.1016/j.funbio.2019.08.004
Izquierdo P., Feng J., Esquena J., Tadros T.F., Dederen J.C., Garcia M.J., Azemar N., Solans C. The influence of surfactant mixing ratio on nano-emulsion formation by the pit method // J. Colloid Interface Sci. 2005. V. 285. № 1. P. 388–394. https://doi.org/10.1016/j.jcis.2004.10.047
Joshi M.D., Muller R.H. Lipid nanoparticles for parenteral delivery of actives // Eur. J. Pharm. Biopharm. 2009. V. 71. № 2. P. 161–172. https://doi.org/10.1016/j.ejpb.2008.09.003
Salmani J.M., Asghar S., Lv H., Zhou J. Aqueous solubility and degradation kinetics of the phytochemical anticancer thymoquinone; Probing the effects of solvents, pH and light // Molecules. 2014. V. 19. № 5. P. 5925–5939. https://doi.org/10.3390/molecules19055925
Motaghed M., Al-Hassan F.M., Hamid, S.S. Cellular responses with thymoquinone treatment in human breast cancer cell line MCF-7 // Pharmacognosy Res. 2012. V. 5. № 3. P. 200–206. https://doi.org/10.4103/0974-8490.112428
Parisi C., Moret F., Fraix A., Menilli L., Failla M., Sodano F., Conte C., Quaglia F., Reddi E., Sortino S. Doxorubicin–NO releaser molecular hybrid activatable by green light to overcome resistance in breast cancer cells // ACS Omega. 2022. V. 7. № 9. P. 7452–7459. https://doi.org/10.1021/acsomega.1c03988
Tian Y., Tam M.K., Hatton, T.A., Bromberg, L. Titration microcalorimetry study: Interaction of drug and ionic microgel system // Chemistry. 2004. P. 1–5. http://hdl.handle.net/1721.1/3953.
Akter H., Rashid Md.M., Islam Md.S., Hossen Md.A., Rahman Md.A., Algheshairy R.M., Almujaydil M.S., Alharbi H.F., Alnajeebi A.M. Biometabolites of Tamarindus indica play a remarkable cardioprotective role as a functional food in doxorubicin-induced cardiotoxicity models // J. Func. Foods. 2022. V. 96. P. 105212. https://doi.org/10.1016/j.jff.2022.105212
Hansch C., Leo A., Hoekman D. Exploring QSAR: Hydrophobic, Electronic, and Steric Constants. Washington: American Chemical Society, 1995.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал



