Журнал аналитической химии, 2022, T. 77, № 8, стр. 721-733
Потенциометрические сенсоры, чувствительные к некоторым цефалоспориновым антибиотикам: свойства, применение
Е. Г. Кулапина a, *, О. И. Кулапина b, Е. Н. Чердакова a, В. Д. Анкина b
a Саратовский национальный исследовательский государственный университет имени Н.Г. Чернышевского
410012 Саратов, ул. Астраханская, 83, Россия
b Саратовский государственный медицинский университет им. В.И. Разумовского
410012 Саратов, ул. Б. Казачья, 112, Россия
* E-mail: kulapinaeg@mail.ru
Поступила в редакцию 30.06.2021
После доработки 10.08.2021
Принята к публикации 11.08.2021
- EDN: RXHJRC
- DOI: 10.31857/S0044450222080059
Аннотация
Разработаны немодифицированные и модифицированные твердоконтактные потенциометрические сенсоры (трубчатые и планарные) для определения некоторых цефалоспориновых антибиотиков в водных, биологических средах, фармацевтических препаратах. В качестве активных компонентов мембран использовали соединения тетраалкиламмония с комплексными соединениями серебро(I)–β-lac[Ag(β-lac)2], в качестве модификаторов – углеродные нанотрубки, полианилин, наночастицы оксида меди и NiZnFeO. Определены основные электроаналитические и операционные характеристики исследуемых сенсоров в водных растворах антибиотиков и на фоне жидкости ротовой полости. Сенсоры обеспечивают широкий диапазон определяемых содержаний антибиотиков 1 × 10–4 (1 × 10–5)–1 × 10–2 (0.1) М, значения сmin = n × 10–5 (1 × 10–6) М. Модификаторы стабилизируют электродный потенциал и осуществляют функцию медиатора электронного переноса, что приводит к улучшению электроаналитических характеристик сенсоров. Показана возможность применения твердоконтактных сенсоров для определения основного вещества в лекарственных препаратах различных производителей, в модельных водных растворах и ротовой жидкости с внесенными добавками антибиотиков, а также в мультисенсорных системах типа “электронный язык” для раздельного определения цефалоспориновых антибиотиков в двухкомпонентных смесях.
β-Лактамные антибиотики широко используют в медицинской практике для лечения различных инфекционно-соматических патологий. Широкое применение антибиотиков привело к развитию резистентных штаммов основных патогенов. Исследователи и клиницисты стараются решить эту проблему следующими путями: синтезом антибиотиков новых поколений, созданием ингибиторов ß-лактамаз, комбинированием уже известных антибиотиков, созданием новых лекарственных форм и изменением режима дозирования [1], что, в свою очередь, требует определения концентрации антибиотиков в диагностически значимых биосредах экспрессным и доступным для клинических лабораторий методом. Цефалоспорины различаются по фармакокинетическим параметрам, по степени всасывания при разных путях введения, скорости наступления эффекта и длительности действия, а следовательно, по необходимой частоте введения препарата, метаболизму и элиминации [2, 3].
Исследуемые в настоящей работе цефалоспорины относятся к поколениям I (цефазолин, цефалексин), II – цефуроксим, цефуроксим аксетил, III – цефотаксим, цефтриаксон, цефиксим, IV – цефепим. Цефалоспорины IV поколения – цефепим; цефпиром − высокоэффективные антибиотики с биполярной структурой. Цефемовое ядро этих антибиотиков несет отрицательный заряд, четвертичный атом азота циклопентопиридиновой группы — положительный заряд, что придает молекуле структуру цвиттер-иона [4]. Они являются парентеральными лекарственными средствами, частично противостоят гидролизу плазмидными ß-лактамазами [5, 6].
Несмотря на все достоинства цефалоспориновых антибиотиков IV поколения, отмечено увеличение смертности больных с нейтропенической лихорадкой при лечении цефепимом [7, 8], а также при инфекциях кожи и мягких тканей, в то же время этот антибиотик остается действенным средством лечений больных с пневмониями и инфекциями других локализаций как в виде монотерапии, так и, при необходимости, в сочетании с другими антибиотиками (например, метронидазолом) [4].
Цефалоспориновые антибиотики определяют в сыворотке и плазме крови методами жидкостной хроматографии с УФ-детектированием и масс-спектрометрии [2, 3], требующими сложной дорогостоящей аппаратуры. Экспрессное определение антибиотиков в биосредах необходимо для исследования фармакокинетики препаратов, выбора оптимальной терапевтической дозы. Для этих целей перспективно применение потенциометрических сенсоров [2, 3, 9–14].
На кафедре аналитической химии СГУ разработаны жидкоконтактные сенсоры, чувствительные к цефалексиму, цефуроксиму, цефиксиму [3, 15, 16], на основе соединений тетраалкиламмония с комплексом серебро(I)–β-лактамный антибиотик; их основной недостаток – возможность использования только в вертикальном положении [3]. Твердоконтактные и планарные сенсоры позволяют проводить исследования при любой ориентации в пространстве, в микрообъемах проб, что важно для анализа биологических жидкостей. На электрохимические характеристики сенсоров влияют способы изготовления и составы мембран. В зависимости от активного материала и модификаторов поверхности можно конструировать планарные сенсоры для определения неорганических и органических соединений в различных объектах [17, 18].
Угольно-пастовые электроды, модифицированные рутением с диоксидом титана, применяют для определения клозапина в фармпрепаратах и в моче человека [19]; наночастицами оксида никеля – для определения сульфасалазина [20] в фармпрепаратах; наночастицами палладия – для определения тербуталина, сальбутамола, рактопамина, кленбутерола [21] в свином мясе, моче человека; наночастицами оксида цинка – для определения ацетаминофена в сыворотке крови человека [22]. В качестве модификаторов для определения дофамина в сыворотке крови и в моче человека используют оксид графена и наночастицы золота [23], для определения накроксена в фармпрепаратах и в моче человека – углеродное нановолокно и наночастицы золота [24]. Электроды на основе углеродных нанотрубок, пирографита, оксида графена, сажи использовали для определения метотрексата, клиндамицина [25] в фармпрепаратах.
Авторами работы [26] для определения тиохинолина предложены тиолчувствительные комбинированные планарные сенсоры, модифицированные слоем диоксида марганца. Предел обнаружения составляет 1 × 10–10 М. Для определения бисопролол фумарата в фармацевтических образцах и биологических жидкостях использовали угольно-пастовые электроды на основе β-циклодекстрина [27]. Модифицированные углеродной пастой планарные сенсоры предложены для определения гидрохлорида лидокаина, доксициклина [28] в фармацевтических препаратах и биологических жидкостях (моча и сыворотка). Разработаны [29–32] немодифицированные и модифицированные твердоконтактные и планарные потенциометрические сенсоры для определения некоторых цефалоспориновых антибиотиков (модификаторы – углеродные нанотрубки, наночастицы NiZnFeO, CuO, полианилин).
Анализ литературы показал, что в качестве модификаторов поверхности планарных сенсоров используют токопроводящие полимеры, углеродные нанотрубки и различные наночастицы (оксиды металлов, сульфиды меди и др.). В большинстве случаев модифицирование сенсоров осуществляют непосредственным введением модификатора в материал электрода. Данный способ имеет ряд преимуществ: не изменяется состав электродноактивного вещества, остается постоянным контакт модификатора с анализируемым раствором и проводником. Введение модификаторов в мембраны сенсоров улучшает их электроаналитические свойства [29–32].
С помощью сенсоров не всегда можно избирательно определить конкретное соединение. Для решения проблемы селективности разработаны мультисенсорные системы типа “электронный язык” и “электронный нос”. “Электронный язык” − это система электрохимических сенсоров, способная обнаруживать индивидуальные вещества в смесях сложного состава [33]. Мультисенсорные системы включают массив сенсоров для определения веществ с дальнейшей обработкой многомерных данных хемометрическими методами, что позволяет определять несколько компонентов смеси при их совместном присутствии [34].
Массивы сенсоров применены для классификации фармацевтических препаратов по веществам, маскирующим вкус [35], для определения уровня креатинина в моче человека [36], метамизолата натрия, псевдоэфедринсульфата, гипромеллозы и кармеллозы в фармацевтических препаратах [37, 38]. Массив из шести потенциометрических сенсоров использовали для оценки маскирования вкуса диклофенака циклодекстрином, ацесульфамом, сахарозой, сахаринатом натрия и лактозой [39]. Авторами работы [40] предложена мультисенсорная система для обнаружения остатков антибиотиков в коровьем молоке, для идентификации фармацевтических препаратов различных фирм, выявления фальсификатов и аналогов лекарственных средств, содержащих бисопролол, инсулин и его аналог. Предложен [41, 42] массив из модифицированных стеклоуглеродных электродов. Для обработки аналитических сигналов использовали методы [43, 44], метод главных компонент [38] дискриминантный анализ [39], метод опорных векторов [36], а также нейронные сети [35], регрессии частичных наименьших квадратов [42]. Массивы потенциометрических сенсоров для раздельного определения пенициллиновых антибиотиков предложены авторами работ [45, 46].
В настоящей работе систематизированы результаты исследований по жидкостным, немодифицированным и модифицированным твердоконтактным (трубчатым и планарным, “screen-printed”) сенсорам; модификаторы – полианилин, углеродные нанотрубки, наночастицы NiZnFeO и CuO; активные компоненты мембран – ионные ассоциаты тетраалкиламмония с комплексными соединениями серебро(I)–β-лактам.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования. В качестве аналитов изучали цефалоспориновые антибиотики цефазолин, цефалексин, цефуроксим, цефуроксим аксетил, цефотаксим, цефиксим, цефтриаксон, цефепим фармакопейной чистоты (табл. 1). Исходные 0.1 М водные растворы антибиотиков готовили по точным навескам препаратов в дистиллированной воде; рабочие (свежеприготовленные) 1 × 10–6–0.01 М растворы получали последовательным разбавлением. Кислотность свежеприготовленных водных растворов цефотаксима, цефазолина, цефуроксима с изменением их концентрации не меняется (рН 6.0).
Таблица 1.
Названия и формулы цефалоспориновых антибиотиков и компонентов мембран сенсоров
| Антибиотик | Сокращение | Формула |
|---|---|---|
| Цефазолин; ОАО “Биосинтез” (Курган) | Cef |  |
| Цефалексин, капсулы; “Хемофарм” (Москва) | Cefl |  |
| Цефтриаксон; ОАО “Биосинтез” (Курган) |
Ceftr |  |
| Цефотаксим; ЗАО ф.ф. “Лекко” |
Ceftx |  |
| Цефиксим, гранулы; “Гедеон Рихтер” (Москва) |
Cefix |  |
| Цефуроксим (цефурабол); ООО “АБолмед” (Новосибирск) |
Cefur1 | 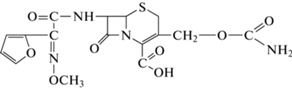 |
| Цефуроксим аксетил, таблетки; “Glaxo Operation UK Limited” (UK) |
Cefur2 |  |
| Цефепим; “Линкольн Парентеральс” (Индия) |
Cefet |  |
| Диметилдистеарил-аммония хлорид | ДМДСА |  |
| Тетрадециламмония бромид | ТДА |  |
В качестве объекта исследования выбрали жидкость ротовой полости (ЖРП) (ротовая жидкость или смешанная слюна) – легкодоступную биологическую жидкость человека. Она представляет интерес для изучения фармакокинетики антибиотиков в связи с простотой и неинвазивностью отбора проб [47–49]. Жидкость ротовой полости содержит 98–99% воды, около 0.5% неорганических солей (Mn2+, Cu2+, Fe2+, Mg2+, Ca2+, Na+, K+, F–, Cl–, ${\text{HCO}}_{3}^{ - }$, ${\text{SO}}_{4}^{{2 - }}$ и др.) и до 1% органических веществ (белки, мочевина, аммиак, креатин, остатки пищи и др.) [49]. Коэффициенты потенциометрической селективности цефалоспориновых антибиотиков по отношению к неорганическим ионам, входящих в состав ЖРП, позволяют проводить их определение в ротовой жидкости [15, 29, 30]. Методика сбора ЖРП и способ ее пробоподготовки описаны в работе [29]. Пробу ЖРП центрифугировали в течение 15 мин при 3500 об/мин; сенсоры предварительно кондиционировали в ЖРП практически здорового человека в течение 20–30 мин.
Получение материалов сенсоров. Синтез электродноактивных компонентов (ЭАК) и получение мембран проводили согласно рекомендациям [29]. Учитывая сложность системы равновесий с участием цефепима необходимо было создать кислотность, при которой антибиотик существует в виде катиона (рН 2), поэтому ЭАК синтезировали из кислого раствора. Получали ЭАК смешением 50 мл 0.01 М тетрафенилбората натрия (ТФБ), 50 мл 0.01 М раствора цефепима и 5 мл 0.1 М НСl в стеклянном стакане. Осадок образовывался в течение суток. Затем осадок центрифугировали и высушивали в сушильном шкафу при 30°С в течение 2–3 ч. Попытки синтезировать соединение цефепим−катионы тетраалкиламмония (ТАА) не дали положительных результатов, так как в щелочной и нейтральной средах цефепим существует в виде цвиттер-иона [50].
В качестве ЭАК в твердоконтактных и планарных сенсорах использовали ионные ассоциаты тетрадециламмония и диметилдистеариламмония с комплексными соединениями серебро(I)–ß-лактам [Ag(ß-lac)n]ТАА; сЭАК = 1–3%. Для стабилизации электродного потенциала твердоконтактных потенциометрических сенсоров в роли ионно-электронного трансдьютера использовали электропроводящий полимер полианилин (ПАНИ) (Эмеральдин, Турция), а также наночастицы оксида меди (d = 50 нм) (Sigma-Aldrich), NiZnFeO и углеродные нанотрубки. Модификаторы вносили непосредственно в мембрану или в углеродсодержащие чернила с ЭАК; соотношение ЭАК−модификатор составляло 2 : 1 (трубчатые) и 1 : 1 (планарные). Перед измерениями трубчатые сенсоры кондиционировали в 1 × 10–3 М растворах соответствующих антибиотиков в течение 24 ч, планарные – 1 ч для получения быстрого, воспроизводимого отклика. Синтез ЭАК, приготовление реактивов, изготовление углеродсодержащих чернил и screen-printed сенсоров, аппаратура описаны в работе [31].
Методы исследования. Для измерения ЭДС использовали элементы с переносом типа:
Контакт между полуэлементами осуществлялся через солевой мостик, заполненный насыщенным раствором хлорида калия.
ЭДС цепи измеряли с помощью иономера Эксперт-001-3(0.1) при 20 ± 3°С (погрешность измерения ЭДС ±1 мВ); электрод сравнения – стандартный хлоридсеребряный ЭВЛ-1М. В анализируемых растворах ЭДС измеряли от меньшей концентрации к большей. Для ускорения достижения постоянного потенциала внешний раствор перемешивали магнитной мешалкой.
Время установления стационарного потенциала сенсоров (время отклика (t0.95) определяли при скачкообразном изменении концентраций антибиотиков на порядок величины в 1 × 10–4–0.1 М растворах согласно рекомендациям ИЮПАК [51, 52]. Коэффициенты потенциометрической селективности (Кi/j) оценивали методом бионных потенциалов и смешанных растворов [53].
Для определения срока службы сенсоров регистрировали электродные функции в свежеприготовленных растворах антибиотиков на протяжении длительного времени и по изменению угла наклона судили о чувствительности данных электродов к антибиотикам.
Спектрофотометрические измерения проводили на спектрофотометре Shimadzu UV-1800, совмещенном с IВМ РС, использовали кюветы из кварцевого стекла. Для измерения рН применяли рН-метр рХ-150Мn, погрешность измерения 0.01 рН. Для создания определенного значения рН к стандартным растворам антибиотиков добавляли 0.1 М НСl или 0.1 М NaOH. Ионную силу раствора μ = 0.1 создавали добавлением 0.1 М NaCl. Для отделения белковых компонентов из ротовой жидкости использовали центрифугу ЦЛМИ-Р-10-0.1 “Элекон”. Пробу ЖРП центрифугировали в течение 10–20 мин при 3500 об/мин. В подготовленные пробы ЖРП вносили различные добавки растворов антибиотиков. Концентрацию антибиотиков в ЖРП находили по градуированному графику. Статистическую обработку результатов проводили согласно рекомендациям [54, 55].
Для исследования объемных свойств мембран под током использовали четырехэлектродную схему, состоящую из пары платиновых (токопроводящих) и пары хлоридсеребряных (регистрирующих) электродов. Измерения проводили в гальваностатическом режиме при силе тока 5 мкА в течение 3 ч. Направление тока поляризации изменяли каждый час. При этом оценивали падение напряжения на мембране при прохождении через ячейку постоянного тока и электрическое сопротивление мембран, контактирующих с растворами антибиотиков различных концентраций.
Сенсоры использовали для определения антибиотиков в модельных растворах, ЖРП, лекарственных препаратах различных производителей, основного вещества в препаратах “Зиннат”, “Цефалексин”, в мультисенсорных системах типа “электронный язык” для раздельного определения цефалоспориновых антибиотиков в двухкомпонентных модельных системах [45, 46], контроля фармакокинетики цефуроксим аксетила по динамике его распределения в ЖРП [56]. Содержание антибиотика в модельных водных растворах, ротовой жидкости, лекарственных препаратах определяли прямой потенциометрией (способом градуировочного графика или способом добавок); правильность контролировали методом введено–найдено.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Цефазолин и цефуроксим – антибиотики кислотного типа, полностью диссоциируют при рН 5; цефотаксим, цефтриаксон, цефалексин, цефиксим – амфотерные антибиотики, имеющие в своей структуре карбоксильную, аминную и аминотиазольную группы. Эти антибиотики существуют в виде катиона (сильнокислая среда), цвиттер-иона (слабокислая среда) и аниона (нейтральная и слабощелочная среда). Цефалоспорины подвержены гидролизу: при раскрытии ß-лактамного кольца образуется 7-аминоцефалоспорановая кислота [1]. Цефуроксим аксетил (эфир цефуроксима) гидролизуется до цефуроксима (в водной среде и кишечнике) [57].
Существенной особенностью строения цефалоспориновых антибиотиков является большая доля гетероатомов (наличие групп −ОН, −NH2, −S–, и др.), т.е. это потенциально комплексообразующие реагенты. Известно [58], что только ион серебра(I) образует отрицательно заряженные комплексные соединения с ß-лактамами. Состав и константы образования комплексов исследуемых антибиотиков с ионами серебра(I) определены методами спектрофотометрии и потенциометрии [59]. В слабокислой среде цефазолин, цефотаксим образуют комплексы стехиометрического состава 1 : 1, в щелочной среде эти же антибиотики взаимодействуют с серебром(I) с образованием билигандных заряженных комплексных соединений (${\text{АgL}}_{2}^{ - }$). Константы устойчивости соединений ${\text{Аg({\ss} - lac}})_{2}^{ - }$ равны: lg K = 7.56 (цефазолин), lg K = 7.35 (цефотаксим), lg K = 7.56 (цефтриаксон), lg K = 7.39 (цефалексин) [59]. Комплексные соединения серебра(I) с цефалоспоринами использовали в качестве ЭАК мембран потенциометрических сенсоров, противоионами являлись катионы тетрадециламмония (ТДА); произведения растворимости [Аg(ß-lac)2]ТДА равны соответственно 1.9 × 10–8 и 2.1 × 10–8 для цефазолина и цефотаксима, для цефепима Cefep−ТФБ Ks = (9.8 ± 0.1) × 10–9, а в мембранной фазе (4.0 ± 0.2) × 10–3 [16, 59].
Рассмотрим основные электрохимические характеристики сенсоров на основе [Аg(ß-lac)2]ТДА. Зависимости ЭДС от концентрации антибиотиков линейны в интервале концентраций 1 × 10–4 (5 × × 10–5)–0.01 (0.1) М; угол наклона электродных функций близок к теоретическому для однозарядных (цефуроксим, цефуроксим аксетил, цефотаксим, цефазолин, цефалексин, цефепим) и двухзарядных ионов (цефтриаксон, цефиксим). Оптимальная концентрация ЭАК в мембранах составляет 2–5%; дрейф потенциала сенсоров 10–20 (2–4) мВ/сут. По зависимости Е = f(−lg cβ-lac) определили пределы обнаружения антибиотиков (табл. 2).
Таблица 2.
Электроаналитические характеристики немодифицированных и модифицированных ß-лактамных сенсоров в растворах соответствующих антибиотиков (сЭАК = 2%, соотношение ЭАК−модификатор 2 : 1, n = 3, P = 0.95)
| Тип сенсора, ЭАК | Раствор антибиотика | Линейный диапазон электродных функций, М | S ± ΔS, мВ/рс | cmin, моль/л |
|---|---|---|---|---|
| Жидкостные | ||||
| [Ag(Cef)2]ТДА | Цефазолин | 1 × 10–5−0.1 | 57 ± 2 | 3 × 10–6 |
| [Ag(Cefur)2]ТДА | Цефуроксим | 5 × 10–4−0.1 | 52 ± 2 | 1 × 10–5 |
| [Ag(Cefix)2]ТДА | Цефиксим | 1 × 10–5−0.01 | 28 ± 2 | 5 × 10–6 |
| Трубчатые | ||||
| [Ag(Cef)2]ТДА | Цефазолин | 5 × 10–5−0.1 | 52 ± 5 | 2 × 10–5 |
| [Ag(Cef)2]ТДА + ПАНИ | 5 × 10–5−0.1 | 56 ± 4 | 2 × 10–5 | |
| [Ag(Ceftx)2]ТДА | Цефотаксим | 5 × 10–5−0.1 | 55 ± 5 | 3 × 10–5 |
| [Ag(Ceftx)2]ТДА + ПАНИ | 5 × 10–5−0.1 | 58 ± 5 | 2 × 10–5 | |
| Планарные | ||||
| [Ag(Ceftx)2]ТДА | Цефотаксим | 1 × 10–4−0.1 | 52 ± 4 | 5 × 10–5 |
| [Ag(Cefur)2]ТДА | Цефуроксим | 5 × 10–5−0.1 | 54 ± 4 | 7 × 10–6 |
| [Ag(Ceftx)2]ТДА | Цефотаксим | 5 × 10–5−0.1 | 54 ± 2 | 6 × 10–6 |
| [Ag(Cefur)2]ТДА + углеродные нанотрубки | Цефуроксим | 5 × 10–6−0.1 | 55 ± 2 | 3 × 10–6 |
| [Ag(Cef)2]ТДА | Цефазолин | 5 × 10–5−0.1 | 48 ± 4 | 3 × 10–5 |
| [Ag(Cef)2]ТДА + ПАНИ | 5 × 10–5−0.1 | 54 ± 3 | 2 × 10–5 | |
| [Ag(Cef)2]ТДА + NiZnFeO | 5 × 10–5−0.1 | 57 ± 3 | 2 × 10–5 | |
| [Ag(Cef)2]ТДА + ПАНИ−NiZnFeO | 5 × 10–5−0.1 | 55 ± 3 | 2 × 10–5 | |
| [Ag(Ceftr)2]ТДА | Цефтриаксон | 3.1 × 10–5−0.01 | 28 ± 4 | 2.6 × 10–5 |
| [Ag(Ceftr)2]ТДА + ПАНИ | 3.1 × 10–5−0.01 | 28 ± 3 | 2.0 × 10–5 | |
| [Ag(Ceftr)2]ТДА + NiZnFeO | 3.1 × 10–5−0.01 | 29 ± 2 | 1.7 × 10–5 | |
| [Ag(Ceftr)2]ТДА + ПАНИ−NiZnFeO | 3.1 × 10–5−0.01 | 29 ± 3 | 1.9 × 10–5 | |
| [Ag(Ceflx)2]ТДА | Цефалексин | 1 × 10–4−0.01 | 46 ± 5 | 1 × 10–4 |
| [Ag(Ceflx)2]ТДА + ПАНИ (с = 2%) | 1 × 10–4−0.01 | 50 ± 4 | 0.8 × 10–5 | |
| [Ag(Ceflx)2]ТДА + ПАНИ (с = 3%) | 1 × 10–4−0.01 | 58 ± 3 | 1.4 × 10–5 | |
| [Ag(Ceftx)2]ДМДСА (с = 3%) | 1 × 10–4−0.01 | 53 ± 5 | 9.8 × 10–5 | |
| [Ag(Ceftx)2]ДМДСА + ПАНИ (c = 3%) | 1 × 10–4−0.01 | 56 ± 4 | 2.1 × 10–5 | |
Время отклика сенсоров определяли при скачкообразном изменении концентрации растворов антибиотиков на порядок величины от меньшей концентрации к большей. На рис. 1 в качестве примера приведены зависимости ЭДС от времени при скачкообразном изменении концентрации для цефуроксима. Исследуемые сенсоры на основе [Аg(ß-lac)2]ТДА характеризуются небольшим временем отклика: для модифицированных полианилином и наночастицами оксида меди в пределах 5–10 с, для немодифицированных — 10–20 с. Уменьшение времени отклика при переходе от разбавленных растворов к более концентрированным связано, вероятно, с образованием вблизи электродной поверхности со стороны водной фазы тонкого слоя, в котором происходит резкое уменьшение концентрации реагирующих веществ и толщина которого с увеличением концентрации электролита уменьшается.
Рис. 1.
Зависимость ЭДС от времени при скачкообразном изменении концентрации растворов цефуроксима для модифицированных полианилином (1) и наночастицами оксида меди (2) сенсоров.

Исследовали электроаналитические свойства твердоконтактных (трубчатых и планарных) сенсоров на основе [Аg(ß-lac)2]ТДА, модифицированных полианилином, наночастицами СuО, NiZnFeO в растворах ß-лактамных антибиотиков. Сенсоры проявляют чувствительность к исследуемым антибиотикам и могут быть использованы для их определения в водных растворах (табл. 2).
Cравнение электроаналитических характеристик сенсоров показало, что модифицирование поверхности мембран или введение модификаторов в углеродсодержащие чернила планарных сенсоров приближает крутизну электродных функций к нернстовским значениям для одно- и двухзарядных ионов исследуемых антибиотиков; при этом сокращается время отклика, уменьшаются пределы обнаружения антибиотиков, а интервалы линейности электродных функций одинаковы для исследуемых немодифицированных и модифицированных сенсоров [29–31]. Процесс перехода от ионной проводимости мембраны к электронной в проводнике достаточно сложен. Модификаторы осуществляют функции медиатора электронного переноса (электрокатализатора), способствуют химической конверсии аналита, его физико-химическому концентрированию на поверхности электрода [60].
Срок службы немодифицированных сенсоров составил 1.5 и 2 мес − модифицированных [29–31]. Улучшение электрохимических характеристик связано с тем, что модификаторы обладают высокими электропроводящими свойствами, снижают сопротивление мембран в два раза, обеспечивают большую удельную поверхность мембран сенсоров.
Оценили коэффициенты потенциометрической селективности $K_{{i/j}}^{{{\text{пот}}}}$ немодифицированных и модифицированных наночастицами CuO селективных сенсоров по отношению к мешающим ионам антибиотиков. Сенсоры на основе [Аg(ß-lac)2]ТДА не обладают специфичностью по отношению к основному иону, они проявляют чувствительность и к другим цефалоспоринам. Неорганические анионы Cl–, I–, Br–, ${\text{HCO}}_{3}^{ - }$, ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - }$, ${\text{HPO}}_{4}^{{2 - }}$ также могут вступать в реакцию ионного обмена, и в этом случае зависимость ЭДС от концентрации описывается уравнением Никольского: $E = {{E}^{0}} - \frac{{2.3RT}}{F}\lg ({{a}_{i}} + K_{{i/j}}^{{{\text{пот}}}} \cdot {{a}_{j}})$, где $K_{{i/j}}^{{{\text{пот}}}}$ – коэффициент потенциометрической селективности, который показывает в присутствии каких количеств мешающих ионов возможно определение основного иона [51–53]. Величины $K_{{i/j}}^{{{\text{пот}}}}$ мембран свидетельствуют о том, что сенсоры высокоселективны по отношению к ряду неорганических ионов Cl–, I–, Br–, ${\text{HCO}}_{3}^{ - }$, ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - }$, ${\text{HPO}}_{4}^{{2 - }}$ ($K_{{i/j}}^{{{\text{пот}}}}$ < 10–3) и неселективны к антибиотикам своей группы ($K_{{i/j}}^{{{\text{пот}}}}$ → 1). Сенсоры можно использовать для определения индивидуальных антибиотиков или их суммарного содержания в лекарственных препаратах, биологических жидкостях.
Электроаналитические характеристики сенсоров на фоне смешанной слюны и сыворотки крови. В качестве объекта исследования выбрали ротовую жидкость. Известно [2, 48], что в каждый момент времени плазма крови превращается в некоторое количество ЖРП, поэтому можно считать, что концентрация лекарственного препарата в ЖРП соответствует концентрации его в плазме крови.
Исследовали поведение сенсоров в пробах ЖРП практически здоровых людей с внесенными добавками β-лактамов. Установили уменьшение интервала линейности и углового коэффициента электродных функций сенсоров в ЖРП вследствие высокой ионной силы раствора и “белкового отравления” поверхности мембран. Так, в растворах цефиксима на фоне ЖРП электродная функция линейна в интервале 1 × 10–4–0.01 М, угловой коэффициент электродных функций составляет 28 ± 3 мВ/рс (рис. 2).
Рис. 2.
Электродные функции сенсора на основе цефиксим−ДМДСА на фоне смешанной слюны в первые (1) и вторые (2) сутки; сЭАК = 3.11% (ДМДСА – диметилдистеариламмония хлорид).

Для всех исследуемых антибиотиков интервалы линейности электродных функций составляют 1 × 10–5–5 × 10–3 М. Полученные градуировочные характеристики являются воспроизводимыми, и увеличение времени кондиционирования сенсоров не влияет на их свойства. Для ионометрических определений антибиотиков нет необходимости осаждать белки. Аналогичные зависимости Е = f(c) получены на фоне сыворотки крови практически здоровых людей и больных с различными патологиями.
С целью полученияданных о транспорте ионов в мембранах на примере ЭАК Cefep–ТФБ получили зависимость сопротивления мембран от времени при различных концентрациях ЭАК. Установили, что при увеличении концентрации ЭАК стационарное сопротивление мембран уменьшается и происходит увеличение концентрации ионообменных центров в фазе мембран (рис. 3). По величинам стационарного сопротивления графическим методом Краусса‒Брея [16] рассчитали кажущуюся константу диссоциации ЭАК в фазе мембраны, которая оказалась равной (4.0 ± ± 0.2) × 10−3.
Рис. 3.
Зависимость стационарного сопротивления мембран на основе цефепимтетрафенилборат от концентрации электродноактивного компонента в мембране.

Исследовали также зависимости сопротивления мембран от времени при смене полярности при различных концентрациях цефепима в примембранных растворах. Установили уменьшение стационарного сопротивления мембран с возрастанием концентрации цефепима в примембранных растворах, что свидетельствует о проникновении антибиотика в фазу мембран.
Аналитическое применение. Исследуемые цефалоспориновые антибиотики определяли в модельных водных растворах (sr ≤ 0.08) и в ЖРП (sr ≤ ≤ 0.1) с внесенными добавками антибиотиков; анализировали препараты “Зиннат”, “Цефалексин” на содержание основного вещества. Планарные потенциометрические сенсоры применили для определения цефуроксима в лекарственных препаратах различных производителей (ЭАК [Ag(Cefur)2]ТДА). Электроаналитические характеристики сенсоров, чувствительных к цефуроксиму, представлены в табл. 3. Интервал линейности электродных функций для всех препаратов одинаков (1 × 10–4−0.01 М), срок службы 1 мес.
Таблица 3.
Электроаналитические характеристики планарных сенсоров в растворах антибиотиков (n = 3, P = = 0.95, E = f(c), 1 × 10–4−0.01 M)
| Производитель | S ± ∆S, мВ/pc | сmin, M | τ, с |
|---|---|---|---|
| Цефуроксим, ОАО “Красфарма” (Красноярск) | 50.6 ± 1.8 | 5 × 10–5 | 20–30 |
| Цефурус, ОАО “Синтез”, (Курган) | 52.3 ± 1.9 | 6.3 × 10–5 | 20–25 |
| Цефурозин, “Протекх Биосистемс”(Индия) | 48.5 ± 1.5 | 6.8 × 10–5 | 20–30 |
В растворе цефуруса (ОАО “Синтез”, Курган) сенсоры генерируют аналитический сигнал лучше, чем в растворах препаратов других производителей. Наблюдается уменьшение времени отклика, угол наклона электродных функций приближается к теоретическому в соответствии с уравнением Нернста для однозарядных ионов.
Цефуроксим определяли в препаратах различных производителей (табл. 4). Установили, что λmax исследуемых препаратов цефуроксима, оптическая плотность при c = 2.5 × 10–5 М одинаковы (λmax 274–275 нм), что доказывает идентичность исследуемых лекарственных препаратов.
Таблица 4.
Результаты определения цефуроксима в препаратах различных производителей (n = 3, P = 0.95)
| Антибиотик | Введено, мг/10 мл | Найдено, мг/10 мл | sr | D, % |
|---|---|---|---|---|
| Цефуроксим | 0.85 | 0.74 ± 0.02 | 0.011 | 12.9 |
| Цефурус | 0.85 | 0.81 ± 0.03 | 0.015 | 4.7 |
| Цефурозин | 0.85 | 0.78 ± 0.03 | 0.015 | 8.2 |
Применение немодифицированных и модифицированных твердоконтактных ß-лактамных сенсоров в мультисенсорных системах типа “электронный язык” для раздельного определения цефалоспориновых антибиотиков. Существует необходимость раздельного экспрессного определения цефалоспориновых антибиотиков в биологических жидкостях и лекарственных формах. Сенсоры на основе [Ag(β-lac)2]ТДА не обладают специфичностью по отношению к основному иону, они проявляют чувствительность и к другим цефалоспоринам. Близость значений $K_{{{i \mathord{\left/ {\vphantom {i j}} \right. \kern-0em} j}}}^{{{\text{пот}}}}$ к единице свидетельствует о том, что данные сенсоры можно применять для раздельного определения цефалоспориновых антибиотиков в мультисенсорных системах типа “электронный язык”.
Наиболее перспективным является использование в составе мультисенсорной системы сенсоров с низкой селективностью и с высокой перекрестной чувствительностью, т.е. чувствительностью к максимальному числу определяемых компонентов в сложных растворах [33]. В связи с этим в настоящей работе наряду с селективностью оценивали параметры перекрестной чувствительности сенсоров в растворах β-лактамных антибиотиков согласно [61, 62]. К параметрам перекрестной чувствительности относятся средний наклон электродной функции сенсора Sср, фактор неселективности F, фактор воспроизводимости K:
Количественный анализ двухкомпонентных модельных смесей антибиотиков (Cef–Сeftx, Сef–Cefur, Ceftx–Cefur) проводили с помощью массива из немодифицированных и модифицированных полианилином и наночастицами CuO сенсоров с разными составами мембран (ЭАК: [Ag(Cefur)2]TДA, [Ag(Ceftx)2]TДA, [Ag(Cef)2]TДA). Для анализа двухкомпонентных смесей приготовили 17 растворов различного состава: концентрации антибиотиков изменялись в интервалах 2.5 × 10–4–0.01 М. Отклики cенсоров измеряли три раза в каждой смеси. Аналитические сигналы (ЭДС, мВ) от массива сенсоров обрабатывали методом искусственных нейронных сетей (ИНС), использовали программу Statistica 6.1. Входными данными для обучения и тестирования сети являлись значения ЭДС (мВ), а выходными – значения концентрации (рс). Далее рассчитывали значения концентрации в моль/л и пересчитывали содержание в мг/л. Использовали ИНС с обратным распространением ошибок (активационная функция – сигмоида, скорость обучения 0.1; момент 0.9; число эпох 20 000). Применяли трехслойную нейронную сеть, состоящую из четырех нейронов в первом слое, двух – во втором, одного – в третьем. Результаты обучения нейронной сети можно использовать в дальнейших анализах, что сокращает продолжительность определения до 10–15 мин.
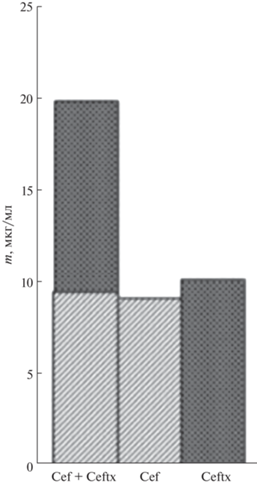
Рис. 4 иллюстрирует пример раздельного определения β-лактамных антибиотиков в двухкомпонентных модельных смесях. Показано что, мультисенсорный подход вместе с математической обработкой аналитических сигналов позволяет раздельно определять β-лактамные антибиотики в двухкомпонентных смесях при совместном присутствии [46, 63].
* * *
Таким образом, разработанные немодифицированные и модифицированные твердоконтактные потенциометрические сенсоры на основе соединений тетрадециламмония с комплексными соединениями серебро(I)–β-lac применимы для определения цефалоспориновых антибиотиков в водных средах, ротовой жидкости, лекарственных препаратах. Слабоселективные и перекрестно-чувствительные ß-лактамные сенсоры позволяют раздельно определять цефалоспориновые антибиотики с применением мультисенсорных систем и метода ИНС.
К перспективам развития следует отнести разработку планарных сенсоров различных типов, в том числе с псевдоэлектродом сравнения, выявление влияния окислителей и восстановителей, кислотности, модификаторов на электроаналитические и эксплуатационные характеристики screen-printed сенсоров; создание массивов планарных сенсоров для раздельного определения β-лактамных антибиотиков в многокомпонентных смесях в водных и биологических средах; разработку планарных сенсоров на другие группы антибиотиков – тетрациклины, макролиды, фторхиналоны и др.
Список литературы
Яковлев В.П. Рациональная антимикробная фармакотерапия. М.: Литтерра, 2007. 784 с.
Кулапина О.И., Кулапина Е.Г. Антибактериальная терапия. Современные методы определения антибиотиков в биологических и лекарственных средах. Саратов: Саратовский источник, 2015. 91 с.
Кулапина Е.Г., Снесарев С.В., Кулапина О.И., Баринова О.В. Некоторые проблемы обеспечения избирательности и чувствительности определения антибиотиков в лекарственных и биологических средах / Проблемы аналитической химии. Т. 16. Фармацевтический анализ. М.: Аргамак-Медиа, 2013. С. 326.
Березняков И.Г. Цефепим сегодня и завтра // Болезни и антибиотики. 2011. Т. 5. № 2. С. 95.
Егоров Н.С. Основы учения об антибиотиках. М.: Наука, 2004. 528 с.
Богомолова Н.С., Орешкина Т.Д., Большаков Л.В. Перспективы использования цефалоспоринового антибиотика четвертого поколения в хирургии // Антибиотики и химиотерапия. 2003. Т. 48. № 7. С. 20.
Paul M., Yahav D., Fraser A., Leibovici L. Empirical antibiotic monotherapy for febrile neutropenia : Systematic review and meta-analysis of randomized controlled trials // J. Antimicrob. Chemother. 2006. V. 57. P. 89.
Yahav D., Paul M., Fraser A., Sarid N, Leibovici L. Efficacy and safety of cefepime: A systematic review and meta-analysis // Lancet Infect. Dis. 2007. V. 7. P. 48.
Khaled E., Khalil M.M., Abed el Aziz G.M. Calixarene/carbon nanotubes based screen printed sensors for potentiometric determination of gentamicin sulphate in pharmaceutical preparations and spiked surface water samples // Sens. Actuators B: Chem. 2017. V. 244. P. 876.
Yu J., Tang W., Wang F., Zhang F., Wang Q., He P. Simultaneous detection of streptomycin and kanamycin based on an all-solid-state potentiometric aptasensor array with a dual-internal calibration system // Sens. Actuators B: Chem. 2020. V. 311 Article 127857.
Ismail F., Adeloju S.B. Comparison of single layer and bilayer biosensors based on crosslinking of penicillinase for potentiometric detection of penicillin in milk and antibiotics // Electroanalysis. 2015.V. 27. № 6. P. 1523.
Abdel-Haleem F.M., Gamal E., Rizk M.S., El Nashar R.M., Anis B., Elnabawy H.M. Barhoum, A. t-Butyl calixarene/Fe2O3@MWCNTs composite-based potentiometric sensor for determination of ivabradine hydrochloride in pharmaceutical formulations // Mater. Sci. Eng. 2020. V. 116. Article 111110.
Badr I.H.A., Saleh G.A., Sayed S.M., El-Deen A novel membrane sensor for batch and flow injection potentiometric determination of cefazolin sodium in pharmaceutical preparations // Int. J. Electrochem. Sci. 2014. V. 9. P. 1621.
Saleh G.A., Badr I.H.A., El-Deen D.A.M.N., Derayea S.M. Novel potentiometric sensor for the selective determination of cefotaxime sodium and its application to pharmaceutical analysis // IEEE Sensors J. 2019. V. 20. № 7. P. 3415.
Кулапина О.И., Макарова Н.М., Кулапина Е.Г. Потенциометрические сенсоры для определения некоторых цефалоспориновых антибиотиков в биологических жидкостях и лекарственных препаратах // Журн. аналит. химии. 2015. Т. 70. № 4. С. 399. (Kulapina O.I., Makarova N.M., Kulapina E.G. Potentiometric sensors for the determination of some cephalosporin antibiotics in biological fluids and medicinal preparations // J. Anal. Chem. 2015. V. 70. № 4. P. 477.)
Кулапина Е.Г., Кулапина О.И., Каренко В.А. Потенциометрические сенсоры для определения цефепима в водных и биологических средах // Изв. Сарат. ун-та Нов. сер. Сер. Химия. Биология. Экология. 2016. Т. 16. № 2. С. 138.
Li M., Li Y.T., Li D.W., Long Y.T. Recent developments and applications of screen-printed electrodes in environmental assays − A review. // Anal. Chim. Acta. 2012. V. 734. P. 31.
Alonso-Lomillo M.A., Domínguez-Renedo O., Arcos-Martínez M.J. Screen-printed biosensors in microbiology; A review// Talanta. 2010. V. 82. № 5. P. 1629.
Shetti N.P., Nayak D.S., Malode S.J., Kulkarni R.M. An electrochemical sensor for clozapine at ruthenium doped TiO2 nanoparticles modified electrode // Sens. Actuators B: Chem. 2017. V. 247. P. 858.
Amani-Beni Z., Nezamzadeh-Ejhieh A. NiO nanoparticles modified carbon paste electrode as a novel sulfasalazine sensor // Anal. Chim. Acta. 2018. V. 1031. № 4. P. 47.
Lomae A., Nantaphol S., Kondod T., Chailapakul O., Siangproh W., Panchompoo J. Simultaneous determination of β-agonists by UHPLC coupled with electrochemical detection based on palladium nanoparticles modified BDD electrode // J. Electroanal. Chem. 2019. V. 840. P. 439
Kenarkob M., Pourghobadi Z. Electrochemical sensor for acetaminophen based on a glassy carbon electrode modified with ZnO/Au nanoparticles on functionalized multi-walled carbon nano-tubes // Microchem. J. 2019. V. 146. P. 1019.
Chang Y.H., Woi P.M., Alias Y. The selective electrochemical detection of dopamine in the presence of ascorbic acid and uric acid using electro-polymerised-β-cyclodextrin incorporated f-MWCNTs/polyaniline modified glassy carbon electrode // Microchemical J. 2019. V. 148. P. 322.
Afzali M., Jahromi Z., Nekooie R. Sensitive voltammetric method for the determination of naproxen at the surface of carbon nanofiber/gold/polyaniline nanocomposite modified carbon ionic liquid electrode // Microchem. J. 2019. V. 145. P. 373.
Хади М., Хонарманд Э. Применение электрода из анодированного пирографита с торцевой поверхностью для анализа клиндамицина в фармацевтических препаратах и образцах человеческой мочи // Электрохимия. 2017. Т. 53. № 4. С. 431. (Hadi M., Honarmand E. Application of anodized edge-plane pyrolytic graphite electrode for analysis of clindamycin in pharmaceutical formulations and human urine samples // Russ. J. Electrochem. 2017. V. 53. № 4. P. 380.)
Еременко А.В., Прокопкина Т.А., Касаткин В.Э., Осипова Т.А., Курочкин И.Н. Планарные тиол-чувствительные сенсорные элементы для определения активности бутирилхолинэстеразы и анализа ее ингибиторов // Вест. Моск. ун-та. Серия 2. Химия. 2014. Т. 55. № 3. С. 174.
Frag E.Y., Mohamed S.H. Carbon potentiometric sensors modified with beta-cyclodextrin as a carrier for the determination of bisoprolol fumarate // Int. J. Electrochem. Sci. 2019. V. 14. № 7. P. 6603.
Ali T.A., Mohamed G.G., Yahya G.A. Development of novel potentiometric sensors for determination of lidocaine hydrochloride in pharmaceutical preparations, serum and urine samples // Iran. J. Pharm. Res. 2017. V. 16. № 2. P. 498.
Кулапина Е.Г., Тютликова М.С., Кулапина О.И., Дубасова А.Е. Твердоконтактные потенциометрические сенсоры для определения некоторых цефалоспориновых антибиотиков в лекарственных препаратах и ротовой жидкости // Журн. аналит. химии. 2019. Т. 74. № 7. С. 63. (Kulapina E.G., Tyutlikova M.S., Kulapina O.I., Dubasova A.E. Solid-contact potentiometric sensors for the determination of some cephalosporin antibiotics in pharmaceuticals and oral fluid // J. Anal. Chem. 2019. V. 74. № 7. P. 52.)
Кулапина Е.Г., Дубасова А.Е., Кулапина О.И. Модифицированные твердоконтактные сенсоры для определения цефуроксима и цефалексина в лекарственных средствах и ротовой жидкости // Заводск. лаборатория. Диагностика материалов. 2019. Т. 85. № 9. С. 4.
Кулапина Е.Г., Кулапина О.И., Анкина В.Д. Планарные потенциометрические сенсоры на основе углеродных материалов для определения цефотаксима и цефуроксима // Журн. аналит. химии. 2020. Т. 75. № 2. С. 145. (Kulapina E.G., Kulapina O.I., Ankina V.D. Screen-printed potentiometric sensors based on carbon materials for determining cefotaxime and cefuroxime // J. Anal. Chem. 2020. V. 75. № 2. P. 231.)
Ayad M.F., Trabik Y.A., Abdelrahman M.H., Fares N.V., Magdy N. Potentiometric carbon quantum dots-based screen-printed arrays for nano-tracing gemifloxacin as a model fluoroquinolone implicated in antimicrobial resistance // Chemosensors. 2021. V. 9. № 8. P. 1.
Легин А.В., Рудницкая А.М., Власов Ю.Г. “Электронный язык” – системы химических сенсоров для анализа водных сред / Проблемы аналитической химии. Т. 14. Химические сенсоры / Под ред. Власова Ю.Г. М.: Наука, 2011. С. 79.
Кулапина Е.Г., Макарова Н.М. Мультисенсорные системы в анализе жидких и газовых объектов. Саратов: ИЦ “Наука”, 2010. 165 с.
Wesoly M., Ciosek-Skibinska P. Comparison of various data analysis techniques applied for the classifi cation of pharmaceutical samples by electronic tongue // Sens. Actuators. B. 2018. V. 267. P. 570.
Saidi T., Moufi M., Zaim O., Bari N.E., Bouchikhi B. Voltammetric electronic tongue combined with chemo metric techniques for direct identifi cation of creatinine level in human urine // Measurement. 2018. V. 115. P. 178.
Wesoly M., Cal K., Ciosek P., Wroblewski W. Influence of dissolution-modifying excipients in various pharmaceutical formulations on electronic tongue results // Talanta. 2017. V. 162. P. 203.
Wesoly M., Zabadaj M., Amelian A., Winnicka K., Wroblewski W., Ciosek P. Tasting cetirizine-based microspheres with an electronic tongue // Sens. Actuators. B. 2017. V. 238. P. 1190.
Lenik J., Wesoly M., Ciosek P., Wroblewski W. Evaluation of taste masking effect of diclofenac using sweeteners and cyclodextrin by a potentiometric electronic tongue // J. Electroanal. Chem. 2016. V. 780. P. 153.
Wei Zh., Wang J. Detection of antibiotic residues in bovine milk by a voltammetric electronic tongue system // Anal. Chim. Acta. 2011. V. 694. P. 46.
Зильберг Р.А., Сидельников А.В., Яркаева Ю.А., Кабирова Л.Р., Майстренко В.Н. Идентификация лекарственных средств на основе бисопролола с использованием вольтамперометрического “электронного языка” // Вестн. Башкир. ун-та. 2017. Т. 22. № 2. С. 356.
Зильберг Р.А., Яркаева Ю.А., Максютова Э.И., Сидельников А.В., Майстренко В.Н. Вольтамперометрическая идентификация инсулина и его аналогов с использованием модифицированных полиариленфталидами стеклоуглеродных электродов // Журн. аналит. химии. 2017. Т. 72. № 4. С. 348. (Zil’berg R.A., Yarkaeva Y.A., Maksyutova E.I., Sidel’nikov A.V., Maistrenko V.N. Voltammetric identification of insulin and its analogues using glassy carbon electrodes modified with polyarylenephthalides // J. Anal. Chem. 2017. V. 72. № 4. P. 402.)
Safronova E., Parshina A.V., Kolganova T., Yelnikova A., Bobreshova O.V., Pourcelly G., Yaroslavtsev A. Potentiometric multisensory system based on perfluorosulfonic acid membranes and carbon nanotubes for sulfacetamide determination in pharmaceuticals // J. Electroanal. Chem. 2020. V. 873. № 15. Article 114435.
Salama F.M., Attia K.A.M., El-Olemy A., Mohamad A. Potentiometric determination of Enrofloxacin using PVC and coated graphite sensors // Glob. Drugs Ther. 2018. V. 3. № 3. P. 1.
Кулапина Е.Г., Снесарев С.В., Макарова Н.М., Погорелова Е.С. Массивы потенциометрических сенсоров для раздельного определения антибиотиков пенициллинового ряда с использованием метода искусственных нейронных сетей // Журн. аналит. химии. 2011. Т. 66. № 1. С. 82. (Kulapina E.G., Snesarev S.V., Makarova N.M., Pogorelova E.S. Potentiometric sensor arrays for the individual determination of penicillin class antibiotics using artificial neural networks // J. Anal. Chem. 2011. V. 66. № 1. P. 78.)
Кулапина Е.Г., Дубасова А.Е., Кулапина О.И., Анкина В.Д. Мультисенсорные системы типа “электронный язык” для раздельного определения цефотаксима и цефазолина // Изв. Сарат. ун-та Нов. сер. Сер. Химия. Биология. Экология. 2021. Т. 21. № 1. С. 4.
Вавилова Т.П., Янушевич О.О., Островская И.Г. Слюна. Аналитические возможности и перспективы. М.: БИНОМ, 2014. 312 с.
Савинов С.С., Анисимов А.А. Влияние условий отбора образцов слюны на результаты определения макро- и микроэлементов // Журн. аналит. химии. 2020. Т. 75. № 4. С. 327. (Savinov S.S., Anisimov A.A. Effect of conditions for sampling of human saliva on the results of determination of macro- and micronutrients// J. Anal. Chem. 2020. V. 75. № 4. P. 453.)
Жирков А.А., Ягов В.В., Антоненко А.А., Коротков А.С., Зуев Б.К. Определение минерального состава слюны человека при помощи микроплазменной атомно-эмиссионной спектроскопии // Журн. аналит. химии. 2020. Т. 75. № 1. С. 43. (Zhirkov A.A., Yagov V.V., Korotkov A.S., Zuev B.K., Antonenko A.A. Determination of the mineral composition of human saliva by microplasma atomic emission spectroscopy // J. Anal. Chem. 2020. V. 75. № 1. P. 63.)
Алексеев В.Г. Бионеорганическая химия пенициллинов и цефалоспоринов. Тверь: Твер. гос. ун-т, 2009. 104 с.
Buck R., Lindner E. Recommendations for nomenclature of ion-sensitive electrodes (IUPAC Recommendatoin 1994) // Pure Appl. Chem. 1994. V. 66. № 12. P. 2527.
Umezawa Y., Buhlmann P., Umazawa K., Tohda K., Amemiya S. Potentiometric selectivity coefficients of ion-selective electrodes. Part I. Inorganic cations (IUPAC Technical Report) // Pure Appl. Chem. 2000. V. 72. № 10. P. 1851.
Белюстин А.А. Потенциометрия: физико-химические основы и применения. СПб: Лань, 2015. 336 с.
Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ Statistica. Медиа Сфера, 2002. 312 с.
Гайдышев И. Анализ и обработка данных. Специальный справочник. СПб, 2011.
Кулапина О.И., Михайлова М.С. Изучение фармакокинетики цефуроксима по динамике его распределения в жидкости ротовой полости больных синуситами // Антибиотики и химиотерапия. 2014. Т. 59. № 9–10. С. 29.
Машковский M.Д. Лекарственные средства. M.: Новая волна, 2014. 1216 с.
Алексеев В.Г., Демская JI.B. Комплексообразование серебра(1) с ампициллином, амоксициллином и цефалексином // Коорд. химия. 2007. Т. ЗЗ. № 3. С. 211. (Alekseev V.G., Demskaya L.V. Ag(I) complexes with the ampicillin, amoxicillin, and cephalexin anions // Russ. J. Coord. Chem. 2007. V. 33. № 3. P. 203.)
Кулапина Е.Г., Снесарев С.В. Потенциометрические сенсоры на основе органических ионообменников тетраалкиламмония и комплексов серебра с ампициллином, оксациллином и цефазолином // Журн. аналит. химии. 2012. Т. 67. № 2. С. 198. (Kulapina E.G., Snesarev S.V. Potentiometric sensors based on organic ion exchangers of tetraalkylammonium and silver complexes with ampicillin, oxacillin, and cefazolin // J. Anal. Chem. 2012. V. 67. № 2. P. 163.)
Будников Г.К., Евтюгин Г.А., Майстренко В.Н. Модифицированные электроды для вольтамперометрии в химии, биологии, медицине. M.: Бином, 2009. 331 с.
Vlasov Yu., Legin A., Rudnitskaya A. Cross-sensitivity evaluation of chemical sensors for electronic tongue: determination of heavy metal ions // Sens. Actuators B: Chem. 1997. V. 44. № 1–3. P. 532.
Власов Ю.Г., Легин А.В., Рудницкая А.М. Катионная чувствительность стекол системы AgI-Sb2S3 и их применение в мультисенсорном анализе жидких сред // Журн. аналит. химии. 1997. Т. 52. № 8. С. 837. (Vlasov Yu.G., Legin A.V., Rudnitskaya A.M. Cation sensitivity of AgI-Sb2S3 glasses and their use in the multisensor analysis of liquid media // J. Anal. Chem.1997. V. 52. № 8. P. 758.)
Кулапина Е.Г., Дубасова А.Е., Кулапина О.И., Анкина В.Д. Массивы твердоконтактных потенциометрических сенсоров для раздельного определения некоторых цефалоспориновых антибиотиков // Заводск. лаборатория. Диагностика материалов. 2021. Т. 87. № 5. С. 5.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии