Химия высоких энергий, 2021, T. 55, № 4, стр. 287-296
Фотохимические свойства протонированной формы несимметричной бифотохромной стирилбензохинолиновой диады с оксиметиленовой мостиковой группой
М. Ф. Будыка a, *, Т. Н. Гавришова a, В. М. Ли a, С. А. Дозморов a, b, В. И. Козловский c
a Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, просп. Академика Семенова, 1, Россия
b Факультет фундаментальной физико-химической инженерии МГУ им. М.В. Ломоносова
Москва, Россия
c Филиал Федерального исследовательского центра химической физики им. Н.Н. Семенова Российской академии наук в г. Черноголовке
142432 Черноголовка, Россия
* E-mail: budyka@icp.ac.ru
Поступила в редакцию 17.02.2021
После доработки 03.03.2021
Принята к публикации 13.03.2021
Аннотация
Исследованы фотофизические и фотохимические свойства протонированной формы несимметричной бифотохромной диады D2, содержащей в качестве фотохромов производные 3-стирилбензо[f]хинолина (SBQ). В гидрохлориде диады D2·2HCl наблюдается межфотохромный перенос энергии, эффективность которого, по данным флуоресцентной спектроскопии, составляет 92%. Под действием света гидрохлорид D2·2HCl подвергается реакции фотоизомеризации SBQ-фотохромов. Кроме того, при длительном облучении D2·2HCl наблюдаются дополнительные к фотоизомеризации побочные реакции, основными из которых, по данным масс-спектральных исследований, являются разрыв мостиковой эфирной связи CH2–O между двумя SBQ фотохромами и присоединение молекулы этанола к этиленовой группе одного из фотохромов. Эти реакции приводят к деструкции диады и препятствуют функционированию ее в качестве фотонного переключателя и молекулярного логического вентиля.
Ранее нами исследована несимметричная бифотохромная диада D2, содержащая два фотохрома – производных 3-стирилбензо[f]хинолина (SBQ), связанных оксиметиленовой мостиковой группой, схема 1 [1]. Структура диады с продольным сдвигом фотохромов была разработана таким образом, чтобы предотвратить реакцию [2 + 2] фотоциклоприсоединения [2–5], которая является побочной по отношению к реакции фотоизомеризации (ФИ) SBQ фотохромов и препятствует использованию диады для моделирования функций фотонных молекулярных логических вентилей (МЛВ). Исследования мультифотохромных систем, способных функционировать в качестве фотонных переключателей и МЛВ, проводятся в последнее время с целью поиска возможной альтернативы современным полупроводниковым средствам обработки информации [6–12].
В результате исследований диады D2 было установлено [1], что в диаде, действительно, отсутствует реакция межфотохромного [2 + 2] фотоциклоприсоединения, однако наблюдается другая побочная по отношению к ФИ реакция – внутрифотохромной фотоциклизации (ФЦ) одного из фотохромов, которая также препятствует функционированию МЛВ. Поскольку ФЦ происходит с участием бензохинолинового атома азота, было установлено [13], что протонирование этого атома блокирует ФЦ, но сохраняет способность SBQ фотохромов к ФИ. В связи с этим мы предположили, что перевод диады D2 в протонированную форму позволит предотвратить побочную реакцию ФЦ SBQ2-фрагмента и устранить этот недостаток диады как фотонного МЛВ.
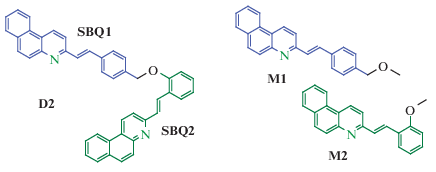
Схема 1 . Структура бис-стирилбензохинолиновой диады D2 и модельных (E)-3-(4-метоксиметилстирил)бензо[f]хинолина М1 и (E)-3-(2-метоксистирил)бензо[f]хинолина М2.
Для проверки этого предположения, в настоящей работе исследованы свойства гидрохлорида (3-(E)-2-{4-((E)-2-бензо[f]хинолин-3-ил-винил)феноксиметил]-фенил}-винил)-бензо[f]хинолина – бифотохромной диады D2, схема 1 . Модельными фотохромами для структурных блоков диады SBQ1·HCl и SBQ2.HCl являются гидрохлориды 3-(4-метоксиметилстирил)бензо[f]хинолина М1 и 3-(2-метоксистирил)бензо[f]хинолина М2 соответственно. Здесь и далее SBQ1 обозначает SBQ фотохром с заместителем в положении 4 стирильного фрагмента, а SBQ2 – с заместителем в положении 2 стирильного фрагмента, схема 1 .
Исследования показали, что в гидрохлориде диады D2.2HCl наблюдаются межфотохромный перенос энергии (ПЭ) и реакция ФИ фотохромов, а при длительном облучении – дополнительные побочные реакции, приводящие к постепенной деградации диады. По данным масс-спектрального анализа, это реакция разрыва мостиковой эфирной связи CH2–O между двумя SBQ фотохромами, приводящая к разрушению супрамолекулярной структуры диады, а также реакция присоединения молекулы этанола к этиленовой группе одного из фотохромов, обуславливающая разрушение сопряженной π-системы фотохрома и потерю способности к ФИ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтезы модельных стирилбензохинолинов [13] и диады D2 описаны ранее [1]. Протонированные формы получали путем добавления к 2 мл 2 × 10–5 М раствора субстрата 0.01 мл 12 М раствора соляной кислоты.
Электронные спектры поглощения записаны на спектрофотометре Specord M-400, спектры флуоресценции сняты на спектрофлуориметре фирмы PerkinElmer LS-55 в Аналитическом центре коллективного пользования ИПХФ РАН.
Для регистрации масс-спектров использовался масс-спектрометр Orbitrap, Exactive (Thermofisher Scientific Bremen, Германия). Метод ионизации – электроспрей, использовался оригинальный самодельный ионный источник, который описан в [13, 14]. Точность определения m/z пиков в масс-спектре составляла не хуже 0.004 Да.
Все исследования выполнены при красном свете при комнатной температуре в воздушно-насыщенных растворах в этаноле с добавлением соляной кислоты в кварцевых кюветах с длиной оптического пути l = 1 см. Квантовые выходы флуоресценции измеряли, используя в качестве эталона разбавленный спиртовой раствор антрацена, квантовый выход флуоресценции которого составляет 0.3 [15], точность измерения 15%.
В качестве источника УФ света использовали светодиод LED-408 (λmax = 408 нм, FWHM = 15 нм) с интенсивностью действующего света (0.9–2.6) × × 10–10 Эйнштейн см–2 с–1 (измерена ферриоксалатным актинометром). Ошибка измерения квантовых выходов реакций 20%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Гидрохлорид диады D2·2HCl имеет интенсивную длинноволновую полосу поглощения (ДВПП) с максимумом 412 нм и молярным показателем поглощения (МПП) 6.66 × 104 М–1 см–1 и менее интенсивную коротковолновую полосу с максимумом 312 нм (МПП 5.76 × 104 М–1 см–1), рис. 1, спектр 3. Отличие экспериментального спектра диады (рис. 1, спектр 3) от модельного спектра (рис. 1, спектр 4), полученного как сумма спектров гидрохлоридов модельных SBQ (рис. 1, спектры 1 и 2), свидетельствует о некотором взаимодействии двух фотохромных фрагментов диады в S0 состоянии.
Рис. 1.
Спектры поглощения (левая ось) гидрохлоридов: модельных фотохромов (1) E-М1·HCl и (2) E-М2·HCl, EE изомера диады D2·2HCl (3) экспериментальный и (4) рассчитанный как сумма спектров модельных соединений; нормированные по спектру диады спектры люминесценции (правая ось, возбуждение 403 нм): (5) E-М1·HCl, (6) E-М2· H-Cl, (7) EE-D2·2HCl.
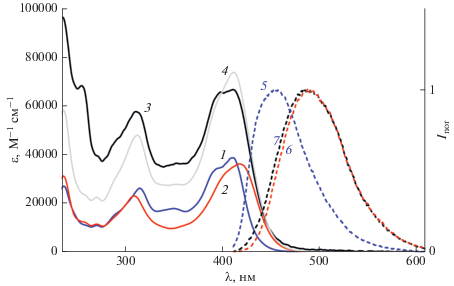
Из сравнения спектров модельных соединений (рис. 1, спектры 1 и 2) следует, что в коротковолновой области до 310 нм оба фотохромных фрагмента диады имеют равное поглощение. В средней области 310–410 нм преобладает поглощение SBQ1, а на спаде ДВПП диады в области свыше 415 нм преобладает поглощение SBQ2, который имеет батохромно сдвинутый спектр.
Гидрохлориды модельных SBQ проявляют слабую флуоресценцию с максимумами и квантовыми выходами (φfl) 456 нм и 0.036 для М1·HCl, 491 нм и 0.020 для М2·HCl [13]. Максимум полосы излучения и квантовый выход флуоресценции гидрохлорида диады D2·2HCl составляют 490 нм и 0.025. Из соотношения спектров поглощения и излучения двух модельных гидрохлоридов следует вывод, что в гидрохлориде диады, как и в нейтральной форме [1], возможен синглет-синглетный ПЭ от SBQ1·HCl к SBQ2·HCl. Действительно, спектр флуоресценции D2·2HCl (рис. 1, спектр 7), практически, совпадает со спектром флуоресценции М2·HCl (рис. 1, спектр 6), а различие в коротковолновой части спектра (на приподнятом спаде полосы диады), как и в случае нейтральной диады, можно отнести к остаточному излучению М1·HCl (см. ниже).
Спектры поглощения и флуоресценции модельных соединений были использованы для оценки эффективности ПЭ в диаде. Согласно теории Фёрстера [16], константа скорости диполь-дипольного индуктивно-резонансного ПЭ (FRET) определяется уравнением
Рассчитанные интегралы перекрывания для разных донорно-акцепторных пар, а также оценочные значения радиусов Фёрстера, которые рассчитаны с использованием среднеквадратичной величины κ2 = 2/3 [16], приведены в табл. 1.
Таблица 1.
Интегралы перекрывания спектров (J) и радиусы Фёрстера (R0) для разных донорно-акцепторных пар гидрохлоридов модельных SBQ фотохромов
| Донор | Акцептор | J/1013 М–1 см–1 нм4 | R0/нм | |
|---|---|---|---|---|
| 1 | E-M1·HCl | E-M2·HCl | 25.1 | 2.31 |
| 2 | E-M2·HCl | E-M1·HCl | 1.4 | 1.29 |
| 3 | E-M1·HCl | Z-M2·HCl | 3.5 | 1.66 |
| 4 | E-M2·HCl | Z-M1·HCl | 1.1 | 1.25 |
Из этих данных видно, что в гидрохлориде EE изомера диады, содержащем оба SBQ хромофора в транс-конфигурации, преобладающим является процесс ПЭ в направлении E-SBQ1·HCl → → E-SBQ2·HCl, поскольку значения J и R0 для этой модельной пары (таб. 1, пример 1) существенно больше аналогичных параметров для обратного переноса в направлении E-SBQ2·HCl → → E-SBQ1·HCl (пример 2). Для изомеров диады, в которых один из SBQ хромофоров находится в цис-конфигурации, параметры ПЭ в направлении E-SBQ1·HCl → Z-SBQ2·HCl в EZ изомере (пример 3) больше, чем для ПЭ в направлении E‑SBQ2·HCl → Z-SBQ1·HCl в ZE изомере (пример 4), т.е. во всех случаях фрагмент E-SBQ1·HCl как донор энергии эффективнее, чем E-SBQ2·H-Cl.
Действительно, как отмечено выше, спектр и квантовый выход флуоресценции гидрохлорида EE изомера диады близки к таковым для М2·HCl, т.е. эти параметры обусловлены излучением SBQ2·HCl, отмечен также небольшой вклад SBQ1·HCl в излучение диады. Исходя из разности площадей полос излучения D2·2HCl и М2·HCl в шкале волновых чисел, можно рассчитать, что доля SBQ1·HCl в полосе излучении диады составляет 6%. Из соотношения МПП на длине волны возбуждения (403 нм) следует, что SBQ1·HCl поглощает 53% света, и поскольку для диады φfl = 0.025, получаем для квантового выхода флуоресценции SBQ1·HCl в D2·2HCl $\varphi _{{{\text{fl}}}}^{'}$ = 0.0028.
Полученное значение было использовано для расчета эффективности (квантового выхода) ПЭ в диаде по формуле φET = 1 – ${{\varphi _{D}^{'}} \mathord{\left/ {\vphantom {{\varphi _{D}^{'}} {{{\varphi }_{D}}}}} \right. \kern-0em} {{{\varphi }_{D}}}}$, где φD и $\varphi _{D}^{'}$ – это квантовые выходы флуоресценции донора (SBQ1·HCl) в свободном состоянии (в М1·HCl) и в диаде (в присутствии акцептора SBQ2·HCl). Используя в качестве φD значение φfl для М1·HCl (0.036), получаем для гидрохлорида D2·2HCl φET = 0.92.
ПЭ приводит к уменьшению фотохимической активности донора энергии в мультифотохромных системах, что препятствует их использованию в качестве фотонных молекулярных переключателей [17]. Однако уменьшение эффективности ПЭ имеет обратный эффект и может, по крайней мере частично, восстановить активность донора. Поскольку в протонированной диаде D2·2HCl эффективность ПЭ от SBQ1·HCl к SBQ2·HCl немного уменьшилась по сравнению с нейтральной формой (φET = 0.99) [1], т.е. увеличилась доля непотушенного SBQ1·HCl, для этого фотохрома можно ожидать большей фотохимической активности в гидрохлориде диады. Показано, что уменьшение φET до 0.66 приводит к увеличению активности фотохрома-донора в диаде до такой степени, что диада уже способна функционировать как двухадресный фотонный МЛВ [18] и выполнять другие логические функции, например, контроллера четности [19].
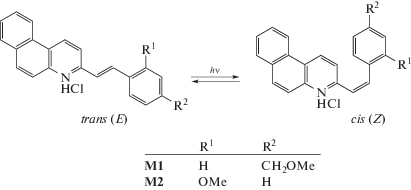
Как отмечено во введении, фотохимические свойства гидрохлоридов модельных фотохромов были исследованы ранее [13]. Оба стирилбензохинолина в протонированной форме подвергаются обратимой ФИ, схема 2 , с квантовыми выходами транс-цис (φtc) и цис-транс (φct) ФИ φtc = 0.70 и φct = 0.57 для М1·HCl и φtc = 0.79 и φct = 0.71 для М2·HCl. Дополнительная реакция ФЦ, наблюдаемая в нейтральной форме М2, не протекает в гидрохлориде М2·HCl [13].
Схема 2 . Фотоизомеризация гидрохлоридов производных 3-стирилбензо[f]хинолина, показана на примере s-транс конформеров.
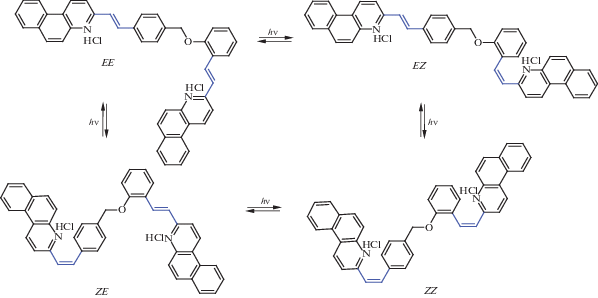
При облучении гидрохлорида диады D2.2HCl светом 408 нм, вблизи максимума ДВПП, на начальной стадии (0–1200 с) наблюдались спектральные изменения, характерные для реакции транс-цис ФИ производных SBQ: уменьшение интенсивности полос поглощения транс-изомеров в области 300–450 нм с одновременным ростом полос цис-изомеров в коротковолновой области 230–290 нм, рис. 2. На схеме 3 для гидрохлорида диады D2.2HCl показан цикл реакций ФИ, в которых могут участвовать все четыре изомера диады – EE, EZ, ZE и ZZ.
Рис. 2.
Спектральные изменения при облучении воздушно-насыщенного раствора гидрохлорида диады D2·2HCl (2 × × 10–5 М) светом с длиной волны 408 нм, интенсивность 1.2 × 10–9 Эйнштейн см–2 с–1, общее время фотолиза (1)–(10) 47 000 с; вставка: кинетика изменения оптической плотности на длине волны 408 нм, экспериментальные точки и аппроксимирующая кривая (до 1200 с, см. текст).
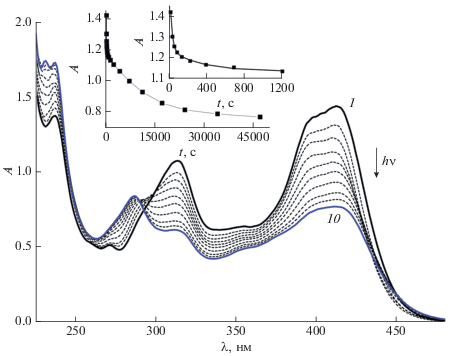
Схема 3 . Цикл реакций фотоизомеризации гидрохлорида диады D2·2HCl (с фрагментами SBQ фотохромов в форме s-цис конформеров).
Спектральные изменения в обратимой реакции ФИ должны прекратиться по достижении фотостационарного состояния (ФС), когда скорости прямой и обратной реакций становятся равными, при этом кинетическая кривая изменения оптической плотности выходит на плато, положение которого определяется соотношением концентраций изомеров в реакционной смеси и зависит от соотношения МПП и квантовых выходов ФИ.
Как видно на рис. 2, при фотолизе гидрохлорида диады D2.2HCl после быстрого начального участка падения оптической плотности кинетическая кривая, практически, выходила на плато (вставка, 0–1200 с), однако при дальнейшем облучении поглощение в длинноволновой части спектра продолжало медленно уменьшаться (вставка, 0–47 000 с) при одновременном росте в коротковолновой части. Этот факт, а также отсутствие изосбестических точек свидетельствовали о протекании нескольких реакций, кроме ФИ, при облучении гидрохлорида диады D2.2HCl.
Вывод о появлении в реакционной смеси дополнительных хромофоров, связанных с протеканием реакций, побочных по отношению к реакции ФИ, подтвердился при анализе спектральных изменений, происходящих при фотолизе D2.2HCl, методом главных компонент (МГК, principal component analysis) [20, 21]. Для анализа была взята суммарная матрица, содержащая экспериментальные спектры, снятые при фотолизе гидрохлорида диады D2·2HCl, а также модельные спектры изомеров диады, рассчитанные исходя из спектров гидрохлоридов транс- (E-) и цис- (Z-) изомеров модельных фотохромов М1·HCl и М2·HCl. На рис. 3 показан график счетов, на котором экспериментальные и модельные спектры представлены в общем базисе первых двух сингулярных векторов p1 и p2. Каждая точка на графике соответствует конкретному спектру, при анализе учитывался спектральный диапазон 230–500 нм с шагом 1 нм, т.е. исходная матрица включала 271 значение оптической плотности для каждого спектра.
Рис. 3.
График счетов – обработка методом главных компонент (principal component analysis) спектральных изменений, происходящих при фотолизе гидрохлорида диады D2·2HCl светом 408 нм, экспериментальные спектры представлены в общем базисе первых двух сингулярных векторов p1 и p2. Звездочками отмечены точки, соответствующие модельным спектрам изомеров диады (см. текст), стрелка показывает направление спектральных изменений при фотолизе.

На рис. 3 точки EE, EZ, ZE и ZZ, отмеченные звездочками и соответствующие модельным спектрам изомеров диады, образуют четырехугольник, который ограничивает область возможных спектральных изменений, связанных с реакциями ФИ двух SBQ фотохромов в диаде. Четырехугольник лежит в одной плоскости, что обусловлено наличием только трех независимых хромофоров, соответствующих трем изомерам диады; спектр четвертого изомера является алгебраической суммой трех других (см. [1]). Поскольку экспериментальный и модельный спектры гидрохлорида диады различаются (см. выше), первая точка на кривой фотолиза на графике МГК не совпадает с точкой EE.
На начальном участке графика МГК (рис. 3) спектральные изменения направлены вдоль стороны четырехугольника EE–EZ и характеризуют преимущественно быструю реакцию ФИ фотохрома SBQ2·HCl, поскольку реакция ФИ SBQ1·HCl в EE изомере диады (приводящая к ZE изомеру) значительно потушена в результате ПЭ на SBQ2·HCl и не проявляется в начальный период облучения. Затем, по мере достижения ФС в реакции ФИ SBQ2·HCl, начинает спектрально проявляться более медленная реакция ФИ SBQ1·HCl (в EE и EZ изомерах), о чем свидетельствует поворот графика МГК в сторону ZE и ZZ изомеров.
Однако при дальнейшем облучении кривая МГК выходит за рамки четырехугольника на рис. 3, что свидетельствует о появлении в этот период времени в реакционной смеси новых хромофоров, образующихся в дополнительных к ФИ реакциях. В отличие от нейтральной диады [1], при фотолизе гидрохлорида D2·2HCl эти другие медленные реакции, по-видимому, не связаны с ФЦ фотохрома SBQ2·HCl, т.к. контрольные эксперименты по длительному фотолизу гидрохлорида М2·HCl показали, что при увеличении времени облучения до 25 периодов полупревращения спектр реакционной смеси, находящейся в ФС, сохранялся без изменений, т.е. в модельном фотохроме в сравнимых условиях протекала только реакция ФИ.
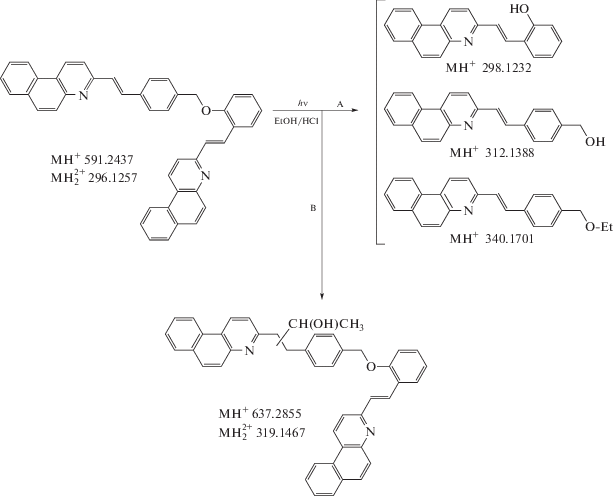
Для выявления природы побочных реакций и структуры образующихся продуктов реакционные смеси после фотолиза гидрохлорида D2·2HCl были исследованы методом масс-спектрометрии с ионизацией электрораспылением (электроспрей). Масс-спектр раствора до облучения содержал только пики протонированных форм диады, представленные моно-протонированной формой (однозарядный катион C43H31N2O+) с m/z = 591.238 и ди-протонированной формой (двухзарядный катион C43H32N2O2+) с m/z = 296.122. Масс-спектр раствора после облучения показан на рис. 4.
В масс-спектре доминируют четыре основных пика с относительной интенсивностью более 60%. Близкий к максимальному пик двухзарядного иона с m/z = 296.122 (97.9%) и его углеродные изотопы с m/z = 296.623 (48.0%) и m/z =297.125 (10.1%) принадлежат ди-протонированной форме диады; в спектре также присутствует пик моно-протонированной формы с m/z = 591.238 (12.5%).
Самый интенсивный пик с m/z = 298.119 (100%) соответствует катиону с брутто-формулой C21H16NO+ (теоретическое значение m/z = 198.1232, см. схему 4 ), что можно приписать протонированному гидрокси-производному SBQ2–OH·H+. Это соединение образуется в результате разрыва мостиковой эфирной связи CH2–O, соединяющей два SBQ фотохрома диады. При гомолитическом разрыве связи образуются два радикала, ${\text{SBQ}}1--{\text{CH}}_{2}^{\centerdot }$ и SBQ2–O·, которые после диффузии из клетки растворителя и отщепления атомов водорода от соседних молекул этанола должны дать в равном соотношении метил-производное SBQ1–CH3 с метильной группой в положении 4 стирильного фрагмента и гидрокси-производное SBQ2–OH с гидроксильной группой в положении 2 стирильного фрагмента (ср. со структурами модельных соединений, схема 1 ). Протонированная форма SBQ1–CH3·H+ имеет m/z = 296.144, однако такой пик отсутствует в масс-спектре, из чего можно сделать вывод, что связь CH2–O диссоциирует по гетеролитическому механизму без образования радикалов.
При гетеролитическом разрыве связи CH2–O формально образуются катион SBQ1–${\text{CH}}_{2}^{ + }$ и анион SBQ2–O–. Анион при протонировании дает SBQ2–OH, молекулярный пик которого является максимальным в масс-спектре, а катион в реакции с нуклеофилом может образовать или производное бензилового спирта SBQ1–CH2OH, если нуклеофилом является молекула воды, или соответствующий простой эфир SBQ1–CH2OEt, если нуклеофилом является молекула этанола. Протонированное производное бензилового спирта имеет брутто-формулу C22H18NO+, а протонированный эфир – C24H22NO+, соответствующие пики с m/z = 312.134 (19.0%) и m/z = 340.165 (72.7%) наблюдаются в масс-спектре, причем последний является одним из основных, рис. 4. Как видно, суммарная интенсивность этих пиков близка к интенсивности пика SBQ2–OH·H+, в соответствии с теоретически необходимым соотношением 1 : 1, что подтверждает предположение о гетеролитическом разрыве мостиковой связи в диаде.
Вероятно, гетеролитический разрыв связи происходит по механизму нуклеофильного замещения и облегчается в протонированной форме SBQ2-фрагмента диады, поскольку в возбужденном состоянии за счет мезомерного эффекта кислорода положительный заряд в значительной степени локализуется на этом атоме, что облегчает нуклеофильную атаку на соседний бензильный атом углерода с разрывом связи CH2–O.
Таким образом, основной канал фотоинициированной деструкции гидрохлорида диады D2·2HCl – это гетеролиз связи CH2–O, схема 4 , путь А. При этом образуются производные двух SBQ-фотохромов, близкие по структуре модельным соединениям М1 и М2, в которых полностью сохраняются π-системы фотохромов. Очевидно, что фотодеструкция диады по пути А слабо проявляется в спектре поглощения – в той степени, в которой спектр диады отличается от суммы спектров отдельных SBQ фотохромов (см. выше). В то же время анализ спектров поглощения реакционной смеси свидетельствует о постепенном исчезновении хромофорной сис-темы SBQ и появлении новых хромофоров. В результате побочных реакций происходит сдвиг спектра поглощения в коротковолновую область, из чего можно сделать вывод, что новые хромофоры имеют меньший размер системы сопряженных π-связей по сравнению с SBQ фотохромами.
Схема 4 . Основные пути фотоинициированной деструкции гидрохлорида диады D2·2HCl, приведены рассчитанные значения m/z протонированных молекулярных ионов, SBQ фотохромы показаны в форме s-цис конформеров транс-изомеров.
Реакция, приводящая к уменьшению π-системы SBQ-хромофора – это присоединение молекулы этанола по этиленовой связи. При этом происходит разрыв цепи сопряжения, общая π-система SBQ-хромофора разделяется на две меньшие π-системы – бензохинолина и бензола, образуется производное алкилбензохинолина и спектр поглощения смещается гипсохромно. Ранее такая реакция наблюдалась для некоторых производных SBQ [22]. Аддукт диады с этанолом имеет брутто-формулу C45H36N2O2, пики протонированной формы с m/z = 637.280 (7.0%) и дипротонированной формы с m/z = 319.142 (62.1) наблюдаются в масс-спектре, рис. 4. В сумме это дает второй по выходу продуктов канал деструкции диады, схема 4 , путь В, сравнимый с гетеролизом мостиковой группы при использованном времени фотолиза.
В масс-спектре отсутствует пик аддукта диады с двумя молекулами этанола, из чего можно сделать вывод, что этанол присоединяется только к одному из SBQ-фотохромов диады. На основании исследования SBQ-фотохромов с разными заместителями в стирильном фрагменте [22], предположительно, активным является SBQ1-фотохром, как показано на схеме 4 , путь В. На схеме также учтено, что, в зависимости от механизма присоединения, могут образовываться изомерные продукты – производные алкилбензохинолина, которые имеют одинаковые π-системы и молекулярные массы, поэтому неразличимы ни в спектрах поглощения, ни в масс-спектрах.
Формально, пики (ковалентно-связанного) аддукта диады с этанолом можно было бы отнести к кластерам (ассоциатам, связанным водородной связью) протонированных форм диады с молекулой этанола, однако эти пики отсутствуют в спектре нефотолизованной диады, что противоречит такому отнесению.
В масс-спектре наблюдаются довольно интенсивные пики с m/z = 356.160 (21.9%) и 384.192 (18.7%), рис. 4, которые соответствуют катионам ${{{\text{C}}}_{{{\text{24}}}}}{{{\text{H}}}_{{{\text{22}}}}}{\text{NO}}_{2}^{ + }$ и ${{{\text{C}}}_{{26}}}{{{\text{H}}}_{{26}}}{\text{NO}}_{2}^{ + }$ соответственно. Такой состав должны иметь, например, дегидрированные вторичные продукты присоединения этанола к этиленовой группе первичных продуктов SBQ1–CH2OH и SBQ1–CH2OEt. Присоединение молекулы этанола к фотохромам, содержащим SBQ1-фрагмент, согласуется с высказанным выше предположением, что этанол присоединяется к SBQ1-фотохрому в диаде. Остается неясным, на какой стадии происходит дегидрирование и какова структура этих соединений. Для выяснения этого вопроса необходимы дополнительные исследования.
Таким образом, данные масс-спектрометрического анализа, в совокупности с данными спектрофотометрического анализа позволяют выявить два основных канала фотоинициированной деструкции гидрохлорида диады D2·2HCl. Первый канал (схема 4 , путь А) – это гетеролитический разрыв мостиковой связи CH2−O между двумя SBQ фотохромами, приводящий к разрушению супрамолекулярной структуры диады. Второй канал (схема 4 , путь В) – это присоединение молекулы этанола, предположительно, к SBQ1-фотохрому, что приводит к деструкции фотохромной π-системы и гипсохромному сдвигу спектра поглощения.
Поскольку в начальный период облучения (0–1200 с) в диаде протекает, практически, только реакция ФИ фотохромов (схема 3 ), кинетику спектральных изменений в этот период времени можно описать упрощенной системой дифференциальных уравнений (1)–(4) (см. подробнее [1]):
(1)
$\begin{gathered} {{d{{c}_{{EE}}}} \mathord{\left/ {\vphantom {{d{{c}_{{EE}}}} {dt}}} \right. \kern-0em} {dt}} = ({{\varphi }_{{{\text{ct1}}}}}{{\varepsilon }_{{{\text{c1}}}}}{{c}_{{ZE}}} + {{\varphi }_{{{\text{ct2}}}}}{{\varepsilon }_{{{\text{c2}}}}}{{c}_{{EZ}}}-- \\ - \,\,({{\varphi }_{{{\text{tc1}}}}}{{\varepsilon }_{{{\text{t1}}}}} + {{\varphi }_{{{\text{tc2}}}}}{{\varepsilon }_{{{\text{t2}}}}}){{c}_{{EE}}}){{I}_{0}}F, \\ \end{gathered} $(2)
$\begin{gathered} {{d{{c}_{{ZE}}}} \mathord{\left/ {\vphantom {{d{{c}_{{ZE}}}} {dt}}} \right. \kern-0em} {dt}} = {\text{ }}({{\varphi }_{{{\text{tc1}}}}}{{\varepsilon }_{{{\text{t1}}}}}{{c}_{{EE}}}-- \\ - \,\,({{\varphi }_{{{\text{ct1}}}}}{{\varepsilon }_{{{\text{c}}1}}} + {{\varphi }_{{{\text{tc}}2}}}{{\varepsilon }_{{{\text{t}}2}}}){{c}_{{ZE}}} + {{\varphi }_{{{\text{ct2}}}}}{{\varepsilon }_{{{\text{c}}2}}}{{c}_{{ZZ}}}){{I}_{0}}F, \\ \end{gathered} $(3)
$\begin{gathered} {{d{{c}_{{EZ}}}} \mathord{\left/ {\vphantom {{d{{c}_{{EZ}}}} {dt}}} \right. \kern-0em} {dt}} = ({{\varphi }_{{{\text{tc2}}}}}{{\varepsilon }_{{{\text{t}}2}}}{{c}_{{EE}}}-- \\ - \,\,({{\varphi }_{{{\text{ct2}}}}}{{\varepsilon }_{{{\text{c}}2}}} + {{\varphi }_{{{\text{tc}}1}}}{{\varepsilon }_{{{\text{t}}1}}}){{c}_{{EZ}}} + {{\varphi }_{{{\text{ct1}}}}}{{\varepsilon }_{{{\text{c}}1}}}{{c}_{{ZZ}}}){{I}_{0}}F, \\ \end{gathered} $(4)
$\begin{gathered} {{d{{c}_{{ZZ}}}} \mathord{\left/ {\vphantom {{d{{c}_{{ZZ}}}} {dt}}} \right. \kern-0em} {dt}} = ({{\varphi }_{{{\text{tc1}}}}}{{\varepsilon }_{{{\text{t}}1}}}{{c}_{{EZ}}} + {{\varphi }_{{{\text{tc}}2}}}{{\varepsilon }_{{{\text{t}}2}}}{{c}_{{ZE}}}-- \hfill \\ - \,\,({{\varphi }_{{{\text{ct}}1}}}{{\varepsilon }_{{{\text{c}}1}}} + {{\varphi }_{{{\text{ct}}2}}}{{\varepsilon }_{{{\text{c}}2}}}){{c}_{{ZZ}}}){{I}_{0}}F, \hfill \\ \end{gathered} $Систему дифференциальных уравнений (1)–(4) решали численно путем минимизации среднеквадратичной ошибки оптической плотности ΔA = (Σ(Acalc − Aexp)2/m)1/2, где Acalc – оптическая плотность, рассчитанная численным интегрированием уравнений (1)–(4), Aexp – измеренная оптическая плотность реакционной смеси, m – число экспериментальных точек на кинетической кривой. В расчетах учитывался процесс ПЭ от SBQ1·HCl к SBQ2·HCl, который в EE изомере диады происходит с φET = 0.92 (см. выше). Для EZ изомера диады было использовано меньшее значение φET = 0.5, поскольку при переходе акцептора энергии SBQ2·HCl из транс- в цис-форму интеграл перекрывания и радиус Фёрстера уменьшаются, табл. 1.
Аппроксимация экспериментальных точек на начальном участке кинетической кривой (0 – 1200 с) дала значения квантовых выходов φtc1 = = 0.054, φct1 = 0.19, φtc2 = 0.38, φct2 = 0.81, аппроксимирующая кривая показана на вставке на рис. 2 (диапазон 0–1200 с). Как следует из полученных данных, гидрохлорид бифотохромной диады D2·2HCl имеет сравнительно высокие квантовые выходы ФИ фотохромов и способен функционировать как фотонный двухадресный МЛВ по механизму реакции ФИ, однако наличие побочных реакций, приводящих к деструкции диады, препятствует такой функции.
ЗАКЛЮЧЕНИЕ
Таким образом, при протонировании несимметричной бифотохромной диады D2, содержащей два разных стирилбензохинолиновых (SBQ) фотохрома, наблюдаются батохромные сдвиги спектров поглощения и флуоресценции. В гидрохлориде диады D2·2HCl, как ранее в нейтральной диаде D2, зафиксирован перенос энергии между SBQ-фотохромами, эффективность которого уменьшилась от 99% в нейтральной форме до 92% в протонированной диаде. Под действием света гидрохлорид D2·2HCl подвергался реакции фотоизомеризации SBQ-фотохромов. Кроме того, при длительном облучении D2·2HCl зафиксированы побочные реакции, в основном, связанные с гетеролитическим разрывом мостиковой связи CH2–O между двумя SBQ фотохромами, вызывающим деструкцию супрамолекулярной структуры диады, и присоединением молекулы этанола к SBQ1-фотохрому, приводящим к деструкции π-системы фотохрома. Эти реакции препятствуют функционированию диады в качестве фотонного МЛВ.
Список литературы
Будыка М.Ф., Гавришова Т.Н., Ли В.М., Дозморов С.А. // Химия высоких энергий. 2021. Т. 55. С. 25.
Budyka M.F., Gavrishova T.N., Potashova N.I. // ChemistrySelect. 2016. V. 1. P. 36.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М. // Химия высоких энергий. 2017. Т. 51. С. 216.
Budyka M.F., Gavrishova T.N., Potashova N.I., Li V.M. // ChemistrySelect. 2018. V. 3. P. 10651.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Федулова Ю.А. // Химия высоких энергий. 2019. Т. 53. С. 206.
Szacilowski K. // Chem. Rev. 2008. V. 108. P. 3481.
Будыка М.Ф. // Химия высоких энергий. 2010. Т. 44. С. 154.
Gust D., Andreasson J., Pischel U., Moore T.A., Moore A.L. // Chem. Commun. 2012. V. 48. P. 1947.
Budyka M.F., Potashova N.I., Gavrishova T.N., Li V.M. // Nanotechnol. Russ. 2012. V. 7. P. 280.
Будыка М.Ф. // Успехи химии. 2017. Т. 86. С. 181.
Erbas-Cakmak S., Kolemen S., Sedgwick A.C., Gunnlaugsson T., James T.D., Yoon J., Akkaya E.U. // Chem. Soc. Rev. 2018. V. 47. P. 2228.
Tzeli D., Petsalakis I.D. // J. Chem. 2019. 6793490.
Будыка М.Ф., Гавришова Т.Н., Ли В.М., Дозморов С.А., Козловский В.И. // Химия высоких энергий. 2021. Т. 55. С. 13.
Kozlovski V.I., Brusov V.S., Sulimenkov I.V., Pikhtelev A.R., Dodonov A.F. // Rapid Commun. Mass Spectrom. 2004. V. 18. P. 780.
Becker H.D. // Chem. Rev. 1993. V. 93. P. 145.
Braslavsky S.E., Fron E., Rodriguez H.B., Roman E.S., Scholes G.D., Schweitzer G., Valeur B., Wirz J. // Photochem. Photobiol. Sci. 2008. V. 7. P. 1444.
Perrier A., Maurel F., Jacquemin D. // Acc. Chem. Res. 2012. V. 45. P. 1173.
Budyka M.F., Li V.M. // ChemPhysChem. 2017. V. 18. P. 260.
Будыка М.Ф., Ли В.М. // Химия высоких энергий. 2017. Т. 51. С. 354.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М. // Химия высоких энергий. 2010. Т. 44. С. 436.
Pomerantsev A.L., Chemometrics in Excel, John Wiley & Sons, Inc., Hoboken, 2014.
Будыка М.Ф., Ли В.М., Гавришова Т.Н., Поташова Н.И. // Химия высоких энергий. 2015. Т. 49. С. 185.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий