Химия высоких энергий, 2020, T. 54, № 4, стр. 316-318
Влияние радиолиза на термостойкость хитозана и лигносульфоната
В. В. Калистратова a, Е. В. Белова a, *, А. В. Пономарев a
a Институт физической химии и электрохимии им. А.Н. Фрумкина Российской Академии наук
119991 Москва, Россия
* E-mail: bl174@bk.ru
Поступила в редакцию 05.02.2020
После доработки 05.02.2020
Принята к публикации 16.02.2020
Аннотация
Методами дифференциально-сканирующей калориметрии и термогравиметрии исследовано пост-радиационное термическое разложение лигносульфонатов и крилевого хитозана. Показано, что облучение способствует более чем двукратному снижению выхода угольного остатка в хитозане, но мало влияет на термолиз лигносульфонатов.
Лигнин и хитин рассматриваются как ценное возобновляемое сырье для получения востребованных химических продуктов [1, 2]. Ключевым процессом преобразования подобного биосырья в реагенты считается пирогенетическое разложение. Но в случае лигнина и хитина пиролиз малопродуктивен, однако его производительность и ассортимент продуктов могут быть улучшены путем сочетания пиролиза с радиолизом. В условиях высокотемпературного радиолиза основными продуктами конверсии лигнина являются востребованные одно- и двухатомные фенолы, а в случае хитина – пиридины, пирролы и другие азотсодержащие циклические соединения [3, 4].
На практике лигнин и хитин часто встречаются в виде продуктов их первичной переработки – лигносульфонатов и хитозанов, соответственно. Лигносульфонаты образуются в качестве побочных продуктов варки целлюлозы и представляют собой соли разветвленных бензилсульфоновых кислот с мольной массой вплоть до 200 000 и степенью сульфирования до 92 мас. %. Лигносульфонаты используются преимущественно в качестве пластификаторов, наполнителей или для термического получения углей [5]. Хитозан – продукт диацетилирования хитина. Он ценится как нетоксичный и неаллергенный сорбент природного происхождения и используется в получении косметических и медикаментозных средств, сорбентов, пищевых консервантов [6]. Вместе с тем, потенциал лигносульфонатов и хитозанов как источников соответствующих фенолов и азоторганических соединений до сих пор не реализован. В этой связи знание термической и радиационной стойкости лигносульфонатов и хитозанов важно с точки зрения лучшего понимания и планирования их промышленной переработки, а также для их использования при создании композиционных материалов.
В настоящей работе исследовали пост-радиационные термические превращения крилевого хитозана (производитель ВНИРО) и лигносульфонатов (магний-натриевый лигносульфонатный комплекс, производитель ЦБК “Кама”) в условиях изотермического нагрева. Источником излучения служил линейный ускоритель УЭВК-10-10Т (энергия 8 МэВ, средний ток пучка ≤500 мкА). Для дозиметрии использовали пленочный сополимер с феназиновым красителем СО ПД(Ф)Р-5/50 (ГСО 7865-2000). Мощность дозы составляла 0.22 кГр/с. Хитозан предварительно измельчали в агатовой ступке, а затем высушивали на воздухе при 80°С в течение 4 ч. Совмещенную дифференциально-сканирующую калориметрию (ДСК) и термогравиметрию (ТГМ) осуществляли на приборе STA Netzsch 449 F1 Jupiter в воздушной атмосфере. Образцы массой около 10 мг помещались в корундовый тигель и нагревались со скоростями 2 или 5 град. в минуту (далее СН – скорость нагрева, [град. в минуту]). Образцом сравнения служил оксид алюминия.
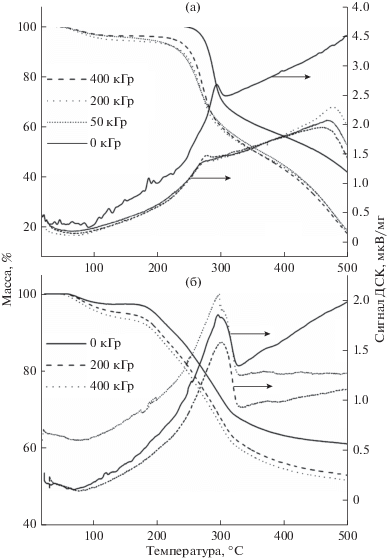
Исходный хитозан и лигносульфонат при нагреве до 500°С претерпевают термическое разложение, о чем свидетельствуют кривые ДСК и ТГМ, представленные на рисунке. Независимо от СН, масса необлученного хитозана снижается до 41.7 ± 0.3%, а лигносульфоната – до 59.8 ± 1.3%. Предварительное облучение способствует более интенсивному термическому разложению. В случае хитозана, при СН = 2 и температуре 500°С масса обугленного остатка составляет 18.4, 17.5 и 17.2% при дозах 50, 200 и 400 кГр соответственно. Однако при СН = 5 и дозе 50 кГр хитозан разлагается лишь до ≈35%, что указывает на более низкую скорость разложения по сравнению со скоростью нагрева. При более высоких дозах, 200 и 400 кГр, выходы распада не зависят от СН. Участок наиболее интенсивного разложения хитозана на кривых ТГМ смещается в область более низких температур по мере роста дозы. Так в необлученном хитозане этот участок начинается при ≈270°С, а в облученном образце (400 кГр) – при 240°С. Одновременно смещаются максимумы сигналов ДСК: с 295 (0 кГр) до 273°С (400 кГр). Доля радиационно-индуцированных легких продуктов, испаряющихся ниже 240°С, не превышает 7–8%, тогда как доля новых легкоразлагаемых тяжелых соединений составляет не менее 24%. Лигносульфонат менее восприимчив к предварительному облучению. При СН = 2 масса обугленного остатка в 1.15–1.18 раза, а при СН = 5 – в 1.1 раза, ниже по сравнению с остатком в необлученном образце. Рисунок 1 свидетельствует, что начало разложения, определяемое по кривым ТГМ, в облученных и необлученном образцах наблюдается при одинаковых температурах. Положения максимумов на кривых ДСК также остаются неизменными – около 300°С.
Из-за эффекта клетки, радиолитические эффекты в твердых образцах не так заметны, как в жидкостях. В лигносульфонате эффект клетки очевидно дополняется процессами химической и физической защиты, характерными для полиароматических соединений. Система сопряженных связей облегчает диссипацию избыточной энергии, а также способствует сшивке молекул и присоединению радикалов. Важную защитную функцию выполняют также сульфогруппы. Они легко отщепляются в радиолитических процессах, о чем свидетельствует появление резкого сернистого запаха у облученных образцов и высокое содержание диметилполисульфидов среди тяжелых продуктов. Десульфирование макромолекул потребляет существенную часть избыточной энергии и, тем самым, разложение органического скелета ослабляется.
Хитозан – более рыхлый материал. Это несколько ослабляет эффект клетки и облегчает удаление легких продуктов фрагментации (СО2, Н2 и др. [7]) из его объема. Пост-радиационное снижение массы хитозана в процессе ТГМ начинается уже при температурах ниже 100°С. Радиолиз приводит, прежде всего, к расщеплению гликозидных связей и дезаминированию [7, 8]. Радиолитические интермедиаты в хитозане, как и в других полисахаридах, склонны к термической дегидратации [3, 7]. В результате этого процесса возникают нестабильные карбонильные соединения, которые, вероятно, разлагаются при более низких температурах по сравнению с исходным хитозаном. При этом хитозан более восприимчив к облучению, чем хитин. Радиационно-химический выход разрыва гликозидных связей в хитозане составляет 4.2 ± 0.3 1/100 эВ, что заметно выше, чем в хитине, но ниже, чем в целлюлозе [7].
Таким образом, замещение гидроксилов лигнина на сульфогруппы обеспечивает лигносульфонатам более высокую радиационную и термическую стойкость. Сульфированная форма лигнина более благоприятна с точки зрения реализации механизмов физической и химической защиты органического скелета от разложения. В свою очередь, удаление ацетогрупп хитина, с образованием легко протонируемых аминогрупп хитозана, приводит к понижению радиационной и термической стойкости полимерной цепи.
Список литературы
CriniG. // Environ. Chem. Lett. 2019. V. 17. P. 1623. https://doi.org/10.1007/s10311-019-00901-0
Ponnusamy V.K., Nguyen D.D., Dharmaraja J., Shobana S., Banu J.R., Saratale R.G., Chang S.W., Kumar G. // Bioresour. Technol. 2019. V. 271. P. 462. https://doi.org/10.1016/j.biortech.2018.09.070
Метревели А.К., Метревели П.К., Макаров И.Е., Пономарев А.В. // Химия высоких энергий. 2013. Т. 47. С. 89. https://doi.org/10.7868/S0023119713020099
Gorbarev I.N., Kasterin A.I., Metreveli P.K., Ponoma-rev A.V. // J. Wood Sci. 2018. V. 64. P. 675. https://doi.org/10.1007/s10086-018-1746-4
Niaounakis M. Biopolymers: Applications and Trends. Elsevier. 2015. https://doi.org/10.1016/c2014-0-00936-7
Ali A., Ahmed S. // Int. J. Biol. Macromol. 2018. V. 109. P. 273. https://doi.org/10.1016/j.ijbiomac.2017.12.078
Ершов Б.Г. // Успехи химии. 1998. Т. 67. № 4. С. 353. https://doi.org/10.1070/RC1998v067n04ABEH000379
Yoksan R., Akashi M., Miyata M., Chirachanchai S. // Radiat. Res. 2004. V. 161. P. 471. https://doi.org/10.1667/rr3125
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий