Химия высоких энергий, 2020, T. 54, № 1, стр. 29-33
О влиянии протолитических реакций в возбужденном состоянии на выполнимость термодинамических соотношений для спектров люминесценции
Е. Е. Волкова a, b, С. А. Товстун a, c, *
a ФГБУН Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. акад. Семенова, 1, Россия
b Московский государственный университет им. М.В. Ломоносова, Факультет фундаментальной
физико-химической инженерии
119991 Москва, Ленинские горы, Россия
c Московский физико-технический институт (национальный исследовательский университет)
141701 Московская обл., Долгопрудный, Институтский пер., 9, Россия
* E-mail: tovstun@icp.ac.ru
Поступила в редакцию 24.06.2019
После доработки 24.06.2019
Принята к публикации 24.07.2019
Аннотация
В водном растворе флуоресцеин может существовать в виде нескольких протолитических форм. Переходы между этими формами в возбужденном состоянии значительно усложняют процесс изучения люминесцентных свойств отдельных компонент. Для такой системы спектр люминесценции зависит от длины волны возбуждения. В данной работе показано, что в образце, обладающем этими свойствами, при любых условиях выполняется универсальное термодинамическое соотношение Кеннарда для интенсивности люминесценции, в то время как менее общее соотношение Кеннарда–Степанова может нарушаться.
ВВЕДЕНИЕ
В 1926 г. Э.Г. Кеннард опубликовал работу [1], в которой дал соотношение, справедливое для любого люминофора в состоянии термодинамического равновесия. Это соотношение можно записать в следующем виде [2]:
(1)
$\frac{{F({{\lambda }_{{{\text{ex}}}}},{{\lambda }_{{{\text{em}}}}})}}{{F({{\lambda }_{{{\text{em}}}}},{{\lambda }_{{{\text{ex}}}}})}} = \frac{{{{F}_{{\text{B}}}}({{\lambda }_{{{\text{em}}}}})}}{{{{F}_{{\text{B}}}}({{\lambda }_{{{\text{ex}}}}})}}\frac{{(1 + n({{\lambda }_{{\operatorname{em} }}}))}}{{(1 + n({{\lambda }_{{{\text{ex}}}}}))}},$(2)
$\ln \left( {\frac{{\operatorname{PL} (\lambda , {{\lambda }_{0}})}}{{\operatorname{PLE} (\lambda ,{{\lambda }_{0}})}}\frac{{{{\lambda }^{4}}}}{{{{\lambda }_{0}}^{4}}}} \right) = - \frac{{hc}}{{kT}}\left( {\frac{1}{\lambda } - \frac{1}{{{{\lambda }_{0}}}}} \right),$Такой выбор исследуемого люминофора объясняется следующим. Молекула флуоресцеина содержит в себе три способных к протонированию/депротонированию кислорода. Присоединяя и отсоединяя протон, она, таким образом, может изменять свои люминесцентные свойства. В водном растворе в диапазоне pH от 0 до 9 данное соединение всегда присутствует в нескольких формах [4]. Это катионная, три нейтральные, две анионные и дианионная формы (рис. 1).
Рис. 1.
Формы флуоресцеина в водном растворе; жирным шрифтом выделены функциональные группы, способные к протонированию/депротонированию.
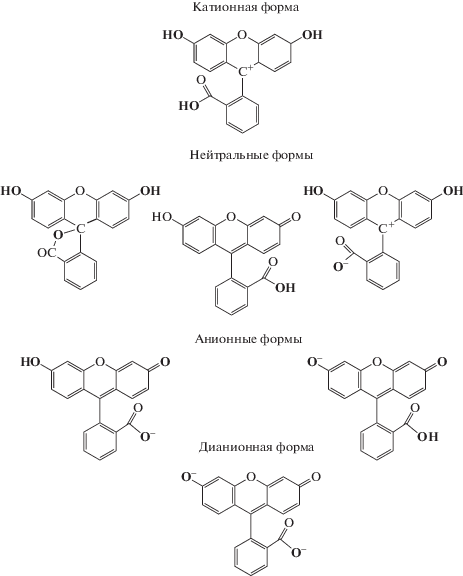
В данной работе все нейтральные формы (далее нейтральная форма) рассматриваются как одна форма, так как в растворе они всегда содержатся в одной и той же пропорции вне зависимости от pH, а в спектре поглощения эффективно выступают как одна компонента. В анионной форме можно пренебречь фенолят-анионом (правая молекула аниона на рис. 1), так как в водном растворе он практически не наблюдается. В зависимости от pH раствора, в нем может содержаться в определенной пропорции смесь нескольких форм. При значениях pH, равных отрицательным десятичным логарифмам констант диссоциации pKa для определенных форм, в растворе находятся в почти одинаковых количествах сразу две формы. Так, в работе [5] были получены значения pKa для каждой из форм: 2.22 для катиона, 4.24 для совокупности нейтральных формы, 6.28 для аниона.
Помимо способности к протонированию/депротонированию в зависимости от pH в основном состоянии, молекула флуоресцеина способна переходить в другую форму и в возбужденном состоянии [6]. Дело в том, что в такой молекуле время протолитической реакции для катиона и нейтральной формы много меньше времени жизни возбужденного состояния. Поэтому мы практически не наблюдаем спектр люминесценции чистого катиона и чистой нейтральной формы – в возбужденном состоянии они мгновенно переходят в анион (хотя при очень низких pH равновесие даже в возбужденном состоянии смещено в сторону катионной формы).
Таким образом, ввиду наличия протолитических реакций в молекуле в возбужденном состоянии, раствор флуоресцеина является подходящим объектом для экспериментальной проверки соотношения Кеннарда – оно должно выполняться, каким сложным бы ни был механизм люминесценции.
Чтобы показать нетривиальность полученного результата, в работе также проведена проверка соотношения Кеннарда–Степанова [7], которое, в отличие от соотношения Кеннарда (1), связывает спектры люминесценции PL(λ) со спектрами поглощения ABS(λ):
(3)
$\ln \left( {\frac{{\operatorname{PL} (\lambda )}}{{\operatorname{ABS} (\lambda )}}{{\lambda }^{4}}} \right) = - \frac{{hc}}{{kT}}\frac{1}{\lambda } + {\text{const}}{\text{.}}$Соотношение (3) выполняется для люминофоров, в которых все центры люминесценции одинаковы, то есть отсутствует неоднородное уширение, и в возбужденном состоянии быстро по сравнению с временем жизни люминесценции устанавливается тепловое равновесие по уровням энергии. Оно может также выполняться для различных центров люминесценции, если в возбужденном состоянии они могут достаточно быстро переходить друг в друга или обмениваться энергией. В случае флуоресцеина в воде возможно сосуществование различных его форм, которые могут переходить друг в друга в основном и в возбужденном состояниях. Заранее не вполне очевидно, будет ли в этом случае выполняться соотношение Кеннарда–Степанова, в силу чего имеет смысл проверить это экспериментально.
МЕТОДИКА ЭКСПЕРИМЕНТА
Оборудование
Спектры поглощения измеряли на спектрофотометре “Shimadzu UV 3101PC”. Люминесцентные измерения проводили на спектрофлуориметре “Shimadzu RF-6000”. При этом на путях возбуждающего и регистрируемого лучей ставились светофильтры, не пропускающие свет высших порядков дифракции на монохроматорах прибора. Измерения проводились при комнатной температуре в односантиметровых кварцевых кюветах. Полосы пропускания монохроматоров возбуждения и наблюдения составляли по 3 нм. Взвешивание образцов осуществлялось на аналитических весах AP-250D (OHAUS).
Приготовление растворов
Для исследований были приготовлены три вида буферных растворов: фосфатный буфер концентрации 5.6 мМ (под концентрациями буферных растворов подразумеваются суммы концентраций кислоты и основания, из которых он состоит) в интервале pH от 5.9 до 8, фосфатный буфер концентрации 1.11 М в интервале pH от 4.1 до 5.9, цитратный буфер концентрации 0.05 М в интервале pH от 1.5 до 4.0. Для приготовления этих растворов были взяты гидрофосфат и дигидрофосфат натрия, цитрат натрия и 36%-й раствор соляной кислоты.
Для проведения измерений был приготовлен концентрированный раствор флуоресцеина с оптической плотностью ~15. Краситель растворялся в 0.01 М NaOH после чего был использован для приготовления растворов высокой и низкой оптической плотности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 2 показаны результаты измерений спектров люминесценции и поглощения при нескольких значениях pH растворителя, при которых преобладает та или иная форма. Полученные спектры поглощения демонстрируют следующее поведение образца. При pH 8 в растворе преобладает дианионная форма, для которой характерен спектр поглощения, показанный на рис. 2 кривой 1. При понижении pH до 5.2 оптическая плотность заметно падает и в районе 450 нм появляется слабо выраженный второй пик (рис. 2, кривая 2) – здесь преобладает анионная форма. При pH 3.5 в наибольшем количестве в растворе присутствует нейтральная форма. Ее оптическая плотность является самой низкой по сравнению с другими формами (рис. 2, кривая 3). При значениях pH около 1.5 можно наблюдать спектр поглощения практически чистого катиона (рис. 2, кривая 4). Его оптическая плотность больше, по сравнению с анионной и нейтральной формами.
Рис. 2.
Спектры люминесценции при возбуждении на 490 нм (штриховые линии) и спектры поглощения (сплошные линии) водных растворов флуоресцеина для различных значений pH, соответствующих преобладанию той или иной протолитической формы: 8 для дианиона (1), 5.6 для аниона (2), 3.5 для нейтральных форм (3), 1.5 для катиона (4). Спектры люминесценции для наглядности отмасштабированы по вертикали.
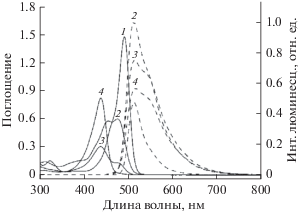
В то время как спектры поглощения показывают поведение флуоресцеина в основном состоянии, спектры люминесценции могут показать его поведение в возбужденном состоянии. На рисунке видно, что интенсивность люминесценции для различных показателей кислотности меняется (при одинаковых значениях оптической плотности для каждого образца). Известно, что в возбужденном состоянии в флуоресцеине имеют место протолитические реакции [6].
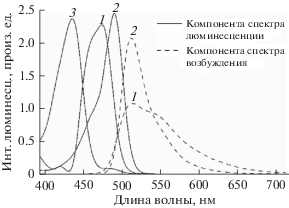
Для того чтобы убедиться в адекватности предлагаемой в литературе схемы протолитических реакций флуоресцеина, был проведен анализ матриц возбуждения/люминесценции по методике PARAFAC. Результаты этого анализа указаны на рис. 3. Здесь можно наблюдать, что для спектра возбуждения люминесценции получено три компоненты в разложении, в то время как для спектра люминесценции всего две. Такое разложение объясняется следующим образом. Из-за слабого π‑π‑сопряжения между ксантеновой частью красителя и бензольным кольцом спектры поглощения и люминесценции различных форм флуоресцеина определяются в основном степенью протонирования ксантеновой части. В этой части красителя имеется два кислорода, к которым может присоединяться протон. С учетом симметрии положения этих групп получается три возможных состояния протонирования ксантеновой части красителя и, соответственно, три различных компоненты в спектре возбуждения люминесценции (сплошные линии на рис. 3). Также, гипотетически, должно быть и три компоненты для спектра люминесценции, но в реальности одна из них, соответствующая полностью протонированной ксантеновой части, при положительных pH почти не проявляется из-за быстрого отщепления протона в возбужденном состоянии. Поэтому в наблюдаемой люминесценции остается только две компоненты (штриховые линии на рис. 3). Таким образом, анализ матриц возбуждения/люминесценции подтвердил предполагаемый в литературе механизм протолитических реакций в возбужденном состоянии.
Рис. 3.
Элементарные спектры люминесценции и возбуждения люминесценции, полученные в результате разложения матриц возбуждения/люминесценции по методике PARAFAC. На рисунке изображены компоненты для анионной (1), дианионной (2) и катионной (3) форм.
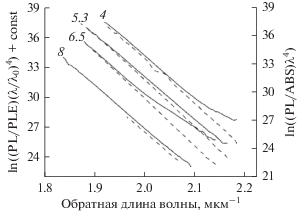
Результат проверки соотношения Кеннарда (2), и Кеннарда–Степанова (3) показан на рис. 4. Видно, что при значениях pH равных 6.5 и 4 построенные кривые для соотношения Кеннарда–Степанова не удовлетворяют линейному закону, в то время как построенные для соотношения Кеннарда прямые подчиняются линейному закону всегда. Также были посчитаны приблизительные значения для коэффициента наклона этих кривых, который равен –hc/kT. Из этих значений вычислялась температура раствора. Было получено, что для соотношения Кеннарда отклонения для реальных значений (298 K) не превышали 5%, в то время как для соотношения Кеннарда–Степанова отклонения доходили до 18%.
Рис. 4.
Сравнение линейных анаморфоз для соотношений Кеннарда (штриховая линия) и Кеннарда–Степанова (сплошная линия) для раствора флуоресцеина при различных pH растворителя (указаны над кривыми). Анаморфозы соотношения Кеннарда для наглядности смещены вдоль оси ординат, поскольку для исследования важен только коэффициент наклона.
ЗАКЛЮЧЕНИЕ
Было проведено исследование люминесцентных свойств раствора флуоресцеина при различных значениях pH буферного растворителя и показано, что для такого образца действительно имеют место протолитические реакции в возбужденном состоянии, описанные в литературе. Также показано, что для раствора флуоресцеина в диапазоне pH от 2 до 9 универсальный термодинамический закон Кеннарда всегда выполняется, однако термодинамическое соотношение Кеннарда–Степанова может нарушаться.
Список литературы
Kennard E.H. // Phys. Rev. 1926. V. 28. P. 672.
Tovstun S.A., Razumov V.F., Spirin M.G., Martyanova E.G., Brichkin S.B. // J. Lumin. 2017. V. 190. P. 436.
Гадомская А.В., Разумов В.Ф., Товстун С.А. // Химия высоких энергий. 2018. Т. 52. № 4. С. 289.
Martin M.M., Lindqvist L. // J. Lumin. 1975. V. 10. P. 381.
Smith S.A., Pretorius W.A. // Water SA. 2002. V. 28. № 4. P. 395.
Sjöback R, Nygren J., Kubista M. // Spectrochimica Acta Part A. 1995. V. 51. P. L7.
Степанов Б.И. // ДАН СССР. 1957. Т. 112. С. 839.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


