Химия высоких энергий, 2020, T. 54, № 1, стр. 68-72
Сравнительная кинетика изменения химического состава жидкого водного анода и катода тлеющего разряда постоянного тока в воздухе
Д. А. Шутов a, *, Н. А. Батова a, В. В. Рыбкин a
a Ивановский государственный химико-технологический университет
153000 Иваново, Шереметевский пр.,7, Россия
* E-mail: shutov@isuct.ru
Поступила в редакцию 02.07.2019
После доработки 02.07.2019
Принята к публикации 12.08.2019
Аннотация
Впервые исследована кинетика образования нитрат, нитрит ионов и пероксида водорода − продуктов воздействия тлеющего разряда в воздухе на дистиллированную воду, являющуюся анодом плазменно-растворной системы. Проведен сравнительный анализ полученных экспериментальных результатов с закономерностями поведения концентраций продуктов плазменного воздействия на жидкий катод. Показано, что изменение полярности жидкого электрода существенно влияет на состав и кинетику образования продуктов в жидкой фазе. Предложены качественные объяснения наблюдаемых различий.
ВВЕДЕНИЕ
Известно, что действие разряда постоянного тока на воду, выступающую в роли катода, приводит к ее, так называемой, химической активации [1]. Наиболее подробно исследованы разряды между металлическим анодом и раствором, так называемые разряды с жидким катодом [1, 2]. В этом случае поверхность раствора подвергается интенсивной ионной бомбардировке. Поток высокоэнергетических ионов вызывает интенсивные химические превращения в растворе. Наиболее надежно регистрируется образование молекул пероксида водорода, а также ионы ${\text{NO}}_{2}^{ - }$ и ${\text{NO}}_{3}^{ - }.$ Факт влияния на концентрацию H2O2 добавки реактива Фентона свидетельствует о появлении в жидкой фазе радикалов ∙ОН и, косвенно, об образовании радикалов Н. Работ, в которых бы проводилось прямое измерение концентраций радикалов не встречалось, все известные результаты основаны на косвенных измерениях с использованием ловушек радикалов – реагентов, селективно реагирующих с данным видом радикалов. При действии разрядов на воду в ней возможно также образование сольватированных электронов. Нам известна только одна работа [3], где измерялась концентрация сольватированных электронов по поглощению (λ = 700 нм, максимум полосы поглощения). Кроме того, воздействие разрядов различного типа на воду (диэлектрического барьерного, разряда скользящей дуги, стримерного, тлеющего и т.д.) приводит к изменению pH раствора. Для разрядов постоянного тока с жидким катодом это изменение pH заключается в его уменьшении со временем обработки по близкому к экспоненциальному закону.
В последние несколько лет появились практические приложения, в которых плазменно-растворные системы с жидким катодом либо не могут обеспечить протекание целевого процесса (например, синтез бинарных соединений возможен только в случае, если раствор выступает в роли анода [4–6]), либо эффективность систем с жидким анодом существенно выше, как, в частности, показано в работах [7, 8], для целей определения содержания металлов в растворах. Однако, как не парадоксально, если кинетика процессов, протекающих в жидком катоде, изучена достаточно подробно, то в случае жидкого анода закономерности процессов, протекающих даже в таком относительно простом объекте для исследования, как дистиллированная вода, не исследовались вовсе.
Целью данной работы являлось сравнительное исследование кинетики изменения состава жидкого водного анода и катода при воздействии на них тлеющего разряда постоянного тока, горящего в воздухе при атмосферном давлении.
МЕТОДИКА ЭКСПЕРИМЕНТА
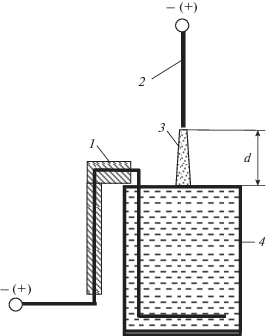
Схема экспериментальной установки приведена на рис. 1. Разряд постоянного тока зажигали приложением постоянного напряжения между острым медным электродом и поверхностью дистиллированной воды в атмосфере окружающего воздуха. Изменение полярности электродов позволяло раствору выступать как анодом, так и катодом плазменно-растворной системы. Межэлектродное расстояние составляло 5 мм. Ток разряда поддерживался равным 40 мА. Объем жидкости составлял 80 мл. Высота столба дистиллированной воды составляла 10 см. Время обработки воды изменяли в диапазоне 0–600 с. После обработки определяли кислотность раствора, концентрации пероксида водорода, нитрат и нитрит ионов в жидкой фазе.
Рис. 1.
Схема экспериментальной установки: 1 – медный погружной электрод (анод/катод); 2 – медный заостренный электрод (катод/анод); 3 – разряд; 4 – ячейка с жидкостью.
Изменения рН раствора в ходе обработки измеряли рН-метром PHT-028 Kelilong (Китай). Для определения концентрации H2O2 использовали перманганатометрическое титрование. Концентрации ${\text{NO}}_{2}^{ - }$ и ${\text{NO}}_{3}^{ - }$ определяли спектрофотометрически (спектрофотометр СФ-56 (Россия)). В основе метода определения концентрации ионов [${\text{NO}}_{2}^{ - }$] лежит реакция диазотирования сульфаниловой кислоты и последующее образование с α-нафтиламином диазосоединения красно-фиолетового цвета. Для определения содержания ионов [${\text{NO}}_{3}^{ - }$] была использована способность нитратов вступать в реакцию с салициловой кислотой в присутствии серной кислоты. Продуктом взаимодействия является соль нитросалициловой кислоты, обладающая в щелочной среде желтой окраской [9, 10].
Для получения каждой временной точки кинетической кривой использовали свежую порцию воды и проводили не менее пяти независимых измерений. При расчете случайной погрешности измерений использовали доверительную вероятность 0.95
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ И ОБСУЖДЕНИЕ
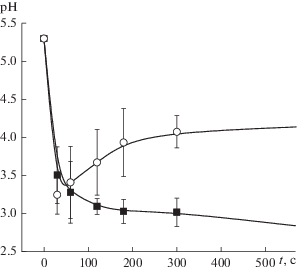
Сразу обращает на себя внимание отличие в характере изменения водородного показателя для разрядов различной полярности (рис. 2). Для случая жидкого катода изменение pH вполне ожидаемо, хорошо согласуется (как по характеру, так и по абсолютной величине) с результатами, полученными для аналогичной плазменно-растворной системы другими авторами. В то же время в жидком аноде показатель кислотности изменяется во времени немонотонно. В системе с жидким анодом на кинетической кривой pH имеется минимум при малых (~30 c) временах обработки, а затем pH несколько подрастает и стабилизируется.
Рис. 2.
Кинетика изменения pH в жидком аноде (1) и жидком катоде (2). Точки – данные эксперимента, линии даны для наглядности.
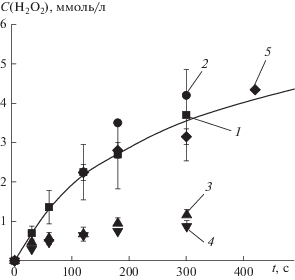
Принято считать, что пероксид водорода образуется в жидкой фазе при действии на нее любого типа разряда. Можно сказать, что это единственный компонент, появление которого в жидкой фазе надежно измеряется разнообразными химическими и физико-химическими методами. Многочисленная подборка данных (более 100 работ) приведена в обзорной работе [11]. Как ни странно, информации о кинетике образования H2O2 в тлеющем разряде постоянного тока, когда вода выступает в качестве анода, в известной нам литературе нет. Очевидно, как упоминалось ранее, это связано с малой изученность именно разряда с жидким анодом.
На рис. 3 приведена кинетика изменения концентрации пероксида водорода, определенная нами для разряда с жидким катодом, в сравнении с результатами, полученными другими авторами для аналогичной конструкции плазменно-растворной системы. Как видно из рисунка, наши результаты хорошо согласуются с данными литературы.
Любопытным является тот факт, что в случае разряда с жидким анодом, образования пероксида водорода в жидкой фазе нами не зафиксировано. Учитывая то, что использованные методики измерения концентрации данного компонента хорошо зарекомендовали себя для разрядов других типов, можно сделать вывод, что при действии разряда постоянного тока на жидкие водные аноды пероксид водорода в воде не образуется.
Обычно предполагается, что основной канал образования Н2О2 это реакция димеризации радикалов •OH (•OH + •OH → Н2О2) и •HO2 (•HO2 + + •HO2 → Н2О2 + O2). В работе [12] показано, что наиболее часто используемая гипотеза о том, что для тлеющего разряда с жидким катодом в воздухе, основным источником образования пероксида водорода являются реакции димеризации радикалов, не совсем верна. С помощью сравнения модельных расчетов с экспериментальными данными авторы [12] приходят к выводу, что основной канал образования молекул H2O2 это реакция с участием молекул воды 2H2O → H2 + H2O2. Эта реакция отражает процесс образования пероксида водорода с участием возбужденных молекул Н2О*: Н2О + ион → Н2О*, Н2О* + Н2О → Н2 +Н2О2.
В случае разряда с жидким катодом поверхность жидкости действительно подвергается бомбардировке положительно заряженными ионами, обладающими значительной кинетической энергией (катодное падение потенциала составляет сотни вольт). В случае же разряда с жидким анодом поверхность должна бомбардироваться электронами, а импульс, передаваемый ими молекулам воды, очевидно, на порядки величины меньше, чем передаваемый ионами. То есть возбужденные молекулы воды в случае разряда с жидким анодом в приконтактной области разряда либо отсутствуют, либо их концентрация существенно меньше, чем для разряда с жидким катодом. Это может объяснять факт отсутствия пероксида водорода в жидком аноде.
Известно, что в плазме тлеющего разряда в воздухе образуется значительное количество как оксидов азота, так и азотсодержащих кислот. Очевидно, что образование оксидов азота и азотсодержащих кислот в дистиллированной воде под действием разряда возможно только за счет их притока из газовой фазы. В соответствии с оценками, проведенными в [13], это потоки NO, NO2 и потоки кислот. Кинетика изменения концентрации нитрит ионов для дистиллированной воды, выступающей как в качестве анода, так и в качестве катода, приведена на рис. 4.
Рис. 4.
Кинетика изменения концентрации [${\text{NO}}_{2}^{ - }$] в жидком аноде (1) и жидком катоде (2–4). 1, 2 – данные данной работы, 3, 4 – данные работы [14] для растворов сульфонола и лаурилсульфата натрия соответственно. Точки – данные эксперимента, линии даны для наглядности.
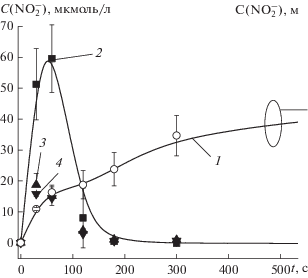
В случае жидкого катода наблюдается быстрый рост концентрации ${\text{NO}}_{2}^{ - }$ на малых временах воздействия разряда, где она проходит через максимум, затем резко спадает. Уже после 2 мин обработки, в пределах погрешности метода измерений, нитрит ионов не наблюдается. Аналогичный характер поведения концентрации нитрит ионов в жидком катоде в ходе обработки водных растворов различных поверхностно-активных веществ и фенола наблюдался в работах [14, 15].
Характер поведения концентрации нитрит ионов в жидком аноде носит принципиально другой характер. На кинетической кривой отсутствует экстремум, концентрация растет с увеличением времени обработки, достигая величин в ммоль на литр.
Прохождение концентрации ${\text{NO}}_{2}^{ - }$ через максимум для случая жидкого катода свидетельствует о протекании реакций его конвертации в некие продукты. Возможно протекание реакции диспропорционирования азотистой кислоты (3${\text{NO}}_{2}^{ - }$ → → ${\text{NO}}_{3}^{ - }$ + 2NO + H2O), но очевидно, этот канал гибели нитрит ионов не обеспечит экстремума на кинетической кривой. В реакциях конвертации ${\text{NO}}_{2}^{ - }$ должны принимать участие частицы, накапливающиеся в растворе под действием разряда. Это могут быть реакции с H, OH радикалами и чувствительная к pH среды реакция с пероксидом водорода:
(1)
$\begin{gathered} {\text{H}} + {\text{NO}}_{2}^{ - } \to {\text{O}}{{{\text{H}}}^{ - }} + {\text{NO }} \\ \left( {K = 7.1 \times {{{10}}^{8}}{\text{л/}}\left( {{\text{моль}}\,{\text{с}}} \right)} \right){\text{ }}\left[ {16} \right], \\ \end{gathered} $(2)
$\begin{gathered} {\text{OH}} + {\text{NO}}_{2}^{ - } \to {\text{O}}{{{\text{H}}}^{ - }} + {\text{N}}{{{\text{O}}}_{2}} \\ \left( {K = 1 \times {{{10}}^{9}}{\text{л}}/\left( {{\text{моль}}\,{\text{с}}} \right)} \right)\left[ {17} \right], \\ \end{gathered} $(3)
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} + {\text{ NO}}_{2}^{ - } + {{{\text{H}}}^{ + }} \to {{{\text{H}}}^{ + }} + {\text{NO}}_{3}^{ - } + {{{\text{H}}}_{{\text{2}}}}{\text{O }} \\ \left( {K = 4.3 \times {{{10}}^{6}}{{{\text{л}}}^{2}}{\text{/}}({\text{мол}}{{{\text{ь}}}^{{\text{2}}}}\,{\text{с}})} \right)\left[ {18} \right]. \\ \end{gathered} $Учитывая то, что концентрации радикалов существенно меньше концентрации пероксида водорода ([OH•] ~ 10–11, [H•] ~ 10–12, [H2O2] ~ 10–3 моль/л), и с учетом pH получающихся растворов, соотношение скоростей реакций 1 : 2 : 3 = ~10–4 × [${\text{NO}}_{2}^{ - }$] : 10–1 × [${\text{NO}}_{2}^{ - }$] : 4 × [${\text{NO}}_{2}^{ - }$], то есть, конвертация нитрит ионов, очевидно, протекает преимущественно в результате их взаимодействия с H2O2. Соответственно, отсутствие пероксида водорода в жидком аноде приводит к отсутствию наиболее быстрого канала гибели нитрит ионов, и к отсутствию максимума на кинетической кривой концентрации ${\text{NO}}_{2}^{ - }.$
На рис. 5 приведены кинетические закономерности изменения концентрации нитрат ионов. В жидком катоде на начальных временах воздействия в пределах погрешности метода не наблюдается ионов ${\text{NO}}_{3}^{ - },$ рост начинается после ~60 с воздействия заряда. Момент установления концентрации соответствует времени исчезновения из раствора ${\text{NO}}_{2}^{ - }.$
Рис. 5.
Кинетика изменения массовой концентрации [${\text{NO}}_{3}^{ - }$] в жидком аноде (1) и жидком катоде (2). Точки – данные эксперимента, линии даны для наглядности.
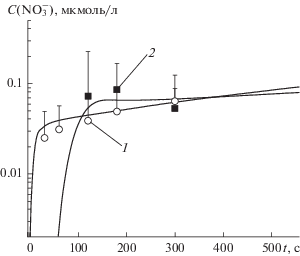
В системе с жидким анодом ионы ${\text{NO}}_{3}^{ - }$ появляются уже на начальных временах обработки, и их концентрация увеличивается практически линейно.
Вид кинетической кривой нитрат ионов в жидком катоде позволяет полагать, что источником их образования является преимущественно конвертация нитрит ионов под действием H2O2. Ввиду отсутствия пероксида водорода в жидком аноде, очевидно, что данный механизм образования [${\text{NO}}_{3}^{ - }$] для него неприменим. При этом концентрация нитрат ионов в электродах обеих полярностей имеет близкие значения.
ЗАКЛЮЧЕНИЕ
Воздействие тлеющего разряда постоянного тока на дистиллированную воду, являющуюся анодом, существенно отличается от результата воздействия аналогичного разряда на водный катод. Принципиальное различие заключается в том, что в жидком аноде не образуются молекулы пероксида водорода, что, в свою очередь, приводит к различию в характере поведения кинетических кривых концентрации нитрит и нитрат ионов в жидкой фазе. Вышесказанное позволяет предположить, что процессы очистки воды от органических/неорганических загрязнений в конфигурации разряд–жидкий анод, будут иметь особенности, что требует отдельного дополнительного изучения.
Список литературы
Рыбкин В.В., Шутов Д.А. // Физика плазмы. 2017. Т. 43. № 11. С. 929.
Bruggeman P., Leys C. // J. Phys. D: Appl. Phys. 2009. V. 42. P. 053001.
Rumbach P. // Nature Communications. 2015. V. 6. Article ID 7248.
Kim S.-H., Choi H.-S., Jung K.-D. // Cryst. Growth Des. 2016. V. 16. P. 1387.
Шутов Д.А., Смирнова К.В., Иванов А.Н, Рыбкин В.В. // Химия высоких энергий. 2017. Т. 51. № 1. С. 69.
Shutov D.A., Smirnova K.V., Gromov M.V., Ivanov A.N., Rybkin V.V. // Plasma Chem. Plasma Proc. 2018. V. 38. № 1. P. 107.
Xiong Q., Yang Z., Bruggeman P.J. // J. Phys. D: Appl. Phys. 2015. V. 48 P. 424008.
Greda K., Swiderski K., Jamroz P., Pohl P. // Anal. Chem. 2016. V. 88. P. 8812.
Новиков Ю.В., Ласточкина К.О., Болдина 3.Н. // Методы исследования качества воды водоемов / под ред. А.П. Шицковой: М.: Медицина, 1990
Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. М.: Химия. 1984. 448 с.
Locke B.R., Shih K.-Y. // Plasma Sources Sci. Tech. 2011. V. 20. № 3. Article ID 034006.
Бобкова Е.С., Шикова Т.Г., Гриневич В.И., Рыбкин В.В. // Химия высоких энергий. 2012. Т. 46. № 1. С. 60.
Шутов Д.А., Смирнов С.А., Рыбкин В.В. // Химия высоких энергий. 2014. Т. 48. № 6. С. 502.
Шутов Д.А., Бобкова Е.С., Рыбкин В.В. // Изв. вузов. Химия и хим. технология. 2014. Т. 57. Вып. 6. С. 49.
Bobkova E.S., Krasnov D.S., Sungurova A.V., Rybkin V.V., Choi H.-S. // Korean J. Chem. Eng. 2016. V. 33. Iss. 5. P. 1620.
Goldstein S., Squadrito G.L., Pryor W.A., Czapski G. // Free radical biology & medicine. 1996. V. 21. № 7. C. 965.
van Gils C.A.J., Hofmann S., Boekema B.K.H.L., Brandenburg R., Bruggeman P.J. // J. Phys. D: Appl. Phys. 2013. V. 46. Article ID 175203.
Anbar M., Taube H. // J. American Chem. Soc. 1954. V. 76. P. 6243.
Шутов Д.А., Коновалов А.С., Исакина А.А., Бобкова Е.С. // Химия высоких энергий. 2013. Т. 47. № 5. С. 389.
Шутов Д.А., Ольхова Е.О., Костылева А.Н., Бобкова Е.С. // Химия высоких энергий. 2014. Т. 48. № 5. С. 393.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий