Вестник Военного инновационного технополиса «ЭРА», 2023, T. 4, № 3, стр. 300-303
Спектроскопические особенности содержания нейромедиаторов при прохождении ТМС-терапии при кататонии
А. С. Заборин 1, *, С. И. Карташов 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: zaborin.as17@physics.msu.ru
Поступила в редакцию 18.10.2023
После доработки 23.10.2023
Принята к публикации 23.10.2023
Аннотация
Кататония находится в фокусе нейрофизиологических исследований как синдром с неуточненными звеньями патогенеза. Современные методы нейровизуализации могут помочь реконструировать патофизиологические механизмы этого расстройства и изучить изменения биомаркеров текущего состояния на клеточном и молекулярном уровнях. С помощью магнитно-резонансной спектроскопии (МРС), а также в дополнение к ней различными другими сопутствующими методами диагностики на магнитном резонансном томографе, такими как функциональная магнитно-резонансная томография (фМРТ), трехмерное структурное МРТ, протокол бесконтрастной МРТ перфузии и диффузионная МРТ, оценивались состояния пациентов с диагнозом кататония по итогу прохождения курса терапии транскраниальной магнитной стимуляции (ТМС). Данное исследование состояния пациентов рассматривается как метод валидации курса ТМС-терапии.
ВВЕДЕНИЕ
При кататонии магнитно-резонансная спектроскопия для определения концентрации гамма-аминомасляной кислоты (ГАМК) и глутамата является одним из самых современных методов, использование результатов которого в качестве биомаркеров целесообразно для оценки эффективности воздействия транскраниальной магнитной стимуляции (ТМС) у пациентов [1]. Такое предположение базируется на установлении следующих фактов. Когнитивный контроль отрицательных эмоций модулируется рецепторами ГАМК в префронтальных областях – орбитофронтальной и медиальной префронтальной коре [2], что в случае ингибирования ГАМК-ергической нейротрансмиссии в этих зонах приводит к психотическим состояниям [3]. При этом снижение процессов торможения вызывает гиперкинетические феномены или симптомы дезорганизации, тогда как чрезмерное торможение этой сети приводит к гипокинетической кататонии с ригидностью, каталепсией, мутизмом и ступором [4].
Цель настоящей работы – валидация посредством магнитно-резонансной спектроскопии метода ТМС-терапии головного мозга, проводимой для пациентов с диагнозом кататония.
МЕТОДЫ
Отбор пациентов осуществляли на базе Психиатрической клинической больницы № 1 им. Н.А. Алексеева, г. Москва. Все исследования пациентов проводили на базе ресурсного центра ядерно-физических методов исследований комплекса НБИКС-природоподобных технологий НИЦ “Курчатовский институт” на магнитно-резонансном томографе Siemens Magnetom Verio 3T.
В исследовании приняли участие 14 пациентов от 18 до 25 лет. Необходимые документы (опросный лист, лист добровольного информированного согласия и согласие на обработку персональных данных) были заполнены всеми участниками до начала сканирования, критерии включения–невключения выполнены.
Разработан протокол исследования для валидации ТМС, заключающийся в проведении МРТ‑сканирования до процедуры ТМС и сразу после прохождения курса спустя месяц. Таким образом, получены две временные точки в динамике лечения пациентов, анализируя которые, можно оценить эффективность терапевтических мероприятий. Для оценки метаболизма в головном мозге у пациентов были выбраны два основных нейромедиатора – глутамат и ГАМК [5].
Для получения более подробных данных о состоянии пациента в рамках обследования были проведены дополнительные сканирования. В начале выполнялось трехмерное структурное МРТ с хорошим пространственным разрешением для оценки сохранности вещества головного мозга. Далее следовал протокол бесконтрастной перфузии для навигации ТМС. фМРТ состояния покоя выполнялась для оценки функционального и эффективного коннектомов головного мозга человека. Сканирование завершалось диффузионной МРТ для оценки структурной связанности отделов мозга друг с другом.
Для оценки содержания ГАМК использовали импульсную последовательность MEGA-PRESS [6] со следующими параметрами: время эхо TE = = 28 мс, время повторения TR = 10 000 мс, количество усреднений = 8, размер вокселя 25 × 25 × × 50 мм. Для протоколов GABA+ и GABA– параметры сканирования: TE = 68 мс, TR = 2500 мс, количество усреднений = 128, размер вокселя 25 × 25 × 50 мм. Для обработки данных, полученных при изучении концентрации ГАМК, использовали программу Gannet Masters в среде Matlab [7, 8]. Абсолютную концентрацию ГАМКH2O в ммоль/л в расчете на концентрацию чистой воды H2O = 55.556 моль/л рассчитывали по формуле
Для оценки концентрации глутамата был выбран протокол импульсной последовательности VAPOR (комбинация радиочастотных импульсов переменной мощности с оптимизированными задержками релаксации) с параметрами: TR = = 4000 мс, TE = 35 мс с шагом увеличения 10 мс при переходе к новому измерению вплоть до 185 мс, количество усреднений 10, размеры вокселя 20 × 20 × × 20 мм, градиент магнитного поля 20 мТл/м. Обработка данных проведена в программе JMRUI [9].
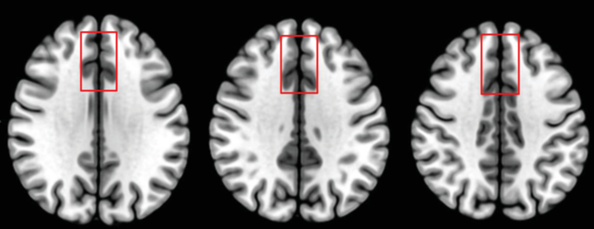
Воксель для измерения ГАМК и глутамата был локализован в области межполушарной щели таким образом (рис. 1), чтобы его больший объем занимало серое вещество [10, 11].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 представлены результаты измерения концентрации глутамата (в абсолютном значении и по отношению к концентрации N-ацетиласпартата – значение рассчитывали как отношение интенсивностей получаемых сигналов от каждого метаболита) и ГАМК четырнадцати пациентов до и после прохождения процедуры ТМС-коррекции. В отличие от здоровых добровольцев пациенты не всегда могут провести весь эксперимент в неподвижном положении, и любые значительные движения головы приводят к ухудшению качества получаемых данных, что иногда делает их невозможными для обработки. Такие случаи отмечены в табл. 1 прочерком. Тенденция к нормализации концентраций после прохождения терапии наблюдается не у всех пациентов ввиду различных сопутствующих факторов, которые вносят коррективы в эффективность лечения.
Таблица 1.
Результаты магнитно-резонансной спектроскопии пациентов с диагнозом кататония
| Глутамат, ммоль/л | Глутамат/NAA | ГАМК, ммоль/л | ||||
|---|---|---|---|---|---|---|
| до ТМС | после ТМС | до ТМС | после ТМС | до ТМС | после ТМС | |
| П1 | 351 | 167 | 0.54 | 0.19 | 4.12 | 3.27 |
| П2 | – | 159 | – | 0.17 | 3.01 | 4.69 |
| П3 | 154 | 176 | 0.17 | 0.17 | 4.37 | 5.56 |
| П4 | – | 294 | – | 0.41 | – | 4.53 |
| П5 | 85 | – | 0.11 | – | 4.50 | – |
| П6 | 142 | – | 0.19 | – | 5.03 | 4.18 |
| П7 | 218 | 127 | 0.22 | 0.16 | 4.74 | 4.72 |
| П8 | 106 | 151 | 0.08 | 0.17 | 4.16 | 3.88 |
| П9 | 75 | – | 0.09 | – | 4.12 | – |
| П10 | 117 | – | 0.15 | – | 4.40 | – |
| П11 | 191 | – | 0.23 | – | 3.41 | – |
| П12 | 68 | – | 0.16 | – | 3.99 | – |
| П13 | – | – | – | – | 2.28 | – |
| П14 | 53 | – | 0.09 | – | 4.62 | – |
В табл. 2 представлены результаты измерения ГАМК для 38 здоровых добровольцев.
Таблица 2.
Результаты магнитно-резонансной спектроскопии здоровой группы добровольцев
| ГАМК, ммоль/л | ГАМК, ммоль/л | ||
|---|---|---|---|
| Д1 | 4.01 | Д20 | 4.20 |
| Д2 | 4.39 | Д21 | 3.63 |
| Д3 | 4.02 | Д22 | 4.63 |
| Д4 | 3.79 | Д23 | 3.74 |
| Д5 | 4.82 | Д24 | 3.74 |
| Д6 | 4.5 | Д25 | 4.98 |
| Д7 | 4.5 | Д26 | 4.94 |
| Д8 | 4.98 | Д27 | 3.91 |
| Д9 | 3.89 | Д28 | 3.61 |
| Д10 | 3.92 | Д29 | 3.88 |
| Д11 | 3.96 | Д30 | 3.64 |
| Д12 | 4.61 | Д31 | 4.24 |
| Д13 | 3.72 | Д32 | 3.93 |
| Д14 | 4.26 | Д33 | 4.44 |
| Д15 | 4.06 | Д34 | 4.02 |
| Д16 | 4.64 | Д35 | 4.87 |
| Д17 | 3.73 | Д36 | 3.68 |
| Д18 | 4.48 | Д37 | 4.23 |
| Д19 | 4.94 | Д38 | 3.97 |
По данным табл. 1 видно, что значение параметра Глутамат/NAA находится около 0.2, что в целом согласуется с нормой. К сожалению, для ГАМК не проявляется какая-либо закономерность – после ТМС концентрация как увеличивается, так и уменьшается. Вероятно, это может быть связано с неоднородностью выборки и разными проявлениями симптомов у пациентов.
ВЫВОДЫ
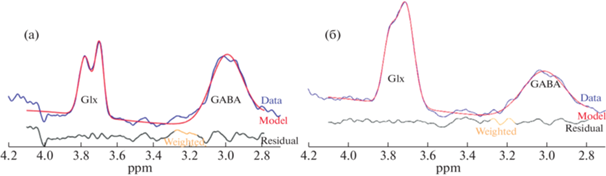
Разработан оптимальный протокол комплексного исследования на МРТ пациентов с кататоническим синдромом для контроля их состояния после проведения ТМС. Выявлены различия в данных по здоровым добровольцам и пациентам (рис. 2), что, вероятно, связано с физиологическими особенностями проявления заболевания.
Рис. 2.
Сравнение спектров здорового человека (а) и пациента с диагнозом кататония (б) в программе Gannet Masters.
Для повышения достоверности и увеличения качества результатов будет продолжен набор данных для пациентов с кататонией. Для точной интерпретации результатов сканирования до и после проведения ТМС-терапии необходимо соотнесение метаболической активности с клиническими показателями, проводимыми курсами медикаментозного лечения, а также со структурно-функциональными данными МРТ.
Работа выполнена в рамках государственного задания НИЦ “Курчатовский институт”.
Список литературы
Ulrike Dydak, Yue-Ming Jiang, Li-Ling Long et al. // Environ. Health Perspect. 2011. V. 119. № 2. P. 219.
Fricchione G., Beach S. // Handb. Clin. Neurol. 2019. V. 166. P. 223.
Harris A.D., Saleh M.G., Edden R.A.E. et al. // Magn. Reson. Med. 2017. V. 77. № 4. P. 1377.
Hirjak D., Wolf R.C., Northoff G. et al. // Schizophr. Bull. 2019. V. 45. № 6. P. 1168.
Jensen J.E., Frederick B. de B., Renshaw P.F. et al. // NMR Biomed. 2005. V. 18. № 8. P. 570.
Mescher M., Merkle H., Kirsch J. et al. // NMR Biomed. 1998. V. 11 № 6. P. 266.
Paul G. Mullins, David J. McGonigle, Ruth L. O’Gorman et al. // Neuroimage. 2014. V. 86. P. 43.
Muhammad G. Saleh, Georg Oeltzschner, Kimberly L. Chan et al. // Neuroimage. 2016. V. 142. P. 576.
http://www.jmrui.eu/
Emmanuel Stip, Paul Lespérance, Olivier Farmer et al. // Brain Stimul. 2017. V. 10. № 4. P. 859.
Emmanuel Stip, Blain-Juste M.-E., Farmer O. et al. // Encephale. 2018. V. 44. № 2. P. 183.
Дополнительные материалы отсутствуют.
Инструменты
Вестник Военного инновационного технополиса «ЭРА»