Вестник Военного инновационного технополиса «ЭРА», 2023, T. 4, № 1, стр. 27-32
Исследование получения сырья для производства биотоплива из биомассы микроводоросли Scenedesmus obliquus
А. А. Шестакова 1, В. М. Пожидаев 2, К. В. Горин 2, *
1 Российский государственный университет им. А.Н. Косыгина
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: Gorin_KV@nrcki.ru
Поступила в редакцию 10.10.2023
После доработки 10.10.2023
Принята к публикации 10.10.2023
Аннотация
Рост мирового энергопотребления в последние десятилетия и ограниченная доступность природного ископаемого сырья привели к спросу на использование возобновляемых источников энергии, в том числе биомассы микроводорослей. Биомасса микроводорослей представляет большой интерес как один из ценных источников возобновляемого сырья для получения различных коммерчески значимых продуктов, используемых в химической, нефтехимической и пищевой промышленностях. Рассмотрена возможность культивирования фототрофного микроорганизма Scenedesmus obliquus в условиях естественного освещения. Исследован жирнокислотный профиль биомассы с целью получения биодизельного топлива.
ВВЕДЕНИЕ
Scenedesmus – один из наиболее распространенных родов пресноводных микроводорослей [1]. Изображение микроводоросли Scenedesmus obliquus штамм CCAP 276/3A, полученное с помощью световой микроскопии в проходящем свете, представлено на рис. 1. У рода Scenedesmus ценобии имеют вид плоских, прямых или изогнутых пластинок из 4‒8 (реже 2–32) продолговатых или округлых клеток, соединенных по бокам в простые или двойные ряды [2].
Рис. 1.
Фотография микроводоросли S. obli-quus штамм CCAP 276/3A, полученное в проходящем свете (увеличение объектива ×100).

Оболочки гладкие или с ребрами, или шипами, часто на концах клеток с длинными шипами-рогами. Хлоропласт пластинчатый, с боковым пиреноидом и центральным ядром. Размножается автоспорами, которые внутри материнской клетки слагаются в дочерний ценобий [2].
Известно, что Scenedesmus обладает высокой продуктивностью биомассы среди зеленых микроводорослей и активно исследуется на предмет его использования для производства биодизеля. В [3, 4] показано, что его гетеротрофное производство биомассы и липидов в оптимальных условиях имеет более высокую эффективность, чем его автотрофное производство.
Сегодня наиболее распространенным способом получения биодизельного топлива является процесс переэтерификации липидов микроводорослей, в котором один моль триацилглицеридов реагирует в присутствии катализатора с тремя молями спирта (чаще метанола) с образованием одного моля глицерина и трех молей метиловых эфиров. В качестве катализатора часто используют концентрированную серную кислоту.
Основные свойства биодизеля определяются составом и содержанием метиловых эфиров жирных кислот (МЭЖК). Одним из ключевых факторов, влияющих на качество биодизеля, является степень ненасыщенности жирных кислот (ЖК), входящих в его состав. Уменьшение степени ненасыщенности приводит к повышению эффективности воспламеняемости получаемого из опытной биомассы топлива.
Хотя Scenedesmus может производить многие виды биотоплива, такие как биоводород, биодизель, биоэтанол и альтернативные виды топлива, наиболее обширные исследования были проведены по использованию Scenedesmus для производства биодизельного топлива. Как и все системы, внедрение интегрированного производства биотоплива, полученного из биомассы Scenedesmus на основе лабораторных исследований, имеет проблемы при крупномасштабном производстве. Основные проблемы включают в себя поставку и переработку питательных веществ, перенос и обмен газа, доставку PAR (фотосинтетически активного излучения), культурную целостность, экологический контроль, сбор биомассы, а также генетическую и метаболическую инженерию [5].
В данной работе рассмотрена возможность культивирования фототрофного микроорганизма Scenedesmus obliquus CCAP 276/3A при естественном освещении, а также исследован жирнокислотный профиль выращенной биомассы.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования выбран штамм культуры Scenedesmus obliquus CCAP 276/3A, полученный из коллекции водорослей и простейших (CCAP, Великобритания).
Получение посевного материала. Посевной материал микроводоросли Scenedesmus obliquus культивировали на среде Bold’s Basal Media (ВВМ) [6]. Состав питательной среды ВВМ представлен в табл. 1. В питательную среду добавляли 1 мл исходного раствора микроэлементов [7], его состав представлен в табл. 2. Питательную среду готовили на дистиллированной воде, pH питательной среды доводили до 7 с помощью pH-метра путем добавления в среду раствора гидроксида натрия или соляной кислоты. Среду перед использованием автоклавировали 30 мин при температуре 121°С и давлении 1 атм.
Таблица 1.
Состав среды ВВМ
| Компонент | Концентрация, г/л |
|---|---|
| NaNO3 | 0.75 |
| KH2PO4 | 0.175 |
| Na2HPO4 · 12H2O | 0.075 |
| NaCl | 0.025 |
| MgSO4 · 7H2O | 0.075 |
| CaCl2 · 2H2O | 0.025 |
Таблица 2.
Раствор микроэлементов по Пфеннигу
| Компонент | Концентрация, г/л |
|---|---|
| ЭДТА | 5 |
| FeSO4 · 7H2O | 2 |
| ZnSO4 · 7H2O | 0.1 |
| MnCl2 | 0.03 |
| H3BO3 | 0.3 |
| CoCl2 · 6H2O | 0.2 |
| CuCl2 | 0.01 |
| NiCl2 · 2H2O | 0.02 |
| Na2MoO4 · 2H2O | 0.02 |
Культивирование проводили в конической колбе с рабочим объемом 250 мл при постоянном барботировании атмосферным воздухом. Температуру при культивировании поддерживали на уровне 24 ± 2°C путем кондиционирования воздуха в помещении. Культура росла в условиях постоянной интенсивности освещения 3000 Люкс в течение 11 дней.
Метод анализа на состав и содержание жирных кислот. Анализ на состав и содержание ЖК в биомассе выполняли согласно [8]. Для анализа отбирали навеску (5.0 ± 0.5 мг) лиофилизованно высушенной биомассы Scenedesmus obliquus в стеклянные виалы с рабочим объемом 4 мл. Биомассу тщательно измельчали шпателем.
После измельчения навески добавляли 2 мл метилирующей смеси 2%-ной H2SO4 в метаноле (табл. 3) и вносили хроматографическим шприцом 0.02 мл внутреннего стандарта. Хроматографический шприц предварительно промывали хлороформом. В качестве внутреннего стандарта использовали лауриновую кислоту (С12:0).
Реакцию проводили на водяной бане при температуре 78°С в течение двух часов. Полученные МЭЖК экстрагировали гексаном. Для этого реакционную смесь охлаждали до комнатной температуры и переливали в эппендорфы с рабочим объемом 5 мл. Виалы омывали 1 мл гексана, затем гексан с остатками МЭЖК приливали к реакционной смеси. Объем смеси в эппендорфах доводили до 4 мл дистиллированной водой.
Разделение фаз проводили центрифугированием (7500 об./мин, 5 мин), после чего гексановый (верхний) слой, содержащий МЭЖК, отбирали в виалы с рабочим объемом 2 мл для дальнейшего анализа.
Анализ МЭЖК проводили методом газовой хроматографии (ГХ) на газовом хроматографе Bruker 430 GC (Varian Inc., США), снабженном пламенно-ионизационным детектором и кварцевой капиллярной колонкой Select TM Biodiesel (30 м × 0.32 мм × 0.25 мкм). Количество вводимой пробы составляло 1 мкл [9].
Жирные кислоты идентифицировали по относительному времени удерживания на колонке компонентов смеси в сравнении со стандартом, относительное количественное содержание индивидуальных ЖК определяли методом нормализации площадей. Коэффициент ненасыщенности липидов микроводорослей (Кненас) определяли по данным ГХ по формуле
Условия проведения экспериментов по культивированию. Культивирование проводили в колбах Эрленмейера с рабочим объемом 250 мл и объемом среды 150 мл в течение 10 сут с беспрерывным барботированием. Посев проводи так, чтобы начальная оптическая плотность культуры во всех колбах была равна 0.1 при длине волны 750 нм. В качестве контроля использовали культивирование в люминостате с использованием люминесцентных дневного света, опытные образцы культивировали при естественном освещении, исходящем от оконных проемов. Значения освещенности и фотосинтетически активной радиации приведены в табл. 4.
Рост биомассы контролировали путем измерения оптической плотности суспензии микроводоросли при длине волны 750 нм с помощью спектрофотометра (Thermo Scientific Varioscan LUX), измерения проводили 1 раз в сутки, в трех повторах.
РЕЗУЛЬТАТЫ И ИХОБСУЖДЕНИЕ
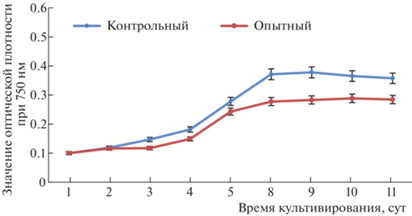
Выращивание культуры S. obliquus осуществляли при условиях, описанных выше, в течение 10 дней. Кривые роста культуры представлены на рис. 2. На основе полученных данных можно сделать вывод, что в контрольном и опытном образцах динамика роста культуры схожа.
Значения конечной оптической плотности у образцов, которые культивировали в люминостате, были выше на 20.5%.
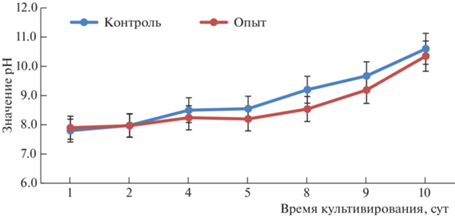
Значения рН в течение всего культивирования представлены на рис. 3. Происходило постепенное защелачивание культуральной среды в результате жизнедеятельности микроводоросли. У всех образцов конечное значение рН было выше 10.
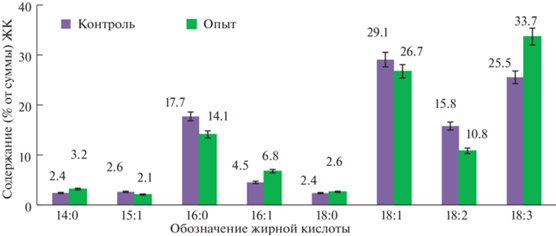
Для анализа состава ЖК, входящих в состав липидов исследуемой микроводоросли, использовали ГХ. Анализ проводили в конце культивирования после сбора биомассы и лиофильной сушки для выявления существенных отличий в содержании отдельных ЖК по сравнению с контролем. Полученные данные представлены на рис. 4. У опытного образца наблюдалось увеличенное содержание полиненасыщенной линоленовой ЖК по сравнению с контрольным – 33.7 и 25.5% соответственно.
Рис. 4.
Содержание индивидуальных жирных кислот в биомассе: 14:0 – миристиновая кислота, 15:1 – пентадеценовая кислота, 16:0 – пальмитиновая кислота, 16:1 – пальмитолеиновая кислота, 18:0 – стеариновая кислота, 18:1 – олеиновая кислота, 18:2 – линолевая кислота, 18:3 – линоленовая кислота.
При рассмотрении отдельных групп ЖК отмечено, что в обоих образцах преобладают ненасыщенные ЖК (табл. 5). Сумма ненасыщенных ЖК в опытном образце была выше, чем в контрольном, и составляла 80.1%. Данная тенденция приводит к увеличению степени ненасыщенности и снижению цетанового числа биодизеля, что негативно сказывается на его качестве. Величина коэффициента ненасыщенности (который представляет собой отношение суммы ненасыщенных ЖК к сумме насыщенных ЖК) у опытного и контрольного образцов составляла 4 и 3.5 соответственно.
Таблица 5.
Состав отдельных групп жирных кислот биомассы S. obliquus
| Код жирной кислоты | Образец | |
|---|---|---|
| Контроль | Опыт | |
| ∑Насыщенных ЖК | 22.5 | 19.9 |
| ∑Ненасыщенных ЖК | 77.5 | 80.1 |
| ∑Мононенасыщенные жирные кислоты | 36.2 | 35.6 |
| ∑Полиненасыщенные жирные кислоты | 41.3 | 44.5 |
| Кненас | 3.5 | 4.0 |
| Степень ненасыщенности* | 1.4 | 1.6 |
На основе полученных данных можно сделать вывод о том, что содержание как отдельных кислот, так и по сумме насыщенных и ненасыщенных контрольный и опытный образцы различались незначительно. То же утверждение закономерно для коэффициента и степени ненасыщенности. Для опытного образца, выращенного при естественном освещении, наблюдается пониженное содержание насыщенных ЖК на 11.5% и повышенное на 3.2% ненасыщенных кислот по сравнению с контролем.
В [6] была проведена количественная оценка отдельных групп ЖК, выделенных из биомассы микроводоросли Scenedesmus obliquus штамм CCAP 276/3А: сумма насыщенных ЖК составляет 37.8%, моно- и полиненасыщенных ЖК – 20.1 и 34.5% соответственно, коэффициент ненасыщенности составлял 1.44. Отметим, что по сравнению с этими данными в рассматриваемом случае биомасса как для контроля, так и для опытного образца имела порядка 15% меньше насыщенных ЖК и порядка 44 и 16% больше моно- и полиненасыщенных ЖК соответственно. Хотя культура и питательная среда были одинаковыми как в данном случае, так и в [6], наблюдается явный сдвиг по содержанию насыщенных и ненасыщенных ЖК, что, вероятно, связано с условиями культивирования. Поэтому можно предположить, что соотношение насыщенных и ненасыщенных ЖК в меньшей степени зависит от светового режима и в большей от температуры культивирования.
В действующих стандартах к биодизелю присутствуют ограничения по профилю ЖК, входящих в его состав. Содержание метилового эфира линоленовой кислоты не должно превышать 12%, так как данный компонент снижает способность топлива противостоять окислению. Из этого следует, что биодизель, полученный на основе липидов биомассы Scenedesmus obliquus штамм CCAP 276/3A, более восприимчив к окислению, чем это допускается стандартами.
ЗАКЛЮЧЕНИЕ
Показана возможность культивирования фототрофного микроорганизма Scenedesmus obliquus в условиях естественного освещения. В опытном и контрольном образцах динамика роста культуры схожа. Значения конечной оптической плотности образцов, которые культивировались в люминостате, были выше на 20.5% ввиду более благоприятных условий культивирования. По результатам анализа экспериментальных данных и сравнению их с литературными можно сделать вывод о том, что соотношение насыщенных и ненасыщенных ЖК в меньшей степени зависит светового режима и в большей от температуры культивирования.
Дальнейшая работа будет направлена на варьирование параметров культивирования Scenedesmus obliquus для получения наиболее качественных показателей биодизельного топлива.
Работа выполнена в рамках тематического плана “Разработка платформенных технологий на основе фототрофных микроорганизмов для интенсивной утилизации СО2 и производства биотоплив и других полезных продуктов”.
Список литературы
Lurling M., Van Donk E. // Oikos. 2000. V. 88. P. 111.
Мелькумов Г.М. // Альгология: учебное пособие. 2015. С. 43.
Mandal S., Mallick N. // Appl. Microbiol. Biotechnol. 2009. V. 84. № 2. P. 281.
El-Sheekh M., Abomohra A.E.F., Hanelt D. // World J. Microbiol. Biotechnol. 2013. V. 29. № 5. P. 915.
Christenson L., Sims R. // Biotechnol. Adv. 2011. V. 29. № 6. P. 686.
Trivedi J., Atray N., Agrawal D., Ray A. // Fuel. 2022. V. 316. P. 123.
Gorin K., Pojidaev V., Borgolov A., Sergeeva Y. // IOP Conf. Ser.: Earth and Environmental Science. 2019. https://doi.org/10.1088/1755-1315/337/1/012006
Liu J., Liu Y., Wang H., Xue S. // Bioresour. Technol. 2015. V. 176. P. 284. https://doi.org/10.1016/j.biortech.2014.10.094
Сергеева Я.Э., Мостова Е.Б., Горин К.В. и др. // Биотехнология. 2017. Т. 33. № 1. С. 53.
Дополнительные материалы отсутствуют.
Инструменты
Вестник Военного инновационного технополиса «ЭРА»