Радиационная биология. Радиоэкология, 2023, T. 63, № 2, стр. 146-156
КИНЕТИКА ПРОРАСТАНИЯ СЕМЯН КАК ИНФОРМАТИВНЫЙ ПОКАЗАТЕЛЬ ДЛЯ ОЦЕНКИ ВОЗДЕЙСТВИЯ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ (НА ПРИМЕРЕ АБК-МУТАНТНЫХ ЛИНИЙ Arabidopsis thaliana)
Е. В. Бондаренко 1, *, Д. Д. Бабина 1, М. Ю. Подобед 1, А. С. Миценык 1, П. Ю. Волкова 1
1 Всероссийский научно-исследовательский институт радиологии и агроэкологии
Обнинск, Россия
* E-mail: bev_1408@mail.ru
Поступила в редакцию 01.07.2022
После доработки 14.12.2022
Принята к публикации 21.12.2022
- EDN: EOKPNW
- DOI: 10.31857/S0869803123020030
Аннотация
Проведен анализ динамики прорастания семян модельного растения Arabidopsis thaliana после воздействия γ-излучения в дозах 50, 100 и 150 Гр. Объектами исследования выбраны линии: abi3-8 с мутацией в гене ABI3 и со сниженной чувствительностью к природной форме абсцизовой кислоты и генотип aba3-1 с мутацией в гене ABA3 и пониженным уровнем эндогенной абсцизовой кислоты. В качестве контроля использован дикий тип Col-8. Для изучения влияния γ-излучения на различные аспекты прорастания семян (всхожесть, время и скорость прорастания, синхронность прорастания партии семян) проведена оценка кинетики прорастания при помощи пакета Germinationmetrics для среды программирования R. Контрольные и облученные семена (источник излучения – 60Co) выращивали на питательной среде Мурасиге–Скуга половинной концентрации в контролируемых условиях. Прорастание оценивали в течение первых 6 сут после переноса в фитотрон по разрыву эндосперма и появлению корешка. Всего проведены три независимых эксперимента с тремя биологическими повторностями в каждом. Отмечено более выраженное влияние γ-излучения в дозе 150 Гр на все исследуемые генотипы. Кластеризация всхожести показала, что распределение процента прорастания семян по дням больше зависит от генотипа, чем от дозы воздействия. Лучшие показатели всхожести, скорости и временного интервала между прорастанием 10 и 90% семян отмечены у необлученных семян линии abi3-8. Полученные результаты и сравнительный анализ с ранее опубликованными данными позволяют утверждать, что оценка кинетики прорастания при помощи пакета Germinationmetrics для R – наглядный и достаточно информативный инструмент для изучения влияния ионизирующего излучения и иных абиотических факторов на различные аспекты прорастания семян.
Выход из стадии покоя и прорастание семян являются одним из ключевых и, в то же время, хрупких этапов в жизненном цикле растений и определяет начало роста растений в естественных или сельскохозяйственных экосистемах. Одним из основных фитогормонов, регулирующих покой семени, является абсцизовая кислота (АБК). Прорастание семян, в свою очередь, контролируется балансом АБК и гибберелловых кислот [1]. Во время развития семян АБК контролирует поздние стадии созревания зародыша и устойчивость к десикации с помощью семейства факторов транскрипции с доменом В3, в том числе ABSCISIC ACID INSENSITIVE 3 (ABI3, AT3G24650) [2]. ABI3 кодирует ДНК-связывающий белок, являющийся важным компонентом передачи сигналов АБК и регулятором перехода от стадии зародыша к ранним этапам развития проростков [3].
АБК участвует в ответе семени, прошедшего стратификацию, на водный стресс. В условиях дефицита воды прорастающий зародыш проходит АБК-опосредованную контрольную точку развития, которая перезапускает программы позднего эмбриогенеза, и его дальнейшее превращение в автотрофный проросток блокируется. Зародыши, прорастание которых заблокировано, остаются жизнеспособными, но находятся в состоянии покоя и осмотолерантности, пока в их клетках присутствует АБК [4].
Синтез АБК начинается в пластидах из ксантофиллов и после серии последовательных превращений предшественник АБК выходит в цитоплазму, где превращается в абсцизовый альдегид. Ключевым компонентом последнего этапа биосинтеза АБК является сульфураза молибденового кофактора (Moco-сульфураза, альдегид-оксидаза), кодируемая геном ABA3 (AT1G16540) [5]. Moco-сульфураза регулирует превращение абсцизового альдегида в АБК и участвует во множестве биологических процессов, таких как активируемый ауксином сигнальный путь, движение устьиц, защитная реакция на бактериальные инфекции, реакция на абиотический стресс (холод, тепло, осмотический стресс) [6–8].
Кроме контроля прорастания семян АБК также участвует в вегетативном развитии растений, стимулируя рост при низких концентрациях и подавляя его при высоких [9]. При этом одной из ключевых функций АБК является не только участие в процессах роста и развития растений, но и контроль внутриклеточного ответа на воздействие разнообразных стрессоров, включая ионизирующее излучение [10]. В рамках исследования эффектов хронического радиационного воздействия в популяциях Pinus sylvestris, расположенных на территориях, загрязненных радионуклидами в результате аварии на Чернобыльской АЭС, был проведен анализ транскриптома хвои P. sylvestris методом высокопроизводительного секвенирования РНК и выявлены дифференциально экспрессирующиеся гены, общие для загрязненных радионуклидами популяций: Масаны, Кулажин и Заборье Кладбище [11]. Из пяти выявленных генов с пониженной экспрессией четыре были связаны с ответом на стресс: транскрипт анионной пероксидазы, вовлеченный в апоптоз, и три транскрипта, связанные с сигналингом абсцизовой кислоты (АБК) – CIPKK_ARATH, CIPKA_ARATH и SLAC1_ARATH [11]. Концентрации АБК, как ингибитора прорастания семян [12], снижались в проростках ячменя после облучения семян в стимулирующих малых дозах γ-излучения [13].
Учитывая роль АБК в прорастании семени и в ответе растения на стресс, кинетика прорастания семян АБК-мутантов представляется информативным параметром для оценки воздействия стрессовых факторов на раннем этапе жизненного цикла растений. Цель данной работы заключалась в изучении влияния γ-излучения на различные аспекты прорастания семян при помощи пакета Germinationmetrics (версия 0.1.3 [14]) для среды программирования R (версия 3.6.3 [15]).
МАТЕРИАЛЫ И МЕТОДИКА
Объект исследования
Для изучения динамики прорастания семян Arabidopsis thaliana после γ-облучения в дозах 50, 100 и 150 Гр объектами исследования выбраны линии, мутантные по генам, связанным с АБК-сигналингом: abi3-8 маловосприимчивая к природной форме S-(+)-АБК, содержит мутацию в гене ABI3, что препятствует S-(+)-АБК-опосредованному сигналингу [16]; aba3-1, с нарушением синтеза АБК, содержит рецессивную мутацию гена ABA3, кодирующего Moco-сульфуразу [17]. Экотип Col-8 был использован в качестве контроля. Семена были получены из коллекции Института Жан-Пьера Буржена (Национальный институт сельскохозяйственных исследований, Версаль, Франция).
Облучение и проращивание семян A. thaliana
Семена дикого типа и мутантных линий подвергали воздействию γ-излучения на уникальной научной установке ГУР-120 (Россия) в ФГБНУ ВНИИРАЭ (источник излучения – 60Co) в бумажных пакетах. Дозы острого облучения составили 50, 100 и 150 Гр при мощности дозы 460 Гр/ч.
Семена выращивали на питательной среде Мурасиге–Скуга половинной концентрации, содержащей растворы макро- и микроэлементов, хелат железа, агар-агар и MES буфер с добавлением 0.3% сахарозы. После облучения семена помещали в холодильник (+4°С) на 48 ч для стратификации, после чего их переносили в фитотрон (+21°С, 55% влажности и плотности фотосинтетического фотонного потока 80 мкмоль/с м2) для индукции прорастания.
Всхожесть семян оценивали в течение первых 6 сут после переноса в фитотрон по разрыву эндосперма и появлению корешка.
Всего проведены три независимых эксперимента с тремя биологическими повторностями в каждом. Одна биологическая повторность одного эксперимента состояла из 20–36 семян каждой исследуемой линии (Col-8, abi3-8, aba3-1) на дозу. Итого использованы около 1000 семян каждой линии.
Расчет показателей прорастания
Для вычисления показателей (всхожесть, время и скорость прорастания), необходимых для построения кривой прорастания семян, в Germinationmetrics используется четырехпараметрическая функция Хилла [18], описываемая следующей формулой:
Кривые прорастания семян, построенные с помощью четырехпараметрической функции Хилла, основаны на медианных значениях трех повторностей каждого экспериментального условия в трех независимых экспериментах.
Статистический анализ
Для статистического анализа экспериментальных данных и визуализации полученных результатов использовали набор пакетов tidyverse, rstatix и Hmisc для R. Для изучения связи между показателями прорастания использовалась непараметрическая ранговая корреляция Спирмена. Статистическая значимость различий принималась при уровне р ≤ 0.05. Для построения иерархической кластеризации использовали библиотеки pandas и seaborn языка программирования Python 3.8.
РЕЗУЛЬТАТЫ
Для построения кривой прорастания семян использовалась четырехпараметрическая функция Хилла, как метод аппроксимации кривой [18], определяющая всхожесть, время и скорость прорастания. Пример кривой прорастания семян представлен на рис. 1. Кривые прорастания контрольных и γ-облученных семян A. thaliana дикого типа (Col-8) и линий с нарушениями синтеза (aba3-1) и рецепции (abi3-8) АБК наглядно представлены на рис. 2. Количественные параметры кривых прорастания даны в табл. 1.
Рис. 1.
Кривая прорастания семян генотипа Col-8. Вертикальная ось – всхожесть, %; горизонтальная ось – время, дни. FPHF curve – кривая прорастания, основанная на четырехпараметрической функции Хилла; RoG curve – кривая скорости прорастания; TMGR – время максимальной скорости прорастания; t50.germ – вертикальная линия, указывающая время, необходимое для прорастания 50% жизнеспособных семян; t50.total – вертикальная линия, указывающая время, необходимое для прорастания 50% семян, уложенных на субстрат; MGT– вертикальная линия, указывающая среднее время прорастания; U90_10 – горизонтальная линия, показывающая временной интервал между прорастанием 10 и 90% семян.
Fig. 1. Seed germination curve of Col-8 genotype. The vertical axis – germination, %; the horizontal axis – time, days. FPHF curve – germination curve based on the four-parameter Hill function; RoG curve – germination rate curve; TMGR is the time of maximum germination rate; t50.germ – vertical line indicating the time required for germination of 50% of viable seeds; t50.total – a vertical line indicating the time required for the germination of 50% of the seeds sown on the substrate; MGT is a vertical line indicating the average germination time; U90_10 is a horizontal line showing the time interval between the germination of 10 and 90% of seeds.
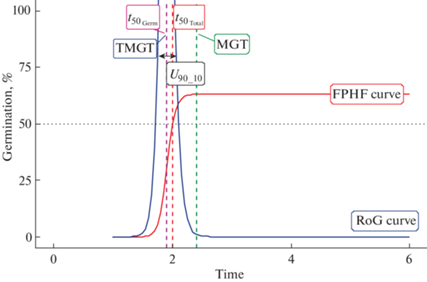
Рис. 2.
Кумулятивные кривые прорастания необлученных и γ-облученных семян Col-8 (дикий тип), aba3-1 (АБК-дефицитная линия), abi3-8 (линия с нарушениями восприимчивости к АБК). Вертикальная ось – прорастание, %; горизонтальная ось – время, дни. Красная кривая основана на четырехпараметрической функции Хилла и описывает прорастание; синяя кривая – кривая скорости прорастания.
Fig. 2. Cumulative germination curves of non-irradiated and γ-irradiated seeds Col-8 (wild type), aba3-1 (ABA-deficient line), abi3-8 (line with impaired susceptibility to ABA). The vertical axis is germination, %; the horizontal axis is time, days. The red curve is based on the four-parameter Hill function and describes the germination; blue curve – germination rate curve.
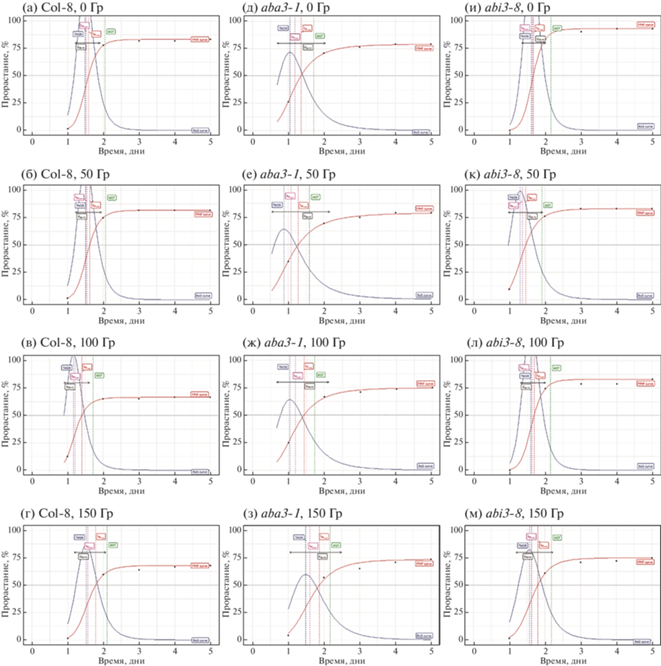
Таблица 1.
Параметры кривой прорастания контрольных и γ-облученных семян A. thaliana дикого типа (Col-8) и линий с нарушениями синтеза (aba3-1) и рецепции (abi3-8) абсцизовой кислоты Table 1. Parameters of the germination curve of control and γ-irradiated seeds of A. thaliana wild type (Col-8) and lines with impaired synthesis (aba3-1) and reception (abi3-8) of abscisic acid
| Гено-тип | Доза γ-облучения, Гр | a | b | c | TMGR | U90_10 |
|---|---|---|---|---|---|---|
| Col-8 | 0 | 83.33 | 9.60 | 1.52 | 1.49 | 0.70 |
| 50 | 81.94 | 9.30 | 1.55 | 1.51 | 0.74 | |
| 100 | 66.67 | 7.57 | 1.21 | 1.17 | 0.72 | |
| 150 | 75.00 | 7.53 | 1.52 | 1.47 | 0.90 | |
| aba3-1 | 0 | 79.17 | 4.04 | 1.19 | 1.05 | 1.36 |
| 50 | 79.17 | 3.17 | 1.08 | 0.88 | 1.62 | |
| 100 | 75.00 | 3.82 | 1.20 | 1.04 | 1.45 | |
| 150 | 73.61 | 5.04 | 1.61 | 1.49 | 1.45 | |
| abi3-8 | 0 | 93.05 | 10.71 | 1.64 | 1.61 | 0.68 |
| 50 | 83.33 | 6.40 | 1.37 | 1.31 | 0.96 | |
| 100 | 83.10 | 10.11 | 1.62 | 1.58 | 0.71 | |
| 150 | 75.00 | 7.02 | 1.63 | 1.56 | 1.04 |
Кроме основных четырех показателей (y0, a, b, c), функция рассчитывает и другие параметры, в том числе: TMGR (time at maximum germination rate) – время максимальной скорости прорастания – временная точка, после которой мгновенная скорость прорастания (instantaneous rate of germination) снижается; U90_10 (uniformity) – временной интервал между прорастанием 10 и 90% семян (табл. 1).
Из необлученных семян максимальное значение асимптоты а, т.е. всхожести, отмечено у линии abi3-8 (а = 93.05%). У контрольных семян этого же генотипа зарегистрированы самые высокие значения скорости прорастания 50% жизнеспособных семян и максимальной скорости прорастания (c = 1.64 дней–1, TMGR = 1.61 дней), а также самый крутой подъем к асимптоте (b = 10.71). Линия abi3-8 характеризуется самым коротким временным интервалом между прорастанием 10 и 90% семян (U90_10 = 0.68 дней у необлученных семян).
Влияние ионизирующего излучения было более выражено для дикого типа Col-8 и АБК-дефицитного генотипа (aba3-1). Самая низкая всхожесть наблюдалась у облученных в дозе 100 Гр семян Col-8 (а = 66.67%). У семян aba3-1, облученных в дозе 50 Гр, отмечены минимальные значения крутизны кривой прорастания (b = 3.17), скорости прорастания 50% жизнеспособных семян (c = 1.08 дней–1) и времени максимальной скорости прорастания (TMGR = 0.88). Самое высокое значение временного интервала между прорастанием 10 и 90% семян также обнаружено у облученных в дозе 50 Гр семян линии aba3-1 (U90_10 = = 1.62 дня).
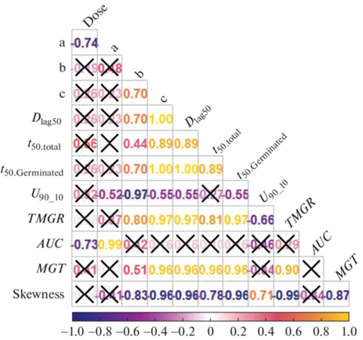
С помощью коэффициента ранговой корреляции Спирмена (рис. 3) была выявлена статистически значимая отрицательная корреляция между параметрами b и U90_10 (rho = –0.97), TMGR и U90_10 (rho = –0.66) и между с и U90_10 (rho = –0.55). Сильная статистически значимая положительная корреляция обнаружена между с и TMGR (rho = 0.97).
Рис. 3.
Корреляционная матрица на основе расчетных показателей функции Хилла. Статистически незначимые значения перечеркнуты (Х). Dose – доза (0, 50, 100, 150 Гр); a – асимптота; b – показатель скорости прорастания, определяющий форму и крутизну кривой прорастания; c – полумаксимальный уровень активации; Dlag50 – продолжительность времени между началом прорастания и прорастанием 50% жизнеспособных семян; t50.total – прорастание 50% семян, уложенных на субстрат; t50.Germinated – прорастание 50% жизнеспособных семян; TMGR – время максимальной скорости прорастания; U90_10 – временной интервал между прорастанием 10 и 90% семян; AUC – площадь под эмпирической кривой; MGT – среднее прорастание; Skewness – коэффициент асимметрии.
Fig. 3. Correlation matrix based on the calculated parameters of the Hill function. Statistically insignificant values are crossed out (X). Dose – dose (0, 50, 100, 150 Gy); a – asymptote ; b – shape and steepness of the germination curve; c – the half-maximal activation level; Dlag50 – the duration between the time at germination onset and that at 50% germination; t50.total – germination of 50% of the seeds laid on the substrate; t50.Germinated – germination of 50% of viable seeds; TMGR is the time of maximum germination rate; U90_10 – time interval between germination of 10 and 90% of seeds; AUC is the area under the empirical curve; MGT – medium germination; Skewness – coefficient of skewness.
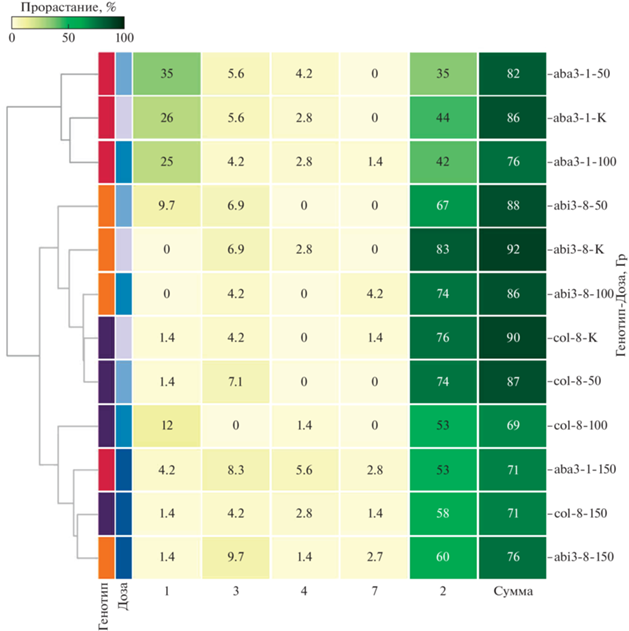
Пик прорастания семян линии с нехваткой эндогенной АБК aba3-1 пришелся на 1-й и 2-й дни. Для семян дикого типа Col-8 и линии abi3-8 наивысшие значения процента прорастания зафиксированы во 2-й день (рис. 4). В целом иерархическая кластеризация всхожести показала, что распределение процента прорастания семян по дням больше зависит от генотипа, чем от дозы воздействия. γ-Облучение в дозе 150 Гр, однако, позволило выделить исследуемые генотипы в отдельный подкластер, что наглядно представлено на рис. 4.
Рис. 4.
Кластеризация всхожести, выраженной в процентах по дням с цветовым распределением по дозе (К – необлученный контроль, 50, 100, 150 Гр) и генотипу, необлученных и γ-облученных семян Col-8 (дикий тип), aba3-1 (АБК-дефицитная линия), abi3-8 (линия с нарушениями восприимчивости к АБК).
Fig. 4. Clustering of germination, expressed as a percentage by day, with color distribution by dose (0 – non-irradiated control, irradiated at doses 50, 100 or 150 Gy) and genotype of Col-8 (wild type), aba3-1 (ABA-deficient line), abi3-8 (line with impaired susceptibility to ABA).
ОБСУЖДЕНИЕ
Биологическая интерпретация динамики прорастания семян на основе кумулятивных кривых прорастания, построенных при помощи 4-параметрической функции Хилла
В практике семенного контроля для определения посевных качеств семян, т.е. совокупности свойств семян, характеризующих степень их пригодности для посева, используются показатели лабораторной всхожести и энергии прорастания [19]. Всхожесть – способность семян образовывать нормально развитые проростки [20] – рассчитывается как доля проросших семян (в %) за определенный срок (в основном, 7–10 дней) от числа заложенных на проращивание. Энергию прорастания (в %) – способность семян быстро и дружно прорастать [20] – вычисляют на конкретный день прорастания, определенный для каждого вида растений и указанный в ГОСТ 12038-84 [19]. Упомянутые два параметра свидетельствуют о способности семян прорастать за определенный срок при благоприятных для данной культуры условиях субстрата, температуры и влажности, однако они недостаточно информативны для оценки влияния абиотических факторов на прорастание и определения потенциальной стрессоустойчивости растений.
Было предпринято несколько попыток упростить определение параметров прорастания семян путем объединения различных показателей в единый индекс или значение [18, 21]. Однако сведение нескольких параметров прорастания к одному показателю дает неполную картину динамики прорастания. Четыре параметра функции Хилла позволяют как прямую, так и косвенную биологическую интерпретацию динамики прорастания семян и влияния предварительной обработки семян на прорастание [18].
Форма и крутизна кривой прорастания контролируются параметром b. Чем больше b, тем круче подъем к асимптоте a и тем короче время между началом прорастания и максимальным прорастанием. El-Kassaby et al., анализируя кривые прорастания стратифицированных и нестратифицированных семян сосны скрученной широкохвойной (P. contorta) показали, что параметр b кривой прорастания стратифицированных семян не коррелировал с их всхожестью (а), что указывает на то, что крутизна кривой прорастания не связана с более высокой всхожестью [18]. В наших экспериментальных данных также наблюдается отсутствие значимой корреляции между параметрами а и b. Оценка коэффициента ранговой корреляции Спирмена, однако, выявила высокую отрицательную корреляцию между параметрами b и U90_10 (rho = –0.97, р ≤ 0.05). Таким образом, чем выше b и круче подъем кривой, тем меньше промежуток времени между прорастанием 10 и 90% семян и соответственно тем более однородно прорастание.
Полумаксимальный уровень активации c является эквивалентом параметра скорости прорастания [R50ꞌ], предложенного [22]. Продолжительность времени между началом прорастания и прорастанием 50% жизнеспособных семян c определено параметром Dlag-50, являющимся эффективным индикатором скорости прорастания, равномерности и энергии прорастания. Чем выше значение Dlag-50, тем быстрее и равномернее прорастание и круче кривая прорастания (т.е. выше значение b) [18]. Dlag-50 и b, таким образом, являются положительно коррелирующими параметрами (рис. 3).
TMGR – время максимальной скорости прорастания, т.е. временная точка, после которой мгновенная скорость прорастания (instantaneous rate of germination) снижается (максимальная точка на кривой скорости прорастания (instantaneous slope)) [14, 18]. Чем меньше времени необходимо для достижения максимальной скорости, тем выше энергия прорастания семян и короче время прорастания 50% жизнеспособных семян, т.е. выше скорость ([R50'] = с) [18] и соответственно меньше временной интервал, необходимый для прорастания 10–90% семян. Таким образом, были ожидаемы положительная корреляция между полумаксимальным уровнем активации с и TMGR, и отрицательная – между TMGR и U90_10 (рис. 3). Примечательно, что TMGR отличается от величины пика (Czabator’s peak value, PV), которое представляет собой максимальное частное, полученное путем деления последовательных кумулятивных значений всхожести на соответствующее время инкубации [21]. Другими словами, PV – это максимальная всхожесть, деленная на общее время прорастания, тогда как TMGR представляет собой максимальную скорость прорастания в определенный момент или небольшой интервал времени, который альтернативно можно назвать мгновенной скоростью прорастания [18]. TMGR определяет точку перегиба кривой прорастания, в то время как в определении уникальной формы и масштаба сигмовидной кривой, PV равноценно любой другой точке кривой. Таким образом, с биологической точки зрения, TMGR является более значимым параметром [18].
Прорастание семян АБК-мутантных линий
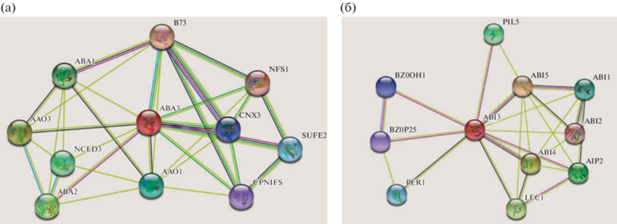
Генотип abi3-8 содержит “слабый” abi3 аллель и характеризуется нормальным цветом семян, в отличие от семян “сильных” аллелей (таких как abi3-3, abi3-4, abi3-5 и abi3-6), которые остаются зелеными на протяжении всего развития [23]. Мутации в гене ABI3 нарушают покой семян [4] и, при благоприятных условиях окружающей среды (свет, температура, влажность), даже свежесобранные семена прорастают. Линия abi3-8, маловосприимчивая к природной форме АБК, содержит аминокислотную замену в домене B1 продукта гена ABI3 с превращением лейцина в позиции 298 в фенилаланин [16]. Эта мутация, предположительно, нарушает взаимодействие белков ABI3 и ABI5 (рис. 5), что приводит к избирательной нечувствительности к S-(+)-АБК [16]. Известны три фактора транскрипции, ингибирующие прорастание семян (PIL5, ABI3 и ABI5, рис. 5, б), которые образуют функциональный модуль, как посредством регуляции транскрипции, так и межбелкового взаимодействия [4, 24]. ABI3 и PIL5 совместно активируют экспрессию SOMNUS (ключевой обратный регулятор прорастания семян), напрямую связываясь с его промотором во впитавших воду семенах A. thaliana, тогда как PIL5 регулирует светозависимую экспрессию мРНК SOMNUS даже в отсутствие ABI3 [24]. Паттерн экспрессии SOMNUS во время созревания семян аналогичен паттерну экспрессии ABI5 и Em1 – двух семя-специфичных генов, также регулируемых ABI3 [24].
Ранее сообщалось, что у генотипа abi3-8 с нарушениями S-(+)-АБК-опосредованного сигналинга не отмечено статистически значимых различий между облученными в дозах 100 и 150 Гр семенами и контролем, а γ-излучение в дозе 50 Гр вызвало быстрое прорастание в ранние часы [25], проявив стимулирующий эффект. В нашей работе лучшие показатели всхожести, скорости и временного интервала между прорастанием 10 и 90% семян отмечены у необлученных семян линии abi3-8 (табл. 1).
Chan и соавт. показали, что на фоне абиотического стресса (кроме повышенной температуры и окислительного стресса) уровни транскриптов ABA3, NCED3 и AAO3 повышаются [26]. Эти три функциональных партнера (рис. 1, а) являются ключевыми ферментами в биосинтезе АБК.
Линия aba3-1 содержит мутацию G-to-A в положении 3707 в гене ABA3, кодирующем Moco-сульфуразу [27]. Учитывая роль молибден-содержащих ферментов во многих аспектах жизни растений, мутантные по ABA3 линии демонстрируют плейотропные фенотипы [28]. Растения линии aba3-1 характеризуются пониженными уровнями АБК в вегетативных тканях в нормальных и стрессовых условиях, которые, тем не менее, выше, чем у большинства других АБК-дефицитных мутантов (aba1, aba2) [17].
Из-за дефицита АБК семена aba3-1 проросли быстрее семян других исследуемых генотипов (пик прорастания семян пришелся на 1-й и 2-й дни, рис. 4). Пониженный уровень АБК, вероятно, является также причиной чувствительности генотипа aba3-1 к острому воздействию γ-излучения, которое уменьшает скорость и однородность прорастания. В ранее опубликованном анализе 22 индивидуальных параметров прорастания в идентичном эксперименте [25] показано, что γ-излучение в максимальной исследованной дозе 150 Гр отрицательно влияло на параметры, характеризующие всхожесть, время, энергию и синхронность прорастания АБК-дефицитного генотипа.
Процент прорастания или всхожесть (%), безусловно, является одним из основных параметров оценки партии семян, который, однако, не может характеризовать кинетику процесса прорастания. Даже совокупность процента прорастания и среднего времени недостаточна для описания активности прорастания партии семян в заданный период времени [29]. Период времени между прорастанием первых и последних семян, вариация скорости прорастания и время прорастания большинства семян – одни из параметров, влияющих на период внесения удобрения, сбор урожая и полевое созревание сельскохозяйственных культур, также эти параметры могут выступать показателями жизнеспособности и стрессоустойчивости семян [29].
Время, скорость, однородность и синхронность являются важными измеряемыми аспектами, информирующими о динамике процесса прорастания. Поскольку эти параметры являются характеристикой сельскохозяйственных культур, они важны для физиологов, семеноводов, экологов, агрономов [30].
ЗАКЛЮЧЕНИЕ
Кривые прорастания семян, построенные с помощью четырехпараметрической функции Хилла из пакета Germinationmetrics в среде программирования R, являются наглядным инструментом для анализа динамики процесса прорастания партии семян, который может быть использован для оценки кинетики прорастания семян после стимулирующего или угнетающего воздействия ионизирующего излучения и других абиотических факторов на различные аспекты прорастания семян, и, как следствие, для оценки стрессоустойчивости генотипа.
Проведенные исследования показали выраженное влияние γ-излучения в дозе 150 Гр на семена всех исследуемых генотипов, выделив при анализе иерархической кластеризации эту дозу в отдельный подкластер.
Список литературы
Verma V., Ravindran P., Kumar P. Plant hormone-mediated regulation of stress responses // BMC Plant Biol. 2016. V. 16. Art. 86. https://doi.org/10.1186/s12870-016-0771-y
Finkelstein R., Reeves W., Ariizumi T. et al. Molecular aspects of seed dormancy // Ann. Rev. Plant Biol. 2008. V. 59. № 1. P. 387–415. https://doi.org/10.1146/annurev.arplant.59.032607.092740
Nambara E., Nambara E., McCourt P. et al. A regulatory role for the ABI3 gene in the establishment of embryo maturation in Arabidopsis thaliana // Development. 1995. V. 121. № 3. P. 629–636. https://doi.org/10.1242/dev.121.3.629
Lopez-Molina L., Mongrand S., McLachlin D.T. et al. ABI5 acts downstream of ABI3 to execute an ABA-dependent growth arrest during germination // Plant J. 2002. V. 32. № 3. P. 317–328. https://doi.org/10.1046/j.1365-313x.2002.01430.x
Watanabe S., Sato M., Sawada Y. et al. Arabidopsis molybdenum cofactor sulfurase ABA3 contributes to anthocyanin accumulation and oxidative stress tolerance in ABA-dependent and independent ways // Sci. Rep. 2018. V. 8. P. 16592. https://doi.org/10.1038/s41598-018-34862-1
Eckert M., Kaldenhoff R. Light-induced stomatal movement of selected Arabidopsis thaliana mutants // J. Experim. Bot. 2000. V. 51. № 49. P. 1435–1442. https://doi.org/10.1093/jexbot/51.349.1435
Xiong L., Ishitani M., Lee H. et al. The Arabidopsis LOS5/ABA3 Locus Encodes a Molybdenum Cofactor Sulfurase and Modulates Cold Stress- and Osmotic Stress-Responsive Gene Expression // Plant Cell. 2001. V. 13. № 9. P. 2063–2083. https://doi.org/10.2307/3871428
Llorente F., Oliveros J.C., Martinez-Zapater J.M. et al. A freezing-sensitive mutant of Arabidopsis, frs1, is a new aba3 allele // Planta. 2000. V. 211. № 5. P. 648–55. https://doi.org/10.1007/s004250000340
Barrero J.M., Piqueras P., Gonzalez-Guzmán M. et al. A mutational analysis of the ABA1 gene of Arabidopsis thaliana highlights the involvement of ABA in vegetative development // J. Exp. Bot. 2005. V. 56. № 418. P. 2071–2083. https://doi.org/10.1093/jxb/eri206
Nakashima K., Yamaguchi-Shinozaki K. ABA signaling in stress-response and seed development // Plant Cell Rep. 2013. V. 32. № 7. P. 959–970. https://doi.org/10.1007/s00299-013-1418-1
Duarte G.T., Volkova P., Geras’kin S. The response profile to chronic radiation exposure based on the trans-criptome analysis of Scots pine from Chernobyl affec-ted zone // Environ. Pollut. 2019. V. 250. P. 618–626. https://doi.org/10.1016/j.envpol.2019.04.064
Cutler S.R., Rodriguez P.L., Finkelstein R.R. et al. Abscisic acid: emergence of a core signaling network // Ann. Rev. Plant Biol. 2010. V. 61. № 1. P. 651–679. https://doi.org/10.1146/annurev-arplant-042809-112122
Bitarishvili S.V., Volkova P.Y. & Geras’kin S.A. γ-Irradiation of Barley Seeds and Its Effect on the Phytohormonal Status of Seedlings // Russ. J. Plant Physiol. 2018. V. 65. P. 446–454. https://doi.org/10.1134/S1021443718020024
Aravind J., Vimala D.S., Radhamani J. et al. Germinationmetrics: Seed Germination Indices and Curve Fitting. R package version 0.1.3. 2019. Available at: https://github.com/aravind-j/germinationmetricshttps://cran.r-project.org/package=germinationmetrics. Accessed May 25, 2021.
R Core Team, 2021. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Available at: https://www.R-project.org/. Accessed May 25, 2021.
Nambara E., Suzuki M., Abrams S. et al. A screen for genes that function in abscisic acid signalling in Arabidopsis thaliana // Genetics. 2002. V. 161. № 3. P. 1247–1255. https://doi.org/10.1093/genetics/161.3.1247
Leon-Kloosterziel K.M., Gil M.A., Ruijs G.J. et al. Isolation and characterization of abscisic acid-deficient Arabidopsis mutants at two new loci // Plant J. 1996. V. 10. № 4. P. 655–661. https://doi.org/10.1046/j.1365-313X.1996.10040655.x
El-Kassaby Y.A., Moss I., Kolotelo D. et al. Seed germination: Mathematical representation and parameters extraction // Forest Sci. 2008. V. 54. P. 220–227. https://doi.org/10.1093/forestscience/54.2.220
ГОСТ 12038-84. Межгосударственный стандарт. Семена сельскохозяйственных культур. Методы определения всхожести (с Изменениями N 1, 2). [GOST 12038-84. Agricultural seeds. Methods for determination of germination (In Russ.]
ГОСТ 20290-74. Семена сельскохозяйственных культур. Определение посевных качеств семян. Термины и определения. [GOST 20290-74. Seeds of crops. Determination of seed sowing quality. Terms and definitions (In Russ.)]
Czabator F.J. Germination value: An index combining speed and completeness of pine seed germination // Forest Sci. 1962. V. 8. P. 386–396.
Thomson A., El-Kassaby Y. Interpretation of seed-germination parameters // New Forests. 1993. V. 7. P. 123–132. https://doi.org/10.1007/BF00034195
Nambara E., Naito S., McCourt P. A mutant of Arabidopsis which is defective in seed development and sto-rage protein accumulation is a new abi3 allele // Plant J. 1992. V. 2. № 4. P. 435–441. https://doi.org/10.1111/j.1365-313X.1992.00435.x
Park J., Lee N., Kim W. et al. ABI3 and PIL5 collaboratively activate the expression of SOMNUS by directly binding to its promoter in imbibed Arabidopsis seeds // Plant Cell. 2011. V. 23. № 4. P. 1404–1415. https://doi.org/10.1105/tpc.110.080721
Babina D., Podobed M., Bondarenko E. et al. Seed Gamma Irradiation of Arabidopsis thaliana ABA-Mutant Lines Alters Germination and Does Not Inhibit the Photosynthetic Efficiency of Juvenile Plants // Dose-Response. 2020. P. 1–13. https://doi.org/10.1177/1559325820979249
Chan Z. Expression profiling of ABA pathway trans-cripts indicates crosstalk between abiotic and biotic stress responses in Arabidopsis // Genomics. 2012. V. 100. P. 110–115. https://doi.org/10.1016/j.ygeno.2012.06.004
Plessis A., Cournol R., Effroy D. et al. New ABA-hypersensitive Arabidopsis mutants are affected in loci mediating responses to water deficit and Dickeya dadantii infection // PLoS One. 2011. V. 6. № 5. P. e20243. https://doi.org/10.1371/journal.pone.0020243
Schwartz S.H., Leon-Kloosterziel K.M., Koornneef M. et al. Biochemical characterization of the aba2 and aba3 mutants in Arabidopsis thaliana // Plant Physiol. 1997. V. 114. P. 161–166.
Kader M. A comparison of seed germination calculation formulae and the associated interpretation of resulting data // J. & Proc. Royal Society of New South Wales. 2005. V. 138. P. 65–75.
Talská R., Machalová J., Smýkal P., Hron K. A compa-rison of seed germination coefficients using functional regression // Appl Plant Sci. 2020. V. 8. № 8. P. e11366. https://doi.org/10.1002/aps3.11366
Szklarczyk D., Gable A.L., Lyon D. et al. STRING v11: protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets // Nucl. Acids Res. 2019. V. 8. № 47 (D1). P. D607–D613. https://doi.org/10.1093/nar/gky1131
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология