Радиационная биология. Радиоэкология, 2022, T. 62, № 6, стр. 565-577
МИКРОРНК: РОЛЬ В РЕГУЛЯЦИИ ГЕНОВ, ПРОГНОЗЕ ЗАБОЛЕВАНИЙ, РАДИОТЕРАПИИ И ПРИ ДЕЙСТВИИ РАДИОПРОТЕКТОРОВ
Д. В. Салеева 1, *, Н. Ф. Раева 1, Д. А. Свиридова 2, Г. Д. Засухина 1, 2
1 ГНЦ Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
Москва, Россия
2 Институт общей генетики им. Н.И. Вавилова РАН
Москва, Россия
* E-mail: dasha_saleeva@inbox.ru
Поступила в редакцию 22.05.2022
После доработки 19.08.2022
Принята к публикации 07.09.2022
- EDN: RKJMES
- DOI: 10.31857/S0869803122060121
Аннотация
МикроРНК относятся к классу некодирующих РНК (длиной около 20 нуклеотидов) и являются одними из регуляторов генной активности, которая осуществляется посттранскрипционным путем и может изменять процесс трансляции. В обзоре представлен анализ литературных данных по радиоиндуцированным изменениям микроРНК, которые являются стабильными элементами, циркулируют в крови и характеризуются определенными профилями активности в зависимости от функции органа и ткани, а также специфичности патологического процесса. Оценка изменения экспрессии микроРНК дает возможность постановки диагноза, определения стадии и прогноза заболевания и эффективности радиотерапии. Вовлеченность микроРНК в патологические процессы оказывает влияние на радиочувствительность опухолей. Данные авторов демонстрируют различия в активности исследованных микроРНК при действии ионизирующего излучения в высоких и малых дозах, в нормальных и злокачественных клетках человека, а также при онкологических заболеваниях различной локализации. Показано исследование микроРНК как ранних биомаркеров патологических процессов. Обсуждается перспективность участия микроРНК при применении ионизирующего излучения в малой дозе перед радиотерапией новообразований для сохранения здоровых тканей, окружающих опухоль, от повреждающего действия высоких доз. МикроРНК могут служить индикаторами уровней радиации в профессиональных условиях, а также в аварийных ситуациях.
Некодирующие РНК составляют значительную часть генома человека (98%). К ним относятся рибосомальные, малые ядерные, теломеразные, малые интерферирующие, длинные некодирующие и другие типы РНК [1].
Долгое время некодирующие РНК считались “мусором”, и лишь недавно были определены их истинные функции в поддержании клеточного гомеостаза, регуляции генов, жизнедеятельности клеток, а также в развитии различных патологий, в частности, онкологических заболеваний. Особый интерес представляет изучение длинных некодирующих РНК (днРНК) и микроРНК, играющих важную роль в процессах опухолеобразования [2, 3].
Некодирующие РНК относятся к эпигенетическим факторам, которые, в отличие от генетических механизмов, могут изменять экспрессию генов без нарушения ДНК-последовательности. Кроме этого, к эпигенетическим факторам относятся специфические изменения метилирования ДНК, модификация гистонов, экспрессия микроРНК и высшая хроматиновая организация. Такие изменения чувствительны к воздействию окружающей среды и одновременно обусловлены наследственными факторами, поскольку являются персистирующими даже после прекращения стрессового воздействия [4].
МикроРНК состоят из 21–23 нуклеотидов, активны как посттранскрипционные модуляторы генной экспрессии, ингибиторы трансляции или индукторы деградации мРНК. Каждая микроРНК может влиять на различные клеточные процессы (дифференциацию, пролиферацию, апоптоз), а также на экспрессию множества генов. Многие микроРНК играют ключевую роль в Р53-зависимом пути и регулируют иммунную реакцию [5].
Можно выделить несколько стадий созревания микроРНК [6]. Из первичного транскрипта вырезается pri-микроРНК, которая превращается в pre-микроРНК в ядре с помощью комплекса Drosha/DGCR8, после чего в цитоплазме формируются зрелые микроРНК из pre-микроРНК с участием Dicer/TRBP комплекса [7]. МикроРНК взаимодействует с 3'-нетранслируемым регионом мРНК по принципу комплементарности. Кроме того, микроРНК могут связываться с 5’-нетранслируемой областью или кодирующими участками мРНК генов. МикроРНК могут регулировать процессы репарации, влияя на этот процесс через днРНК и гены [8].
Около 50% всех микроРНК находятся в участках генома, ассоциированного с онкогенами (let-7 при раке легких, miR-155 при лимфомах). Для каждого типа опухоли характерны свой набор и уровень активности микроРНК, что используется для диагностики и терапии различных онкопатологий [9].
В регуляцию экспрессии генов могут также быть вовлечены циркулярные РНК, которые имеют сайты для связывания с микроРНК [10].
Другой класс некодирующих РНК – днРНК, имеют длину более 200 нуклеотидов и исчисляются в геноме десятками тысяч (в отличие от десятков сотен микроРНК). Пути регуляции ими генов описаны в отдельных сообщениях [11, 12].
Показана важная роль некодирующих РНК при различных заболеваниях, в том числе онкологических, кардиоваскулярных и вирусных [13–15].
Многое известно об эффектах ионизирующего излучения (ИИ) на клетки. Однако влияние радиации на экспрессию некодирующих РНК, в частности, микроРНК в последнее время приобретает повышенный интерес [16].
Вовлеченность специфических днРНК и микроРНК в патологические пути в клетке при действии ИИ может быть основой для разработки радиосенсибилизирующих агентов и таргетной терапии при злокачественных новообразованиях.
Нами получен ряд экспериментальных данных, свидетельствующих об участии микроРНК в формировании как чувствительности, так и устойчивости к действию радиации, использованию их как биомаркеров диагностики и прогноза заболевания [17].
В данном обзоре были обобщены как литературные, так и собственные данные, полученные при облучении мышей, а также клеточных линий человека в малых и высоких дозах радиации. Акцент сделан на роли микроРНК как показателей эффективности радиотерапии, прогноза заболевания, а также при действии радиопротекторов в радиоиндуцированном канцерогенезе в зависимости от локализации и вида опухоли.
ЭКСПРЕССИЯ микроРНК ПРИ ОТВЕТЕ НА ДЕЙСТВИЕ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ В ЗАВИСИМОСТИ ОТ ДОЗЫ, ДЛИТЕЛЬНОСТИ ВОЗДЕЙСТВИЯ И ТИПА КЛЕТОК
Уровень экспрессии микроРНК в перевиваемых клетках эндотелия линии EA.hy926 отличался на разных сроках после воздействия ИИ. Так, через 4 ч после облучения изменялась экспрессия 22 микроРНК. Из них у 14 микроРНК отмечалось снижение экспрессии, тогда как у восьми – повышение. Через 24 ч после облучения активность 18 микроРНК ингибировалась, а у четырех – увеличивалась.
Для let-7d, miR-519e, miR-323-3р, miR-517b как через 4, так и через 24 ч было характерно увеличение экспрессии, а для miR-518b – снижение. Интересно, что изменение экспрессии микроРНК влияло на регуляцию клеточного цикла и апоптоз, тогда как на репарацию двунитевых разрывов ДНК-повреждений – нет [18].
В нашем эксперименте изучена активность ряда микроРНК при воздействии малой (0.1 Гр) и высокой (5 Гр) дозы радиации, а также при их сочетании в лимфоцитах здоровых доноров и лимфоидных клетках Jurkat через 1 и 4 ч, а также через 20 ч. В табл. 1 показаны различия между активностью микроРНК в разных клетках. При облучении клеток сначала в малой дозе (МДР), а затем в повреждающей формируется адаптивный ответ (АО) клеток. АО лимфоцитов периферической крови характеризовался повышением активности всех исследованных микроРНК, тогда как в злокачественных клетках активность микроРНК была снижена или не изменялась [17, 19].
Таблица 1.
Активность микроРНК в лимфоцитах и клетках Jurkat через 20 ч после воздействия ИИ в высокой дозе и при адаптивном ответе (0.1 + 5 Гр) [из работы 19] Table 1. Activity of microRNA in Jurkat lymphocytes and cells after 20 hours after exposure to ionizing radiation at a high dose and with an adaptive response [from 19]
| Через 20 ч после 0.1 + 5 Гр или 5 Гр | ||||
|---|---|---|---|---|
| miR | Лимфоциты (n = 32) | Jurkat (n = 40) | ||
| 5 Гр. отн. ед. | 0.1 + 5 Гр. отн. ед. | 5 Гр. отн. ед. | 0.1 + 5 Гр. отн. ед. | |
| –181 | ↑1.29* | ↑3.44* | 0.33* (↓ в 3.03 раза) | 0.37 (не изм.) |
| –27а | ↑1.52* | ↑1.81* | 1.37 (не изм.) | 1.29 (не изм.) |
| –107 | ↑9.84* | ↑2.22* | 0.25* (↓в 4 раза) | 0.28* (↓в 3.5 раза) |
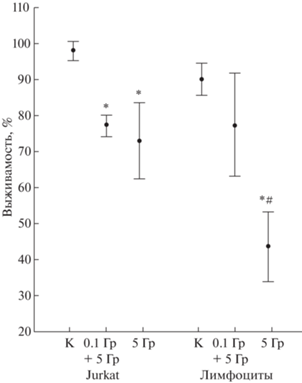
Показана устойчивость клеток Jurkat к действию радиации в высокой дозе (ВДР) по сравнению с лимфоцитами (рис. 1). Выживаемость лимфоцитов, предварительно облученных в дозе 0.1 Гр, при дальнейшем воздействии в дозе 5 Гр, была высокой (~80%), тогда как в опухолевых клетках такой закономерности обнаружено не было. То есть предварительное облучение в МДР “защищало” нормальные клетки от воздействия ВДР.
Рис. 1.
Выживаемость лимфоцитов и клеток линии Jurkat в контроле (К), через 20 ч после однократного воздействия радиации в дозе 5 Гр (5 Гр), а также комбинированного облучения в дозах 0.1 и 5 Гр через 4 ч (0.1 Гр+5 Гр) [из работы 19].
Данные представлены в виде отношения медианы исследуемой группы к медиане контрольной группы, принятой за единицу.
*Статистически значимые изменения (p < 0.05) по критерию Манна–Уитни в исследуемой группе по сравнению с контролем; # статистически значимые изменения (p < 0.05) по критерию Манна–Уитни в исследуемой группе по сравнению с группой с предварительным облучением в малой дозе.
Fig. 1. Survival of lymphocytes and of Jurkat cells in the control (K), 20 h after single exposure to radiation at a dose of 5 Gy (5 Gy), as well as combined irradiation at doses of 0.1 Gy and 5 Gy after 4 h (0.1 Gy+5 Gy) [из работы 19]
The data are presented in the form of the ratio of the median of the study group to the median of the control group, taken as one.
*Indicates statistically significant changes (p < 0.05) according to the Mann–Whitney criterion in the study group compared with the control; # indicates statistically significant changes (p < 0.05) according to the Mann–Whitney criterion in the study group compared to the group with low-dose radiation.
В табл. 1 и на рис. 2 показано, что в лимфоцитах при облучении в высокой и сочетанной (0.1 Гр + + 5 Гр) дозе экспрессия микроРНК повышалась, а в лимфоидных клетках чаще снижалась.
Рис. 2.
Изменение содержания зрелых микроРНК в клетках линии Jurkat (а) и нормальных лимфоцитах (б) в контроле (1) и через 20 ч после воздействия радиации в дозе 5 Гр (2), либо после адаптивного действия 0.1 Гр и через 4 ч – 5 Гр (3) [из работы 19].
Данные представлены в виде отношения медианы исследуемой группы к медиане контрольной группы, принятой за единицу.
*Статистически значимые изменения (p < 0.05) по критерию Манна–Уитни в исследуемой группе по сравнению с контролем; # статистически значимые изменения (p < 0.05) по критерию Манна–Уитни в исследуемой группе по сравнению с группой с предварительным облучением в малой дозе.
Fig. 2. Changes in the content of mature microRNA in Jurkat cells (a) and normal lymphocytes (b) in the control (1) and 20 hours after exposure to radiation at a dose of 5 Gy (2), or after the adaptive response of 0.1 Gy and after 4 hours – 5 Gy (3) [adaptation from 19].
The data are presented in the form of the ratio of the median of the study group to the median of the control group, taken as one.
*Indicates statistically significant changes (p < 0.05) according to the Mann–Whitney criterion in the study group compared with the control; # indicates statistically significant changes (p < 0.05) according to the Mann–Whitney criterion in the study group compared to the group with low-dose radiation.
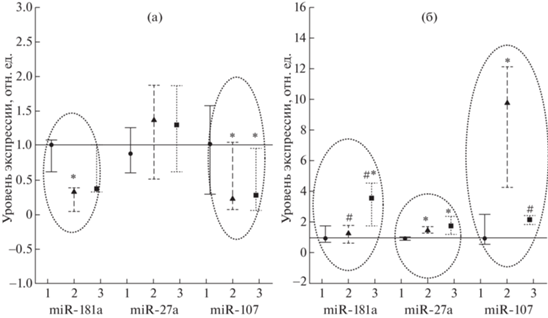
Таким образом, нами показано положительное влияние предварительного облучения в малых дозах на устойчивость нормальных клеток к действию ИИ в высокой дозе, что, несомненно, важно при радиотерапии для сохранения неповрежденными нормальных тканей, окружающих опухоль. Исследованные микроРНК могли бы служить показателями дисбаланса ответа нормальных и опухолевых клеток в ответ на действие облучения [17].
Из литературы также известно, что микроРНК могут служить биомаркерами и даже биодозиметрами ионизирующего излучения, поскольку являются высокоспецифичными, чувствительными и быстро реагирующими показателями в ответ на действие радиации. Было показано, что miR-4267 и miR-5096 регулируют более 1000 генов. При этом в зависимости от времени после облучения, экспрессия микроРНК может как увеличиваться, так и снижаться. Так, через 30 мин после облучения активность miR-4267 повышалась до 4.11 отн. ед., а через 2 ч снижалась до 1.69 отн. ед. Экспрессия miR-5096 увеличивалась как через 30 мин, так и через 2 ч после облучения, в 14.9 и 2.42 раза соответственно. [20]. Однако для более детального анализа и подтверждения наличия биодозиметрического механизма микроРНК необходимо расширять выборку пациентов.
МикроРНК КАК УЧАСТНИКИ РАДИОИНДУЦИРОВАННОГО КАНЦЕРОГЕНЕЗА И ПОКАЗАТЕЛИ ПРОГНОЗА ЗАБОЛЕВАНИЯ
Радиоиндуцированный канцерогенез можно рассматривать как результат длительной экспозиции ИИ. На мышах линии С57Вl/6 было показано, что продолжительное воздействие радиации может приводить к развитию новообразований, например, лимфом [21], а микроРНК могут играть ключевую роль в прогрессии опухолей [6, 22]. Специфичность микроРНК выражается в ассоциации ее уровня экспрессии с локализацией и гистологической структурой новообразований, а также стадией развития заболевания.
При лимфоме тимуса miR-147 была идентифицирована как онкоген, сверхэкспрессия которого связана с проапоптотическим геном TNFα. В свою очередь miR-143 характеризовалась сниженной экспрессией, мишенью которой является ген В7Н1, позволяющий раковым клеткам избегать иммунной системы организма. Была обнаружена связь miR-21 с процессами ангиогенеза, что провоцировало формирование метастазов, инвазию и рост опухоли. При этом повышенная активация miR-21 приводила к подавлению активности гена PTEN, в результате чего индуцировался ангиогенез через запуск РI3К-АКТ пути [23, 24].
МикроРНК активируются не только при развитии патологических процессов, но и при осложнениях после радиотерапии. Так, критическая роль miR-155-5р проявлялась в радиационно-индуцированном легочном фиброзе. В работе Wang et al. показано, что miR-155-5р может ингибировать киназу гликогенсинтазы GSK-3β, что снижает активность эпителиально-мезенхимального перехода, индуцированного действием ИИ через NFkB патологический путь, предотвращая формирование легочного фиброза. Как полагают авторы, таким образом можно идентифицировать терапевтические мишени [25].
Нами также была показана вовлеченность микроРНК при различных онкологических заболеваниях и осложнениях после радиотерапии новообразований. Важным оказалось изменение экспрессии miR-21 у пациентов при возникновении цистита после радиотерапии, что позволяет прогнозировать это осложнение еще до его появления [26].
В табл. 2 описана связь активности микроРНК с развитием рака гортани. Оказалось, что некоторые микроРНК (miR-21,-27а) характеризовались более высокой активностью в крови по сравнению с таковой в клетках опухоли. Это указывает на возможность исследования активности микроРНК неинвазивным путем. Кроме того, профиль экспрессии некоторых микроРНК коррелировал как с благоприятным, так и с неутешительным прогнозом течения заболевания [27].
Таблица 2.
Связь активности микроРНК с раком гортани [27] Table 2. Association of microRNA activity with laryngeal cancer [27]
| miR | Опухоль (n = 35) | Кровь (n= 35) |
|---|---|---|
| miR-21 | ↑7.5 раза | ↑73.7 раза |
| miR-27а | ↓1.9 раза | ↑3.48 раза |
| miR-34а | 1.0 | 1.0 |
| miR-101 | 1.0 | 1.0 |
| miR-124 | 1.0 | ↓66.7 раза |
| miR-125а | ↑152 | 1.0 |
| miR181а | 1.0 | ↑1.31 раза |
Примечания. Показаны изменения активности микроРНК в опухолевой ткани и крови пациентов с раком гортани. Данные представлены в виде отношения медианы исследуемой группы к медиане контрольной группы, принятой за единицу. Экспрессия miR-21, miR-27а, miR-124 выше в крови пациентов, чем в опухолевых клетках, что демонстрирует преимущества малоинвазивного метода диагностики (взятие крови) по сравнению с биопсией.
Изложенные данные позволяют использовать профили активности микроРНК как показатели течения патологического процесса и прогноза возможных осложнений радиотерапии. Однако следует учитывать специфичность каждой опухоли и индивидуальные особенности пациента.
СПЕЦИФИЧНОСТЬ ПРОФИЛЕЙ ЭКСПРЕССИИ РАДИОИНДУЦИРОВАННЫХ микроРНК В ЗАВИСИМОСТИ ОТ ВИДА ОПУХОЛИ
Некодирующие РНК, в частности микроРНК, характеризуются дисрегуляцией при радиотерапии в радиорезистентных опухолевых клетках. МикроРНК, циркулирующие в биологических жидкостях человека, могут “предсказывать” ответ на радиотерапию и служить прогностическими биомаркерами ее эффективности. При этом каждая опухоль и ее ответ на радиотерапию демонстрируют различия в экспрессии микроРНК [28].
Высокая экспрессия микроРНК может увеличивать чувствительность опухолевых клеток к радиотерапии. По данным D. Pan et al., miR-29b-3p может сенсибилизировать радиационное повреждение стволовых опухолевых клеток за счет ингибирования экспрессии онкогенов (RBL1, PIK3R1, AKT2 и Bcl-2). То есть miR-29b-3p может представлять собой одну из терапевтических мишеней-кандидатов при лучевой терапии [29].
С другой стороны, экспрессия miR-504 увеличивалась в клетках остеосаркомы, по сравнению с нормальными клетками и коррелировала с опухолевым ростом и клинической стадией. MiR-504 ингибировала активность P53, что в результате привело к активации пролиферации и инвазии злокачественных клеток [30].
В работе Chen et al. были определены пять биомаркеров – miR-31, miR-410, miR-99а, miR-424 и miR-495, по профилю которых предсказывались успешность радиотерапии и долговременная выживаемость пациентов с раком головы и шеи [31].
Увеличенная экспрессия miR-1908 была обнаружена у пациентов с раком шейки матки, что сопровождалось агрессивным течением. MiR-1908 связывалась с 3'-UTR областью гистоновой деацетилазы 10 (HDAC10) и регулировала ее активность [32].
Для микроРНК miR-423-5р, miR-7-5р, miR-522-3р, miR-3184-3р, miR-3529-3р было характерно изменение экспрессии в двух линиях клеток рака прямой кишки. В частности, после нокдауна miR-423-5р в радиочувствительных клетках (HCT116) уровень их пролиферации значительно увеличивался. А сверхэкспрессия этой микроРНК в радиорезистентных опухолевых клетках защищала их от действия радиации. Таким образом, miR-423-5р можно рассматривать как мишень при радиотерапии рака прямой кишки [33].
Нами была изучена кинетика изменений miR-21 на 14-е и 21-е сутки после тотального облучения (75 мГр) мышей линии СВАхС57Bl, которым инокулировали опухолевые клетки саркомы Льюиса [21].
В табл. 3 показано, что для miR-21 на 14-е сутки после облучения в клетках костного мозга в группе “Опухоль” отмечалось снижение экспрессии, тогда как на 21-е сутки наблюдали тенденцию к увеличению активности этого показателя. В клетках селезенки на 14-е сутки после облучения отмечали повышение экспрессии miR-21, тогда как в группе “Опухоль+облучение” на 21-е сутки профиль экспрессии был снижен. Это коррелировало со снижением объема опухоли.
Таблица 3.
Профили экспрессии miR-21 в различных органах мышей, инокулированных опухолевыми клетками Льюиса при облучении в дозе 75 мГр на 14-е и 21-е сутки от начала эксперимента [21] Table 3. МiR-21 expression profiles in various mice organs inoculated Lewis’s tumor cells under irradiation with a dose of 75 mGy on 14 and 21 days after the beginning of the experiment [21]
| Органы мышей (n = 40) | Группа | 14-е сутки после облучения | 21-е сутки после облучения |
|---|---|---|---|
| Костный мозг | Опухоль + облучение | ↓1.4 | ↑1.03 |
| Опухоль | ↓1.47 | ↑1.15 | |
| Тимус | Опухоль + облучение | ↑1.14 | ↑1.52 |
| Опухоль | ↑1.07 | ↓1.96* | |
| Селезенка | Опухоль + облучение | ↑1.72* | ↓1.72* |
| Опухоль | ↑1.93* | 1.19 |
Дисбаланс действия онкосупрессоров и онкогенов был показан также при пролонгированном облучении мышей и формировании опухолей [34]. Полученные данные позволяют использовать микроРНК как маркеры прогноза при развитии новообразований.
Таким образом, были показаны особенности индукции микроРНК в зависимости от вида опухоли, ответа на радиотерапию, в том числе по показателям радиочувствительности или резистентности.
СВЯЗЬ МЕЖДУ УРОВНЕМ ЭКСПРЕССИИ микроРНК И ПРОЯВЛЕНИЕМ УСТОЙЧИВОСТИ ИЛИ ЧУВСТВИТЕЛЬНОСТИ К ДЕЙСТВИЮ РАДИАЦИИ
МикроРНК могут являться мишенями не только для генов, но и для днРНК. Так, miR-449b-5p является мишенью днРНК HOTAIR. Их связывание приводит к повышению радиорезистентности клеток рака молочной железы, тогда как сверхэкспрессия GAS5 вместе с miR-106b и miR-205-5p повышает радиочувствительность клеток рака шейки матки [35].
МикроРНК могут в свою очередь иметь мишенью структурные гены. Например, в клетках мышей ген PTEN, который модулировал ответ на действие радиации, являлся мишенью для miR-21. В клетках карциномы легкого человека показано, что PTEN также был мишенью miR-221, которая блокирует трансляцию белка этого гена, что отражается в увеличении радиочувствительности злокачественных клеток [36].
В работе L. Yang et al. получено, что miR-181а подавляла экспрессию Bcl-2, что способствовало сенсибилизации клеток глиомы человека к радиации [37].
Важную функцию в гипоксии, индуцирующей апоптоз, играет ингибирование экспрессии miR-17, которая является мишенью гена P53 при ответе на клеточный стресс. Продемонстрировано, что miR-17 подавляет активность P53 (регулятора mdm2), в результате чего снижается клеточная пролиферация. Таким образом, miR-17 может служить примером мишени для модификации ответа клеток на действие ИИ [38].
ДнРНК связываются с микроРНК, оказывая влияние на радиорезистентность или радиочувствительность при различных типах рака [39, 40]. Так, описана связь между активностью днРНК NORAD, индуцированной действием радиации, и подавлением синтеза pri-miR-199а, что приводило к увеличению радиорезистентности клеток рака пищевода [41].
Изменения активности микроРНК, индуцированные действием радиации, показаны при разных типах опухолей, что указывает на их роль в канцерогенезе, вызываемом ИИ [28].
В табл. 4 представлены данные по чувствительности и резистентности некоторых микроРНК, индуцированных действием радиации, при злокачественных новообразованиях разных локализаций [40].
Таблица 4.
Связь между микроРНК и радиочувствительностью некоторых опухолей (адапт из статьи [38]) Table 4. Relationship between microRNA and radiosensitivity of some tumors (adaptation from [38])
| Опухоль | МикроРНК | Ответ на действие ИИ |
|---|---|---|
| Рак легких | miR-21 | Устойчивый |
| miR-34а | Чувствительный | |
| miR-124 | Чувствительный | |
| Назофаренгиальный рак | miR-21 | Устойчивый |
| miR-9 | Устойчивый | |
| miR-124 | Чувствительный | |
| Рак молочной железы | miR-144 | Устойчивый |
| miR-200с | Чувствительный |
Из табл. 4 видно, что изменение экспрессии miR-21 при разных типах опухолей соответствует устойчивости новообразований к радиотерапии. Вместе с тем ясно, что каждая опухоль характеризуется особенностями в ассоциации стабильности к действию радиации и изменениями конкретной микроРНК [42].
Для miR-21 описана роль в эффекте свидетеля, который объясняется включением микроРНК в экзосомы (их размер 40–100 нмоль в диаметре), осуществляющие межклеточное взаимодействие посредством растворимых факторов. Экзосомы могут диагностироваться в моче, сыворотке, слюне, а также в опухолевых, дендритных и эпителиальных клетках [43].
Обнаружено, что модуляция экспрессии микро-РНК влияет на радиочувствительность опухолей разными путями. Фермент лактатдегидрогеназа играет ключевую роль в модуляции гликолиза в опухолевых клетках за счет обеспечения их энергией для роста и распространения. Показано, что активация miR-449а (супрессора фермента лактатдегидрогеназы) повышала радиочувствительность клеток линии А549 [44]. Таким образом, микроРНК могут осуществлять функцию сенсибилизаторов, увеличивая радиочувствительность [40].
МикроРНК КАК ПОКАЗАТЕЛИ ЭФФЕКТИВНОСТИ РАДИОТЕРАПИИ И ПРОГНОЗА РАДИОИНДУЦИРОВАННЫХ ОСЛОЖНЕНИЙ
МикроРНК принимают участие в регуляции ответа клеток на радиотерапию. Огромным преимуществом анализа этих генетических структур является использование плазмы крови для прогноза эффективности терапии. При этом они могут свидетельствовать о прогрессирующей радиорезистентности или радиочувствительности [45].
При радиотерапии рака молочной железы были идентифицированы 36 микроРНК, из них 22 были определены как радиочувствительные, 12 – как радиорезистентные и две микроРНК, обладающие обеими вариациями. К радиочувствительным относились let-7, miR-7, miR-16, miR-22, miR-155, miR-634 и др. Многие из них подавляли активность генов-мишеней, которые включались в клеточный рост и инвазию. Некоторые из радиосенсибилизирующих микроРНК были участниками блокирования клеточного цикла, ДНК-репарации, что способствовало повышению чувствительности клеток к действию радиации.
Сверхэкспрессия miR-634 приводила к снижению экспрессии STAT-3 in vitro и сенсибилизировала чувствительность раковых клеток к действию радиации [46]. Генерация опухолевых стволовых клеток является фактором, сопутствующим развитию радиорезистентности. Повышенная активность miR-142-3р была ассоциирована с экспрессией маркеров стволовых клеток (СD-44, CD-133 и ALDH1) и сниженной регуляцией генов репарации (BRCA1 и BRCA2) [47].
Одними из первых, анализирующих динамику экспрессии микроРНК в процессе радиотерапии и их включение в процессы радиочувствительности опухолевых клеток, были китайские исследователи [48, 49]. Было показано, что miR-16 может использоваться как потенциальный маркер при раке гортани, демонстрирующий благоприятный прогноз радиотерапии при повышенном уровне экспрессии. При этом было обнаружено, что профили экспрессии 100 микроРНК, циркулирующих в плазме, существенно отличаются у здоровых и больных пациентов. Сниженная экспрессия miR-16, являющейся супрессором опухолей, была обнаружена у пациентов с хроническим лимфолейкозом [50].
Важно подчеркнуть, что каждая микроРНК дифференциально экспрессируется в различных опухолях, а развитие опухоли может регулироваться несколькими микроРНК.
Ингибирование апоптоза, индукция остановки клеточного цикла, ДНК-репарация – ключевые события, ведущие к радиорезистентности [51]. В большинстве случаев микроРНК подавляли экспрессию их мишеней, которые влияют на процессы роста, инвазии и метастазирование (miR-668 и ген NFkB). Однако сверхэкспрессия miR-21, которая индуцировала остановку клетки в стадии G2/М и активировала ДНК-повреждение в клетках рака молочной железы, также оказывала влияние на радиорезистентность. Кроме того, сверхэкспрессия miR-21 ассоциировалась с метастазированием и коррелировала со сниженной выживаемостью пациентов с раком молочной железы [52].
Вместе с тем некоторые микроРНК могут играть двойную роль в формировании радиочувствительности и резистентности. К таким регуляторам была отнесена miR-122, которая при раке молочной железы обладала свойствами или онкосупрессора или онкогена. При этом сверхэкспрессия miR-122 ассоциировалась со снижением активности генов, регулирующих пролиферацию и апоптоз (KRAS, RIPK1 и др.). Было сделано предположение, что повышенная экспрессия miR-122 может быть благоприятной на ранней стадии радиотерапии, но иметь неутешительный прогноз после продолжительного лечения [53].
Авторы показали, что 22 микроРНК регулировали сниженную активность генов, которые включаются в рост клеток, 14 микроРНК – в ДНК-репарацию и 11 – в апоптоз. Регуляцию инвазии и метастазирования осуществляли всего четыре микроРНК, остановки клеточного цикла – три, аутофагии – две. Именно эти процессы играют роль в развитии радиорезистентности [54].
Чувствительность опухолевых клеток при радиотерапии зависит от ряда факторов: интенсивности ДНК-повреждений, способности клеток поддерживать экспрессию генов, ассоциированную с апоптозом, клеточным циклом и ДНК-репарацией. Радиорезистентные раковые клетки характеризовались подавлением апоптоза и повышением ДНК-репарации [28].
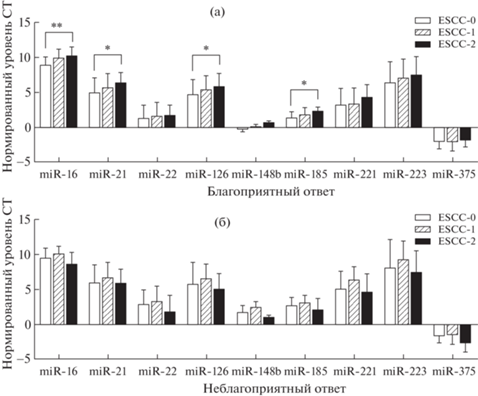
На рис. 3 представлены данные по прогностической ценности микроРНК при радиотерапии [49]. Профили экспрессии девяти микроРНК менялись в зависимости от периода терапии. При этом благоприятный или неблагоприятный прогноз ассоциировался с особенностями экспрессии микроРНК.
Рис. 3.
Изменения экспрессии микроРНК в разные периоды лучевой терапии (адапт из статьи [49]).
Представлена тенденция изменения экспрессии микроРНК – кандидатов в разные периоды лучевой терапии. ESCC-0, ESCC-1 и ESCC2 представляют собой три разных периода лечения (до, первую неделю и конец лучевой терапии) соответственно. а: изменения экспрессии miR-16, miR-21, miR-22, miR-126, miR-148 b, miR-185, miR-221, miR-223 и miR-375 в ходе лучевой терапии в группе с благоприятным ответом (отсутствие поражений или 30% уменьшение очага поражения); б: тенденция изменения девяти потенциальных мишеней при лучевой терапии в группе с неблагоприятным ответом соответственно (прогрессирование заболевания с увеличением очага поражения более чем на 20%).
Fig. 3. Changes in microRNA expression during different periods of radiation therapy (adaptation from [49]).
Changes of expression microRNA-candidate in different periods of radiotherapy treatment. ESCC-0, ESCC-1 and ESCC-2 represent three different periods of treatment (before, the first week, and the end of radiotherapy), respectively. a: The change tendency of miR-16, miR-21, miR-22, miR-126, miR-148b, miR-185, miR-221, miR-223 and miR-375 in the course of radiotherapy in good response group, respectively (disappearance of lesions or 30% or greater reduction of the overall total sum of lesion diameter); b: The change tendency of the nine candidate targets in the course of radiotherapy in poor response group, respectively (disease progression with an increase in the lesion more than 20%).
Нами было показано, что профили микроРНК в периферической крови пациентов с раком предстательной железы до и после лучевой терапии резко отличаются по уровням экспрессии (miR-107, miR-181а, miR-124, miR-21) у пациентов с циститами, развивающимися после лучевой терапии, от группы пациентов без постлучевых осложнений [26, 55].
Следует отметить, что miR-21 является “чувствительным” показателем при многих патологиях (онкологические, воспалительные заболевания и др.), а также может служить индикатором риска развития побочных эффектов лучевой терапии у пациентов с раком предстательной железы. Такие изменения экспрессии miR-21 можно использовать для прогноза осложнений еще до лечения. Было показано, что содержание miR-21 увеличивается в 34.2 раза у пациентов с циститами. Вместе с тем у пациентов с раком молочной железы отмечено увеличение содержания не только miR-21, но и miR-34, miR-145 и let-7a [26].
Активность микроРНК оказывает определенное влияние на лечение рака простаты при радиотерапии [56, 57].
Таким образом, идентифицированные микроРНК могут быть использованы в качестве прогностических маркеров для предсказания эффекта радиотерапии в клинике. МикроРНК могут рассматриваться для прогноза лучевых осложнений. Кроме того, радиорезистентные или радиочувствительные микроРНК могут расцениваться как потенциальные терапевтические мишени.
ЭКСПРЕССИЯ микроРНК ПРИ ДЕЙСТВИИ РАДИОПРОТЕКТОРОВ
В радиобиологии продолжается поиск эффективных радиопротекторов. Некоторые из них исследуются с точки зрения их влияния на конкретные патологические пути, которые являются причиной повреждений органов (печени, почек, легких и селезенки) мышей. К таким радиопротекторам относится фукоксантин (морской каротиноид), влияющий на апелин-13/APJ-путь [58]. Авторы доказали, что этот препарат, применяемый до облучения, снижал количество повреждений за счет механизма перехватывания свободных радикалов. Таким образом, фукоксантин понижал оксидативный стресс и сохранял баланс активности ММР-2, ММР-9, TIMP-1 в разных органах, повышая уровень IL-6 и NFkB, и снижая IL-10 и α-7nAchR. То есть показана перспективность применения этого препарата, обладающего способностью снижать оксидативные повреждения и повышать иммунный статус.
МикроРНК, как регуляторы генов, принимают участие в процессах защиты клеток при действии радиации. Было показано, что если мышам ввести радиопротекторы (амифостин, СВLB502, нилестриол), число активируемых микроРНК составляло 113, 80 и 136. При совместном воздействии ИИ вместе с радиопротекторами число индуцированных микроРНК составляло 105, 127 и 71 соответственно [59].
Радиопротекторы применялись по-разному: нилестриол – орально за 48 ч до облучения, амифостин и CBLB502 – внутрибрюшинно за 30 мин до облучения.
Амифостин – тиоловое соединение, механизм действия которого связан с перехватом свободных радикалов, регулирующих клеточный цикл и экспрессию генов, в том числе ДНК-репарацию [60].
CBLB502 – дериват флагеллина Salmonella – активирует ядерный фактор NFkB, который моделирует экспрессию ингибиторов апоптоза, свободных радикалов и спектр цитокинов [61]. Нилестриол – дериват эстрогена, усиливает пост-радиационную регенерацию, активируя провоспалительные сигнальные пути и стимулируя гемопоэтическую систему регуляции [62].
Недавние исследования показали, что микроРНК взаимодействуют с P53 и его генами-мишенями. P53 регулирует транскрипцию и созревание ряда микроРНК. С другой стороны, микроРНК могут регулировать активность как P53, так и его регуляторов в клетках посредством прямого ингибирования. Тем самым микроРНК могут опосредованно влиять на процессы пролиферации, дифференциации, апоптоза [5, 63].
Анализ дифференциально экспрессируемых РНК, в том числе микроРНК, позволил предположить, что радиопротекторы подавляли экспрессию гистоновых генов и процессы сборки нуклеосом при воздействии ИИ. Авторы полагают, что применяемые протекторы осуществляют свой защитный эффект после, а не до воздействия радиации. Важным является факт, что снижение активности гистоновых генов является первичным ответом на радиоиндуцированные ДНК-повреждения, а радиопротекторы регулируют этот ответ [59]. Следовательно, микроРНК также могут в определенной степени проявлять защитные функции при действии радиации.
ЗАКЛЮЧЕНИЕ
В радиобиологии важным остается необходимость разработки нового подхода определения безопасности применяемых в современной медицине доз радиации (например, при компьютерной томографии) и возможных отдаленных последствий, связанных с профессиональной деятельностью. В связи с тем, что радиотерапия, безусловно, остается незаменимым средством лечения пациентов с онкологическими заболеваниями, необходимо определение индивидуальных показателей чувствительности или устойчивости к воздействию ИИ и применению быстрых, ранних и чувствительных маркеров для оценки эффективности прогноза и лечения заболевания. МикроРНК наряду со структурными генами могут быть использованы как биодозиметры. Изменение экспрессии циркулирующих микроРНК в крови и других биологических жидкостях в зависимости от дозы радиации позволяет рассматривать их как возможные биодозиметры в экстренных ситуациях [64, 65].
Огромную роль может сыграть поиск маркеров семейной предрасположенности к онкологии. Так, было показано, что некоторые микроРНК стабильно экспрессировались в новых поколениях при раке молочной железы, если ближайшие родственники страдали онкологией.
Решение этих проблем требует конкретных результатов для профилактики здоровья и лечения больных при использовании современных методов, которые могут дать принципиально новые подходы для выбора тактики терапии. По этой причине встает вопрос о том, какие клеточные компоненты могут быть использованы не только для диагностики, но и для прогноза течения заболевания и эффективности радио- и химиотерапии, а также для понимания механизмов ответа на действие радиации в зависимости от особенностей генотипа индивида.
Генотип определяется полиморфизмом генов, контролирующих различные физиологические реакции [66]. С нашей точки зрения, кандидатами на маркеры при ряде патологий, их диагностики, прогноза заболевания и эффективности терапии могут служить микроРНК, поскольку они являются стабильными компонентами, которые можно обнаружить в плазме и сыворотке крови. Это дает возможность применению малоинвазивных исследований, минуя взятие биопсии. МикроРНК обладают определенной специфичностью в отношении локализации и вида опухоли, особенностей индивида.
МикроРНК, как показатели патологического процесса, могут в дальнейшем использоваться в качестве мишеней при радиотерапии. Так, была предложена панель микроРНК, активность которых изменялась в ответ на действие ИИ [20]. При облучении в дозе 4 Гр повышенная экспрессия была обнаружена у miR-1246, miR-1307-3р, miR-3197, miR-4267, miR-5096 и miR-7641.
Обобщая полученные результаты по вовлеченности микроРНК в физиологические и патологические процессы в клетке и организме, можно расценивать их как показатели раннего ответа на стрессовые воздействия, в том числе при действии ИИ.
На современном уровне развития радиобиологии именно микроРНК можно рассматривать в качестве биомаркеров по сравнению с другими компонентами клетки.
Список литературы
Zhang P., Wu W., Chen Q. et al. Non-Coding RNAs and their Integrated Networks // J. Inegr. Bioinform. 2019. V. 16. № 3. P. 20190027. https://doi.org/10.1515/jib-2019-0027
Foggin S., Mesquita-Ribeiro R., Dajas-Bailador F. et al. Biological Significance of microRNA Biomarkers in ALS-Innocent Bystanders or Disease Culprits? // Front. Neurol. 2019. V. 10. P. 578. https://doi.org/10.3389/fneur.2019.00578
Yao R.W., Wang Y., Chen L.L. Cellular functions of long noncoding RNAs // Nat. Cell Biol. 2019. V. 21. № 5. P. 542–551. https://doi.org/10.1038/s41556-019-0311-8
Chen J., Wang Y., Wang C., et al. LncRNA Functions as a New Emerging Epigenetic Factor in Determining the Fate of Stem Cells // Front Genet. 2020. V. 31. № 11. P. 277. https://doi.org/10.3389/fgene.2020.00277
Goeman F., Strano S., Blandino G. MicroRNAs as key effectors in the p53 network // Int. Rev. Cell Mol. Biol. 2017. V. 333. P. 51–90.
Бермишева М.А., Тахирова З.Р., Гилязова И.Р. и др. Ассоциация полиморфных вариантов генов биогенеза микроРНК с развитием рака молочной железы // Генетика. 2018. Т. 54. № 5. С. 563–572. [Bermisheva M.A., Tahirova Z.R., Gilyazova I.R. et al. Associaciya polimorfnyh variantov genov biogeneza mikroRNK s razvitiem raka molochnoj zhelezy // Genetika. 2018. V. 54. № 5. P. 563–572 (In Russ.)]
Yoshida T., Asano Y., Ui-Tei K. Modulation of MicroRNA Processing by Dicer via Its Associated dsRNA Binding Proteins // Noncoding RNA. 2021. V. 7. № 3. P. 57. https://doi.org/10.3390/ncrna7030057
Peraza-Vega R.I., Valverde M., Rojas E. miR-27b-3p a negative regulator of DSB-DNA repare // Genes. (Basel). 2021. V. 12. № 9. P. 133. https://doi.org/10.3390/genes12091333
Миронова А.Н., Падкина М.В., Самбук Е.В. РНК: синтез и функции. СПб.: Изд. Эко-вектор, 2017. 288 с. [Mironova A.N., Padkina M.V., Sambuk E.V. RNK: sintez i funkcii. Sankt-Peterburg: Izd. Eko-vektor, 2017. 288p. (In Russ.)]
Fang J., Qi J., Dong X., et al. Perspectives on circular RNAs as prostate cancer biomarkers // Front. Cell Dev. Biol. 2020. V. 8. P. 594992. https://doi.org/10.3389/fcell.2020.594992
Шуленина Л.В., Михайлов В.Ф., Засухина Г.Д. Длинные некодирующие РНК в радиоответе // Радиац. биология. Радиоэкология. 2020. Т. 60. № 3. С. 239–248 [Shulenina L.V., Mihajlov V.F., Zasuhina G.D. Dlinnye nekodiruyushchie RNK v radiootvete // Radiacionnaya biologiya. Radioekologiya. 2020. V. 60. № 3. P. 239–248. (In Russ.)]
Kopp F., Mendell J.T. Functional classification and experimental dissection of long noncoding RNAs // Cell. 2018. V. 172. № 3. P. 393–407. https://doi.org/10.1016/j.cell.2018.01.011
He J., Hua J., Ding N., et al. Modulation of microRNAs by ionizing radiation in human gastric cancer // Oncol. Rep. 2014. V. 32. P. 787–793. https://doi.org/10.3892/or.2014.3246
Aryankalayil M.J., Martello S., Bylicky M.A. et al. Ana-lysis of lncRNA-miRNA-mRNA expression pattern in heart tissue after total body radiation in a mouse model // J. Transl. Med. 2021. V. 19. P. 336. https://doi.org/10.1186/s12967-021-02998-w
Салеева Д.В., Засухина Г.Д. Перспективы применения малых доз радиации в комплексной терапии COVID-19 // Вопр. вирусологии. 2021. Т. 66. № 6. С. 252–258. [Saleeva D.V., Zasuhina G.D. Perspektivy primeneniya malyh doz radiacii v kompleksnoj terapii COVID-19 // Voprosy virusologii. 2021. V. 66. № 4. P. 252–258. (In Russ.)]https://doi.org/10.36233/0507-4088-62
Shen C.Y., Yang C., Xia B. et al. Long non-coding RNAs: Emerging regulators for chemo/immunotherapy resistance in cancer stem cells // Cancer Lett. 2021. V. 500. P. 244–252. https://doi.org/10.1016/j.canlet.2020.11.010
Михайлов В.Ф., Засухина Г.Д. Новый подход к стимуляции защитных систем организма малыми дозами радиации // Успехи совр. биологии. 2020. Т. 140. № 3. С. 244–252. [Mikhailov V.F., Zasukhina G.D. Novyi podkhod k stimulyatsii zashchitnykh sistem organizma malymi dozami radiatsii // Uspekhi sovremennoi biologii. 2020. V. 140. № 3. P. 244–252. (In Russ.)]
Kraemer A., Anastasov N., Angermeier M. et al. MicroRNA-mediated processes are essential for the cellular radiation response // Radiat. Res. 2011. V. 176. № 5. P. 575–586. https://doi.org/10.1667/rr2638.1
Михайлов В.Ф., Шуленина Л.В., Раева Н.Ф. и др. Влияние малых доз ионизирующей радиации на экспрессию генов и некодирующих РНК в нормальных и злокачественных клетках человека // Цитология. 2019. Т. 61. № 6. С. 427–438. [Mikhailov V.F., Shulenina L.V., Raevaa N.F. et al. The effect of low doses of ionizing radiation on the expression of genes and non-coding RNA in normal and malignant human cells // Cell and Tissue Biology. 2019. V. 13. № 6. P. 423–433. doi:10.1134/S1990519X19060063 (In Russ.)]
Song M., Xie D.F., Gao S.S. et al. A biomarker panel of radiation-upregulated miRNA as signature for ionizing radiation exposure // LIFE-BASEL. 2020. V. 10. № 12. P. 361. https://doi.org/10.3390/life10120361
Михайлов В.Ф., Салеева Д.В., Шуленина Л.В. и др. Связь между динамикой роста перевивной карциномы Льюиса у мышей и изменением активности генов и некодирующих РНК после рентгеновского облучения в малых дозах // Радиац. биология. Радиоэкология. 2022. Т. 62. № 1. С. 28–41. [Mihajlov V.F., Saleeva D.V., Shulenina L.V. et al. Svyaz’ mezhdu dinamikoj rosta perevivnoj karcinomy L’yuisa u myshej i izmeneniem aktivnosti genov i nekodiruyushchih RNK posle rentgenovskogo oblucheniya v malyh dozah // Radiacionnaya biologiya. Radioekologiya. 2022. V. 62. № 1. P. 28–41. (In Russ.)]
Hussen B.M., Hidayat H.J., Salihi A. et al. MicroRNA: A signature for cancer progression // Biomed. Pharmacother. 2021. V. 138. P. 111528. https://doi.org/10.1016/j.biopha.2021.111528
Wang S., Liu Z., Wang J. et al. miR 21 promotes osteoclastogenesis through activation of PI3K/Akt signaling by targeting Pten in RAW264.7 cells // Mol. Med. Rep. 2020. V. 21. P. 1125–1132. https://doi.org/10.3892/mmr.2020.10938
Zhang Y., Chen Z., Feng L. et al. Ionizing radiation-inducible microRNA-21 induces angiogenesis by directly targeting PTEN // Asian Pac. J. Cancer Prev. 2019. V. 20. № 5. P. 1587–1593. https://doi.org/10.31557/APJCP.2019.20.5.1587
Wang D., Liu Z., Yan Z.Y. et al. MiRNA-155-5p inhibits epithelium-to-mesenchymal transition (EMT) by targeting GSK-3 beta during radiation-induced pulmonary fibrosis // Arch. Biochem. Biophys. 2021. V. 697. https://doi.org/10.1016/j.abb.2020.108699
Шуленина Л.В., Михайлов В.Ф., Васильева И.М. и др. МикроРНК в крови пациентов с раком предстательной железы как возможный показатель ранних осложнений лучевой терапии // Радиац. биология. Радиоэкология. 2017. Т. 57. № 6. С. 598–607. [Shulenina L.V., Mihajlov V.F., Vasil’eva I.M. et al. MikroRNK v krovi pacientov s rakom predstatel’noj zhelezy kak vozmozhnyj pokazatel' rannih oslozhnenij luchevoj terapii // Radiacionnaya biologiya. Radioekologi. 2017. V. 57. № 6. P. 598–607 (In Russ.)]
Салеева Д.В., Михайлов В.Ф., Шуленина Л.В. и др. Функционирование регуляторных РНК, влияющих на развитие опухолевых клеток, у больных раком гортани // Патол. физиология и эксперим. терапия. 2018. Т. 62. № 4. С. 67–74. [Saleeva D.V., Mihajlov V.F., Shulenina L.V. et al. Funkcionirovanie regulyatornyh RNK, vliyayushchih na razvitie opuholevyh kletok, u bol’nyh rakom gortani // Patolo-gicheskaya fiziologiya i eksperimental’naya terapiya. 2018. V. 62. № 4. P. 67–74. (In Russ.)]https://doi.org/10.25557/0031-2991.2018.04.67-74
Zhang X., Yang J. Role of non-coding RNAs on the radiotherapy sensitivity and resistance of head and neck cancer: from basic research to clinical application // Front. Cell Develop. Biol. 2021. V. 8. P. 637435. https://doi.org/10.3389/fcell.2020.637435
Pan D., Du Y., Li R. et al. miR-29b-3p Increases Radiosensitivity in Stemness Cancer Cells via Modulating Oncogenes Axis // Front. Cell Develop. Biol. 2021. V. 9. P. 741074. https://doi.org/10.3389/fcell.2021.741074
Cai Q., Zeng S., Dai X. et al. miR-504 promotes tumour growth and metastasis in human osteosarcoma by targeting TP53INP1. Oncol Rep 2017. V. 38. P. 2993–3000. https://doi.org/10.3892/or.2017.5983
Chen L., Wen Y., Zhang J. et al. Prediction of radiotherapy response with a 5-microRNA signature-based nomogram in head and neck squamous cell carcinoma // Cancer Med. 2018. V. 7. № 3. P. 726–735. https://doi.org/10.1002/cam4.1369
Yu D.S., Song X.L., Yan C. Oncogenic miRNA-1908 target HDAC10 and promotes the aggressive phenotype of cervical cancer cell // Kaohsiung J. Med. Sci. 2021. V. 37. № 5. P. 402–410. https://doi.org/10.1002/kjm2.12348
Shang Y.Y., Wang L.F., Fu C.G. et al. Downregulation of miR-423-5p contributes to the radioresistance in colo-rectal cancer cells // Front. Oncol. 2021. V. 10. https://doi.org/10.3389/fonc.2020.582239
Михайлов В.Ф., Салеева Д.В., Рождественский Л.М. и др. Активность генов и некодирующих РНК как подход к определению ранних биомаркеров радиоиндуцированного опухолеобразования у мышей // Генетика. 2021. Т. 57. № 10. С. 1131–1140. [Mihajlov V.F., Saleeva D.V., Rozhdestvenskij L.M. et al. Aktivnost’ genov i nekodiruyushchih RNK kak podhod k opredeleniyu rannih biomarkerov radioinducirovannogo opuholeobrazovaniya u myshej // Genetika. 2021. V. 57. № 10. P. 1131–1140. (In Russ.)]https://doi.org/10.31857/S0016675821100076
May J.M., Bylicky M., Chopra S. et al. Long and shot non-coding RNA and radiation response: a review // Translat. Res. 2021. V. 233. P. 162–179. https://doi.org/10.1016/j.trsl.2021.02.005
Wang N., Zhu C., Xu Y. et al. Negative Regulation of PTEN by MicroRNA-221 and Its Association with Drug Resistance and Cellular Senescence in Lung Cancer Cells // Biomed. Res. Int. 2018. V. 2018. P. 7908950. https://doi.org/10.1155/2018/7908950
Yang L., Ma Y., Xin Y. et al. Role of the microRNA 181 family in glioma development // Mol. Med. Rep. 2018. V. 17. № 1. P. 322–329. https://doi.org/10.3892/mmr.2017.7895
Yan H.L, Xue G., Mei Q. et al. Repression of the miR-17-92 cluster by p53 has an important function in hypoxia-induced apoptosis // EMBO J. 2009. V. 28. № 18. P. 2719–2732. https://doi.org/10.1038/emboj.2009.214
Wang C., Yu G.,Xu Y. et al. Knockdown of long non-coding RNA HCP5 increases radiosensitivity through cellular senescence by regulating microRNA-128 in gliomas // Cancer Manag. Res. 2021. V. 13. P. 3723–3737. https://doi.org/10.2147/CMAR.S301333
Chen Y., Cui J., Gong Y. et al. MicroRNA: a novel implication for damage and protection against ionizing radiation // Env. Sci. Pollut. Res. 2021. V. 28. P. 15584–15596. https://doi.org/10.1007/s11356-021-12509-5
San Y., Wang Y., Ma Y. et al. Radiation induces NORAD expression to promote ESCC radiotherapy resistance via EEPD1/ATP/chk1 signalling and by inhibitory pri-miR-199a1 processing and exosomal transfer of mir-199a-5p // J. Exp. &Clin. Cancer Res. 2021. V. 40. P. 306. https://doi.org/10.1186/s13046-021-02084-5
Tang S., Liu B., Liu M. et al. Ionizing radiation-induced growth in soft agar is associated with miR-21 upregulation in wild-type and DNA double stand break repair deficient cells // DNA Repair (Amst.). 2019. V. 78. P. 37–44. https://doi.org/10.1016/j.dnarep.2019.03.012
Xu S., Wang J., Ding N. et al. Exosome-mediated microRNA transfer plays a role in radiation-induced bystander effect // RNA Biol. 2015. V. 12. № 12. P. 1355–63. https://doi.org/10.1080/15476286.2015.1100795
Li L., Liu H., Du L. et al. miR-449a suppresses LDHA-mediated glycolysis to enhance the sensitivity of non-small cell lung cancer cells to ionizing radiation // Oncol Res Featur Precli and Cli Cancer Therap. 2018. V. 26. № 4. P. 547–556. https://doi.org/10.3727/096504017X15016337254605
Chong Z.X., Yeap S.K., Ho W.Y. Role of miRNAs in re-gulating responses to radiotherapy in human breast cancer // Int. J. Radiat. Biol. 2021. V. 97. № 3. P. 289–301. https://doi.org/10.1080/09553002.2021.1864048
Yang B., Kuai F., Chen Z. et al. miR-634 decreases the radioresistance of human breast cancer cells by targe-ting STAT3 // Cancer Biother. Radiopharm. 2020. V. 35. № 3. P. 241–248. https://doi.org/10.1089/cbr.2019.3220
Troschel F.M., Böhly N., Borrmann K. et al. miR-142-3p attenuates breast cancer stem cell characteristics and decreases radioresistance in vitro // Tumour Biol. 2018. V. 40. № 8. P. 1010428318791887. https://doi.org/10.1177/1010428318791887
Yang J., Xu X., Hao Y. Research of the relationship between radiotherapy and microRNAs // Chinese-German J. Clin. Oncol. 2012. V. 11. № 5. P. 285–289. https://doi.org/10.1007/s10330-012-0972-2
Yu Q., Li B., Li P. et al. Plasma microRNAs to predict the response of radiotherapy in esophageal squamous cell carcinoma patients // Am. J. Transl. Res. 2015. V. 7. № 10. P. 2060–2071.
Braga T.V., Evangelista F.C., Gomes L.C. et al. Evaluation of MiR-15a and MiR-16-1 as prognostic biomar-kers in chronic lymphocytic leukemia // Biomed. Pharmacother. 2017. V. 92. P. 864–869. https://doi.org/10.1016/j.biopha.2017.05.144
Schulz A., Meyer F., Dubrovska A. et al. Cancer stem cells and radioresistance: DNA repair and beyond // Cancer. 2019. V. 11. № 6. P. 862. https://doi.org/10.3390/cancers11060862
Han M., Wang F., Gu Y. et al. MicroRNA-21 induces breast cancer cell invasion and migration by suppressing smad7 via EGF and TGF-β pathways // Oncol. Rep. 2016. V. 35. № 1. P. 73–80. https://doi.org/10.3892/or.2015.4360
Perez-Anorve I.X., Gonzalez-De la Rosa C.H., Soto-Reyes E. et al. New insights into radioresistance in breast cancer identify a dual function of miR-122 as a tumor suppressor and oncomiR // Mol. Oncol. 2019. V. 13. № 5. P. 1249–1267. https://doi.org/10.1002/1878-0261.12483
Liu Y., Yang M., Luo J. et al. Radiotherapy targeting cancer stem cells “awakens” them to induce tumor relapse and matastasis in oral cancer // Int. J. Oral. Sci. 2020. V. 12. № 1. P. 19. https://doi.org/10.1038/s41368-020-00087-0
Михайлов В.Ф., Шуленина Л.В., Васильева И.М. и др. МикроРНК как регуляторы активности генов в клетках человека при воздействии ионизирующей радиации // Генетика. 2017. Т. 53. № 3. С. 265–278. [Mihajlov V.F., SHulenina L.V., Vasil’eva I.M. et al. MikroRNK kak regulyatory aktivnosti genov v kletkah cheloveka pri vozdejstvii ioniziruyushchej radiacii // Genetika. 2017. V. 53. № 3. P. 265–278 (In Russ.)].https://doi.org/10.7868/S0016675817020072
Soares S., Guerreiro S.G.,Cruz-Martins N. et al. The influence of miRNAs on radiotherapy treatment in prostate cancer – A systematic review // Front. Oncol. 2021. V. 11. P. 704664. https://doi.org/10.3389/fonc.2021.704664
Guo T., Zou L., Ni J. et al. Radiotherapy for unresec-table locally advanced non-small cell lung cancer: a narrative review of the current landscape and future prospects in the era of immunotherapy // Transl. Lung Cancer Res. 2020. V. 9. №5. P. 2097–2112. https://doi.org/10.21037/tlcr-20-511
Bakary El N.M., Thabet N.M., Fatih El N.M. et al. Fucoxanthin alters the apelin-13/APJ pathway in certain organs of γ-irradiated mice // J. Radiat. Res. 2021. V. 62. № 4. P. 600–617. https://doi.org/10.1093/jrr/rraa141
Ge C., Su F., Fu H. et al. RNA Profiling Reveals a Common Mechanism of Histone Gene Downregulation and Complementary Effects for Radioprotectants in Response to Ionizing Radiation // Dose Response. 2020. V. 18. №. P. 1559325820968433. https://doi.org/10.1177/1559325820968433
Andreassen C.N., Grau C., Lindegaard J.C. Chemical radioprotection: a critical review of amifostine as a cytoprotector in radiotherapy // Semin. Radiat. Oncol. 2003. V. 13. № 1. P. 62–72. https://doi.org/10.1053/srao.2003.50006
Li W., Ge C., Yang L. et al. CBLB502, an agonist of Toll-like receptor 5, has antioxidant and scavenging free radicals activities in vitro // Int. J. Biol. Macromol. 2016. V. 82. P. 97–103. https://doi.org/10.1016/j.ijbiomac.2015.10.033
Vasin M.V. Comments on the mechanisms of action of radiation protective agents: basis components and their polyvalence // Springerplus. 2014. V. 7. № 3. P. 414. https://doi.org/10.1186/2193-1801-3-414
Belli M., Tabocchini M.A. Ionizing radiation-induced epigenetic modifications and their relevance to radiation protection // Int. J. Mol. Sci. 2020. V. 21. P. 5993. https://doi.org/10.3390/ijms21175993
Lee K., Chen G., Hsu P. et al. MicroRNA expression profiling altered by variant dosage of radiation exposure // Biomed. Res. Int. 2014. V. 2014. P. 456323. https://doi.org/10.1155/2014/456323
Lacombe J., Sima C., Amundson S.A. et al. Candidate gene biodosimetry markers of exposure to external ioni-zing radiation in human blood: A systematic review // PLoS One. 2018. V. 13. P. e0198851. https://doi.org/10.1371/journal.pone.0198851
Засухина Г.Д., Кузьмина Н.С. Генетический полиморфизм в защите клеток человека от мутагенов // Молекулярный полиморфизм человека. М.: РУДН, 2007. Т. 2. С. 583–599. [Zasuhina G.D., Kuz’mina N.S. Geneticheskij polimorfizm v zashchite kletok cheloveka ot mutagenov // Molekulyarnyj polimorfizm cheloveka. M.: RUDN, 2007. V. 2. P. 583–599. (In Russ.)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


