Радиационная биология. Радиоэкология, 2021, T. 61, № 2, стр. 206-213
На заре радиационной генетики
1 Федеральный научно-клинический центр физико-химической медицины ФМБА России
Москва, Россия
* E-mail: smirngb@yandex.ru
Поступила в редакцию 01.11.2020
После доработки 10.12.2020
Принята к публикации 16.12.2020
Аннотация
Обсуждаются события, люди и эксперименты, связанные с первыми шагами на пути изучения механизмов, определяющих устойчивость и чувствительность бактерий к радиационным воздействиям.
Сначала нам нужно определиться, что именно мы будем сегодня обсуждать. Дело в том, что предмет науки радиационной генетики отечественные и зарубежные ученые определяют по-разному. Согласно Большой медицинской энциклопедии (БМЭ) “Радиационная генетика – раздел генетики и радиобиологии, посвященный изучению закономерностей и механизмов возникновения наследственных изменений (мутаций) под действием ионизирующего излучения с целью разработки путей управления этим процессом”. При этом заметьте, речь идет исключительно об ионизирующей радиации. Однако многие исследователи считают, что радиационная генетика должна также заниматься изучением влияния на генетический материал и неионизирующих излучений (ультрафиолетового и видимого света, ультракоротких радиоволн, лазерного излучения и т. д.). Более того, ваш покорный слуга уверен в том, что важнейшим и интереснейшим разделом радиационной генетики является изучение генетических механизмов, обеспечивающих устойчивость или чувствительность организмов к радиации. Давайте с этого и начнем.
9 марта 1921 года в Нью-Йорке, в еврейской семье эмигрантов из России родилась девочка. Ее назвали Эвелина. Сначала они жили на Ман-хэттене, потом в Квинсе. Это были относительно недавние эмигранты. Семья Майзель, видимо, была вынуждена эмигрировать, поскольку мама Эвелины в России каким-то образом была вовлечена в революционную деятельность. Каким именно, мы не знаем и, скорее всего, об этом не узнаем никогда. Но сведения достоверные – мне об этом говорила сама Эвелина.
Девочка подрастала, в 16 лет поступила в университет Нью-Йорка и в 1941 году защитила степень бакалавра. Собиралась там и продолжить работать, но, видимо, наследственность сыграла свою роль, и Эвелина оказалась вовлеченной в студенческие волнения по поводу ущемления в правах цветных студентов. Вынужденно переместилась в Колумбийский университет, где защитила степень Мастер дегри и в 1943 году вышла замуж за психолога Германа А. Виткин. Так появилась E.M. Witkin (рис. 1). Сначала я думал, что буква “М” в инициалах это второе имя, например, Эвелина-Мария, или что-то в этом роде, и только позже я узнал, что “М” обозначает девичью фамилию – Майзель.
А почему, собственно, так подробно об Эвелине Виткин? А потому, что именно она положила начало радиационной генетике в той ее важнейшей части, которая касается генетических механизмов радиочувствительности. Подчеркиваю, начало не радиобиологии (там свои основоположники), а именно радиационной генетике.
В Колумбийском университете она оказалась “под крылом” великого человека – американца российского происхождения (род. в Подольской губернии) Феодосия Григорьевича Добржанского (рис. 2), дальнего потомка Ф.М. Достоевского (мать – внучатая племянница Достоевского). Он изучал генетику и эволюцию на модели дрозофилы. В том же 1943 году Добржанский поручил Эвелине сделать для студентов доклад об экспериментах Луриа и Дельбрюка. Кстати, за этот эксперимент авторы получили Нобелевскую премию. Так для Э. Виткин началась генетика бактерий. Добржанский знаменит своим историческим высказыванием: “Ничто в биологии не имеет смысла иначе, чем в свете эволюции”. И это совершенно верно.
Эвелина на лето переехала в Колд Спринг Харбор. В этой крупной лаборатории и тогда, и сейчас работали и работают лучшие умы планеты. Она не захотела продолжать “линию” Добржанского, т.е. работать с дрозофилой, а под впечатлением от эксперимента Луриа–Дельбрюка решила использовать в качестве модели кишечную палочку. Это что касается объекта исследования. Но был еще один момент. Выбор направления. И вот здесь мы подошли к парадоксам. Все-таки генетика! Повлиял Добржанский? Да. Но был еще один человек, оказавший влияние на этот выбор. И этим человеком, вот в чем парадокс, был Трофим Лысенко. Виткин мечтала управлять наследственностью. Занялась экспериментом. Ей захотелось выделить из Escherichia соli мутант, более устойчивый к радиации, чем исходный штамм. Приспособить кишечную палочку к радиации. Приучить. Воспитать. И она его выделила. В качестве мутагенного воздействия был выбран ультрафиолет. Благо, далеко ходить не пришлось.
Она назвала мутант Escherichia соli B/r. По устойчивости к ультрафиолету он был практически неотличим от Escherichia соli К12. Но от исходного Escherichia соli В он очень отличался (рис. 3). Это был первый в мире радиорезистентный мутант бактерий. Статья была опубликована в 1947 году [1].
Рис. 3.
УФ-чувствительность штаммов Escherichia coli B, B/r и Bs-1.
Fig. 3. UV-sensitivity of Escherichia coli B, B/r and Bs-1 strains.
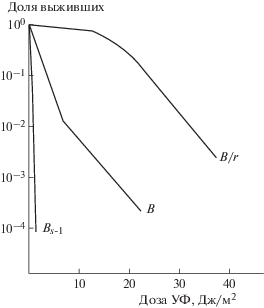
Собственно, это и было рождением радиационной генетики в той ее части, которая посвящена изучению радиочувствительности и радиорезистентности.
А теперь давайте подумаем, что было бы, если бы Виткин взяла в качестве исходного штамма не Escherichia соli В, а Escherichia соli К12. Ничего не было бы. Не получился бы радиорезистентный мутант. А на Escherichia соli К12 всего за год до этого в 1946 г. Джошуа Ледерберг с Эдвардом Тэйтумом уже показали возможность конъюгации [2]. (Это Нобелевская премия). Конъюгация – инструмент генетического анализа. Это означало, что, во всяком случае, в то время ставить генетические эксперименты на К12 было уже можно, а на В – еще нет. Что же, Виткин ошиблась с выбором объекта? Это была тупиковая ветвь? Получается, что нет, получается, что счастливая звезда. Да, кстати, если бы Ледерберг и Тэйтум в поисках конъюгации взяли Escherichia coli В, то у них тоже ничего не получилось бы. Интересно, как же везет гениям!
Известно, что идеи носятся в воздухе и, если можно выделить мутант, устойчивый к радиации, то почему бы не попытаться выделить мутант чувствительный. Это было сделано в 1958 г. И сделала это опять женщина. Ее звали Руфь Хилл. Она в качестве исходного штамма тоже взяла Escherichia соli B. Но, как мы увидим позже, этот случай оказался скорее несчастным, чем счастливым. Первый радиочувствительный мутант получился “на загляденье”. Хилл назвала его Bs-1 (рис. 3) [3].
В этом опыте Хилл так же, как и Виткин при получении радиорезистентного мутанта, в качестве мутагена использовала ультрафиолет, которым облучала суспензию Escherichia соli B. Выжившие бактерии образовали всего 12 колоний. Одна из этих колоний и состояла из мутантных бактерий Escherichia соli Bs-1. И, как мы увидим чуть позже, натворил этот мутант много если не бед, то уж, во всяком случае, способствовал формированию ложных выводов.
Почему Escherichia соli B/r был устойчив к радиации, а Escherichia соli Bs-1 – сверхчувствителен, никто тогда не знал. Но довольно скоро всем все “стало понятно”. В те времена бывший студент профессора биофизики Дика Сетлоу (R.B. Setlow) (рис. 4) Фил Хэнэуолт (P.C. Hanawalt) переехал из Нью Хэйвена (Йельский университет) в Стэнфорд (Стэнфордский университет) и занялся влиянием основных фотопродуктов при УФ-облучении – циклобутановых пиримидиновых димеров на продвижение репликативной вилки. Фил обнаружил, что после УФ-облучения в ДНК бактерий дикого типа образуются короткие “заплатки” из вновь синтезированной ДНК. Он позвонил своему бывшему наставнику в Нью Хэйвен и сообщил об этом.
Рис. 4.
Р.Б. Сетлоу (через несколько десятилетий после описываемых cобытий).
Fig. 4. R.B. Setlow (several decades after described events).

Сетлоу ответил, что он только что обнаружил, что после облучения пиримидиновые димеры в бактериях дикого типа выщепляются из ДНК и переходят в кислоторастворимую фракцию, а вот в мутанте Руфи Хилл Escherichia соli Bs-1 этого не происходит [4]. Хилл тогда тоже находилась в Йельском университете. Именно она любезно поделилась с Диком Сетлоу своим мутантом. Таким образом, первый этап эксцизионной репарации – выщепление пиримидиновых димеров – был открыт [5].
Но ни Хэнэуолт, ни Сетлоу не были генетиками. А вот Пол Говард-Фландерс и его сотрудники, работавшие в том же Йельском университете, были генетиками. Они выделили свои УФ-чувствительные мутанты, но уже из Escherichia соli К12, и не только выделили, но и картировали мутантные гены, и показали, что их мутанты также не способны удалять из ДНК пиримидиновые димеры. Мутантные гены были названы uvrA, uvrB и uvrC [6]. Примечательно, что эти работы группы Сетлоу и группы Говарда-Фландерса были опубликованы в одном номере одного и того же журнала. Процесс восстановления ДНК после УФ-облучения был назван эксцизионной репарацией. Сейчас функции каждого из первых трех генов uvr тщательно изучены биохимически.
(Нужно сказать, что “за исследование механизмов восстановления ДНК” в 2015 году присудили Нобелевскую премию. Ее получили Томас Роберт Ли́ндаль, Азиз Санджар и Пол Модрич. По-моему, это очень странное решение. Почему “за исследование”, а не за открытие феномена? (Механизмы восстановления ДНК изучали десятки, если не сотни исследователей, а честь открытия феномена принадлежит, все-таки, Сетлоу, Говарду-Фландерсу и Хэнэуолту.)
Совершенно логичен следующий вопрос: какие повреждения, кроме пиримидиновых димеров, способна узнавать и удалять эксцизионная репарация? В то время далеко не все повреждения, вызываемые в ДНК различными химическими агентами, были известны. Поэтому простейший способ хотя бы предварительно определить диапазон действия эксцизионной репарации состоял в сравнении чувствительности к тому или иному агенту бактерий штамма дикого типа и его радиочувствительного мутанта. И все бы ничего для начала, но многие исследователи стали сравнивать Escherichia соli B/r с Escherichia соli Bs-1. Причем в целом ряде случаев Escherichia соli Bs-1 сравнивали даже не с B/r, а с и вовсе неродственной, но радиорезистентной Escherichia соli TAU-bar. И грешили этим очень многие уважаемые ученые. Что тут началось! Сколько статей! В результате “оказалось”, что эксцизионная репарация оперирует чуть ли не на всех мыслимых повреждениях. А дело было в том, что Escherichia соli Bs-1, действительно, чувствительна практически ко всем воздействиям на свете. И причина, чаще всего, не в эксцизионной репарации.
Разобраться в этой заварухе удалось профессору Джозефу Гринбергу из Пало Альто [7]. Низкий ему поклон за это. Ценой огромного терпения, настойчивости и профессионализма ему удалось адаптировать генетические методы, в первую очередь, трансдукцию фагом Р1 для Escherichia соli B. Что же выяснил Гринберг? Очень много неожиданного. Оказалось, что, хотя бактерии Escherichia соli B/r фенотипически неотличимы от Escherichia соli К12 дикого типа, штамм Escherichia соli B/r не дикий тип, а супрессорный мутант Escherichia соli B. Тогда, надо понимать, что Escherichia соli B – дикий тип? Тоже не совсем верно – он, действительно, дикий, но он природный мутант. А что же Escherichia соli Bs-1? А это не только мутант по эксцизионной репарации, но множественный мутант по генам, влияющим на радио- и не только радиочувствительность (табл. 1).
Итак, в природе существует стабильная линия Escherichia соli B. (Нужно сказать, что, судя по всему, популяция Escherichia соli B гетерогенна и состоит как минимум из двух компонентов. Большинство бактерий по радиочувствительности – типичные Escherichia соli B, однако существует минорная фракция, примерно 2%, радиочувствительность которой идентична Escherichia соli B/r. (При этом радиорезистентность B/r-подобной фракции – признак фенотипический, т.е. не зафиксирован в геноме.) У Escherichia соli B дефектен ген lon, продуктом которого является сериновая протеиназа. Эти бактерии умеренно УФ-чувствительны, однако, что важно, они чувствительны не только к УФ-, но и к рентгеновским и γ-лучам, и практически ко всем радиомиметикам. После облучения или обработки ДНК-тропными агентами эти бактерии образуют нити (филаменты), так как у них среди множества процессов нарушен процесс клеточного деления из-за дефекта протеолиза неправильно свернутых или агрегированных белков. Одним из субстратов протеазы Lon является продукт гена sul – ингибитор клеточного деления. Если бактерии, дефектные по гену lon, облучить или обработать радиомиметиком, синтезируемый продукт гена sul индуцируется, но не разрушается, ингибитор накапливается, клетка не делится, а образует нить и вскоре гибнет [8–10]. Э. Виткин в 1947 году инактивировала у Esche-richia соli B ген sul и получила УФ-резистентный супрессорный мутант Escherichia соli B/r. Мутант Хилл Escherichia соli Bs-1 сохранил мутацию в гене lon и дополнительно приобрел мутации в генах uvr и lex, а это означает выключение более 20 генов SOS-регулона! Как я уже говорил – мутант “на загляденье”. А теперь вспомним, что в свое время, сравнивая Escherichia соli B/r (или TAU-bar) и Bs-1, очень видные ученые делали выводы о диапазоне действия системы именно эксцизионной репарации, оперирующей на пиримидиновых димерах. А ведь возможности для корректного сравнения были. Помимо Bs-1, Хилл выделила из Escherichia соli B еще несколько УФ-чувствительных мутантов. (Помните 12 колоний из выживших после облучения в ее опыте?) Эти мутанты тоже были названы Bs, но под другими номерами, (например, Bs-2). Они были не настолько чувствительны к УФ-свету, как Bs-1, но некоторые из них не были способны реактивировать УФ-облученный бактериофаг Т1. То есть не были способны к host cell реактивации (HCR). А это и есть одно из фенотипических проявлений эксцизионной репарации, обусловленных мутацией в любом из трех генов uvr. Один из этих мутантов и нужно было сравнивать с Escherichia соli B для определения диапазона действия системы эксцизионной репарации. Немного позже можно было воспользоваться uvr мутантом Escherichia соli B/r – WP2 uvr–, сравнивая его с Escherichia соli B/r.
Так что же, кроме пиримидиновых димеров, узнает и выщепляет эксцизионная репарация? Значительную часть моей кандидатской диссертации составили эксперименты по определению диапазона действия эксцизионной репарации. Я был аспирантом Аделины Генриховны Скавронской. Мы изучали летальное и мутагенное действие различных химических мутагенов на модели uvr мутантов Escherichia соli К12, выделенных в лаборатории А. Рерша в Нидерландах. В качестве контроля и сравнения использовали ультрафиолет. Эти опыты мы проводили в 1967 и 1968 г. Кратко суммировать результаты можно следующим образом. Дефект по первому этапу эксцизионной репарации приводит к увеличению чувствительности бактерий к летальному, но не мутагенному действию бифункциональных алкилирующих агентов. Иными словами, эксцизионная репарация распознает и репарирует искажения вторичной структуры ДНК. Никакие другие повреждения (кроме вызванных ультрафиолетом) uvrABC-зависимой системой не репарируются [11]. Однако позже стало известно, что существуют системы репарации, которые оперируют на самых разнообразных повреждениях ДНК, вызываемых химическими агентами. Теперь эти системы хорошо изучены.
Какие же выводы необходимо сделать из всех этих историй? Конечно, не следует работать со штаммами, не изученными генетически. Можно совершить массу ложных открытий. Но вот вопрос, а достаточно ли генетических характеристик, чтобы быть уверенным в результатах такой работы? Теперь становится понятным, что нет, недостаточно. Буквально в последние годы мы с коллегой занялись экспериментами на модели мутантов, выделенных из штамма Escherichia соli К12 АВ 1157. Именно из этого исходного штамма Говард-Фландерс и его сотрудники получали мутанты по генам комплекса 3R (репарация, репликация, рекомбинация). Мы стали работать с мутантами по генам uvrB, recA и lexA. Они были получены в 1960-е годы и за всю последующую историю с этими мутантами выполнены многие сотни работ. И вот, в какой-то момент Елена Николаевна Ильина сказала мне: “Георгий Борисович, Вы работаете с плохо изученными штаммами. Необходимо провести их полногеномное секвенирование”. Я довольно долго “тянул время”, думая, что уж эти штаммы называть плохо охарактеризованными никак нельзя. В конце концов секвенирование провели [12]. Хорошо, что не получилось, как с Bs-1, но очевидно, что никто не мог ожидать, что после однократной обработки мутагеном в каждом из геномов recA и lexA мутантов возникнет около двух сотен мутаций. Здесь обошлось без драматических событий, но все-таки получается, что выдающиеся ученые всего мира многие десятилетия не имели достаточной информации о геномах штаммов, с которыми они работали.
А теперь вернемся к предметам исследований радиационной генетики. В начале нашей беседы мы говорили о том, что радиационная генетика – “раздел генетики и радиобиологии, посвященный изучению закономерностей и механизмов возникновения наследственных изменений (мутаций) под действием ионизирующего излучения с целью разработки путей управления этим процессом”. Не чувствуете диссонанса, дисгармонии в этом определении? Смотрите, первая часть: “…изучению закономерностей и механизмов возникновения наследственных изменений (мутаций)…” вполне соответствует канонам фундаментальной науки, цель которой – получение новых знаний. Однако окончание фразы: “…с целью разработки путей управления этим процессом” ставит вполне определенную и в чистом виде прикладную цель. В одном определении цели для разных наук! И получается, что кроме управления процессом делать ничего не нужно. Налицо явное, искусственно заданное ограничение. Однако продолжим. Определение БМЭ диктует нам необходимость изучения мутагенного действия ионизирующей радиации.
Нужно сказать, что этот раздел радиационной генетики имеет даже более длинную историю, чем генетика радиорезистентности, с которой мы начали. В 1925 году российские исследователи Г.А. Надсон и Г.С. Филиппов получили мутации у дрожжей после их облучения γ-лучами. Однако за рубежом честь первооткрывателя мутагенного действия радиации принято отдавать Г. Меллеру. Он работал с дрозофилой и в 1927 году показал на этом объекте мутагенное действие рентгеновских лучей. Годом позже Л. Стадлер подтвердил данные Меллера, работая с ячменем. Герман Меллер был яркой, нестандартной личностью: ученик Томаса Ханта Моргана, лауреат Нобелевской премии по физиологии и медицине (1946), в 1933 году он был избран членом-корреспондентом АН СССР. 24 сентября 1948 года он направил в адрес АН СССР письмо с отказом от звания в знак протеста против преследования генетики в СССР. АН СССР в нетипичной для себя манере вопрос обсуждала недолго, очень оперативно удовлетворила его просьбу, и в январе 1949 года он был лишен звания, которое было восстановлено только в 1990 г. Мне не известны другие случаи отказа от академического звания.
А как же с неионизирующими излучениями? Ведь такой огромный пласт науки как открытие и изучение репаративных процессов возник благодаря работам с УФ-светом. Кто открыл мутагенное действие УФ-света? Хорошо, если кто-то из читателей может ответить на этот вопрос.
А сделал это наш соотечественник, орнитолог Александр Николаевич Промптов (рис. 5). Был он двоюродным племянником Александра Сергеевича Серебровского. О Серебровском просто необходимо сказать хотя бы несколько слов. В 1914 году он закончил физико-математический факультет Московского университета и сразу же оказался на фронте. По окончании Первой Мировой войны по предложению Николая Константиновича Кольцова стал руководителем отдела генетической станции в Московской области. В 1929 году вышла его книга “Антропогенетика и евгеника в социалистическом обществе” [13]. В ней он писал: “Решение вопроса по организации отбора в человеческом обществе, несомненно, будет только при социализме после окончательного разрушения семьи, перехода к социалистическому воспитанию и отделения любви от деторождения. Мы полагаем, что решением вопроса об организации отбора у человека будет распространение получения зачатия от искусственного осеменения рекомендованной спермой, а вовсе не обязательно от любимого мужчины”. С 1930 года и до конца своей жизни Серебровский – заведующий основанной им кафедрой генетики на биологическом факультете МГУ. Выпускникам кафедры генетики МГУ полезно знать, кто основатель их alma mater. Вам не кажется интересным задуматься, как бы мы жили, если бы планы Александра Сергеевича осуществились? Кто бы рекомендовал сперму нашим дамам?
Но вернемся к Промптову. После окончания в 1923 году биофака МГУ он работал препаратором, а потом научным сотрудником на Звенигородской биостанции. Позже он был активным участником семинаров Тимофеева-Рессовского, и когда последний надолго уехал в Германию, то предложил Промптову с женой поселиться в его московской квартире. Работу по мутагенному действию ультрафиолета на модели дрозофилы Александр Николаевич выполнил в 1931 г. уже в Москве на ул. Обуха, 6 (Воронцово поле), где тогда располагался Институт экспериментальной биологии, руководимый Н.К. Кольцовым. По этой теме в 1831 и 1932 годах опубликовано две статьи, одна из которых в Кембридже. То есть мутагенное действие ультрафиолета было открыто недалеко от Курского вокзала. Таким образом, огромный вклад отечественных ученых в создание и развитие науки “Радиационная генетика” не вызывает сомнений.
Со многими из действующих лиц этого повествования я встречался лично. Джозеф Гринберг посетил Москву в 1967 году, когда я был еще аспирантом. Это был очень мягкий, интеллигентный человек. Его хобби – наблюдение птиц (birdwatcher). Он рассказывал мне, насколько это непростое занятие – нужна мощная оптика, хорошая фотоаппаратура (хотя сам он, кажется, не снимал, а только наблюдал) и автомобиль с мощным движком, который “мог бы забираться на крутой холм на прямой передаче”. После традиционного “Лебединого озера” в Большом театре на вопрос о музыке Чайковского Джозеф ответил: “Очень романтическая музыка”. Мои знания о музыке тогда приближались к нулю, и я спросил:
– А бывает другая?
– Бывает.
– Например?
– Например, Малер.
Пожалуй, это было началом моего музыкального образования. Позже к музыке меня приобщали уже другие люди.
Э. Виткин оказалась в Москве в самом начале 1970-х, кажется, весной. Ни Владимира Дмитриевича Тимакова, ни Аделины Генриховны в стране не было. Принимали сами. Она выступила с кратким обзором последних данных по УФ-индуцированному мутагенезу. Мы организовали чай с десертом. Так как за ее работами мы следили и были, что называется, в курсе дела, то длинных дискуссий не было. Я знал, что вчера у группы Эвелины была экскурсия по Москве-реке на прогулочном теплоходе. Спросил о впечатлениях. В ответ увидел полуприкрытые глаза, улыбку и мурлыкание: “It was beautiful”. “Ну, прямо пантера Багира”, – подумал я. Еще она рассказала мне о том, что причиной отъезда ее родителей из России была революционная активность ее мамы. О каких годах шла речь, я не запомнил.
Фил Хэнэуолт тоже был в Москве в первой половине 1970-х. Он был участником международного биофизического конгресса. Мы с Сашей Саенко разговаривали с ним на скамейке против входа на биофак МГУ. Фил помог нам с английским текстом нашей статьи, которая вскоре была опубликована в журнале BBRC. Через несколько лет Фил был у меня в гостях дома в Строгино. Мы пошли гулять в Троице-Лыково, и на берегу реки побросали летающую тарелочку (рис. 6).
“Никто мне не поверит, – сказал Фил, – если я расскажу в Стэнфорде, что в Москве, на реке я играл во фрисби”.
Когда я был в Стэнфорде, Фил занимал достаточно значимую позицию – он был главой отдела биологии Стэнфордского университета. Лаборатории этого отдела тогда возглавляли такие ученые, как Чарльз Яновский и Артур Корнберг. У Фила двое маленьких детей – Лиза и Алекс. Им примерно по 5–6 лет. Номер его автомобиля выглядит так: LIZALEX и никаких цифр – Калифорния, и этим все сказано! Мы едем в этом автомобиле на тренировку супруги Фила – она увлеченно занимается фламенко. Дети возятся на заднем сиденье, у Лизы в руках оказывается печенье, которое Алекс пытается у нее отобрать с возгласами: “Cookies must be shared!”. Сейчас это очень взрослые, серьезные люди. Алекс, кажется, преуспевающий юрист. Мы с Филом беседуем о музыке. Я признаюсь ему, что один их моих самых любимых джазовых композиторов – Дэйв Брубек. Вспоминаем его вещи. Я упоминаю Lake Tahoe. “Я там свой медовый месяц провел”, – говорит Фил.
Супруги Сетлоу посетили нашу лабораторию вдвоем. Дик – человек небольшого роста, изящного телосложения. Джейн – высокая, крупная женщина. Чувствуется, что она в семье главная. Войдя в нашу лабораторную комнату и быстро оглядевшись, она тут же выдает афоризм: “Большая страна – большие чашки”. Имеются в виду чашки Петри. Я замечаю, что ее страна тоже не маленькая. “Да, – говорит Джейн, – но чашки у нас меньше”. Аделина Генриховна задает вопрос о детях. Есть ли и сколько? “Есть”, – отвечает Джейн, после чего следует пауза. Смотрит на мужа. Он пожимает плечами и молчит. Наконец, Джейн отвечает нерешительно: “Кажется, пять”.
Список литературы
Witkin E.M. Genetics of resistance to radiation in Esche-richia coli // Genetics. 1947. V. 32. P. 221–248.
Lederberg J., Tatum E.L. Gene Recombination in Escherichia Coli // Nature. 1946. V. 158. № 4016.
Hill R.F. A radiation-sensitive mutant of Escherichia coli // Biochim. Biophys. Acta. 1958. V. 30. P. 636–637.
Philip C. Hanawalt. The Awakening of DNA Repair at Yale Focus: 50 Years of DNA Repair: The Yale Symposium Reports // Yale J. Biol. Med. 2013 Dec. V. 86. № 4. P. 517–523. Publ. online 2013 Dec 13.
Setlow R.B., Carrier W.L. The disappearance of thymine dimers from DNA: An error-correcting mechanism // Proc. Natl. Acad. Sci. USA. 1964. V. 51. P. 226–231.
Boyce R.P., Howard-Flanders P. Release of ultraviolet light-induced thymine dimers from DNA in E. coli K-12 // Proc. Natl. Acad. Sci. USA. 1964. V. 51. P. 293–300.
Greenberg J. Loci for radiation sensitivity in Escherichia coli Bs-1 // Genetics. 1967. V. 55. P. 198–201.
Shineberg B., Zipser D. The lon gene and degradation of beta-galactosidase nonsense fragments // J. Bacteriol. 1973. 01 Dec. V. 116. № 3. P. 1469–1471.
Fredriksson A., Ballesteros M., Dukan S., Nyström T. Defence against protein carbonylation by DnaK/DnaJ and proteases of the heat shock regulon // J. Bacteriol. 2005. V. 187. P. 4207–4213.
Kuroda A., Nomura K., Ohtomo R., Kato J., Ikeda T., Takiguchi N., Ohtake H., Kornberg A. Role of Inorganic Polyphosphate in Promoting Ribosomal Protein Degradation by the Lon Protease in E. coli // Sci. 2001. Jul 27. V. 293. № 5530. P. 705–708.
Smirnov G.B., Favorskaya Y.N., Skavronskaya A.G. Range of action of the mechanism that repairs damage induced by certain chemical agents in Escherichia coli K-12 // Sov. Genet. 1973 Sep. V. 7. № 3. P. 366–371.
Смирнов Г.Б., Бодоев И.Н., Макарова А.П. и др. Сравнительная геномика штаммов Escherichia coli АВ1157, АВ2463, АВ2494 и АВ1885 // Молек. генетика, микробиология и вирусология. 2019. Т. 37. № 3. С. 134–139. [Smirnov B., Bodoev I.N., Makarova A.P., et al. Sravnitel’naya genomika shtammov Escherichia coli АВ1157, АВ2463, АВ2494 и АВ1885 // Molekulyarnaya genetika, microbiologiya i virusologiya. 2019. V. 37. № 3. P. 134–139. (In Russian)]
Серебровский А.С. Антропогенетика и евгеника в социалистическом обществе // Медико-биологический журнал. 1929. Вып. 5. С. 1–19. [Serabrov-skiy A.S. Antropogenetika i evgenika v sotsialisticheskom obschestve // Mediko-biologicheskiy zhurnal. 1929. Issue 5. P. 1–19. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология