Прикладная биохимия и микробиология, 2022, T. 58, № 5, стр. 419-433
Лекарственная устойчивость бактерий к действию наносеребра: молекулярные механизмы и возможные пути преодоления
Ю. А. Крутяков 1, 2, *, А. Г. Хина 1
1 Московский государственный университет им. М.В. Ломоносова, химический факультет
199991 Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
123182 Москва, Россия
* E-mail: sir_yurii@mail.ru
Поступила в редакцию 18.03.2022
После доработки 01.04.2022
Принята к публикации 22.04.2022
- EDN: QWYGZI
- DOI: 10.31857/S0555109922050105
Аннотация
В обзоре обобщены результаты экспериментальных исследований последних лет, направленных на изучение лекарственной устойчивости бактерий к действию наноразмерного серебра, и описаны возможные молекулярные механизмы ее развития. Особый акцент сделан на изучении работ, посвященных механизмам устойчивости бактерий к действию ионов серебра, являющихся основным фактором бактерицидности наночастиц. Предложены направления дельнейших исследований, связанных с поиском путей преодоления проблемы резистентности отдельных бактерий к действию наносеребра и способов предотвращения ее дальнейшего распространения.
Массовое медицинское применение антибиотиков, начавшееся в конце 40 гг. XX в., уже через 20 лет привело к широкому распространению штаммов бактерий с лекарственной устойчивостью к ним [1, 2]. Активная ротация антибактериальных препаратов, выводимых из резерва в попытках поиска более эффективных терапевтических схем лечения пациентов, в конце 80 гг. прошлого века–начале 2000 гг. стала причиной значительного роста числа штаммов бактерий, обладающих множественной лекарственной устойчивостью (МЛУ), в том числе к фторхинолонам, карбопенемам и даже колистину [3–6]. Проблема существенно усугубилась в 2000 гг., когда стала очевидной неэффективность подававшей надежды стратегии высокопроизводительного генетического скрининга ДНК бактерий, направленного на поиск новых молекул, пригодных для медицинского применения. Большинство крупных фармацевтических компаний свернуло программы поиска новых антибиотиков по причине экономической нецелесообразности [7]. В настоящее время МЛУ микроорганизмов находится в числе критических вызовов, представляющих, в соответствии с резолюцией Генеральной ассамблеи ООН, наибольшую угрозу для человечества наряду с глобальным потеплением и неинфекционными болезнями [8].
Согласно современным представлениям развитие МЛУ у комменсальных бактерий продолжается по причине широкого применения антибиотиков. Кроме того, многократное повторение разовых антибактериальных терапевтических схем в популяции также является причиной эволюции МЛУ [9]. Одним из путей решения проблемы МЛУ является рациональное применение антибактериальных препаратов – исключительно в случаях прямых показаний, после идентификации возбудителя и постановки точного диагноза. В этой связи для остальных случаев особую актуальность приобретает разработка лекарственных средств, содержащих альтернативные традиционным антибиотикам действующие вещества. Так, в последнее время большой интерес вызывает перспектива использования в схемах местной терапии инфекционных и ожоговых поражений кожных покровов и слизистых оболочек наночастиц (НЧ) металлов и их оксидов, которые обладают высокой антибактериальной активностью, в том числе в отношении штаммов с МЛУ [10–12]. Эффективность НЧ в подавлении роста бактерий связана с их особыми физико-химическими свойствами. В частности, небольшой диаметр (менее 100 нм) и высокая удельная площадь поверхности НЧ позволяет им непосредственно связываться с бактериальной клеткой химически или электростатически [13]. Это, в свою очередь, приводит к значительным изменениям в структуре клеточной стенки, увеличению проницаемости мембраны, нарушению транспортной и дыхательной функций клетки, а также генерации активных форм кислорода, повреждающих внутриклеточные компоненты, такие как рибосомы и ДНК [14].
Среди НЧ различных металлов широко применяется серебро, про антибактериальные свойства которого было известно уже в начале нашей эры [15, 16]. Высокая антимикробная активность НЧ серебра в отношении вирусов [17–19], бактерий [20, 21], грибов [22–24] и паразитарных организмов [25, 26] продемонстрирована в многочисленных современных исследованиях. Наличие у НЧ серебра способности подавлять рост широкого спектра патогенов привело к их использованию в ветеринарии и медицине [27] в качестве основного компонента медицинских изделий и лекарственных препаратов для местной антибактериальной терапии с различным способом применения. В частности, НЧ серебра входят в состав некоторых перевязочных материалов, предназначенных для терапии бактериально осложненных ран и ожогов [28–31], а также могут применяться для лечения воспалительных стоматологических [32] и гинекологических [33] заболеваний, конъюнктивита, ринита [34], мастита [35] и даже туберкулеза [36]. Другим применением наносеребра является создание на его основе биологически совместимых антибактериальных покрытий на поверхности имплантов и других медицинских изделий для предотвращения развития инфекций, вызываемых госпитальными возбудителями [37, 38]. Кроме того, достижения в области материаловедения и коллоидной химии сделали возможным включение стабилизированных различными соединениями НЧ серебра не только в медицинские препараты и изделия медицинского назначения, но и в другие продукты, предназначенные для профессионального и бытового использования, такие как пестициды [39–41], косметические [42], дезинфицирующие и моющие средства [43], упаковочные материалы для пищевой продукции [44, 45], фильтры для очистки воды [46–48], компоненты микроэлектронных схем и даже одежду и детские игрушки [49, 50].
Резистентность некоторых бактерий к действию ионного серебра, которая в основном сформировалась за счет широкого медицинского применения сульфадиазина серебра в терапии ожоговых поражений кожных покровов, известна уже давно [51]. Долгое время считалось, что ввиду большого количества клеточных мишеней, подвергаемых действию НЧ серебра, бактериям будет чрезвычайно сложно эволюционировать в устойчивый к их действию фенотип. Однако, в свете увеличения числа бактериальных штаммов с МЛУ, бесконтрольное применение НЧ серебра и появление первых сообщений о развитии резистентности к действию НЧ серебра in vitro как у грамположительных, так и у грамотрицательных бактерий вызывает определенную озабоченность [52, 53].
Цель настоящей обзорной статьи – обобщение известных молекулярных механизмов МЛУ к ионному серебру (Ag+) и обсуждение возможности развития устойчивости бактерий к действию НЧ серебра. Понимание перспектив широкого распространения штаммов бактерий с МЛУ к НЧ серебра будет полезно для продолжения научных исследований, направленных на поиск новых антибактериальных агентов, способных к преодолению существующей устойчивости к антибиотикам.
Механизм антибактериального действия НЧ серебра. Механизм действия НЧ серебра на бактерии изучался в ряде оригинальных работ [54–59], результаты которых были обобщены в недавно опубликованных обзорах [32, 60], поэтому здесь сведения о нем приводятся в краткой форме, достаточной для понимания потенциальных путей развития устойчивости к действию НЧ серебра у бактерий.
Частицы коллоидного серебра, как и НЧ других металлов, способны связываться с бактериальной мембраной [55]. Это может происходить за счет высокого сродства серебра к азоту и сере – элементам, присутствующим в белках внешней мембраны [61–63], а также электростатического притяжения между отрицательно заряженной мембраной бактериальной клетки [64] и адсорбированными на поверхности НЧ положительно заряженными ионами Ag+ [65]. Связываясь с мембраной, нарушая ее структуру, НЧ серебра вызывают необратимые нарушения транспортной и барьерной функции бактериальной клетки, что приводит к утечке внутриклеточных компонентов из цитоплазмы во внешнюю среду (лизису) и, в результате, клеточной гибели [66]. С другой стороны, антибактериальное действие НЧ серебра тесно связано с эффектом ионов Ag+, выделяющихся c поверхности НЧ в результате окислительного растворения нульвалентного металла в непосредственной близости от поверхности клетки [65, 67–69]. Образовавшиеся при окислении серебра ионы Ag+ взаимодействуют с тиол-содержащими остатками цистеина [70] и глутатионом [61, 62], а также флавиновыми группами [63], являющимися компонентами мембранных белков, в том числе, белков электронно-транспортной цепи (ЭТЦ) [71]. Это препятствует протеканию мембранного фосфорилирования и приводит к нарушениям дыхательной функции клетки [72]. Другим следствием воздействия ионов серебра на белки цитоплазматической мембраны (ЦПМ), является увеличение ее проницаемости, что приводит к нарушениям в трансмембранном транспорте, а также коллапсу протонной движущей силы [54]. Известно, что помимо воздействия на мембранные белки и ферменты, ионы серебра способны проникать в цитоплазму без повреждения клеточной мембраны [56]. Вероятно, это происходит через системы активного транспорта ионов меди [73], которые имеют с ионами серебра схожую электронную структуру и необходимы для работы ферментов участвующих в электронном транспорте и дыхании, а также поддержания окислительно-восстановительного гомеостаза бактерий [74, 75]. Попадая внутрь бактериальной клетки, Ag+ могут взаимодействовать с большим количеством биологических мишеней, такими как белки и ферменты [65, 71], структурные составляющие рибосом [56], ДНК и РНК [59, 76], что, в свою очередь, может влиять на протекание многих жизненно важных для клетки процессов. Другим механизмом антибактериального действия НЧ серебра является окислительный стресс, вызываемый увеличением концентрации АФК в цитоплазме в результате воздействия Ag+ на ферменты ЭТЦ, стимуляции дыхания, вызванной потерей трансмембранного градиента концентрации протонов, а также запуском реакции Фентона в цитоплазматическом пространстве, вызванным высвобождением ионов Fe2+ при воздействии Ag+ на Fe–S кластеры, что приводит к повреждениям белков, липидов и ДНК [77–79].
В целом, биологическая активность дисперсий наносеребра, как правило, существенно превышает активность чистого ионного серебра в концентрациях, сравнимых с равновесными концентрациями Ag+ в дисперсиях НЧ. В связи с этим, можно считать, что НЧ серебра обладают особыми, связанными не только с действием ионов Ag+, механизмами антибактериального действия. Ассоциируясь с мембраной бактерии, вызывая нарушения в ее структуре, а также увеличивая локальную концентрацию ионов Ag+, НЧ увеличивают внутриклеточную концентрацию Ag+, что делает именно ее, а не концентрацию Ag+ в питательной среде основным фактором токсичности НЧ серебра. По этой причине, хотя основные мишени в бактериальной клетке для ионов и НЧ серебра совпадают, НЧ влияют, в первую очередь, на внутриклеточные процессы, такие как трансляция и синтез необходимых для поддержания жизни бактерии биомолекул, например, жирных кислот [60].
Механизмы развития устойчивости бактерий к действию ионов серебра. Как было показано выше, механизм антибактериального эффекта НЧ серебра тесно связан с ионами Ag+, генерирующимися на поверхности НЧ при их взаимодействии с кислородом воздуха или другими окислителями. Действительно, в ряде работ установлено, что в присутствии избытка восстановителя, сводящего к минимуму равновесную концентрацию Ag+ в среде, НЧ серебра не проявляют антибактериальную активность. Напротив, в присутствии окислителя (избыток кислорода воздуха, пероксид водорода) активность наносеребра заметно возрастает [80, 81]. Становится очевидным, что для развития МЛУ к действию НЧ серебра, бактериальным клеткам, как минимум, необходимо выработать резистентность к действию Ag+.
В общем, механизмы развития устойчивости у бактерий могут быть разделены на три основные группы:
– защита молекулярной мишени от действия антибиотика путем ее модификации или замены;
– снижение концентрации антибиотика в цитоплазматическом пространстве за счет изменений в структуре клеточной стенки и мембраны (например, за счет остановки биосинтеза некоторых поринов), появления нового или дополнительной активации действующего механизма эффлюкса антибиотика за пределы клетки;
– инактивация (например, ферментативная или хелатирующая) антибиотика за счет образования менее токсичной формы [82, 83].
Ионы серебра, как уже было замечено, действуют одновременно на большое число молекулярных мишеней, находящихся как в цитоплазме, так и на мембране бактериальной клетки, что делает маловероятным развитие устойчивости к их действию по механизму модификации или защиты отдельных сайтов связывания. Однако, достоверно известно, что как грамположительные, так и грамотрицательные бактерии способны развивать устойчивый к действию ионов Ag+ фенотип, используя системы активного эффлюкса с использованием механизма инактивации путем связывания Ag+ с помощью низкомолекулярных белков с высокой хелатирующей способностью [84–86].
Впервые молекулярные механизмы и генетические основы активного эффлюкса ионов серебра, приводящего к развитию устойчивости к действию Ag+ у бактерий, были описаны в работе [84]. Объектом исследования в ней являлась Salmonella enterica (серовар Typhimurium) – грамотрицательная бактерия с МЛУ к нитрату серебра, хлориду ртути(II), нескольким антибиотикам, изолированная из клинической среды в 1975 г. и вызвавшая гибель трех человек в ожоговом отделении больницы [51]. При секвенировании определяющей МЛУ S. typhimurium плазмиды, отнесенной к HI-2 группе несовместимости (IncHI-2) и получившей название pMG101, было установлено, что она имеет размер около 180 т. п. о. и содержит область, определяющую резистентность к действию Ag+, сокращенно – sil. Она включает в себя 9 открытых рамок считывания (silE, silS, silR, silC, silF, silB, silA, silG, silP), находящихся в трех единицах транскрипции silCFBAGP, silRS и silE. Примечательно, что плазмида pMG101 до настоящего времени является самой распространенной (и наиболее изученной) последовательностью, обуславливающей устойчивость бактерий к серебру, и, помимо этого, также обуславливает устойчивость к меди и некоторым другим антибиотикам [51, 84]. Механизмы и молекулярное обоснование путей экспрессии отдельных генов sil были впервые обобщены в работах Сильвера [85, 86], а затем дополнены другими авторами.
В первой единице транскрипции sil-системы находится ген silE, кодирующий небольшой Ag(I)-связывающий периплазматический белок SilE. По своей первичной структуре он на 48% гомологичен периплазматическому медь-связывающему белку PcoE [87] и, потому, так же как и PcoE, – обладает высокой селективностью связывания с моновалентными металлами (Ag+ и Cu+). Связывание SilE с ионами Ag+ происходит за счет содержания в его составе десяти гистиндиновых остатков, восемь из которых расположены в виде четырех пар в последовательностях HisX6His [88]. Методом обратного титрования совместно со спектроскопией кругового дихроизма (КД) было показано, что оптимальное количество ионов Ag+, связанных с одной молекулой – 6. Однако другим методом – масс-спектрометрией с ионизацией методом электроспрея (ESI-MS), показано, что широко распространены также комплексы, содержащие 5 и 7 ионов металла, а максимальное их количество может доходить до 8 [89]. Следует отметить, что SilE является внутренне неупорядоченным белком (IDP) в своей апо-форме, которая приобретает α-спиральную структуру только при связывании с ионами Ag+, что также было показано в работе [89] с использованием метода КД-спектроскопии. Таким образом, благодаря способности связывать большое количество ионов Ag+ за счет образования с ними прочных комплексов, SilE представляет собой первую линию защиты от их токсического действия.
Вторая единица транскрипции sil-системы состоит из генов silRS, которые кодируют двухкомпонентную систему регулирования экспрессии silE. Она гомологична другим подобным двухкомпонентным системам, регулирующим гены, обуславливающие устойчивость бактерий к действию тяжелых металлов [90]. SilRS состоит из SilS-сенсора – мембраносвязанной киназы, меняющей конформацию при взаимодействии с ионами Ag+, находящимися в периплазматическом пространстве, и SilR – регулятора ответа, являющимся, собственно, фактором транскрипции гена silE [84]. Наиболее вероятно, что SilRSE система развилась из существовавшей ранее гомологичной Pco системы регуляции меди, которая также включает в себя двухкомпонентную систему pcoRS регулирующую транскрипцию pcoE [91].
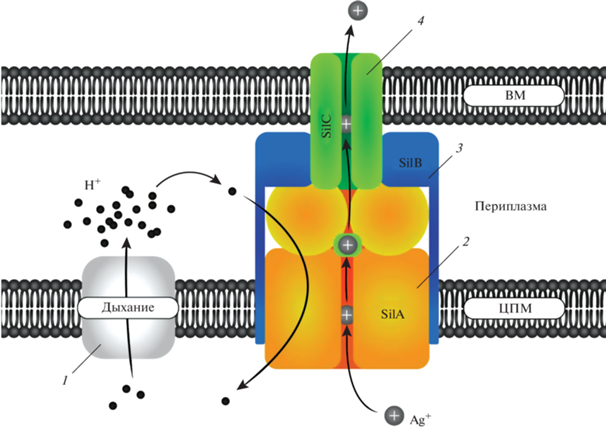
Транскрипция генов silCFBAGP, находящихся в третьей единице транскрипции sil-системы, не зависит от silRSE. Гены silCBA кодируют HME-RND (heavy metal efflux resistance-nodulation-cell division) систему эффлюкса ионов серебра, состоящую из трех белков и работающую аналогично другим HME-RND системам эффлюкса ионов металлов [92], обуславливающим эффлюкс ионов одно- и двухвалентных металлов у прокариот [92–95]. Первым компонентом данной системы является белок SilA из суперсемейства RND. Такие белки располагаются на цитоплазматической мембране, отличаются большим размером и обуславливают эффлюкс токсичных ионов из цитоплазмы. Они функционируют по принципу антипорта: катионы металлов перекачиваются из цитоплазматического пространства по ионному каналу расположенному внутри белка, для чего используется энергия протонного градиента получаемая при перекачке в противоположном направлении (в цитоплазматическое пространство) протонов выделенных в периплазму при дыхании. RND-белки состоят из 4 доменов, два из которых являются гидрофильными, а два гидрофобными, при этом гидрофобные домены этих белков пересекают ЦПМ, закрепляя на ней белок, а гидрофильные домены располагаются в периплазме и могут контактировать с другими субъединицами эффлюксного комплекса [92, 96]. Такая структура создает воронку для прохождения субстрата (катиона Ag+) из цитоплазматического региона ко второму компоненту системы – SilC, фактору внешней мембраны (OMF), обеспечивающего эффлюкс ионов серебра из периплазматического пространства [97]. Третий белок, SilB, принадлежит к классу белков слияния мембран (MFP) [98]. Он закрепляется на внутренней мембране за счет SilA, а также связан с белком SilC на внешней мембране. Такая трехкомпонентная система обеспечивает движение ионов Ag+ из цитоплазматического пространства сразу за пределы клетки [92, 95] без их выброса в периплазматическое пространство. Принцип действия SilCBA HME-RND системы эффлюкса ионов серебра схематично изображен на рис. 1.
Рис. 1.
Схематическое изображение работы системы эффлюкса ионов серебра HME-RND SilCBA: 1 – протонный насос; 2 – RND эффлюксный насос SilA, 3 – белок слияния мембран SilB, 4 – фактор внешней мембраны SilC.
Важной для углубленного понимания роли работы всей Sil-системы, стала работа [99] в которой методом исследования модельных пептидов, представляющих собой структурные мотивы ранее описанного периплазматического белка SilE, были определены константы связывания белка с ионами Ag+. Они оказались на 1–2 порядка ниже, чем соответствующие константы связывания Ag+ c белком SilB, определенные ранее в работе [100]. Исходя из этих данных предполагается следующий механизм действия. Белок SilE в своей голо-форме может обладать высоким сродством к другим компонентам Sil-системы, в частности, белкам SilCBA, аналогично другим внутренне неупорядоченным белкам [101]. В свою очередь, различия в константах связывания Ag+ между SilE и SilB позволяют белку SilE эффективно “выгружать” собранные ранее ионы в эффлюксный транспортер SilCBA, которые затем выводятся им за пределы бактериальной клетки. Таким образом, SilE представляет собой не только “молекулярную губку” являющуюся первой линией защиты от токсического действия ионов Ag+, но и действует как эффективный молекулярный переносчик ионов Ag+ к SilCBA-эффлюксной системе.
Другим компонентом Sil системы является белок SilP, являющийся мембранной эффлюксной АТФ-азой P-типа. Данный класс белков представляет собой ионные насосы, расположенные на ЦПМ и обеспечивающие активный эффлюкс катионов металлов из цитоплазматического пространства, с использованием энергии, выделяющейся при гидролизе связанной с белком молекулы АТФ с образованием одного или двух остатков фосфорной кислоты [92]. SilP гомологичен другим эффлюксным АТФ-азам, обуславливающим устойчивость к тяжелым металлам, таким как Cu+ and Zn2+ [102, 103], закодированным в хромосоме E. coli [104]. Он обеспечивает перенос катионов серебра из цитоплазмы в периплазматическое пространство, откуда они могут быть выведены за пределы клетки с помощью других компонентов Sil-системы по описанным ранее механизмам.
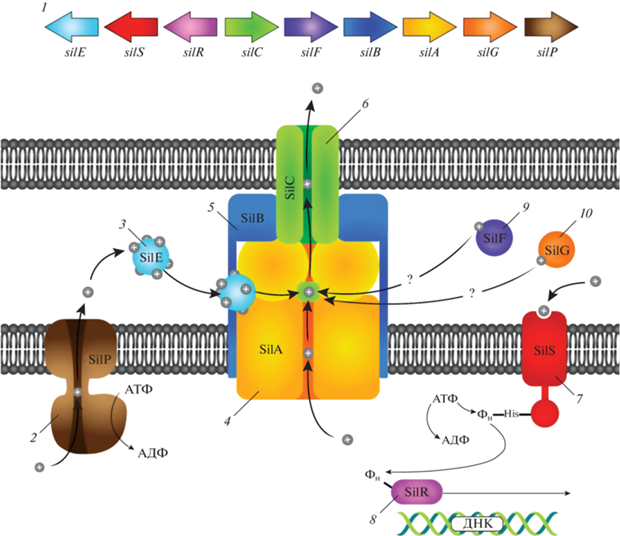
Что касается оставшихся SiIF и SilG-белков, то их роль до конца не изучена. Однако, основываясь на последовательностях аминокислот схожих детерминант устойчивости тяжелым металлам (например, систем Pco, Czc, Cus), предполагается, что они, также как и SilE, являются периплазматическими Ag-связывающими белками (шаперонами), сопровождающими ионы серебра, попавшие в периплазматическое пространство из внешней среды или из цитоплазмы за счет действия SilP, к системе SilCBA и, таким образом, способствующими их эффлюксу [85, 105]. Принцип действия плазмидной Sil-системы схематично показан на рис. 2.
Рис. 2.
Схематическое изображение работы плазмидной Sil-системы обуславливающей развитие устойчивости бактерий к действию ионов серебра: 1 – генетическая архитектура sil-оперона; 2 – мембранная эффлюксная АТФ-аза SilP; 3 – Ag+-связывающий периплазматический белок SilE; 4 – RND эффлюксный насос SilA; 5 – белок слияния мембран SilB; 6 – фактор внешней мембраны SilC; 7 – мембраносвязанная киназа SilS; 8 – регулятора ответа SilR; 9, 10 – SilF и SilG, предположительно: периплазматические Ag+-связывающие белки.
Активный эффлюкс ионов серебра у грамотрицательных бактерий также может быть обусловлен генами, находящимися в хромосомной ДНК. Так, в ДНК Escherichia coli K12 содержится 6 участков, кодирующих белки близко гомологичные продуктам экспрессии генов sil. Эти гены были названы cus из-за их роли в гомеостазе меди [92], однако белки данной системы также способны использовать в качестве субстрата и ионы серебра, поскольку ионы Ag+ и Cu+ имеют одинаковую электронную конфигурацию d10, одинаковый заряд и схожий ионный радиус [106]. Участие Cus системы в развитии у E. coli устойчивости к действию ионов серебра было доказано в работе [107] с помощью протеомных исследований. Методами двумерного электрофореза и масс-спектрометрии показано, что компоненты белковой системы CusCFBA подвергаются сверхэкспрессии у невосприимчивого к действию ионного серебра штамма E. coli. Напротив, делеции генов cus приводят к увеличению чувствительности бактерий к действию серебра во много раз [84]. Например, делеция cusF приводит к уменьшению минимальной ингибирующей концентрации на три порядка (с 1 мM до 12 мкM) [107]. Важно отметить, что наличие детерминанты устойчивости Cus не уникально для E. coli, она также присутствует в широком ряде других видов патогенных грамотрицательных бактерий [108].
В отличие от sil генов, гены cus располагаются только в 2 оперонах. В первом находятся гены cusCFBA, кодирующие трехкомпонентный эффлюксный насос CusCBA, а также небольшой периплазматический металлсвязывающий белок CusF. Во втором находится двухкомпонентная регуляторная система cusRS. Гены cusCFBA и cusRS транскрибируются разнонаправленно из общей промоторной области, вероятно, с участием σ-фактора (белка, необходимого для инициации транскрипции у бактерий), зависящего от наличия катионов тяжелых металлов [107, 109]. При этом, в cus-системе отсутствуют гомологи белков SilP, SilG и SilE.
CusRS является двухкомпонентной системой регуляции трансляции CusCFBA эффлюксного транспортера с положительной обратной связью [110]. Она кодирует сигнальную сенсорную гистидиновую киназу CusS и регулятор транскрипционного ответа CusR. Также cusRS может регулировать другие системы участвующие в гомеостазе меди, такие как cop и pco, так как они содержат гомологичные ДНК-связывающие мотивы [91, 110, 111].
Аналогично системе SilCBA, CusCBA представляет собой CBA эффлюксную систему, состоящую из трех белков [92, 109]. CusA является связанным с ЦПМ транспортером протонного типа из суперсемейства RND [92, 96], CusB – периплазматический белок слияния мембран [98], а CusC – белок внешней мембраны, через который производится эффлюкс ионов серебра и меди из периплазмы за пределы клетки [97]. CusCBA гомологична системам устойчивости к кадмию, цинку и кобальту (Czc) у Ralstonia и системе множественной лекарственной устойчивости Acr у E. coli [92–95].
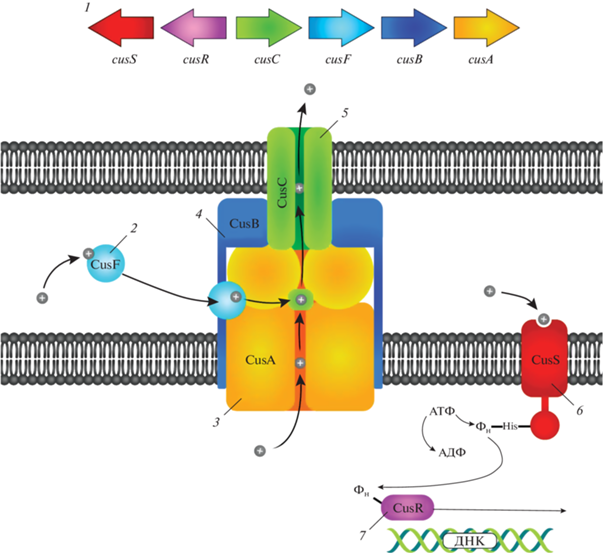
Между генами cusC and cusB располагается ген cusF, кодирующий периплазматический металлсвязывающий белок CusF. В отличие от SilF, механизмы образования комплексов металлов с CusF и пути их эффлюкса были подробно изучены. В работе [109] показано, что каждая молекула CusF способна связывать один ион металла, а также, что в этот процесс вовлечены остатки метионина (серосодержащая аминокислота в составе белка CusF). Следует отметить, что CusF обладает даже более высоким сродством к Ag, чем к Cu, что было определено методом изотермического калориметрического титрования в работе [106]. Далее, специфически связываясь с CusB и CusC, данный белок позволяет выводить ионы серебра и меди за пределы клетки через эффлюксный насос CusCBA. Более подробно механизмы связывания между компонентами системы CusCFBA, а также молекулярные механизмы эффлюкса были исследованы в работах [112–116] с помощью методов изучения кристаллической структуры этих белков. Принципиальная схема действия хромосомной Cus системы изображена на рис. 3.
Рис. 3.
Схематическое изображение работы хромосомной Cus-системы обуславливающей развитие устойчивости бактерий к действию ионов серебра: 1 – генетическая архитектура cus-оперона; 2 – Ag+-связывающий периплазматический белок CusF; 3 – RND эффлюксный насос CusA; 4 – белок слияния мембран CusB; 5 – фактор внешней мембраны CusC; 6 – мембраносвязанная киназа CusS; 7 – регулятора ответа CusR.
Другим способом снижения внутриклеточной концентрации токсичных для бактерий ионов Ag+ является модификация клеточной мембраны. В частности, грамотрицательные бактерии в ответ на действие ионов Ag+, способны уменьшать количество поринов – малоселективных транспортных белков внешней мембраны грамотрицательных бактерий, способствующих осуществлению пассивного транспорта [117]. Например, E. coli K12 обладает как минимум двумя видами поринов – OmpC и OmpF, имеющих размер пор превышающий диаметр ионов серебра [118]. Регулируя экспрессию поринов, бактерии способны снижать или увеличивать проницаемость внешней мембраны и, следовательно, регулировать поступление Ag+ в периплазматическое пространство. Так, в работе [117] показано, что отсутствие генов обоих указанных поринов или же гена, регулирующего их транскрипцию, приводит к развитию устойчивого к действию серебра фенотипа у E. coli. При этом делеция только одного из указанных генов не приводит к развитию резистентности у бактерии, что косвенно свидетельствует о возможности проникновения Ag+ в периплазму через любой из двух белков.
Для некоторых штаммов бактерий встречаются особенные механизмы развития резистентности к действию ионов серебра, связанные, например, с их инактивацией за счет химического восстановления. Так, Pseudomonas aeruginosa способны развить устойчивость к действию ионов серебра за счет синтеза пиоцианина [119], способствующего восстановлению серебра ионной формы в нетоксичную металлическую. Пиоцианин – окислительно-восстановительный метаболит, имеющий характерную голубую окраску и использующийся P. aeruginosa подавления других бактерий, так как обладает антибиотическими свойствами [120]. Кроме того, пиоцианин является фактором патогенности P. aeruginosa для клеток человека за счет его действия на глутатион [121]. В работе [119] показано, что при наличии в среде ионов серебра, именно они, а не молекулярный кислород, выступают в качестве приоритетного конечного электронного акцептора в электронной цепи при окислении восстановленной формы пиоцианина. Таким образом, может происходить восстановление ионов серебра до нетоксичной металлической формы Ag0.
Подводя итог, несмотря на наличие большого количества сайтов потенциального связывания ионов серебра с различными биомолекулами, у бактерий существует достаточно эволюционных механизмов для развития устойчивых к действию ионов серебра фенотипов. В табл. 1 представлены МИК нитрата серебра, которые вызывают торможение роста патогенных микроорганизмов, развившим различную степень устойчивости к ионам серебра.
Таблица 1.
МИК AgNO3 по отношению к различным изолятам патогенов, обладающих устойчивостью к действию ионов серебра
| Патоген, вид | Штамм | МИК AgNO3 (μg/mL) |
Источник выделения | Ссылка |
|---|---|---|---|---|
| Грамотрицательные бактерии | ||||
| Acinetobacter baumannii | BL88 | 108 | Окружающая среда | [122] |
| – | ≥512 | Клинический изолят из ожоговых ран | [123] | |
| Citrobacter freundii | – | 27.2 | Клинический изолят | [124] |
| Enterobacter cloacae | S4279/06 и S0707396 | >512 | Клинический изолят из хронических язв на ногах, подвергшийся воздействию AgNO3 | [125] |
| – | ≥512 | Клинический изолят из ожоговых ран | [123] | |
| – | 540 | Клинический изолят из ожоговых ран, подвергавшихся лечению сульфадиазином серебра | [126] | |
| – | 595 | Клинический изолят | [124] | |
| Escherichia coli | J53 | >256 | Селекция в результате воздействия AgNO3 в субингибирующих концентрациях | [105] |
| S0506373 | >512 | Клинический изолят из хронических язв на ногах, подвергшийся воздействию AgNO3 | [125] | |
| – | ≥512 | Клинический изолят из ожоговых ран | [123] | |
| – | >512 | Клинический изолят из людей и птиц | [127] | |
| – | >540 | Клинический изолят из ожоговых ран, подвергавшихся лечению сульфадиазином серебра | [126] | |
| 116, 496, B1 | >1024 | Селекция, в результате воздействия на устойчивые клинические штаммы нитрата или сульфадиазина серебра в ступенчато возрастающих концентрациях | [117] | |
| Klebsiella aerogenes | – | 32.4 | Клинический изолят | [124] |
| – | >64 | Клинический изолят из крови пациентов | [128] | |
| Klebsiella oxytoca | – | 32.4 | Клинический изолят | [124] |
| – | >64 | Клинический изолят из крови пациентов | [128] | |
| Klebsiella pneumoniae | – | ≥512 | Клинический изолят из ожоговых ран | [123] |
| CCUG 54718 | >512 | Клинический изолят из хронических язв на ногах, подвергшийся воздействию AgNO3. | [125] | |
| – | 540 | Клинический изолят из ожоговых ран, подвергавшихся лечению сульфадиазином серебра | [126] | |
| – | 594 | Клинический изолят | [125] | |
| Pantoea agglomerans | – | <64 | Клинический изолят из крови пациентов | [128] |
| Proteus mirabilis | – | <27 | Клинический изолят из ожоговых ран, подвергавшихся лечению сульфадиазином серебра | [126] |
| Pseudomonas aeruginosa | – | 27.2 | Клинический изолят | [124] |
| – | ≥512 | Клинический изолят из ожоговых ран | [123] | |
| Salmonella typhimurium | pMG101 | 1080 | Клинический изолят из ожоговых ран, вызвавший гибель трех человек | [51] |
| Stenotrophomonas maltophilia | – | 32.4 | Клинический изолят | [124] |
| Грамположительные бактерии | ||||
| Enterococcus species | – | 32.4 | Клинический изолят | [124] |
| Staphylococcus aureus | – | 3.24 | Клинический изолят | [124] |
| – | 16–32 | Клинический изолят из хронических язв на ногах, подвергшийся воздействию AgNO3 | [125] | |
| – | ≥512 | Клинический изолят из ожоговых ран | [123] | |
Развитие устойчивости к действию НЧ серебра у бактерий. Впервые о развитии устойчивости бактерий к действию нанодисперсного серебра сообщалось в работе [129], в которой исследовали продолжительное воздействие НЧ оксида серебра (НЧ Ag2O) диаметром 2 нм, закрепленных на поверхности НЧ диоксида титана, на модельную систему, содержащую E. coli. В ходе эксперимента авторы обнаружили в культуральной среде грамположительную бактерию Bacillus subtilis, сохраняющую способность к росту в присутствии Ag в форме НЧ Ag2O в концентрациях вплоть до 7 мкг/мл, в то время как штамм E. coli терял эту способность в присутствии уже 3 мкг/мл Ag2O. Кроме того, максимальная концентрация НЧ Ag2O, при которой сохранялся рост B. subtilis, возрастала до 10 мкг/мл при предварительном воздействии на бактерии НЧ серебра в металлической или оксидной форме в сублетальных концентрациях в течение 13 дней, что может свидетельствовать о появлении устойчивых мутантов. В другой работе [130] сообщается о развитии устойчивости к действию НЧ Ag2O, закрепленным на TiO2, у S. aureus – грамположительной бактерии, некоторые штаммы которой широко известны своей устойчивостью к действию большинства антибиотиков, в том числе к метициллину и ванкомицину (MRSA и VRSA соответственно), и являющейся одним из возбудителей нозокомиальных инфекций [131]. В рамках исследования клетки S. aureus подвергались воздействию НЧ Ag2O в увеличивающихся от 2.5 до 11 мкг/мл концентрациях в течение 50 дней, что привело к росту минимальной ингибирующей концентрации НЧ Ag2O в 5–7 раз до 15–20 мкг/мл. Методом секвенирования генома S. aureus было показано, что выработанная резистентность обусловлена появлением двух мутаций в ДНК бактерии. Первая из них произошла в гене purR, кодирующем ДНК-связывающий белок (репрессор), регулирующий биосинтез пурина. Предположительно, данная мутация снижает связывающую способность PurR, что приводит к увеличению синтеза пуриновых нуклеотидов [132], играющих важную роль в репликации и репарации ДНК, а также синтезе аминокислот [133]. Вторая мутация была обусловлена делецией одного нуклеотида в гене tcyA, кодирующем L-цистин-связывающий белок (TcyA), являющийся импортером цистина для его последующего восстановления до аминокислоты цистеина. Помимо прочего, цистеин способен восстанавливать ионы трехвалентного железа (Fe3+) до двухвалентного (Fe2+), которые в свою очередь вступают в реакцию Фентона с содержащимся в бактериальной клетке пероксидом водорода (H2O2), высвобождая высокореакционные гидроксильные радикалы (·ОН) [134]. Таким образом, обнаруженные мутации способны снизить антибактериальный эффект наночастиц Ag2O за счет более активного синтеза белков, подвергающихся его негативному воздействию и снижения индуцированного окислительного стресса. Авторы работы также отмечают, что за аналогичный период времени предварительного воздействия ципрофлоксацина (антибиотика из группы фторхинолонов) в увеличивающихся сублетальных концентрациях, его минимальная ингибирующая рост S. aureus концентрация возросла значительно сильнее – более чем в 64 раза. Это может говорить о том, что развитие устойчивости бактерий к действию наносеребра происходит не так активно как к действию некоторых традиционных антибиотиков.
Что касается НЧ металлического серебра, то развитие устойчивости у бактерий к его воздействию также может быть обусловлено появлением мутаций. Доказательством этого факта может служить работа [135], в которой изучалось продолжительное воздействие НЧ серебра (размером ~10 нм и стабилизированных цитратом) на E. coli K-12 MG1655 – грамотрицательную бактерию, не имеющую плазмидных элементов устойчивости к серебру Sil, но имеющую Cus оперон в хромосомной ДНК (см. выше). В результате воздействия наносеребра в увеличивающихся от 50 до 125 мкг/л концентрациях в течение времени, необходимого для смены 225 поколений бактерий, минимальная ингибирующая рост E. coli концентрация НЧ серебра увеличилась в три раза (с 250 до 750 мкг/л Ag), что говорит о развитии резистентности.
В результате полного секвенирования ДНК исследованных E. coli, подвергшихся воздействию НЧ серебра, были обнаружены три точечные мутации в генах cusS, purL и rpoB. PurL – фермент фосфорибозил-формилглицинамид синтаза, играющий важную роль в биосинтезе пуриновых нуклеотидов [132]. RpoB – бета-субъединица РНК-полимеразы, адаптивные мутации в которой часто обнаруживаются в экспериментах по эволюции E. coli, поскольку изменение ее активности оказывает большое влияние на паттерны экспрессии большого количества генов [136, 137]. CusS – сигнальная сенсорная гистидиновая киназа, регулирующая транскрипцию CusCFBA эффлюксного транспортера ионов серебра. Кроме того, было обнаружено 3 различные мутации в гене ompR, кодирующем ДНК-связывающий белок OmpR, регулирующий экспрессию поринов OmpC и OmpF. Авторы работы [135] также отмечают развитие у E. coli кросс-устойчивости к действию, как ионов, так и НЧ серебра, что представляется закономерным, учитывая упомянутые ранее механизмы бактерицидного действия наносеребра, связанные с действием Ag+, и роль мутировавших Cus и Omp систем при адаптации бактерий к воздействию ионов серебра.
Однако, помимо воздействия токсичных ионов Ag+, НЧ серебра за счет малого размера (менее 100 нм), высокого химического сродства к белковым компонентам мембраны, а также электростатического притяжения НЧ способны связываться с клеточной стенкой, вызывая нарушения ее структуры [55]. Одним из механизмов противодействия бактерий указанному свойству может стать выделение во внешнюю среду химических соединений различной природы, вызывающих агрегацию НЧ, и приводящих к потере их дисперсности и, следовательно, способности эффективно связываться с бактериальной мембраной. Так, в работе [138] с помощью метода динамического светорассеяния (ДРС) было показано, что развившаяся повышенная устойчивость E. coli K-12 MG1655 к действию НЧ серебра (диаметром 27 нм, стабилизированных метилполиэтиленглигольтиоловым эфиром) обусловлена не только мутациями (в частности, как и в предыдущей рассматриваемой работе, в гене cusS), но и увеличением гидродинамического диаметра НЧ с 60 до 110–160 нм. Однако авторы данной работы отмечают, что развитие устойчивости к действию наносеребра у E. coli происходит значительно медленнее по сравнению с традиционными антибиотиками, такими как гентамицин, ампициллин, тетрациклин и хлорамфеникол [139, 140], что согласуется с результатами, полученными в работе [130]. Близкие результаты были получены в работе [141], в которой исследовалась возможность развития устойчивости к действию НЧ серебра (6.2 нм, стабилизатор цитрат) у трех видов бактерий: S. aureus, P. aeruginosa и Acinetobacter baumannii. Было обнаружено, что P. aeruginosa способны развить устойчивость в результате воздействия наносеребра в последовательно увеличивающихся сублетальных концентрациях. При этом, как и в работе [138], появление резистентности сопровождалось увеличением гидродинамического диаметра НЧ и снижением (по модулю) их ζ-потенциала с –30 до –13 мВ. При этом другие исследованные штаммы бактерий оказались неспособны развить устойчивость к действию НЧ серебра, а появившаяся у P. aeruginosa устойчивость не влияла на их устойчивость к бактерицидному действию AgNO3. Это указывает на то, что развивавшаяся у P. aeruginosa резистентность к действию НЧ сопровождалась агрегацией НЧ во внеклеточной среде, а не развилась по механизму устойчивости клеток к воздействию ионов, выделяющихся при окислении НЧ и штамм-специфичности возможности развития такой резистентности. Причина специфического развития устойчивости к действию наносеребра у некоторых видов бактерий кроется в их способности выделять во внешнюю среду веществ, способствующих агрегации НЧ. Так, в работе [142] было показано, что развитие устойчивости к действию НЧ серебра (диаметр 28 нм, стабилизированы мальтозой) у P. aeruginosa и E. coli, вызванное агрегацией НЧ, сопровождается увеличением концентрации в питательной среде флагеллина – белка, формирующего внеклеточные филаменты жгутиков, которые обеспечивают подвижность бактерий [143, 144]. При этом резистентность к действию НЧ развивалась без каких-либо нуклеотидных изменений в ДНК, в том числе, в генах связанных с синтезом флагеллина.
Возможные пути преодоления устойчивости бактерий к НЧ серебра Одним из возможных способов преодоления резистентности бактерий к действию НЧ серебра может стать их совместное использование с веществами, ингибирующими синтез белков, вызывающих агрегацию НЧ. Так, в работе [142] показано, что развившуюся устойчивость возможно устранить, вводя в питательную среду экстракт кожуры граната, подавляющий синтез флагеллина [145]. Однако в обсуждаемой ранее работе [138] было показано, что агрегация НЧ происходит даже при отсутствии у E. coli гена flhD, активирующего оперон flhDC, ответственный за продуцирование флагеллина [146, 147]. Это указывает на существование и других белков, способных вызывать агрегацию НЧ, что существенно ограничивает возможность преодоления устойчивости методом ингибирования их биосинтеза.
Другим способом повышения коллоидной стабильности НЧ серебра и, следовательно, снижения риска развития устойчивости к их действию, может стать целенаправленное использование стабилизаторов НЧ определенных химических классов. Такие стабилизаторы могут во-первых, существенно увеличивать коллоидную стабильность препаратов наносеребра и их устойчивость к действию дестабилизирующих агентов [148], во-вторых, обладать собственной активностью в отношении бактерий, например, по механизму разрыхления клеточной стенки или снижения внешнего мембранного потенциала [27, 149, 150], и, в-третьих, усиливать биологическое действие ионов и частиц серебра путем влияния на их ζ-потенциал и увеличивая сродство НЧ к клеточной стенке бактерии [81, 148]. Действительно, все стабилизаторы (среди которых могут быть использованы биологически активные катионные ПАВ, катионные полимеры, амфотерные и неионогенные ПАВ) с одной стороны снижают свободную энергию на поверхности раздела НЧ с дисперсионной средой, а с другой, создают на поверхности частиц электростатический заряд, препятствующий их агрегации, что в результате приводит к увеличению коллоидной устойчивости стабилизированных НЧ. В работе [148] было показано, что биологическая активность НЧ серебра коррелирует с их способностью сохранять коллоидную стабильность в растворах электролитов, а наиболее эффективными в этом отношении являются амфотерные ПАВ, содержащие в своем составе головные карбоксильные группы. При этом, ни в одной из опубликованных работ в настоящее время не был исследован вопрос развития у бактерий устойчивости к действию НЧ серебра, в качестве стабилизатора в которых использовались биологически активные ПАВ.
Снижения риска развития МЛУ у бактерий также возможно добиться, прибегая к комбинированию в терапевтических схемах двух или более активных веществ. Так, в работе [151] в результате исследований препарата на основе гибридных НЧ серебра и нитрида бора, допированных гентамицином, было обнаружено, что они обладают выраженным антибактериальным эффектом, в том числе, в отношении бактерий, обладающих лекарственной устойчивостью к действию гентамицина и других антибиотиков. Кроме того, в ряде работ было показано, что НЧ серебра демонстрируют синергетический эффект при совместном применении с традиционными антибиотиками [152–156], что свидетельствует о перспективности использования такой стратегии для расширения спектра антибактериального действия НЧ серебра в отношении патогенов и преодоления МЛУ.
* *
Несмотря на широкий набор биологических мишеней в бактериальной клетке, которые потенциально могут подвергаться действию НЧ серебра, у бактерий существует возможность выработки механизмов адаптации, при реализации которых активация существующих генов может привести к развитию устойчивых фенотипов. Действительно, бактериальные клетки способны как противостоять воздействию токсичных ионов серебра за счет их активного эффлюкса, связывания и восстановления ионов до металлической формы, так и вызывать внеклеточную агрегацию НЧ, выделяя во внешнюю среду некоторые белки, например, флагеллин. В совокупности, это может привести к резкому снижению антибактериальной активности НЧAg.
Тем не менее, основываясь на опубликованных экспериментальных данных, можно сделать вывод о том, что развитие МЛУ к действию НЧ серебра пока возможно лишь у ограниченного круга бактериальных штаммов и формируется значительно дольше, по сравнению со временем возникновения этого свойства при действии традиционных антибиотиков. Кроме того, биологическая активность наносеребра в значительной степени является следствием набора физико-химических параметров частиц, особенно таких, как их коллоидная стабильность, восстановительный потенциал по отношению к кислороду воздуха и ζ-потенциал. Эти параметры, в свою очередь, определяются химической природой используемого стабилизатора и структурой формируемого им поверхностного слоя НЧ.
Перспективным направлением для дальнейших исследований в данной области, на наш взгляд, может стать изучение биологических свойств НЧ серебра, стабилизированных поверхностно-активными веществами или полимерами, обладающими одновременно двумя ключевыми характеристиками, обеспечивающими высокую коллоидную стабильность НЧ, в том числе, в реальных биологических средах, и при этом проявляющими собственную биологическую активность. В этой связи можно предположить, что принципиальная возможность и скорость развития резистентности могут быть существенно снижены за счет модифицирования поверхности НЧ целенаправленно выбранными эффективными стабилизаторов, которые приведут к получению материалов с требуемыми физико-химическими и биологическими характеристиками.
Список литературы
Medernach R.L., Logan L.K. // Infect. Dis. Clin. North. Am. 2018. V. 32. № 1. P. 1–17.
Goudarzi M., Navidinia M. // Arch. Clin. Infect. Dis. 2019. V. 14. № 2. https://doi.org/10.5812/archcid.65744
Battah B. // J Infect Dev Ctries. 2021. V. 15. № 2. P. 179–184.
Stachelek M., Zalewska M., Kawecka-Grochocka E., Sakowski T., Bagnicka E. // Annals of Animal Science. 2021. V. 21. № 1. P. 63–87.
Elshamy A.A., Aboshanab K.M. // Future Sci. OA. 2020. V. 6. № 3. https://doi.org/10.2144/fsoa-2019-0098
Gonzalez-Avila L.U., Loyola-Cruz M.A., Hernández-Cortez C., Bello-López J.M., Castro-Escarpulli G. // J. Mol. Sci. 2021. V. 22. № 11. Article № 5974. https://doi.org/10.3390/ijms22115974
Durand G.A., Raoult D., Dubourg G. // Int. J. Antimicrob. Agents. 2019. V. 53. № 4. P. 371–382.
Vaithinathan A.G., Vanitha A. // Perspect. Public Health. 2018. V. 138. № 2. P. 87–88. https://doi.org/10.1177/1757913917743881
Jacopin E, Lehtinen S, Débarre F, Blanquart F. // J. R. Soc. Interface. 2020 V. 17. Article № 20200105. https://doi.org/10.1098/rsif.2020.0105
Xu X.L., Kang X.Q., Qi J., Jin F.Y., Liu D., Du Y.Z. // Curr. Pharm. Des. 2019. V. 25. № 44. P. 4717–4724.
Shkodenko L., Kassirov I., Koshel E. // Microorganisms. 2020. V. 8. № 10. Article № 1545.
Sánchez-López E., Gomes D., Esteruelas G., Bonilla L., Lopez-Machado A.L., Galindo R. et al. // Nanomaterials (Basel). 2020 V. 10. № 2. Article № 292.
Pachaiappan R., Rajendran S., Show P.L., Manavalan K., Naushad M. // Chemosphere. 2021 V. 272. Article № 128607. https://doi.org/10.1016/j.chemosphere.2020.128607
Gharpure S., Ankamwar B. // J. Nanosci. Nanotechnol. 2020. V. 20. № 10. P. 5977–5996.
Russell A.D., Hugo W.B. // Prog. Med. Chem. 1994. V. 31. № 1. P. 351–370.
Klasen H.J. // Burns. 2000. V. 26. № 2. P. 117–130.
Tortella G.R., Pieretti J.C., Rubilar O., Fernández-Baldo M., Benavides-Mendoza A., Diez M.C., Seabra A.B. // Crit. Rev. Biotechnol. 2021. V. 7. P. 1–19.
Das C., Paul S.S., Saha A., Singh T., Saha A., Im J., Biswas G. // Int. J. Nanomedicine. 2020. V. 15. P. 9301–9315.
Akbarzadeh A., Kafshdooz L., Razban Z., Dastranj Tbri-zi A., Rasoulpour S., Khalilov R. et al. // Artif. Cells Nanomed. Biotechnol. 2018. V. 46. № 2. P. 263–267.
Bruna T., Maldonado-Bravo F., Jaran P., Caro N. // Int. J. Mol. Sci. 2021. V. 22. № 13. Article № 7202.
Crisan C.M., Mocan T., Manolea M., Lasca L.I., Tăbăran F.A., Mocan L. // Applied Sciences. 2021. V. 11. № 3. Article № 1120.
Elmer W., White J.C. // Annu. Rev. Phytopathol. 2018. V. 25. № 56. P. 111–133.
Malandrakis A.A., Kavroulakis N., Chrysikopoulos C.V. // Sci. Total. Environ. 2020. V. 747. Article № 141287.
Huang W.D., Wang C.J., Duan H.M., Bi Y.L., Wu D.G., Du J.L., Yu H.B. //Int. J. Agricult. and Biol. 2018. V. 20. № 5. P. 1225–1229.
Nafari A., Cheraghipour K., Sepahvand M., Shahrokhi G., Gabal E., Mahmoudvand H. // Parasite Epidemiol Control. 2020. V. 10. https://doi.org/10.1016/j.parepi.2020.e00156
Sharma G., Kalra S.K., Tejan N., Ghoshal U. // Exp. Parasitol. 2020. V. 218. Article № 108008.
Krutyakov Yu., Klimov A., Violin B., Kuzmin V., Ryzhikh V., Gusev A., Zakharova O., Lisichkin G. // Europ. J. Nanomed. 2016. V. 8. № 4. P. 185–194.
Ahmed M.K., Zayed M.A., El-Dek S.I., Hady M.A., El Sherbiny D.H., Uskoković V. // Bioact. Mater. 2021. V. 6. № 7. P. 2070–2088. https://doi.org/10.1016/j.bioactmat.2020.12.026
Mishra M., Kumar H., Tripathi K. // Digest J. Nanomaterials and Biostructures. 2008. V. 3. № 2. P. 49–54.
Nadworny P.L., Wang J.F., Tredget E.E., Burrell R.E. // J. Inflamm. 2010. V. 7. Article № 13. https://doi.org/10.1186/1476-9255-7-13
Boucher W., Stern J.M., Kotsinyan V., Kempuraj D., Papaliodis D., Cohen M.S., Theoharides T.C. // J. Urology. 2008. V. 179. № 4. P. 1598–1602. https://doi.org/10.1016/j.juro.2007.11.037
Yin I.X., Zhang J., Zhao I.S., Mei M.L., Li Q., Chu C.H. // Int. J. Nanomedicine. 2020. V. 15. P. 2555–2562.
Симонов П.Г., Ашенбреннер А.И., Виолин Б.В., Федотов С.В., Малышев А.А., Крутяков Ю.А. // Ветеринария. 2015. № 10. С. 42–45.
Коробкова Е.А., Кузьмин В.А., Лунегов А.М., Савенков К.С., Виолин Б.В., Загоруйко Е.Н., и др. // Вопросы нормативно-правового регулирования в ветеринарии. 2015. № 3. С. 153–156.
Симонов П.Г., Ашенбреннер А.И., Хаперский Ю.А., Виолин Б.В., Крутяков Ю.А. // Аграрная наука. 2016. № 6. С. 17–21.
Kalmantaeva O.V., Firstova V.V., Grishchenko N.S. Rudnitskaya T.I., Potapov V.D., Ignatov S.G. // Appl. Biochem. Microbiol. 2020. V. 56. № 2. P. 226–232.
Ponomarev V.A., Shvindina N.V., Permyakova E.S., Slukin P.V., Ignatov S.G., Sirota B., Voevodin A.A., Shtansky D.V. // Colloids and Surfaces B: Biointerfaces. 2019. V. 173. P. 719–724.
Permyakova E.S., Manakhov A.M., Kiryukhantsev-Korneev P.V., Sheveyko A.N., Gudz K.Y., Kovalskii A.M. et al. // Applied Surface Science. 2021. V. 556. Article № 149751.
Zhao L., Lu L., Wang A., Zhang H., Huang M., Wu H., Xing B., Wang Z., Ji R. // J. Agric. Food Chem. 2020. V. 68. № 7. P. 1935–1947.
Kutuzova I.A., Kokaeva L.Y., Pobendinskaya M.A., Krutyakov Y.A., Skolotneva E.S., Chudinova E.M., Elansky S.N. // J. Plant. Path. 2017. V. 99. № 3. P. 635–642.
Gusev A.A., Kudrinsky A.A., Zakharova O.V., Klimov A.I., Zherebin P.M., Lisichkin G.V. et al. // Mater. Sci. Eng. C. Mater. Biol. Appl. 2016. V. 62. P. 152–159.
Pulit-Prociak J., Grabowska A., Chwastowski J., Majka T.M., Banach M. // Colloids Surf. B Biointerfaces. 2019. V. 183. Article № 110416.
Deshmukh S.P., Patil S.M., Mullani S.B., Delekar S.D. // Mater Sci. Eng. C Mater. Biol. Appl. 2019. V. 97. P. 954–965.
He Y., Li H., Fei X., Peng L. // Carbohydr. Polym. 2021. V. 252. Article № 117156.
Edwards-Jones V. // Lett. Appl. Microbiol. 2009. V. 49. № 2. P. 147–152.
Qumar U., Hassan J., Naz S., Haider A., Raza A., UlHamid A., Haider J., Shahzadi I., Ahmad I., Ikram M. // Nanotechnology. 2021. V. 32. № 25. Article № 255704.
Gangadharan D., Harshvardan K., Gnanasekar G., Dixit D., Popat K.M., Anand P.S. // Water Res. 2010. V. 44. № 18. P. 5481–5487.
Krutyakov Y.A., Zherebin P.M., Kudrinskiy A.A., Zubavichus Y.V., Presniakov M.Y., Yapryntsev A.D. et al. // J. Physics D – Applied Physics. 2016. V. 49. https://doi.org/10.1088/0022-3727/49/37/375501
Quadros M.E., Marr L.C. // Environ. Sci. Technol. 2011. V. 45. № 24. P. 10713–10719.
Marambio-Jones C., Hoek E.M.V. // J. Nanopart. 2010. V. 12. P. 1531–1551.
Mchugh G.L., Moellering R.C., Hopkins C.C., Swartz M.N. // The Lancet. 1975. V. 305. № 7901. P. 235–240.
McNeilly O., Mann R., Hamidian M., Gunawan C. // Front. Microbiol. 2021. V. 12. Article № 652863.
Niño-Martínez N, Salas Orozco MF, Martínez-Castañón GA, Torres Méndez F, Ruiz F. // Int. J. Mol. Sci. 2019. V. 20. № 11. https://doi.org/10.3390/ijms20112808
Dibrov P., Dzioba J., Gosink K.K., Häse C.C. // Antimicrob. Agents Chemother. 2002. V. 46. № 8. P. 2668–2670.
Morones J.R., Elechiguerra J.L., Camacho A., Holt K., Kouri J.B., Ramírez J.T., Yacaman M.J. // Nanotechnology. 2005. V. 16. № 10. P. 2346–2353.
Yamanaka M., Hara K., Kudo J. // Appl. Environ. Microbiol. 2005. V. 71. № 11. P. 7589–7593.
Ivask A., Elbadawy A., Kaweeteerawat C., Boren D., Fischer H., Ji Z., Chang C.H., Liu R., Tolaymat T., Te-lesca D., Zink J.I., Cohen Y., Holden P.A., Godwin H.A. // ACS Nano. 2014. V. 8. № 1. P. 374–386.
McQuillan J.S., Infante H.G., Stokes E., Shaw A.M. // Nanotoxicology. 2012. V. 6. № 8. P. 857–866.
Sadoon A.A., Khadka P., Freeland J., Gundampati R.K., Manso R.H., Ruiz M., Krishnamurthi V.R., Thallapuranam S.K., Chen J., Wang Y. // Appl. Environ. Microbiol. 2020. V. 86. № 6.https://doi.org/10.1128/AEM.02479-19
Khina A.G., Krutyakov Y.A. // Appl. Biochem. Microbiol. 2021. V. 57. P. 683–693.
Masip L., Veeravalli K., Georgiou G. // Antioxid. Redox. Signal. 2006. V. 8. № 5. P. 753–762.
Fenoglio I., Corazzari I., Francia C., Bodoardo S., Fubini B. // Free Radic. Res. 2008. V. 42. № 8. P. 437–745.
Zeiri L., Bronk B.V., Shabtai Y., Eichler J., Efrima S. // Appl. Spectrosc. 2004. V. 58 № 1. P. 33–40.
Abbaszadegan A., Ghahramani Y., Gholami A., Hemmateenejad B., Dorostkar S., Nabavizadeh M. // J. Nanomaterials. 2015. V. 2015. Article № 720654.
Liu J., Hurt R.H. // Environ. Sci. Technol. 2010. V. 44. № 6. P. 2169–2175.
Du J., Hu Z., Dong W., Wang Y., Wu S., Bai Y. // Microchemical J. 2019. V. 147. P. 333–338.
Matai I., Sachdev A., Dubey P., Kumar S.U., Bhushan B., Gopinath P. // Colloids Surf. B: Biointerfaces. 2014. V. 115. P. 359–367.
Smetana A.B., Klabunde K.J., Marchin G.R., Sorensen C.M. // Langmuir. 2008. V. 24. № 14. P. 7457–7464.
Klimov A.I., Zherebin P.M., Gusev A.A., Kudrinskiy A.A., Krutyakov Y.A. // IOP Conf. Ser.: Materials Science and Engineering. 2015 V. 98. № 012034. P. 1–9.
Liau S.Y., Read D.C., Pugh W.J., Furr J.R., Russell A.D. // Lett. Appl. Microbiol. 1997. V. 25. № 4. P. 279–283.
Gordon O., Vig Slenters T., Brunetto P.S., Villaruz A.E., Sturdevant D.E., Otto M., Landmann R., Fromm K.M. // Antimicrob. Agents Chemother. 2010. V. 54. № 10. P. 4208–4218.
Yudkin J. // Enzymologia. 1937. V. 2. P. 161–170.
Bertinato J., Cheung L., Hoque R., Plouffe L.J. // J. Trace Elem. Med. Biol. 2010. V. 24. № 3. P. 178–184.
Silva J.J.R.F.D., Williams R.J.P. The Biological Chemistry of the Elements: The Inorganic Chemistry of Life. N.Y.: Oxford University Press, 1991. 561 p.
Argüello J.M., Raimunda D., Padilla-Benavides T. // Front. Cell Infect. Microbiol. 2013. V. 5. № 3. Article № 73.
Arakawa H., Neault J.F., Tajmir-Riahi H.A. // Biophys J. 2001. V. 81. № 3. P. 1580–1587.
Sies H. // Exp. Physiol. 1997. V. 82. № 2. P. 291–295.
Cabiscol E., Tamarit J., Ros J. // Int. Microbiol. 2000 V. 3. № 1. P. 3–8.
Morones-Ramirez J.R., Winkler J.A., Spina C.S., Collins J.J. // Sci. Transl. Med. 2013. V. 5. https://doi.org/10.1126/scitranslmed.3006276
Liu J., Sonshine D.A., Shervani S., Hurt R.H. // ACS Nano. 2010. V. 4. № 11. P. 6903–6913.
Krutyakov Y., Kudrinskiy A., Zherebin P., Lisichkin G. // J. Nanopart. Res. 2019. V. 21. № 69.https://doi.org/10.1007/s11051-019-4495-4
Reygaert W.C. // AIMS Microbiol. 2018. V. 4. № 3. P. 482–501.
Munita J.M., Arias C.A. // 2016. V. 4 № 2. Article № 10.1128.
Gupta A., Phung L.T., Taylor D.E., Silver S. // Microbiology. 2001. V. 147. № 12. P. 3393–402.
Silver S. // FEMS Microbiol Rev. 2003. V. 27. № 2–3. P. 341–353.
Silver S., Phung le T., Silver G. // J. Ind. Microbiol. Biotechnol. 2006. V. 33. № 7. P. 627–634.
Zimmermann M., Udagedara S.R., Sze C.M., Ryan T.M., Howlett G.J., Xiao Z., Wedd AG. // J. Inorg. Biochem. 2012. V. 115. P. 186–197.
Mirolo L., Schmidt T., Eckhardt S., Meuwly M., Fromm K.M. // Chemistry. 2013. V. 19. № 5. P. 1754–1761.
Asiani K.R., Williams H., Bird L., Jenner M., Searle M.S., Hobman J.L., Scott D.J., Soultanas P. // Mol. Microbiol. 2016. V. 101. № 5. P. 731–742.
Nies D.H., Silver S. // J. Ind. Microbiol. 1995. V. 14. № 2. P. 186–199.
Brown N.L., Barrett S.R., Camakaris J., Lee B.T., Rouch D.A. // Mol. Microbiol. 1995. V. 17. № 6. P. 1153–1166.
Nies D.H. // Microbiol. Rev. 2003. V. 27. № 2–3. P. 313–339.
Nies D.H., Nies A., Chu L., Silver S. // Proc. Natl. Acad. Sci. USA. 1989. V. 86. № 19. P. 7351–7355.
Nies D.H. // J. Bacteriol. 1995. V. 177. № 10. P. 2707–2712.
Murakami S., Nakashima R., Yamashita E., Yamaguchi A. // Nature. 2002. V. 419. № 6907. P. 587–593.
Tseng T.T., Gratwick K.S., Kollman J., Park D., Nies D.H., Goffeau A., Saier M.H. Jr. // J. Mol. Microbiol. Biotechnol. 1999. V. 1. № 1. P. 107–125.
Paulsen I.T., Park J.H., Choi P.S., Saier M.H. // FEMS Microbiol. Lett. 1997. V. 156. № 1. P. 1–8.
Saier M.H. Jr., Tam R., Reizer A., Reizer J. // Mol. Microbiol. 1994. V. 11. № 5. P. 841–847.
Chabert V., Hologne M., Sénèque O., Crochet A., Walker O. // Chem. Commun. (Camb). 2017. V. 53 № 45. P. 6105–6108.
Urbina P., Bersch B., De Angelis F., Derfoufi K.M., Prévost M., Goormaghtigh E., Vandenbussche G. // Biochemistry. 2016. V. 55 № 20. P. 2883–2897.
Kosol S., Contreras-Martos S., Cedeño C., Tompa P. // Molecules. 2013. V. 18. № 9. P. 10802–10828.
Rensing C., Grass G. // FEMS Microbiol. Rev. 2003. V. 27. № 2–3. P. 197–213.
Blencowe D.K., Morby A.P. // FEMS Microbiol. Rev. 2003. V. 27. № 2–3. P. 291–311.
Rensing C., Fan B., Sharma R., Mitra B., Rosen B.P. // Proc. Natl. Acad. Sci. USA. 2000. V. 97. № 2. P. 652–656.
Randall C.P., Gupta A., Jackson N., Busse D., O’Neill A.J. // J. Antimicrob. Chemother. 2015. V. 70. № 4. P. 1037–46.
Kittleson J.T., Loftin I.R., Hausrath A.C., Engelhardt K.P., Rensing C., McEvoy M.M. // Biochemistry. 2006. V. 45. № 37. P. 11096–11102.
Lok C.N., Ho C.M., Chen R., Tam P.K., Chiu J.F., Che C.M. // J. Proteome. Res. 2008. V. 7. № 6. P. 2351–2356.
Staehlin B.M., Gibbons J.G., Rokas A., O’Halloran T.V., Slot J.C. // Genome Biol. Evol. 2016. V. 8. № 3. P. 811–826.
Franke S., Grass G., Rensing C., Nies D.H. // J. Bacteriol. 2003. V. 185. № 13. P. 3804–3812.
Munson G.P., Lam D.L., Outten F.W., O’Halloran T.V. // J. Bacteriol. 2000. V. 82. № 20. P. 5864–5871.
Mills S.D., Lim C.K., Cooksey D.A. // Mol. Gen. Genet. 1994. V. 244. № 4. P. 341–351.
Xue Y., Davis A.V., Balakrishnan G., Stasser J.P., Staehlin B.M., Focia P., Spiro T.G., Penner-Hahn J.E., O’Halloran T.V. // Nat. Chem. Biol. 2008. V. 4. № 2. P. 107–109.
Kulathila R., Indic M., van den Berg B. // PLoS One. 2011. V. 6. № 1. Article № e15610. https://doi.org/10.1371/journal.pone.0015610
Su C.C., Long F., Zimmermann M.T., Rajashankar K.R., Jernigan R.L., Yu E.W. // Nature. 2011. V. 470. № 7335. P. 558–562.
Bagai I., Rensing C., Blackburn N.J. // Biochemistry. 2008. V. 47. P. 11408–11414.
Mealman T.D., Bagai I., Singh P., Goodlett D.R., Rensing C., Zhou H., Wysocki V.H., McEvoy M.M. // Biochemistry. 2011. V. 50. № 13. P. 2559–2566.
Li X.Z., Nikaido H., Williams K.E. // J. Bacteriol. 1997. V. 179. P. 6127–6132.
Nikaido H. // J. Bacteriol. 1999. V. 181. № 1. P. 4–8.
Muller M. // Antimicrob. Agents Chemother. 2018. V. 62. № 8. Article № e00672-18. https://doi.org/10.1128/AAC.00672-18
Hassan H.M., Fridovich I. // J. Bacteriol. 1980. V. 141. № 1. P. 156–163.
Muller M. // Free Radic. Biol. Med. 2002. V. 33. № 11. P. 1527–1533.
Deshpande L.M., Chopade B.A. // Biometals. 1994. V. 7. № 1. P. 49–56.
Hosny A.E.M., Rasmy S.A., Aboul-Magd D.S., Kashef M.T., El-Bazza Z.E. // Infect. Drug Resist. 2019. V. 12. P. 1985–2001.
Finley P.J., Norton R., Austin C., Mitchell A., Zank S., Durham P. // Antimicrob. Agents Chemother. 2015. V. 59. № 8. P. 4734–4741.
Sütterlin S., Tano E., Bergsten A., Tallberg A.B., Melhus A. // Acta. Derm. Venereol. 2012. V. 92. № 1. P. 34–39.
Hendry A.T., Stewart I.O. // J. Microbiol. 1979. V. 25. № 8. P. 915–921.
Sütterlin S., Edquist P., Sandegren L., Adler M., Tängdén T., Drobni M., Olsen B., Melhus A. // Appl. Environ. Microbiol. 2014. V. 80. № 22. P. 6863-9.
Sütterlin S., Dahlö M., Tellgren-Roth C., Schaal W., Melhus Å. // J. Hosp. Infect. 2017. V. 96. № 3. P. 256–261.
Gunawan C., Teoh W.Y., Marquis C.P., Amal R. // Small. 2013. V. 9. № 21. P. 3554–3560.
Valentin E., Bottomley A.L., Chilambi G.S., Harry E.J., Amal R., Sotiriou G.A., Rice S.A., Gunawan C. // Nanoscale. 2020. V. 12. № 4. P. 2384–2392.
Cong Y., Yang S., Rao X. // J. Adv. Res. 2019. V. 21. P. 169–176.
Sinha S.C., Krahn J., Shin B.S., Tomchick D.R., Zalkin H., Smith J.L. // J. Bacteriol. 2003. V. 185. № 14. P. 4087–4098.
Gardner S.G., Marshall D.D., Daum R.S., Powers R., Somerville G.A. // Antimicrob. Agents Chemother. 2017. V. 62. № 1. Article № e01608-17.
Park S., Imlay J.A. // J. Bacteriol. 2003. V. 185. № 6. P. 1942–1950.
Graves J.L. Jr., Tajkarimi M., Cunningham Q., Campbell A., Nonga H., Harrison S.H., Barrick J.E. // Front. Genet. 2015. V. 6. 42. https://doi.org/10.3389/fgene.2015.00042
Conrad T.M., Frazier M., Joyce A.R., Cho B.K., Knight E.M., Lewis N.E., Landick R., Palsson B.Ø. // Proc. Natl. Acad. Sci. USA. 2010. V. 107. № 47. P. 20500–20505.
Conrad T.M., Lewis N.E., Palsson B.Ø. // Mol. Syst. Biol. 2011. V. 7. № 509. https://doi.org/10.1038/msb.2011.42
Stabryla L.M., Johnston K.A., Diemler N.A., Cooper V.S., Millstone J.E., Haig S.J., Gilbertson L.M. // Nat. Nanotechnol. 2021. V. 16. № 9. P. 996–1003.
Adam M., Murali B., Glenn N.O., Potter S.S. // BMC Evol. Biol. 2008. V. 8. № 52. https://doi.org/10.1186/1471-2148-8-52
George A.M., Levy S.B. // J. Bacteriol. 1983. V. 155. № 2. P. 531–540.
Ellis D.H., Maurer-Gardner E.I., Sulentic C.E.W., Hussain S.M. // Biomed. Phys. Eng. Express. 2019. V. 5. № 1. Article № 015013.
Panáček A., Kvítek L., Smékalová M., Večeřová R., Kolář M., Röderová M., et al. // Nat. Nanotechnol. 2018. V. 13. № 1. P. 65–71.
Bardy S.L., Ng S.Y.M., Jarrell K.F. // Microbiology. 2003. V. 149. № 2. P. 295–304.
Metlina A.L. // Biochemistry. 2004. V. 69. № 11. P. 1203–1212.
Asadishad B., Hidalgo G., Tufenkji N. // FEMS Microbiol. Lett. 2012. V. 334. № 2. P. 87–94.
Gauger E.J., Leatham M.P., Mercado-Lubo R., Laux D.C., Conway T., Cohen P.S. // Infect. Immun. 2007. V. 75. № 7. P. 3315–3324.
Barker C.S., Prüss B.M., Matsumura P. // J. Bacteriol. 2004. V. 186. № 22. P. 7529–7537.
Kudrinskiy A., Zherebin P., Gusev A., Shapoval O., Pyee J., Lisichkin G., Krutyakov Y. // Nanomaterials (Basel). 2020. V. 10. № 8. Article № 1459.
Kaur A., Preet S., Kumar V., Kumar R. // Colloids Surf. B Biointerfaces. 2019. V. 176. P. 62–69.
Krutyakov Y.A., Kudrinsky A.A., Gusev A.A., Zakharova O.V., Klimov A.I., Yapryntsev A.D., Zherebin P.M., Shapoval O.A., Lisichkin G.V. // Materials Research Express. 2017. V. 4. № 7. P. 1–16.
Gudz K.Y., Antipina L.Yu., Permyakova E.S. et al. // ACS Applied Materials & Interfaces. 2021. V. 13. № 20. P. 23452–23468.
Mazur P., Skiba-Kurek I., Mrowiec P., Karczewska E., Drożdż R. // Int. J. Nanomedicine. 2020. V. 15. P. 3551–3562.
Surwade P., Ghildyal C., Weikel C., Luxton T., Peloquin D., Fan X., Shah V. // J. Antibiot. (Tokyo). 2019. V. 72. № 1. P. 50–53.
Awad M., Yosri M., Abdel-Aziz M.M., Younis A.M., Sidkey N.M. // Biol. Trace Elem. Res. 2021. V. 199. № 11. P. 4225–4236.
Yu. H., Sun H., Yin C., Lin Z. // Ecotoxicol. Environ. Saf. 2019. V. 181. P. 43–48.
Volova T.G., Shumilova A.A., Shidlovskiy I.P., Nikolaeva E.D., Sukovatiy A.G., Vasiliev A.D., Shishatskaya E.I. // Polymer Testing. 2018. V. 65. P. 54–68.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


