Прикладная биохимия и микробиология, 2021, T. 57, № 5, стр. 467-476
Сравнительная активность новых рекомбинантных L-аспарагиназ экстремофилов
М. В. Думина 1, *, А. А. Жгун 1, М. В. Покровская 2, С. С. Александрова 2, Д. Д. Жданов 2, Н. Н. Соколов 2, М. А. Эльдаров 1
1 Институт биоинженерии, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” РАН
117312 Москва, Россия
2 Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича
119121 Москва, Россия
* E-mail: DuminaMaria@gmail.com
Поступила в редакцию 07.04.2021
После доработки 22.04.2021
Принята к публикации 23.04.2021
Аннотация
В работе исследовали активность новых L-аспарагиназ экстремофильного происхождения: термоацидофильной археи Acidilobus saccharovorans, термофильной бактерии Melioribacter roseus и психрофильного гриба Sclerotinia borealis. Активные формы ферментов в рекомбинантных штаммах Escherichia coli получали путем экспрессии нативного гена L-аспарагиназы из M. roseus (MrA); для генов L-аспарагиназ из A. saccharovorans (AsA) и S. borealis (SbA) потребовалась оптимизация кодонового состава. Сравнительный анализ специфической активности рекомбинантных L-аспарагиназ при различных температурах и pH показал, что наибольшей способностью к гидролизу L-аспарагина обладала MrA. В ходе изучения влияния температуры и рН на ферментативную активность неочищенного экстракта MrA выявлено, что максимальную активность фермент проявлял при 75°С и рН 9.0. Добавление ионов металлов в концентрации 1.0 мМ оказывало различное действие на активность MrA. Катионы Сu2+ и Zn2+ полностью ингибировали активность фермента. При добавлении ионов Fe3+, Ni2+, Ca2+ и Mg2+ к неочищенному экстракту MrA специфическая активность изменялась в диапазоне 5–28%. Полученные в работе результаты указывают, что L-аспарагиназа из M. roseus может быть перспективным объектом для последующего детального изучения энзиматических характеристик и использования в биотехнологической промышленности.
L-аспарагиназа (L-АСП, L-аспарагин-амидогидролаза, КФ 3.5.1.1) – первый для клинической онкогематологии бактериальный фермент со специфическим действием на опухолевые клетки. Он остается одним из основных препаратов комбинированной химиотерапии острого лимфобластного лейкоза на протяжении более 40 лет [1, 2]. Помимо биомедицинского применения в настоящее время проводятся исследования по использованию фермента в технологиях пищевых производств для снижения уровня акриламида, потенциально канцерогенного и нейротоксического вещества [3, 4]. Акриламид образуется в пищевых продуктах в процессе взаимодействия L‑аспарагина с редуцирующими сахарами в реакции Майяра [5]. Обработка L-АСП выступает одним из способов снижения уровня L-аспарагина, а следовательно, акриламида в пищевых продуктах при сохранении их органолептических характеристик.
Известные и применяемые на данный момент L-АСП не лишены недостатков. Препараты L‑АСП в онкогематологии способны вызывать ряд нежелательных эффектов: аллергические реакции, гепатотоксичность, нефротоксичность, тромбозы, осложнения со стороны ЦНС и др. [6, 7]. Нежелательные проявления связывают с низкой субстратной специфичностью фермента – проявлением L-глутаминазной активности [8, 9]. Важной характеристикой является также стабильность применяемых в биомедицине L-АСП [10, 11]. Повышение стабильности фермента способствует улучшению его фармакокинетических свойств: увеличению продолжительности циркуляции в крови, снижению кратности дозирования и вероятности развития аллергических проявлений.
Применение существующих препаратов L-АСП для предобработки сырья с целью снижения уровня акриламида на пищевых производствах также ограничено, ввиду их недостаточной активности и стабильности при высоких температурах [12].
Известно, что L-АСП широко распространены в природе, характеризуются разнообразием структурно-функциональных и биохимических свойств. Этим объясняется непрерывный поиск новых источников перспективных L-АСП с повышенной специфичностью действия, активностью и стабильностью.
L-АСП выделены и охарактеризованы у множества бактерий, архей, дрожжей, мицелиальных грибов, животных, растений [2, 12]. Среди различных микроорганизмов особый интерес представляют экстремофилы, выступающие естественным источником многих высокостабильных ферментов с широкими перспективами применения в биотехнологии [13, 14]. Поскольку проблема стабильности, активности мезофильных L-АСП является одной из ключевых, усилия в данном исследовании были сфокусированы на поиске новых “экстремофильных” гомологов этих ферментов.
В качестве источников таких L-АСП были выбраны микроорганизмы 3 классов, устойчивые к различным экстремальным условиям внешней среды.
– Sclerotinia borealis – психрофильный гриб. Этот аскомицет способен обитать на поверхности почвы под снегом и развиваться при температурах до –2…–3°С; оптимальный рост наблюдается при –1°С [15], он также способен расти в условиях сниженной влажности [16].
– Acidilobus saccharovorans – ацидофильная термофильная кренархея, растет в диапазоне температур от 60 до 90°С, оптимальный рН 3.5–4.0 [17].
– Melioribacter roseus – умеренно термофильная, факультативно анаэробная бактерия [18], имеет температурный диапазон роста 35–60°С при оптимуме 55°С.
Психрофильные L-АСП могут быть интересны, поскольку реакции, катализируемые психрофильными ферментами, термодинамически характеризуются низкой энергией активации. При этом активные сайты таких белков, как правило, больше и доступнее для субстрата. В результате их удельная активность может быть в 10 и более раз выше, чем для мезофильных гомологов при температуре 20–30°C [19]. Для исследования выбрали психрофильный гриб S. borealis, являющийся эукариотическим микроорганизмом. Полагают, что L-АСП эукариотического происхождения потенциально менее иммуногенны для человека и имеют перспективы для разработки препаратов с улучшенным профилем безопасности [20].
Выбор термофила M. roseus и термоацидофила A. saccharovorans как источников новых L-АСП продиктован возможностью их использования как в высокотемпературных процессах в пищевой промышленности, так и в биомедицине. Установлено, что повышенная стабильность термофильных L‑АСП позволяет им успешно конкурировать с L‑АСП мезофильных микроорганизмов, превосходя их по активности, в том числе, в относительно мягких физиологических условиях при 37°C [21].
Цель работы – получение рекомбинантных штаммов E.coli, экспрессирующих L-АСП экстремофилов S. borealis, A. saccharovorans, M. roseus, сравнительное исследование специфической активности рекомбинантных L-АСП.
МЕТОДИКА
Биоинформационный анализ. Поиск гомологичных последовательностей L-АСП проводили в среде BLAST с использованием ресурса NCBI (“National Center for Biotechnology Information”, США) [22]. Для филогенетического анализа использовали программу MEGA X (“MEGA software group”, США) [23]. Дизайн экспрессионных конструкций осуществляли в среде Vector NTI v.6.0. (“InforMax”, США) [24]. Оптимизацию кодонового состава для экспрессии в клетках E. coli генов L-АСП из A. saccharovorans и S. borealis проводили с помощью программы Twist Codon Optimization tool (“TWIST Bioscience”, США) (https://www.twistbioscience.com/).
Штаммы микроорганизмов. В работе использовали следующие источники последовательностей экстремофильных L-АСП: S. borealis F-4128 (геном штамма депонирован в Genbank под номером KI628577 AYSA01000000) [25], A. saccharovorans 345-15 (номер доступа в Genbank – NC_014374) [17], M. roseus P3M-2 (номер доступа в Genbank – NC_018178) [18]. Для создания генно-инженерных конструкций использовали штамм E. coli XL1-Blue (“Stratagene”, США). Гетерологическую экспрессию L-АСП экстремофилов проводили в клетках E.coli BL21(DE3) (“Novagene”, США).
Конструирование экспрессионных векторов. Экспрессионные векторы конструировали на базе коммерческой плазмиды pET-28а(+) (“Novagen”, США). Были разработаны два варианта конструкций: для экспрессии нативных и оптимизированных нуклеотидных последовательностей L-АСП. Все варианты кодирующих последовательностей для клонирования в вектор pET-28а(+) под контроль промотора гена 10 фага Т7 были предварительно синтезированы компанией “TWIST Bioscience” (США).
Первую серию векторов получили после клонирования нативных кодирующих последовательностей L-АСП экстремофилов, содержащих дополнительные сайты рестрикции на 5'- и 3'‑концах. Для этого последовательности, содержащие ген MROS_RS06765 (из M. roseus P3M), ген ASAC_RS04025 (из A. saccharovorans 345-15) и сплайсированный вариант гена для SBOR_3103 (из S. borealis F-4128) гидролизовали по сайтам NheI/ HindIII и встраивали в гидролизованный по сайтам NheI/ HindIII вектор pET-28а(+). В результате получали конструкции pET28a(+)_mrA, pET28a(+)_asA и pET28a(+)_sbA. Для получения рекомбинантных L-АСП из археи A. saccharovorans 345-15 и гриба S. borealis F-4128 дополнительно сконструировали векторы, несущие последовательности с оптимизированным для экспрессии в E. coli кодоновым составом. Последовательности гидролизовали по сайтам NheI/HindIII и встраивали в гидролизованный по сайтам NheI/HindIII вектор pET-28а(+). В результате получили конструкции pET28a(+)_asAmod, и pET28a(+)_sbAmod.
Получение рекомбинантных штаммов. Для гетерологичной экспрессии L-АСП экстремофилов созданные конструкции трансформировали в клетки E. coli BL21(DE3). В результате получили рекомбинантные штаммы Mr1, As1, Sb1, As2, Sb2 (табл. 1). Штамм Ec0 (табл. 1), полученный при трансформации E. coli BL21(DE3) исходной плазмидой pET28a(+), использовали в качестве контроля во всех экспериментах.
Таблица 1.
Штаммы микроорганизмов, полученные в работе
| Обозначение штамма | Характеристика экспрессионного штамма | Номер доступа GenBank | |
|---|---|---|---|
| штамм E. coli/экспрессионная конструкция | экспрессируемый ген L-АСП, его тип | ||
| Ес0 | BL21(DE3)/pET28a(+) | – | – |
| Mr1 | BL21(DE3)/pET28a(+)_mrA | mrA, дикий тип из M. roseus P3M-2 | MROS_RS06765 [18] |
| As1 | BL21(DE3)/pET28a(+)_asA | asA, дикий тип из A. saccharovorans 345-15 | ASAC_RS04025 [17] |
| Sb1 | BL21(DE3)/pET28a(+)_sbA | sbA, сплайсированная последовательность гена дикого типа из S. borealis F-4128 | SBOR_3103 [25] |
| As2 | BL21(DE3)/pET28a(+)_asAmod | asAmod, синтетический аналог asA, получен после оптимизации кодонового состава для экспрессии в E. coli | MW699185, данная работа |
| Sb2 | BL21(DE3)/pET28a(+)_sbAmod | sbAmod, синтетический аналог sbA, получен после оптимизации кодонового состава для экспрессии в E. coli | MW699184, данная работа |
Культивирование штаммов. Штаммы E. coli BL21(DE3), экспрессирующие L-АСП экстремофилов, и штамм Ec0 культивировали согласно условиям, описанным ранее [26], в LB среде с добавлением 0.05 мг/мл канамицина при 37°C. Штаммы Sb1, As1, As2 и Sb2 дополнительно выращивали при 24°C. Индуктор (лактозу или ИПТГ) добавляли в среду при OD600 = 0.5, 1.0 либо 1.9 до конечной концентрации 0.02, 0.1 либо 0.2%. Клеточную биомассу собирали через 17–20 ч после индукции.
Определение ферментативной активности L-аспарагиназ. После культивирования клетки собирали центрифугированием (4000 g, 15 мин), ресуспендировали в буферах с различными значениями рН: А (0.1 мМ Na-ацетатный, рН 5.2), Б (0.1 мМ Na-фосфатный, рН 7.3), В (0.1 мМ боратный, рН 9.6). Далее клетки разрушали ультразвуком в условиях, описанных ранее [26]. Клеточный дебрис удаляли центрифугированием при 12 000 g, 15 мин при 4°C. Активность L-АСП определяли в супернатанте (неочищенном экстракте) по количеству образовавшегося аммиака методом прямой несслеризации [29, 30]. Реакции проводили в буферах А, Б и В при температурах 24, 37 и 94°C. За 1 единицу активности L‑аспарагиназы (1 МЕ – международная единица) принимали количество фермента, катализирующее высвобождение 1 мкмоль аммиака за 1 мин в условиях эксперимента, активность выражали в ME/мл.
Влияние на ферментативную активность температуры и рН. Специфическую активность неочищенного экстракта L-АСП определяли в инкубационной смеси в 0.05 М трис-HCl буфере, рН 7.8, в интервале температур 37–80°C. Влияние рН на активность фермента изучали при температуре, соответствующей максимальной активности неочищенного фермента, с L-аспарагином в качестве субстрата в следующих буферных системах: 0.1 М Na-фосфатной, рН 7.1–8.0; 0.05 М трис-HCl, рН 7.8–9.0; 0.25 М боратный, рН 9.0–9.5. Относительную активность выражали в % от максимального значения, установленного в эксперименте.
Определение влияния ионов металлов. Активность L-АСП в неочищенном экстракте определяли при добавлении ионов металлов (Ni2+, Cu2+, Mg2+, Zn2+, Ca2+, Fe3+), а также ЭДТА. Все вещества (NiCl2, CuSO4, MgCl2, ZnCl2, CaCl2, FeCl3 и ЭДТА) добавляли в концентрации 1.0 мМ. Ферментативную активность определяли при значениях температуры и рН, соответствующих максимальной активности неочищенного фермента (75°C, рН 9.0), при добавлении L-аспарагина и соответствующих ионов металлов в трех повторностях. Полученные значения выражали в % от активности фермента без добавления катионов металлов, которую принимали за 100%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Идентификация и анализ последовательностей экстремофильных L-АСП. В качестве источников новых перспективных L-АСП были выбраны экстремофилы с ранее аннотированными геномными последовательностями: психрофильный мицелиальный гриб S. borealis F-4128 [25], ацидофильная термофильная кренархея A. saccharovorans 345-15 [17], а также термофильная бактерия M. roseus P3M-2 [18]. Данные микроорганизмы, являясь представителями трех доменов, адаптированы к росту при различных экстремальных факторах среды. Филогененетический анализ на основе белковых последовательностей показал, что L-АСП психрофильного гриба S. borealis F‑4128 (SbA) кластеризуется с L-АСП грибного происхождения, относящимся к Botrytis sp., Molinilia sp. и Aspergillus sp. Уровень идентичности данных L-АСП составляет 91–78% (рис. 1, табл. 2). Ближайшими гомологами L-АСП A. saccharovorans 345-15 (AsA) являются L-АСП Acidilobus sp. Уровень их гомологии варьирует в диапазоне 78–64% (рис. 1, табл. 2). Для L-АСП термофильной бактерии M. roseus (MrA) показано промежуточное положение между L-АСП Acidilobus sp. и представителями группы Bacteroidetes/Chlorobi, к которой относится данный микроорганизм (рис. 1, табл. 2).
Рис. 1.
Филогенетическая дендрограмма последовательностей L-АСП микроорганизмов. Дендрограмма построена по методу попарного внутригруппового невзвешенного среднего (UPGMA), подчеркнуты исследуемые в работе последовательности.
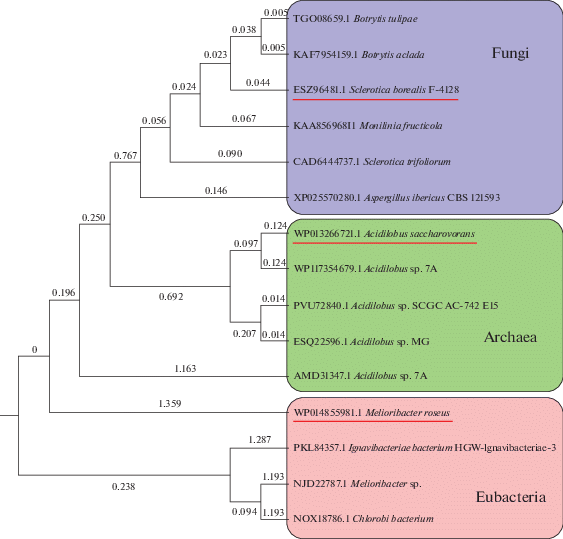
Таблица 2.
Сравнение аминокислотных последовательностей L-АСП
| Микроорганизм-источник L-АСП | Номер доступа последовательности в GenBank | Идентич-ность, % | Комментарии |
|---|---|---|---|
| Гомологи L-АСП S. borealis F-4128 | |||
| S. borealis F-4128 | ESZ96481.1 | 100.00 | SbA, изучаемая L-АСП |
| Botrytis tulipae | TGO08659.1 | 91.78 | Гипотетический белок, предсказанный по гомологии |
| Botrytis aclada | KAF7954159.1 | 91.51 | |
| Botryotinia squamosa | KAF7869258.1 | 90.98 | |
| Monilinia fructicola | KAA8569682.1 | 85.75 | |
| Sclerotinia sclerotiorum 1980 UF-70 | APA11519.1 | 83.64 | |
| Sclerotinia trifoliorum | CAD6444737.1 | 83.64 | |
| Aspergillus ibericus CBS 121593 | XP_025570260.1 | 77.99 | |
| Pyrococcus yayanosii CH1 | AEH25396.1 | 27.21 | Охарактеризованная периплазматическая L-АСП II типа экстремофильной археи [29] |
| Thermococcus kodakarensis | WP_011250607.1 | 25.17 | Охарактеризованная периплазматическая L-АСП II типа экстремофильной археи [30] |
| E. coli | WP_167585435.1 | 24.25 | Охарактеризованная периплазматическая L-АСП II типа мезофильной бактерии [31, 32] |
| Гомологи L-АСП A. saccharovorans 345-15 | |||
| A. saccharovorans 345-15 | WP_013266721.1 | 100.00 | AsA, изучаемая L-АСП |
| Acidilobus sp. 7A | WP_117354679.1 | 78.25 | Неохарактеризованное субсемейство L-АСП 2 типа архейного происхождения |
| Acidilobus sp. SCGC AC-742_E15 | PVU72840.1 | 65.31 | |
| Acidilobus sp. MG | ESQ22596.1 | 63.58 | Гипотетический белок из некультивируемого вида, предсказанный по гомологии |
| Гомологи L-АСП M. roseus P3M-2 | |||
| M. roseus P3M-2 | WP_014855981.1 | 100.00 | MrA, изучаемая L-АСП |
| Ignavibacteria bacterium | KAF0152192.1 | 70.16 | Гипотетический белок, предсказанный по гомологии |
| Melioribacter sp. | NJD22787.1 | 65.56 | |
| Chlorobibacterium | NOX18786.1 | 62.34 | |
Сравнение SbA, AsA и MrA с подробно изученными L-АСП экстремофильного и мезофильного происхождения показало низкий уровень их гомологии, который не превышал 27% (табл. 2). Согласно данным анализа, наиболее близкими идентифицируемыми гомологами для изучаемых в работе SbA, AsA и MrA могут быть ранее неохарактеризованные L-АСП, основными источниками которых являются некультивируемые штаммы микроорганизмов (табл. 2). L-АСП A. saccharovorans 345-15 по классификации CDD относится к неохарактеризованному подсемейству L-аспарагиназа 2-подобных ферментов архебактерий.
Клонирование и экспрессия генов экстремофильных L-АСП. Гетерологическую экспрессию изучаемых экстремофильных L-АСП проводили в клетках мезофильной бактерии E. coli BL21(DE3) под контролем промотора гена 10 фага T7 в составе вектора pET-28а(+). На первом этапе создали конструкции для экспрессии нативных генов L-АСП. При культивировании рекомбинантных штаммов в стандартных условиях (индукция 0.2%-ой лактозой при OD600 = 1.0) активность L-АСП обнаружили только для штамма Mr1. У штаммов As1 и Sb1 L-АСП активность полностью отсутствовала. Поскольку оптимизация условий экспрессии для этих штаммов (по температуре культивирования, оптической плотности клеток при добавлении индуктора, концентрации и типу индуктора) не позволила получить активные формы ферментов, провели оптимизацию кодонового состава кодирующих их последовательностей для экспрессии в клетках E. coli.
В ходе частичной замены редких для данного микроорганизма минорных кодонов на синонимичные мажорные кодоны получили синтетические варианты генов, кодирующих AsA и SbA аналогичного аминокислотного состава. Оптимизированные последовательности для L-АСП из психрофильного гриба S. borealis F-4128 и термоацидофильной кренархеи A. saccharovorans 345-15, депонированные в Genbank под номерами доступа MW699184 и MW699185 соответственно, синтезировали и использовали для создания генно-инженерных конструкций на базе вектора pET-28а(+) для экспрессии в клетках E.coli BL21(DE3) (табл. 1). Полученные таким образом рекомбинантные штаммы As2 и Sb2, экспрессирующие модифицированные asAmod и sbAmod соответственно, проявляли L-аспарагиназную активность. В оптимизированных условиях культивирование штаммов As2 и Sb2 проводили при температуре 24°C, в качестве индуктора добавляли лактозу при OD600 = 0.5 до конечной концентрации 0.2%.
Оптимизация нуклеотидной последовательности позволила провести гетерологическую экспрессию неизученной ранее психрофильной L‑АСП грибов и полиэкстремофильной L-АСП архей, относящейся к неохарактеризованному подсемейству L-аспарагиназа 2-подобных ферментов архебактерий. Ранее предпринимались попытки гомологичной экспрессии L-АСП психрофилов и ацидофилов, которые сопровождались необходимостью многофакторной оптимизации условий культивирования продуцентов и высокой вариабельностью ферментативной активности экспрессируемых таким образом L-АСП [19, 20, 35, 36].
Следует отметить, что источниками белков экстремофильного происхождения часто являются микроорганизмы, некультивируемые либо требующие особых условий культивирования, экспрессии целевого белка, что существенно осложняло возможность как их изучения, так и возможного биотехнологического получения. В частности, для роста изучаемого психрофильного гриба S. borealis необходимы пониженные температуры [15]. Для культивирования полиэкстремофильной кренархеи A. saccharovorans и термофильной бактерии M. roseus требуется повышенная температура и создание анаэробных условий [18, 27].
Для характеристики L-АСП таких бактерий, архей или грибов могут быть использованы рекомбинантные штаммы на базе E. coli. В ходе работы по экспрессии природных кодирующих последовательностей активность проявлял фермент из экстремофильной бактерии M. roseus P3M-2. Для L-АСП архейного и грибного происхождения и экспрессии в клетках E. coli потребовалась предварительная оптимизация кодонового состава. Рекомбинатные штаммы As2 и Sb2, экспрессирующие синтетические варианты нуклеотидных последовательностей L-АСП asAmod и sbAmod, а также Mr1 с экспрессией нативной последовательности mrA использовали для последующей характеристики ферментативной активности этих белков.
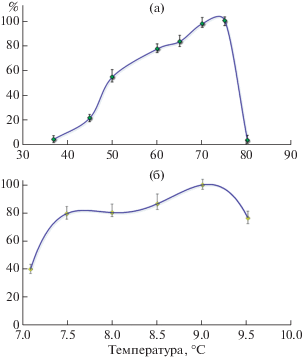
Ферментативная активность неочищенных экстрактов L-АСП экстремофилов. Активность гетерологично экспрессируемых L-АСП экстремофилов оценивали методом прямой несслеризации при различных экспериментальных условиях – температуре и рН (рис. 2). Наиболее высокую L-АСП активность среди изученных гомологов показал фермент умеренно термофильной бактерии M. roseus P3M-2. Максимальное значение активности фермента 9.6 МЕ/мл было при 37°C и рН 9.6. Повышение температуры до 94°C, а также снижение рН приводили к резкому падению активности L‑АСП (рис. 2a).
Рис. 2.
Относительная активность рекомбинантных L-АСП экстремофилов (%) после экспрессии в штаммах Mr1 (а), Sb2 (б) и As2 (в) при 24, 37 и 94°С и рН 5.2 (1), 7.3 (2) и 9.6 (3).
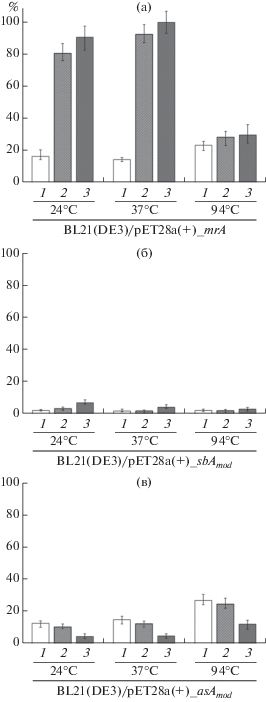
Активность SbA была значительно ниже и составляла 1.7 – 6.6% (0.2–0.6 МЕ/мл) от максимальной активности, полученной для MrA в этой серии экспериментов (рис. 2б). При этом наилучшие показатели активности L-АСП из S. borealis F-4128 наблюдали при 24°C и щелочных рН (рН 9.6). Эти результаты согласовывались с ранее полученными результатами оценки активности L-АСП психрофильных мицелиальных грибов, изолированных на острове Кинг-Джордж (Антарктика) [33]. При культивировании 42 представителей мицелиальных грибов, относящихся к родам Geomyces, Pseudogymnoascus, Cosmospora, Hypocrea, Cadophora, Cladosporium, Penicillium, Pseudeurotium, Oidiodendron и Acremonium, их активность варьировала в диапазоне 0.2–1.45 МЕ/мл [33].
Активность L-АСП AsA составила 4.5–26.7% (0.4–2.6 МЕ/мл) от максимальной для MrA (рис. 2в). AsA демонстрировала максимальную активность при 94°C и рН 5.2, что соответствовало условиям обитания этой полиэкстремофильной кренархеи при повышенных температурах и кислых рН. Среди ацидофильных микроорганизмов, у которых была обнаружена активность L‑АСП, описан аскомицет Aspergillus terreus, который используется в биотехнологической промышленности для получения вторичных метаболитов [35–37]. При культивировании A. terreus в оптимизированных условиях (35°C, рН 6.0) активность L‑АСП составила 4.81 МЕ/мг [34].
Проведенные эксперименты в различных условиях показали, что L-АСП активность MrA превосходила таковую SbA и AsA в 5–50 раз. Таким образом, MrA рассматривалась как наиболее перспективная и была выбрана для последующего изучения.
Влияние температуры на ферментативную активность MrA. Изучение влияния температуры на активность неочищенного экстракта L-АСП MrA проводили в диапазоне значений 37–80°C. Максимальная активность рекомбинантного фермента MrA (190–205 МЕ/мл) проявлялась при 75°C (рис. 3а). При этом более 75% от максимального уровня L-АСП активности MrA наблюдали в интервале температур 60–75°C (рис. 3а). При температуре ниже 50°C, а также свыше 78°C происходило резкое снижение активности фермента (рис. 3а).
В ходе предварительного скрининга в физиологических условиях при 37°C была установлена активность MrA 9.6 МЕ/мл (рН 9.6). Дополнительные исследования на неочищенном экстракте показали, что активность препарата при 37°C составила 4.8% от максимальной при 75°C и рН 7.8. Ранее для термофильной L-АСП Thermococcus kodakaraensis KOD1, проявляющей максимальную L-АСП активность при 85°C, pH 9.5, в физиологических условиях (при 37°C) также фиксировали падение активности фермента до уровня 4% от максимальной [21].
Влияние рН на ферментативную активность MrA. Зависимость активности MrA от pH среды изучали в диапазоне значений 7.1–9.5. Максимальная активность фермента проявлялась при рН 9.0. При этом более 75% активности сохранялось в интервале значений рН 7.5–9.5 (рис. 3б). Повышение ферментативной активности при сдвиге в область слабощелочных рН, установленное для MrA, показано также для других L-АСП. Высокая каталитическая активность в диапазоне рН 7.0–9.0 при рН-оптимуме большинства из них 8.0–8.5 наблюдалась у Thermococcus zilligii, Thermococcus gammatolerans, Pyrococcus yayanosii, Pyrococcus furiosus [38]. Среди L-АСП термофильных бактерий рН-оптимум 8.0–9.0 установлен для Streptomyces thermoluteus subsp. fuscus NBRC 14270 [39 ] .
Оптимальные значения рН среды для многих L-АСП мезофильных штаммов аналогичны: оптимум рН 8.0–9.0 характерен для L-АСП E. coli, Erwinia chrysanthemi, Pseudomonas stutzeri, Erwinia carotovora [38, 40].
Среди экстремофилов максимальная активность при более щелочной реакции среды зафиксирована только для L-АСП Thermus thermophilus [41] и Archaeoglobus fulgidus [42] – рН 9.2, а также Thermus aquaticus T351 – рН 9.5 [43].
Влияние ионов металлов на ферментативную активность MrA. Ионы металлов могут оказывать существенное влияние на активность L-АСП. Изучение влияния ионов металлов на функциональные свойства L-АСП экстремофильных микроорганизмов представляет особый интерес, поскольку они могут выступать не только в качестве кофакторов, повышая каталитическую активность, но также способны стабилизировать структуру белка посредством формирования ионных связей.
Показано, что ионы Сu2+ и Zn2+ в концентрации 1.0 мМ способны полностью ингибировать активность в неочищенном экстракте MrA (рис. 4). Снижение активности MrA было установлено также в присутствии 1.0 мМ ЭДТА – 18%, Fe+3 – 5% (рис. 4). В то же время присутствие ионов Ni2+, Ca2+ и Mg2+ в концентрации 1.0 мМ приводило к увеличению активности MrA на 28, 23 и 11% соответственно (рис. 4).
Рис. 4.
Влияние ионов металлов и ЭДТА (%) на активность L-АСП M. roseus P3M-2. Все соединения добавлили в концентрации 1 мМ, за 100% принимали уровень активности, соответствующий активности L-АСП без добавок, н/о – неопределяемые значения.
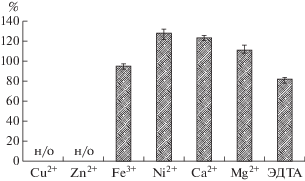
Полученные в работе результаты согласовывались с ранее опубликованными результатами исследований по влиянию ионов металлов на ферментативную активность L-АСП. Так, среди мезофильных гомологов фермента в присутствии Ni2+, Mg2+ отмечали рост активности коммерческой L-АСП из E. coli, добавление Mg2+ увеличивало активность фермента на 330.6% [44]. В то же время для L-АСП Erwinia carotovora наблюдали снижение активности в присутствии дивалентных ионов 1.0 мМ Cu2+, Mg2+ и Ni2+, а также 0.5 мМ Fe3+ и Zn2+, причем добавление 1.0 мМ Cu2+, как и для MrA, приводило к полному ингибированию фермента [45].
Для экстремофильных L-АСП также показано изменение активности в присутствии ионов металлов. Так, повышение активности L-АСП Thermococcus zilligii на 15–20% вызывало добавление 1 мМ Mg2+ и Mn2+, ионы Zn2+, Ва2+, Co2+, Ca2+, Ni2+ и Cu2+ не оказывали существенного влияния на активность фермента. Полученные результаты сопоставимы с результатами изучения L-АСП Thermococcus gammatolerans EJ3 за исключением ионов Zn2+, которые приводили к снижению активности фермента [46, 47].
Ранее установлено, что ионы Mg2+ в концентрациях 1 либо 10 мМ способствовали повышению активности L-АСП T. kodakaraensis на 138 и 127% соответственно, Co2+ и Ni2+ (10 мМ) – полностью ингибировали фермент; Ca2+, Cu2+ и ЭДТА снижали активность до 80, 15 и 90% от исходной соответственно [48].
Таким образом, выявлено, что ионы металлов могут оказывать влияние на активность MrA, аналогично ранее изученным L-АСП мезофильных и эстремофильных штаммов. Активирующий эффект обнаружен при добавлении 1.0 мМ Ni2+, Ca2+ и Mg2+. В работах [49, 50] было показано, что Ca2+, а также Mg2+, Mn2+, Zn2+, Sr2+, связываясь с молекулой белка, играют важную роль в стабилизации структуры, предотвращая денатурацию при высоких температурах.
Экстремофилы, устойчивые к различным факторам внешней среды, являются естественным источником ферментов, которые могут быть использованы в биотехнологии. L-АСП экстремофильных штаммов характеризуются высокой энзиматической активностью и стабильностью в широком диапазоне условий реакции, что определяет перспективы их применения в биомедицине, пищевых технологиях, создании биосенсоров [47, 48, 51].
В настоящей работе представлены результаты гетерологической экспрессии ранее неохарактеризованных L-АСП экстремофилов: психрофильного гриба S. borealis, термоацидофильной кренархеи A. saccharovorans и термофильной бактерии M. roseus. Для экспрессии L-АСП грибного и архейного происхождения в реципиентном штамме E. coli потребовалась оптимизация кодонового состава их нуклеотидных последовательностей.
Показано, что полученные рекомбинантные L-АСП различны по активности, характеру влияния на нее температуры и рН. В предварительном скрининге на неочищенных экстрактах максимальные значения специфической активности для MrA составили 9.6 МЕ/мл при 37°C и рН 9.6; AsA – 2.6 МЕ/мл при 94°C и рН 5.2, для SbA – 0.6 МЕ/мл при 24°C и рН 9.6. Несмотря на низкую активность AsA из ацидофильной археи и SbA и психрофильного гриба, близкие значения ранее были получены для L-АСП ацидофила A. terreus, (4.81 МЕ/мг) [34] и других психрофильных грибов (0.2–1.45 МЕ/мл) [33].
Для L-АСП неочищенного экстракта MrA, проявляющей наибольшую активность, было изучено влияние температуры, рН, а также влияние ионов металлов. Установлено, что максимальная активность MrA проявлялась при 75°С и слабощелочном рН – 9.0. Ионы металлов по-разному влияли на активность фермента: 1 мМ Сu2+ и Zn2+ приводили к полному ингибированию, ионы Fe3+ снижали активность на 5%, а Ni2+, Ca2+ и Mg2+ повышали активность на 28, 23 и 11% соответственно.
Полученные в работе результаты создают предпосылки для дальнейшего изучения свойств и кинетических характеристик очищенных препаратов L-АСП этих экстремофилов.
Работа выполнена при частичной поддержке гранта РФФИ 19-04-01173 и в рамках “Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021–2030 гг.)”.
Список литературы
Solomon B., Parihar N., Ayodele L., Hughes M. // J. Blood Disord. Transfus. 2017. V. 8. P. 24.
Brumano L.P., da Silva F.V.S., Costa-Silva T.A. // Front. Bioeng. Biotechnol. 2018. V. 6. P. 1–22.
Baskar G., Subanjalin J. S., Aiswarya R. // Int. J. Mod. Sci. Technol. 2016. V. 6. № 1. P. 224–229.
Aiswarya R., Baskar G. // Int. J. Food Sci. Technol. 2018. V. 53. P. 491–498.
Baskar G., Aiswarya R. // J. Science of Food and Agriculture. 2018. V. 98. P. 4385–4394.
El-Naggar N.E.A., El-Ewasy S.M., El-Shweihy N.M. // Int. J. Pharmacol. 2014. V. 10. P. 182–199.
Duval M., Suciu S., Ferster A. // Blood. 2002. V. 99. P. 2734–2739.
Matsumoto Y., Nomura K., Kanda-Akano Y. // Leuk. Lymphoma. 2003. V. 44. P. 879–882.
Соколов Н.Н., Эльдаров М.А., Покровская М.В., Александрова С.С., Абакумова О.Ю., Подобед О.В., Мелик-Нубаров Н.С., Кудряшова Е.В., Гришин Д.В., Арчаков А.И. // Биомедицинская химия. 2015. V. 61. № 3. P. 312–324.
Nunes J.C.F., Cristóvão R.O., Freire M.G. // Molecules (Basel, Switzerland). 2020. V. 25. № 24. P. 5827.
Varshosaz J., Anvari N. // IET Nanobiotechnology. 2018. V. 12. № 4. P. 466–472.
Krishnapura P.R., Belur P.D., Subramanya S. // Crit. Rev. Microbiol/ 2016. V. 42. № 5. P. 470–737.
Sarmiento F., Peralta R., Blamey J.M. // Frontiers in Bioengineering and Biotechnology. 2015. V. 3. P. 148.
Van den Burg B. // Curr/Opin/Microbiol/. 2003. V. 6. № 3. P. 213–218.
Hoshino T., Xiao N., Tkachenko O.B. // Mycoscience. 2009. V. 50. № 1. P. 26–38.
Hoshino T., Terami F., Tkachenko O.B., Tojo M., Matsumoto N. // Mycoscience. 2010. V. 51. № 2. P. 98–103.
Mardanov A.V., Svetlitchnyi V.A., Beletsky A.V. // Appl. Environ. Microbiol. 2010. V. 76. № 16. P. 5652–5657.
Podosokorskaya O.A., Kadnikov V.V., Gavrilov S.N. // Environ. Microbiol. 2013. V. 15. № 6. P. 1759–1771.
Tiwari A.K., Rao J.V., Doriya K., Kumar D.S., Qureshi A., Ashok A. // Sci. Rep. 2019. V. 9. P. 1423.
Moguel I.S., Yamakawa C.K., Pessoa A., Mussatto S.I. // Front. Bioeng. Biotechnol. 2020. V. 8. P. 576511.
Chohan S.M., Rashid N. // J. Biosci. Bioeng. 2013. V. 116. P. 438–443.
Altschul S.F., Madden T.L., Schäffer A.A. // Nucleic Acids Research. 1997. V. 25. № 17. P. 3389–3402.
Kumar S., Stecher G., Li M., Knyaz C., Tamura K. // Mol. Biol. Evol. 2018. V. 35. № 6. P. 1547–1549.
Lu G., Moriyama E.N. // Softw. Rev. 2004. V. 5. № 4. P. 378–388.
Mardanov A.V., Beletsky A.V., Kadnikov V.V., Ignatov A.N., Ravin N.V. // Genome Announc. 2014. V. 2. № 1. P. e01175-13.
Pokrovskaya M.V., Aleksandrova S.S., Pokrovsky V.S., Veselovsky A.V., Grishin D.V., Abakumova O.Y., Podo-bed O.V., Mishin A.A., Zhdanov D.D., Sokolov N.N. // Mol. Biotechnol. 2015. V. 57. № 3. P. 192–208.
Wriston J.C., Yellin T.O. // Advances in Enzymology and Related Areas of Molecular Biology. 2006. V. 39. P. 185–248.
Wade H.E., Robinson H.K., Phillips B.W. // J. Gen. Microbiol. 1971. V. 69. № 3. P. 299–312.
Li A.N., Ding A.Y., Chen J., Liu S.A., Zhang M., Li D.C. // Sci. Rep. 2018. V. 8. P. 7915.
Guo J., Coker A.R., Wood S.P. // Acta Cryst. 2017. V. 73. P. 889–895.
Safary A., Moniri R., Hamzeh-Mivehroud M., Dastmalchi. S. // BioImpacts. 2019. V. 9. P. 15–23.
Kelo E., Noronkoski T., Stoineva I.B., Petkov D.D., Mononen I. // FEBS Lett. 2002. V. 528. P. 130–132.
Duarte A.W.F, Barato M.B., Nobre F.S. // Polar Biol. 2018. V. 41. № 12. P. 2511–2521.
Farag A.M., Hassan S.W., Beltagy E.A., El-Shenawy M.A. // Egypt. J. Aquat. Res. 2015. V. 41. № 4. P. 295–302.
Zhgun A.A., Nuraeva G.K., Dumina M.V., Voinova T.M., Dzhavakhiya V.V., Eldarov M.A.// Appl. Biochem. Microbiol. 2019. V. 55. № 3. P. 243–254.
Gunny A.A.N, Arbain D., Jamal P., Gumba R.E. // Saudi J. Biol. Sci. 2015. V. 22. № 4. P. 476–483.
Zhgun A.A., Dumina M.V., Voinova T.M., Dzhavakhiya V.V., Eldarov M.A.// Appl. Biochem. Microbiol. 2018. V. 54. № 2. P. 188–197.
Dumina M.V., Eldarov M.A., Zdanov D.D., Sokolov N.N. // Biomeditsinskaya Khimiya. 2020. V. 66. № 2. P. 105–123.
Hatanaka T., Usuki H., Arima J. // Appl. Biochem. Biotechnol. 2011. V. 163. № 7. P. 836–844.
Borisova A.A., Eldarov M.A., Zhgun A.A., Alexandrova S.S., Omelyanuk N.M., Sokov B.N., Berezov T.T., Sokolov N.N. // Biomeditsinskaya Khimiya. 2003. V. 49. № 5. P. 505–507.
Pritsa A.A., Kyriakidis D.A. // Mol. Cell. Biochem. 2001. V. 216. № 1–2. P. 93–101.
Li J., Wang J., Bachas L.G. // Anal. Chem. 2002. V. 74. № 14. P. 3336–3341.
Curran M.P., Daniel R.M., Guy G.R., Morgan H.W. // Arch. Biochem. Biophys. 1985. V. 241. № 2. P. 571–576.
Han S., Jung J., Park W. // J. Microbiol. Biotechnol. 2014. V. 24. № 8. P. 1091–1104.
Warangkar S.C., Khobragade C.N. // Enzyme Res. 2010. V. 2010. P. 1–10.
Zuo S., Zhang T., Jiang B., Mu W. // Extremophiles. 2015. V. 19. № 4. P. 841–851.
Zuo S., Xue D., Zhang T., Jiang B., Mu W. // J. Mol. Catal. B Enzym. 2014. V. 109. № 14. P. 122–129.
Hong S.J., Lee Y.H., Khan A.R. // J. Basic Microbiol. 2014. V. 163. № 7. P. 826–834.
Li A.N., Ding A.Y., Chen J., Liu S.A., Zhang M., Li D.C. // J. Microbiol. Biotechnol. 2007. V. 17. № 4. P. 324–631.
De Azeredo L.A.I., Freire D.M.G., Soares R.M.A., Leite S.G.F, Coelho R.R.R. // Enzyme Microb. Technol. 2004. V. 34. № 3–4. P. 354–358.
Chohan S.M., Rashid N., Sajed M. // Folia Microbiologica. 2019. V. 64. № 2. P. 313–320.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология