Прикладная биохимия и микробиология, 2021, T. 57, № 3, стр. 274-281
Исследование антимикробных свойств препаратов на основе сополимера малеиновой кислоты, содержащих наночастицы серебра и остатки фенола
Н. А. Самойлова 1, *, М. А. Краюхина 1, Н. М. Анучина 2, Д. А. Попов 2
1 Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
119991 Москва, Россия
2 Национальный медицинский исследовательский центр сердечно-сосудистой хирургии
им. А.Н. Бакулева Минздрава России
121552 Москва, Россия
* E-mail: samoilova.nadezhda@gmail.com
Поступила в редакцию 09.11.2020
После доработки 04.12.2020
Принята к публикации 22.12.2020
Аннотация
Получены водорастворимые полимерные композиты, содержащие два антимикробных компонента – наночастицы серебра и фенольные лиганды. Остатки малеиновой кислоты используемой матрицы – сополимера малеиновой кислоты с этиленом, – позволяли получать нековалентные полимерные коньюгаты п-аминофенола, которые легко термически трансформировались в реакционноспособные остатки малеинового ангидрида, что позволяло синтезировать также ковалентные полимерные комплексы п-аминофенола. Наночастицы серебра получали восстановлением соответствующей соли металла боргидридом натрия в присутствии полимерных коньюгатов фенола. Полученные коллоидные растворы препаратов были активны в отношении ряда условно-патогенных микроорганизмов. Минимальные подавляющие концентрации комплексных препаратов в отношении Escherichia coli составляли 32 и 64 мкг/мл Pseudomonas aeruginosa – 8 и 16 мкг/мл и Candida albicans – 4 и 8 мкг/мл для содержащих наносеребро нековалентных и ковалентных полимерных комплексов п-аминофенола, соответственно. Выявлен выраженный синергетический эффект антибактериальных компонентов препаратов в отношении указанных штаммов микроорганизмов. Фракционные ингибирующие концентрационные индексы полученных препаратов были меньше 0.5.
Возрастающая резистентность к антибиотикам популяционно опасных микроорганизмов по отношению к традиционно применяемым лекарствам представляет собой одну из актуальных проблем современной фармакологии и терапии [1, 2]. Альтернативой традиционным методам борьбы с устойчивыми формами бактерий и грибов (поиск природных и синтез новых антибиотиков) является использование “наноантибиотиков” [3–6]. Основное внимание последнее время уделяется материалам на основе наночастиц органической и, наиболее часто, неорганической природы – это наночастицы ряда металлов и оксидов металлов [3, 7–9].
Большинство разработок касается синтеза, исследования свойств и использования наночастиц серебра (НЧС), как представлено в недавних обзорах [10, 11]. К НЧС нет толерантности у большинства патогенов [11, 12]. С другой стороны, давно известен дешевый и доступный антисептик – фенол [13]. Его использовали в тест-системах при стандартизации бактерицидных агентов с использованием специфических тестовых микроорганизмов [14]. Ранее фенол широко применяли в составе антисептических средств наружного применения, средств для дезинфекции оборудования или ряда органических материалов. В последнее время его использование в медицине и фармации ограничено из-за раздражающих, коррозийных свойств и потенциальной системной токсичности. Негативные свойства фенола значительно снижаются в ряду его низкомолекулярных производных, например, тирозин, ванилин, салициловая кислота, п-аминофенол и т.д., и полимерных (прополис, таннин, лигнин, и др.) производных. При этом ряд синтетических и выделенных из природных источников низкомолекулярных производных фенола сохраняют антибактериальные свойства [15–23]. Показано, например, что использование соединений фенола может быть альтернативной стратегией для нейтрализации растущей устойчивости к противогрибковым препаратам [24]. Известны также эффективные в отношение ряда патогенов полимерные формы фенола, как природного происхождения [25–27], так и синтезированные [28–32].
Комбинирование наносеребра с полимерным производным фенола при выраженном антимикробном эффекте обоих компонентов может привести к снижению действующей концентрации такого комплексного препарата, его токсичности и количества более дорогого компонента системы – наносеребра, что, в свою очередь, может снизить стоимость активной дозы антимикробной субстанции. До настоящего времени такие комплексные препараты не были получены и исследованы.
Ранее были синтезированы полимер-стабилизированные наночастицы серебра и показана перспектива их использования в качестве антимикробных агентов как таковых [33–35], так и в комбинации с традиционными антибиотиками [36], а также препаратов, содержащих специфические маркеры лектинов поверхности клеток патогенов [37]. Применение в качестве полимеров-стабилизаторов наночастиц металлов доступных, нетоксичных сополимеров малеинового ангидрида (кислоты) может иметь ряд преимуществ. Основное – легкость модификации сополимеров в ангидридной форме с получением ковалентных коньюгатов с различными гидроксид- или аминосодержащими лигандами в мягких условиях, без применения конденсирующих средств. Возможно также получение и нековалетных, ионных комплексов с аминосодержащими лигандами при использовании сополимеров в форме сополимеров малеиновой кислоты [37, 38].
Цель настоящей работы – получение полимерных комплексных препаратов, содержащих фенольные группировки и частицы наносеребра, стабилизированные сополимером малеиновой кислоты, а также исследование их антимикробных свойств. В данном исследовании для получения такого комплекса использовано менее токсичное, чем фенол, соединение – пара-аминофенол [39], крупнотоннажный продукт, широко используемый в химической промышленности, фармацевтике (при производстве парацетамола, метола, амидола, глицина) и др.
МЕТОДИКА
Реактивы и материалы. Сополимеры этилена и малеиновой кислоты (ЭМК) получали гидролизом (путем растворения в деионизованной воде с последующим лиофильным высушиванием) чередующегося сополимера этилена и малеинового ангидрида (ЭМА) (“Monsanto”, США, Мw = 2.5 × 104). AgNO3, NaBH4, п-аминофенол (п-АФ) – производства “Sigma-Aldrich” (США). Диметилформамид, NaOH – производства “Реахим” (Россия).
В работе использовали 3 штамма условно-патогенных микроорганизмов (“BD MicrotrolTM”, “Becton Dickinson”, США): грамотрицательные бактерии Pseudomonas aeruginosa (NCTC 12903/ATCC 27853) и Escherichia coli (NCTC 11954/ATCC 35218), а также дрожжеподобный гриб Candida albicans (NCPF3255/ATCC 2091).
Получение полимер-стабилизированных НЧС. Получение ЭМК/Ag0. К свежеприготовленному раствору 96 мг сополимера ЭМК в 448 мл бидистиллированной воды, доведенному 1.0 М NaOH до рН 7.0, прибавляли при интенсивном перемешивании 6.24 мл раствора 0.1 М AgNO3; через 0.5 ч к полимерной соли при интенсивном перемешивании прибавляли свежеприготовленный водный раствор 0.1 М NaBH4 в 2-кратном мольном избытке по отношению к ионам серебра. После перемешивания в течение суток при комнатной температуре препарат подвергали ультрафильтрации (мембрана YM5, Diaflo, “Amicon Corporation”, США) и затем лиофильному высушиванию (–55°С, 0.05 мбар). Препарат содержал 40% (по массе) наносеребра (данные элементного анализа).
Получение коньюгатов НЧС и п-АФ. Получение нековалентного (н/ков) коньюгата ЭМК/Ag0/n-AФ. п-АФ (30 мг) растворяли при перемешивании и нагревании до 50°С в 5 мл бидистиллированной воды, затем добавляли 100 мг ЭМК (предварительно гидролизованного ЭМА путем растворения в деионизованной воде с последующим лиофильным высушиванием), реакционную смесь перемешивали 5 ч при комнатной температуре. К полученному раствору добавляли 95 мл бидистиллированной воды и доводили рН до 7.0 1.0 М раствором NaOH, а затем при перемешивании прибавляли 7 мл раствора 0.1 М AgNO3. Через 5 мин при интенсивном перемешивании прибавляли 14 мл свежеприготовленного водного раствора 0.1 М NaBH4. После перемешивания в течение суток при комнатной температуре препарат подвергали ультрафильтрации (мембрана YM5, DIAFLO, AMICON CORPORATION) и лиофильно высушивали (–55°С, 0.05 мбар). Препарат содержал 30% (по массе) наносеребра и 14.3% (по массе) п-АФ (данные элементного анализа).
Получение ковалентного коньюгата ЭМК/Ag0/п-AФ (ков). К раствору 100 мг ЭМА в 1.5 мл диметилформамида прибавляли при перемешивании 30 мг п-АФ, затем реакционную смесь перемешивали при комнатной температуре в течение суток. Препарат подвергали ультрафильтрации и затем лиофильному высушиванию (–55°С, 0.05 мбар). 70 мг полученного препарата ЭМК/п-AФ (ков) растворяли в 70 мл бидистиллированной воды, доводили до рН 7 с помощью 1М NaOH, затем при перемешивании прибавляли 5 мл раствора AgNO3 (0.1 М); через 5 мин при интенсивном перемешивании прибавляли 10 мл свежеприготовленного водного раствора NaBH4 (0.1 М). После перемешивания в течение суток при комнатной температуре препарат подвергали лиофильному высушиванию (55°С, 0.05 мбар) после ультрафильтрации реакционной смеси. Препарат содержал 35% (весов.) наносеребра и 3.7% (весов.) п-АФ (данные элементного анализа).
Методы исследования коньюгатов. Величину рН среды регистрировали с помощью рН-метра “Fisher Scientific 300 403.1” (США). Оптические спектры регистрировали на спектрофотометре “Hitachi U-5100” (Япония) с использованием кварцевых кювет с длиной оптического пути 1 см. Изображения НЧС были получены на просвечивающем электронном микроскопе “LEO 912 AB” (“Omega”, “Karl Zeiss”, Германия) c магнитным омега спектрометром с энергетическим фильтром, интегрированным непосредственно в оптическую систему инструмента. Напряжение ускорения электронов составляло E = 100 кВ; увеличение: от 80× до 500 000×; разрешение изображения: 0.2–0.34 нм. Для исследований каплю исследуемого раствора помещали на 3 мм медную сетку, покрытую формваром, и высушивали в вакууме.
ИК спектры регистрировали с помощью ИК-спектрометра с Фурье-преобразованием Nicolet Magna IR-720 (США). Данные об элементном составе препаратов получены в лаборатории микроанализа ИНЭОС РАН.
Определение активности НЧС и их коньюгатов в отношении условно-патогенных микроорганизмов. Определение минимальной подавляющей концентрации (МПК) синтезированных препаратов в отношении исследуемых штаммов осуществляли методом серийных микроразведений в триптиказо-соевом бульоне (“Bio-Rad Laboratories”, США) на планшете по стандартной методике (Методические указания МУК 4.2. 1890-04 “Определение чувствительности микроорганизмов к антибактериальным препаратам”). Тестирование проводили в объеме 0.2 мл с использованием стерильного 96-луночного планшета для иммунологических исследований. Конечная концентрация клеток исследуемого микроорганизма – 105 КОЕ/мл. Триптиказо-соевый бульон разливали по 0.1 мл в каждую лунку планшета. Количество лунок определялось необходимым диапазоном разведений, последняя лунка оставлялась для постановки отрицательного контроля. В первую лунку с 0.1 мл бульона вносили и 0.1 мл исследуемого препарата. Тщательно перемешивали смесь и затем переносили 0.1 мл смеси во вторую лунку, содержащую первоначально 0.1 мл бульона. Процедуру повторяли до приготовления необходимого ряда разведений.
Для инокуляции использовали суспензию клеток тестируемых микроорганизмов, приготовленную на питательном бульоне. По 0.1 мл инокулята вносили в лунку с 0.1 мл исследуемого препарата соответствующего разведения, последняя лунка была с питательным бульоном без исследуемого препарата (положительный контроль). Приготовленную суспензию проверяли на чистоту путем высева на плотные питательные среды, контролировали также рост культуры в бульоне без препарата (положительный контроль).
Планшеты, закрытые стерильной пленкой, инкубировали при температуре 35°С в течение 24 ч. При использовании C. albicans время инкубирования составляло 48 ч. Рост культуры в присутствии препаратов сравнивали с ростом культуры в референтной ячейке без препарата (положительный контроль) при визуальном контроле планшета в проходящем свете. МПК определяли по наименьшей концентрации препарата в ячейке, подавляющей видимый рост тестируемого микроорганизма.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез препаратов. Полимерный наноконьюгат серебра (ЭМК/Ag0) получали по ранее описанной нами методике восстановления катионов серебра боргидридом натрия в присутствии полимера-стабилизатора – гидролизованного сополимера малеинового ангидрида с этиленом [40].
Содержащий наносеребро нековалентный коньюгат п-аминофенола (ЭМК/Ag0/п-AФ (н/ков.) получали в две стадии: получение полимерной соли карбоксилсодержащего полимера и п‑ам-инофенола (–CH2–CH2–CHCOOH–CHCOO–) (${\text{NH}}_{{\text{3}}}^{ + }$C6H4OH)–)n и введение в полимерный коньюгат наночастиц серебра по ранее описанной методике получения ЭМК/Ag0 [40]. При этом растворимость п-аминофенола в воде повышалась в присутствии карбоксил-содержащего полимера.
Для получения ковалентного композита ЭМК/ Ag0/п-AФ (ков.) в начале проводили термическую активацию сополимера, затем реакционноспособные ангидридные группы сополимера образовывали амидную связь с аминогруппами п‑аминофенола (–CH2–CH2–CHCOOH–CHCO) (NHC6H4OH)–)n. Далее, аналогично вышеописанному, полученный коньюгат использовали в качестве полимерного стабилизатора при формировании наночастиц серебра. Ранее фенольный лиганд в сополимер малеинового ангидрида с этиленом вводили более сложным путем: в ангидридную форму сополимера вначале вводили диамины – этилендиамин или гексаметилендиамин, а затем иммобилизовывали на аминосодержащий полимер 4-гидроксибензальдегид [31].
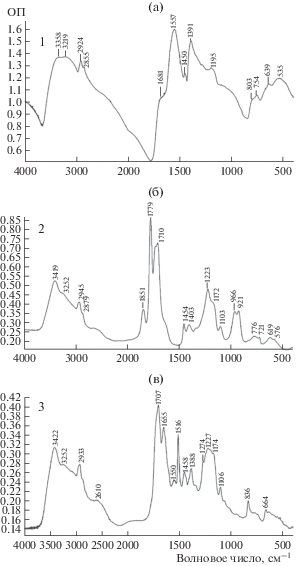
Характеристика препаратов. ИК-спектры образцов исходного сополимера, его активированной формы и ковалентного коньюгата с п-аминофенолом представлены на рис. 1.
В ИК-спектре ЭМК (рис. 1а) присутствовали колебания карбонилов ионизированных карбоксильных группы ν C=O 1395, 1559 см–1. Термическая обработка сополимера – ЭМА (рис. 1б) приводила к появлению в спектре полос при 1779 и 1710 см–1, соответствующих циклической структуре янтарного ангидрида. Характерные колебания амидной связи при 1655 см–1 (Амид I), 1551 см–1 (Амид II) обнаружены в спектре ЭМК/п-АФ (ков.), 1516 см–1 – С=С связь, 1227 см–1 С–О – полоса спиртовой группы (рис. 1в).
ПЭМ-изображения НЧС в полученных препаратах представлены на рис. 2. Форма НЧС во всех исследованных образцах золей близка к сферической. Диаметр частиц серебра для всех образцов был в диапазоне 2–10 нм. Форма НЧС во всех исследованных образцах золей близка к сферической. Диаметр частиц серебра для всех образцов был в диапазоне 2–10 нм.
Рис. 2.
ПЭМ микрофотографии частиц нанокомплекса серебра ЭМК/Ag0 (а), композитов ЭМК/Ag0/п-AФ (н/ков.) (б) и ЭМК/Ag0/п-AФ (ков.) (в).

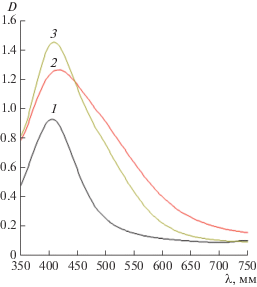
На рис. 3 представлены оптические спектры препаратов НЧС. Значения максимума пика плазмонного резонанса для всех использованных коллоидных препаратов, содержащих наночастицы серебра варьировалось от 406 до 420 нм при близких значениях диаметров НЧС (ПЭМ).
Действие полученных композитов на условно-патогенные микроорганизмы. Данные по активности препарата наночастиц серебра и композитов в отношении грамотрицательных E. coli и P. aeruginosa, а также дрожжеподобного гриба C. albicans,- представлены в табл. 1. Значения МПК определяли как наименьшие концентрации антимикробного агента, ингибирующие видимый рост микроорганизма, при использовании метода серийных микроразведений.
Таблица 1.
Данные по составу и активности препаратов в отношении исследованных штаммов
| Препарат | Содержание в препарате активного компонента, % | МПК, мкг/мл | ФИК | ФИКИ | ||||
|---|---|---|---|---|---|---|---|---|
| Препарат | Ag0 в препарате* | п-АФ в препарате* | ФИК Ag0 | ФИК п-АФ | ||||
| Ag0 | п-АФ | |||||||
| E. coli | ||||||||
| п-АФ | – | 100 | 64 [41] | – | 64 | – | – | – |
| ЭМК/Ag0 | 40 | – | 256 | 102.4 | – | – | – | – |
| ЭМК/Ag0/п-AФ (н/ков.) | 30 | 14.3 | 32 | 9.6 | 4.58 | 0.094 | 0.071 | 0.165 |
| ЭМК/Ag0/п-AФ (ков.) | 35 | 3.7 | 64 | 22.4 | 2.37 | 0.22 | 0.037 | 0.257 |
| P. aеruginosa | ||||||||
| п-АФ | – | 100 | 64 [41] | – | 64 | – | – | – |
| ЭМК/Ag0 | 40 | – | 64 | 25.6 | – | – | – | – |
| ЭМК/Ag0/п-AФ (н/ков.) | 30 | 14.3 | 8 | 2.4 | 1.14 | 0.09 | 0.018 | 0.108 |
| ЭМК/Ag0/п-AФ (ков.) | 35 | 3.7 | 16 | 5.6 | 0.59 | 0.22 | 0.009 | 0.229 |
| C. albicans | ||||||||
| п-АФ | – | 100 | 100 [41] | – | 100 | – | – | – |
| ЭМК/Ag0 | 40 | – | 32 | 12.8 | – | – | – | – |
| ЭМК/Ag0/п-AФ (н/ков.) | 30 | 14.3 | 4 | 1.2 | 0.57 | 0.094 | 0.006 | 0.100 |
| ЭМК/Ag0/п-AФ (ков.) | 35 | 3.7 | 8 | 2.8 | 0.30 | 0.22 | 0.003 | 0.223 |
Согласно полученным данным все использованные препараты проявляли активность в отношение всех исследованных микроорганизмов. Поскольку содержание наносеребра и остатков п‑аминофенола в препаратах различалось, сравнение активности синтезированных препаратов проводили с учетом количества действующего вещества в образцах (МПК наносеребра и п-АФ в препарате). Антимикробные свойства препаратов наносеребра на основе полимеров-стабилизаторов – сополимеров малеиновой кислоты, – были продемонстрированы нами ранее [35], также были исследованы такие препараты в комбинации с антибиотиками [36, 37]. С другой стороны, описаны антимикробные свойства полимерных производных п-АФ [31]. Ранее комплексные препараты, содержащие наночастицы серебра и остатки п-АФ (лиганды фенола), не были получены и их антимикробные свойства не исследовались.
Для оценки степени взаимного влияния антимикробных компонентов: п-аминофенола (А) и наночастиц серебра, стабилизированных сополимером этилена и малеиновой кислоты (В) – в их коньюгатах рассчитаны фракционные ингибирующие концентрации (ФИК) и фракционные ингибирующие концентрационные индексы (ФИКИ):
Расчетные данные ФИКИ для полученных препаратов приведены в табл. 1.
Значения ФИКИ интерпретируются различными исследователями по-разному [42–48], но все исследователи придерживались точки зрения, что взаимодействие компонентов системы определялось как синергетическое в тех случаях, когда значения ФИКИ были меньше или равны 0.5. Для всех исследованных образцов рассчитанные значения ФИКИ попадают в этот диапазон, что свидетельствует о том, что введение в препарат наносеребра фенольных лигандов увеличивает их активность в отношении микроорганизмов различных классов. По-видимому, это связано с разными механизмами воздействия наносеребра и фенольного компонента на клетки патогена. Так, показано, что наночастицы серебра при контакте с клетками бактерий образуют свободные радикалы, которые обладают способностью повреждать клеточную мембрану. Также наночастицы могут высвобождать ионы серебра, и эти ионы могут взаимодействовать с тиольными группами многих жизненно важных ферментов и инактивировать их, а также разрушать ДНК, что приводит к гибели клеток [49]. Фенольные соединения, в отличие от традиционных антибиотиков, обладают неспецифическими антимикробными свойствами, воздействуя на бактериальную стенку, цитоплазму и ядро на уровне хромосом [13]. Кроме того, поскольку клеточная мембрана обладает слабым отрицательным зарядом, введение фенольного лиганда снижает отрицательный заряд частиц нанокомпозита, что также может способствовать его поглощению клеткой микроорганизма.
Препарат, содержащий солевую форму п-АФ ЭМК/Ag0/п-AФ (н/ков.) был несколько более активен, чем композит с ковалентным присоединением п-АФ, что, по-видимому, связано большей конформационной подвижностью лиганда, а также возможной диссоциацией нековалентного комплекса с отщеплением данного лиганда.
Таким образом, в настоящей работе были получены водорастворимые комплексные препараты, содержащие два антимикробных компонента – наночастицы серебра и остатки п-АФ. Полимерная соль п-АФ экранирует аминогруппу и повышает стабильность п-АФ к окислению в его коньюгате. Остатки малеиновой кислоты используемого сополимера легко термически трансформируются в реакционноспособные остатки малеинового ангидрида, что позволяет синтезировать кроме нековалентных, также и ковалентные комплексы аминосодержащего лиганда. Поскольку аминогруппа п-аминофенола вовлечена во взаимодействие с полимерной матрицей, на полимерной матрице таким образом позиционируются остатки фенола. Синтез препаратов на всех стадиях – введение фенольного лиганда и формирование наночастиц серебра, прост в осуществлении, условия реакции легко воспроизводимы. Полученные препараты после очистки и высушивания могут сохраняться в сухом виде длительное время без потери свойств. Коллоидные растворы полученных препаратов были активны в отношении ряда условно-патогенных микроорганизмов. Выявлен синергетический эффект антибактериальных компонентов в использованных препаратах в отношении E. coli, P. aeruginosa и C. albicans. Наличие в коньюгате более дешевого компонента системы – п-АФ, – позволило снизить активную дозировку препарата, при этом снижалось также содержание более дорогого компонента системы – наносеребра. Предложенный вариант комбинации антимикробных агентов может быть расширен при использовании в системе наноформ иных металлов или оксидов металлов с бактерицидными свойствами.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Список литературы
Михалёва Т.В., Захарова О.И., Ильясов П.В. // Прикл. биохимия и микробиология. 2019. Т. 55. № 2. С. 124–132.
Magiorakos A.-P., Srinivasan A., Careyetal R.B // Clin. Microbiol. Infect. 2012. V. 18. № 3. P. 268–281.
Beyth N., Houri-Haddad Y., Domb A., Khan W., Hazan R. // Evidence-Based Complementary and Alternative Medicine. 2015. V. 2015. Article ID 246012. https://doi.org/10.1155/2015/246012
Pelgrift R.Y., Friedman A.J. // Adv. Drug Deliv. Rev. 2013. V. 65. № 13–14. P. 1803–1815.
Huh A.J., Kwon Y.J. // J. Control Release. 2011. V. 156. № 2. P. 128–145.
Hemeg H.A. // Int. J. Nanomedicine. 2017. V. 12. P. 8211–8225.
Rudramurthy G.R., Swamy M.K., Sinniah U.R., Ghasemzadeh A. // Molecules. 2016. V. 21. № 7. P. 836. https://doi.org/10.3390/molecules21070836
Jamdagni P., Sidhu P.K., Khatri P., Nehra K., Rana J.S. // Advances in Animal Biotechnology and its Applications. /Eds. S.K. Gahlawat, J.S., Duhan, R.K. Salar, P. Siwach, S. Kumar, P. Kaur. Springer Nature Singapore Pte Ltd., 2018. P. 143–160.
Nilesh K., Umama Y., Khan M. G., Kkushwah M., Ayush K. // IJETIR. 2019. V. 6. № 6. P. 140–146.
Al-Hasnawy H.H. // Int. J. Psychosoc. Rehabilitation. 2020. V. 24. № 5. P. 4217–4224.
Medici S., Peana M., Nurchi V.M., Zoroddu M.A. // J. Med. Chem. 2019. V. 62. № 13. P. 5923–5943.
Franci G., Falanga A., Galdiero S., Palomba L., Rai M., Morelli G., Galdiero M. // Molecules. 2015. V. 20. № 5. P. 8856–8874.
Sabbineni J. // JOMC. 2016. V. 3. № 2. P. 182–188.
Nandhini R., Sumathy V.J.H. // IJCTPR. 2016. V. 4. № 6. P. 355–361.
Lucchini J.J., Corre J., Cremieux A. // Res. Microbiol. 1990. V. 141. P. 499–510.
Cronin M.T.D., Schultz T.W. // Chemosphere. 1996. V. 32. № 8. P. 1453–1468.
Puupponen-Pimia R., Nohynek L., Meier C., Kahkonen M., Heinonen M., Hopia A., Oksman-Caldentey K.M. // J. Appl. Microbiol. 2001. V. 90. № 4. P. 494507.
Maddox C.E., Laur L.M., Tian L. // Curr. Microbiol. 2010. V. 60. № 1. P. 53–58.
Alves M.J., Ferreira I.C., Froufe H.J., Abreu R. M., Martins A., Pintado M. // J. Appl. Microbiol. 2013. V. 115. № 2. P. 346–357.
Villalobos M.C., Serradilla M.J., Martin A., Ordiales E., Ruiz-Moyano S., Cordoba M.G. // J. Sci. Food Agric. 2016. V. 96. P. 2116–2124.
Pinheiro P.F., Menini L.A.P., Bernardes P.C., Saraiva S.H., Carneiro J. W. M., Costa A.V. et al. // J. Agric. Food Chem. 2018. V. 66. P. 323–330.
Walsh D.J., Livinghouse T., Goeres D.M., Mettler M., Philip S.S. // Front. Chem. 2019. V. 7. Article 653. https://doi.org/10.3389/fchem.2019.00653
Teodoro G.R., Ellepola K., Seneviratne C.J., Koga-Ito C.Y. // Front. Microbiol. 2015. V. 6. Article 1420. https://doi.org/10.3389/fmicb.2015.01420
Negri M., Salci T.P., Shinobu-Mesquita C.S., Capoci I.R., Svidzinski T.I., Kioshima E.S. // Molecules. 2014. V. 19. P. 2925–2956.
Tafesh A., Najami N., Jadoun J., Halahlih F., Riepl H., Azaizeh H. // Evid. Based Complementary Altern. Med. 2011. P. 1–9. Article ID 431021. https://doi.org/10.1155/2011/431021
Shahzad M., Millhouse E., Culshaw S., Edwards C.A., Ramage G., Combet E. // Food Funct. 2015. V. 6. P. 719–729.
Coppo E., Marchese A. // Curr. Pharm Biotechnol. 2014. V. 15. P. 380–390.
Jeong J.-H., Byoun Y.-S., Lee Y.-S. // React. Funct. Polym. 2002. V. 50. P. 257–263.
Kenawy E.R., Abdel-Fattah Y.R. // Macromol.Biosci. 2002. V. 2. P. 261–266.
Nonaka T., Uemura Y., Ohse K., Jyono K., Kurihara S. // J. Appl. Polym. Sci. 1997. V. 66. P. 1621–1630.
El-Newehy M.H., El-Hamshary H., Alamri A., Al-Deyab S.S. // Int. J. Polym. Mater. 2014. V. 63. № 11. P. 563–575.
Park E.S., Moon W.S., Song M.J., Kim M.N., Chung K.H., Yoon J.S. // Int. Biodeter. Biodegr. 2001. V. 47. P. 209–214.
Samoilova N., Kurskaya E., Krayukhina M., Askadsky A., Yamskov I. // J. Phys. Chem. B. 2009. V. 113. № 11. P. 3395–3403.
Самойлова Н.А., Краюхина М.А., Попов Д.А., Анучина Н.М., Ямсков И.А. // Биотехнология. 2015. № 1. С. 75–84.
Самойлова Н.А., Краюхина М.А., Вышиванная О.В., Благодатских И.В., Попов Д.А., Анучина Н.М., Ямсков И.А. // Изв. АН. Сер. хим. 2018. № 6. С. 1010–1017.
Samoilova N., Krayukhina M., Popov D., Anuchina N. // Monatsh. Chem. 2019. V. 150. № 12. P. 2071–2080.
Samoilova N.A., Krayukhina M.A., Popov D.A., Anuchina N.M., Piskarev V.E. // Biointerface Res. Appl. Chem. 2018. V. 8. № 1. P. 3095–3099.
Samoilova N.A., Krayukhina M.A., Babushkina T.A., Yamskov I.A., Likhosherstov L.M., Piskarev V.E. // J. Appl. Polym. Sci. 2017. V. 134. № 16. P. 1–12. https://doi.org/10.1002/app44718
Song H., Chen T.S. // J. Biochem. Mol. Toxicol. 2001. V. 15. № 1. P. 34–40.
Самойлова Н.А., Благодатских И.В., Курская Е.А., Краюхина М.А., Вышиванная О.В., Абрамчук C.С., Аскадский А.А., Ямсков И.А. // Коллоидный журн. 2013. Т. 75. № 4. С. 1–13.
Hellal A., Chafaa S., Chafai N. // International J. Scientific & Engineering Research. 2015. V. 6. № 8. P. 1622–1627.
Liu W., Li L.P., Zhang J.D. // PLoS One. 2014. https://doi.org/10.1371/journal.pone.0103442
Gupta A., Saleh N. M., Das R., Landis R. F., Bigdeli A., Motamedchaboki K., Campos A.R., Pomeroy K., Mahmoudi M., Rotello V.M. // Nano Futures. 2017. 1:015004.https://doi.org/10.1088/2399-1984/aa69fb
Konaté K., Mavoungou J.F., Lepengué A.N., Aworet-Samseny R.R.R., Hilou A., Souza A., Dicko M.H., Bat-chi B.M. // Ann. Clin. Microbiol. Antimicrob. 2012. 11:18. https://doi.org/10.1186/1476-0711-11-18
Sadiki M., Balouipi M., Barkai H., Maataoui H., Ibnsoudkoraichi S., Elabed S. // Intern. J. Pharm. Pharm. Sci. 2014. V. 6. № 6. P. 121–124.
Choi S.-M., Jang E.-J., Cha J.-D. // Advanc. Biosci. Biotechnol. 2015. V. 6. P. 275–285.
Cha J.D., Lee J.H., Choi K.M., Choi S.M., Park J.H. // Evid. Based Complement Alternat. Med. 2014. 2014:450572. https://doi.org/10.1155/2014/450572
Bassole I.H.N., Juliani H.R. // Molecules. 2012. V. 17. № 4. P. 3989–4006.
Prabhu S., Poulose E.K. // Int. Nano Lett. 2012. V. 2. № 32. https://doi.org/10.1186/2228-5326-2-32
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология