Прикладная биохимия и микробиология, 2021, T. 57, № 1, стр. 3-23
Жасмонатный сигналинг и адаптация растений к действию абиотических стрессоров (обзор)
Ю. Е. Колупаев 1, *, Т. О. Ястреб 1
1 Харьковский национальный аграрный университет им. В.В. Докучаева
62483 Харьков, Украина
* E-mail: plant.biology.knau@gmail.com
Поступила в редакцию 16.04.2020
После доработки 08.06.2020
Принята к публикации 02.09.2020
Аннотация
Рассмотрена роль жасмоновой кислоты (ЖАК) и жасмонатного сигналинга в регуляции адаптивных реакций растений на действие стрессоров. Кратко описан синтез ЖАК у растений и основной путь трансдукции жасмонатного сигнала. Рассматривается влияние ЖАК на содержание в клетках других сигнальных посредников (ионов кальция, активных форм кислорода, оксида азота, сероводорода и монооксида углерода). Впервые обобщаются данные об участии компонентов жасмонатного сигналинга (в частности, белков COI1 и JIN1/MYC2) в реализации физиологических эффектов сигнальных посредников-газотрансмиттеров. Приводятся сведения об изменении эндогенного содержания ЖАК при действии стрессоров и влиянии экзогенной ЖАК и ее производных на устойчивость растений. Анализируются спектр жасмонатзависимых защитных реакций растений и механизмы их индуцирования. Особое внимание уделяется роли ЖАК в активации антиоксидантной системы и регуляции состояния устьиц в стрессовых условиях.
Формирование адаптивных реакций растений происходит с участием сигнальных посредников и фитогормонов, которые объединены в регуляторную сеть и пребывают в сложном функциональном взаимодействии. Несмотря на стремительное накопление сведений о сигналинге в клетках и организме растений в целом, представления о взаимодействии компонентов сигнальных систем остаются весьма фрагментарными. При этом доступные методические подходы обычно позволяют исследовать лишь отдельные фрагменты сигнальной сети, функционирующие в определенных экспериментальных условиях. Тем не менее, анализ и обобщение таких данных приближает к пониманию механизмов формирования физиологических реакций на те или иные воздействия за счет функциональных связей между сигнальными и гормональными посредниками.
Одной из ключевых групп “стрессовых” фитогормонов являются жасмоновая кислота (ЖАК) и ее производные, представленные метилжасмонатом (Ме-ЖАК) и конъюгатом жасмоната с изолейцином (Иле-ЖАК) [1]. Также значительной физиологической активностью обладает предшественник ЖАК – 12-оксофитодиеновая кислота, сигнальное действие которой перекрывается с ЖАК, но может быть и отличным от ее эффектов [2]. Поскольку ЖАК, ее предшественники и производные являются продуктами липоксигеназного каскада, их рассматривают в ряду представителей оксилипинов – физиологически активных молекул, образующихся из ненасыщенных жирных кислот во всех аэробных организмах [3]. При этом среди многочисленных продуктов данного каскада именно ЖАК и ее производным принадлежит доминирующая роль в силу их наиболее высокой биологической активности и универсального присутствия у всех видов растений – от водорослей до покрытосеменных.
ЖАК интенсивно изучается уже более четверти века [4]. Значительное внимание уделяется ее исследованию как фактора регуляции роста и развития растений [5, 6], а также как сигнала, активирующего экспрессию защитных генов растений в процессе патогенеза [7]. Менее изученными остаются роль и механизмы действия ЖАК при адаптации растений к абиотическим стрессовым факторам. Это касается прежде всего сигнальных посредников, вовлеченных в процессы активации адаптивных реакций растений с участием ЖАК. Несмотря на то, что природа ключевых белков, задействованных в рецепции жасмонатного сигнала и его трансдукции в генетический аппарат в целом известна [8], открытыми остаются вопросы взаимодействия собственно жасмонатного сигнала с сигналами ключевых клеточных посредников: ионов кальция, активных форм кислорода (АФК), оксида азота (NO) и других. Актуальность выяснения такого взаимодействия усиливается в связи с расширением спектра сигнальных соединений растительных клеток, в частности, с развитием представлений о роли газотрансмиттеров – сигнальных газообразных молекул [9, 10]. Предметом настоящего обзора явился анализ данных о жасмонатиндуцируемых защитных реакциях растений на действие абиотических стрессоров, реализующихся с участием низкомолекулярных посредников, а также вовлечении компонентов жасмонатного сигналинга в реализацию эффектов других регуляторных молекул.
КРАТКИЕ СВЕДЕНИЯ О СИНТЕЗЕ ЖАК
В течение последних десятилетий биосинтез ЖАК был достаточно подробно охарактеризован у различных видов двудольных и однодольных растений и описан в ряде специальных обзоров [11–14]. В связи с этим ниже кратко будут изложены основные представления. Синтез ЖАК происходит в результате последовательного превращения непредельных жирных кислот под влиянием ферментов, локализованных в пластидах, пероксисомах и цитоплазме [11].
В ответ на действие внутренних или внешних сигналов фосфолипазы, локализованные в мембранах хлоропластов, отщепляют линоленовую (С18:3) кислоту от липидной основы [13]. Под действием 13-липоксигеназы она окисляется до 13‑гидропероксилиноленовой кислоты [12]. Последняя дегидрируется алленоксидсинтазой с образованием 12-оксофитодиеновой кислоты (12-ОФДК) – первого пентациклического производного октадекатриенового пути. До недавнего времени было неизвестно, как 12-ОФДК поступает в пероксисомы, где проходят заключительные стадии синтеза ЖАК. В настоящее время считается, что 12-ОФДК транспортируется в пероксисомы с помощью так называемого АТФ-связывающего кассетного белка-транспортера CTS [15]. Нарушение импорта 12-ОФДК из цитозоля у мутантов по гену этого белка cts приводит к повышению содержания этой сигнальной молекулы в цитозоле и активации самостоятельного сигнального пути 12-ОФДК [16]. В то же время, поскольку у растений этого генотипа синтез ЖАК, хотя и в меньших количествах, происходит, считают возможным и попадание 12-ОФДК в пероксисомы путем пассивной диффузии [15].
После поступления в пероксисомы 12-ОФДК превращается 12-ОФДК-редуктазой в 12-оксофитоеновую кислоту. Синтез ЖАК происходит в результате трех реакций β-окисления 12-оксофитоеновой кислоты, которые катализируются тремя различными ферментами: ацил-КоА-оксидазой, так называемым мультифункциональным белком и 3-кетоацил-КоА-тиолазой [17].
Синтезированная в пероксисомах ЖАК высвобождается в цитоплазму, где может превращаться в более чем 30 различных активных и неактивных производных, в зависимости от химической модификации карбоксильной группы, боковой цепи пентенила или пентанонового кольца [5]. Среди ряда метаболитов свободной ЖАК основными биологически активными формами считаются цис-жасмон, Me-ЖАК и Иле-ЖАК [5, 13]. Цис-жасмон образуется путем декарбоксилирования ЖАК [18]. Летучий Me-ЖАК синтезируется с помощью карбоксилметилтрансферазы ЖАК [19]. Иле-ЖАК образуется под влиянием JAR1-синтазы (jasmonate amino acid synthetase) [20]. Именно Иле-ЖАК необходим для дальнейшей передачи сигналов ЖАК [5].
КАНОНИЧЕСКИЙ ПУТЬ ПЕРЕДАЧИ СИГНАЛА ЖАСМОНАТА
В цитоплазме растительных клеток наиболее биологически активной формой жасмонатов является Иле-ЖАК [5, 21]. Именно эта форма жасмоната транспортируется в ядро [5]. Следует также отметить изученные эффекты транспорта Иле-ЖАК и Me-ЖАК на большие расстояния через сосудистые пучки и/или передачу по воздуху [5, 22, 23]. Ме-ЖАК рассматривается в качестве мобильного сигнала, обеспечивающего контакты между частями растения, отдельными растениями, а возможно, и взаимодействие растений разных видов [7]. Высокая летучесть Ме-ЖАК и его способность легко проникать через мембраны была установлена еще 30 лет тому назад [24]. Считается, что Ме-ЖАК может быть “сигналом тревоги” для соседних с испытавшими действие стрессора клеток растений. При этом Ме-ЖАК, поступивший в клетки растений, гидролизуется, и образующаяся ЖАК превращается в Иле-ЖАК. В целом, эффекты системной передачи жасмонатного сигнала у растений рассматриваются в основном в контексте формирования их устойчивости к патогенам.
В отсутствие действия на растения стресс-факторов или других стимулов содержание Иле-ЖАК низкое, в связи с чем транскрипционные факторы жасмонатного сигналинга находятся в репрессированном состоянии [5]. Под влиянием стрессоров или иных стимулов усиливается образование ЖАК и ее превращение в Иле-ЖАК в цитозоле с последующим транспортом этого конъюгата в ядро (рис. 1). Недавно установлено, что у Arabidopsis thaliana субклеточная локализация ЖАК регулируется с помощью белка-переносчика AtJAT1 [15, 25]. Этот белок переносит Иле-ЖАК через ядерную мембрану. Помимо этого, он локализован и в плазматической мембране и при чрезмерном повышении концентрации ЖАК в цитоплазме переносит ее молекулы во внешнее пространство для десенсибилизации сигнала ЖАК.
Рис. 1.
Основной путь трансдукции жасмонатного сигнала. JAR1 – JAR1-синтаза (jasmonate amino acid synthetase); JAT1 – белок-переносчик Иле-ЖАК (jasmonic acid transfer protein1); SCF/COI1: SCF – Skp1, Cullin, F-box proteins, COI1 – убиквитинлигазный комплекс, участвующий в деградации белков в 26S протеасоме (coronatine insensitive1); JAZ – репрессор жасмонатного сигналинга (jasmonate ZIM-domain protein); MYCs – транскрипционные факторы семейства MYC. Пояснения в тексте.
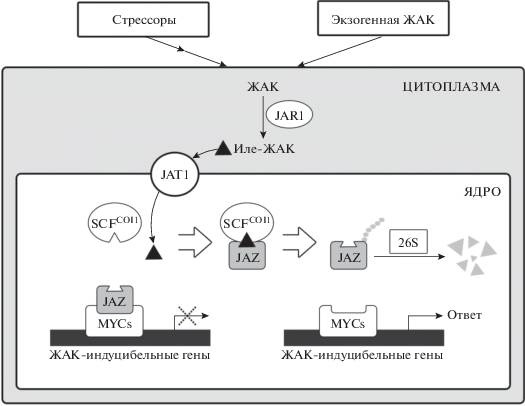
Установлено, что Иле-ЖАК – единственная форма жасмонатов, способная к связыванию с F‑box-белком (COI1) [26]. ЖАК, Ме-ЖАК и 12‑оксофитодиеновая кислота такой способностью не обладают. F-box-белок является частью SCF/COI1 – убиквитинлигазного комплекса, участвующего в деградации белков в 26S протеасоме. COI1-белок определяет субстратную специфичность SCF-типа E3 убиквитинлигазы [7]. После взаимодействия Иле-ЖАК с комплексом SCF/COI1 последний приобретает способность к убиквитинированию белков семейства JAZ (Jasmonate-Zim-Domain) – репрессоров жасмонатного сигналинга. JAZ белки содержат два домена, ZIM и Jas, и эти домены опосредуют взаимодействие JAZ с другими белками. Домен ZIM отвечает за его димеризацию и взаимодействие с NINJA, который соединяет супрессор транскрипции TOPLESS с передачей сигналов ЖАК, а домен Jas опосредует JAZ-COI1-взаимодействие [27, 28]. Протеасомная деградация JAZ приводит к высвобождению MYC2 из JAZ‑M--YC2 комплекса [6].
Ранее считалось, что только белок MYC2 может напрямую взаимодействовать с белками JAZ. Однако в последние годы было показано, что белки MYC3 и MYC4 также взаимодействуют с белками JAZ in vivo и in vitro, имея сходную ДНК-связывающую специфичность с MYC2 и действуют синергически с MYC2 [29].
Наряду с семейством MYC к жасмонату могут быть чувствительны и транскрипционные факторы семейства MYB. Установлено, что они, как и белки MYC, могут непосредственно репрессироваться белками JAZ, а их высвобождение из JAZ, происходящее под действием сигнала ЖАК, может активировать их целевые гены [8]. К чувствительным к жасмонату относятся и транскрипционные факторы семейства NAC. Относящиеся к этому семейству транскрипционные факторы ATAF1 и ATAF2 у A. thaliana индуцируются сигналами ЖАК и участвуют в реакциях, обеспечивающих развитие устойчивости растений к засухе, засолению и агентам окислительного стресса [8, 30].
Также получены экспериментальные доказательства индуцирования транскрипции многих генов ERF под влиянием сигналов ЖАК. Эти гены в основном причастны к реакциям растений на действие патогенов, связанным с синтезом монотерпенов, индолов и алкалоидов [31, 32]. Наконец, к жасмонат-регулируемым относятся и некоторые гены большого семейства WRKY. В частности, показана жасмонатная регуляция такого важного для адаптации к абиотическим факторам гена, как WRKY70 [33], а также WRKY22, WRKY50, WRKY57 и WRKY89 [8]. Таким образом, помимо MYC, ЖАК может влиять на экспрессию генов еще, как минимум, четырех больших семейств.
ВЛИЯНИЕ ЖАК НА СОДЕРЖАНИЕ ВНУТРИКЛЕТОЧНЫХ СИГНАЛЬНЫХ ПОСРЕДНИКОВ В РАСТИТЕЛЬНЫХ КЛЕТКАХ
В реализации физиологических эффектов ЖАК наряду с рассмотренными выше специфическими белками участвуют такие универсальные внутриклеточные сигнальные посредники, как Ca2+, АФК, NO и некоторые другие.
Показано, что обработка клеток листьев арабидопсиса 100 мкМ ЖАК вызывала повышение концентрации кальция в цитозоле [34]. При этом индуцируемое ЖАК усиление экспрессии гена VSP угнеталось нифедипином и гепарином, что, по мнению авторов, указывает на роль поступления кальция как из апопласта, так и из внутриклеточных компартментов в реализации эффектов ЖАК. Такое же нивелирующее действие на ЖАК-индуцированную экспрессию гена VSP оказывал и антагонист кальмодулина W-7, что свидетельствует о его значении для реализации эффектов ЖАК. Еще раньше с использованием ингибиторного метода на растениях арабидопсиса было установлено участие внутриклеточного кальция и кальмодулина в ЖАК-индуцированном синтезе белков ответа на раневой стресс семейства JR [35]. Также показано, что индуцируемое Ме-ЖАК накопление PR- (pathogenesis related) белков и фитоалексинов у растений винограда зависело от поступления кальция через кальциевые каналы плазматической мембраны [36]. Повышение теплоустойчивости клеток колеоптилей пшеницы, индуцируемое ЖАК, в значительной степени угнеталось обработкой хелатором внеклеточного кальция ЭГТА, что указывает на роль апопластного кальция в реализации стресс-протекторного действия ЖАК [37]. Вызываемое Ме-ЖАК закрывание устьиц также является кальцийзависимым процессом [38] (см ниже). Наконец, установлена зависимость от кальциевого гомеостаза еще одного известного эффекта ЖАК – индуцирования образования латеральных корней. На растениях риса показано, что хелаторы Ca2+, блокаторы кальциевых каналов и антагонисты кальмодулина снижали такой эффект Ме-ЖАК [39].
В трансдукции сигнала ЖАК могут быть задействованы и АФК. Так, показано усиление генерации супероксидного анион-радикала и пероксида водорода листьями молодых растений пшеницы, выращенных из семян, обработанных ЖАК [40]. При этом отмечалось повышение активности пероксидазы и оксалатоксидазы и одновременное ингибирование каталазы. Известно, что пероксидазы (особенно апопластные) могут генерировать супероксидный радикал и пероксид водорода [41, 42], оксалатоксидаза в растительных клетках может быть одним из ферментов, образующих пероксид водорода [43].
Под влиянием ЖАК в изолированных колеоптилях пшеницы усиливалась генерация супероксидного анион-радикала [37]. Этот эффект частично подавлялся как ингибитором пероксидазы салицилгидроксамовой кислотой, так и ингибитором НАДФH-оксидазы имидазолом.
В процессах активации ЖАК ферментов, генерирующих АФК, могут быть участвовать другие посредники, в частности кальций. Так, вызываемое ЖАК усиление генерации ${\text{O}}_{2}^{{\centerdot - }}$ на поверхности колеоптилей пшеницы подавлялось хелатором кальция ЭГТА [37].
Еще одним сигнальным посредником, задействованным в реализации физиологических эффектов ЖАК, может быть оксид азота. Показано повышение содержания NO в листьях арабидопсиса после обработки ЖАК [44]. Предобработка растений риса скавенджером NO PTIO (2-phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxide) угнетала вызываемое ЖАК образование латеральных корней [45]. Обработка растений пшеницы ЖАК, смягчающая негативное влияние засухи на состояние мембран клеток листьев, вызывала повышение содержания NO. При этом скавенджер оксида азота PTIO устранял положительное влияние ЖАК [46]. Обработка проростков пшеницы экзогенной ЖАК также повышала содержание оксида азота в корнях [47]. При этом она индуцировала развитие теплоустойчивости проростков, которое угнеталось PTIO и ингибитором NO-синтазы животных L-NAME (NG-nitro-L-arginine methyl ester) [47]. Интересно, что индуцированное ЖАК образование оксида азота в корнях проростков пшеницы оказалось зависимым от АФК и подавлялось скавенджером пероксида водорода диметилтиомочевиной.
В целом, приведенные выше примеры указывают на роль функционального взаимодействия между NO, АФК и ионами кальция при реализации действия ЖАК на растительные объекты. Безусловно, детали этого взаимодействия пока остаются неисследованными. Так, известно лишь немного примеров конкретных стресс-протекторных систем, контролируемых ЖАК с участием этих посредников [40, 41, 48]. При этом в большинстве работ чаще изучается роль какого-либо одного посредника, а не их функционального взаимодействия друг с другом.
Сообщается и о возможном участии монооксида углерода как посредника эффектов ЖАК. Показано, что обработка ЖАК растений сои, повышающая их устойчивость к действию кадмия и смягчающая окислительные повреждения, вызывала увеличение активности гемоксигеназы [49]. Однако экспрессия гена, кодирующего этот фермент, не изменялась. Авторы полагают, что ЖАК вызывала посттрансляционные модификации гемоксигеназы, механизм которых пока не раскрыт. С другой стороны, показано, что влияние Ме-ЖАК на образование латеральных корней у риса сопряжено с повышением не только активности гемоксигеназы, но и с индукцией синтеза мРНК OsHO1 [39].
Недавно получены данные о вовлечении липидного сигналинга в реализацию стресс-протекторного действия ЖАК. Обработка ЖАК, уменьшающая повреждения мембран листьев арабидопсиса при действии токсических доз меди и кадмия, вызывала усиление экспрессии двух генов, кодирующих разные изоформы фосфолипазы D, при этом у растений дикого типа увеличивалось содержание фосфатидной кислоты. Однако обработка ЖАК слабо влияла на физиологическое состояние мутантов арабидопсиса, дефектных по соответствующим генам фосфолипазы D [50].
ВЗАИМОДЕЙСТВИЕ ЖАК С ФИТОГОРМОНАМИ АКТИВАТОРАМИ РОСТА
Эффекты ЖАК во многом реализуются при функциональном взаимодействии с другими фитогормонами. Имеются сведения о связях ЖАК с индолил-3-уксусной кислотой, цитокининами, гибберелловой кислотой и другими фитогормонами [6].
Следует отметить особое значение взаимодействия ЖАК с цитокининами в реализации его физиологического действия. Известно, именно цитокинины играют центральную роль в гормональной регуляции роста и развития растений [51], поэтому влияние других фитогормонов, в частности ЖАК, на их гомеостаз может быть важно как для ростовых процессов, так и для формирования адаптивных реакций.
Имеются данные как об антагонизме ЖАК и цитокининов, так и о выполнении последними функции посредников в реализации эффектов ЖАК. С одной стороны, сообщается об устранении ЖАК положительного влияния цитокининов на содержание хлорофилла [52]. Также показано, что дифференцировка ксилемы в корнях арабидопсиса регулируется ЖАК, и антагонистическое взаимодействие между ЖАК и цитокинином является важным для ЖАК-зависимого развития ксилемы [53].
С другой стороны, есть исследования, в которых показано , что отдельные эффекты ЖАК могут реализовываться при участии цитокининов. Известно, что в неблагоприятных условиях содержание цитокининов обычно уменьшается [54], в связи с чем важной является способность растений поддерживать уже имеющийся их пул. Ключевым ферментом деградации цитокининов является цитокининоксидаза [55, 56]. Влияние ЖАК на ее активность может быть одной из причин ее стресс-протекторного действия. Так, показано, что инкубация проростков пшеницы на среде с Ме-ЖАК приводила к быстрому кратковременному накоплению цитокининов, не влияя при этом на содержание АБК и индолил-3-уксусной кислоты [57]. Такой эффект авторы связывают со значительным снижением экспрессии гена и активности цитокининоксидазы под влиянием Ме-ЖАК. На фоне действия солевого стресса обработка Ме-ЖАК предотвращала падение содержания цитокининов в проростках. Также под влиянием экзогенного Ме-ЖАК отмечалось предотвращение чрезмерного снижения содержания индолил-3-уксусной кислоты в проростках и уменьшение эффекта повышения содержания АБК [57]. Таким образом, Ме-ЖАК может смягчать индуцируемые солевым стрессом изменения в гормональной системе растений и тем самым предотвращать чрезмерное ингибирование роста. Естественно, что в целом влияние ЖАК и ее производных на содержание цитокининов (и, по-видимому, других фитогормонов) не может быть однозначным и зависит от видовых особенностей, экспериментальных условий и других факторов [58, 59].
Взаимодействие ЖАК с гибберелловой кислотой (ГК) считается преимущественно антагонистическим. Предложена модель, согласно которой в определенных условиях (при низкой концентрации ГК) белки DELLA напрямую взаимодействуют с JAZ и тем самым освобождают белок MYC2, что позволяет реализоваться действию ЖАК. В то же время в присутствии ГК, белки JAZ высвобождаются из комплекса DELLA-JAZ в результате деградации DELLA, при этом свободные JAZ ослабляют действие ЖАК посредством прямого взаимодействия с MYC2 [60]. Эта модель в какой-то мере отображает соотношение между процессами активного роста, связанными со значительной активностью гиббереллинов, и защитными реакциями на действие стрессоров, которые сопряжены с торможением роста [61].
Антагонистическими при регуляции ростовых процессов могут быть и отношения ЖАК с ауксинами. Так, показано, что сигнал ЖАК блокирует экспрессию генов белков PLETHORA (PLT), которые ответственны за пролиферацию клеток корня [62]. Однако экспрессия PLT не была подавлена у мутантов по жасмонатному сигналингу coi1-1 и myc2. Показано, что MYC2 может напрямую связываться с промоторами PLT. Таким образом, усиление передачи жасмонатного сигнала может блокировать экспрессию ауксин-чувствительных генов PLT [6].
В целом, взаимодействия ЖАК с другими фитогормонами могут быть как антагонистическими, так и синергическими. Многие из таких взаимодействий связаны с участием одних и тех же белков-посредников в трансдукции сигналов разных фитогормонов. Детальное рассмотрение вопросов взаимодействия ЖАК с другими фитогормонами выходит за рамки темы настоящего обзора. Недавно они достаточно подробно были изложены в сводках спецвыпуска International Journal of Molecular Sciences [1, 6].
УЧАСТИЕ КОМПОНЕНТОВ ЖАСМОНАТНОГО СИГНАЛИНГА В РЕАЛИЗАЦИИ ЭФФЕКТОВ СИГНАЛЬНЫХ ПОСРЕДНИКОВ И АБСЦИЗОВОЙ КИСЛОТЫ
Известно, что увеличение содержания в клетках отдельных сигнальных посредников может формировать сигнал, индуцирующий синтез определенных фитогормонов и зависимые от них физиологические реакции. В частности, с гормональным сигналингом в растительных клетках тесно связаны два ключевых посредника-газотрансмиттера – оксид азота (NO) и сероводород (H2S). С одной стороны, они участвуют в трансдукции гормональных (в том числе жасмонатных) сигналов в геном растительной клетки [45, 63], с другой – изменение концентрации этих газотрансмиттеров может оказывать влияние на гормональный комплекс [44, 64]. Так, показано, что у растений арабидопсиса в ответ на ранение происходит быстрое усиление генерации оксида азота, которое, в свою очередь, вызывает повышение активности ферментов синтеза ЖАК – липоксигеназ и алленоксидсинтазы [65]. Установлено, что в патогениндуцируемом синтезе ЖАК также участвует NO [66].
Функциональное взаимодействие между ЖАК и оксидом азота происходит не только при формировании ответных реакций растений на стрессоры. Так, вызываемое ЖАК угнетение удлинения корней и усиление их бокового роста у арабидопсиса сочеталось с повышением содержания оксида азота в клетках корней у растений дикого типа [67]. В то же время экзогенный NO слабо влиял на развитие корней жасмонат-нечувствительных мутантов coi1. Этот факт может свидетельствовать в пользу роли компонентов жасмонатного сигналинга и(или) самой ЖАК в реализации физиологических эффектов оксида азота [67].
Между сероводородом и ЖАК как участниками сигнальной трансдукции, по-видимому, также существуют прямые и обратные связи. Так, обнаружено усиление генерации сероводорода у растений арабидопсиса при их обработке ЖАК [63]. С другой стороны, молекулярно-генетическими методами получены данные, указывающие на возможность влияния H2S на экспрессию гена, кодирующего белок COI1 [68].
Еще один ключевой белок жасмонатного сигналинга – транскрипционный фактор JIN1/MYC2 – в настоящее время рассматривается в качестве одного из узловых в передаче многих связанных со стрессом сигналов в растительных клетках [69]. На основании данных, полученных методами биоинформатики, было высказано предположение об участии генов семейства MYC в трансдукции сигналов оксида азота [70]. В наших экспериментах показано, что донор оксида азота нитропруссид натрия индуцировал солеустойчивость растений арабидопсиса дикого типа, повышая активность антиоксидантных ферментов и смягчая окислительные повреждения [71]. В то же время положительное влияние донора NO на солеустойчивость мутантов jin1, дефектных по гену белка JIN1/MYC2, практически не проявлялось, а у мутантов coi1 проявлялось очень слабо [72]. Похожей была и реакция арабидопсиса разных генотипов на действие донора сероводорода NaHS. Обработка им растений дикого типа существенно повышала солеустойчивость, увеличивая относительное содержание воды, способствуя сохранению целостности мембран и пула хлорофилла, в то время как влияние донора H2S на растения генотипа coi1 было слабым, а у растений jin1 оно вообще не проявлялось [72]. Полученные результаты указывают на вовлечение компонентов жасмонатного сигналинга в реализацию стресс-протекторного действия газотрансмиттеров H2S и NO.
По-видимому, ЖАК может быть задействована и в реализации эффектов такого газотрансмиттера, как монооксид углерода (CO). Недавно было показано участие жасмонатного сигнального пути в процессе опосредованного CO индуцирования синтеза никотина у растений табака при действии на них высоких температур [73]. Биосинтез никотина в значительной степени лимитируется активностью путресцин-N-метилтрансферазы, обеспечивающей метилирование путресцина, которое является первой стадией пути синтеза никотина. Показано, что действие высокой температуры на растения табака вызывает зависимый от гемоксигеназы биосинтез CO, что, в свою очередь, индуцирует синтез ЖАК. В результате этого активируется транскрипционный фактор NtMYC2. В обычных условиях NtMYC2 ингибируется белком NtJAZ, но вызываемое монооксидом углерода увеличение содержания ЖАК может способствовать деградации NtJAZ и активации NtMYC2 [74, 75]. С другой стороны, показано, что под влиянием CO усиливается связывание NtMYC2 с промотором гена путресцин-N-метилтрансферазы NtPMT1 [73]. Таким образом, два механизма – снятие белком NtJAZ блокирования транскрипционного фактора NtMYC2 и усиление его связывания с промотором гена путресцин-N-метилтрансферазы NtPMT1 – приводят к активации синтеза никотина в ответ на действие гипертермии.
Как уже отмечалось, также сообщается и о влиянии ЖАК на активность гемоксигеназы и синтез CO [49]. Таким образом, по-видимому, CO может не только индуцировать синтез ЖАК, но и выступать в роли посредника при реализации ее эффектов.
В целом, есть основания полагать, что жасмонатный сигналинг и отдельные его компоненты принимают участие в реализации многих физиологических эффектов других сигнальных посредников и абсцизовой кислоты (АБК) (рис. 2).
Рис. 2.
Вовлечение компонентов жасмонатного сигналинга в реализацию физиологических (стресс-протекторных) эффектов газотрансмиттеров и АБК. Стрессоры либо экзогенное действие ЖАК, АБК или доноров сигнальных молекул приводят к повышению в клетках растений эндогенного содержания соответствующих фитогормонов и/или NO, H2S, CO. При этом ЖАК обладает способностью индуцировать синтез NO, H2S, CO и АБК. Синтез ЖАК может быть опосредован АБК или газотрансмиттерами. Сигналы NO, H2S, CO и АБК могут передаваться в генетический аппарат с участием ключевых белков жасмонатного сигналинга COI1 и MYC. При этом белки семейства MYC могут выполнять роль “хаба” в передаче сигналов, индуцирующих гены, обеспечивающие развитие устойчивости растений к действию стрессоров.
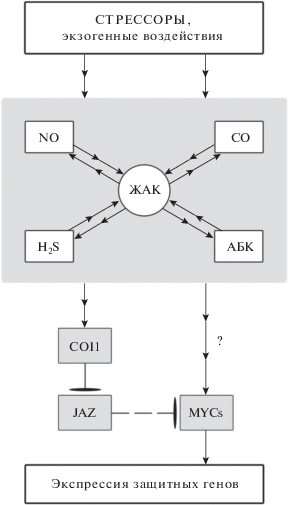
Особенно важным для передачи разнообразных сигналов, по-видимому, является белок жасмонатного сигналинга JIN1/MYC2. Этот транскрипционный фактор контролирует экспрессию генов, активируемых не только ЖАК, но и АБК [69, 76]. Показано, что АБК, как и ЖАК, усиливала экспрессию гена AtMYC2 [77]. Также обнаружено, что у мутантов арабидопсиса jin1 слабо проявлялось ростингибирующее действие экзогенной АБК [78]. С другой стороны, растения-трансформанты со сверхэкпрессией гена AtMYC2 обладали повышенной чувствительностью к АБК и были устойчивы к осмотическому стрессу [79]. В работе [80] показано, что внесение АБК в среду выращивания растений арабидопсиса при солевом стрессе способствовало поддержанию нормальной оводненности у растений дикого типа, но не у мутантов jin1. В условиях солевого стресса более высокая активность супероксиддисмутазы (СОД), каталазы и гваяколпероксидазы наблюдалась у растений дикого типа, обработанных АБК, но не у мутантов jin1. Таким образом, можно предполагать участие ключевого белка жасмонатного сигналинга JIN1/MYC2 в формировании отдельных АБК-индуцированных физиологических реакций растений арабидопсиса. Естественно, что такая интерпретация данных о слабой чувствительности мутантов jin1 к АБК не является однозначной. Функциональное взаимодействие ЖАК и АБК может включать в себя различные механизмы, часть из них обусловлена тем, что АБК может быть необходима для синтеза ЖАК, а последняя обладает способностью усиливать синтез АБК [81, 82].
ИЗМЕНЕНИЕ СОДЕРЖАНИЯ ЖАК У РАСТЕНИЙ ПРИ ДЕЙСТВИИ СТРЕССОРОВ
Повышение эндогенного содержания ЖАК у растений в ответ на действие стрессоров различной природы свидетельствует о ее вовлечении в процессы адаптации. Наиболее изученной является индукция синтеза ЖАК у растений при ранении [83]. Обнаружено транзиторное усиление экспрессии генов липоксигеназы, алленоксидсинтазы, алленоксидциклазы и 12-ОФДК-редуктазы при механических повреждениях растений [84, 85]. Как известно, реакции растений на ранение и механическое раздражение имеют много общего с их ответами на действие фитофагов и патогенов, в которых принимает участие ЖАК [7].
В то же время накоплена феноменология повышения содержания ЖАК и в ответ на другие абиотические воздействия: засуху, засоление, стрессовые температуры. Так, например, показано быстрое увеличение эндогенного содержания ЖАК в сегментах листьев ячменя при действии на них агента осмотического стресса маннита [86]. У растений арабидопсиса при засухе отмечалось транзиторное увеличение содержания ЖАК [5, 8]. В листьях сои увеличение содержания ЖАК было быстрым ответом на дегидратацию, по времени опережающим накопление АБК, что может указывать на первичность ЖАК-сигнала по отношению к сигналу АБК при стрессах, связанных с обезвоживанием [3].
При солевом стрессе обнаружено повышение содержания ЖАК у томата, картофеля, риса и других видов [5, 87, 88]. У ячменя в ответ на солевой стресс зафиксирована активация экспрессии генов ключевых ферментов синтеза ЖАК: алленоксидсинтазы, липоксигеназы, 12-ОФДК-редуктазы [89]. Сравнение реакции на солевой стресс томата дикого типа и жасмонатдефицитного мутанта def-1 показало, что у последнего развивался более глубокий окислительный стресс и отмечались меньшее содержание неферментативных антиоксидантов и низкая активность СОД, глутатионредуктазы и глутатион-S-трансферазы [90].
У арабидопсиса и риса обнаружено повышение содержания ЖАК в ответ на действие холода, также установлена холодоиндуцируемая экспрессия генов ключевых ферментов синтеза ЖАК – липоксигеназы, алленоксидсинтазы и алленоксидциклазы [91, 92]. Показано усиление синтеза ЖАК у бананов при действии холода [1, 8].
Тепловой стресс также может индуцировать синтез ЖАК. В культуре клеток Aquilaria sinensis отмечалось пятикратное транзиторное повышение эндогенного содержания ЖАК с максимумом через 0.5–2.0 ч после прогрева при 50°С [93]. При этом зарегистрировано усиление экспрессии генов ферментов синтеза ЖАК: липоксигеназы, алленоксидсинтазы и алленоксидциклазы, а также гена, кодирующего основной белок трансдукции сигнала ЖАК, MYC2. С другой стороны, у проростков риса при тепловом стрессе содержание ЖАК снижалось [94]. У растений арабидопсиса при продолжительном умеренном тепловом стрессе содержание ЖАК повышалось незначительно, однако при его сочетании с интенсивным освещением оно увеличивалось в несколько раз [94]. Вероятно, изучаемые эффекты зависят от видовых особенностей объектов, а также силы и продолжительности стрессового воздействия.
Кроме того, хорошо известно, что увеличение эндогенного содержания ЖАК в органах растений может быть индуцировано не только действием стрессоров, но и многими сигнальными посредниками, а также экзогенной ЖАК, которая вызывает усиление экспрессии генов ключевых ферментов липоксигеназного каскада алленоксидсинтазы, алленоксидциклазы и липоксигеназы [95] и увеличение количества этих белков в клетках [96].
ВЛИЯНИЕ ЭКЗОГЕННОЙ ЖАК И ЕЕ ПРОИЗВОДНЫХ НА УСТОЙЧИВОСТЬ РАСТЕНИЙ К ДЕЙСТВИЮ СТРЕСС-ФАКТОРОВ
За последние два десятилетия накоплена обширная феноменология повышения устойчивости растений разных таксономических групп к действию стресс-факторов различной природы при экзогенном воздействии ЖАК.
Обработка растений арабидопсиса Ме-ЖАК значительно повышала морозоустойчивость как в сочетании с холодовой акклиматизацией (закаливание в течение недели при 4°С), так и без нее [97]. В то же время дефектные по жасмонатному сигналингу (jar1 и coi1) или по синтезу ЖАК (lox2 и aos) растения отличались пониженной морозоустойчивостью. Также установлен конкретный механизм участия жасмонатного сигналинга в регуляции экспрессии генов, важных для морозоустойчивости. Показано, что белки-репрессоры передачи сигналов ЖАК JAZ угнетают транскрипционную функцию ICE и сигнальный путь ICE-CBF/DREB1, под контролем которого находится целый ряд белков COR (cold regulated protein), необходимых для адаптации к низким температурам [92, 97, 98]. При этом экзогенная ЖАК либо синтезируемая в результате холодового закаливания, индуцируя деградацию белков JAZ, снимает блок с сигнального пути ICE-CBF/DREB1, контролирующего экспрессию генов COR.
Предобработка растений огурца Ме-ЖАК уменьшала повреждающий эффект низкой положительной температуры, что проявлялось в меньшем торможении ростовых процессов и снижении интенсивности окислительного стресса [99].
В прикладных исследованиях, связанных с поиском способов уменьшения повреждений плодов при низкотемпературном хранении, показано повышение экзогенным Ме-ЖАК устойчивости к низким температурам плодов различных видов растений: цуккини [100], манго [101], гуавы [102], сладкого перца, томатов [103], граната [104], персика [105], мушмулы [106] и других. Также известно, что синтетический аналог жасмонатов прогидрожасмон (n-пропилдигидрожасмонат) используется для обработки древесных растений с целью повышения морозоустойчивости [107].
Данных о влиянии экзогенной ЖАК на теплоустойчивость растений значительно меньше. Показано повышение выживания изолированных колеоптилей пшеницы после прогрева при 46°С при их предварительной обработке 1 мкМ ЖАК [37]. Как отмечалось выше, у некоторых объектов зарегистрировано повышение содержания эндогенной ЖАК в ответ на тепловой стресс [93].
Более изучено влияние ЖАК на устойчивость растений к стрессу дегидратации. Ме-ЖАК смягчал действие осмотического стресса на листья клубники, что выражалось в уменьшении накопления продуктов пероксидного окисления липидов (ПОЛ) [108]. Обработка ЖАК молодых растений разных видов Brassica также уменьшала образование продукта ПОЛ малонового диальдегида (МДА), способствовала сохранению близкого к нормальному содержания воды в листьях и накоплению биомассы при обезвоживании, вызываемом обработкой ПЭГ-6000 [109]. Аналогичные результаты получены и с использованием молодых растений пшеницы, их обработка ЖАК уменьшала накопление продуктов ПОЛ и способствовала сохранению целостности мембран при действии осмотического стресса [46]. Обработка Prunus armeniaca ЖАК также уменьшала вызываемое засухой накопление МДА в листьях [110]. При действии Ме-ЖАК на этиолированные проростки пшеницы повышались их сырая и сухая биомасса, а также содержание воды при выращивании на среде с 12% ПЭГ-6000 [111]. Предпосевная обработка семян кукурузы ЖАК способствовала нормальному поглощению элементов минерального питания в условиях почвенной засухи [112].
Экзогенные ЖАК [113, 114] и Ме-ЖАК [115] повышали солеустойчивость растений арабидопсиса дикого типа, что проявлялось в смягчении ростингибирующего действия засоления, уменьшении окислительных повреждений и сохранении пула фотосинтетических пигментов в стрессовых условиях. В то же время у мутантов арабидопсиса, дефектных по жасмонатному сигналингу (jin1, coi1) базовая устойчивость к солевому стрессу была ниже, чем у растений дикого типа, также их солеустойчивость практически не изменялась под влиянием экзогенных ЖАК или Ме-ЖАК [114, 115]. Опрыскивание растений пшеницы ЖАК перед действием солевого стресса снижало накопление МДА и способствовало сохранению пула фотосинтетических пигментов [116]. Обработка растений кукурузы ЖАК также повышла их солеустойчивость, уменьшая поступление ионов Na+ в клетки корней [117]. Экзогенный Me-ЖАК повышал устойчивость Robinia pseudoacacia к засолению, что проявлялось в сохранении близкого к нормальному относительного содержания воды и меньшем накоплении продукта ПОЛ МДА в стрессовых условиях [118]. Опрыскивание ЖАК оливковых деревьев, выращиваемых на засоленной почве, повышало содержание хлорофилла, площадь листьев и сбор урожая [119].
Во многих работах исследовано влияние ЖАК на устойчивость растений к действию тяжелых металлов. Экзогенная ЖАК смягчала отрицательное влияние токсических доз меди на растения Cajanus cajan, что выражалось в уменьшении ингибирования роста корней и накопления МДА в побегах [120]. Обработка Ме-ЖАК снижала эффект ингибирования ионами Cd2+ роста корней у растений Solanum nigrum, также в присутствии экзогенного Ме-ЖАК уменьшалось вызываемое действием тяжелого металла накопление МДА в листьях [121]. Позитивное влияние, выражающееся в смягчении эффекта окислительного стресса и сохранении пула хлорофилла, Ме-ЖАК оказывал и на подвергнутые токсическому действию ионов Cd2+ растения Capsicum frutescens [122]. Подобные эффекты ЖАК отмечались при кадмиевом стрессе на растениях рапса [123]. Экзогенная ЖАК оказывала защитное влияние и на растения арабидопсиса, подвергнутые токсическому действию сульфатов меди и кадмия, что проявлялось в смягчении их ростингибирующего эффекта и уменьшении накопления МДА в листьях [45]. Обработка ЖАК растений сои уменьшала проявление эффекта ПОЛ при действии на них никеля [124].
АДАПТИВНЫЕ РЕАКЦИИ РАСТЕНИЙ, ИНДУЦИРУЕМЫЕ ЖАК
Изложенные выше сведения о повышении эндогенного содержания ЖАК и развитии устойчивости растений к различным абиотическим стресс-факторам под влиянием экзогенной ЖАК и ее производных свидетельствуют о способности этих соединений индуцировать разнообразные стресс-протекторные системы растений. Такие эффекты могут быть связаны с тем, что множественные сигнальные пути в растениях сложно переплетены, при этом модуляция содержания одних сигнальных посредников и фитогормонов вызывает изменения других звеньев сигнально-регуляторной сети. Кроме того, активность одних и тех же транскрипционных факторов может изменяться под влиянием сигналов, индуцируемых различными агентами. Наконец, несмотря на специфичность адаптации растений к определенным стресс-факторам, важное значение для устойчивости имеют и общие протекторные системы [125]. К ним относятся антиоксидантная система, комплекс стрессовых белков, некоторые полифункциональные низкомолекулярные протекторные соединения. Одной из универсальных реакций растений на многие как биотические, так и абиотические стрессовые воздействия, проявляющихся на уровне целого организма, является закрывание устьиц [126]. В регуляции всех перечисленных универсальных защитных реакций в той или иной степени задействована ЖАК и ее производные.
Антиоксидантная система. Нарушения процессов, связанных с редокс-регуляцией, и окислительные повреждения являются наиболее частыми последствиями действия на растения стресс-факторов. В связи с этим среди стресс-протекторных систем наиболее универсальной считается антиоксидантная [127]. Жасмонатный сигналинг является чрезвычайно важным для защиты растений при их инфицировании патогенами-некротрофами. При этом одна из составляющих защитных реакций, индуцируемых жасмонатами, – активация антиоксидантной системы [40]. В то же время она важна и для защитного ответа на действие практически любого абиотического стрессора.
Эффекты усиления функционирования антиоксидантной системы под влиянием ЖАК зарегистрированы у растений разных видов при действии стрессоров различной природы (табл. 1). В ряде работ зафиксирована связь между увеличением под влиянием стрессовых воздействий содержания эндогенной ЖАК и активацией антиоксидантной системы [94, 131]. Однако в большинстве работ влияние ЖАК на состояние антиоксидантной системы исследовалось путем экзогенных обработок растительных объектов фитогормоном (табл. 1). При этом следует обратить внимание на очень широкий диапазон концентраций ЖАК или Ме-ЖАК, индуцирующих антиоксидантную систему – от пикомолярных [124] до миллимолярных [109, 142]. Можно полагать, что для ЖАК даже в высоких концентрациях не характерны выраженные токсические эффекты, вызывающие необратимые нарушения про-/антиоксидантного равновесия в растительных клетках. При этом, однако, как уже отмечалось, ЖАК способна усиливать образование АФК и именно это может быть причиной активации под ее влиянием антиоксидантной системы. Так, активации под влиянием ЖАК антиоксидантных ферментов (СОД, каталазы и гваяколпероксидазы) в колеоптилях пшеницы предшествовало во времени усиление генерации АФК, зависимое как от НАДФН-оксидазы, так и от внеклеточной пероксидазы [37]. Более того, предполагается, что в определенных условиях индуцирование ЖАК антиоксидантной системы включает в себя происходящее ранее усиление ПОЛ [128, 130]. Роль других посредников в активации ЖАК антиоксидантной системы изучена пока слабо. Результаты ингибиторного анализа указывают на возможную опосредованность таких эффектов ЖАК газотрансмиттерами – NO [46] и CO [49].
Таблица 1.
Влияние ЖАК и ее производных на состояние антиоксидантной системы растений
| Объект | Действие жасмоната | Характер влияния на компоненты антиоксидантной системы | Источник |
|---|---|---|---|
| Triticum aestivum, колеоптили | Экзогенная ЖАК, 10 мкМ | Повышение активности СОД, каталазы, аскорбатпероксидазы и гваяколпероксидазы в обычных условиях и после действия теплового стресса | [37] |
| Triticum aestivum, листья | Экзогенная ЖАК, 1 или 2.5 мМ | Повышение активности СОД в обычных условиях и при действии УФ-B | [128] |
| Экзогенный Ме-ЖАК, 0.25 мкМ | Повышение активности СОД, каталазы аскорбатпероксидазы и пероксизады в обычных условиях и на фоне засухи | [129] | |
| Экзогенная ЖАК, 2 мМ | Повышение количества транскриптов и активности СОД, каталазы и гваяколпероксидазы в обычных условиях и на фоне солевого стресса | [116] | |
| Экзогенная ЖАК, 2 мкМ | Повышение активности аскорбатпероксидазы, глутатионредуктазы, дегидроаскорбат-редуктазы и монодегидроаскорбат-редуктазы, содержания аскорбата и GSH в обычных условиях и при осмотическом стрессе | [46] | |
| Arachis hypogaea, листья и корни | Экзогенный Ме-ЖАК, 25–250 мкМ | Повышение активности СОД, каталазы и пероксидазы, появление двух новых молекулярных форм пероксидазы | [130] |
| Arabidopsis thaliana, листья | Увеличение содержания эндогенной ЖАК при сочетанном действии гипертермии и избыточного освещения | Усиление экспрессии генов аскобатпероксидазы APX1, APX2 у растений Col-0 и отсутствие эффекта у мутантов aos | [94] |
| Экзогенные ЖАК (0.1 мкМ) или Ме-ЖАК (50 мкМ) | Повышение активности СОД и гваяколпероксидазы при солевом стрессе у растений Col-0 и отсутствие эффектов у мутантов jin1 и coi1 | [113, 115] | |
| Agropyron cristatum, листья | Увеличение содержания эндогенной ЖАК в ответ на обезвоживание | Зависимое от ЖАК усиление экспрессии генов аскорбатпероксидазы, дегидроаскорбатредуктазы и монодегидроаскорбатредуктазы, повышение содержания аскорбата и GSH при осмотическом стрессе | [131] |
| Solanum tuberosum, листья | ЖАК (0.1 мкМ) | Повышение активности пероксидазы, снижение активности каталазы | [132] |
| Glycine max, листья | ЖАК (1 пМ) | Повышение активности СОД, каталазы, гваяколпероксидазы, глутатион-S-трансферазы, аскорбатпероксидазы, дегидроаскорбатредуктазы, глутатиоредактазы, содержания аскорбата и GSH в обычных условиях и при действии никеля | [124] |
| Glycine max, корни | ЖАК (20 мкМ) | Повышение активности СОД и каталазы, содержания аскорбата в обычных условиях и при действии кадмия | [49] |
| Glycine max, листья | ЖАК (1 нМ) | Повышение экспрессии генов и активности СОД, каталазы, неспецифической пероксидазы, аскорбатпероксидазы и содержания аскорбата при действии никеля | [133] |
| Vicia faba, листья | ЖАК (1 мкМ) | Повышение активности СОД, каталазы, аскорбатпероксидазы, глутатионредуктазы при действии кадмия | [134] |
| Zea mays, листья | ЖАК (10 нМ – 1 мкМ) | Повышение активности СОД, каталазы, гваяколпероксидазы, аскорбатпероксидазы, глутатионредуктазы в обычных условиях и при действии никеля | [135] |
| Zea mays, каллусы | Ме-ЖАК (3.3 или 10 мкМ) | Усиление синтеза антоцианов | [136] |
| Capsicum frutescens, листья | Ме-ЖАК (0.1 мкМ) | Повышение активности СОД, каталазы, аскорбатпероксидазы при действии кадмия | [137] |
| Brassica (различные виды), листья | ЖАК (0.5–1 мМ) | Повышение активности аскорбатпероксидазы, монодегидроаскорбатредуктазы, дегидроаскорбатредуктазы, глутатионредуктазы, содержания аскорбата и GSH при засухе | [109] |
| Brassica napus листья | Ме-ЖАК (1 мкМ) | Усиление экспрессии генов и повышение активности СОД, аскорбатпероксидазы, каталазы, глутатионредуктазы, содержания аскорбата и GSH при действии мышьяка | [138] |
| ЖАК (1 нМ) | Повышение содержания антоцианов, каротиноидов,α-токоферола и аскорбиновой кислоты в обычных условиях и при действии солевого стресса | [139] | |
| Brassica juncea, листья | ЖАК (0.1 мкМ) | Повышение активности СОД, каталазы, пероксидазы, глутатион-S-трансферазы, содержания аскорбата, GSH, токоферола, и фенольных солединений при действии токсиканта имидоклаприда | [140] |
| Lemna valdiviana, листья | ЖАК (50–500 мкМ) | Повышение активности СОД, каталазы, неспецифической пероксидазы, глутатионпероксидзы и глутатионредуктазы при действии мышьяка | [141] |
| Hibiscus sabdariffa, листья | ЖАК (1 мМ) | Повышение активности аскорбатпероксидазы, содержания антоцианов и флавоноидов при солевом стрессе | [142] |
При исследовании влияния ЖАК или Ме-ЖАК анализируется в основном активность антиоксидантных ферментов, хотя в последние годы накопились данные и об усилении экспрессии генов, кодирующих соответствующие ферменты: СОД, каталазу, аскобатпероксидазу, неспецифическую пероксидазу и ряд других (табл. 1). Причем в некоторых случаях такие эффекты ЖАК и ее производных зафиксированы не только на фоне действия стрессоров, но и в обычных условиях [37, 46, 49, 116, 129, 136], что может указывать на специфическую роль фитогормона в активации антиоксидантной системы. Причинно-следственную связь между синтезом ЖАК и активацией экспрессии генов антиоксидантных ферментов удалось доказать и молекулярно-генетическими методами: при действии на растения арабидопсиса дикого типа высоких температур и избыточного освещения отмечалось повышение содержания ЖАК и одновременное усиление экспрессии двух генов, кодирующих формы цитозольной аскорбатпероксидазы – APX1 и APX2 [94]. При этом у мутантов по синтезу ЖАК (растений aos, дефектных по гену алленоксидсинтазы) такого эффекта не наблюдалось.
Получены сведения и об индуцировании ЖАК накопления низкомолекулярных антиоксидантов у растений, как в обычных, так и в стрессовых условиях. Так, установлено, что транскрипционный фактор JIN1/MYC2 участвует в регуляции экспрессии генов ферментов, обеспечивающих синтез аскорбата и цистеина [143]. Кроме того, белок JIN1/MYC2, действуя как положительный регулятор экспрессии генов MYB75/PAP1 и EGL3, принимает участие в синтезе флавоноидов [144], которые отличаются высокой антиоксидантной активностью и могут вносить существенный вклад в устойчивость растений к действию стрессоров [127, 145, 146]. При солевом стрессе обработка ЖАК растений арабидопсиса дикого типа способствовала поддержанию высокого содержания антоцианов и бесцветных флавоноидов (поглощающих в области УФ-B) [114]. В то же время у мутантов jin1 содержание флавоноидных соединений при обработке ЖАК почти не изменялось, а в стрессовых условиях значительно уменьшалось. При низкотемпературном хранении обработка Ме-ЖАК плодов гуавы повышала активность ключевого фермента синтеза вторичных метаболитов фенилаланинаммонийлиазы и увеличивала общее содержание фенольных соединений [102].
ЖАК, по-видимому, важна для многих звеньев вторичного метаболизма. Так, показана ее роль в индуцируемом гипертермией синтезе сесквитерпенов у растений Aquilaria sinensis. Тепловой шок у этих растений приводил к резкому усилению экспрессии генов липоксигеназы, алленоксидсинтазы, белка MYC2 и увеличению содержания ЖАК, после чего отмечалось накопление сесквитерпенов [93]. При этом ингибитор синтеза ЖАК NDGA (nordihydroguaiaretic acid) подавлял индуцированный высокой температурой синтез сесквитерпенов.
Мультифункциональные низкомолекулярные соединения. Одним из наиболее многофункциональных стрессовых продуктов первичного метаболизма растений является пролин. В настоящее время считается, что помимо известной функции совместимого осмолита, он выполняет антиоксидантные функции [147]. Также пролин рассматривается как низкомолекулярный шаперон, который может участвовать в поддержании нативной структуры ферментов [148]. В листьях сои [149] и плодах банана [150] содержание пролина возрастало под действием экзогенного Ме-ЖАК. При этом была установлена положительная связь между уровнем экспрессии гена MYC2 и накоплением пролина. Усиление накопления пролина при почвенной засухе под влиянием Ме-ЖАК зарегистрировано у растений кукурузы [112]. У пшеницы ЖАК усиливала накопление пролина в листьях при стрессовом воздействии УФ-B [128].
У бобов обнаружено повышение содержания пролина при обработке ЖАК в условиях стресса, вызываемого токсическим действием кадмия [134]. В листьях Hibiscus sabdariffa показано усиление синтеза пролина под влиянием экзогенной ЖАК в условиях солевого стресса [142].
Обработка Ме-ЖАК в отсутствие действия стрессоров не оказывала существенного влияния на содержание пролина в листьях арабидопсиса дикого типа (Col-0) и мутантов по жасмонатному сигналингу jin1 и coi1. После солевого стресса оно увеличивалось у растений всех трех генотипов, однако предварительное воздействие Ме-ЖАК вызывало дополнительное повышение количества пролина только у растений дикого типа [115]. Следует также отметить, что на растениях кукурузы показана роль ЖАК как позитивного регулятора синтеза АБК, которая также индуцирует синтез пролина [151]. В связи с этим не исключено, что индуцирование ЖАК накопления пролина, по крайней мере, отчасти, может быть опосредовано АБК.
С другой стороны, имеются сведения и о снижении содержания пролина у растений под влиянием ЖАК. Так, у растений рода Brassica обработка ЖАК уменьшала индуцируемый засухой эффект повышения содержания пролина [109]. Не исключено, что отдельные эффекты ЖАК могут иметь видовую специфичность. Также вероятно, что в определенных условиях ЖАК индуцирует не накопление пролина, а другие протекторные системы.
В целом же, есть основания полагать, что жасмонатный сигнальный путь принимает участие в регуляции содержания пролина при стрессах, связанных с дегидратацией. Наряду с пролином под влиянием ЖАК и ее производных у растений могут накапливаться ароматические аминокислоты и аминокислоты с разветвленной цепью, которые также относят к защитным метаболитам [152].
Помимо аминокислот важными полифункциональными протекторами растительных клеток считаются сахара. Их накопление зарегистрировано в ответ на действие стрессоров различной природы на растения [153–155]. Одной из важных функций растворимых углеводов, накапливаемых при стрессах, является их антиденатурационное действие на белково-липидные компоненты клеток, которые испытывают дегидратацию или влияние других альтерирующих факторов. Показано, в частности, что сахароза может заменять воду в структуре фосфолипидов при стрессовых воздействиях, которые вызывают обезвоживание клеток [156]. Достаточно давно известно, что сахарам присущи и антиоксидантные свойства, обусловленные способностью связывать свободные радикалы [157]. Так, в растениях арабидопсиса, обработанных глюкозой, накапливалось меньше синглетного кислорода и пероксида водорода [158].
К регуляции содержания сахаров при стрессах ЖАК может иметь если не прямое, то, по крайней мере, косвенное отношение. Например, показано, что под влиянием солевого стресса происходило незначительное уменьшение содержания сахаров в листьях растений арабидопсиса дикого типа и более заметное его снижение у дефектных по жасмонатному сигналингу мутантов jin1. В то же время у растений дикого типа, обработанных ЖАК, после солевого стресса содержание сахаров не только не уменьшалось, но и существенно возрастало [114]. Обработка ЖАК растений jin1 подобного эффекта не вызывала. Повышение содержания сахаров при солевом стрессе под влиянием ЖАК зафиксировано и у растений гибискуса [142]. Методами протеомики было показано, что среди белков, количество которых при действии ЖАК заметно изменялось – ферменты углеводного обмена [159]. Сведения о положительном влиянии ЖАК на накопление углеводов [1, 5] согласуются с данными о ее способности поддерживать фотосинтетическую активность растений в стрессовых условиях [88]. С другой стороны, в ряде исследований под влиянием ЖАК в стрессовых условиях зафиксировано уменьшение содержания метаболитов, связанных с активным ростом, в том числе сахаров, но увеличение количества фосфорилированных гексоз, ответственных за подавление роста и фотосинтеза [152]. Возможно, влияние ЖАК и ее производных на накопление растворимых углеводов может быть различным в зависимости от силы стрессового воздействия.
Защитные белки и пептиды. Показано участие ЖАК в индуцировании синтеза дегидринов – LEA (late embryogenesis abundant) белков группы 2, важных для адаптации растений к обезвоживанию. Установлена способность Ме-ЖАК индуцировать транскрипционную активность TADHN гена дегидрина и накопление белков дегидринов с мол. массой 28 и 55 кДа в проростках пшеницы в обычных условиях и дополнительно увеличивать их содержание при осмотическом стрессе, вызываемом маннитом [160].
Как уже отмечалось, под контролем жасмонатного сигналинга у растений разных видов также находится экспрессия генов COR, кодирующих особую группу белков, важных для адаптации к низким температурам [97, 161].
Сообщается и об усилении под влиянием ЖАК синтеза растениями белков-тионеинов, связывающих тяжелые металлы. Показано усиление экспрессии гена металлотионеина типа-2 (KoMT2) в листьях проростков Kandelia obovata, подвергнутых стрессовому воздействию Cd2+, при обработке Me-ЖАК [162].
ЖАК и регуляция состояния устьичного аппарата растений. Закрывание устьиц, вызываемое жасмонатами, считается одной из важных защитных реакций, направленных на предотвращение проникновения патогенов через листья [163]. Однако в настоящее время этот эффект ЖАК и ее производных рассматривают и как механизм, повышающий устойчивость растений к абиотическим стресс-факторам, в первую очередь к засухе [48]. Он также может быть важен для солеустойчивости и резистентности к действию тяжелых металлов, поскольку уменьшение транспирации снижает поступление в растение токсичных ионов [159].
На состояние устьиц влияют как ЖАК, так и другие продукты липоксигеназного каскада [48, 163]. Показано, что ЖАК может регулировать состояние устьиц зависимым и независимым от АБК способами [164]. В первом случае АБК выступает в роли посредника эффекта ЖАК. Установлено, что ЖАК, как и АБК, может активировать медленные анионные каналы S-типа, обеспечивающие выход ионов из замыкающих клеток и уменьшение их тургора [48].
В целом, экспериментальные данные об устьичных реакциях, индуцируемых ЖАК и Ме-ЖАК, довольно многочисленны, хотя и противоречивы. Например, показано, что эти соединения вызывали закрывание устьиц только в концентрациях выше 20 мкМ [27]. При обработке эпидермиса ЖАК и Ме-ЖАК в меньших концентрациях такой эффект не проявлялся; более того, обнаружено ингибирование этими соединениями закрывания устьиц, вызываемого АБК. В некоторых работах зарегистрировано увеличение устьичной апертуры под влиянием Ме-ЖАК [48]. С другой стороны, установлено, что 12-ОФДК (предшественник ЖАК) более эффективно индуцировала закрывание устьиц у арабидопсиса по сравнению с Ме-ЖАК [2].
Как отмечалось, в рецепции и трансдукции сигналов ЖАК ключевую роль играют гены JAR1, COI1 и MYC2. В то же время их значение в регуляции устьичного аппарата изучено недостаточно. Показано, что у мутантной линии арабидопсиса jar1-1 устьица были нечувствительны к обработке Ме-ЖАК, но закрывались под влиянием АБК, хотя и в меньшей степени, чем у растений дикого типа Col-0 [165]. У мутантов coi1 существенных изменений состояния устьиц при обработке Ме-ЖАК не происходило [27].
В наших исследованиях, выполненных на листьях растений арабидопсиса разных генотипов, показано, что под действием Ме-ЖАК в концентрациях 50–200 мкМ величина устьичной апертуры у растений дикого типа (Col-0) существенно уменьшалась. У мутантов jin1 и jar1 при обработке Ме-ЖАК в различных концентрациях показатели, характеризующие устьичную активность, почти не изменялись, хотя у генотипа coi1 отмечалась тенденция к некоторому уменьшению величины устьичной щели [166].
Влияние ЖАК на состояние устьичного аппарата реализуется с участием основных клеточных сигнальных посредников [48]. Так, достаточно давно установлено участие различных пулов кальция в проявлении эффекта закрывания устьиц у растений арабидопсиса при действии метилжасмоната [38]. Блокаторы кальциевых каналов рутениевый красный и хлорид лантана полностью снимали вызываемое обработкой фитогормоном закрывание устьиц. Этот эффект метилжасмоната полностью устранялся и при обработке эпидермиса антагонистом кальмодулина трифторперазином. В то же время обработка хелатором внеклеточного кальция ЭГТА лишь частично снимала эффект закрывания устьиц, вызываемый Ме-ЖАК.
Наряду с кальцием, посредниками в реализации эффектов жасмоната могут быть АФК и оксид азота. Обнаружено повышение содержания NO и пероксида водорода в замыкающих клетках у растений Arabidopsis thaliana и Vicia faba при обработке ЖАК или Ме-ЖАК [167, 168]. Считается, что усиление образования АФК при индуцировании устьичных реакций жасмонатом происходит в основном за счет повышения активности НАДФН-оксидазы [48].
В работе Лиу с соавт. [167] на эпидермисе листьев бобов, показано, что закрывание устьиц, вызываемое ЖАК, устранялось ингибитором NO-синтазы животных L-NAME. В наших исследованиях установлено, что индуцированное Ме-ЖАК уменьшение размера устьичной щели и количества открытых устьиц у растений арабидопсиса практически полностью устранялось предварительной обработкой клеток эпидермиса скавенджером оксида азота PTIO (2-phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxide) и частично ингибиторами NO-синтазы животных (L-NAME) и нитратредуктазы (вольфраматом натрия) [169]. Таким образом, полученные результаты показывают значение образования NO двумя основными путями (окислительным и восстановительным) в реализации эффектов Ме-ЖАК на состояние устьиц. Однако на эпидермисе Vicia faba было показано, что ингибирование нитратредуктазы не снимает эффект закрывания устьиц, вызываемый ЖАК [167]. Возможно, что вклад различных путей синтеза NO в замыкающих клетках может изменяться в зависимости от вида и возраста растений, а также экспериментальных условий.
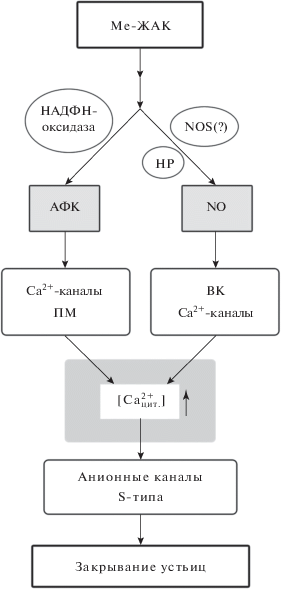
В целом, влияние Ме-ЖАК на состояние устьиц опосредовано АФК и NO, образующимися с участием НАДФH-оксидазы, нитратредуктазы и, возможно, каталитического комплекса, по действию подобного NO-синтазе животных (рис. 3). Считается, что АФК оказывают влияние в первую очередь на кальциевые каналы плазматической мембраны, в то время как NO – на внутриклеточные кальциевые каналы [48]. Повышение концентрации кальция в цитозоле, происходящее за счет его поступления извне, а также из внутриклеточных компартментов приводит к активации анионных каналов S-типа, в результате чего происходит выход ионов из замыкающих клеток, приводящий к потере ими тургора и закрыванию устьиц (рис. 3).
Рис. 3.
Гипотетический механизм индуцирования закрывания устьиц Ме-ЖАК. NOS – фермент с каталитической активностью, подобной NO-синтазе животных; НР – нитратредуктаза; Ca2+-каналы ПМ – кальциевые каналы плазматической мембраны; ВК Ca2+-каналы – внутриклеточные кальциевые каналы. Пояснения в тексте.
Закрывание устьиц у растений может быть индуцировано не только засухой, но и засолением. Эффект осмотического стресса у растений в ответ на повышение концентрации солей в среде проявляется быстро и вызывает резкое снижение устьичной проводимости [170, 171]. Для выяснения возможной роли жасмонатного сигналинга в регуляции состояния устьиц при солевом стрессе исследовали влияние обработки хлоридом натрия листьев растений Arabidopsis thaliana дикого типа и мутантов, дефектных по жасмонатному сигналингу. 2–3-часовое воздействие NaCl индуцировало закрывание устьиц у растений дикого типа (Col-0). В то же время обработка NaCl листьев мутанта jin1 практически не влияла на состояние устьиц. У растений генотипа coi1 под влиянием соли происходило сравнительно небольшое уменьшение устьичной апертуры [172]. Возможно, что мутация по гену jin1, кодирующему транскрипционный фактор JIN1/MYC2, более существенно сказывается на процессах устьичной регуляции, поскольку, как уже отмечалось, этот белок участвует в трансдукции сигналов не только жасмоната, но и АБК [69, 173].
* * *
Изложенные факты позволяют заключить, что ЖАК и жасмонатному сигналингу принадлежит ключевая роль в адаптации растений к действию стрессоров различной природы, в том числе ко многим неблагоприятным абиотическим факторам. В последние годы была получена новая важная информация о синтезе и транспорте ЖАК и ее предшественников. Как известно, первые стадии синтеза ЖАК происходят в хлоропластах, их продуктом является 12-ОФДК. В настоящее время установлено, что 12-ОФДК транспортируется с помощью АТФ-связывающего белка-транспортера CTS в пероксисомы, где происходят заключительные стадии синтеза ЖАК [15]. Синтезированная в пероксисомах ЖАК высвобождается в цитоплазму. Основные ее физиологические эффекты связаны с превращением в Иле-ЖАК с помощью с помощью белка JAR1. Недавно установлено, что Иле-ЖАК через ядерную мембрану переносит белок AtJAT1 [15, 25]. Попадающий в ядро Иле-ЖАК взаимодействует с комплексом SCF/COI1, в результате чего происходит убиквитинирование репрессоров жасмонатного сигналинга JAZ и высвобождение ряда транскрипционных факторов (в первую очередь, MYCs), регулирующих экспрессию жасмонатиндуцибельных генов.
Широкий спектр адаптивных реакций, на которые влияют ЖАК и ее производные, может быть обусловлен ее способностью вызывать изменение содержания многих сигнальных посредников, в частности, кальция, АФК, газотрансмиттеров – NO, H2S и CO. С другой стороны, есть основания полагать, что отдельные компоненты жасмонатного сигналинга вовлекаются в трансдукцию сигналов других посредников (рис. 2). Особенно ярким примером в этом отношении может быть транскрипционный фактор JIN1/MYC2 и, возможно, другие транскрипционные факторы семейства MYC, которые участвуют в трансдукции сигналов не только ЖАК, но и АБК [80], а также в реализации физиологических (стресс-протекторных) эффектов таких посредников-газотрансмиттеров как NO и H2S [72].
Эффекты ЖАК также реализуются за счет функционального взаимодействия с другими фитогормонами. Особое значение в этом отношении имеет установленный сравнительно недавно эффект усиления накопления цитокининов, вызываемый ЖАК [57]. По всей вероятности, это смягчает вызываемое стрессорами ингибирование роста и таким образом ЖАК может способствовать балансу ростовых и адаптивных процессов. С другой стороны, ЖАК находится в антагонистических отношениях с ауксином и гибберелловой кислотой [6], что позволяет рассматривать ее все же как “гормон стресса”, а не “гормон роста”.
Особо важным и пока недостаточно изученным эффектом ЖАК является способность влиять на экспрессию генов большой группы регуляторных белков, необходимых для устойчивости растений к действию стрессоров: NAC, MYB, WRKY и других [125].
ЖАК способна индуцировать как относительно специфические, так и универсальные адаптивные реакции, в частности, влиять на редокс-гомеостаз и усиливать работу антиоксидантной системы. При этом особое значение может иметь активация жасмонатами вторичного метаболизма, что приводит к усилению синтеза фенольных соединений, в частности, флавоноидов и прочих метаболитов с антиоксидатными, мембранопротекторными и другими защитными функциями.
Помимо реакций, которые реализуются на молекулярном (биохимическом) уровне (например, индуцирование антиоксидантной системы), ЖАК и ее производные регулируют процессы, реализующиеся на уровне целого организма. К ним относится устьичные реакции. В их регуляции ЖАК и другие оксилипины, а также компоненты жасмонатного сигналинга могут иметь очень большое значение. Как уже отмечалось, отдельные оксилипины вызывают эффект закрывания устьиц в очень низких концентрациях [3]. ЖАК может индуцировать синтез АБК и устьичная реакция может быть опосредована именно этим гормоном [164]. С другой стороны, в реализации эффектов АБК (в том числе устьичных) принимает участие важный компонент жасмонатного сигналинга – транскрипционный фактор JIN1/MYC2 [69].
Ключевая роль ЖАК и ее производных в адаптации растений к стрессорам различной природы позволяет рассматривать их как перспективный инструмент для использования в растениеводстве. Привлекательным в этом отношении представляется очень широкий диапазон концентраций, в которых экзогенные ЖАК и Ме-ЖАК оказывают на растения стресс-протекторное влияние, индуцируя защитные системы (табл. 1). Широкий диапазон нетоксичных доз ЖАК и ее производных снижает вероятность передозировки при практическом применении. Однако пока использование ЖАК и ее производных в растениеводстве сдерживается их высокой стоимостью. В настоящее время ЖАК и ее производные применяются преимущественно для коррекции физиологического состояния растений, выращиваемых в основном в защищенном грунте. В то же время удешевление синтеза ЖАК создаст возможности для широкого их применения при выращивании полевых культур, особенно в неблагоприятных условиях. Кроме того, есть основания полагать, что интенсивное накопление данных о механизмах влияния ЖАК на ключевые регуляторные и протекторные системы растений, а также сведений о роли компонентов жасмонатного сигналинга в реализации эффектов других сигнальных молекул создаст новые теоретические предпосылки для целенаправленного повышения устойчивости культурных растений к действию стрессоров различной природы.
Список литературы
Wang J., Song L., Gong X., Xu J., Li M. // Int. J. Mol. Sci. 2020. V. 21. № 4. Art. 1446. https://doi.org/10.3390/ijms21041446
Savchenko T., Kolla V.A., Wang C.-Q., Nasafi Z., Hicks D.R., Phadungchob B., Chehab W.E., Brandizzi F., Froehlich J., Dehesh K. // Plant Physiol. 2014. V. 164. № 3. P. 1151–1160.
Савченко Т.В., Застрижная О.М., Климов В.В. // Биохимия. 2014. Т. 79. № 4. С. 458–475.
Gomi K. // Int. J. Mol. Sci. 2020. V. 21. № 4. https://doi.org/10.3390/ijms21041261
Ali M.S., Baek K.-H. // Int. J. Mol. Sci. 2020. V. 21. № 2. Art. 621. https://doi.org/10.3390/ijms21020621
Jang G., Yoon Y., Choi Y.D. // Int. J. Mol. Sci. 2020. V. 21. № 1. https://doi.org/10.3390/ijms21010305
Васюкова Н.И., Озерецковская О.Л. // Физиология растений. 2009. Т. 56. № 5. С. 643–653.
Ruan J., Zhou Y., Zhou M., Yan J., Khurshid M., Weng W., Cheng J., Zhang K. // Int. J. Mol. Sci. 2019. V. 20. № 10 https://doi.org/10.3390/ijms20102479
Lamattina L., Garcia-Mata C. // Gasotransmitters in Plants, Signaling and Communication in Plants. / Eds. L. Lamattina, C. Garcia-Mata. Switzerland: Springer International Publishing, 2016. P. 5–9.
Kolupaev Yu.E., Karpets Yu.V., Beschasniy S.P., Dmitriev A.P. // Cytol. Genet. 2019. V. 53. № 5. P. 392–406.
Feussner I.; Wasternack C. // Annu. Rev. Plant Biol. 2002. V. 53. P. 275–297.
Agrawal G.K., Tamogami S., Han O., Iwahashie H., Rakwal R. // Biochem. Biophys. Res. Commun. 2004. V. 317. № 1. P. 1–15.
Wasternack C., Hause B. // Ann. Bot. 2013. V. 111. № 6. P. 1021–1058.
Huang H., Liu B., Liu L., Song S. // J. Exp. Bot. 2017. V. 68. № 6. P. 1349–1359.
Wang F., Yu G., Liu P. // Front. Plant Sci. 2019. V. 10. Art. 390. https://doi.org/10.3389/fpls.2019.00390
Maynard D., Groger H., Dierks T., Dietz K.J. // J. Exp. Bot. 2018. V. 69. № 22. P. 5341–5354.
Santino A., Taurino M., De Domenico S., Bonsegna S., Poltronieri P., Pastor V., Flors V. // Plant Cell Rep. 2013. V. 32. P. 1085–1098.
Koch T., Bandemer K., Boland W. // Helv. Chim. Acta. 1997. V. 80. № 3. P. 838–850.
Li J., Zhang K., Meng Y., Hu J., Ding M., Bian J., Yan M., Han J., Zhou M. // Plant J. 2018. V. 95. № 3. P. 444–457.
Suza W.P., Rowe M.L., Hamberg M., Staswick P.E. // Planta. 2010. 231. № 3. P. 717–728.
Fonseca S., Chini A., Hamberg M., Adie B., PorzelA., Kramell R., Miersch O., Wasternack C., SolanoR. // Nat. Chem. Biol. 2009. V. 5. № 5. P. 344–350.
Thorpe M.R., Ferrieri A.P., Herth M.M., Ferrieri R.A. // Planta. 2007. V. 226. № 2. P. 541–551.
Heil M., Ton J. // Trends Plant Sci. 2008. V. 13. № 6. P. 264–272.
Farmer E.E., Ryan C.A. // Proc. Natl. Acad. Sci. USA. 1990. V. 87. № 19. P. 7713–7716.
Li Q., Zheng J., Li S., Huang G., Skilling S.J., Wang, L., Li L., Li M., Yuan L., Liu P. // Mol. Plant. 2017. V. 10. P. 695–708.
Thines B., Katsir L., Melotto M., Niu Y., Mandaokar A., Liu G., Nomura K., He S.Y., Howe G.A., Browse J. // Nature. 2007. V. 448. № 7154. P. 661–666.
Melotto M., Mecey C., Niu Y., Chung H.S., Katsir L., Yao J., Zeng W., Thines B., Staswick P., Browse J. // Plant J. 2008. V. 55. № 6. P. 979–988.
Sewell J., Gil E. // Nature. 2010. V. 464. № 7289. P. 788–791.
Schmiesing A., Emonet A., Gouhier-Darimont C., Reymond P. // Plant Physiol. 2016. V. 170. № 4. P. 2432–2443.
Nuruzzaman M., Sharoni A.M., Kikuchi S. // Front. Microbiol. 2013. V. 4. Art. 248. https://doi.org/10.3389/fmicb.2013.00248
Lorenzo O., Piqueras R., Sánchez-Serrano J.J., Solano R. // Plant Cell. 2003. V. 15. № 1.165–178.
Pré M., Atallah M., Champion A., de Vos M., Pieterse C.M.J., Memelink J. // Plant Physiol. 2008. V. 147. № 3. P. 1347–1357.
Li J., Zhong R., Palva E.T. // PLoS ONE. 2017. V. 12. e0183731.
Sun Q.-P., Yu Y.-K., Wan S.-X., Zhao F.-K., Hao Y.-L. // Agricult. Sci. China. 2010. V. 9. № 4. P. 497–503.
Leon J., Rojo E., Titarenko E., Sanchez-Serrano J.J. // Mol. Gen. Genet. 1998. V. 258. P. 412–419.
Fauriea B., Cluzeta S., Merillon J.M. // J. Plant Physiol. 2009. V. 166. № 17. P. 1863–1877.
Карпец Ю.В., Колупаев Ю.Е., Луговая А.А., Обозный А.И. // Физиология растений. 2014. Т. 61. № 3. С. 367–375.
Suhita D., Kolla V.A., Vavasseur A., Raghavendra A.S. // Plant Sci. 2003. V. 164. № 4. P. 481–488.
Hsu Y.Y., Chao Y.Y., Kao C.H. // J. Plant Physiol. 2013. V. 170. № 1. P. 63–69.
Яруллина Л.Г., Трошина Н.Б., Черепанова Е.А., Заикина Е.А., Максимов И.В. // Прикл. биохимия и микробиология. 2011. Т. 47. № 5. С. 602–608.
Minibayeva F., Kolesnikov O., Chasov A., Beckett R.P., Lüthje S., Vylegzha-nina N., Buck F., Böttger M. // Plant Cell Environ. 2009. V. 32. № 5. P. 497–508.
Шарова Е.И., Медведев С.С. // Физиология растений. 2017. Т. 64. № 1. С. 3–18.
Berna A., Bernier F. // Plant Mol. Biol. 1999. V. 39. № 3. P. 539–549.
Huang X., Stettmaier K., Michel C., Hutzler P., Mueller M.J., Durner J. // Planta. 2004. V. 218. № 6. P. 938–946.
Hsu Y.Y., Kao C.H. // Crop Environ. Bioinformatics. 2012. V. 9. P. 160–167.
Shan C., Zhou Y., Liu M. // Protoplasma. 2015. V. 252. № 5. P. 1397–1405.
Карпец Ю.В., Колупаев Ю.Е., Косаковская И.В. // Физиология растений и генетика. 2016. Т. 48. № 2. С. 158–166.
Munemasa S., Mori I.C., Murata Y. // Plant Signal. Behav. 2011. V. 6. № 7. P. 939–941.
Noriega G., Cruz D.S., Batlle A., Tomaro M., Balestrasse K. // J. Plant Growth Regul. 2012. V. 31. P. 79–89.
Колесников Я.С., Кретинін С.В. // Допов. Нац. акад. наук Укр. 2018. № 10. С. 95–102.
Zalabák D., Pospisilová H., Smehilová M., Mrizová K., Frebort I., Galuszka P. // Biotechnol. Adv. 2013. V. 31. № 1. P. 97–117.
Liu L., Li H., Zeng H., Cai Q., Zhou X., Yin C. // J. Plant Growth Regul. 2016. V. 35. № 2. P. 366–376.
Jang G., Chang S.H., Um T.Y., Lee S., Kim J.-K., Do Choi Y. // Sci. Rep. 2017. V. 7. Art. 10212. https://doi.org/10.1038/s41598-017-10634-1
Shakirova F.M., Avalbaev A.M., Bezrukova M.V., Fatkhutdinova R.A., Maslennikova D.R., Yuldashev R.A., Allagulova C.R., Lastochkina O.V. // Phytohormones and Abiotic Stress Tolerance in Plants / Eds. N.A. Khan., R. Nazar, N. Iqbal, N.A. Anjum. Berlin, Heidelberg: Springer-Verlag, 2012. P. 18 –228.
Merewitz E.B., Du H., Yu W., Liu Y., Gianfagna T., Huang B. // J. Exp. Bot. 2012. V. 63. № 3. P. 1315–1328.
Frebort I., Kowalska M., Hluska T., Frebortova J., Galuszka P. // J. Exp. Bot. 2011. V. 62. № 8. P. 2431–2452.
Avalbaev A., Yuldashev R., Fedorova K., Somov K., Vysotskaya L., Allagulova C., Shakirova F. // J. Plant Physiol. 2016. V. 191. P. 101–110.
Battal P., Erez M.E., Turker M., Berber I. // Ann. Bot. Fenn. 2008. V. 45. № 3. P. 173–185.
Schäfer M., Meza-Canales I.D., Navarro-Quezada A., Brütting C., Vanková R., Baldwin I.T., Meldau S. // J. Integr. Plant Biol. 2015. V. 57. № 2. P. 198–212.
Hou X., Lee L.Y.C., Xia K., Yan Y., Yu H. // Dev. Cell. 2010. V. 19. № 6. P. 884–894.
Achard P., Cheng H., De Grauwe L., Decat J., Schoutteten H., Moritz T., Van Der Straeten D., Peng J., Harberd N.P. // Science. 2006. V. 311. № 5757. P. 91–94.
Mahonen A.P., Ten Tusscher K., Siligato R., Smetana O., Diaz-Trivino S., Salojarvi J., Wachsman G., Prasad K., Heidstra R., Scheres B. // Nature. 2014. V. 515. № 7525. P. 125–129.
Shan C., Wang T., Zhou Y., Wang W. // Biol. Plant. 2018. V. 62. P. 188–193.
Banerjee A., Tripathi D.K., Roychoudhury A. // Plant Physiol. Biochem. 2018. V. 132. P. 46–53.
Simontacchi M., Garcia-Mata C., Bartoli C.G. Santa-María G.E., Lamattina L. // Plant Cell Rep. 2013. V. 32. № 6. P. 853–866.
Scheler C., Durner J., Astier J. // Curr. Opin. Plant Biol. 2013. V. 16. № 4. P. 534–539.
Barrera-Ortiz S., Garnica-Vergara A., Esparza-Reynoso S., García-Cárdenas E., Raya-González J., Ruiz-Herrera L.F., López-Bucio J. // J. Plant Growth Regul. 2018. V. 37. P. 438–451.
Li H., Li M., Wei X., Zhang X., Xue R., Zhao Y., Zhao H. // Mol. Genet. Genomics. 2017. V. 292. № 5. P. 1091–1110.
Ton J., Flors V., Mauch-Mani B. // Trends Plant Sci. 2009. V. 14. № 6. P. 310–317.
Palmieri M.C., Sell S., Huang X., Scherf M., Werner T., Durner J., Lindermayr C. // J. Exp. Bot. 2008. V. 59. № 2. P. 177–186.
Ястреб Т.О., Колупаев Ю.Е., Карпец Ю.В., Дмитриев А.П. // Физиология растений. 2017. Т. 64. № 2. С. 142–150.
Ястреб Т.О., Колупаев Ю.Е., Шкляревский М.А., Дмитриев А.П. // Физиология растений. 2020. Т. 67. № 5. С. 482–489.
Cheng T., Hu L., Wang P., Yang X., Peng Y., Lu Y., Chen J., Shi J. // Int. J. Mol. Sci. 2018. V. 19. P. 188. https://doi.org/10.3390/ijms19010188
Shoji T., Hashimoto T. // Plant Cell Physiol. 2011. V. 52. № 6. P. 1117–1130.
Zhang H.B., Bokowiec M.T., Rushton P.J., Han S.C., Timko M.P. // Mol. Plant. 2012. V. 5. № 1. P. 73–84.
Lackman P., González-Guzmán M., Tilleman S., Carqueijeiro I., Pérez A.C., Moses T., Seo M., Kanno Y., Häkkinen S.T., Montagu M.C.E.V., Thevelein J.M., Maaheimo H., Oksman-Caldentey K.M., Rodriguez P.L., Rischer H., Goossens A. // Proc. Natl. Acad. Sci. USA. 2011. V. 108. № 14. P. 5891–5896.
Lorenzo O., Chico J.M., Sanchez-Serrano J.J., Solano R. // Plant Cell. 2004. V. 16. № 7. P. 1938–1950.
Yadav V., Mallappa C., Gangappa S.N., Bhatia S., Chattopadhyay S. // Plant Cell. 2005. V. 17. № 7. P. 1953–1966.
Abe H., Urao T., Ito T., Seki M., Shinozaki K., Yamaguchi-Shinozaki K. // Plant Cell. 2003. V. 15. № 1. P. 63–78.
Yastreb T.O., Kolupaev Yu.E., Lugovaya A.A., Dmitriev A.P. // Cytol. Genet. 2017. V. 51. № 5. P. 325–330.
Adie B., Perez-Perez J., Perez-Perez M.M. Godoy M., Sánchez-Serrano J.J., Schmelz E.A., Solano R. // Plant Cell. 2007. V. 19. № 5. P. 1665–1681.
Sanchez-Romera B., Ruiz-Lozano J.M., Li G. Luu D.T., Martínez-Ballesta Mdel C., Carvajal M., Zamarreno A.M., García-Mina J.M., Maurel C., Aroca R. // Plant Cell Environ. 2014. V. 37. № 4. P. 995–1008.
Wasternack C. // Ann. Bot. 2007. V. 100. № 4. P. 681–697.
Stenzel I., Hause B., Maucher H., Pitzschke A., Miersch O., Ziegler J., Ryan C.A., Wasternack C. // Plant J. 2003. V. 33. № 3. P. 577–589.
Stenzel I., Hause B., Miersch O. Kurz T., Maucher H., Weichert H., Ziegler J., Feussner I., Wasternack C. // Plant Mol. Biol. 2003. V. 51. № 6. P. 895–911.
Kramell R., Miersch O., Atzorn R., Parthier B., Wasternack C. // Plant Physiol. 2000. V. 123. № 1. P. 177–188.
Kang D., Seo Y., Lee J.D., Ishii R., Kim K.U., Shin D.H., Park S.K., Lee I. // J. Agron. Crop Sci. 2005. V. 191. № 4. P. 273−282.
Ryu H., Cho Y.-G. // J. Plant Biol. 2015. V. 58. P. 147−155.
Walia H., Wilson C., Wahid A., Condamine P., Cui X., Close T.J. // Funct. Integr. Genomics. 2005. V 6. № 2. P. 143–156.
Abouelsaad I., Renault S. // J. Plant Physiol. 2018. V. 226. P. 136–144.
Du H., Liu H., Xiong L. // Front. Plant Sci. 2013. V. 4:397. https://doi.org/10.3389/fpls.2013.00397
Hu Y., Jiang L., Wang F., Yu D. // Plant Cell. 2013. V. 25. № 8. P. 2907–2924.
Xu Y.H., Liao Y.C., Zhang Z., Liu J., Sun P.W., Gao Z.H., Sui C., Wei J.H. // Sci. Rep. 2016. V. 6.21843. https://doi.org/10.1038/srep21843
Balfagon D., Sengupta S., Gomez-Cadenas A., Fritschi F.B., Azad R.K., Mittler R., Zandalinas S.I. // Plant Physiol. 2019. V. 181. № 4. P. 1668–1682.
Walia H., Wilson C., Condamine P., Liu X., Ismail A.M., Close T.J. // Plant Cell Environ. 2007. V. 30. № 4. P. 410–421.
Яковлева В.Г., Егорова А.М., Тарчевский И.А. // Доклады АН. 2013. Т. 449. № 2. С. 236–239.
Hu Y., Jiang Y., Han X., Wang H., Pan J., Yu D. // J. Exp. Bot. 2017. V. 68. № 6. P. 1361–1369.
Sharma M., Laxmi A. // Front Plant Sci. 2015. V. 6. 1129. https://doi.org/10.3389/fpls.2015.01129
Игнатенко А.А., Таланова В.В., Репкина Н.С., Титов А.Ф. // Труды Карельского научного центра РАН. 2020. № 3. С. 121–129.
Wang C.Y., Buta G. // Environ. Exp. Bot. 1994. V. 34. № 4. P. 427–432.
González-Aguilar G.A., Fortiz J., Cruz R., Baez R., Wang C.Y. // J. Agric. Food Chem. 2000. V. 48. № 2. P. 515–519.
González-Aguilar G.A., Tiznado-Hernández M.E., Zavaleta-Gatica R., Martínez-Téllez M.A. // Biochem. Biophys. Res. Commun. 2004. V. 313. № 3. P. 694–701.
Dar T.A., Moin U., Khan M.M.A., Hakeem K.R., Jaleel H. // Environ. Exp. Bot. 2015. V. 115. P. 49–57.
Sayyari M., Babalar M., Kalantari S., Martínez-Romero D., Guillén F., Serrano M., Valer D. // Food Chem. 2011. V. 124. № 3. P. 964–970.
Jin P., Zheng Y., Tang S., Rui H., Wang C.Y. // Postharvest Biol. Technol. 2009. V. 52. № 1. P. 24–29.
Jin P., Duan Y., Wang L., Wang J., Zheng Y. // Food Bioprocess Technol. 2014. V. 7. P. 2259–2266.
Koshiyama M., Watanabe K., Fujisawa H., Mitomi M., Imamura K. // Plant Growth Dev. 2006. V. 41. P. 24–33.
Wang S.Y. // J. Plant Growth Regul. 1999. V. 18. № 3. P.127–134.
Alam M.M., Nahar K., Hasanuzzaman M., Fujita M. // Plant Biotechnol. Rep. 2014. V. 8. P. 279–293.
Ge Y.X., Zhang L.J., Li F.H., Chen Z.B., Wang C., Yao Y.C., Han Z.H., Zhang J., Shi Z.S. // Afr. J. Agric. Res. 2010. V. 5. № 15. P. 1978–1983.
Безрукова М.В., Лубянова А.Р., Масленникова Д.Р., Васильев И.Д., Шакирова Ф.М. // Экобиотех. 2019. Т. 2. № 4. С. 553–558.
Abdelgawad Z.A., Khalafaallah A.A., Abdallah M.M. // Agric. Sci. 2014. V. 5. № 12. P. 1077–1088.
Ястреб Т.О., Колупаев Ю.Е., Швиденко Н.В., Луговая А.А., Дмитриев А.П. // Прикл. биохимия и микробиология. 2015. Т. 51. № 4. С. 412–416.
Ястреб Т.О., Колупаев Ю.Е., Луговая А.А., Дмитриев А.П. // Прикл. биохимия и микробиология. 2016. Т. 52. № 2. С. 223–229.
Yastreb T.O., Kolupaev Yu.E., Shvidenko N.V., Dmitriev A.P. // Ukr. Biochem. J. 2018. V. 90. № 5. P. 50–59.
Qiu Z.B., Guo J.L., Zhu A.J., Zhang L., Zhang M.M. // Ecotoxicol. Environ. Saf. 2014. V. 104. P. 202–208.
Shahzad A.N., Pitann B., Ali H., Qayyum M.F., Fatima A., Bakhat H.F. // J. Agron. Crop Sci. 2015. V. 201. P. 443–451.
Jiang M., Xu F., Peng M., Huang F., Meng F. // Acta Physiol. Plant. 2016. V. 38. 106. doi org/https://doi.org/10.1007/s11738-016-2120-z
El-Sayed O.M., El-Gammal O.H.M., A Salama.S.M. // Sci. Horticult. 2014. V. 176. P. 32–37.
Poonam S., Kaur H., Geetika S. // Amer. J. Plant Sci. 2013. V. 4. P. 817–823.
Yan Z., Zhang W., Chen J., Li X. // Biol. Plant. 2015. V. 59. P. 373–381.
Yan Z., Chen J., Li X. // Ecotoxicol. Environ. Saf. 2013. V. 98. P. 203–209.
Ali E., Hussain N., Shamsi I.H., Jabeen Z., Siddiqui M.H., Jiang L.X. // J. Zhejiang Univ. Sci. B. (Biomed. Biotechnol.). 2018. V. 19. № 2. P. 130-146.
Mir M.A., Sirhindi G., Alyemeni M.N., Alam P., Ahmad P. // J. Plant Growth Regul. 2018. V. 37. P. 1195–1209.
Кузнецов В.В. // Актуальные проблемы картофелеводства: фундаментальные и прикладные аспекты. Материалы Всеросс. научно-практ. конф. с междунар. участием. Томск: Издательский Дом Томск. гос. ун-та, 2018. С. 12–15.
Desikan R., Cheung M.K., Bright J., Henson D., Hancock J.T., Neill S.J. // J. Exp. Bot. 2004. V. 55. № 395. P. 205–212.
Колупаев Ю.Е., Карпец Ю.В., Кабашникова Л.Ф. // Прикл. биохимия и микробиология. 2019. Т. 55. № 5. С. 419–440.
Liu X., Chi H., Yue M., Zhang X., Li W., Jia E. // Plant Growth Regul. 2012. V. 31. P. 436–447.
Ma C., Wang Z.Q., Zhang L.T., Sun M.M., Lin T.B. // Photosynthetica. 2014. V. 52. № 3. P. 377–385.
Kumari G.J., Reddy A.M., Naik S.T., Kumar S.G., Prasanthi J., Sriranganayakulu G., Reddy P.C., Sudhakar C. // Biol. Plant. 2006. V. 50. № 2. P. 219–226.
Shana C., Liang Z. // Plant Sci. 2010. V. 178. P. 130–139.
Максимов И.В., Сорокань А.В., Черепанова Е.А., Сурина О.Б., Трошина Н.Б., Яруллина Л.Г. // Физиология растений. 2011. Т. 58. № 2. С. 243–251.
Sirhindi G., Mir M.A., Abd-Allah E.F., Ahmad P., Gucel S. // Front. Plant Sci. 2016. V. 7. Art. 591. https://doi.org/10.3389/fpls.2016.00591
Ahmad P., Alyemeni M.N., Vijaya L., Alam P., Ahanger M.A., Alamri S.A. // Archives Agron. Soil Sci. 2017. V. 63. № 13. P. 1889–1899.
Azeem U. // Russ. Agric. Sci. 2018. V. 44. № 3. P. 209–215.
Leon-Cisneros S., Quirola-Garcés A., Alvarez-Santana J., Barriga-Medina N., Ramirez-Villacís D., Caviedes M., Ramirez-Cárdenas L., Leon-Reyes A. // Cereal Res. Commun. 2019. V. 47. № 4. P. 604–614.
Yan Z., Chen J., Li X. // Ecotoxicol. Environ. Saf. 2013. V. 98. P. 203–209.
Farooq M.A., Gill R.A., Islam F., Ali B., Shu J., Liu H., He S., Zhou W. // Front Plant Sci. 2016. V. 7. Art. 468. https://doi.org/10.3389/fpls.2016.00468
Kaur H., Sirhindi G., Sharma P. // J. Plant Physiol. Biochem. 2017. V. 9. № 4. P. 36–42
Sharma A., Kumar V., Huwei Y., Kanwar M.K., Bhardwaj R., Kumar A.T., Zheng B. // Front. Plant Sci. 2018. V. 9. Art. 1609. https://doi.org/10.3389/fpls.2018.01609
Coelho D.G., Andrade M.H., Marinato C. S., Araujo S.C., de Matos L.P. da Silva V.M., de Oliveira J.A. // Acta Physiol. Plant. 2020. V. 42. Art. 97https://doi.org/10.1007/s11738-020-03086-0
Sheyhakinia S., Bamary Z., Einali A., Valizadeh J. // Biologia. 2020. V. 75. P. 681–692.
Guo J., Pang Q., Wang L., Yu P., Li N., Yan X. // Proteome Sci. 2012. V. 10. № 1. P. 1–13.
Dombrecht B., Xue G.P., Sprague S.J., Kirkegaard J.A., Ross J.J., Reid J.B., Fitt G.P., Sewelam N., Schenk P.M., Manners J.M., Kazan K. // Plant Cell. 2007. V. 19. № 7. P. 2225–2245.
Казанцева В.В., Гончарук Е.А., Фесенко А.Н., Широкова А.В., Загоскина Н.В. // С.-х. биология. 2015. Т. 50. № 5. С. 611–619.
Радюкина Н.Л., Михеева Л.Е., Карбышева Е.А. // Успехи соврем. биологии. 2019. Т. 139. № 3. С. 254–266.
Szabados L., Savoure A. // Trends Plant Sci. 2010. V. 15. № 2. P. 89–97.
Liang X., Zhang L., Natarajan S.K., Becker D.F. // Antioxid. Redox Signal. 2013. V. 19. № 9. P. 998–1011.
Sheteawi S.A. // Int. J. Agri. Biol. 2007. V. 9. № 3. P. 473–478.
Zhao M.L., Wang J.N., Shan W., Fan J.G., Kuang J.F., Wu K.Q., Li X.P., Chen W.X., He F.Y., Chen J.Y., Lu W.J. // Plant Cell Environ. 2013. V. 36. № 1. P. 30–51.
Ahmad R.M., Cheng C., Sheng J., Wang W., Ren H., Aslam M., Yan Y. // Int. J. Mol. Sci. 2019. V. 20. № 24. Art. 6202. https://doi.org/10.3390/ijms20246202
Savchenko T.V., Rolletschek H., Dehesh K. // Plant Cell Physiol. 2019. V. 60. № 12. P. 2613–2620.
Garcia A.B. Engler J., Iyer S., Gerats T., Van Montagu M., Caplan A.B. // Plant Physiol. 1997. V. 115. № 1. P. 159–169.
Bita C.E., Gerats T. // Front. Plant Sci. 2013. V. 4. Art. 273. https://doi.org/10.3389/fpls.2013.00273
Yoshida M., Kawakami A. // Plant and Microbe Adaptations to Cold in a Changing World / Eds. R. Imai, M. Yoshida, N. Matsumoto. New York: Springer Science + + Business Media, 2013. P. 231–243.
Caffery M., Tonseca V., Carl Leopold A. // Plant Physiol. 1988. V. 86. № 3. P. 754–758.
Аверьянов А.А., Лапикова В.П. // Биохимия. 1989. Т. 54. № 10. С. 1646–1651.
Ramel F., Sulmon C., Bogard M., Couée I., Gouesbet G. // BMC Plant Biol. 2009. V. 9. 28. https://doi.org/10.1186/1471-2229-9-28
Chen Y., Pang Q., Dai S., Wang Y., Chen S., Yan X. // J. Plant Physiol. 2011. V. 168. № 10. P. 995–1008.
Аллагулова Ч.Р., Авальбаев А.М., Шакирова Ф.М. // Экобиотех. 2019. Т. 2. № 3. С. 307–311.
Sharma M., Laxmi A. 2016. // Front. Plant Sci. V. 6. Art. 1129. https://doi.org/10.3389/fpls.2015.01129
Chen J., Yan Z., Li X. // Ecotoxicol. Environ. Saf. 2014. V. 104. P. 349–356. https://doi.org/10.1016/j.ecoenv.2014.01.022
Montillet J.L., Leonhardt N., Mondy S., Tranchimand S., Rumeau D., Boudsocq M., Garcia A.V., Douki T., Bigear J., Lauriere C., Chevalier A., Castresana C., Hirt H. // PLOS Biol. 2013. V. 11. № 3: e1001513.
de Ollas C., Dodd I.C. // Plant Mol. Biol. 2016. V. 91. P. 641–650.
Suhita D., Raghavendra A.S., Kwak J.M., Vavasseur A. // Plant Physiol. 2004. V. 134. № 4. P. 1536–1545.
Ястреб Т.О., Колупаев Ю.Е., Карпец Ю.В., Дмитриев А.П. // Вісн. Харків. нац. аграрн. ун-ту. Сер. Біологія. 2017. № 3 (42). С. 72–80.
Liu X., Shi W., Zhang S., Lou C. // Chinese Sci. Bull. 2005. V. 50. № 6. P. 520–525.
Munemasa S., Oda K., Watanabe-Sugimoto M., Nakamura Y., Shimoishi Y., Murata Y. // Plant Physiol. 2007. V. 143. № 3. P. 1398–1407.
Yastreb T.O., Kolupaev Yu.E., Kokorev A.I., Horielova E.I., Dmitriev A.P. // Cytol. Genet. 2018. V. 52. № 6. P. 400–405.
Munns R. // Plant Cell Environ. 2002. V. 25. № 2. P. 239–250.
Веселов Д.С., Маркова И.В., Кудоярова Г.Р. // Успехи соврем. биологии. 2007. Т. 127. № 5. С. 482–493.
Yastreb T.O., Kolupaev Yu.E., Shkliarevskyi M.A., Dyachenko A.I., Dmitriev A.P. // Cytol. Genet. 2020. V. 54. № 4. P. 318–323.
Anderson J.P., Badruzsaufari E., Schenk P.M., Manners J.M., Desmond O.J., Ehlert C., Maclean D.J., Ebert P.R., Kazan K. // Plant Cell. 2004. V. 16. № 12. P. 3460–3479.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


