Прикладная биохимия и микробиология, 2020, T. 56, № 4, стр. 390-400
Влияние ассоциативных микроорганизмов на рост и устойчивость растений к ксенобиотикам и фитопатогенам
С. В. Пиголева 1, Н. С. Захарченко 1, *, О. В. Фурс 1, С. В. Тарлачков 1, 2, Т. В. Фунтикова 2, А. Е. Филонов 2, 4, А. В. Ариповский 3, О. В. Дьяченко 1, Я. И. Бурьянов 1, Т. В. Шевчук 1
1 Филиал Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
142290 Московской обл., Пущино, Россия
2 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Московской обл., Пущино, Россия
3 Научно-производственная компания ООО Фирма “А-БИО”
142290 Московской обл., Пущино, Россия
4 Тульский государственный университет
300012 Тульская обл., Тула, Россия
* E-mail: znata_2008@mail.ru
Поступила в редакцию 03.12.2019
После доработки 17.02.2020
Принята к публикации 25.02.2020
Аннотация
Исследованы эффекты колонизации томата (Lucopersicon esculentum Mill.) и табака (Nicotiana ta-bacum L.), бактериями Pseudomonas fluorescens, Acinetobacter baumannii, Rhodococcus erythropolis, Pseudomonas aureofaciens, Pseudomonas putida, Methylovorus mays. Колонизация бактериями приводила к их стабильной ассоциации с растениями, у которых повышалась скорость роста, урожайность и адаптация к условиям in vivo. Колонизированные растения проявляли повышенную устойчивость к бактериальным фитопатогенам Erwinia carotovora и Pseudomonas syringae. Растения, колонизированные бактериями с устойчивостью к нафталину проявляли стабильный рост на среде с этим соединением. Полученные результаты указывают на перспективность использования ассоциативных микроорганизмов для разработки методов защиты растений от биотических и абиотических стрессовых факторов.
Повышение продуктивности растений и их устойчивости к различным биотическим и абиотическим стрессовым факторам является важной задачей современной биотехнологии. Одним из путей решения этой задачи является разработка методов защиты растений от фитопатогенов и ксенобиотиков с помощью их колонизации ассоциативными микроорганизмами. Ассоциированные с растениями микроорганизмы оказывают стимулирующее влияние на рост и урожай растений за счет способности к азотфиксации, вытеснению и подавлению роста патогенов, образованию физиологически активных веществ, мобилизации питательных элементов из почвы [1–3]. Способность ассоциаций растений с микроорганизмами-деструкторами можно также использовать в биотехнологии для защиты окружающей среды [4–6]. Ассоциированные микроорганизмы способны устанавливать с растениями прочную симбиотическую связь [7], что указывает на перспективность их применения в условиях конкуренции с микроорганизмами различных агробиоценозов. На основе метода колонизации возможно создание экологически безопасных биопрепаратов для стимуляции роста сельскохозяйственных растений и защиты их от болезней [8–10]. Применение традиционных микробиологических препаратов для защиты растений приводит к кратковременным положительным эффектам и требует нескольких обработок растений в период вегетации. Это связано с применением в качестве защитных биопрепаратов таких микроорганизмов, которые, будучи антагонистами фитопатогенов, не являются активными колонизаторами растений. Таким образом, изучение ассоциативных связей между растениями и ассоциативными микроорганизмами важно для разработки экологически чистого способа защиты растений от патогенов и удаления из окружающей среды чужеродных соединений.
Томат (Lycopersicon esculentum L.) – второая по значимости овощная культура после картофеля, используемая также и для производства различных продуктов [11].
Цель работы – исследование физиолого-биохимических особенностей взаимодействия растений томата и табака с ассоциативными микроорганизмами.
МЕТОДИКА
Растительный материал. Объектами исследования служили растения томата (Lucopersicon esculentum) сорта Джина и табака (Nicotiana tabacum L.) сорта Самсун. Семена стерилизовали в 2%-ном растворе гипохлорита натрия (“Лабтех”, Россия) и промывали 3 раза по 10 мин в стерильной воде. Семена проращивали in vitro на агаризованной безгормональной среде Мурасиге-Скуга (МС) [12]. Растения выращивали при температуре 22–24°С и 16-часовом световом дне и освещeнности 2.5 клк. Проростки черенковали 1 раз в месяц.
Микроорганизмы и условия их культивирования. В качестве ассоциативных микроорганизмов использовали штаммы: Pseudomonas aureofaciens BS1393, Pseudomonas fluorescens 142NF, Pseudomonas putida BS3701 (pBS1141, pBS1142), Acinetobacter baumannii 7, Rhodococcus erythropolis S67, метилобактерии Methylovorus mays ВКМВ-2221 (табл. 1), полученные в Институте биохимии и физиологии микроорганизмов имени Г.К. Скрябина РАН (Пущино, Россия) (табл. 1) [7, 13–16]. Бактерии A. baumannii, R. erythropolis и бактерии рода Pseudomonas выращивали до D660 1.0 при 28°C на роторной качалке (120 об./мин) в колбах Эрленмейера на 750 мл с 200 мл среды LB [17], содержащей бактотриптон (“Difco”, США) – 10 г/л, дрожжевой экстракт (“Difco”, США) – 5 г/л и NaCl – 10 г/л. (“Химмед”, Россия).
Таблица 1.
Способность бактерий к росту на различных субстратах
Метилобактерии выращивали на среде Канеда (К), содержащей (г/л): KH2PO4 – 2.0 (“CarlRoth”, Германия); (NH4)2SО4 – 2.0 (“Химмед”, Россия); NaCl – 0.5 (“Химмед”, Россия); MgSO4 · 7H2О – 0.125 (“Химмед”, Россия); FeSO4 – 0.002 (“Химмед”, Россия); агар – 12.0 (“Difco”, США), с добавлением 1.0% СН3ОН в качестве источника углерода и энергии [14] до оптической плотности (D660) 1.5, на роторной качалке (120 об./мин) в колбах Эрленмейера на 750 мл с 200 мл среды К при 37°С. Для колонизации использовали суспензию бактерий плотностью 2–3 × 105 КОЕ/мл.
В качестве фитопатогенных штаммов использовали бактерии Erwinia carotovora subsp. сarotovora B15 (Horticulture Сentre, Канада) и Pseudomonas syringae, полученный из коллекции Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН (Пущино, Россия). Остальные бактерии выращивали в жидкой среде LB.
Колонизация растений ассоциативными бактериями. Семена и молодые побеги томата и табака обрабатывали суспензией ассоциативных бактерий. Для этого семена помещали в жидкую культуру бактерий с титром 103–105 на 1–2 мин, подсушивали на фильтровальной бумаге и переносили на чашки Петри, со средой МС.
Молодые побеги однократно опрыскивали 1 мл суспензии бактерий с титром 103–105 и культивировали в стеклянных пробирках. В качестве контроля на среду МС помещали необработанные бактериями семена и побеги, и культивировали при 22–24°С и 16-часовом фотопериоде при освещенности 2 клк. Колонизированные и укорененные растения in vitro переносили в теплицу станции искусственного климата Биотрон.
Биотесты на стабильность ассоциаций. Микробиологическое тестирование различных эксплантов растений (листьев или корней) проводили через 7, 14 и 49 сут после колонизации. Для этого растительный экстракт, полученный путем гомогенизации 1 см2 растительной ткани, наносили на поверхность твердой питательной среды LB или K с селективными антибиотиками в чашках Петри и инкубировали при температуре 22–24°С 2 сут, затем проводили подсчет КОЕ на 1 см2 площади растительной ткани.
Устойчивость колонизированных растений к нафталину и нефти. Нафталин (“Химмед”, Россия) растворяли в спирте (исходный раствор 100 мг/мл). В расплавленную агаризованную среду МС добавляли нафталин (50–100 мкг/мл) или нефть (0.5–0.7%). Нефть получена с нефтеперерабатывающего завода (“Газпромнефть” – Московский НПЗ”, Москва, Россия). Характеристики вносимой нефти: плотность – 0.868 г/см2; содержание воды – 0.06%; содержание солей – 45 мг/мл; механические примеси – 0.0080%; содержание серы – 1.42%; состав фракций (%): гексановая – 62.29; бензольная – 13.49; спиртобензольная – 11.21. В приготовленные пробирки пересаживали свежечеренкованные растения и проводили наблюдение за ростом растений в течение месяца.
Влияние нафталина на водоемкость, водообеспечение, водный дефицит растений томата. Для исследования влияния нафталина на водный режим [18] листья раскладывали на среду МС с нафталином (3–15 мкг/мл) и без нафталина (контроль), и инкубировали в чашках Петри течение 20 ч при температуре 22–24°С. Затем листья взвешивали (А), отмывали в дистиллированной воде и перекладывали в воду на 2 ч. Через 2 ч листья снова взвешивали (С) и высушивали в сушильном шкафу при температуре 60°С в течение 16 ч. Сухие листья снова взвешивали (D) и проводили расчет по формулам:
Определение перекисного окисления липидов. Уровень перекисного окисления липидов (ПОЛ) оценивали спектрофотометрически по тесту с тиобарбитуровой кислотой (ТБК) (“Acros” Индия), основанному на взаимодействии ТБК с конечными продуктами окисления липидов, основную долю которых составлял малоновый диальдегид (МДА) (“Sigma”, США) [19]. Для этого растительный материал (300 мг) растирали в 5 мл 0.1 М Трис-НСl буфера (“Sigma”, США), pH 7.5, с 0.35 М NaCl (“Химмед”, Россия), отбирали 1.5 мл экстракта и добавляли к нему 1.0 мл 0.5%-ного ТБК в 20%-ной трихлоруксусной кислоте (ТХУ, “Химмед”, Россия). Смесь нагревали на кипящей водяной бане в течение 30 мин, затем очень быстро охлаждали во льду и центрифугировали при 12 000 об./мин в течение 5 мин. После этого измеряли оптическую плотность проб при 532 и 600 нм.
Биотесты на изолированных листьях и растениях. Для проверки устойчивости колонизированных растений к фитопатогенам молодые листья инфицировали суспензией бактерий E. carotovorа и P. syringae. В качестве контроля служили листья не колонизированных растений. Фитопатогенными бактериями (суспензия 103–105 кл./мл) инокулировали черешки листьев колонизированных и не колонизированных растений, помещали их на агаризованную питательную среду МС в чашки Петри и выдерживали их в закрытых емкостях при 24°С и 16-часовом световом дне, через 1–7 сут оценивали степень повреждения. Целые растения заражали уколом иглы, смоченной в суспензии патогенных бактерий. В каждом варианте опыта заражали по 4 листа. В таблицах представлены средние арифметические величины и их стандартные отклонения по 3–5 опытам в 3 биологических повторностях в каждом из них n = 9–15 [7].
Анализ жирнокислотного состава семян томата. Подготовка пробы. Перевод липидов пробы в метиловые эфиры соответствующих высших жирных кислот выполняли методом безэкстракционного последовательного метилирования растворами метоксида натрия и трехфтористого бора в метаноле [20]. Каждый из образцов измельчали в кофемолке и просеивали сквозь сито с ячейками размером 0.7 мм. К навеске 16.0–22.0 мг порошкообразной пробы добавляли раствор 500 мкг маргариновой кислоты в 220 мкл толуола (внутренний стандарт) и 350 мкл 1.0 М метанольного раствора метоксида натрия. Смесь нагревали 20 мин при 70°С, добавляли 400 мкл 15%-ного трехфтористого бора в метаноле и нагревали еще 20 мин при 70°С. К реакционной смеси добавляли 0.7 мл воды и 2 мл перегнанного гептана, и экстрагировали метиловые эфиры жирных кислот в органическую фазу, которую далее анализировали хроматографическим методом.
Хроматография. Анализ выполняли на аналитическом газовом хроматографе НР5890м (“Хьюлетт-Пакард”, США). Использована кварцевая капиллярная колонка размером 15 м × 0.2 мм × × 0.2 мкм с полярной фазой “Супелковакс-10” м (“Supelco”, Швейцария), ввод пробы (0.5 мкл) – с делением потока газа-носителя (1 : 40). Температурная программа анализа – от 120°С (0.5 мин) до 240°С (5 мин) со скоростью 10°С/мин. Температуры испарителя/детектора (ДИП) – 260 и 255°С. Для регистрации сигнала использовали интегратор пиков “НР 3396А” (“Хьюлетт-Пакард”, США). Количественное определение жирных кислот масла семян томата выполнено методом внутреннего стандарта. Внутренний стандарт – маргариновую кислоту (17 : 0) вносили в каждый из образцов исследуемого материала непосредственно перед его химической дериватизацией.
Определение сахаров и оксикислот в томатном соке. Подготовка образцов. К 50 мкл исследуемого сока добавляли 50 мкл водного раствора D-маннита с концентрацией 1.0 мг/мл (внутренний стандарт) и упаривали раствор досуха в вакууме ротационной сушилки “Савант спидвак” (“Savant Ins-trument IN”, США). К сухому остатку добавляли 50 мкл 2%-ного раствора гидрохлорида метоксиамина в пиридине и нагревали при 80°С в течение 15 мин, после чего добавляли 120 мкл чистого бис (N,O-триметилсилил)трифторацетамида и дополнительно нагревали при 80°С в течение 30 мин. Состав смеси полученных триметилсилильных эфиров анализировали методом газовой хроматографии.
Хроматография. Анализ выполняли на аналитическом газовом хроматографе НР5890 (“Хьюлетт-Пакард”, США) со следующими параметрами процесса: использована кварцевая капиллярная колонка SPB-1, размером 20 м × 0.2 мм × 0.2 мкм, газ-носитель – гелий (1.8 мл/мин), метод ввода пробы – с делением потока газа-носителя (1 : 65), объем вводимой жидкой пробы – 1 мкл, температурная программа анализа – от 80°С (0.5 мин) до 310°С со скоростью 10°С/мин, температуры испарителя и пламенно-оинизационного детектора (ДИП) – 280 и 320°С соответственно. Для регистрации сигнала использовали интегратор пиков НР3396А. Для количественной обработки результатов использовали метод внутреннего стандарта с добавлением D-маннита [21].
Биометрические исследования. Для определения влияния ассоциативных бактерий на рост и развитие растений томата и табака и их адаптацию к условиям закрытого грунта, колонизированные растения из стерильных условий высаживали в закрытый грунт станции искусственного климата “Биотрон” ФИБХ РАН (Пущино, Россия). Биометрические измерения проводили еженедельно, отмечая время наступления фенологических фаз.
Статистические методы анализа. Для статистической обработки данных использовали программы Statistica 6.0 и MS Excel 2007. Измерения проводили в трех аналитических и трех биологических повторностях. На графиках и диаграммах приведены средние значения и их стандартные отклонения. Достоверность различий оценивали с использованием непараметрического критерия Мана–Уитни.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Колонизация растений. Колонизацию растений бактериальными штаммами проводили в условиях in vitro. Стерильные растения однократно опрыскивали суспензией одной из бактерий P. fluorescens, A. baumannii, R. erythropolis, P. aureofaciens, P. putida, M. mays (табл. 1), с титром клеток 103 – 105. Через 1–2 нед. после черенкования проводили тестирование на установление ассоциативной связи бактерий с растениями in vitro. Затем растения высаживали в теплицу на 7 нед. после колонизации проводили тестирование растений in vitro. Для этого экстракты, полученные из растительных эксплантов, наносили на поверхность питательной среды с селективными антибиотиками в чашках Петри и инкубировали 2 сут при температуре 22–24°С (табл. 2). Через 1 нед. после колонизации томатов бактериями их численность на корнях увеличивалась с 2.4 × 103 до 2.0 × × 104 КОЕ/г сырой массы, через 7 нед. с 3.2 × 103 до 3.6 × 104 КОЕ/г сырой массы. В последующих циклах микроразмножения растений содержание бактерий M. mays, P. fluorescens, P. putida, P. aureofaciens, A. baumannii и R. erythropolis в корнях сохранялось стабильно практически на одном уровне в течение всего периода вегетации, что указывало на их прочную ассоциацию с растениями.
Таблица 2.
Количество бактерий на корнях томата после колонизации в рассчете на 1 г сырой массы*
| Колонизация, штамм |
Время выращивания, сут | ||
|---|---|---|---|
| 7 | 14 | 49 | |
| М. mays | – | 2.45 ± 0.23 | 2.50 ± 0.29 |
| P. fluorescens | 3.30 ± 0.34 | 3,43 ± 0.29 | 3.53 ± 0.31 |
| P. putida | 3.15 ± 0.38 | 3.24 ± 0.30 | 3.34 ± 0.32 |
| P. aureofaciens | 3.34 ± 0.45 | 3.38 ± 0.31 | 3.49 ± 0.41 |
| A. baumannii | 2.38 ± 0.29 | 3.45 ± 0.27 | 3.55 ± 0.45 |
| R. erythropolis | 3.30 ± 0.43 | 3.42 ± 0.38 | 3.49 ± 0.48 |
Влияние колонизации на рост и развитие растений. Растения, колонизированные штаммами Pseudomonas и M. mays, отличались повышенной скоростью роста по сравнению с контрольными растениями (не колонизированными) (табл. 3). Бутонизация, цветение и плодоношение также начинались раньше у колонизированных растений. К 5 нед. роста в теплице растения, колонизированные М. mays, практически все уже были с бутонами (91%), количество бутонов у растений, колонизированных другими штаммами, было от 40 до 75%, а у контрольных растений – 42%. Цветение томатов наблюдали у 5–10% (от общего количества) растений, колонизированных P. aureofaciens, М. mays и P. putida на 6 нед. после высадки в теплицу, в то время как цветение контрольных растений начиналось только на 7 нед. (табл. 4). Колонизация растений положительно влияла на урожайность растений томата. Число плодов на одном колонизированном растении увеличилось в среднем на 10–20%, по сравнению с контрольными неколонизированными растениями (табл. 4). Средняя масса одного плода у контрольных растений составила 80.4 г. У колонизированных растений масса одного плода была в среднем выше на 2.1–17.7%. Растения томатов, колонизированные исследуемыми штаммами превосходили по урожайности контрольные растения на 14.6–45.9% (табл. 5).
Таблица 3.
Высота колонизированных растений (см) через 1–7 нед. выращивания в теплице, см
| Вариант | Время выращивания, нед | ||||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| M. mays | 3.8 ± 0.3 | 6.8 ± 0.5 | 11.4 ± 1.0 | 19.3 ± 1.7 | 29.7 ± 2.5 | 40.5 ± 4.1 | 50.2 ± 5.0 |
| P. fluorescens | 4.3 ± 0.4 | 7.1 ± 0.6 | 12.2 ± 1.1 | 21.2 ± 1.9 | 31.3 ± 3.1 | 40.3 ± 3.9 | 48.5 ± 4.5 |
| P. putida | 5.1 ± 0.4 | 12.7 ± 0.9 | 13.7 ± 1.3 | 19.1 ± 1.6 | 25.2 ± 2.4 | 31.3 ± 3.1 | 45.6 ± 4.3 |
| P. aureofaciens | 4.7 ± 0.3 | 10.8 ± 1.1 | 12.9 ± 1.2 | 14.6 ± 1.3 | 26.6 ± 2.5 | 34.7 ± 3.5 | 43.7 ± 4.2 |
| A.baumannii | 3.4 ± 0.4 | 7.6 ± 0.6 | 11.4 ± 1.0 | 15.9 ± 1.5 | 20.8 ± 2.0 | 26.0 ± 2.4 | 35.5 ± 3.1 |
| R. erythropolis | 5.9 ± 0.5 | 14.3 ± 1.2 | 15.5 ± 1.4 | 22.1 ± 2.0 | 27.7 ± 2.7 | 39.3 ± 3.8 | 41.4 ± 4.0 |
| Контроль | 4.3 ± 0.4 | 6.7 ± 0.5 | 10.1 ± 0.8 | 15.7 ± 1.4 | 26.4 ± 2.5 | 35.0 ± 3.3 | 42.1 ± 4.3 |
Таблица 4.
Бутонизация, цветение и плодоношение томатов (%) при колоницации различными штаммами бактерий
| Колонизация, штамм |
Показатель | Время выращивания, нед | ||||
|---|---|---|---|---|---|---|
| 5 | 6 | 7 | 8 | 9 | ||
| M. mays | Бутонизация | 91 | 100 | 100 | 100 | 100 |
| Цветение | – | 10 | 82 | 100 | 100 | |
| Плодоношение | – | – | – | 54.5 | 100 | |
| P. fluorescens | Бутонизация | 75 | 85 | 96 | 100 | 100 |
| Цветение | – | – | 76 | 100 | 100 | |
| Плодоношение | – | – | – | 50 | 100 | |
| P. putida | Бутонизация | 71 | 80 | 95 | 100 | 100 |
| Цветение | – | 10 | 70 | 100 | 100 | |
| Плодоношение | – | – | – | 45 | 100 | |
| P.aureofaciens | Бутонизация | 65 | 79 | 90 | 100 | 100 |
| Цветение | – | 5 | 68 | 90 | 100 | |
| Плодоношение | – | – | 20 | 92 | ||
| A.baumannii | Бутонизация | 40 | 55 | 90 | 100 | 100 |
| Цветение | – | – | 29 | 93 | 97 | |
| Плодоношение | – | – | 15 | 86 | ||
| R.erythropolis | Бутонизация | 41 | 62 | 95 | 100 | 100 |
| Цветение | – | – | 30 | 55 | 88 | |
| Плодоношение | – | – | – | 19 | 90 | |
| Контроль | Бутонизация | 42 | 75 | 100 | 100 | 100 |
| Цветение | – | – | 33 | 41.7 | 100 | |
| Плодоношение | – | – | – | 16.7 | 91.7 | |
Таблица 5.
Урожайность томатов при колонизации растений различными штаммами бактрий
| Колонизация, штамм |
Масса одного плода, г | Количество плодов на 1 растении (15 нед) | Урожай с 1 растения, г | Число семян в 1 плоде |
|---|---|---|---|---|
| M. mays | 90.4 ± 8.3 | 7.4 ± 0.6 | 668.9 ± 62 | 105.3 ± 9.4 |
| P. fluorescens | 88.5 ± 7.8 | 6.1 ± 0.4 | 539.8 ± 49 | 129.5 ± 11.2 |
| P. putida | 84.4 ± 9.1 | 6.7 ± 0.5 | 565.4 ± 57 | 131.1 ± 10.7 |
| P. aureofaciens | 85.6 ± 6.9 | 6.2 ± 0.4 | 530.7 ± 51 | 110.4 ± 11.6 |
| A. baumannii | 94.7 ± 9.4 | 5.9 ± 0.6 | 558.7 ± 61 | 99.8 ± 8.7 |
| R. erythropolis | 82.1 ± 8.5 | 6.4 ± 0.4 | 525.4 ± 48 | 126.8 ± 13.4 |
| Контроль | 80.4 ± 7.6 | 5.7 ± 0.5 | 458.2 ± 39 | 74.36 ± 7.9 |
Устойчивость колонизированных растений к нафталину и нефти. В экспериментах по устойчивости растений к нефти и нафталину использовали растения табака. Бактерии штаммов P. putida BS3701, P. fluorescens 142NF содержали гены салицилатгидроксилаз NahG и NahU, которые играют основную роль в деградации токсичных полициклических ароматических углеводородов. [14, 22].
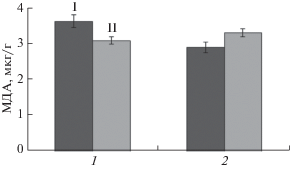
Контрольные и колонизированные P. putida растения были высажены на среды МС с добавлением нафталина 50, 70 и 100 мкг/мл. На среде с концентрацией нафталина 50 мкг/мл растения выращивались в течение месяца. При наблюдении за их ростом было отмечено, что как неколонизированные, так и колонизированные хорошо укоренялись, росли и внешне не отличаются от растений, растущих на среде МС без нафталина. Через 1 сут роста на среде с нафталином в растениях определяли уровень перекисного окисления липидов (ПОЛ). У контрольных и колонизированных растений, растущих на нафталине, уровень ПОЛ практически не отличался от уровня растений, растущих на среде МС без нафталина (рис. 1).
Рис. 1.
Влияние нафталина на уровень ПОЛ у контрольных (1) и колонизированных (2) растений при выращивании in vitro в течение 1 сут. I – контроль, на среде МС, II – на среде МС с добавлением 50 мг/мл нафталина.
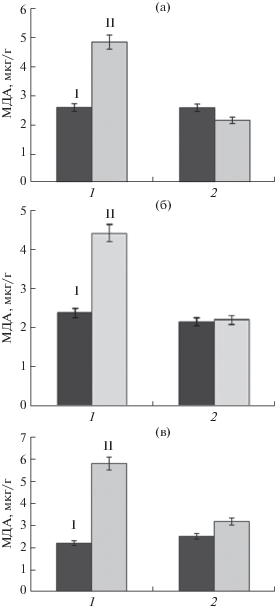
При концентрации нафталина в среде 70 мкг/мл было показано, что колонизация растений микроорганизмами значительно повышала их устойчивость к этому ксенобиотику. Увеличение уровня ПОЛ на 85–86% по сравнению с растениями, растущими без нафталина, отмечали через 4, 7 сут выращивания на нафталине (рис. 2). У колонизированных P. рutida растений уровень ПОЛ на среде с нафталином незначительно отличался от уровня ПОЛ растений, выращенных на среде МС без нафталина (рис. 2). Через 7 сут культивирования растений на среде с 70 мкг/мл нафталина отмечали пожелтение листьев контрольных растений, в то время как у колонизированных растений листья оставались зелеными. Уровень ПОЛ у контрольных растений на среде с нафталином увеличивался на 160%, что указывало на сильный стресс для этих растений (рис. 2в), в то же время колонизированные растения практически не испытывали абиотический стресс при выращиивании на среде МС с 70 мкг/мл нафталина в течение 7 сут.
Рис. 2.
Влияние нафталина на уровень ПОЛ у контрольных (1) и колонизированных (2) растений in vitro после первых (а) четвертых (б) и 7 сут (в) выращивания: I – среда МС; II – среда МС с добавлением 70 мг/мл нафталина.
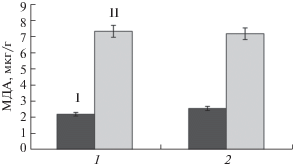
При повышении концентрации нафталина в среде до 100 мкг/мл наблюдали потерю тургора листьев контрольных растений. Листья колонизированных растений сохраняли тургор и зеленый цвет. Уровень ПОЛ растений определяли через 7 сут роста на среде с нафталином. При этом уровень ПОЛ у контрольных растений увеличивался на 230% и у колонизированных на 179%, что означало высокую токсичность его для растений обеих групп (рис. 3).
Рис. 3.
Влияние нафталина на уровень ПОЛ у контрольных (1) и колонизированных P. putida (2) растений in vitro при выращивании в течение суток. I – среда МС, II – среда МС с добавлением 100 мг/мл нафталина.
Влияние нафталина на водный режим растений томата. Для определения водного режима растений листья колонизированных и контрольных растений, выросших in vivo, подвергали абиотическому стрессу, выдерживая их в парах нафталина 3–15 мкг/мл в течение 20 ч. Растения, колонизированные P. putida были более устойчивы к стрессу, несмотря на действие нафталина и повышение водного дефицита в листьях до 20% (табл. 6). При повышении концентрации нафталина происходило нарушение метаболизма, листья теряли массу и погибали. У контрольных растений нарушение метаболизма наступало уже при концентрации нафталина 3 мкг/мл и измерение водного режима становилось недоступным.
Таблица 6.
Водный режим листьев томата, колонизированных Pseudomonas putida
| Концентрация нафталина, мкг/мл | Водоемкость | Водообеспечение | Водный дефицит |
|---|---|---|---|
| Листья растений, колонизированные Pseudomonas putida | |||
| 3 | 90.26 ± 9.7 | 81.42 ± 8.0 | 18.57 ± 1.7 |
| 5 | 90.10 ± 8.8 | 73.05 ± 7.2 | 20.18 ± 2.2 |
| 10 | |||
| 15 | |||
| Вода | 87.67 ± 8.7 | 89,00 ± 8.6 | 9.64 ± 0.7 |
| Листья контрольных растений | |||
| 3 | – | – | – |
| 5 | – | – | – |
| 10 | – | – | – |
| 15 | – | – | – |
| Вода | 88.55 ± 8.6 | 90.92 ± 9.1 | 9.07 ± 0.7 |
Определение отношения площади листа к сухой массе наглядно показало, что при повышении концентрации стрессового агента происходило нарастание распада веществ как у колонизированных так и контрольных растений (табл. 7). Концентрации нафталина 10–15 мкг/мл оказались токсичными для клеток, и через сутки наблюдалась гибель листьев при таких концентрациях.
Таблица 7.
Изменение отношения площади листа к сухому весу в зависимости от концентрации нафталина
| Вариант | Концентрация нафталина, мкг/мл | Sлиста/сухой вес |
|---|---|---|
| Колонизированные Pseudomonas putida |
3 нафталина | 1.01 × 10–3 |
| 5 | 0.91 × 10–3 | |
| 10 | 0.57 × 10–3 | |
| 15 | 0.47 × 10–3 | |
| Вода | 0.9 × 10–3 | |
| Неколонизированные (контроль) |
3 | 0.92 × 10–3 |
| 5 | 0.84 × 10–3 | |
| 10 | 0.7 × 10–3 | |
| 15 | – | |
| Вода | 1.15 × 10–3 |
Исследование колонизированных растений, растущих на нефти. Для исследования устойчивости колонизированных растений к нефти растения высаживали на среду с различными концентрациями нефти (0.5–0.7%). Через неделю культивирования колонизированных растений на среде с нефтью на корнях обнаруживали рост бактерий P. putida. Для этого экстракты корней наносили на поверхность питательной среды с селективными антибиотиками и, после образования колоний через 2 сут, проводили подсчет КОЕ P. putida. (Данные не приведены). Предварительно для выполнения эксперимента на поверхность среды МС наносили 0.5–0.7% нефти (от объема среды). На эту среду высаживали контрольные и колонизированные P. putida растения, за которыми наблюдали в течение месяца. Стресс, обусловленный влиянием нефти, действовал на обе группы растений, однако колонизированные растения были более жизнеспособны за счет присутствия на корнях бактерий-нефтедеструкторов. На среде с содержанием нефти 0.5% колонизированные растения сохраняли способность к росту и образованию новых почек в течение времени эксперимента – 27 дней (рис. 4а), а повышение концентрации нефти до 0.7% в среде приводило к полной гибели контрольных растений и частичной гибели колонизированных растений, при этом верхушечные листья колонизированных растений оставались зелеными (рис. 4б).
Рис. 4.
Растения табака, культивируемые на среде с 0.5 (а) и 0.7%-ным (б) содержанием нефти. Растения в момент высадки (1, 2) и через 27 сут выращивания (3, 4). 1, 3 – контрольные растения; 2, 4 – растение, колонизированное Р. putida

Устойчивость колонизированных растений к фитопатогенам. Уже через 1 сут после инокуляции на контрольных листьях, зараженных бактериальным штаммом E. carotovora, отмечали разрушение ткани мезофилла. К концу 2 сут поражение площади контрольных листьев составляло 100%. При заражении растений P. syringae признаки повреждения наблюдались через 4–5 сут – листья желтели и покрывались бурыми пятнами. В то же время листья растений, колонизированных P. aureofaсiens и M. mays, оставались без признаков повреждения (рис. 5а). Аналогичные симптомы болезни наблюдались при заражении целых растений. Колонизированные растения оставались неповрежденными в течение всего времени эксперимента, в то время как контрольные растения полностью погибали (рис. 5б).
Рис. 5.
Устойчивость отдельных листьев колонизированных P. aureofaciens растений томата к Erwinia carotovora (а) и P. syringae (б). 1 – лист контрольного растения – пожелтение и некроз ткани; 2 – лист колонизированного растения – полное сохранение первоначальных плотности и цвета.

Анализ жирнокислотного состава масла семян томатов. Семена томатов являются основным побочным продуктом при изготовлении томатной пасты в промышленности, которые составляют около 71–72% от общего производства отходов [23]. Масло семян томатов является отличным источником ценных жирных кислот (ЖК), которое используется в пищевой, фармацевтической и косметической промышленности [24].
Исследовано влияние колонизации растений микробными штаммами на жирнокислотный состав семян томатов. Результаты относительного содержания индивидуальных ЖК к массе всех ЖК семян приведены в табл. 8. Анализ показал увеличение процентной доли насыщенных ЖК стеариновой (С18:0) от 4.3% в контроле до 5.0–6.3% в опыте (колонизированные растения) и олеиновой (С18:1) от 18.5% в контроле до 19.7–20.1% в опыте, в зависимости от штамма. Суммарное содержание ЖК в биомассе семян (вес./%) было выше у семян колонизированных растений.
Таблица 8.
Состав и относительное содержание (%) жирных кислот липидов семян контрольных и колонизированных растений томата (Lucopersicon esculentum Mill.)*
| Жирная кислота** | Контроль | P.aureofaciens | P.putida | P.fluorescens | R.erythropulis | A.baumannii | M. mays |
|---|---|---|---|---|---|---|---|
| Пальмитиновая (С16:0) | 13.5 | 12.9 | 13.6 | 13.1 | 13.2 | 13.0 | 14.3 |
| Стеариновая (С18:0) | 4.29 | 6.11 | 4.62 | 5.33 | 4.95 | 6.25 | 5.14 |
| Олеиновая (цис-9-октадеценовая, С18:1) | 18.5 | 19.7 | 18.5 | 19.7 | 19.6 | 20.1 | 20.1 |
| Линолевая (октадека Диеновая, С18:2 – ω6) |
61.2 | 56.5 | 60.1 | 58.3 | 58.3 | 53.7 | 57.0 |
| α-Линоленовая (октадекатриеновая, С18:3 – ω3) | 2.51 | 2.45 | 3.38 | 2.54 | 2.63 | 2.35 | 2.40 |
| Арахиновая (эйкозановая, С20:0) | 0.34 | 0.44 | 0.35 | 0.38 | 0.41 | 0.46 | 0.46 |
| Суммарное весовое содержание ЖК в биомассе семян, вес/% | 26.2 | 26.9 | 26.6 | 28.8 | 29.5 | 30.8 | 26.4 |
* Приведены средние арифметические величины 3 аналитических измерений из 3 биологических повторностей. Во всех случаях величина стандартного отклонения не превышала 3% от среднего. ** В липидах растений содержались также пальмитолеиновая кислота (цис-9-гексадеценовая, С16:1-цис-9) и гондоиновая (цис-11-эйкозеновая) (С20:1), концентрация каждой из которых составляла ≤2%.
Известно, что липиды являются интегральными компонентами клеточных мембран. Среди групп липидов важное место занимают стерины, которые стабилизируют мембраны и контролируют их проницаемость. В растениях стерины в больших количествах обнаруживались в тех органах и тканях, которые интенсивно функционируют и содержат большое число делящихся клеток: меристема, хлоропласты, семена [25]. При стрессовых воздействиях на растение, таких как низкая температура уровень стеринов повышается и тем самым стабилизирует состояние растительного органа [26]. В состав стеринов входит олеиновая кислота. В экспериментах доля олеиновой кислоты в семенах повышалась после колонизации, что указывало на мобилизацию некоторых защитных систем растений.
Анализ сахаров и оксикислот в томатном соке. В томатном соке растений, колонизированными штаммами M. mays и P. fluorescens, обнаружены углеводы – фруктоза и глюкоза, оксикислоты – яблочная и лимонная (табл. 9). Различия в количестве сахаров и оксикислот в колонизированных томатах и контрольных практически не наблюдали.
Таблица 9.
Содержание кислот (мг/100 г сырого веса) и сахаров в зрелых плодах колонизированных растений томатов
| Штамм, используемый для колонизации растений | Яблочная кислота | Лимонная кислота | Фруктоза, г/кг | Глюкоза г/кг |
|---|---|---|---|---|
| M. mays | 60.0 ± 6.4 | 55.8 ± 5.6 | 12.5 ± 1.2 | 9.5 ± 0.9 |
| P. fluorescens | 65.9 ± 6.2 | 90.4 ± 8.7 | 10.9 ± 1.3 | 7.7 ± 0.8 |
| Контроль | 66.0 ± 7.1 | 62.1 ± 6.3 | 11.4 ± 1.1 | 8.0 ± 0.6 |
Таким образом, методы создания стабильной ассоциации растений с микроорганизмами, способными стимулировать их рост, эффективно конкурировать с фитопатогенами и вызывать деградацию чужеродных соединений в окружающей среде, перспективны для восстановления микробных биоценозов и поддержания естественного плодородия почв.
Работа выполнена по Госзаданию № 0101-2014-0046, РК 01201352439 и при частичной финансовой поддержке грантов РФФИ № 19.08.00375, 18-08-00752, 19-08-00299
Список литературы
Haas D., Defago G. // Nat. Rev. Microbiol. 2005. V. 3. № 4. P. 307–319.
Lugtenberg B., Kamilova F. // Annu. Rev. Microbiol. 2009. V. 63. P. 541–556.
Glick B.R. // Hindawi Publishing Corporation Scientifica. 2012. V. 2012. Article ID 963401, 15 p. https://doi.org/10.6064/2012/963401
Ветрова А.А., Овчинникова А.А., Пунтус И.Ф., Филонов А.Е., Боронин А.М. // Биотехнология. 2009. № 4. С. 82–90.
Филонов А.Е., Ахметов Л.И., Пунтус И.Ф., Есикова Т.З., Гафаров А.Б., Кошелева И.А., Боронин А.М. // Микробиология. 2010. Т. 79. № 2. С. 1–7.
Тихонович И.А., Борисов А.Ю., Васильчиков А.Г., Жуков В.А., Кожемяков А.П., Наумкина Т.С., Штарк О.Ю., Яхно В.В., Чеботарь В.К. //Зернобобовые и крупяные культуры. 2012. № 3. С. 11–17.
Захарченко Н.С., Пиголева С.В., Кочетков В.В., Чепурнова М.А., Дьяченко О.В., Лебедева А.А., Захарченко А.В., Пунтус И.Ф., Боронин А.М., Бурья-нов Я.И. // Физиология растений. 2012. Т. 59. № 1. С. 89–98.
Цавкелова Е.А., Климова С.Ю., Чердынцева Т.А., Нетрусов А.И. // Прикл. биохимимя и микробиология. 2006. Т. 42. № 2. С. 133–143.
Кожемяков А.П. Белоброва С.Н., Орлова А.Г. // Сел.-хоз. биология. 2011. С. 112–115.
Логинов О.Н. Бактерии Pseudomonas и Azotobacter как объекты сельскохозяйственной биотехнологии. М.: Наука, 2005. 166 с.
Knobilich M., Anderson B., Latshaw D. // J. Sci. Food Agric. 2005. V. 85. P. 1166–1170.
Murashige T., Skoog F. // Physiol. Plant., 1962, V. 15. № 3. P. 473–497.
Hol W.H.G., Bezemer T.M., Biere A. // Front. Plant. Sci. 2013. V. 10. № 4. P. 81. https://doi.org/10.3389/fpls.2013.00081
Анохина Т.О., Сиунова Т.В., Сизова О.И., Захарченко Н.С. Кочетков В.В. // Агрохимия. 2018. № 10. С. 54–66.
Доронина Н.В., Кудинова Л.В., Троценко Ю.А. // Микробиология. 2000. Т. 69. С. 712–716.
Larkin M.J., Kulakov L.A., Allen C.C. // Curr. Opin. Biotechnol. 2005. V. 16. № 3. C. 282–-290.
Sambrook J., Fritsch E.E., Maniatis T. // Molecular Cloning: A Laboratory Manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 1626 p.
Кузнецов В.В., Дмитриева Г.А. // Физиология растений. М.: ''Высшая школа'', 2005. 742 с.
Uchiyama M. // Analytic. Biochem., 1978. V. 86. P. 287–297.
Griffiths M.J., van Hille R.P., Harrison S.T. // Lipids. 2010. V. 11. № 45. P. 1053–1060.
Knapp D.R. Handbook of Analytical Derivatization Reactions. USA: Wiley–Interscience Publication, 1979. 553 p.
Пунтус И.Ф., Рязанова Л.П., Звонарев А.Н., Фунтикова Т.В., Кулаковская Т.В. // Прикл. биохимия и микробиология. 2015. Т. 51. № 2. С. 198–205.
Fahimdanesh M., Bahram M.E. // J. Nutr. Food Sci. 2013. V. 3. № 3. https://doi.org/10.4172/2155-9600.1000206
Botinestean C., Gruia A.T., Jianu I. // J. Material Cycles and Waste Management. 2015. V. 17. № 1. P. 118–124.
Grunwald C. // Plant Physiol., 1970. V. 45. № 4. P. 663–666.
Девятловская А.Н., Журавлева Л.Н., Алашкевич Ю.Д. Химия растительного сырья. 2014. № 2. С. 195–198.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


