Прикладная биохимия и микробиология, 2020, T. 56, № 4, стр. 352-357
Ферментативный синтез электропроводящего сополимера анилина и 2-аминофенэтилового спирта с функциональными группами
М. Е. Хлупова 1, Г. П. Шумакович 1, И. С. Васильева 1, Е. А. Зайцева 2, О. В. Морозова 1, А. И. Ярополов 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва, Россия
* E-mail: yaropolov@inbi.ras.ru
Поступила в редакцию 13.01.2020
После доработки 03.02.2020
Принята к публикации 25.02.2020
Аннотация
Сополимеры анилина и 2-аминофенэтилового спирта были синтезированы на матрице полисульфокислоты, поли(2-акриламидо-2-метил-1-пропансульфоновой) кислоты в присутствии высоко редокс-потенциальной грибной лакказы Trametes hirsuta в качестве катализатора окислительной сополимеризации. Атмосферный кислород являлся окислителем. Псевдоводорастворимые сополимер/полисульфокислота комплексы были охарактеризованы различными физико-химическими методами. Удельная электропроводность сополимеров зависела от исходного молярного соотношения мономеров. Наилучшими характеристиками обладал сополимер, синтезированный при соотношении 2-аминофенэтиловый спирт : анилин, равном 2 : 8. Показана возможность использования системы лакказа/медиатор для окисления первичных спиртовых групп сополимера до реакционноспособных альдегидных групп.
В последние годы наблюдается интерес к разработке материалов для использования в различных биомедицинских устройствах [1]. Для этих целей перспективными являются электропроводящие полимеры, обладающие собственной электронной проводимостью, биосовместимостью и механическими свойствами, превосходящими свойства традиционных материалов на основе металлов [2]. Получение электропроводящих полимеров с функциональными группами расширяет возможности их практического использования [3].
Полианилин (ПАНИ) и его производные представляют собой один из наиболее перспективных классов органических электропроводящих полимеров благодаря простоте получения, стабильности в условиях окружающей среды и хорошей электропроводимости [4–6]. Основным недостатком незамещенных π-сопряженных полимеров, в том числе и ПАНИ, является их недостаточная растворимость в большинстве растворителей [6]. Для улучшения технологичности использования ПАНИ были разработаны различные подходы. К ним относятся: (1) допирование основной цепи полимера различными органическими и полисульфокислотами [7–11], (2) получение методом in situ композитов ПАНИ с термопластичными полимерами [12], (3) гомополимеризация производных анилина [7, 11, 13–15], а также (4) сополимеризация анилина с другими мономерами или с его производными [11, 15–19]. Два последних подхода позволяют не только улучшить эксплуатационные характеристики синтезируемых полианилинов, но и получать полимер с реакционноспособными группами, которые в дальнейшем можно модифицировать различными соединениями, в том числе биомолекулами.
К традиционным способам получения ПАНИ относятся химический и электрохимический синтез [2, 4, 5]. Использование в качестве биокатализаторов для его синтеза ферментов является более привлекательным, поскольку реакции проводятся в мягких условиях с высокой степенью кинетического контроля реакции [19–21]. Ферментативные реакции характеризуются как экологически чистые процессы. Ранее было показано, что лакказа Trametes hirsuta катализирует полимеризацию анилина, в результате которой образуется электропроводящий ПАНИ [8–10, 22, 23].
Лакказа (п-дифенол кислород оксидоредуктаза, КФ 1.10.3.2) относится к группе медьсодержащих оксидаз и катализирует окисление различных соединений, включая ароматические фенолы и амины, атмосферным кислородом, который в результате реакции восстанавливается до воды [24]. В качестве биокатализатора лакказа имеет широкий спектр промышленного применения [25, 26]. В последнее время этот фермент привлекает все большее внимание в качестве катализатора для тонкого органического синтеза [27, 28].
Цель работы – ферментативная сополимеризация анилина (АНИ) и 2-аминофенэтилового спирта (АФС) на матрице поли(2-акриламидо-2-метил-1-пропансульфоновой) кислоты (ПАМПС) и модификация сополимера с использованием лакказа-медиаторной системы.
МЕТОДИКА
АФС, ПАМПС и (2,2,6,6-тетраметилпиперидин-1-ил)оксил (ТЕМПО) (“Aldrich”, США), диаммонивая соль 2,2'-азино-бис-(3-этилбензтиозолин-6-сульфокислоты) (АБТС) и NaF (“Sigma”, США), NaOH, цитрат натрия и лимонная кислота (“Riedel-de Haën”, Германия) были использованы без дополнительной очистки. АНИ (“Sigma-Aldrich”, США) был очищен вакуумной перегонкой.
Лакказу с удельной активностью 163 МЕ/мг выделяли из культуральной жидкости базидиального гриба T. hirsuta согласно методу [29]. Активность фермента определяли спектрофотометрически, используя в качестве хромогенного субстрата 1 мМ раствор АБТС (λ = 420 нм; ε = 36 000 M–1 см–1) в 0.1 М Na-цитратно-фосфатном буфере, рН 4.5. За единицу активности принимали количество фермента, катализирующего окисление 1 мкм АБТС за 1 мин.
Ферментативную сополимеризацию АНИ и АФС на матрице ПАМПС проводили в 0.1 М Na-цитратном буфере, рН 2.8, при различном молярном соотношении мономеров (9 : 1, 8 : 2, 7 : 3 и 5 : 5). К 10 мл раствора, содержащего 10 ммоль ПАМПС (в пересчете на повторяющее звено), добавляли определенное количество мономеров и перемешивали в течение 1 ч. Сополимеризацию инициировали добавлением лакказы (удельная активность в реакционной среде ~0.4 МЕ/мл) и проводили в течение 24 ч при 22–23°C. Для удаления непрореагировавших мономеров реакционную смесь диализовали против 0.1 М Na-цитратного буфера, рН 2.8. Ферментативный синтез гомополимеров (ПАНИ/ПАМПС и ПАФС/ПАМПС) осуществляли в аналогичных условиях. Все растворы готовили с использованием воды, очищенной на установке Simplicity (“Millipore”, США).
Первичные спиртовые группы сополимера окисляли в присутствии лакказа-медиаторной системы (ЛМС) после добавления к 9 мл раствора сополимера 1 мл 10 мМ раствора ТЕМПО в 0.1 М Na-цитратном буфере, рН 2.8, и лакказы (удельная активность в реакционной среде ~0.4 МЕ/мл). Реакцию проводили при постоянном перемешивании в течение 1 ч при комнатной температуре (22–23°C) и останавливали добавлением 1 мл 10 мМ раствора NaF.
Для спектрофотометрических исследований использовали спектрофотометр Mini 1240 (“Shimadzu”, Япония). ИК-Фурье спектроскопию (Fourier transform infrared spectroscopy) образцов проводили по стандартной методике на спектрометре Frontier FT-IR/FIR (“PerkinElmer Inc”, США) с использованием таблеток KBr, а измерение электропроводности – стандартным четырехточечным методом на приборе Loresta GP (“Mitsubishi”, Япония).
Морфологию образцов исследовали методом просвечивающей электронной микроскопии (ПЭМ) с использованием просвечивающего электронного микроскопа JEM-100CX/SFG (“Jeol”, Япония).
Электрохимические эксперименты проводили в 0.1 М H2SO4 на вольтамперометрическом анализаторе CV-50W (“BAS”, США) с использованием стеклянной ячейки по трехэлектродной схеме. Электродом сравнения служил хлорсеребряный электрод той же фирмы, а вспомогательным электродом – платиновая проволока диаметром 1 мм. Стержни из спектрального графита (диаметр 3.05 мм, тип RW001, “Ringsdorff Werke GmbH”, Германия) с нанесенными образцами сополимеров являлись рабочим электродом.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
АФС является производным анилина и содержит в орто-положении ‒СН2‒СН2ОН группу. Сополимеризация АНИ и АФС позволит получить электропроводящий полимер, имеющий первичные спиртовые группы. Катализируемую лакказой сополимеризацию мономеров АФС и АНИ проводили на матрице полисульфокислоты ПАМПС, что позволило получить водорастворимые дисперсии комплексов поли(анилин-со-2-аминофенэтиловый спирт)/ПАМПС, в дальнейшем обозначенные как сополимер/ПАМПС. Схема реакции представлена на рис. 1.
Рис. 1.
Схема реакции ферментативной сополимеризации анилина и 2-аминофенэтилового спирта на матрице ПАМПС.
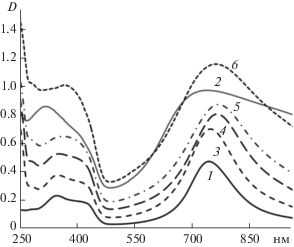
На рис. 2 приведены УФ-видимые спектры сополимер/ПАМПС комплексов, синтезированных при различном молярном соотношении АФС : АНИ, а также спектры гомополимеров ПАНИ/ПАМПС и ПАФС/ПАМПС. На спектре ПАНИ/ПАМПС присутствовали три полосы оптического поглощения, характерные для ПАНИ в электропроводящем состоянии эмеральдиновой соли. Первая полоса в области 360 нм отвечала π–π* электронным переходам в бензеноидных фрагментах полимера. Вторая (420 нм) и третья (750 нм) – соответствовали допированной форме полимера и указывали на формирование полярона, который отвечал за электропроводящие свойства ПАНИ [30]. На спектрах сополимеров при увеличении соотношения АФС : АНИ пик поглощения полярона (750 нм) смещался в длинноволновую область, а пик в области 420 нм, связанный с протонированием (допированием) основной цепи полимера, уменьшался до полного исчезновения на спектре ПАФС/ПАМПС. По-видимому, электрон-донорная группа АФС оказывала существенное влияние на формирование полярона в структуре сополимера [31].
Рис. 2.
УФ-видимые спектры гомополимеров ПАН-И/ПАМПС (1), ПАФС/ПАМПС (2) и сополимеров, синтезированных при различных молярных соотношениях АФС : АНИ – 1 : 9 (3), 2 : 8 (4), 3 : 7 (5) и 5 : 5 (6).
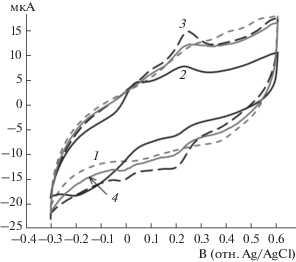
Электрохимическая активность синтезированных сополимеров была изучена методом циклической вольтамперометрии в 0.1 М H2SO4 (рис. 3). На циклических вольтамперограммах всех сополимеров видны две пары катодных и анодных максимумов токов, характеризующихся различной обратимостью. Наиболее четко они проявлялись в сополимере, синтезированном при соотношении АФС : АНИ = 2 : 8, редокс-превращения которого характеризовались двумя парами псевдообратимых пиков с потенциалами средней точки +202 и –75 мВ.
Рис. 3.
Циклические вольтамперограммы сополимер/ПАМПС комплексов, синтезированных при различных молярных соотношениях АФС : АНИ – 1 : 9 (1), 2 : 8 (2), 5 : 5 (3) и 3 : 7 (4); скорость изменения потенциала 50 мВ/с.
Электропроводность сополимеров уменьшалась с увеличением соотношения АФС:АНИ от значения 2.7 мСм/см для ПАНИ/ПАМПС до 4.6 × × 10–5 мСм/см для ПАФС/ПАМПС (табл. 1). Для дальнейших экспериментов был выбран сополимер № 2, синтезированный при исходном соотношении АФС : АНИ = 2 : 8, который наряду с хорошей электропроводностью (2.9 × 10–3 мСм/см) содержал в своем составе значительное количество спиртовых групп.
Таблица 1.
Электропроводность ферментативно синтезированных полимер/ПАМПС комплексов
| Синтезированный полимер | Исходное молярное соотношение АФС : АНИ |
Электропровод-ность, мСм/см |
|---|---|---|
| ПАНИ | 0 : 10 | 2.7 |
| Сополимер № 1 | 1 : 9 | 8.7 × 10–2 |
| Сополимер № 2 | 2 : 8 | 2.9 × 10–3 |
| Сополимер № 3 | 3 : 7 | 2.4 × 10–4 |
| Сополимер № 4 | 5 : 5 | 1.6 × 10–4 |
| ПАФС | 10 : 0 | 4.6 × 10–5 |
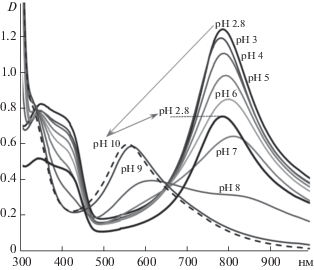
Известно, что ПАНИ, допированный низкомолекулярными кислотами, находится в электропроводящем состоянии (в форме эмеральдиновой соли) только при рН < 3.0, а при более высоких значениях рН переходит в форму эмеральдинового основания, что приводит к потере электропроводности [31], а комплекс ПАНИ/ПАМПС находится в электропроводящем состоянии при рН 6.0–7.0 [10]. Исследование методом УФ-видимой спектроскопии сопополимер/ПАМПС комплекса, ферментативно синтезированного при исходном молярном соотношении АФС : АНИ = 2 : 8, показало, что он также находился в электропроводящем состоянии до рН 7.0 (рис. 4). Смещение полосы поглощения полярона (780 нм) при увеличении pH раствора в коротковолновую область спектра было обусловлено переходом сополимера в дедопированную (не электропроводную) форму. При pH > 8.0 сополимер полностью переходил в дедопированное состояние с характерной полосой поглощения при 550 нм. Данный переход визуально характеризовался изменением цвета раствора с зеленого на голубой. При уменьшении рН среды до первоначального значения 2.8 спектр комплекса практически полностью восстанавливался. Это свидетельствовало об обратимости процесса допирования/дедопирования, что важно для возможного практического использования сополимера.
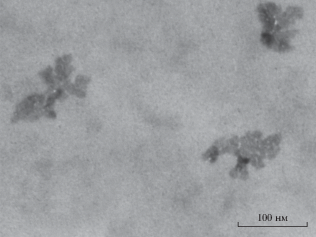
Морфология сополимер/ПАМПС комплекса была изучена методом ПЭМ (рис. 5). Частицы этого комплекса образовывали хлопьевидные структуры, которые могли быть результатом агрегации более мелких гранулярных частиц. Необходимо отметить, что морфология высушенного сополимер/ПАМПС комплекса может отличаться от морфологии комплекса в водной среде.
Рис. 5.
ПЭМ изображение сополимер/ПАМПС комплекса, синтезированного при исходном молярном соотношении АФС : АНИ, равном 2 : 8.
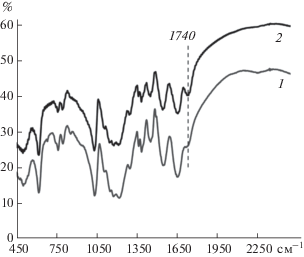
Использование редокс-медиаторов значительно расширяет возможности практического применения лакказ. Редокс-медиаторы – это субстраты лакказы, в результате ферментативного окисления которых образуются стабильные высокопотенциальные продукты, способные вступать в химические (неферментативные) реакции с другими соединениями, которые не подвергаются окислению в присутствии одной лакказы [32]. В литературе имеется множество публикаций по использованию лакказа-медиаторых систем (ЛМС) в тонком органическом синтезе, для делигнификации бумажной пульпы и деградации ксенобиотиков, а также в пищевой, текстильной и косметической промышленности [24, 26–28, 32]. С помощью ЛМС можно эффективно окислять первичные спиртовые группы в “мягких” условиях с образованием реакционноспособных альдегидных групп [27, 33, 34]. В настоящей работе ЛМС на основе ТЕМПО была использована для окисления спиртовых групп сополимер/ПАМПС комплекса. Образование альдегидных групп в цепи сополимера было подтверждено реакцией “серебряного” зеркала, в результате которой на поверхности стеклянной колбы образовывался слой серебра. В контрольном эксперименте с исходным сополимером восстановление ионов серебра не наблюдалось. Исследование исходного и окисленного сополимера методом ИК-спектроскопии показало, что после обработки сополимера системой лакказа/ТЕМПО на спектре появлялся пик в области 1740 см–1, соответствующий колебаниям С=О связи альдегидной группы (рис. 6).
Рис. 6.
ИК-Фурье спектры сополимер/ПАМПС комплекса до (1) и после (2) окисления первичных спиртовых групп с использованием ЛМС.
Таким образом, в работе показана возможность использования грибной лакказы для сополимеризации АНИ и АФС на матрице полисульфокислоты ПАМПС. Синтезированные сополимеры обладали электропроводностью. Первичные спиртовые группы –(СН2)2–ОН в составе сополимера могут быть окислены до реакционноспособных альдегидных групп с помощью лакказа-медиаторной системы. Предложенный подход к синтезу электропроводящих полимеров, имеющих в своем составе функциональные группы, может быть использован для разработки нейроинтерфейсов, систем детекции различных соединений и т.д.
Работа выполнена в рамках государственного задания Института биохимии им. А.Н. Баха ФИЦ Биотехнологии РАН.
При проведении исследований использовалось оборудование Центра коллективного пользования “Промышленные биотехнологии” ФИЦ Биотехнологии РАН.
Список литературы
Mendes P.M. // Chem. Soc. Rev. 2008. V. 37. № 11. P. 2512–2529.
Das T.K.; Prusty S. // Polymer-Plast. Tech. Eng. 2012. V. 51. № 14. P. 1487–1500.
Hackett A.J., Malmström J., Travas-Sejdic J. // Prog. Polym. Sci. 2017. V. 70. P. 18–33.
Bhadra S., Khastgir D., Singha N.K., Lee J.H. // Prog. Polym. Sci. 2009. V. 34. № 8. P. 783–810.
Ćirić-Marjanović G. // Synth. Met. 2013. V. 17. P. 1–47.
Jaymand M. // Prog. Polym. Sci. 2013. V. 38. № 9. P. 1287–2013.
Kulkarni M.V., Viswanath A.K. // Eur. Polym. J. 2004. V. 40. № 2. P. 379–384.
Vasil’eva I.S., Morozova O.V., Shumakovich G.P., Shleev S.V., Sakharov I.Yu., Yaropolov A.I. // Synth. Met. 2007. V. 157. № 18–20. P. 684–689.
Shumakovich G., Kurova V, Vasil’eva I., Pankratov D., Otrokhov G., Morozova O., Yaropolov A. // J. Mol. Cat. B. Enz. 2012. V. 77. P. 105–110.
Shumakovich G.P., Vasil’eva I.S., Morozova O.V., Khomenkov V.G., Staroverova I.N., Budashov I.A., Kurochkin I.N., Boyeva J.A., Sergeyev V.G., Yaropolov A.I. // J. Appl. Polym. Sci. 2010. V. 117. № 3. P. 1544–1550.
Borole D.D., Kapadi U.R., Mahulikar P.P., Hundiwale D.G. // Mater. Lett. 2004. V. 58. № 29. P. 3816–3822.
Abbasian M., Jaymand M., Bonab S.E.S. // J. Appl. Polym. Sci. 2012. V. 125. № S1. P. E131–E140.
Gazotti W.A., DePaoli M.A. // Synth. Met. 1996. V. 80. № 3. P. 263–269.
Gök A., Sari B., Talu M. // Synth. Met. 2004. V. 142. № 1–3. P. 41–48.
Waware U.S., Rashid M., Summers G.J. // Polymer-Plast. Tech. Eng. 2018. V. 57. № 10. P. 1015–1025.
Baek S., Ree J.J., Ree M. // J. Polym. Sci. Part A: Polym. Chem. 2002. V. 40. № 8. P. 983–994.
Fatuch J.C., Soto-Oviedo M.A., Avellaneda C.O., Franco M.F., Romao W., De Paoli M.A., Nogueira A.F. // Synth. Met. 2009. V. 159. № 21–22. P. 2348–2354.
Lashkenari M. S., Eisazadeh H. // Adv. Polym. Technol. 2014. V. 33. № S1. Article number 21466.
Ćirić-Marjanović G., Milojević-Rakić M., Janošević-Ležaić A., Luginbűhl S., Walde P. // Chem. Pap. 2017. V. 71. № 2. P. 199–242.
Xu P., Singh A., Kaplan D. // Adv. Polym. Sci. 2006. V. 194. P. 69–94.
Отрохов Г.В., Морозова О.В., Васильева И.С., Шумакович Г.П., Зайцева Е.А., Хлупова М.Е., Ярополов А.И. // Успехи биологической химии. 2013. Т. 53. С. 355–386.
Стрельцов А.В., Шумакович Г.П., Морозова О.В., Горбачева М.А., Ярополов А.И. // Прикл. биохимия и микробиология 2008. Т. 44. № 3. С. 296–303.
Streltsov A.V., Morozova O.V., Arkharova N.A., Klechkovskaya V.V., Staroverova I.N., Shumakovich G.P., Yaropolov A.I. // J. Appl. Polym. Sci. 2009. V. 114. № 2. P. 928–934.
Yaropolov A.I., Skorobogatko O.V., Vartanov S.S., Varfolomeyev S.D. // Appl. Biochem. Biotechnol. 1994. V. 49. № 3. 257–280.
Mate D.M., Alcalde M. // Microb. Biotechnol. 2017. V. 10. № 6. P. 1457–1467.
Cannatelli M.D., Ragauskas A.J. // Chem. Rec. 2017. V. 17. № 1. P. 122–140.
Witayakran S., Ragauskas A.J. // Adv. Synth. Catal. 2009. V. 351. № 9. P. 1187–1209.
Mogharabi M., Faramarzi M.A. // Adv. Synth. Catal. 2014. V. 356. № 5. P. 897–927.
Горшина Е.С., Русинова Т.В., Бирюков В.В., Морозова О.В., Шлеев С.В., Ярополов А.И. // Прикл. биохимия и микробиология. 2006. Т. 42. № 6. С. 638–644.
Yuan G., Kuramoto N., Su S. // Synth. Met. 2002. V. 129. № 2. P. 173–178.
Haba Y., Segal E., Narkis M., Titelman G., Siegmann A. // Synth. Met. 1999. V. 106. № 1. P. 59–66.
Морозова О.В., Шумакович Г.П., Шлеев С.В., Ярополов А.И. // Прикл. биохимия и микробиология. 2007. Т. 43. № 5. С. 583–597.
Fabbrini M., Galli C., Gentilli P., Macchitella D. // Tetrahedron Lett. 2001. V. 42. № 43. P. 7551–7553.
Galletti P., Pori M., Funiciello F., Soldati R., Ballardini A., Giacomini D. // ChemSusChem 2014. V. 7. № 9. P. 2684–2689.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология