Почвоведение, 2023, № 9, стр. 1190-1202
Оценка направленности и механизмов влияния внесения биоугля на субстрат-индуцированное дыхание почв в длительном лабораторном эксперименте
Е. В. Смирнова a, *, К. Г. Гиниятуллин a, Р. В. Окунев a, А. А. Валеева a, С. С. Рязанов b
a Казанский федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
b Институт проблем экологии и недропользования Академии наук Республики Татарстан
420087 Казань, ул. Даурская, 28, Россия
* E-mail: tutinkaz@yandex.ru
Поступила в редакцию 28.02.2023
После доработки 15.05.2023
Принята к публикации 16.05.2023
- EDN: DVUMZO
- DOI: 10.31857/S0032180X23600312
Аннотация
В лабораторном эксперименте изучали влияние биоугля (БУ) на субстрат-индуцированное дыхание (СИД) почв. В опыте использовали 10 образцов БУ, полученных из древесных и травянистых материалов в двух режимах пиролиза. Интенсивность СИД определяли через 3 сут, 3 и 6 мес. инкубации. При кратковременной инкубации не наблюдалось влияния БУ на СИД. Исключением был вариант с внесением БУ на основе кукурузы, в котором наблюдалось увеличение СИД на 34.6%. При инкубации в течение 3 мес. обнаруживалось значимое увеличение СИД (от 30.4 до 54.8%) при внесении пяти БУ. При инкубации в течение 6 мес. значимое увеличение СИД (от 30.4 до 65.9%) наблюдалось при внесении восьми БУ. Для оценки свойств БУ, оказывающих влияние на СИД, использовали Лассо регрессию и 23 показателя свойств БУ в качестве потенциальных предикторов. Обнаружено, что при трехдневной инкубации положительное влияние на СИД оказывают следующие свойства БУ: содержание окисляемого органического вещества, обменного кальция и рН водной суспензии, а слабое отрицательное – содержание обменного натрия. При инкубации в течение 3 мес. наблюдается положительное влияние окисляемого органического вещества, а через 6 мес. – содержания золы. Поскольку в опытах наблюдалось только положительное статистически значимое влияние БУ на СИД, cделаy вывод, что для объективной оценки эффективности их использования для секвестрации СО2 в почвах необходимы балансовые расчеты, в которых наряду с количеством внесенного в почвы с БУ устойчивого углерода, должно учитываться потенциальное увеличение эмиссии СО2 из почв за счет активации почвенной сапрофитной микробиоты.
ВВЕДЕНИЕ
Почвенный покров играет ключевую роль в поглощении и выделении климатически активных газов атмосферы (СО2, СH4, N2O), которые могут усиливать “парниковый” эффект и создавать опасность глобального изменения климата [6, 14, 15, 34, 71, 79]. Считается, что использование почв в сельском хозяйстве может приводить к потере 30–60% исходного содержания органического углерода (ОУ) [42], а авторы [75] оценили суммарные потери углерода из верхнего слоя почвы (0–30 см) за 12 000 лет сельскохозяйственного использования земель в 31.2 петаграмм (1012 г) углерода (Пг С). Очевидно, что сельскохозяйственные угодья, подвергающиеся деградации, необходимо рассматривать как один из основных источников поступления СО2 в атмосферу, хотя оценки объемов эмиссии углекислого газа из почв в различных литературных источниках существенно различаются [7, 8, 49]. С другой стороны, увеличение содержания органического вещества (ОВ) в почвах, используемых в сельскохозяйственном производстве, рассматривается как вполне жизнеспособная альтернатива смягчения последствий изменения климата за счет компенсации части выбросов парниковых газов, возникающих в результате антропогенной деятельности [20, 37, 67]. Вместе с тем имеются доказательства того, что экстенсивное повышение содержания органического углерода в почве может потенциально компенсировать только 35% исторической оценки углеродного долга сельского хозяйства в 85 Пг С, поступившего в атмосферу из-за преобразования природных экосистем, а по наиболее пессимистичным прогнозам, учитывающим тенденцию к потеплению климата, это количество может уменьшиться к 2040 г. еще на 14% [71]. По мнению Когута с соавт. [4], чтобы считаться секвестрированным, ОВ должно не просто поступить в почву, а стабилизироваться в нем, приобретя способность к медленной минерализации с периодом полного разложения от 10 до 100 лет. Депонированным может считаться органический углерода со временем полного оборота в почве за более чем 100 лет. В последнее время, наряду с традиционными методами увеличения содержания ОВ в почвах, используемых в сельском хозяйстве, уделяется много внимания технологиям закрепления органического углерода в формах, устойчивых к разложению активной и потенциально-активной сапрофитной почвенной микрофлорой [48, 73, 81].
К подобным технологиям можно отнести производство и внесение в почву пиролитически преобразованных растительных остатков, которые являются искусственными аналогами идентифицируемого в составе почв пирогенного “черного углерода” (black carbon (ВС)) природного происхождения [18, 31, 78]. Содержание ВС в определенных почвах может составлять существенную долю от общего содержания органического углерода и выполнять значимые экологические функции [74, 76, 92]. ВС образуется, в основном, в результате неполного сгорания растительных остатков в результате пожаров и представляет собой континуум от частично обугленного растительного материала до частиц графита и сажи [76], однако, только в интенсивно обугленном материале присутствует графитоподобная и полиароматическая структура, устойчивая к микробной деструкции. Несмотря на то, что вопрос о принадлежности ВС к почвенным гумусовым веществам остается открытым [47], гуминовые кислоты, полученные из обугленных растительных остатков и сажи, а не из исходного растительного сырья, рассматриваются, в некоторых работах, как наиболее стабильные составляющие пула почвенного органического вещества (ПОВ) [33]. Не удивительно, что внесение в сельскохозяйственные почвы органических материалов, карбонизированных путем пиролизной обработки, рассматривается как реальная техническая возможность секвестрации углерода атмосферы для смягчения последствий изменения климата [47, 48, 51, 80, 96]. В особенности это актуально с учетом потенциального долговременного положительного влияния получаемого при этом биоугля на почвенное плодородие [12, 13, 40]. В то же время в некоторых работах влияние внесения БУ на продуктивность почв оценивается неоднозначно [42, 61].
Вместе с тем перспектива секвестрации углерода за счет внесения в почву БУ в отдельных источниках ставится под сомнение, а количество подобных работ существенно увеличилось после обнаружения так называемого прайминг-эффекта (ПЭ) – влияния внесения БУ на интенсивность минерализации собственно ПОВ, а также растительных остатков, поступающих в почву [62]. В целом мнение о направленности ПЭ неоднозначно. Положительный ПЭ и увеличение эмиссии СО2 при внесении БУ наблюдали в работах [24, 25, 38, 60, 84, 98]. Другие исследователи [19, 100], наоборот, отмечают отрицательный ПЭ и уменьшение выделения почвами углекислого газа. В отдельных работах показано отсутствие существенного влияния БУ на почвенное дыхание в определенных условиях и в определенных почвах [9, 97, 98]. Существует также мнение, что влияние БУ на почвенное дыхание динамично: положительный ПЭ наблюдается в короткие начальные сроки после его внесения, после чего БУ рассматривается как часть пула ПОВ, устойчивого к окислению [62, 64, 91].
В работе [45] показано, что при внесении в почвы свежеприготовленного БУ выделение СО2 в несколько раз выше, чем при внесении старого БУ, который находился длительное время в контакте с почвой. Данный факт согласуется с отсутствием положительного ПЭ при внесении свежего растительного материала в почвы богатые природным ВС [54]. В длительном (до 1 года) лабораторном эксперименте, проведенном с пятью типами почв и БУ, приготовленными из травянистого и древесного материалов при различных режимах пиролиза, наблюдалось разнонаправленное влияние различных БУ на интенсивность дыхания почв по сравнению с контролем, т.е. наблюдалось как уменьшение (до –52%), так и увеличение (до +89%) эмиссии СО2 [101]. Разнонаправленное влияние на минерализацию почвенного ОВ, в зависимости от типа БУ, почвы и продолжительности взаимодействия, отмечается также в работе [65], основанной на метаанализе литературных данных.
Дискуссионным является вопрос о механизмах влияния БУ на эмиссию СО2 из почв [5, 53, 62]. Их влияние на почвенное дыхание связывают с присутствием доступного (или лабильного) ОВ в пирогенном материале, с повышением эффективности использования доступного органического углерода при локализации почвенных микроорганизмов, ОВ почвы и питательных веществ на поверхности БУ, а также с изменением рН среды при внесении пирогенного ОВ, которое влияет на ферментативную активность почв, и т.д. [39, 63, 83, 97]. По мнению некоторых авторов, внесение БУ в почву может подавлять минерализацию ПОВ за счет сорбции его лабильных фракций во внутреннем пространстве пирогенного продукта [41, 46, 54].
Дискуссионность в оценках направленности и механизмов влияния БУ на почвенные свойства, включая обилие и состояние сапрофитной почвенной микрофлоры, определяющих интенсивность дыхания, может быть связано с тем, что под термином БУ понимают очень широкий спектр продуктов пиролизации, отличающихся органическими и минеральными составляющими, химическими и физико-химическими свойствами [30, 82, 87]. Для получения БУ обычно используют низкокачественную древесину, а также разнообразные отходы деревообрабатывающего и сельскохозяйственного производства [52, 63] вплоть до отходов животноводства [29, 50]. Это позволяет получить дешевый продукт, перспективный для применения в качестве почвенного мелиоранта. Технологические приемы и температурные режимы пиролиза также весьма разнообразны и постоянно модернизируются [19, 56, 69, 70]. В обзорной работе [53] делается вывод, что, несмотря на обилие исследований, показывающих существенное влияние БУ на свойства почв в целом, в том числе на состояние почвенной биоты, очень мало известно о механизмах, посредством которых БУ влияют на обилие и состав микробного сообщества. Отмечается, что вследствие широкого разнообразия БУ необходимо определиться, какие их свойства должны учитываться при оценке их влияния на состояние микробных сообществ.
Традиционно при изучении направленности и механизмов влияния БУ на интенсивность выделения углекислого газа из почв (в том числе за счет прайминг-эффекта) проводится метаанализ литературных данных [32, 62, 65, 99]. При несомненных достоинствах данного подхода, к которым в первую очередь можно отнести возможность составления выборок с большим объемом исходных данных, метод имеет определенные недостатки, которые могут приводить к возникновению систематических ошибок, основным источником которых является этап определения круга включаемых в анализ исследований. К проблемам выбора источников при метаанализе можно отнести множество факторов: различие в способах, условиях, длительности постановки инкубационных лабораторных и полевых экспериментов, технологические особенности используемых БУ, особенности почв или почвенных материалов, а также в методах оценки состояния биоты. Очевидно, что корректное применение метаанализа требует направленной сортировки используемых литературных данных.
В работе [62] при изучении направленности и механизмов ПЭ была составлена выборка исследований, включающая результаты как полевых, так и инкубационных опытов различной длительности. При этом влияние на ПЭ, собственно ПОВ и свежих растительных остатков рассматривались отдельно, а в выборку включались исследования, проведенные только с использованием изотопных методов разделения источников СО2. В работе [91] в выборку для изучения влияния БУ на ПЭ включались источники, где оценка эмиссии СО2 проводилась изотопными методами, но с учетом длительности эксперимента, типа БУ, температуры инкубации. Продуктивным подходом является также использование специальных статистических методов, позволяющих при проведении метаанализа оценить влияние всего комплекса факторов и тем самым снизить вероятность возникновения систематических ошибок. В работе [26] при проведении метаанализа использовали boosted regression trees (BRTs), а в качестве критериев отбора предикторов, наряду со свойствами БУ, использовались условия инкубации и характеристики почвы.
Несмотря на популярность и информативность данных методов, построение регрессионных моделей влияния БУ на почвенные процессы, полученные на основе прямых инкубационных экспериментов, может оказаться продуктивным [101]. Подобные опыты могут ставиться в стандартных условиях инкубации, с одним и тем же (или наоборот отличающимся) почвенным материалом, при применении одних и тех же методов оценки показателей почвенного дыхания. В этом случае круг оцениваемых предикторов автоматически ограничивается только свойствами использованных БУ, а возможность возникновения систематических ошибок минимизируется. Однако в данном случае возникают проблемы, связанные с необходимостью анализа данных с большим количеством потенциальных предикторов при небольших объемах экспериментальных выборок, которые требуют применения специальных методов регрессионного анализа.
Цель работы – изучить в длительном лабораторном эксперименте влияние биоуглей, различающихся по способу получения и свойствам, на интенсивность субстрат-индуцированного дыхания серой лесной почвы.
ОБЪЕКТЫ И МЕТОДЫ
Характеристика почвы и биоуглей. Эксперименты проводили на серой лесной почве, отобранной в начале вегетационного периода из верхнего горизонта А1 на территории, находящейся под широколиственным лесом – дубрава свежая кленово-липовая. По международной классификации почва определяется как Eutric Retisols (Loamic, Cutanic, Ochric), характеризуется кислой реакцией среды, высоким содержанием органического углерода и валового азота, рыхлым сложением (табл. 1).
Таблица 1.
Свойства почвы, используемой в эксперименте
| Свойства почвы | Показатель |
|---|---|
| Содержание органического углерода, % | 3.65 |
| Содержание валового азота, % | 0.29 |
| Отношение С/N | 12.7 |
| рН водный | 5.7 |
| Содержание физической глины, % | 56.8 |
| Плотность сложения, г/см3 | 0.86 |
| Полная влагоемкость, % | 42.3 |
Для проведения эксперимента использовали 10 образцов БУ, полученных с использованием медленного пиролизера, оригинальной конструкции М.Р. Баяна (Department of Agriculture and Environmental Sciences, Lincoln University in Missouri, США), описанной в работе [89]. Изготовление БУ проводили в двух режимах. Низкотемпературные БУ получали при медленном пиролизе (конечная температура 400°C), из древесины (щепа, опилки) ивы, стеблевой и листовой массы кукурузы, проса. Высокотемпературные БУ получали в экзотермических условиях (конечная температура 600°C), из древесины (щепа, опилки) сосны, кедра, дуба, ивы, стеблевой и листовой массы мискантуса, кукурузы, проса. Пиролитическую обработку растительного материала проводили в течение 170 мин, температуру в пиролизной камере контролировали по термопаре. Поскольку образцы биоуглей были представлены материалом разной размерности, перед использованием их измельчали и пропускали через сито 2 мм.
Содержание золы в БУ определяли прокаливанием при 900°C [72], содержания в них общего углерода и азота определяли на приборе vario MICRO cube (Fa Elementar, Германия). Устойчивость органического вещества БУ к окислительной деструкции определяли методом ступенчатого окисления по Хану [21], модифицированным и адаптированным авторами к особенностям объекта [30]. Лабильную фракцию ОВ экстрагировали из БУ горячей водой [11], а также использовали метод ускоренного определения содержания органического углерода, извлекаемого из БУ смесью Na4P2O7–NaOH [43], липидную фракцию выделяли смесью спирт : бензол (1 : 1) в аппарате Сокслета в течение 48 ч по методике, описанной в работе [10]. Величину водного рН определяли потенциометрически в суспензии БУ в дистиллированной воде при соотношении 1 : 12.5, рН насыщенных паст определяли по методике, описанной в работе [72]. Обменные катионы экстрагировали 1н раствором ацетата аммония с рН 7.0 [72]. Концентрацию катионов в ацетат-аммонийной вытяжке определяли спектрофотометрически на спектрометре с индуктивно-связанной плазмой ICPE 9000 (Shimadzu, Япония). Содержание воднорастворимых катионов кальция и магния определяли в водном экстракте титрованием раствором ЭДТА, а калия и натрия − методом пламенной фотометрии [89]. Адсорбционную активность БУ определяли по метиленовому оранжевому спектрометрически [35].
Ход проведения эксперимента. Свежеотобранный почвенный образец очищали от корней, и просеивали через сито 2 мм. Из свежеприготовленной почвы отбирали в чашки Петри образцы массой 40 г, в каждый вносили по 2 г одного из БУ, перемешивали, увлажняли дистиллированной водой до 55% от полной влагоемкости. Внесение БУ в почву в количестве 5% является компромиссным, поскольку позволяет получить значимое влияние на микробную активность, но не будет приводить к слишком сильному изменению физических свойств почвы. Чашки Петри с модельными смесями инкубировали в закрытой хроматографической камере объемом 80 л над влажным песком для предотвращения быстрого иссушения. Исходную влажность поддерживали гравиметрически путем периодического увлажнения дистиллированной водой. В качестве контроля использовали почвенный образец без добавок БУ.
Для оценки влияния БУ на состояние почвенной сапрофитной микробиоты определяли СИД по скорости выделения СО2 после внесения глюкозы, которое вызывает всплеск активности почвенных микроорганизмов [13]. Величина СИД позволяет объективно оценить вклад на почвенное дыхание наряду с активной, биомассу потенциально активной сапрофитной микрофлоры, участвующей в деструкции разлагаемого ОВ в различных почвенных объектах [1, 44, 91].
Определение интенсивности СИД проводили в соответствии с методиками, описанными в работах [2, 3]. После тщательного перемешивания модельных смесей отбирали по 4 пробы (для определения СИД в 4-кратной повторности) весом 2.5 г, которые помещали в герметично закрывающиеся емкости объемом 20 мл. Дозатором вносили расчетное количество водного раствора глюкозы, так чтобы конечная влажность материала составляла 65% от полной влагоемкости, а содержание глюкозы – 10 мг на 1 г смеси почва–биоуголь. Пробы выдерживали в течение 4 ч при t = 25°С. Количество выделившегося СО2 определяли на газовом хроматографе Clarus 580 (Perkin Elmer, США) с катарометром в качестве детектора углекислого газа. Определение СИД проводили через 3 сут, 3 и 6 мес. инкубации.
Статистическая обработка результатов. Для оценки значимости влияния внесения БУ проведен однофакторный дисперсионный анализ данных СИД отдельно для каждого периода инкубации: 0.1, 3 и 6 мес. Для определения свойств БУ, оказывающих влияние на величину СИД, использовали многофакторный регрессионный анализ. Принимали во внимание то, что параметры, характеризующие БУ, могут быть взаимосвязаны, т.е. существует проблема мультиколлинеарности. Необходимо учитывать, что полученные наборы экспериментальных данных являются высокоразмерными, т.е. количество потенциальных предикторов (оцениваемых свойств БУ) больше, чем количество наблюдений (вариантов опыта). Поэтому классические подходы такие, как многофакторная линейная регрессия по наименьшим квадратам к таким данным не применимы, поскольку независимо от реального наличия взаимосвязей между свойствами БУ и зависимой переменной (интенсивностью СИД) будет проявляться сильный эффект переобучения модели [36]. Поэтому, использовали гребневую и ЛАССО регрессии. Применение этих методов позволяет эффективно бороться с переизбыточностью данных [66, 86]. Для сравнения результатов разных способов моделирования использовали метод перекрестной проверки (табл. 2), который показал, что метод ЛАССО регрессии дает наименьшие значения ошибок, поэтому в дальнейшем обсуждаются результаты моделирования, полученные с применением только данного метода. Обработка результатов проводилась в статистической среде R, при уровне значимости α = 0.05.
Таблица 2.
Результаты перекрестной проверки моделирования с применением Гребневой и Лассо регрессий по показателям средней ошибки (ME), среднеквадратичной ошибки (RMSE) и множественному коэффициенту корреляции (r)
| Время инкубации, мес. | ME | RMSE | r |
|---|---|---|---|
| Гребневая регрессия | |||
| 0.1 | –0.1199 | 6.11394 | 0.7473 |
| 3.0 | –0.5028 | 3.41195 | 0.7996 |
| 6.0 | 0.0436 | 1.53032 | 0.7585 |
| Лассо регрессия | |||
| 0.1 | 0.1050 | 5.94891 | 0.8725 |
| 3.0 | –0.3888 | 3.18095 | 0.8133 |
| 6.0 | 0.0047 | 1.50454 | 0.7629 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 3 представлены результаты определения свойств органических и минеральных составляющих БУ. Анализ данных показывает, что полученные образцы БУ отличаются значительной неоднородностью. Органическая составляющая БУ различается по содержанию общего углерода и азота, по способности ОВ к окислению, а также по содержанию лабильных фракций. Более высокое содержание лабильного и окисляемого ОВ характерно для низкотемпературных БУ, полученных из травянистого растительного материала (кукуруза и просо). Образцы БУ различаются также по содержанию золы, составу водорастворимых и обменных катионов, показателям рН и адсорбционной активности. Значительное влияние типа растительного материала и режимов пиролиза на качественные показатели получаемых БУ обсуждается во многих работах [22, 101] и является вполне ожидаемо.
Таблица 3.
Характеристики БУ, полученных из разных растительных материалов при разных условиях пиролиза
| Параметр | Низкотемпературный | Высокотемпературный | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ива | кукуруза | просо | кедр | сосна | дуб | ива | кукуруза | просо | мискантус | |
| Содержание основных компонентов, % | ||||||||||
| С | 77.3 | 57.2 | 63.1 | 86.3 | 84.4 | 78.2 | 79.6 | 66.3 | 71.2 | 77.6 |
| N | 0.23 | 0.90 | 0.47 | 0.29 | 0.17 | 0.40 | 0.28 | 0.86 | 0.66 | 0.56 |
| Зола | 2.7 | 13.5 | 8.3 | 1.0 | 2.7 | 2.8 | 6.8 | 19.9 | 13.9 | 10.9 |
| Содержание Сорг в разных фракциях по Хану, % | ||||||||||
| Фр 1 | 1.09 | 5.44 | 3.69 | 0.34 | 0.84 | 0.75 | 0.54 | 0.63 | 1.46 | 0.50 |
| Фр 2 | 8.95 | 19.32 | 8.86 | 3.95 | 2.82 | 2.91 | 3.69 | 2.04 | 5.52 | 3.28 |
| Фр 3 | 6.2 | 4.3 | 8.2 | 11.2 | 5.4 | 3.6 | 6.8 | 5.6 | 5.2 | 3.9 |
| Фр 4 | 61.1 | 28.1 | 42.3 | 70.8 | 75.4 | 70.9 | 68.5 | 58.0 | 59.0 | 69.9 |
| Содержание Сорг в разных лабильных фракциях, % | ||||||||||
| Экстракт липидов | 0.26 | 2.10 | 1.84 | 0.12 | 0.07 | 0.17 | 0.13 | 0.31 | 0.19 | 0.12 |
| Водорастворимой | 0.21 | 0.53 | 0.65 | 0.09 | 0.04 | 0.1 | 0.14 | 0.19 | 0.2 | 0.07 |
| Щелочно-растворимой | 0.31 | 3.09 | 3.99 | 0.22 | 0.24 | 0.28 | 0.20 | 0.21 | 0.28 | 0.20 |
| Содержание водорастворимых катионов, мг/100 г | ||||||||||
| Са | 38.3 | 116.2 | 154.7 | 19.1 | 18.4 | 31.0 | 19.2 | 19.2 | 30.6 | 23.0 |
| Мg | 9.32 | 101.3 | 58.80 | 6.98 | 2.79 | 14.13 | 7.00 | 34.98 | 41.84 | 13.98 |
| K | 84.4 | 125.8 | 105.4 | 9.1 | 6.6 | 24.4 | 190.0 | 134.7 | 214.3 | 162.1 |
| Na | –* | – | 4.9 | – | – | – | – | – | 5.3 | – |
| Содержание обменных катионов, мг/100 г | ||||||||||
| Са | 312.8 | 221.8 | 186.1 | 55.4 | 63.2 | 372.2 | 554.4 | 130.7 | 253.4 | 110.9 |
| Мg | 16.85 | 134.8 | 45.75 | 9.63 | 2.41 | 9.63 | 9.63 | 45.75 | 86.68 | 33.71 |
| Na | 14.2 | 12.7 | 18.7 | 34.7 | 29.7 | 12.7 | 7.7 | 9.2 | 23.2 | 13.2 |
| K | 275.2 | 314.3 | 280.7 | 56.7 | 50.7 | 172.1 | 627.2 | 320.7 | 845.7 | 461.7 |
| Mn | 3.81 | 3.02 | 2.06 | 0.83 | 1.43 | 0.75 | 13.59 | 1.59 | 0.78 | 0.91 |
| Zn | 3.81 | 3.02 | 2.06 | 0.19 | 0.35 | – | 4.90 | 0.43 | 0.00 | 0.90 |
| Sr | 0.444 | 0.319 | 0.449 | 0.06 | 0.04 | 0.526 | 0.697 | 0.175 | 0.365 | 0.175 |
| Ba | 24.4 | 23.4 | 23.4 | 23.9 | 24.4 | 24.9 | 23.9 | 23.9 | 22.8 | 23.9 |
| Pb | 0.00 | – | 0.036 | 0.09 | – | – | – | – | – | 1.56 |
| Mo | 0.002 | – | 0.007 | 0.002 | 0.004 | 0.002 | 0.013 | 0.010 | 0.027 | 0.011 |
| Дополнительные свойства биоуглей | ||||||||||
| рН водный | 8.6 | 7.0 | 8.0 | 5.5 | 7.9 | 9.6 | 9.3 | 9.3 | 8.7 | |
| pH пасты | 8.4 | 6.7 | 7.6 | 5.4 | 8.1 | 9.4 | 8.9 | 9.6 | 8.1 | |
| Адсорбционная активность, мг/г | 21.3 | 56.4 | 8.3 | 41.5 | 21.4 | 29.4 | 74.8 | 21.2 | 33.8 | |
На рис. 1 представлены результаты определения интенсивности СИД в контроле и вариантах опыта с внесением БУ при разном времени инкубации. Через 3 сут инкубации наблюдается как положительный, так и отрицательный эффекты от внесения БУ, т.е. повышение и снижение СИД по отношению к контролю соответственно. При этом ингибирование активности почвенной микробиоты характерно для БУ, полученных при разных режимах пиролиза, как из древесной, так и из травянистой биомассы. Через 3 мес. инкубации наблюдается положительное влияние почти всех БУ на СИД за исключением высокотемпературных БУ из растительной массы кукурузы и древесины дуба, для которых разница между опытом и контролем практически отсутствует. Через 6 мес. инкубации во всех вариантах с внесением БУ интенсивность СИД значимо выше, чем в контроле.
Рис. 1.
Влияние инкубации на интенсивность СИД модельной смеси почва : биоуголь по сравнению с контролем: K‑0.1, К-3, К-6 – контрольные образцы на 3 сут, 3 и 6 мес. соответственно; БУ-0.1, БУ-3, БУ-6 – варианты опыта с внесением БУ на 3 сут, 3 и 6 мес. соответственно.
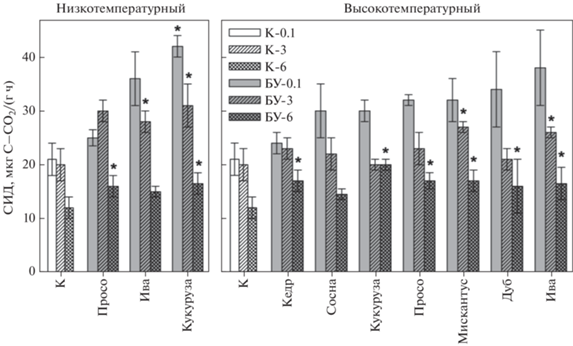
В табл. 4 представлены результаты однофакторного дисперсионного анализа и оценка значимости разницы между интенсивностью СИД в опытных вариантах по сравнению с контролем (без добавок БУ), при уровне значимости α = 0.05. Анализ дисперсионных комплексов по F-критерию показывает наличие статистически значимого влияния внесения БУ в целом при различных сроках инкубации модельных смесей. Вместе с тем оценка наименьшей значимой разницы (НЗР) интенсивности СИД между вариантами опыта и контролем по срокам инкубации существенно различаются. После 3 сут инкубации наблюдается только одна значимая разница (+34.6%) интенсивности СИД – в варианте с внесением низкотемпературного БУ из растительной массы кукурузы. После 3 мес. инкубации значимое положительное влияние на СИД оказывает внесение пяти БУ, это все низкотемпературные БУ, а также высокотемпературные БУ, полученные из мискантуса и ивы: от 30.4 до 54.8%. Через 6 мес. инкубации значимое положительное влияние по сравнению с контролем (от 32.3 до 65.9%) проявляют восемь БУ. Отсутствие статистически значимого влияния наблюдается для высокотемпературных БУ из древесины сосны и низкотемпературного БУ из ивы.
Таблица 4.
Разница между величинами определения СИД в вариантах опыта с добавками разных БУ и контролем, а также результаты дисперсионного анализа и оценки НЗР между интенсивностью СИД для образцов в разные сроки инкубации
| Время инкубации, мес. |
Разница в интенсивности СИД между вариантами опыта и контролем | Низкотемпературный | Высокотемпературный | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ива | кукуруза | просо | кедр | сосна | дуб | ива | кукуруза | просо | мискантус | ||
| 0.1 | мкг С–СО2/(г ч) | 4.8 | 10.7* | –6.1 | –7.3 | –1.2 | 3.0 | 6.8 | –1.3 | 1.5 | 2.6 |
| % от контроля | 15.5 | 34.6 | –19.8 | –23.6 | –3.9 | 9.6 | 22.1 | –4.1 | 4.8 | 8.3 | |
| F = 2.40 при Fst = 2.13, НЗР = 9.76 мкг С–СО2/(г ч), (α = 0.05) | |||||||||||
| 3.0 | мкг С–СО2/(г ч) | 8.1 | 10.8 | 9.4 | 2.8 | 1.1 | 0.2 | 6.0 | 0.1 | 3.0 | 6.4 |
| % от контроля | 41.0 | 54.8 | 47.6 | 14.0 | 5.8 | 0.8 | 30.4 | 0.5 | 15.0 | 32.5 | |
| F = 4.01 при Fst = 2.13, НЗР = 5.72 мкг С–СО2/(г ч), (α = 0.05) | |||||||||||
| 6.0 | мкг С–СО2/(г ч) | 2.9 | 4.5 | 4.2 | 5.1 | 2.0 | 3.8 | 4.6 | 7.7 | 5.1 | 5.2 |
| % от контроля | 25.0 | 38.1 | 35.8 | 43.3 | 17.5 | 32.3 | 39.1 | 65.9 | 43.9 | 44.2 | |
| F = 2.30 при Fst = 2.13, НЗР = 3.75 мкг С–СО2/(г ч), (α = 0.05) | |||||||||||
Для построения множественных регрессионных уравнений зависимости СИД модельных смесей от свойств БУ применяли ЛАССО регрессию (табл. 5), в качестве потенциальных предикторов использовали показатели, приведенные в табл. 2. Из-за большого количества нулевых значений в параметрах из анализа были исключены содержание водорастворимого натрия и обменного свинца. При построении модели учитывали содержание легкоокисляемых (Фр 1), среднеокисляемых (Фр 2) и трудноокисляемых фракций (Фр 3) ОВ по Хану, поскольку сумма всех четырех фракций равна общему содержанию углерода в БУ, что нарушало бы принцип независимости переменных. В итоге как потенциальные предикторы, которые могут оказывать влияние на интенсивность СИД, учитывались 23 характеристики.
Таблица 5.
Значимые (при α = 0.05) коэффициенты Лассо регрессии между СИД и некоторыми свойствами БУ для трех периодов наблюдения
| Предиктор | 0.1 мес. (λ = 1.13*) |
3.0 мес. (λ = 1.13) |
6.0 мес. (λ = 0.73) |
|---|---|---|---|
| Свободный член | 26.972 | 22.543 | 15.688 |
| Содержание золы, % | – | – | 0.062 |
| Окисляемое ОВ (Фр 2), % | 0.317 | 0.277 | – |
| Ca обменный, мг/100 г | 0.006 | – | – |
| рН водный | 0.536 | – | – |
| Na обменный, мг/100 г | –0.153 | – | – |
Итоговая регрессионная модель Лассо для короткого инкубационного периода показала влияние свойств БУ на СИД, которое характеризуется четырьмя статистически значимыми коэффициентами (при значимости α = 0.05). Положительное влияние оказывает содержание окисляемого ОВ (выраженное через содержание Фр 2 – b1 = 0.317), рН водной суспензии (b2 = 0.536) и очень слабое – содержание обменного кальция (b3 = 0.006). Отрицательное влияние на СИД оказывает содержание обменного натрия (b4 = –0.153). При инкубации в течение 3 мес. положительное влияние на СИД оказывает только содержания окисляемого ОВ (Фр 2, b1 = 0.277). Через 6 мес. содержание окисляемого ОВ не оказывает значимого влияния на интенсивность СИД, но наблюдается значимое положительное влияние содержания золы (b1 = 0.062).
Из анализа полученных моделей можно сделать вывод о том, что в зависимости от длительности инкубации влияние БУ на СИД разнонаправлено и зависит от их свойств. Увеличение интенсивности выделения СО2 за счет разложения доступного ОВ БУ при кратковременной инкубации отмечается в ряде работ и является вполне ожидаемым [39, 63, 95]. При внесении БУ, богатых лабильным ОВ в почвы, как правило, наблюдается быстрое увеличение эмиссии СО2. В работе [39] такой эффект наблюдался уже через 48 ч после внесения БУ и сохранялся в течение 1 мес. В работе [63] отмечается положительный ПЭ за счет внесения доступного ОВ с БУ, который может проявляться в течение 1 года. В нашем случае существенное положительное влияние окисляемого ОВ проявлялось в течение первых 3 мес. и прекращалось в период с 3 до 6 мес.
Также можно отнести к ожидаемому результату положительное влияние на СИД водного рН и содержания обменного кальция. Считается, что внесение БУ нормализует реакцию почвенной среды в результате подщелачивания за счет присутствия в них зольных элементов [55, 90], что может приводить к увеличению интенсивности микробного дыхания в кислых почвах [39, 58, 97]. Существует мнение, что влияние рН самих БУ на изменение состояния почвенной микрофлоры происходит в основном в первые несколько суток [16, 17, 53], а в последующем интенсивность этих процессов уменьшается [21]. В проведенном исследовании положительное влияние рН БУ на СИД обнаруживалось только в начале инкубации, а после 3 мес. уже не проявлялось.
Негативное влияние обменного натрия в БУ на интенсивность выделения углекислого газа в литературе не обсуждается. Однако в работе [101] сделано предположение, что токсичные для микроорганизмов соединения могут освобождаться из пирогенного материала и уменьшать микробиологическую активность и минерализацию ОВ. Можно допустить кратковременное негативное влияние легкорастворимых катионов, которые попадая в почвенный раствор из БУ, могут также подавлять почвенную микрофлору. Положительное влияние зольности БУ на интенсивность СИД при инкубации в течение 6 мес. может быть связано как с улучшением физико-химических свойств почвы, так и с увеличением обеспеченности почвенной микробиоты элементами питания. Логично предположить, что потенциально активные микроорганизмы при наличии доступного источника энергии способны извлекать необходимые зольные элементы из БУ, что может приводить к увеличению СИД на поздних стадиях взаимодействия некоторых БУ с почвами. В целом можно заключить, что влияние внесения различных БУ на изменение интенсивности СИД почвы – это процесс очень сложный и многофакторный, даже при использовании одного типа почвы и инкубации образцов в стандартных лабораторных условиях.
В современной литературе, посвященной изучению перспектив использования БУ для секвестрации атмосферного углекислого газа, устоялось общее мнение, что влияние БУ на эмиссию СО2 сильно зависит как от свойств почв [32, 39, 54, 58, 59, 65, 68, 85, 93], так и факторов внешней среды, в которых происходит взаимодействие БУ с почвой [28, 32, 57, 94]. Поэтому, с учетом сложности и неоднородности влияния различных БУ на состояние почвенной микробиоты, при построении прогнозных моделей для оценки масштабов потенциальной секвестрации органического углерода в почвах необходим балансовый анализ потоков углекислого газа в системе почва–атмосфера, который учитывал бы особенности климата и почвенного покрова территорий, для которых эти прогнозы составляются.
ЗАКЛЮЧЕНИЕ
Проведение прямых лабораторных экспериментов с различными БУ позволяет получить информацию о направленности и механизмах их влияния на интенсивность СИД на длительную перспективу взаимодействия с почвами. При различной длительности взаимодействия БУ с серой лесной почвой (3 сут, 3 и 6 мес.) обнаружены только положительные статистически значимые (при α = 0.05) влияния на СИД по сравнению с контролем. Показано, что воздействие БУ на способность активной и потенциально активной сапрофитной микробиоты к разложению ПОВ и поступающего в почвы растительного материала в зависимости от времени взаимодействия может протекать по различным механизмам, которые во многом определяются исходными свойствами БУ. Для объективной оценки перспектив и эффективности использования БУ для связывания СО2 атмосферы в почвах необходим балансовый учет потоков углекислого газа в системе почва–растение–атмосфера. Балансовые расчеты должны рассматривать наряду с количеством внесенного в почвы с пиролизными продуктами устойчивого к разложению органического углерода, потенциальную возможность увеличения эмиссии углекислого газа из почв за счет активации почвенной сапрофитной микробиоты.
Список литературы
Ананьева Н.Д., Благодатская Е.В., Орлинский Д.Б., Мякшина Т.Н. Методические аспекты определения скорости субстрат-индуцированного дыхания почвенных микроорганизмов // Почвоведение. 1993. № 11. С. 72–77.
Ананьева Н.Д., Сусьян Е.А., Гавриленко Е.Г. Особенности определения углерода микробной биомассы почвы методом субстрат индуцированного дыхания // Почвоведение. 2011. № 11. С. 1327–1333.
Журавлева А.И., Якимов А.С., Демкин В.А., Благодатская Е.В. Минерализация почвенного органического вещества, инициированная внесением доступного субстрата, в профиле современных и погребенных подзолистых почв // Почвоведение. 2012. № 4. С. 490–499.
Когут Б.М., Семенов В.М., Артемьева З.С., Данченко Н.Н. Дегумусирование и почвенная секвестрация углерода // Агрохимия. 2021. № 5. С. 3–13. https://doi.org/10.31857/S0002188121050070
Красильников П.В. Устойчивые соединения углерода в почвах: происхождение и функции // Почвоведение. 2015. № 9. С. 1131–114. https://doi.org/10.1134/S1064229315090069
Кудеяров В.Н. Эмиссия закиси азота из почв в условиях применения удобрений (аналитический обзор) // Почвоведение. 2020. № 10. С. 1192–1205. https://doi.org/10.1134/S1064229320100105
Кудеяров В.Н. Почвенно-биогеохимические аспекты состояния земледелия в Российской Федерации // Почвоведение. 2019. № 1. С. 109–121. https://doi.org/10.1134/S1064229319010095
Кудеяров В.Н. Современное состояние углеродного баланса и предельная способность почв к поглощению углерода на территории России // Почвоведение. 2015. № 9. С. 1049–1060. https://doi.org/10.1134/S1064229315090070
Рижия Е.Я., Бучкина Н.П., Мухина И.М., Белинец А.С., Балашов Е.В. Влияние биоугля на свойства образцов дерново-подзолистой супесчаной почвы с разной степенью окультуренности (лабораторный эксперимент) // Почвоведение. 2015. № 2. С. 211–220. https://doi.org/10.1134/S1064229314120084
Смирнова Е.В., Гиниятуллин К.Г., Валеева А.А., Ваганова Е.С. Пироугли как перспективные почвенные мелиоранты: оценка содержания и спектральные свойства их липидных фракций // Ученые записки Казанского университета. Сер. Естественные науки. 2018. № 160. С. 259–275.
Шульц Е., Деллер Б., Хофман Г. Методы исследования органического вещества почв. М.: Россельхозакадемия, 2005. 521 с.
Alburquerque J.A., Calero J.M., Barron V., Torrent J., Campillo M.C., Gallardo A., Villar R. Effects of biochars produced from different feedstocks on soil properties and sunflower growths // J. Plant Nutr. Soil Sci. 2014. V. 177. P. 16–25. https://doi.org/10.1002/jpln.201200652
Anderson I.F.E., Domsch K.M. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. № 3. P. 215–221.
Batjes N.H. Total carbon and nitrogen in the soils of the world // Eur. J. Soil Sci. 2014. V. 65. P. 10–21. https://doi.org/10.1111/EJSS.12114_2
Batjes N.H., Bridges E.M. Potential emissions of radiatively active gases from soil to atmosphere with special reference to methane: Development of a global database (WISE) // J. Geophys. Res. 1994. V. 99. P. 16479–16489. https://doi.org/10.1029/93JD03278
Blagodatskaya E., Kuzyakov Y. Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure: critical review // Biol. Fertil. Soils. 2008. V. 45. P. 115–131.
Blagodatskaya E., Kuzyakov Y. Active microorganisms in soil: Critical review of estimation criteria and approaches // Soil Biol. Biochem. 2013. V. 67. P. 192–211. https://doi.org/10.1016/j.soilbio.2013.08.024
Brodowski S., Amelung W., Haumaiera L., Abetz C., Zech W. Morphological and chemical properties of black carbon in physical soil fractions as revealed by scanning electron microscopy and energy-dispersive X-ray spectroscopy // Geoderma. 2005. V. 128. P. 116–129. https://doi.org/10.1016/j.geoderma.2004.12.019
Case S.D.C., McNamara N.P., Reay D.S., Whitaker J. Can biochar reduce soil greenhouse gas emissions from a miscanthus bioenergy crop? // GCB Bioenergy. 2014. V. 6. P. 76–89. https://doi.org/10.1111/gcbb.1205
Chambers A., Lal R., Paustian R. Soil carbon sequestration potential of US croplands and grasslands: implementing the 4 per thousand initiative // J. Soil Water Conserv. 2016. V. 71. P. 68–74. https://doi.org/10.2489/jswc.71.3.68A
Chan K.Y., Bowman A., Oates A. Oxidizable organic carbon fractions and soil quality changes in an oxic paleustalf under different pature leys // Soil Sci. 2001. V. 166. P. 61–67.
Chatterjee R., Sajjadi B., Chen W.-Y., Mattern D.L., Hammer N., Raman V., Dorris A. Effect of Pyrolysis Temperature on Physico Chemical Properties and Acoustic-Based Amination of Biochar for Efficient CO2 Adsorption // Front. Energy Res. 2020. V. 8. P. 85. https://doi.org/10.3389/fenrg.2020.00085
Cheng C.-H., Lehmann J., Thies J.E., Burton S.D., Engelhard M.H. Oxidation of black carbon by biotic and abiotic processes // Org. Geochem. 2006. V. 37. P. 1477–1488.
Cross A., Sohi S.P. The priming potential of biochar products in relation to labile carbon contents and soil organic matter status // Soil Biol. Biochem. 2011. V. 43. P. 2127–2134.
Crow S.E., Lajtha K., Bowden R.D., Yano Y., Brant J.B., Caldwell B.A., Sulzman E.W. Increased coniferous needle inputs accelerate decomposition of soil carbon in an old-growth forest // Forest Ecol. Managem. 2009. V. 258. P. 2224–2232. https://doi.org/10.1016/j.foreco.2009.01.014
Ding F., Van Zwieten L., Zhang W., Weng Z., Shi S., Wang J., Meng J. A meta-analysis and critical evaluation of influencing factors on soil carbon priming following biochar amendment // J. Soils Sediments. 2018. V. 18(4). https://doi.org/10.1007/s11368-017-1899-6
Ding Y., Liu Y., Liu S. Biochar to improve soil fertility. A review // Agron. Sustain. Dev. 2016. V. 36. P. 36. https://doi.org/10.1007/s13593-016-0372-z
Fang Y., Singh B.P., Singh B. Temperature sensitivity of biochar and native carbon mineralization in biochar-amended soils // Agric. Ecosyst. Environ. 2014. V. 191. P. 158–167.
Gaskin J.W., Steiner C., Harris K., Das K.C., Bibens B. Effect of low-temperature pyrolysis conditions on biochar for agricultural use // Am. Soc. Agricult. Biol. Eng. 2008. V. 51. P. 2061–2069.
Giniyatullin K.G., Smirnova E.V., Grigoryan B.R., Valeeva A.A. The Possibility of Use Research Methods of Soil Organic Matter for Assess the Biochar Properties // Res. J. Pharmaceutical, Biol. Chem. Sci. 2015. V. 6(4). P. 194–201.
Glaser B., Lehmann J., Zech W. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal – a review // Biol. Fertil. Soils. 2002. V. 35. 219–230. https://doi.org/10.1007/s00374-002-0466-4
Gross A., Bromm T., Glaser B. Soil Organic Carbon Sequestration after Biochar Application: A Global Meta-Analysis // Agronomy. 2021. V. 11. P. 2474. https://doi.org/10.3390/agronomy11122474
Haumaier L., Zech W. Black carbon–possible source of highly aromatic components of soil humic acids // Org. Geochem. 1995. V. 23. P. 191–196. https://doi.org/10.1016/0146-6380(95)00003-W
IPCC. Intergovernmental panel on climate change. Special report: climatechange and land. 2019.
Islam S., Ang B.C., Gharehkhani S., Afifi A.B.M. Adsorption capability of activated carbon synthesized from coconut shell // Carbon. 2016. V. 20. P. 1–9. https://doi.org/10.5714/cl.2016.20.001
James G., Witten D., Hastie T., Tibshirani R. An Introduction to Statistical Learning with Applications in R. N.Y.: Springer, 2013. 440 p.
Jiang P., Xiao L.Q., Wan X. Research Progress on Microbial Carbon Sequestration in Soil: a Review. // Eurasian Soil Sc. 2022. V. 55. P. 1395–1404. https://doi.org/10.1134/S1064229322100064
Jien S.H., Wang C.C., Lee C.H., Lee T.Y. Stabilization of organic matter by biochar application in compost-amended soils with contrasting pH values and textures (Switzerland) // Sustainability. 2015. V. 7. P. 13317–13333. https://doi.org/10.3390/su71013317
Jones D.L., Murphy D.V., Khalid M., Ahmad W., Edwards-Jones G., DeLuca T.H. Short-term biochar-induced increase in soil CO2 release is both biotically and abiotically mediated // Soil Biol. Biochem. 2011. V. 43. P. 1723–1731. https://doi.org/10.1016/j.soilbio.2011.04.018
Kapoor A., Sharma R., Kumar A., Sepehya S. Biochar as a means to improve soil fertility and crop productivity: a review // J. Plant Nutrition. 2022. V. 45(15). P. 2380–2388. https://doi.org/10.1080/01904167.2022.2027980
Keith A., Singh B., Singh B.P. Interactive priming of biochar and labile organic matter mineralization in a smectite-rich soil // Environ. Sci. Technol. 2011. V. 45. P. 9611–9618.
Kloss S., Zehetner F., Wimmer B., Buecker J., Rempt F., Soja G. Biochar application to temperate soils: Effects on soil fertility and crop growth under greenhouse conditions // J. Plant Nutr. Soil Sci. 2014. V. 177. P. 3–15. https://doi.org/10.1002/jpln.201200282
Kononova M.M., Bel’cikova N.P. Speed up methods for humus determination // Pochvovedenie. 1961. V. 25. P. 125–129.
Kopittke P.M., Menzies N.W., Wang P., McKenna B.A., Lombi E. Soil and the intensification of agriculture for global food security // Environ. Int. 2019. V. 1132. P. 105078. https://doi.org/10.1016/j.envint.2019.105078
Kurt A.S. Impact of biochar field aging on laboratory greenhouse gas production potentials // GCB Bioenergy. 2013. V. 5. P. 165–176. https://doi.org/10.1111/gcbb.12005
Kuzyakov Y., Subbotina I., Chen H., Bogomolova I., Xu X. Black carbon decomposition and incorporation into soil microbial biomass estimated by 14C labeling // Soil Biol. Biochem. 2009. V. 41. P. 210–219.
Laird D.A., Chappell V.A., Martens D.A., Wershaw R.L., Thompson M. Distinguishing black carbon from biogenic humic substances in soil clay fractions // Geoderma. 2008. V. 143. P. 115–122. https://doi.org/10.1016/j.geoderma.2007.10.025
Lal R. Beyond COP 21: potential and challenges of the “4 per Thousand” initiative // J. Soil Water Conserv. 2016. V. 71. P. 68A–74A. https://doi.org/10.2489/jswc71.1.20A
Lal R. Challenges and opportunities in soil organic matter research // Eur. J. Soil Sci. 2009. V. 60. P. 158–169. https://doi.org/10.1111/j.1365-2389.2008.01114.x
Lee J.M., Park D.G., Kang S.S., Choi E.J., Gwon H.S., Lee H.S., Lee S.I. Short-Term Effect of Biochar on Soil Organic Carbon Improvement and Nitrous Oxide Emission Reduction According to Different Soil Characteristics in Agricultural Land: A Laboratory Experiment // Agronomy. 2022. V. 12. P. 1879. https://doi.org/10.3390
Lehmann J., Gaunt J., Rondon M. Bio-char sequestration in terrestrial ecosystems – a review // Mitigation and Adaptation Strategies for Global Change. 2006. V. 11. P. 403–427. https://doi.org/10.1007/s11027-005-9006-5
Lehmann J., Joseph S. Biochar for environmental management science technology and implementation. N.Y.: Routledge, 2015.
Lehmann J., Rillig M.C., Thies J., Masiello C.A., Hockaday W.C., Crowley D. Biochar Effects on Soil Biota-A Review // Soil Biol. Biochem. 2011. V. 43. P. 1812–1836. https://doi.org/10.1016/j.soilbio.2011.04.022
Liang B., Lehmann J., Sohi S.P., Thies J.E., O’Neill B., Trujillo L., Gaunt J., Solomon D., Grossman J., Neves E.G., Luizão F.J. Black carbon affects the cycling of non-black carbon in soil // Org. Geochem. 2010. V. 41. P. 206–213. https://doi.org/10.1016/j.orggeochem.2009.09.007
Liu X.H., Zhang X.C. Effect of biochar on pH of alkaline soils in the loess plateau: results from incubation experiments // Int. J. Agricult. Biol. 2012. V. 14. P. 745–750.
Liu Z., McNamara P., Zitomer D. Autocatalytic Pyrolysis of Wastewater Biosolids for Product Upgrading // Environ. Sci. Technol. 2017. V. 51. P. 9808–9816. https://doi.org/10.1021/acs.est.7b02913
Lu W., Zhang H. Response of biochar induced carbon mineralization priming effects to additional nitrogen in a sandy loam soil // Appl. Soil Ecol. 2015. V. 96. P. 165–171. https://doi.org/10.5194/se-5-585-2014
Luo Y., Durenkamp M., De Nobili M., Lin Q., Brookes P.C. Short term soil priming effects and the mineralisation of biochar following its incorporation to soils of different pH // Soil Biol. Biochem. 2011. V. 43. P. 2304–2314.
Luo Y., Durenkamp M., De Nobili M., Lin Q., Devonshire B.J., Brookes P.C. Microbial biomass growth, following incorporation of biochars produced at 350°C or 700°C, in a silty-clay loam soil of high and low pH // Soil Biol. Biochem. 2013. V. 57. P. 513–523. https://doi.org/10.1016/j.soilbio.2012.10.033
Luo Y., Lin Q., Durenkamp M. Does repeated biochar incorporation induce further soil priming effect? // J. Soils Sediments. 2018. V. 18. P. 128–135. https://doi.org/10.1007/s11368-017-1705-5
Macdonald L.M., Farrell M., Zwieten L.V. et al. Plant growth responses to biochar addition: an Australian soils perspective // Biol. Fertil. Soils. 2014. V. 50. P. 1035–1045. https://doi.org/10.1007/s00374-014-0921-z
Maestrini B., Nannipieri P., Abiven S. A meta-analysis on pyrogenic organic matter induced priming effect // Glob. Chang. Biol. Bioenergy. 2015. V. 7. P. 577–590. https://doi.org/10.1111/gcbb.12194
Maestrini B., Herrmann A.M., Nannipieri P., Schmidt M.W.I., Abiven S. Ryegrass-derived pyrogenic organic matter changes organic carbon and nitrogen mineralization in a temperate forest soil // Soil Biol. Biochem. 2014. V. 69. P. 291–301. https://doi.org/10.1016/j.soilbio.2013.11.013
Major J., Lehmann J., Rondon M., Goodale C. Fate of soil-applied black carbon: downward migration, leaching and soil respiration // Global Change Biology. 2010. V. 16. P. 1366–1379. https://doi.org/10.1111/j.1365-2486.2009.02044.x
Majumder S., Neogi S., Dutta T., Powel M.A., Banik P. The impact of biochar on soil carbon sequestration: Meta-analytical approach to evaluating environmental and economic advantages // J. Environ. Manage. 2019. V. 15. P. 109466. https://doi.org/10.1016/j.jenvman.2019.109466
Marquardt D., Snee R. Ridge Regression in Practice // Am. Statistician. 1975. V. 29. P. 3–20.
Minasny B., Malone B.P., Mcbratney A.B., Angers D.A., Arrouays D. Soil carbon 4 per mille // Geoderma. 2017. V. 292. P. 59–86. https://doi.org/10.1016/j.geoderma.2017.01.002
Naisse C., Girardin C., Davasse B., Chabbi A., Rumpel C. Effect of biochar addition on C mineralisation and soil organic matter priming in two subsoil horizons // J. Soils Sediments. 2014. V. 15. P. 825–832.
Nam W.L., Phang X.Y., Su M.H., Liew R.K., Ma N.L., Rosli M.H.N.B., Lam S.S. Production of bio-fertilizer from microwave vacuum pyrolysis of palm kernel shell for cultivation of Oyster mushroom Pleurotus ostreatus // Sci. Total Environ. 2018. V. 624. P. 9–16. https://doi.org/10.1051/e3sconf/20172200122
Nguyen B., Lehmann J., Hockaday W.C., Joseph S., Masiello C.A. Temperature sensitivity of black carbon decomposition and oxidation // Environ. Sci. Technol. 2010. V. 44. P. 3324–3331.
Padarian J., Minasny B., McBratney A., Smith P. Soil carbon sequestration potential in global croplands // PeerJ. 2022. V. 10. P. 13740. https://doi.org/10.7717/peerj.13740
Pansu M., Gautheyrou J. Handbook of soil analysis. Mineralogical, organic and inorganic methods. Heidelberg: Springer-Verlag, 2006. 993 p.
Piccolo A., Spaccini R., Cozzolino V., Nuzzo A., Droso M., Zavattaro L., Grignani C., Puglisi E., Trevisan M. Effective carbon sequestration in italian agricultural soils by in situ polymerization of soil organic matter under biomimetic photo-catalysis // Land Degradation end Development. 2018. V. 29. https://doi.org/10.1002/ldr.2877
Preston C.M., Schmidt M.W.I. Black pyrogenic. carbon in boreal forests: a synthesis of current knowledge and uncertainties // Biogeosciences Discussions, European Geosciences Union, 2006. V. 3. P. 211–271.
Sanderman J., Hengl T., Fiske G. Soil carbon debt of 12 000 years of human land use // Proceedings of the National Academy of Sciences. 2017. V. 114. P. 201706103. https://doi.org/10.1073/pnas.1706103114
Schmidt M., Noack A. Black carbon in soils and sediments: Analysis, distribution, implications, and current challenges // Global Biogeochem. Cycles. 2000. V. 14. 777–793.
Shahnazarova V.Yu., Orlova N.E., Orlova E.E. et al. Influence of biochar on the taxonomic composition and structure of prokaryotic communities in agrosoddy-podzolic soil // Agricultural Biology. 2020. V. 55. P. 163–173. https://doi.org/10.15389/agrobiology.2020.1.163rus
Skjemstad J.O., Reicosky D.C., Wilts A.R., McGowan J.A. Charcoal Carbon in U.S. Agricultural Soils // Soil Sci. Soc. Am. J. 2002. V. 66. P. 1249–1255. https://doi.org/10.2136/sssaj2002.1249
Smith P., Soussana J.F., Angers D., Schipper L., Chenu C. How to measure, report and verify soil carbon change to realize the potential of soil carbon sequestration for atmospheric greenhouse gas removal // Global Change Biol. 2020. V. 26. P. 219–241. https://doi.org/10.1111/gcb.14815
Sohi S., Krull E., Lopez-Capel E., Bol R. A review of biochar and its use and function in soil // Advances in Agronomy. 2010. V. 105. P. 47–82. https://doi.org/ 10.05002-9https://doi.org/10.1016/S0065-2113
Spaccini R., Piccolo A., Conte P., Haberhauer G., Gerzabek M.H. Increased soil organic carbon sequestration through hydrophobic protection by humic substances // Soil Biol. Biochem. 2002. V. 34. P. 1839–1851. https://doi.org/ 02.00197-9https://doi.org/10.1016/S0038-0717
Sun X., Shan R., Li X., Pan J., Liu X., Deng R., Song J. Characterization of 60 types of Chinese biomass waste and resultant biochars in terms of their candidacy for soil application // GCB Bioenergy. 2017. V. 9. P. 1423–1435. https://doi.org/10.1111/gcbb.12435
Sun T., Feng W., Shi L. et al. Microbial growth rates, carbon use efficiency and enzyme activities during post-agricultural soil restoration // Catena. 2022. V. 214. P. 106226. https://doi.org/10.1016/j.catena.2022.106226
Tang Y., Gao W., Cai K., Chen Y., Li C., Lee X., Cheng H., Zhang Q., Cheng J. Effects of biochar amendment on soil carbon dioxide emission and carbon budget in the karst region of southwest China // Geoderma. 2021. V. 385. P. 114895. https://doi.org/10.1016/j.geoderma.2020.114895
Thiessen S., Gleixner G., Wutzler T., Reichstein M. Both priming and temperature sensitivity of soil organic matter decomposition depend on microbial biomass–an incubation study // Soil Biol. Biochem. 2013. V. 57. P. 739–748. https://doi.org/10.1016/j.soilbio.2012.10.029
Tibshirani R. Regression Shrinkage and Selection via the Lasso // J. Royal Statistical Society. Series B Methodological. 1996. V. 58(1). P. 267–288.
Tran H.N., You S.J., Chao H.P. Effect of pyrolysis temperatures and times on the adsorption of cadmium onto orange peel derived biochar // Waste Management and Research. 2015. V. 34. P. 129–138. https://doi.org/10.1177/0734242X15615698
USDA-NRCS. Soil Survey Laboratory Methods Manual. Soil Survey Investigations. 1996. Report No. 42, Version 3.0. P. 693.
Valeeva A.A., Grigoryan B.R., Bayan M.R., Giniyatullin K.G., Vandyukov A.E., Evtygin V.G. Adsorption of Methylene Blue by Biochar Produced Through Torrefaction and Slow Pyrolysis from Switchgrass // Res. J. Pharmaceutical, Biol. Chem. Sci. 2015. V. 6(4). P. 8–17.
Van Zwieten L., Kimber S., Morris S. et al. Effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility // Plant and Soil. 2009. V. 327. P. 235–246.
Wang J., Xiong Z., Kuzyakov Y. Biochar stability in soil: meta-analysis of decomposition and priming effects // GCB Bioenergy. 2016. V. 8. P. 512–523. https://doi.org/10.1111/gcbb.12266
Wardle D., Zackrisson O., Nilsson M.C. The charcoal effect in Boreal forests: mechanisms and ecological consequences // Oecologia. 1998. V. 115. P. 419–426. https://doi.org/10.1007/s004420050536
Watzinger A., Feichtmair S., Kitzler B. et al. Soil microbial communities responded to biochar application in temperate soils and slowly metabolized 13C-labelled biochar as revealed by 13C PLFA analyses: results from a short-term incubation and pot experiment // Eur. J. Soil Sci. 2014. V. 65(1). P. 40–51.
Weng Z., Van Zwieten L., Singh B.P., Kimber S., Morris S., Cowie A., Macdonald L.M. Plant-biochar interactions drive the negative priming of soil organic carbon in an annual ryegrass field system // Soil Biol. Biochem. 2015. V. 90. P. 111–121. https://doi.org/10.1016/j.soilbio.2015.08.005
Whitman T.L., Enders A., Lehmann J. Pyrogenic carbon additions to soil counteract positive priming of soil carbon mineralization by plants // Soil Biol. Biochem. 2014. V. 73. P. 33–41. https://doi.org/10.1016/J.SOILBIO.2014.02.009
Woolf D., Lehmann J., Joseph S., Campbell C., Christo F.C., Angenent L.T. An open-source biomass pyrolysis reactor // Biofuels, Bioproducts and Biorefining. 2017. V. 11. P. 945–954.
Wu D., Senbayram M., Zang H., Ugurlar F., Aydemir S., Brüggemann N., Kuzyakov Y., Bol, R., Blagodatskaya E. Effect of biochar origin and soil pH on greenhouse gas emissions from sandy and clay soils // Appl. Soil Ecol. 2018. V. 129. P. 121–127. https://doi.org/10.1016/j.apsoil.2018.05.009
Zavalloni C., Alberti G., Biasiol S., Vedove G.D., Fornasier F., Liu J., Peressotti A. Microbial mineralization of biochar and wheat straw mixture in soil: a short-term study // Applied Soil Ecology. 2011. V. 50. P.45–51. https://doi.org/10.1016/j.apsoil.2011.07.012
Zhang Q., Xiao J., Xue J., Zhang L. Quantifying the Effects of Biochar Application on Greenhouse Gas Emissions from Agricultural Soils: A Global Meta-Analysis // Sustainability. 2020. V. 12. P. 3436. https://doi.org/10.3390/su12083436
Zhang A., Liu Y., Pan G., Hussain Q., Li L., Zheng J., Zhang X. Effect of biochar amendment on maize yield and greenhouse gas emissions from a soil organic carbon poor calcareous loamy soil from Central China Plain // Plant Soil. 2011. V. 351. P. 263–275.
Zimmerman A.R., Gao B., Ahn M.-Y. Positive and negative carbon mineralization priming effects among a variety of biochar-amended soils // Soil Boil. Biochem. 2011. V. 43. P. 1169–1179. https://doi.org/10.1016/j.soilbio.2011.02.005
Дополнительные материалы отсутствуют.
Инструменты
Почвоведение


