Почвоведение, 2021, № 9, стр. 1124-1132
Физико-томографическая характеристика и структура бактериального сообщества агрофизической системы прорастающие корни–поровое пространство почв (модельные физические экспериментальные исследования)
А. В. Суздалева a, *, Н. В. Верховцева a, К. Н. Абросимов b, А. А. Романычева c
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
c Ярославский государственный медицинский университет
150000 Ярославль, ул. Революционная, 5, Россия
* E-mail: avsuzdaleva@gmail.com
Поступила в редакцию 08.02.2021
После доработки 10.03.2021
Принята к публикации 07.04.2021
Аннотация
Компьютерная томография позволяет количественно охарактеризовать объемы элементов твердой фазы почв, порового пространства и корневой системы. В рамках физического модельного эксперимента с выращиванием проростков ячменя в течение 7 сут и томографической съемкой через равные промежутки времени фиксировалась динамика изменений структуры объемов почвенных пор и корней. Основная цель заключалась в количественной оценке изменений показателей пористости, диаметра и объема пор, при развитии корневой системы. Эксперимент проведен в образцах дерново-подзолистой (Albic Glossic Retisols (Loamic, Cutanic)) почвы и чернозема (Calcic Chernozem). В пластиковых бюксах объемом 3 см3 создавались модели семенного ложа с двумя слоями: подсеменным, уплотненным до 1.2 г/см3, и надсеменным с плотностью 0.7–0.8 г/см3. Семена ячменя (Hordeum vulgare L.) сорта Михайловский размещались на границе слоев. По мере прорастания проводилась томографическая съемка и исследование бактериального сообщества методом газовой хроматографии – масс-спектрометрии. В этот период зафиксировано сокращение томографической пористости в подсеменном слое и изменение численности микроорганизмов, преимущественно выполняющих деструкцию сложных углеводных соединений. Томографические и микробиологические исследования показали взаимосвязанность происходящих процессов изменения объемов пор почвы, корней и состава микробиоты при прорастании семени.
ВВЕДЕНИЕ
Структура порового пространства вокруг корней имеет большое значение для роста и развития растения, обеспечения питательными веществами, формирования гидрофизических свойств почвы, газопроницаемости и среды обитания микроорганизмов [6, 20]. Требования растений к почвенным условиям могут выражаться через такие физические параметры, как плотность, объемное распределение пор по их диаметрам и соотношение воды и воздуха внутри пор. Известно, что растения хорошо развиваются в почве с плотностью в диапазоне от 1.15 до 1.45 г/см3 и пористостью в диапазоне от 45 до 50% [1]. Однако отмечено, что корневые волоски увеличивают агрегацию почвы [11] и тесно связаны с формированием ризосферы [7]. Структура порового пространства также может определять биоразнообразие микробного сообщества. В частности, такой параметр, как связность пор был предложен в качестве объяснения биоразнообразия микроорганизмов в почве [6]. Отмечалось, что агрегаты с большей площадью поверхности и большей пористостью наиболее благоприятны для развития микробиоты [18].
Цель работы – исследовать процесс формирования корневой системы ячменя, визуализированный с помощью метода рентгеновской компьютерной микротомографии, и соответствующие количественные изменения физических параметров структуры почв и бактериального ценоза прикорневого пространства в ходе прорастания семени.
ОБЪЕКТЫ И МЕТОДЫ
Для проведения эксперимента создавалась искусственная модель семенного ложа из агрегатов двух типов почв:
– чернозема южного (Calcic Chernozem – WRB) [9]. Место отбора проб – Соль-Илецкий район, Оренбургская область 51°58′12″ N, 55°19′15″ E. Почва отнесена к тяжелосуглинистой по содержанию физической глины (<0.01 мм) – от 51.8 до 59.1%;
– дерново-подзолистой почвы (Albic Glossic Retisols, Loamic, Cutanic – WRB) [9]. Место отбора проб – Московская область, с. Ельдигино 56°07′23″ N 37°48′16″ E. Почва отнесена к тяжелосуглинистой по содержанию физической глины (<0.01 мм) – от 51.8 до 59.1%.
В пластиковые бюксы, объемом 3 см3, прозрачные для рентгеновских лучей микротомографа и обладающие минимальной степенью поглощения, сопоставимой с водой, помещались почвенные агрегаты (5–3 мм) таким образом, чтобы создать 2 слоя, различающихся по плотности почв. Нижний слой утрамбовывался поршнем до плотности 1.2 г/см3, верхний – состоял из агрегатов и не уплотнялся дополнительно (равновесная плотность – 0.7 г/см3). На границе слоев располагалось семя ячменя (Hordeum vulgare L.) сорта Михайловский.
Предварительно для исследуемых семян устанавливались значения всхожести (она составляла 92%) и энергии прорастания составляли (61%) в соответствии с требованиями методики ГОСТ [3, 4]. Внутри бюкса на протяжении всего эксперимента поддерживалась оптимальная влажность, близкая к наименьшей влагоемкости (НВ). Растения первоначально поливали сверху, избыток гравитационной воды свободно стекал через воронкообразное отверстие, после чего добавляли по 0.5 мл каждые 48 ч для поддержания воды на уровне, близком к НВ. Контроль влажности проводился с помощью взвешивания образцов. Температура в помещении составляла 26°С, прорастание семян происходило в условиях темноты.
На протяжении периода прорастания с первых по седьмые сутки через равные промежутки времени проводилась томографическая съемка с помощью рентгеновского микротомографа Bruker Sky Scan 1172G (Бельгия). Настройки съемки и реконструкции для образца данного типа и диаметра неоднократно опробованы в ряде аналогичных исследований [8, 12, 15, 19], но в данном случае они скорректированы в сторону ускорения процесса съемки из-за быстрого роста корней. Время съемки для одного сегмента занимало 10 мин. В процессе реконструкции и воссоздания объемной структуры с четко различимыми рентген-контрастными фазами удалось разделить почву, поровое пространство и биологические объекты (зерно с проростком и корнями). Реконструкция – отдельный этап томографического исследования, при котором теневые проекции пересчитываются в набор горизонтальных томографических срезов по заранее выставленным настройкам. В процессе модельного эксперимента получено около 2000 томографических срезов для каждого образца, с разрешением 16.1 мкм и размером 1000 × 1000 пикселей. В микротомографах SkyScan вертикальное разрешение равно горизонтальному, что позволяет сгенерировать вертикальные томографические срезы без математического пересчета. Цифровые шумы скорректированы программными фильтрами (Median, Smoothing). Автоматическая сегментация фаз в таких условиях оказалась частично работоспособной – методом Оцу [13] можно успешно сегментировать только почву. По этой причине в исследовании использована ручная сегментация, что с высокой степенью достоверности позволило разделить перечисленные выше рентген-контрастные фазы.
Помимо визуализации объемной структуры проросшего семени рассчитывали объем семени и корней на каждом этапе исследования при помощи программного обеспечения Bruker CT analyzer (CTan), а также общую пористость почвы.
Состав микробного сообщества реконструировали по микробным маркерам (жирным кислотам и их производным – жирным гидроксикислотам и альдегидам), которые определяли после кислого метанолиза почвенных образцов молекулярным методом газовой хроматографии – масс-спектрометрии (ГХ-МС). Анализ проводили на ГХ-МС системе “HP-5973 Agilent Technologies” (США). Подробно методика анализа описана в [14, 17]. Анализировали следующие образцы: контрольный – исходная почва, в которой не производилось выращивание ячменя; почва из образцов с прорастающим семенем ячменя на пятые и седьмые сутки. Измерения проводили в трехкратной повторности. Образцы, в которых проводился отбор проб для микробиологического исследования разбирались. Отделялось около 1.5 г почвы в зоне корней. В основном это были агрегаты, которые пронизаны корнями. Воздушно-сухой образец растирался в фарфоровой ступке пестиком с резиновым наконечником. Из этой почвы отбирались навески для микробиологичсекого анализа.
Определение влажности в образцах проводилось на приборе анализатор влажности МХ-50 (Япония), термогравиметрическим методом.
Содержание органического углерода определялось на экспресс-анализаторе АН-7529 (Измеритель, Беларусь) методом сухого сжигания в потоке кислорода. Определение плотности твердой фазы – пикнометрическим методом, определение плотности агрегатов методом парафинирования [5]. Гранулометрический состав почвы – методом лазерной дифракции Analysette 22 (Fritsch, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 представлены некоторые свойства исследуемых почв. По содержанию органического вещества обе почвы относятся к малогумусным.
Таблица 1.
Плотность (г/см3) и содержание Сорг в пахотном горизонте дерново-подзолистой почвы и чернозема южного
| Почва | Плотность, г/см3 | Сорг, % | |||
|---|---|---|---|---|---|
| агрегированного надсеменного слоя | уплотненного подсеменного слоя | твердой фазы | агрегатов в надсеменном слое | ||
| Чернозем южный, тяжелосуглинистый, Оренбургская обл. (Calcic Chernozem) | 0.7 | 1.2 | 2.56 | 1.28–1.36 | 2.73–3.18 |
| Дерново-подзолистая, тяжелосуглинистая почва, Московская обл. (Albic Glossic Retisols (Lomic, Cutanic)) | 0.8 | 1.2 | 2.57 | 1.23–1.51 | 1.23 |
На рис. 1 показано томографическое изображение контрольного образца модели семенного ложа без семени в вертикальном срезе. Отчетливо различимы рыхлый надсеменной и уплотненный подсеменной слои. Были рассчитаны значения томографической пористости, которые составили для черноземной почвы для контрольного образца – 34.9%, в образце на пятые сутки – 19.7%, на седьмые сутки – 24.1%, для дерново-подзолистой почвы для контрольного образца – 37.8%, в образце на пятые сутки – 37.8%, на седьмые сутки – 38.2%.
Рис. 1.
Томографическое изображение модели семенного ложа в вертикальном срезе: А – чернозем южный, тяжелосуглинистый, Б – дерново-подзолистая тяжелосуглинистая почва.

На рис. 2 изображена визуализация объемной структуры проросшего семени в черноземе южном. В самом низу образца корни упираются в часть лизиметрической установки для сбора воды, которая имеет форму воронки. На третьи сутки корневая система только начинает формироваться (объем составляет 14%), к седьмым суткам он увеличивается в 3 раза (45%). При этом доля семени уменьшается почти в 2 раза (с 81 до 42%). В дерново-подзолистой почве энергия прорастания больше – на третьи сутки объем корней занимает уже 22%, увеличиваясь к седьмым суткам практически в 3 раза (до 61%). При этом доля семени уменьшилась при прорастании в дерново-подзолистой почве немного более чем на половину (с 50 до 31%).
Рис. 2.
Томографическая объемная реконструкция прорастающего зерна ячменя на плотном зерновом ложе: А – на третьи, Б – на седьмые сутки.
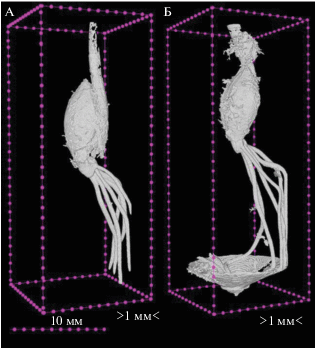
Таким образом, несмотря на близкие значения плотности двух исследованных почв и плотности их твердой фазы, дерново-подзолистая тяжелосуглинистая почва оказалась более благоприятной для начальных этапов прорастания семени ячменя, при этом корневая система в обеих почвах к седьмым суткам увеличивает свой объем в 3 раза. Однако потери доли семени в дерново-подзолистой почве меньше, чем в черноземе.
Основной тренд развития, прослеживающийся на всем этапе роста растения, – корни успешно осваивают почвенное пространство, почвенное сложение не оказывает определяющего влияния. Биологические программы роста и необходимость освоения пространства, заложенные в семени, в начальный период, по-видимому, играют главенствующую роль. Это подтверждает график распределения соотношения толщины корней и основных диапазонов пор. Как видно из рис. 3, наибольший объем порового пространства представлен порами <0.17 мм, тогда как наибольшая доля объемов корней сосредоточена в диапазоне от 0.17 до 0.27 мм, что указывает на способность корней прорастающего семени изменять поровое пространство почв, формировать собственные пути для развития корней диаметром от 0.1 до 0.24 мм.
Рис. 3.
Соотношение распределений объемов пор почвы (1) и корней (2) по диаметрам на седьмые сутки в дерново-подзолистой почве.

Для того, чтобы определить, какой биологический фактор играл главенствующую роль на разных этапах прорастания, в двух почвах определили динамику их ризосферного микробного сообществa.
В составе сообществ ризосферы методом ГХ-МС реконструировано 39 (в черноземе) и 37 (в дерново-подзолистой почве) бактериальных видов, принадлежащих к пяти филумам – Proteobacteria, Actinobacteria, Firmicutes, Bacteroidetes, Cyanobacteria. Видовой состав и численность микробного комплекса представлен в табл. 2.
Таблица 2.
Видовой состав микробного комплекса и численность микроорганизмов сообщества агрофизической системы прорастающие корни–поровое пространство
| Микроорганизмы | Состав микроорганизмов, кл × 106/г | ||||||
|---|---|---|---|---|---|---|---|
| дерново-подзолистая почва | чернозем южный | ||||||
| контроль | пятые сутки | седьмые сутки | контроль | пятые сутки | седьмые сутки | ||
| Actinobacteria | Актинобактерии (без определения видов) | 43.8 | 382.6 | 63.7 | 0 | 0 | 0 |
| Actinomadura roseola | 0.6 | 0.3 | 1.2 | 0.3 | 0.2 | 0.3 | |
| Arthrobacter sp. | 12.6 | 10.6 | 12.3 | 1 | 0.5 | 0.3 | |
| Bifidobacterium sp. | 0 | 0 | 0 | 5.9 | 5.2 | 8.9 | |
| Cellulomonas sp. | 11.3 | 19.1 | 7.9 | 0 | 0 | 0 | |
| Mycobacterium sp. | 3.5 | 4.9 | 5.6 | 5.8 | 6.2 | 11.3 | |
| Nocardia carnea | 2.8 | 2.7 | 3.5 | 0 | 0 | 0 | |
| Nocardiopsis | 0 | 0 | 0 | 0.3 | 0.3 | 0.5 | |
| Propionibacterium jensenii | 0 | 0 | 0 | 2.7 | 3.6 | 4.3 | |
| Pseudonocardia sp. | 3 | 4.4 | 2.5 | 0.6 | 0.5 | 0.4 | |
| Rhodococcus equi | 31.3 | 29.6 | 27.3 | 3.4 | 2 | 2.3 | |
| Streptomyces-Nocardiopsis | 14.2 | 9.2 | 13.2 | 1.6 | 0.9 | 1.8 | |
| Сумма | 123 | 463.4 | 137.2 | 21.6 | 19.4 | 30.2 | |
| Bacteroidetes | Bacteroides fragilis | 0 | 0 | 0 | 0.1 | 0.1 | 0.3 |
| Bacteroides hypermegas | 0.2 | 0.1 | 0.2 | 0 | 0 | 0 | |
| Bacteroides ruminicola | 1.3 | 1.1 | 1.5 | 0.2 | 0.3 | 0.4 | |
| Cytophaga sp. | 2.4 | 2.1 | 2.2 | 0 | 0.1 | 0.2 | |
| Riemirella | 1.5 | 1.3 | 1.2 | 0.2 | 0.2 | 0.6 | |
| Sphingobacterium spiritovorum | 1.7 | 1.5 | 1.8 | 0.6 | 0.3 | 0.7 | |
| Общее количество | 7.1 | 6 | 6.9 | 0.9 | 0.8 | 1.9 | |
| Cyanobacteria | Anabaena (cyanobacteria) | 6.5 | 6 | 9 | 36 | 29.4 | 56.8 |
| Сумма | 6.5 | 6 | 9 | 36 | 29.4 | 56.8 | |
| Firmicutes | Bacillus subtilis | 5.1 | 5.8 | 4.6 | 1.5 | 0.8 | 0.9 |
| Bacillus subtilis | 0 | 0 | 0 | 0.6 | 0.6 | 0.9 | |
| Butyrivibrio 1-2-9 | 0 | 0 | 0 | 0.3 | 0.5 | 2.3 | |
| Butyrivibrio 1-4-7 | 0 | 0 | 0 | 0.5 | 1.5 | 6.1 | |
| Butyrivibrio 7S-14-1 | 0 | 0 | 0 | 1.4 | 1.6 | 4.1 | |
| Clostridium pasteurianum | 19.9 | 49.6 | 11 | 4.6 | 4.2 | 3.4 | |
| Eubacterium lentum | 0 | 0 | 0 | 0.1 | 0.5 | 1.7 | |
| Ruminococcus sp. +** | 81.9 | 107.2 | 43.5 | 0 | 0 | 0 | |
| Сумма | 106.8 | 162.6 | 59.2 | 9.1 | 9.7 | 19.5 | |
| Proteobacteria | Acetobacter sp. | 9 | 6.8 | 7.4 | 0 | 0 | 0 |
| Acetobacterium sp. | 0 | 0 | 0 | 0.1 | 0.2 | 1.5 | |
| Acetobacter-Rhodobacter group | 0 | 0 | 0 | 1.7 | 1.1 | 2.3 | |
| Aeromonas hydrophila | 7.8 | 9.8 | 6.5 | 0.2 | 0 | 0.3 | |
| Agrobacterium radiobacter | 2.5 | 0.4 | 0.9 | 0.5 | 0.4 | 0.4 | |
| Caulobacter sp. | 5 | 4 | 6.1 | 1.2 | 1.2 | 1.4 | |
| Desulfovibrio sp. | 6.1 | 5.9 | 5.3 | 10.8 | 9.3 | 17.5 | |
| Enterobacteriaceae | 5.7 | 2 | 13.5 | 0.4 | 0.7 | 1.1 | |
| Nitrobacter sp. | 17.4 | 25.5 | 13.3 | 0 | 0 | 0 | |
| Proteobacteria | Ochrobactrum | 0 | 0 | 0 | 0.5 | 0.4 | 0.8 |
| Pseudomonas fluorescens | 3.8 | 4.2 | 7.6 | 0.7 | 0.5 | 1.6 | |
| P. putida | 0.9 | 0.6 | 2 | 0 | 0 | 0 | |
| P. vesicularis | 1.4 | 1.2 | 1.6 | 0.2 | 0.1 | 0.5 | |
| Sphingomonas adgesiva | 1 | 1.5 | 2 | 0.5 | 0.3 | 0.6 | |
| Sphingomonas capsulata | 2 | 2.1 | 3 | 2.9 | 2.4 | 3.4 | |
| WARB* | 3 | 2.7 | 2.5 | 0.4 | 0.1 | 0.6 | |
| Xanthomonas sp. | 4.7 | 3.6 | 4.9 | 0.5 | 0.3 | 0.6 | |
| Сумма | 70.4 | 70.4 | 76.7 | 19.8 | 16.8 | 30.1 | |
| Сумма | 333.8 | 734.9 | 305.1 | 89.6 | 77.5 | 142.9 | |
По биоразнообразию наиболее многочисленно был представлен филум Proteobacteria. Далее по количеству видов следовали Actinobacteria и Firmicutes (рис. 4, А) в черноземе и Bacteroidetes в дерново-подзолистой почве (рис. 4, Б). Исходя из экологических принципов, это свидетельствует о том, что именно эти филумы были наиболее устойчивы и адаптационно пластичны. Наиболее отличался в двух почвах по количеству видов филум Firmicutes, который в дерново-подзолистой почве был в 2 раза меньше, чем в черноземной.
Рис. 4.
Биоразнообразие бактерий (%) в филумах: А – чернозем южный, тяжелосуглинистый, Б – дерново-подзолистая тяжелосуглинистая почва.

Кроме того, был проведен анализ динамики таксономического состава микробиологического сообщества. По мере роста семени в черноземной почве происходит увеличение количества анаэробных видов из разных филогенетических групп (рис. 4), в том числе тех, для которых известна способность гидролизовать целлюлозу в анаэробных условиях (табл. 2). В частности, об этом свидетельствует существенное увеличение численности в черноземном образце облигатно анаэробного вида Desulfovibrio sp. с такой ферментативной активностью [16]. По-видимому, уменьшается количество кислорода, увеличивается содержание углекислого газа (изменяется окислительно-восстановительный потенциал) и доминантными в процессе разрушения оболочки становятся анаэробы. Об изменении газового режима в сторону увеличения содержания СО2 в образцах с черноземом свидетельствует рост численности таких видов, как Anabaena sp. – анаэробной фототрофной бактерии, то есть осуществляющей анаэробный фотосинтез и Bifidobacterium sp. – анаэроба, требующего высокого содержания (10%) СО2 в среде. Консорциум анаэробных фототрофов с другими видами бактерий описан как взаимовыгодная ассоциация [2]. Повышено относительно других видов и содержание Propionibacterium jensenii, анаэробного вида, способного за счет выделения большого количества пропионовой кислоты изменять pH среды, что определяет его антифунгальные свойства [10] и, следовательно, регулирующую роль в формировании сообщества.
В образцах дерново-подзолистой почвы наблюдалось обилие численности анаэробного азотфиксатора Clostridium pasteurianum, анаэробного гидролитика Ruminococcus sp. и аэробного нитрификатора Nitrobacter sp. Увеличение этих видов свидетельствует о первоначальном разрушении целлюлозной оболочки зерна и процессов фиксации и преобразовании азота в микробиоте прорастающего семени, необходимого для формирования С/N соотношения. Наблюдалось также увеличение численности Cellulomonas sp. на пятые сутки, с последующим уменьшением на седьмые. Этот вид является представителем факультативно анаэробных целлюлозолитиков, как и другой представитель филума Actinobacteria, Pseudonocardia sp. – активный целлюлозолитик с комплексом целлюлозолитических ферментов. В таком же количестве, как и в черноземной почве, представлен и анаэробный фототрофный вид Anabaena.
Таким образом, как в черноземной, так и в дерново-подзолистой почве при прорастании семени ячменя формируется специфическое сообщество микроорганизмов, которое обеспечивает разрушение целлюлазной оболочки за счет аэробно-анаэробного консорциума бактерий, в которой первичные анаэробные виды (Clostridium pasteurianum) для дерново-подзолистой почвы и вторичные анаэробы (Desulfovibrio sp.) для черноземной обеспечивают не только разрушение оболочки, но и фиксацию азота в анаэробных условиях (анаэробный фототроф Anabaena).
Обращаясь к результатам, которые получены томографическим методом, можно связать увеличение численности анаэробных видов бактерий с существенным (в 3 раза раза) увеличением доли корней в системе семя–корневая система, что приводит к повышению выделения экссудатов корневой системой, стимулирующих развитие определенных видов микроорганизмов, которые связаны с этими органическими соединениями трофическими потребностями. С другой стороны, дыхание повышенной биомассы корней приводит к увеличению содержания углекислого газа и уменьшения концентрации кислорода. Эти физические факторы определяют изменение экологических факторов почвенной среды и соответствующего взаимосвязанного отклика микробного сообщества.
ЗАКЛЮЧЕНИЕ
Микротомография позволяет количественно охарактеризовать структуру порового пространства почвы, определив показатели пористости, диаметра и объема пор, распределение пор по размерам, а также количественно оценить параметры формирования корневой системы. Такие, как толщина корней, доля объема корней, длина корней, что весьма важно для оценки функционирования агрофизической динамической системы прорастающие корни–поровое пространство.
Корни осваивают уплотненное (до 1.2 г/см3) поровое пространство, формируя собственные ходы, при этом показатель томографической пористости к седьмым суткам в черноземе южном уменьшается с 34.9 до 24.1%, в дерново-подзолистой почве меняется незначительно с 37.8 до 38.2%.
В изученный период в составе микробного сообщества в ризосфере Hordeum vulgare L. складывается специфический гидролитический комплекс микроорганизмов, способных к активной, преимущественно анаэробной, деструкции сложных органических соединений (растительных остатков, семенной оболочки, углеводов корневых выделений) и обладающих антагонистической активностью к фитопатогенам.
Томографические и микробиологические исследования показали взаимосвязанность происходящих процессов. Первые позволили заглянуть внутрь почвы при прорастании семени, а результаты изучения динамики таксономического состава сообщества микроорганизмов дали возможность получить новые данные о формировании газового режима, порового пространства и особенностей изменения плотности почвы при посеве семян зерновых культур.
Список литературы
Белоусов С.В., Ханин Ю.В. Проблемы повышения плодородия почвы “Общество, образование, наука в современных парадигмах развития” [Электронный ресурс] // Сборник трудов по материалам Национальной научно-практической конференции (26 ноября 2020 г.) Керчь: ФГБОУ ВО “КГМТУ”, 2020. 236 c. http://www.kgmtu.ru /documents/nauka/ obcshestvo,obrazovanie,nauka_vparadigmah_1-2020.pdf
Зенова Г.М., Иванова Е.А., Омарова Е.О., Николаев Г.М., Лобакова Е.С., Чижикова Н.П. Модельные ассоциации актиномицетов и цианобактерии Anabaena variabilis KÜTZ и их способность к преобразованию структуры глинистых минералов // Теоретическая и прикладная экология. 2009. № 3. С. 79–88. https://doi.org/10.25750/1995-4301-2009-3-079-088
Зерно. Методы определения энергии прорастания и способности прорастания: ГОСТ 10968-88. [Введен 1988-07-01]. М.: Стандартинформ, 2009. 4 с.
Семена сельскохозяйственных культур. Методы определения всхожести: ГОСТ 12038-84. [Введен 1986-07-01]. М.: Стандартинформ, 2011. 64 с.
Шеин Е.В., Милановский Е.Ю., Хайдапова Д.Д., Поздняков А.И., Тюгай З.Н., Початкова Т.Н., Дембовецкий А.В. Практикум по физике твердой фазы почв. М.: Буки-Веди, 2017. 119 с.
Carson J.K., Gonzalez-Quiñones V., Murphy D.V., Hinz C., Shaw J.A., Gleeson D.B. Microbial Ecology Low Pore Connectivity Increases Bacterial Diversity in Soil Jennifer // Applied and Environmental Microbiology. 2010. V. 76. № 12. P. 3936–3942. https://doi.org/10.1128/AEM.03085-09
George T.S., Brown L.K., Ramsay L., White P.J., Newton A.C., Bengough A.G., Russell J., Thomas W.T.B. Understanding the genetic control and physiological traits associated with rhizosheath production by barley (Hordeum Vulgare L.) // New Phytologist. 2014. V. 203. P. 195–205. https://doi.org/10.1111/nph.12786
Ivanov A.L., Shein E.V., Skvortsova E.B. Tomography of soil pores: from morphological characteristics to structural-functional assessment of pore space // Eurasian Soil Science. 2019. № 52(1). P. 50–57. https://doi.org/10.1134/S106422931901006X
IUSS Working Group WRB. World Reference Base for Soil Resources 2014. International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports No. 106. FAO, Rome. 2014.
Lind H. Antifungal properties of dairy propionibacteria. Doctoral thesis // Uppsala: Sverigeslantbruksuniv, ActaUniversitatis agriculture Sueciae. 2010. 44 p.
Moreno-Espíndola I.P., Rivera-Becerril F., Ferrara-Guerrero M., De León-González F. Role of root-hairs and hyphae in adhesion of sand particles // Soil Biology and Biochemistry. 2007. V. 39. № 10. P. 2520–2526. https://doi.org/10.1016/j.soilbio.2007.04.021
Müller K., Katuwal S., Young I., McLeod M., Moldrup P., de Jonge L.W., Clothier B. Characterising and linking X‑ray CT derived macroporosity parameters to infiltration in soils with contrasting structures // Geoderma. 2018. V. 313. P. 82–91. https://doi.org/10.1016/j.geoderma.2017.10.020
Otsu N. A threshold selection method from gray-level histograms // IEEE Transactions on Systems, Man, and Cybernetics. 1979. V. 9(1). P. 62–66. https://doi.org/10.1109/TSMC.1979.4310076
Shekhovtsova N.V., Marakaev O.A., Pervushina K.A., Osipov G.A. The underground organ microbial complexes of moorland spotted orchid Dactylorhiza maculata (L.) Soó (Orchidaceae) // Advances in Bioscience and Biotechnology. 2013. № 4. P. 35–42. https://doi.org/10.4236/abb.2013.47A2005
Skvortsova E.B., Shein E.V., Abrosimov K.N., Romanenko K.A., Yudina A.V., Klyueva V.V., Khaidapova D.D., Rogov V.V. The Impact of Multiple Freeze-Thaw Cycles on the Microstructure of Aggregates from a Soddy-Podzolic Soil: A Microtomographic Analysis // Eurasian Soil Science. 2018. № 51(2). P. 190–199. https://doi.org/10.1134/S1064229318020102
Taufieq N.A., Rahim S.A., Jamil H., Huyyirnah H.J., Arfan A. Isolation and Identification of Desulfovibrio sp. Bacteria from Acid Sulfate Soil // Asian J. Applied Sciences. 2015. № 03(05). P. 730–738.
Verkhovtseva N.V., Osipov G.A., Bolysheva T.N. et al. Comparative Investigation of Vermicompost Microbial Communities. Microbiology of composting. Springer, Berlin, Heidelberg, 2002. P. 99–108. https://doi.org/10.1007/978-3-662-08724-4_8
Voltolini M., Taş N., Wang S., Brodie E.L., Ajo-Franklin J.B. Quantitative characterization of soil microaggregates: New opportunities from sub-micron resolution synchrotron X-ray microtomography // Geoderma. 2017. № 305. P. 382–393. https://doi.org/10.1016/j.geoderma.2017.06.005
Wildenschild D., Sheppard A.P. X-ray imaging and analysis techniques for quantifying pore-scale structure and processes in subsurface porous medium systems // Advances in Water Resources. 2013. № 51. P. 217–246. https://doi.org/10.1016/j.advwatres.2012.07.018
White P.J., George T.S., Gregory P.J., Bengough A.G., Hallett P.D., McKenzie B.M. Matching roots to their environment // Annals of Botany. 2013. № 112. P. 207–222. https://doi.org/10.1093/aob/mct123
Дополнительные материалы отсутствуют.


