Проблемы машиностроения и надежности машин, 2023, № 2, стр. 3-17
Моделирование внешнего волнового воздействия на микроциркуляцию и транскапиллярный обмен
Е. И. Велиев 1, Р. Ф. Ганиев 2, А. А. Кубатиев 3, Д. Л. Ревизников 2, Л. Е. Украинский 2, *
1 Государственная клиническая больница им. С.П. Боткина
Департамент здравоохранения Москвы
Москва, Россия
2 Институт машиноведения им. А.А. Благонравова РАН
Москва, Россия
3 Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
* E-mail: leukrainsky@gmail.com
Поступила в редакцию 28.09.2022
После доработки 05.12.2022
Принята к публикации 20.12.2022
- EDN: CNXPQV
- DOI: 10.31857/S0235711923020104
Аннотация
Рассматривается влияние внешнего волнового воздействия на фильтрацию жидкостей из капилляров в окружающую капилляры ткань и из ткани в капилляры. Установлены два механизма увеличения скорости фильтрации: нерезонансный, связанный с несимметричностью изменения проницаемости поверхностного слоя капилляров и окружающей капилляр ткани на смежных полупериодах волновых воздействий и резонансный, связанный с увеличением перепада давлений, обусловленного пульсовой волной в капилляре, синхронного и синфазного с ним повышения проницаемости, обусловленного волновыми воздействиями. Установленные эффекты могут найти применение в медицине для интенсификации транскапиллярного обмена и микроциркуляции в кровеносной системе.
Моделирование гемодинамических процессов играет важную роль в анализе и диагностике сердечно-сосудистой системы. Несмотря на интенсивное развитие измерительной техники и методов обработки экспериментальных данных, многие аспекты гемодинамики остаются за рамками прямого наблюдения, что обусловливает интерес к вычислительному эксперименту. Совместному применению численного моделирования и обработки данных измерений применительно к анализу пульсовой волны посвящена работа авторов [1] и ряд других. В этих работах использовалась вычислительная модель течения крови в системе крупных артерий.
В настоящей статье рассматриваются микроциркуляционные течения, обеспечивающие снабжение элементов ткани кислородом и другими веществами, присутствующими в крови. Говоря о микроциркуляции, прежде всего, имеют в виду процессы, протекающие в микрососудах. К ним относятся капилляры, мельчайшие артериолы и венулы, артериоло-венулярные анастомозы, а также лимфоносные сосуды. Часто к этим процессам добавляется течение жидкости в окружающем кровеносные сосуды тканевом пространстве. Подробно вопросы микроциркуляции рассмотрены, например, в монографии [2]. Экспериментальному изучению микроциркуляторных процессов посвящены работы [3–7].
На протяжении последних десятилетий все больший интерес вызывает интерес к математическому моделированию микроциркуляции в живых организмах [8–13]. В общем случае, модель микроциркуляции предполагает совместное рассмотрение трех подсистем: гемо-микроциркуляторной, лимфоциркуляторной, и интерстициальной. Поскольку непосредственный обмен веществ между кровеносной системой и тканевым пространством осуществляется через стенку капилляров, в большинстве моделей ограничивают рассмотрение гемо-микроциркуляции именно капиллярами. Такой подход позволяет описывать взаимное влияние течения жидкости в кровеносных и лимфатических капиллярах, течение жидкости в межклеточном пространстве. Важную роль играет транскапиллярный обмен, связанный с фильтрацией и реабсорбцией жидкости между капиллярами и межклеточным пространством, а также абсорбцией в лимфатические капилляры. Кроме того, перенос ряда веществ через стенку капилляра осуществляется с помощью диффузионного механизма.
Модель микроциркуляции должна описывать капиллярную сеть и течение жидкости в межклеточном пространстве. Однако такая модель вычислительно очень сложна в силу большого количества капилляров. В большинстве случаев рассмотрение ограничивается одним капилляром и окружающим его тканевым цилиндром. Простейшие модели основаны на балансовых соотношениях и являются по сути нестационарными нульмерными по пространству моделями. Более сложные, пространственно-одномерные и двумерные модели, учитывают перенос массы в поперечном к оси капилляра, а также в продольном, направлениях.
Целью настоящей статьи является моделирование влияния внешнего волнового воздействия на интенсивность транскапиллярного обмена. В этой связи нужно рассмотреть непосредственное влияние внешних воздействий на транскапиллярный обмен, а также эффекты, связанные с взаимодействием внешнего волнового воздействия с внутренними волнами, имеющими место в микроциркуляторном русле живых организмов. Эксперименты, проведенные с помощью лазерной допплеровской флоуметрии, свидетельствуют о наличии нескольких таких волн. В спектре колебаний кожного кровотока выделяют пять поддиапазонов, соответствующих различным факторам регуляции сосудистого тонуса [5, 6]. К ним относятся: пульсовая волна с диапазоном частот 0.8–1.6 Гц, амплитуда которой зависит от состояния резистивных сосудов, дыхательная волна с диапазоном частот 0.15–0.4 Гц, обусловленная динамикой венозного давления при легочной механической активности, миогенные колебания в частотном диапазоне 0.07–0.15 Гц, происхождение которых связывают с сокращениями гладких мышечных волокон, нейрогенные колебания в диапазоне частот 0.02‒0.052 Гц, а также эпителиальная активность. В настоящей статье при рассмотрении взаимодействия внешних волновых воздействий с внутренними волнами будут учитываться только внутренние волны, связанные с прохождением пульсовой волны.
Математическая модель. Рассматривается модель одиночного капилляра, взаимодействующего с окружающей тканью. Предполагается, что взаимодействие между капиллярами не существенно, и геометрию системы можно задать в виде цилиндрического капилляра и окружающего тканевого цилиндра (рис. 1).
Модель включает следующие уравнения: уравнения, описывающие течение жидкости в капилляре; уравнения, описывающие движение жидкости в окружающей капилляр ткани; уравнения, описывающие фильтрацию жидкости через капиллярную стенку в окружающую ткань и обратную реабсорбцию жидкости из ткани в капилляр; уравнения, описывающие дренаж жидкости из ткани в лимфатическую систему.
Течение крови в сосудах в общем случае описывается трехмерными нестационарными уравнениями для вязкой неньютоновской жидкости совместно с уравнениями динамики эластичных оболочек сосудов. Это связано с необходимостью учета реальных свойств крови, пространственной геометрии сосудов, влияния вязкости, взаимного влияния гидродинамики сосудов и их деформации. Как правило, течение крови носит в основном осесимметричный характер, поэтому в вычислительной практике часто используются двумерные модели и одномерные, осредненные по поперечному сечению сосуда, модели.
В одномерной постановке течение крови в капилляре можно описать гиперболической системой уравнений [14]
В отличие от артерий, течение в капиллярах является медленным, скорость течения составляет порядка 0.1 мм/сек. Согласно экспериментальным данным изменение проходного сечения капилляра в ходе сердечного цикла не значительно. При этом в отличие от других сосудов стенка капилляра является проницаемой, через нее осуществляется фильтрация крови в окружающую ткань и обратно. В пренебрежении инерционными слагаемыми и изменением проходного сечения система уравнений существенно упрощается
В силу относительно малой проницаемости стенки капилляра второе слагаемое в уравнении неразрывности оказывает слабое влияние и профиль давления в капилляре близок к линейному. При этом пульсовые колебания давления можно учесть квазистационарным образом.
Уравнение для давления в окружающей капилляр ткани запишем в виде
При этом используется закон Дарси, связывающий скорость жидкости и градиент давления.
Для описания фильтрации жидкости через стенку капилляра в окружающую ткань и обратную реабсорбцию жидкости из ткани в капилляр используется гипотеза Старлинга, согласно которой плотность потока жидкости через стенку пропорциональна локальной разности давлений в капилляре и окружающей ткани с учетом онкотической составляющей, обусловленной, главным образом, разностью концентраций белков в капилляре и ткани.
Таким образом, уравнение на границе “капилляр–ткань”, описывающее процессы фильтрации и реабсорбции имеет вид
Уравнение, описывающее дренаж жидкости из ткани в лимфатическую систему можно записать в виде
где J – поток жидкости в лимфатическую систему, β – коэффициент проницаемости стенок лимфатических сосудов; Рl – давление в лимфатическом русле.Таким образом, в модели задействованы следующие параметры: поперечный и продольный размеры кровеносного капилляра; коэффициенты проницаемости ткани и стенки кровеносного капилляра; плотность и коэффициент вязкости крови, который в случае применения модели неньютоновской жидкости зависит от напряжения сдвига, давления на артериальном и венозном концах капилляра, задаваемые как функции времени; онкотическое давление; давление в лимфатическом русле; коэффициент проницаемости стенок лимфатических сосудов. Значения параметров в настоящей работе брались из статьи [8].
Пульсационное воздействие на течение в капилляре можно описать с помощью периодического изменения давления на левой (артериальной) границе капилляра
где γр – относительная амплитуда колебаний давления, ${{\omega }_{p}}$ – частота колебаний внешнего воздействия. При этом учитывается затухание колебаний по мере приближения к правой (венозной) границе капилляра. Несмотря на то, что в действительности пульсовые колебания не является гармоническими, такое приближение представляется уместным в свете анализа влияния внешнего волнового воздействия на микроциркуляционное течение.В настоящей статье ставится задача качественного определения возможного влияния волновых воздействий на фильтрацию жидкости сквозь стенку капилляра и сквозь пористую ткань. В общем случае проницаемость ткани зависит от пористости ткани и размеров пор в ткани, а проницаемость стенки капилляра зависят от размеров межклеточного пространства и расстояний между клетками в эндотелии, причем, при уменьшении пористости и размеров пор ткани, а также при уменьшении размеров межклеточного пространства и расстояний между клетками в эндотелии проницаемость уменьшается. Будем рассматривать такие внешние воздействия, при которых жидкость в порах ткани и проницаемой стенки капилляра не будет сжиматься, а объемы пористой ткани насыщенной жидкостью и проницаемой стенки капилляра будут изменяться без сжатия и растяжения только за счет изменения пористости и размеров пор. При этом для модельного описания волновых воздействий такого рода принимается гипотетическая модель, согласно которой объем тканевого цилиндра V, показанного на рис. 1 в виде кольцевой цилиндрической зоны, располагающейся между цилиндрами радиусов R и Re, и объем стенки капилляра υ (эндотелия, лежащего между капилляром и тканью), однозначно связаны с проницаемостями тканевого цилиндра λ и поверхности капилляра α соответственно степенными функциями
где ${{\Phi }_{\lambda }}(V) = {{V}^{{{{\eta }_{\lambda }}}}}$, ${{\Phi }_{\alpha }}~\left( {v} \right) = {{{v}}^{{{{\eta }_{\alpha }}}}}$, ηλ и ηα показатели степеней функций, определяющих проницаемости тканевого цилиндра и пористой поверхности капилляра соответственно.Таким образом, если объемы рассматриваемых пористых сред будут подвергаться вышеуказанным периодическим изменениям, то в выбранной здесь модели проницаемости ткани и поверхности капилляра будут также изменяться периодически. Такой упрощенный подход, ограничивающийся однозначной связью между величинами объема пористой ткани и объема стенки капилляра и их проницаемостями, позволяет установить простейшие закономерности фильтрации жидкости сквозь колеблющуюся проницаемую пористую среду. Это, в свою очередь, позволит вскрыть некоторые возможные механизмы волновых воздействий на микроциркуляцию жидкости. Конечно, для более точного и детального анализа следует перейти к более сложным моделям, учитывающим динамическое поведение насыщенных жидкостью пористых сред. В настоящей статье мы ограничимся лишь описанной выше моделью.
Будем считать, что последнее соотношение можно конкретизировать следующим образом:
Предложенные здесь модельные соотношения для зависимости проницаемости от колебаний объемов могут быть пригодны для широкого круга пористых систем, отвечающих различным значениям показателей ηλ и ηα. Для уточнения этих значений можно поставить специальные эксперименты. Далее установим возможные эффекты, которые могут наблюдаться при разных значениях показателей.
В дальнейшем будем использовать единую форму для обоих коэффициентов
(1)
$a = {{({{a}_{0}} + {{\gamma }_{a}}{{a}_{0}}\sin ({{\omega }_{a}}t + {{\varphi }_{a}}))}^{\eta }},$При этом в силу малых размеров капилляра и тканевого цилиндра можно считать, что колебания давления осуществляются синхронно и синфазно по всей исследуемой области.
Результаты расчетов в двумерной постановке. Рассмотрим сначала стационарное течение при отсутствии пульсовой волны и внешних воздействий. Давление на левой (артериальной) границе капилляра принималось равным 32 ммHg, на правой (венозной) границе – 14 ммHg, результирующее онкотическое давление – 23 ммHg, давление на внешней границе тканевого цилиндра полагалось равным нулю. Таким образом, на левой границе капилляра фильтрация в ткани осуществляется под действием перепада давления 9 ммНg, направленного от капилляра к ткани. На правой границе капилляра действовал тот же по модулю перепад, направленный от ткани к капилляру. На левой и правой границах тканевого цилиндра задавались нулевые производные давления (нулевые потоки жидкости). Обмен жидкостью между тканью и лимфатической системой в расчетах не учитывался. Вязкость крови считается постоянной. На рис. 2 представлены профили нормальной к поверхности капилляра компоненты скорости в интерстициальном пространстве в различных сечениях. По оси абсцисс отложено безразмерное (отнесенное к толщине тканевого цилиндра) расстояние, отсчитываемое от поверхности капилляра. Кривая 1 соответствует области, граничащей с артериолой (левая граница капилляра), кривая 2 – середине капилляра, кривая 3 – области, примыкающей к венозной части (правая граница капилляра).
Рис. 2.
Поперечные профили нормальной компоненты скорости в тканевом пространстве: 1 – левая граница; 2 – середина капилляра; 3 – правая граница.
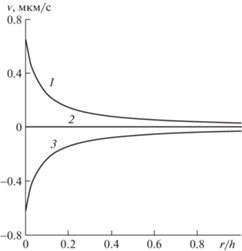
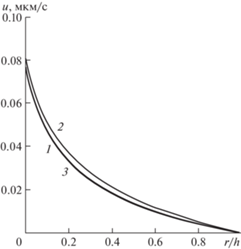
Видно, что в левой части капилляра происходит фильтрация жидкости в тканевое пространство (скорость положительна). В середине нормальная компонента скорости фильтрации близка к нулю, а в правой части капилляра имеет место реабсорбция жидкости из ткани в капилляр. При этом модуль скорости фильтрации быстро убывает по мере удаления от капилляра, что в определенной мере подтверждает справедливость модели одиночного капилляра. На рис. 3 показаны профили продольной компоненты скорости в тех же сечениях, что и на рис. 2. Здесь профили в левой и правой частях практически совпадают в силу симметричного расположения сечений, а наибольшая продольная скорость реализуется в средней части (кривая 2). При этом средний уровень продольной скорости существенно ниже средней абсолютной величины нормальной компоненты. Таким образом, в капилляре и окружающей ткани имеет место микроциркуляция жидкости.
Рис. 3.
Поперечные профили продольной компоненты скорости в тканевом пространстве: 1 – левая граница; 2 – середина капилляра; 3 – правая граница.
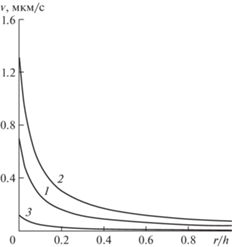
Далее рассмотрим течение жидкости в тканевом пространстве при наличии пульсовой волны в капилляре и отсутствии внешнего волнового воздействия. Относительная амплитуда пульсовой волны ${{{{\gamma }}}_{p}}$ в расчетах полагается равной 0.5, период колебаний T = 1 c. Профили нормальной компоненты скорости в левой части рассматриваемой области (часть капилляра, граничащая с артериолой) в различные моменты времени показаны на рис. 4. Как и следовало ожидать, период максимальной интенсивности фильтрации (кривая 2) соответствует времени пика пульсовой волны (систолическая фаза), а в диастолической фазе скорость фильтрации минимальна. Рассмотрение процесса на правой стороне капилляра приводит к аналогичным результатам. Следовательно, пульсовые колебания давления жидкости в капилляре приводят к колебаниям скорости микроциркуляции и к колебаниям транскапиллярного обмена. При этом, как показывают расчеты, средняя за период колебаний скорость микроциркуляции равна скорости микроциркуляции при рассмотренном выше стационарном режиме. Таким образом, пульсации давления в капилляре приводят только к колебаниям скорости микроциркуляции, но не к их изменению в среднем. Транскапиллярный обмен остается в среднем по времени неизменным.
Рис. 4.
Поперечные профили нормальной компоненты скорости в различные моменты времени: 1 – t = 0; 2 – t = T/4; 3 – t = 3T/4.
Перейдем к рассмотрению внешнего волнового воздействия, которое заключается в гармонических колебаниях объемов ткани и стенки капилляра. При этом коэффициенты проницаемости ткани и стенки капилляра изменяются во времени согласно соотношению (1).
Согласно результатам численного интегрирования двумерной системы уравнений были получены следующие результаты.
На рис. 5 представлен вариант воздействия с частотой ωp, соответствующей пульсовой волне, т.е. частота внешних воздействий на пористую ткань, окружающую капилляр и на проницаемую стенку капилляра равна частоте пульсаций давления внутри капилляра ωa = ωp.
Рис. 5.
Поперечные профили нормальной компоненты скорости в момент времени t = T/4: 1 – невозмущенное течение; 2 – при наличии внешнего волнового воздействия.
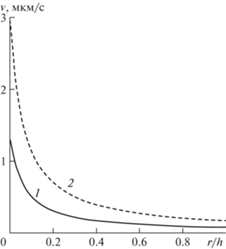
Относительная амплитуда воздействия γa здесь и далее равна 0.5. Показатель степени η, характеризующий нелинейную зависимость проницаемости от волнового воздействия, в данных расчетах равен двум. Рассматривается синфазное и синхронное воздействие. Штриховой кривой показан профиль скорости фильтрации (нормальная компонента) в окрестности левой границы области, полученный при наличии волнового воздействия, сплошная кривая – соответствует невозмущенному течению. Представлен момент времени, когда давление в капилляре максимально и реализуется максимальная скорость фильтрации. Видно, что волновое воздействие приводит в этот момент к двукратному усилению интенсивности фильтрации. В другие моменты времени также имеет место увеличение скорости фильтрации. При этом увеличение осредненной за период скорости фильтрации составляет около 30%. Рассмотрение процесса на правом конце капилляра показало аналогичное увеличение скорости фильтрации, направленной от ткани к капилляру. Таким образом, имеет место интенсификация микроциркуляции и транскапиллярного обмена. Основным механизмом интенсификации фильтрации в данном варианте является синфазное и синхронное повышение давления в капилляре вследствие пульсовой волны и проницаемости окружающей капилляр среды, а также проницаемой стенки капилляра вследствие внешнего волнового воздействия. Отметим, что в этом случае интенсификация фильтрации будет наблюдаться и при линейной зависимости коэффициентов проницаемости от пористости, т.е. при η = 1. Ясно, что существенным фактором в данном варианте является сдвиг фаз между пульсовой волной и внешним воздействием. Наибольшее усиление фильтрации происходит при нулевом сдвиге фаз.
Другой вариант интенсификации фильтрации наблюдается при волновом воздействии с частотами, отличными от частоты пульсовой волны и не связанными с этой частотой рядом соотношений, о которых будет сказано здесь в дальнейшем. Этот вариант продемонстрирован на рис. 6. Здесь для примера рассмотрен случай, когда частота внешнего волнового воздействия в 2.5 (5ωa = 2ωp) раза превышает частоту пульсовой волны, показатель η = 2. Видно, что в момент времени T/4 (кривые 2) интенсивность фильтрации при волновом воздействии (штриховая кривая) оказывается ниже, чем в невозмущенном случае. Однако в момент времени 3T/4 (кривые 3) скорость фильтрации при волновом воздействии многократно превышает невозмущенную величину.
Рис. 6.
Поперечные профили нормальной компоненты скорости в различные моменты времени. Нумерация кривых соответствует рис. 4: сплошные кривые – невозмущенное течение; штриховые кривые – при наличии внешнего волнового воздействия.
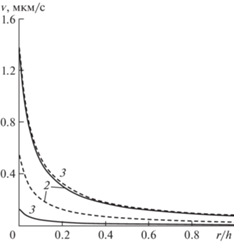
Как результат, средняя за период интенсификация фильтрации составляет более 10%. При этом степень интенсификации практически не зависит от частоты и сдвига фаз между пульсовой и внешней волнами, а определяется только амплитудой внешнего воздействия, которая при выбранной постановке не зависит от частоты. Отметим, что величина односторонне-направленной в среднем скорости фильтрации и скорости микроциркуляции при действии этого нерезонансного механизма существенно зависит от величины η, т.е. от того, каким образом проницаемость зависит от волнового воздействия.
Упрощенная одномерная постановка. Аналитическое решение. Приближенные результаты. Как показывают расчеты в двумерной постановке, результаты которых были приведены в предыдущем разделе, продольная скорость жидкости существенно меньше, чем поперечная. С целью получения приближенных функциональных зависимостей для оценки влияния волнового воздействия на интенсивность фильтрации рассмотрим квазиодномерную задачу. Ограничимся случаем, когда изменением продольной скорости жидкости вдоль оси капилляра можно пренебречь. Уравнения преобразуются следующим образом:
В силу близкого к линейному по продольной координате профилю давления в капилляре, здесь принимаем, что давление во внутренних точках капилляра меняется во времени также, как и на границе
где p0 = p0(x) исходное распределение давление в капилляре, близкое к линейому.Вследствие внешнего волнового воздействия коэффициенты проницаемости ткани и стенки капилляра меняются по закону
Тогда фильтрационный поток жидкости через капиллярную стенку может быть получен в аналитическом виде
Возможны два предельных варианта. В первом варианте (B $ \gg $ 1) интенсивность переноса жидкости через стенку капилляра превалирует над проницаемостью ткани, во втором – имеет место обратная картина. Отметим, что с точки зрения реальных процессов в системе транскапиллярного обмена реализуется второй вариант
Пусть ωa = kωp, pe = 0. Тогда относительное (по отношению к величине без волнового воздействия) изменение среднего по времени односторонне направленного фильтрационного потока в обоих вариантах можно записать в виде
Такое изменение можно представить в виде суммы двух слагаемых
Первое слагаемое определяет фильтрационное течение, обусловленное взаимодействием пульсаций жидкости в капилляре и колебаний проницаемости ткани, окружающей капилляр. Оно может быть отличным от нуля только при некоторых значениях числа k, которые определяют резонансные соотношения между частотами пульсации жидкости в капилляре ωp и колебаний проницаемости ωa. Оно отвечает первому (резонансному) из рассмотренных выше механизмов усиления фильтрации. Второе слагаемое зависит только от характеристик внешнего воздействия и соответствует второму нерезонансному механизму.
Выпишем решение для некоторых частных случаев степени $\eta $, характеризующего нелинейность зависимости проницаемости от колебаний окружающей капилляр среды
Полученные решения позволяют оценить степень увеличения фильтрационного потока через стенку капилляра в зависимости от амплитуды, частоты и фазы волнового воздействия. Отметим, что для рассматриваемого частного случая при k = 1, а также k = 1/2 и k = 1/3, полученные выражения включают как характеристики пульсового воздействия, так и внешнего воздействия.
Первые два слагаемых в выражениях для $\bar {q}$ описывают дополнительную односторонне направленную фильтрацию между капилляром и тканью, происходящую благодаря только изменению проницаемости. Они не связны с резонансом. Для них действует нерезонансный механизм возникновения дополнительной фильтрации. Отметим, что в рамках принятой здесь простейшей кинематической постановки, он реализуется для любых частот и зависит только от амплитуды воздействия. Для нахождения более реалистической зависимости скорости дополнительной фильтрации от частоты необходимо учитывать динамические зависимости колебаний пористых объемов от частоты, которые могут быть установлены из исследования более полной динамической модели насыщенных жидкостью пористых сред.
Для k > 1 существенным фактором, влияющим на интенсификацию фильтрации, в рамках рассматриваемой здесь модели является только амплитуда внешнего волнового воздействия.
Для значений η < 1 односторонне направленные в среднем скорости фильтрации существенно уменьшаются по сравнению со случаем η > 1. Дело в том, что в этом случае значения проницаемости для всех режимов течения существенно меньше, чем ее значения в линейном случае при η = 1.
Для иллюстрации полученных аналитических зависимостей рассмотрим несколько частных случаев.
На рис. 7–9 результаты получены для η = 2, γр = 0.5, γа = 0.5, варьируется фазовый сдвиг.
Рис. 7.
Зависимость степени интенсификации фильтрации от относительной частоты волнового воздействия φа = 0.
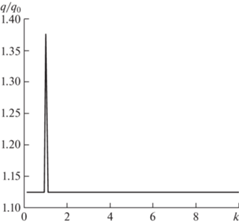
Рис. 8.
Зависимость степени интенсификации фильтрации от относительной частоты волнового воздействия, φа = π/4.
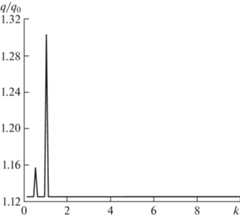
Рис. 9.
Зависимость степени интенсификации фильтрации от относительной частоты волнового воздействия, φа = π/3.
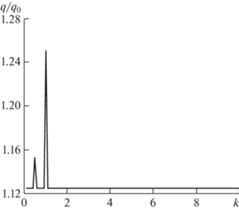
Реальные резонансные кривые будут отличаться от приведенных здесь зависимостью амплитуды от частоты (резонансные кривые будут не вертикальные, а наклонные), однако основные данные, такие как значения резонансных частот, будут близкими к установленным в настоящей статьте. Как было отмечено выше, более точные данные можно получить исходя из рассмотрения динамических моделей и экспериментов.
При k = 1 работают оба механизма – резонансный и нерезонансный, при k, отличном от единицы, действует только нерезонансный механизм.
При k = 1, k = 0.5 работают оба механизма – резонансный и нерезонансный, при других значениях k для рассматриваемых здесь случаев действует только нерезонансный механизм. При φа = π/4 действие резонансного механизма на основной частоте немного ослабевает, но появляется резонанс на половинной частоте.
При k = 1, k = 0.5 работают оба механизма – резонансный и нерезонансный, при других значениях k действует только нерезонансный механизм. С увеличением сдвига по фазе ослабевает действие резонансного механизма как на основной, так и на половинной частоте.
Отметим, что возможны и другие резонансы, например, из примеров рассмотренных выше, при k = 1/3, наблюдался резонансный режим для η = 3 и η = 1/2.
В заключение подчеркнем основной вывод.
Основным резонансным механизмом интенсификации фильтрации, микроциркуляции и транскапиллярного обмена в данном случае является синфазное повышение давления в капилляре вследствие пульсовой волны и увеличение проницаемости благодаря колебаниям в окружающей капилляр среде вследствие внешнего волнового воздействия. Величина увеличения скорости микроциркуляции существенно зависит при действии указанного механизма от сдвига фаз между колебаниями давления в капилляре и колебаниями пористых элементов.
Нерезонансный механизм обусловлен несимметричными во времени колебаниями проницаемости, благодаря чему увеличение скорости жидкости, поступившей из капилляра в пористую ткань, по сравнению со стационарным режимом за ту часть периода колебательных воздействий, когда проницаемость повышена, превосходит уменьшение скорости жидкости, поступившей из капилляра в пористую ткань, по сравнению со стационарным режимом, за оставшееся до конца периода воздействий время, когда проницаемость уменьшена. Эта несимметричность определяется нелинейностью зависимости проницаемости от изменяющегося объема окружающей капилляр пористой среды и проницаемой стенки капилляра при его колебаниях. Он реализуется при η > 1. При η < 1 действие этого механизма приводит к уменьшению средней скорости фильтрации. При η = 1 (в линейном случае) этот механизм не действует.
Практическая реализация установленного эффекта для нужд медицины возможна с помощью разработанных в последние годы гидродинамических массажеров [15], которые к настоящему времени уже запатентованы и проходят клинические испытания.
Список литературы
Ганиев Р.Ф., Ревизников Д.Л., Рогоза А.Н., Сластушенский Ю.В., Украинский Л.Е. Анализ и диагностика сердечно-сосудистой системы человека на принципах нелинейной волновой механики // Проблемы машиностроения и надежности машин. 2016. № 2. С. 96.
Caro C.G., Pedley T.J., Schroter R.C., Seed W.A. The Mechanics of the Circulation. Second Edition, 2012.
Bagayev S.N., Fomin Yu.N., Orlov V.A., Panov S.V., Zakharov V.N., Metyolkin M.G. Investigation of Transcapillary Exchange by the Laser Method // Laser Physics. 2005. V. 15. № 9. P. 1292.
Bagayev S.N., Zakharov V.N., Orlov V.A., Panov S.V., Fomin Yu.N. Investigation of Physical Mechanisms of Blood Microcirculation and Transcapillary Exchange by Using the Phase Sensitive Laser Method // Rus. J. Biomechanics. 2006. V. 10. № 3. P. 21.
Подтаев С.Ю., Мизева И.А. Смирнова Е.Н. Диагностика функционального состояния микроциркуляции на основе термометрии высокого разрешения // Вестник Пермского федерального исследовательского центра. 2012. № 3–4. С. 11.
Жарких Е.В., Маковик И.Н., Потапова Е.В., Дремин В.В., Жеребцов Е.А., Жеребцова А.И., Дунаев А.В., Сидоров В.В., Крупаткин А.И. Оптическая неинвазивная диагностика функционального состояния микроциркуляторного русла пациентов с нарушением периферической микрогемодинамики // Регионарное кровообращение и микроциркуляция. 2018. № 17 (3). С. 23.
Крупаткин А.И., Сидоров В.В. Функциональная диагностика состояния микроциркуляторно-тканевых систем: Колебания, информация, нелинейность. Руководство для врачей. URSS. 2022. 496 с.
Шабрыкина Н.С. Математическое моделирование микроциркуляторных процессов // Российский журнал биомеханики. 2005. Т. 9. № 3. С. 70.
Шабрыкина Н.С. Моделирование микроциркуляторных процессов: нестационарное течение жидкости в ткани // Известия Саратовского университета. Сер. Математика. Механика. Информатика. 2007. Т. 7. Вып. 1. С. 69.
Хмель Т.А., Федоров А.В., Фомин В.М., Орлов В.А. Моделирование процессов микрогемоциркуляции с учетом пульсовых колебаний давления // ПМТФ. 2011. Т. 52. № 2. С. 92.
Хмель Т.А., Федоров А.В. Моделирование пульсирующих течений в кровеносных капиллярах // Матем. биология и биоинформ. 2013. Т. 8. Вып. 1. С. 1.
Моисеева И.Н. Транскапиллярная фильтрация жидкости: модель с сосредоточенными параметрами // Биофизика. 1984. Т. ХХIХ. Вып. 1. С. 126.
Регирер С.А., Шадрина Н.Х. Математическое описание движения крови в микрососудистом модуле скелетной мышцы // Биофизика. 1994. Т. 39. № 1. С. 107.
Мозохина А.С., Мухин С.И. О квазиодномерном течении жидкости с анизотропной вязкостью в сокращающемся сосуде // Дифференциальные уравнения. 2018. Т. 54. № 7. С. 956.
Велиев Е.И., Ганиев Р.Ф., Корнеев А.С., Украинский Л.Е. Гидродинамические генераторы колебаний – новый тип устройств для осуществления периодических воздействий // Доклады РАН. Физика, технические науки. 2021. Т. 501. С. 79.
Дополнительные материалы отсутствуют.
Инструменты
Проблемы машиностроения и надежности машин