Палеонтологический журнал, 2022, № 5, стр. 3-10
Темпы появления и вымирания родов и общая схема диверсификации морских животных фанерозоя
В. Ю. Дмитриев *
Палеонтологический институт им. А.А. Борисяка РАН
117647 Москва, Россия
* E-mail: vyudmi@mail.ru
Поступила в редакцию 09.02.2021
После доработки 25.03.2022
Принята к публикации 25.03.2022
- EDN: YUOPXP
- DOI: 10.31857/S0031031X22050063
Аннотация
Рассмотрены основные характеристики появления и вымирания родов морских животных в течение фанерозоя. Предложено объяснение независимости скоростей появления и вымирания от биоразнообразия. Выявлены основные переломные моменты изменения характерных скоростей и кратко описана кусочно-линейная модель фанерозойской диверсификации морских животных. Сделаны выводы о существовании механизмов саморегуляции скоростей появления и вымирания, обусловленной эволюционным единством биоты.
В истории таксономического разнообразия его изменения, как очевидно и общеизвестно, определяются соотношением появления и вымирания таксонов. Поэтому, рассматривая эволюцию разнообразия, следует учитывать необходимость согласования обсуждаемой в каждом конкретном исследовании картины диверсификации организмов со сведениями об их появлении и вымирании. Это несомненное условие обычно не соблюдается. В настоящей работе сначала изучаются особенности появления и вымирания родов морских животных в течение фанерозоя, и только после этого обсуждается эволюция их таксономического разнообразия. Материалом для предлагаемого исследования послужили сведения из компендиума Дж. Сепкоски (Sepkoski, 2002). Хотя эта сводка была опубликована 20 лет назад и представленный в ней материал нуждается в обновлении, современного обобщения еще не сделано, так что приходится пользоваться имеющимся. Несмотря на многочисленность публикаций, выполненных по данным Сепкоски, некоторые вопросы, как будет видно ниже, еще не были обсуждены, так что дальнейшее исследование этого материала является оправданным.
Имеются обоснованные сомнения в репрезентативности имеющихся палеонтологических и стратиграфических данных (Raup, 1976; Jablonski et al., 2003; Alroy, 2010; Hawkins et al., 2018). Поэтому невозможно считать, что выводы, получаемые в результате их изучения, описывают надежно установленные факты, но они могут быть полезны в качестве интересных гипотез. Подготовка материала к предлагаемому исследованию заключалась только в распределении числа появлений и вымираний родов, датированных интервалом в два или более века, по этим векам пропорционально числам точно установленных в них появлений и вымираний. В работе использована шкала геологического возраста Ф. Градштейна с соавт. (Gradstein et al., 2020).
ОБОБЩЕННЫЕ СКОРОСТИ ПОЯВЛЕНИЯ И ВЫМИРАНИЯ РОДОВ
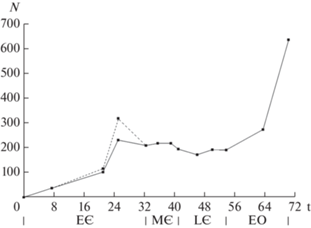
Для изучения скоростей (темпов) удобно рассматривать графики, показывающие накопленное число появившихся и вымерших родов в течение всего фанерозоя, от начала кембрия до нижней границы каждого из последующих веков (рис. 1). Угловые коэффициенты таких графиков равны скоростям, т.е. числу соответствующих событий за один млн лет. Графики наглядно выявляют основные особенности всего хода процесса. Появление и вымирание родов характеризуется долгопериодическими колебаниями около постоянных скоростей. Высокое значение показателей соответствия R2 означает, что прямо пропорциональная зависимость удовлетворительно описывает основное варьирование изучаемых величин. Главный вывод состоит в том, что скорости появления и вымирания не зависят от разнообразия, которое от кембрия до современности многократно возросло. Это заключение противоречит наиболее распространенному в палеонтологической литературе представлению об уменьшении в течение фанерозоя скорости вымирания (Raup, Sepkoski, 1982), появления (Sepkoski, 1998) или обеих скоростей (Peters, 2006; Alroy, 2008; Foote, 2010; и др.). Следует заметить, что в упомянутой работе Сепкоски скорость формообразования оценивалась по косвенному признаку – доле появившихся родов. Также на косвенных оценках – числе появившихся и вымерших родов, основано мнение А.В. Маркова (2001) о “стохастически постоянных” скоростях обоих процессов.
Рис. 1.
Накопленное появление и вымирание родов морских животных от начала кембрия до современности: а – появление родов, Nо = 61.249t, R2 = 0.981; б – вымирание родов, Nе = 56.485t, R2 = 0.986. Обозначения осей на рис. 1–4: Nо – накопленное число появившихся родов, Nе – накопленное число вымерших родов, N – число родов на границах геологических веков, t – время в млн лет от начала кебрия (немакит-далдынского века).
ИНТЕРПРЕТАЦИЯ ПОСТОЯННЫХ СКОРОСТЕЙ
Считая постоянные скорости основной особенностью процесса, а отклонения от них явлениями второго порядка, можно рассмотреть биологический смысл постоянных скоростей. Если биотические отношения представителей разных родов не влияют на вероятности формообразования и вымирания, скорости обоих процессов должны прямо зависеть от наличного разнообразия. Следовательно, отсутствие такой зависимости свидетельствует о несомненной определяющей роли биотических отношений.
Зависимость от биотических отношений означает, что виды составляют некоторые совместно эволюционирующие группы. Вероятности появления и вымирания и соответствующие скорости зависят от группы. Если имеется N видов, подразделенных на биотически связанные группы, то вклад всех групп, содержащих k видов, в общую скорость появления (или вымирания):
где $C_{N}^{k}$ – число групп по k видов (k = 1, 2, …, N), которые могут быть составлены из биоты, содержащей N видов, (число сочетаний из N по k); qk – доля реализующихся в природе групп из $C_{N}^{k}$ возможных; rk = r(k) – средние скорости появления (вымирания) в такой группе. Общая скорость появления (вымирания) V это сумма всех vk. Поскольку qk и rk неотрицательны, то V всегда прямо зависит от N, кроме тривиального случая k = N (qN = 1, $C_{N}^{N}$ = 1). Этот вывод точно так же применим и к родам.Здесь рассмотрены постоянные qk и rk. Математически допустимы постоянные скорости появления и вымирания, если qk и rk являются переменными величинами, например, все произведения qkrk обратно пропорциональны числам сочетаний $C_{N}^{k}.$ Такой процесс вряд ли возможен, так что этот, как и другие мыслимые случаи переменных qk и rk, можно считать не заслуживающими внимания.
Таким образом, существующие в некоторый момент организмы составляют единую группу, эволюционирующую как целое в том смысле, что скорости появления и вымирания регулируются всей совокупностью биотических отношений. Но любая (древняя или современная) биота образует связную систему, в которой не существует изолированных видов или групп видов. В глобальной сети биотических отношений всегда можно найти путь от одного вида к любому другому, случай k = N действительно осуществляется в экологии. Т.е. все организмы, составляющие полную биоту и связанные сетью биотических отношений, должны быть отождествлены с единой эволюционирующей группой, предсказываемой в результате исследования обобщенных скоростей появления и вымирания родов в геологическом прошлом.
Второй вывод из анализа обобщенных скоростей относится к вероятностям появления и вымирания отдельных родов. Основные величины, от которых зависят вероятности, это удельные скорости. В случае постоянных скоростей удельные скорости обратно пропорциональны разнообразию (числу родов), т.е. должны уменьшаться в течение фанерозоя при общем росте биоразнообразия, как и было показано ранее для семейств (Van Valen, 1984; Gilinsky, 1994) и позже для родов (Foote, 2000, 2003; Aberhan et al., 2012). Скаттер-диаграммы, непосредственно демонстрирующие обратную зависимость удельных скоростей от числа родов, были опубликованы автором (Дмитриев, 2001).
Скорости появления и вымирания всех морских родов в каждый момент времени – это средние величины, зависящие от распределения родов по их склонности к формообразованию или вымиранию. Постоянство скоростей накладывает определенные ограничения на возможные изменения обоих распределений во времени.
ДЕТАЛИЗИРОВАННЫЕ СКОРОСТИ ПОЯВЛЕНИЯ И ВЫМИРАНИЯ РОДОВ
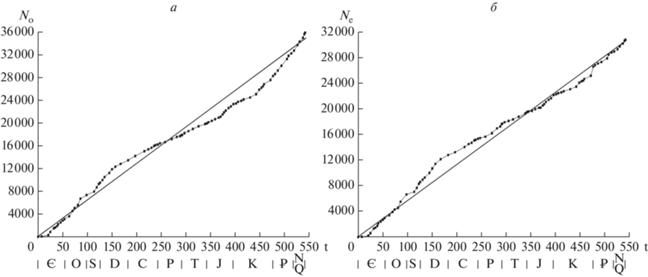
Число родов на границах геологических веков есть разность чисел появлений и вымираний до этих границ. Согласно обобщенным скоростям (рис. 1), в течение фанерозоя число родов морских животных постоянно увеличивалось со скоростью 4.764 рода за млн лет. Показатель соответствия такого процесса фактически наблюдаемому R2 = 0.53, т.е. использование обобщенных скоростей для описания фанерозойской диверсификации морских животных в целом не позволяет удовлетворительно охарактеризовать этот процесс. Чтобы получить более точное описание, сохранив основные сделанные выше выводы, следует рассмотреть кусочно-линейную модель появлений и вымираний родов (рис. 2; табл. 1).
Рис. 2.
Кусочно-линейное приближение накопленного появления и вымирания родов морских животных: а – появление, б – вымирание. Показатель соответствия обоих процессов R2 = 0.999 для области линейной аппроксимации.
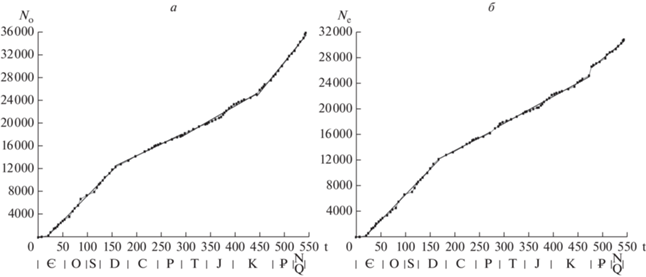
Таблица 1.
Основные характеристики кусочно-линейного описания появления и вымирания родов морских животных в течение фанерозоя
| Интервалы | L* | V | R2 |
|---|---|---|---|
| Появления | |||
| Атдабан–живет | 136 | 87.58 | 0.997 |
| Фран–дорашам | 134 | 41.08 | 0.992 |
| Инд–альб | 151 | 49.73 | 0.984 |
| Сеноман–ныне | 97 | 106.44 | 0.994 |
| Вымирания | |||
| Атдабан–фран | 146 | 79.44 | 0.996 |
| Фамен–ленерд | 104 | 40.19 | 0.992 |
| Инд–кампан | 180 | 42.28 | 0.990 |
| Даний–ныне | 65 | 62.80 | 0.985 |
* Обозначения к табл. 1, 2: L – продолжительность, млн лет, V – скорость, родов/млн лет, R2 – достоверность.
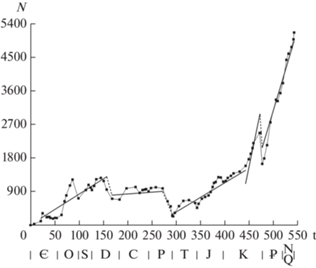
Следствием кусочно-линейного описания появлений и вымираний является кусочно-линейная модель фанерозойской диверсификации морских животных (рис. 3; табл. 2).
Рис. 3.
Кусочно-линейная модель диверсификации морских животных фанерозоя, R2 = 0.975 для всей области линейной аппроксимации. Прерывистыми линиями соединены концы интервалов аппроксимации.
Указанные в табл. 1 и 2 скорости зависят от состояния знаний, зафиксированного в использованном для данной работы компендиуме Сепкоски. При описании новых родов оценки скоростей увеличиваются. Кроме того, на них влияет постоянно идущее уточнение стратиграфического распространения родов. Поэтому основную смысловую нагрузку несут не сами скорости, а сведения об их изменениях при переходе от одного характерного интервала к другому.
После кембрия пять отрезков, характеризующихся различными режимами диверсификации, покрывают 453 млн лет, или почти 93% продолжительности времени от начала ордовика до современности. Оставшиеся 7% приходятся на фран, среднюю–позднюю пермь и маастрихт, когда наблюдаемое разнообразие снижалось (прерывистые линии на рис. 3) – в маастрихте в течение одного века (в самом его конце?), или постепенно – в позднем девоне и, возможно, в средней и поздней перми. Изменение характерных скоростей определяет возможность периодизации истории морской биоты по этой характеристике ее развития (табл. 1 и 2) в дополнение к предложенным ранее различным схемам периодизации по другим основаниям (Bottjer, Ausich, 1986; Марков, 2001).
Ордовикско-среднедевонский этап характеризуется высокими скоростями появления и вымирания родов и диверсификации. Карбоново-раннепермский этап отличается низкими скоростями. В триасе-раннем мелу скорости появления и вымирания родов сравнимы с позднепалеозойскими, но их разность резко увеличена, так что скорость диверсификации сравнима с ордовикско-девонской. С середины мела происходит переход к очень высокой скорости появления родов, что может быть связано со все большим влиянием знаний о современной фауне (Raup, 1979). Скорость вымирания в кайнозое несколько увеличена по сравнению с позднепалеозойской и мезозойской, но не достигает уровня ордовикско-среднедевонской. Скорость диверсификации в позднем мелу и кайнозое значительно превосходит таковую во всей предыдущей истории морской биоты. Некоторое превышение ее в позднем мелу по сравнению с кайнозоем нельзя считать убедительно установленным. Переход от ранне-среднепалеозойского этапа к позднепалеозойскому совпадает со снижением биоразнообразия в позднем девоне, а от позднепалеозойского к триас-раннемеловому – со снижением разнообразия в средней и поздней перми. Переход в середине мелового периода к кайнозойскому типу процесса не связан, в отличие от двух предыдущих, с предшествующим уменьшением числа родов. Кусочно-линейная модель детализированных скоростей игнорирует минимумы разнообразия на границах ордовик–силур и триас–юра, как и все малые минимумы (рис. 2, 3). После глубокого минимума на границе мела и палеогена существенного изменения скоростей не происходит.
КЕМБРИЙСКОЕ РАЗНООБРАЗИЕ
Показанная на рис. 3 кусочно-линейная схема фанерозойской эволюции биоразнообразия неприменима к кембрийскому периоду (рис. 4). В среднем и позднем кембрии число родов менялось незначительно (Дмитpиeв, 2001; Marshall, 2006; Rasmussen et al., 2019). Общий уровень разнообразия в это время длительно сохранялся при быстром обновлении фаунистического состава морской биоты. Единственное существенное снижение разнообразия происходит в ботомском веке почти целиком за счет вымирания археоциат, как ранее было установлено Сепкоски (Sepkoski, 1979) по семействам. Переход к мощной ордовикской диверсификации происходит постепенно, без снижения разнообразия перед ним (Bambach et al., 2004).
ОБСУЖДЕНИЕ
Прежде всего, следует остановиться на механизме, обеспечивающем эволюционное единство биоты, следующее из интерпретации обобщенных скоростей. Скорее всего, оно является результатом большого различия характерных времен экологических и эволюционных процессов. Действительно, согласно данным Сепкоски, среднее время между двумя появлениями новых родов морских животных – около 16 тыс. лет, а вымираниями – 18 тыс. лет, тогда как обычный период популяционных волн на три порядка меньше. Данные Сепковски занижают родовое богатство древних морских животных (Алексеев, 2001; Дмитриев, 2016), но даже при полном знании всей фауны отличие характерных времен будет очень велико.
Сеть биотических взаимовлияний с элементами в ее узлах, меняющими свои свойства в зависимости от характера приходящих сигналов, во многом сходна с нейронными сетями. Эта аналогия в дальнейшем может оказаться продуктивной.
В подобных сетях обычно возникают те или иные автоколебания, и это следует учитывать при каузальном анализе минимумов биоразнообразия, традиционно отождествляемых с массовыми вымираниями. Поскольку время между двумя биотически взаимозависимыми событиями даже на сильно удаленных друг от друга территориях может быть много меньше разрешающей способности стратиграфии, такие события будут приняты за одновременные. Эта синхронность может относиться даже к событиям, происходящим в море и на суше, но выявление их причинной связи будет сильно затруднено или невозможно, и использование таких совпадений для событийной корреляции окажется проблематичным.
Снижение вероятностей появления и вымирания отдельных родов при росте разнообразия может означать зависящее от него увеличение эволюционной стабильности биоты. В связи с этим представляет интерес сообщение Маркова (Markov, 2009) о корреляции продолжительности существования родов и родового богатства сообществ, в которых эти роды обитали.
Саморегуляция скоростей появления и вымирания родов, определяемая их биотическими отношениями, – это ясный случай гомеостаза, зависящего от эволюционных свойств биоты. Другие примеры, такие как длительное сохранение основных температурных и химических параметров биосферы, определяющее возможность существования жизни, являются предметом длительной дискуссии о пределах биотического регулирования (Tyrrell, 2013).
Большой интерес представляет обсуждение механизмов, обеспечивающих гомеостаз скоростей появления и вымирания. В этом отношении обращает на себя внимание связность биоты (отношение числа реализованных биотических связей, т.е. таких случаев, когда некоторый род влияет на какой-либо другой род, к числу возможных связей). Общее число связей равно CN(N – 1)/2, N – число родов, C – связность. Среднее число связей на род будет C(N – 1)/2, а поскольку N $ \gg $ 1, то оно близко к CN/2. В случае постоянной связности среднее число связей единичного рода меняется так же, как разнообразие, и это очень просто объясняет биологический механизм обратной зависимости вероятностей появления и вымирания от числа таксонов и сохранения постоянных скоростей при увеличении числа связей. В экологии современных сообществ их постоянная связность предполагалась ранее (Martinez, 1992). Дальнейшее обсуждение вопроса о соотношениях связности, видового богатства и стабильности сообществ свидетельствует о сложности и отсутствии однозначного решения этой проблемы (Landi et al., 2018). Аналогия с сообществами может быть некорректной и затруднять понимание механизма изучаемых здесь процессов. Поэтому применительно ко всем организмам в геологическом времени лучше говорить об эволюционной связности биоты.
В случае постоянной эволюционной связности среднее число биотических связей отдельных родов увеличивается параллельно общему росту биоразнообразия в фанерозое. Это число может служить грубой характеристикой биотического компонента экологической специализации родов, т.е., в течение фанерозоя при постоянной связности специализация в среднем должна постепенно уменьшаться. Поскольку скорости появления и вымирания оказываются зависящими от общего уровня специализации родов, то наблюдаемые отклонения скоростей от их средних значений должны в значительной степени определяться колебаниями уровня специализации.
Постоянная эволюционная связность – интересный, но не единственно возможный случай. Вполне может существовать закономерный тренд связности. Выяснение этого – вопрос эмпирического изучения, которое для палеонтологического материала сильно затруднено, но косвенные данные, вероятно, могут быть получены при анализе специализации таксонов.
Кусочно-линейная модель диверсификации описывает этот процесс, согласуясь с данными о появлениях и вымираниях родов. Этим она отличается от других ранее предложенных моделей, как кусочных, выделяющих интервалы логистического роста (Sepkoski, 1979; Courtillot, Gaudemer, 1996), так и единообразно описывающих изменения таксономического разнообразия в течение всего фанерозоя (Benton, 1995; Markov, Korotayev, 2007; Марков, Коротаев, 2007, 2009). Экспоненциальная модель М. Бентона и гиперболическая модель А.В. Маркова и А.В. Коротаева коренным образом отличаются друг от друга по своему биологическому смыслу: первая подразумевает процесс, не зависящий от биотических отношений, тогда как вторая – сильно зависящий от них. Сравнительный анализ обеих моделей показывает, что они в равной мере соответствуют имеющемуся фактическому материалу, то есть, описывают наблюдаемые изменения разнообразия со сходной достоверностью (Дмитриев, 2011), так что статистические критерии не позволяют определить, какую из них следует предпочесть. Изучение же изменений числа родов как процесса, зависящего от соотношения их появлений и вымираний, вынуждает отвергнуть обе модели. Это же можно сказать и о любых других возможных попытках внешне удачного единого описания всего фанерозойского процесса монотонной функцией с двумя-тремя параметрами без учета данных о появлениях и вымираниях.
ВЫВОДЫ
1. Появление и вымирание родов характеризуется долгопериодическими колебаниями около постоянных скоростей, не зависящих от мгновенного разнообразия вследствие определяющей роли биотических отношений.
2. Существующие в некоторый момент организмы составляют единую группу, эволюционирующую как целое в том смысле, что скорости появления и вымирания гомеостатически регулируются всей совокупностью биотических отношений.
3. Эволюционное единство биоты является результатом большого различия характерных времен экологических и эволюционных процессов.
4. Эволюционная стабильность биоты увеличивается с ростом биоразнообразия.
5. После кембрия по скоростям появления, вымирания и диверсификации различается четыре основных этапа развития: тремадок–живетский, фамен–раннепермский, триас–раннемеловой и позднемеловой–кайнозойский.
6. Изменения скоростей на интервалах линейной аппроксимации могут быть связаны с изменениями среднего уровня экологической специализации таксонов.
Список литературы
Алексеев А.С. Палеонтологическая летопись и ее свойства // Алексеев А.С., Дмитриев В.Ю., Пономаренко А.Г. Эволюция таксономического разнообразия. М.: ГЕОС, 2001. С. 8–18 (Экосистемные перестройки и эволюция биосферы. Вып. 5).
Дмитpиeв B.Ю. Кривые разнообразия // Алексеев А.С., Дмитриев В.Ю., Пономаренко А.Г. Эволюция таксономического разнообразия. М.: ГЕОС, 2001. С. 19–67 (Экосистемные перестройки и эволюция биосферы. Вып. 5).
Дмитpиeв B.Ю. Эволюция биоразнообразия: гипербола или экспонента? // Палеонтол. журн. 2011. № 6. С. 107–110.
Дмитpиeв B.Ю. Полное разнообразие ископаемых: перспективы // Палеонтол. журн. 2016. № 6. С. 3–10. https://doi.org/10.7868/S0031031X16060064
Марков А.В. Новый подход к моделированию динамики разнообразия фанерозойской морской биоты // Журн. общ. биол. 2001. Т. 62. № 6. С. 460–471.
Марков А.В., Коротаев А.В. Динамика разнообразия фанерозойских морских животных соответствует модели гиперболического роста // Журн. общ. биол. 2007. Т. 68. № 1. С. 3–18.
Марков А.В., Коротаев А.В. Гиперболический рост в живой природе и обществе. М.: URSS, 2009. 198 с.
Aberhan M., Nürnberg S., Kiessling W. Vision and the diversification of Phanerozoic marine invertebrates // Paleobiology. 2012. V. 38. № 2. P. 187–204. https://doi.org/10.5061/dryad.qt0c2
Alroy J. Dynamics of origination and extinction in the marine fossil record // Proc. Nat. Acad. Sci. USA. 2008. V. 105. Suppl. 1. P. 11536–11542. https://doi.org/10.1073/pnas.0802597105
Alroy J. Fair sampling of taxonomic richness and unbiased estimation of origination and extinction rates // Quantitative methods in paleobiology. Short course / Eds Alroy J., Hunt G. New Haven, CT: 2010. P. 55–80 (Pap. Paleontol. Soc. V. 16). https://doi.org/10.1017/S1089332600001819
Bambach R.K., Knoll A.H., Wang S.C. Origination, extinction, and mass depletions of marine diversity // Paleobiology. 2004. V. 30. № 4. P. 522–542. https://doi.org/10.1666/0094-8373(2004)030,0522:OEAMDO.2.0. CO;2
Benton M.J. Diversification and extinction in the history of life // Science. 1995. V. 268. № 5207. P. 52–58.
Bottjer D.J., Ausich W.I. Phanerozoic development of tiering in soft substrata suspension-feeding communities // Paleobiology. 1986. V. 12. № 4. P. 400–420.
Courtillot V., Gaudemer Y. Effects of mass extinction on biodiversity // Nature. 1996. V. 381. № 6578. P. 146–148. DOI.org/10.1038/381146a0
Foote M. Origination and extinction components of taxonomic diversity: general problems // Paleobiology. 2000. V. 26. Iss. S4: Deep Time: Paleobiology’s Perspective. P. 74–102. https://doi.org/10.1017/S0094837300026890
Foote M. Origination and extinction through the Phanerozoic: a new approach // J. Geol. 2003. V. 111. № 2. P. 125–148. https://doi.org/10.1086/345841
Foote M. The geologic history of biodiversity // Evolution Since Darwin: the First 150 Years / Eds Bell M.A., Futuyma D.J., Eanes W.F., Levinton J.S. Sunderland, MA: Sinauer, 2010. P. 479–510.
Gilinsky N.L. Volatility and the phanerozoic decline of background extinction intensity // Paleobiology. 1994. V. 20. № 4. P. 445–458. https://doi.org/10.1017/s0094837300012926
Gradstein F.M., Ogg J.G., Schmitz M.D., Ogg G.M. (Eds). Geologic Time Scale 2020. Elsevier, 2020. V. 1, 2. 1357 p. https://doi.org/10.1016/C2020-1-02369-3
Hawkins A.D., Kowalewski M., Xiao S. Breaking down the lithification bias: the effect of preferential sampling of larger specimens on the estimate of species richness, evenness, and average specimen size // Paleobiology. 2018. V. 44. № 2. P. 326–345. https://doi.org/10.1017/pab.2017.39
Jablonski D., Roy K., Valentine J. W. et al. The impact of the Pull of the Recent on the history of marine diversity // Science. 2003. V. 300. № 5622. P. 1133–1135. https://doi.org/10.1126/science.1083246
Landi P., Minoarivelo H.O., Brännström E. et al. Complexity and stability of ecological networks: a review of the theory // Population Ecol. 2018. V. 60. № 4. P. 319–345. https://doi.org/10.1007/s10144-018-0628-3
Markov A.V. Alpha diversity of Phanerozoic marine communities positively correlates with longevity of genera // Paleobiology. 2009. V. 35. № 2. P. 231–250. https://doi.org/10.1666/07077.1
Markov A.V., Korotayev A.V. Phanerozoic marine biodiversity follows a hyperbolic trend // PalaeoWorld. 2007. V. 16. № 4. P. 311–318. https://doi.org/10.1016/j.palwor.2007.01.002
Marshall C.R. Explaining the Cambrian “Explosion” of animals // Ann. Rev. Earth Planet. Sci. 2006. V. 34. P. 355–384. https://doi.org/10.1146/annurev.earth.33.031504.103001
Martinez N.D. Constant connectance in community food webs // Amer. Natur. 1992. V. 139. № 6. P. 1208–1218. https://doi.org/10.1086/285382
Peters S.E. Genus extinction, origination, and the durations of sedimentary hiatuses // Paleobiology. 2006. V. 32. № 3. P. 387–407. https://doi.org/10.1666/05081.1
Rasmussen C.M.Ø., Kröger B., Nielsen M.L., Colmenar J. Cascading trend of Early Paleozoic marine radiations paused by Late Ordovician extinctions // Proc. Nat. Acad. Sci. USA. 2019. V. 116. № 15. P. 7207–7213. https://doi.org/10.1073/pnas.1821123116
Raup D.M. Species diversity in the Phanerozoic: an interpretation // Paleobiology. 1976. V. 2. № 4. P. 289–297. https://doi.org/10.1017/S0094837300004929
Raup D.M. Biases in the fossil record of species and genera // Bull. Carnegie Mus. Natur. Hist. 1979. № 13. P. 85–91.
Raup D.M., Sepkoski J.J., Jr. Mass extinctions in the marine fossil record // Science. 1982. V. 215. № 4539. P. 1501–1503. https://doi.org/10.1126/science.215.4539.1501
Sepkoski J.J., Jr. A kinetic model of Phanerozoic taxonomic diversity II. Early Phanerozoic families and multiple equilibria // Paleobiology. 1979. V. 5. № 3. P. 222–251. https://doi.org/10.1017/S0094837300006539
Sepkoski J.J., Jr. Rates of speciation in the fossil record // Phil. Trans. Roy. Soc. London B. 1998. V. 353. № 1366. P. 315–326. https://doi.org/10.1098/rstb.1998.0212
Sepkoski J.J., Jr. A Compendium of Fossil Marine Animal Genera // Bull. Amer. Paleontol. 2002. № 363. 560 p.
Tyrrell T. On Gaia a critical investigation of the relationship between life and Earth. Princeton, NJ: Princeton Univ. Press, 2013. 320 p. https://doi.org/10.1515/9781400847914
Van Valen L. A resetting of Phanerozoic community evolution // Nature. 1984. V. 307. № 5. P. 50–52. https://doi.org/10.1038/307050a0
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал