Океанология, 2023, T. 63, № 4, стр. 604-617
Первичная и бактериальная продукция в проливе Брансфилда (Антарктика) в летний период
С. А. Мошаров 1, 2, *, И. В. Мошарова 1, 3, Д. И. Фрей 1, А. М. Селиверстова 1, А. А. Латушкин 4, С. В. Гонтарев 1
1 Институт океанологии им. П.П. Ширшова Российской академии наук
Москва, Россия
2 Московский государственный технический университет имени Н.Э. Баумана
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова, Биологический факультет
Москва, Россия
4 Морской гидрофизический институт Российской академии наук
Севастополь, Россия
* E-mail: sampost@list.ru
Поступила в редакцию 05.12.2022
После доработки 06.02.2023
Принята к публикации 16.02.2023
- EDN: YMODMP
- DOI: 10.31857/S0030157423040135
Аннотация
В работе представлены результаты измерений пространственного распределения основных параметров первичной продуктивности в проливе Брансфилда антарктическим летом. Интегральная первичная продукция в проливе варьировала от 435 до 741 мгС/м2 в сутки. Доля первичной продукции в общей продукции фито- и бактериопланктона в верхнем 10-м слое составляла 82–91%. Потенциальная фотосинтетическая способность (Fv/Fm) была на высоком уровне в пределах эвфотического слоя (0.418–0.749) во всем районе. Продукционные параметры в двух основных водных массах в проливе не различались. Фотосинтетическая эффективность (соотношение ассимиляционного числа и относительной скорости электронного транспорта, АЧ/rETR) варьировала в разных субрегионах района исследований почти в шесть раз.
ВВЕДЕНИЕ
Пролив Брансфилда представляет собой относительно глубокий и узкий пролив между Южными Шетландскими островами и Антарктическим полуостровом. Пролив соединяет море Беллинсгаузена на западе, море Уэдделла на востоке и море Скотия на севере, однако водообмен в глубинных слоях между указанными акваториями ограничен, поскольку пороги между ними достаточно мелководны [16]. Гидрография пролива неоднократно изучалась с начала 20-го века [14]. Верхний слой океана в этом регионе представлен двумя основными водными массами: модифицированной водой, распространяющейся из моря Беллинсгаузена (TBW), относительно более теплой и менее соленой, и модифицированной водой моря Уэдделла (TWW), относительно более холодной и более соленой [19, 43]. TBW занимает северную часть пролива и распространяется в северо-восточном направлении вдоль Южных Шетландских островов, TWW наблюдается в южной части пролива и распространяется в юго-западном направлении вдоль Антарктического полуострова [39].
Существующие данные показывают, что в проливе Брансфилда наблюдается циклоническая циркуляция [39, 45]. Главной особенностью циркуляции вод в проливе является наличие быстрого и узкого течения Брансфилда, направленного на северо-восток вдоль Южных Шетландских островов. Важным аспектом динамики вод в проливе являются приливные течения [46], которые, в частности, приводят к генерации интенсивных внутренних волн в некоторых районах пролива [26].
Для значительной части Южного океана отмечен феномен высокой концентрации биогенных элементов и низкого содержания хлорофилла. Считается, что относительно низкая первичная продукция при высоком содержании биогенных элементов обусловлена в основном ограничениями по доступности света и железа [13]. Причем влияние этих двух факторов на фотосинтетическую активность фитопланктона взаимосвязано на физиологическом уровне. Ограничение количества железа вызывает нарушение синтеза пигментов и неэффективное функционирование системы транспорта электронов, снижая выход фотосинтеза на единицу хлорофилла [12]. Эти нарушения фотосинтетических процессов сильно снижают способность фитопланктона адаптироваться к условиям низкой освещенности [10, 18].
Существует представление, что в океанических районах, где сильно влияние TBW, особенно вокруг Южных Шетландских островов, наблюдается более высокая концентрация хлорофилла “а” (хл “а”) по сравнению с водами под влиянием TWW в летний период [24, 30, 38]. Но такое горизонтальное распределение хлорофилла формируется не каждый год [21].
Фитопланктон и гетеротрофные бактерии являются ключевыми группами в основании пищевой сети, которые преобразуют растворенные биогенные элементы в органическое вещество и обеспечивают продукционный потенциал более высоких трофических уровней, таких, как мезозоопланктон и рыбы. Формирование биомассы фитопланктона и бактериопланктона служит основанием для двух вариантов пищевых цепей – пастбищной цепи и микробной петли. Согласно концепции “микробной петли” [3, 11], выделяемое фитопланктоном растворенное органическое вещество (РОВ), практически не используемое гетеротрофными организмами, потребляется гетеротрофными бактериями, которые служат пищей для простейших – гетеротрофных нанофлагеллят и циллиат. Таким образом, растворенная часть первичной продукции включается в пищевую цепь. Кроме автохтонного РОВ, гетеротрофные бактерии потребляют также и аллохтонное РОВ. Доминирование продукции гетеротрофных бактерий может приводить к более низкой эффективности пищевой сети и более низкой продукции высших трофических уровней.
Целью данной работы было исследовать особенности первичной продуктивности, а также баланса между первичной и бактериальной продукцией в Антарктике в условиях сильных градиентов гидрофизических параметров, определяемых двумя различающимися водными массами в проливе Брансфилда.
МАТЕРИАЛЫ И МЕТОДЫ
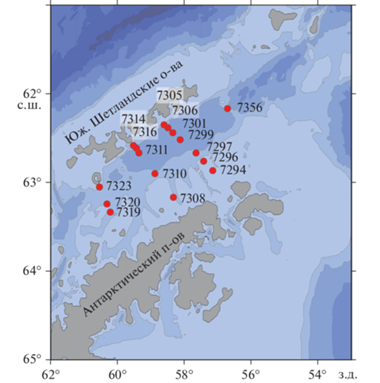
Район исследований, гидрофизические и гидрохимические измерения. Исследования проводили в ходе 87 рейса НИС “Академик Мстислав Келдыш” в проливе Брансфилда (Антарктика) в летний период южного полушария с 21 января по 1 февраля 2022 г. [33] Пробы воды отбирали с помощью пластиковых батометров Нискина в составе комплекса General Oceanic GO1018 на 16 станциях. Было сделано три поперечных разреза (разрез 1 – станции 7294–7305, разрез 2 – станции 7308–7314, разрез 3 – станции 7319–7323) и одна станция восточнее пролива (ст. 7356) (рис. 1). Профили солености и температуры на станциях были получены с помощью CTD-зонда Idronaut Ocean Seven 320p в составе комплекса. Горизонты отбора проб (5–7 горизонтов на станцию) выбирали по следующей схеме: поверхность, слой максимума флуоресценции, нижняя граница эвфотического слоя и промежуточные горизонты.
Интенсивность фотосинтетически активной радиации (ФАР, 400–700 нм) на поверхности моря и в толще воды измеряли с использованием автономного зондирующего измерителя “Кондор”. Эвфотическая зона определялась как слой, ограниченный глубиной проникновения 1% поверхностной ФАР.
Потенциальную плотность воды рассчитывали по данным температуры, солености и давления, полученным по результатам CTD-зондирований. Глубина верхнего перемешанного слоя (ВПС) оценивалась как глубина, на которой градиент плотности был равен или превосходил 0.02 кг/м3 [9].
Определение содержания растворенного неорганического фосфора (фосфаты) проводилось колориметрически в соответствии с [7]. Определение растворенного неорганического кремния (силикатов) проводилось по методу Королева [1] с образованием голубого молибденового комплекса. При ожидаемо высоких величинах содержания кремния, пробы предварительно разбавлялись 1 : 2 или 1 : 10 малокремниевой морской водой. Определение нитратного азота (нитраты) проводилось по [6].
Определение продукционных параметров фитопланктона. Определение скорости первичной продукции (ПП) проводили на 7 станциях (5 горизонтов на каждой) экспериментально радиоуглеродным методом [40]. Во флаконы c пробами воды объемом 50 мл был добавлен раствор NaH14СO3. Экспонирование флаконов осуществляли по методу имитации световых и температурных условий в оригинальном лабораторном инкубаторе с регулируемой светодиодной подсветкой [4]. Поддержание температуры инкубации, соответствующей температуре в точке отбора проб, осуществляли с помощью лабораторного охладителя HAILEA-100 и микропомпы для циркуляции воды. Уровень освещенности для каждого флакона, также соответствующей освещенности в точке отбора проб, задавался регулируемой величиной постоянного тока, протекающего через светодиод [4].
Условия освещенности в инкубаторе устанавливались для каждого измерения следующим образом. Учитывая параболическую зависимость интенсивности освещения от времени суток и величину максимальной (полуденной) интенсивности ФАР, измеренной при пробоотборе, был рассчитан средний за светлое время суток уровень ФАР. В период исследований эти значения составляли 300–700 мкмоль фотонов/м2 в сек. Эти значения устанавливались в инкубаторе для поверхностных проб. Для задания освещенности проб с других горизонтов использовались значения доли ФАР, достигавшей соответствующих горизонтов, рассчитанных при оптическом зондировании водной толщи с помощью комплекса “Кондор”. Суточные значения ПП были рассчитаны по экспериментально полученным значениям часовой скорости ПП (мгС/м3 в час) и длины дня для данной широты и периода времени (17 ч).
После инкубации в течение 3 часов пробы отфильтровывали через мембранные фильтры “Владипор” (0.45 мкм). Радиоактивность исходного раствора и фильтров определяли с помощью жидкостного сцинтилляционного счетчика Triathler (Hidex, Финляндия). Ассимиляционное число (удельная первичная продукция, АЧ, мг С/мг хл в ч) было рассчитано путем нормирования ПП на отдельных горизонтах по соответствующей концентрации хл “а”. Долю феофитина определяли как отношение концентрации феофитина к сумме концентраций хл “а” и феофитина. Этот параметр рассматривался как показатель состояния хлорофилла с точки зрения продукционного потенциала. Как показано в работе [5], доля феофитина менее 40% соответствует активному состоянию фитопланктона с высоким продукционным потенциалом.
Концентрацию хл “а” в воде измеряли методом флуоресценции ацетонового экстракта [25]. Пробы воды (500 мл) отфильтровывали через стекловолоконные фильтры Whatman GF/F под вакуумом не более 0.2 атм. Для экстракции хл “а” фильтры помещали в пробирки с ацетоном (90%) и выдерживали в темноте при температуре +4°С в течение 24 ч. Затем флуоресценцию экстракта измеряли с помощью флуориметра МЕГА-25 до и после подкисления 1 н HCl (коррекция на феофитин). Флуориметр был предварительно откалиброван с использованием стандарта хлорофилла (Sigma). Концентрация хл “а” и феофитина была рассчитана согласно [23].
Активная флуоресценция хл “а” была измерена с помощью ультрачувствительного РАМ-флуориметра WATER-PAM (Walz, Германия). Измерение соотношения интенсивности флуоресценции хлорофилла для фитопланктона, выдержанного в темноте, при слабой вспышке возбуждающего света (минимальный выход флуоресценции, F0) и при насыщающем фотосинтез возбуждающем свете (максимальный выход флуоресценции, Fm) позволяет определить максимальную эффективность первичных процессов фотосинтеза (Fv/Fm), которая рассчитывается по формуле Fv/Fm = (Fm–– F0)/Fm [20]. Относительная переменная флуоресценция Fv/Fm – это максимальный квантовый выход фотосистемы II, служащий мерой потенциальной фотосинтетической способности фитопланктона. Измерения флуоресцентных параметров фотосинтетической системы фитопланктона F0 и Fv/Fm были выполнены в пробах, выдержанных в темноте в течение часа. Для оценки активности первичных процессов фотосинтеза (конвертация солнечной энергии в химически связанную) определялась величина rETR (относительная скорость электронного транспорта в фотосистеме II) при задании освещенности, соответствующей точке отбора пробы:
где Y – фотохимическая эффективность фотосистемы II при определенной освещенности, Е – уровень актиничного (соответствующего природному в месте отбора) света (мкмоль фотонов/м2 в сек) и фактор 0.5 – величина, учитывающая распределение фотонов между фотосистемой I и фотосистемой II.Фотохимическую эффективность фотосистемы II для свето-адаптированных проб рассчитывали согласно [20]:
(2)
${\text{Y}} = {{\Delta {\text{F}}} \mathord{\left/ {\vphantom {{\Delta {\text{F}}} {{\text{F}}_{{\text{m}}}^{{\text{'}}}}}} \right. \kern-0em} {{\text{F}}_{{\text{m}}}^{{\text{'}}}}} = {{({\text{F}}_{{\text{m}}}^{{\text{'}}} - {{{\text{F}}}_{{\text{t}}}})} \mathord{\left/ {\vphantom {{({\text{F}}_{{\text{m}}}^{{\text{'}}} - {{{\text{F}}}_{{\text{t}}}})} {{\text{F}}_{{\text{m}}}^{{\text{'}}},}}} \right. \kern-0em} {{\text{F}}_{{\text{m}}}^{{\text{'}}},}}$Определение микробиологических параметров. Определения численности (ЧБ), биомассы (ББ) и продукции бактериопланктона (ПБ) выполняли на 6 станциях (4–5 горизонтов на каждой). Пробы морской воды сразу после их отбора фиксировали 38% формальдегидом (предварительно профильтрованным через мембранный фильтр с диаметром пор 0.2 мкм (Nucleopor)) до конечной концентрации в пробе 1% и хранили максимум в течение суток в темноте при температуре 4°С. Численность и размеры бактериальных клеток определяли методом эпифлуоресцентной микроскопии с использованием флуоресцентного красителя 3.6-bis(dimethylamino)acridine (акридиновый оранжевый) и черных ядерных фильтров с диаметром пор 0.2 мкм (Osmonics, США) [22, 36, 37]. Препараты для микроскопирования изготовляли с применением низкофлуоресцирующего иммерсионного масла (Olimpus, Япония). Бактерий учитывали с помощью микроскопа МикМед-3 ЛЮМ LED, оснащенного цифровой камерой Touptek Photonics FMA 050 (Китай) и персональным компьютером. На каждом препарате считали не менее 200 и измеряли не менее 50 клеток бактерий. Сырую биомассу бактерий вычисляли путем умножения их численности на средний объем клеток. Содержание углерода в бактериальных клетках (С, фг С/кл) рассчитывали с использованием аллометрического уравнения, наиболее подходящего для клеток, окрашенных акридиновым оранжевым: С = 120V 0.72 [34, 37].
Скорость роста и продукцию бактериопланктона (ПБ) определяли в “живых” пробах морской воды методом “разбавления” по изменению их численности в изолированных пробах воды, инкубируемых в течение 24–48 ч в инкубаторе при температуре in situ. Для устранения бактериотрофных организмов пробы морской воды разбавляли 1 : 10 морской водой, взятой из места отбора пробы и профильтрованной через мембранный фильтр с диаметром пор 0.20 мкм [15]. Эксперименты проводили в трехкратной повторности. Удельную скорость роста численности бактерий (μ, ч–1) вычисляли по формуле:
(3)
$\mu = {{({\text{ln}}{\kern 1pt} {{{\text{N}}}_{{\text{t}}}} - {\text{ln}}{\kern 1pt} {{{\text{N}}}_{{\text{o}}}})} \mathord{\left/ {\vphantom {{({\text{ln}}{\kern 1pt} {{{\text{N}}}_{{\text{t}}}} - {\text{ln}}{\kern 1pt} {{{\text{N}}}_{{\text{o}}}})} {{\text{t}},}}} \right. \kern-0em} {{\text{t}},}}$Интегрированные по глубине значения были рассчитаны по методу трапеции. Средневзвешенные значения параметров для водной толщи рассчитывали путем интегрирования значений по глубине и делением на значение глубины. Значения средних величин представлены с указанием стандартного отклонения (±SD).
РЕЗУЛЬТАТЫ
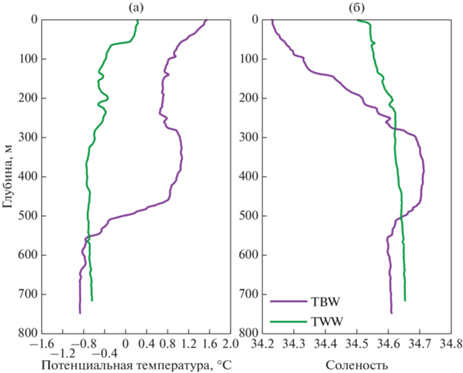
Гидрофизические и гидрохимические условия. Район исследований охватывал всю акваторию пролива Брансфилда (северный, центральный и южный сектора) и района восточнее пролива. Обе основные водные массы в проливе (TBW и TWW) хорошо просматриваются на профилях температуры и солености (рис. 2). Можно видеть, что в южной части пролива (зеленые кривые на рис. 2) воды более однородны по глубине, температура здесь колеблется от –0.7 до 0.3°С, соленость – от 34.50 до 34.65. Напротив, в зоне потока вод TBW наблюдается многослойная вертикальная структура. В то время как сверху мы видим сильно распресненный слой (соленость опускается до 34.2), на глубине от 300 до 500 метров явно прослеживается слой модифицированной циркумполярной воды с максимумом солености 34.71 и локальным максимумом температуры (1.1°С).
Рис. 2.
Термохалинная структура основных водных масс в проливе Брансфилда: TBW (фиолетовые линии) и TWW (зеленые линии).
По результатам анализа TS-графиков, основанных на CTD-данных, было определено положение станций относительно двух водных масс. Станции 7294, 7296 и 7308 находились в водной массе TWW. Станции 7356, 7297, 7310 и 7319 предположительно находились в зоне смешения водных масс TWW и TBW. Остальные станции находились в водной массе TBW.
Для оценки океанографических особенностей водных масс в пределах пролива, станции были сгруппированы в четыре субрегиона, при этом в каждой из двух водных масс отдельно рассматривались районы в восточной и средние частях пролива (разрезы 1 и 2, соответственно) (табл. 1). В районе TWW была самая низкая температура поверхности воды (0.03 ± 0.31°С) и более высокая соленость (34.54 ± 0.01). И наоборот, район TBW был связан с более высокой температурой воды (1.29 ± 0.28°С) и более низкой соленостью (34.32 ± ± 0.10). Ст. 7356, расположенная восточнее пролива, характеризовалась промежуточными значениями температуры и солености, отражая смешение двух водных масс.
Таблица 1.
Средние поверхностные значения и стандартные отклонения (в скобках) гидрофизических и гидрохимических параметров для четырех субрегионов
| Параметр | TBW-1 | TBW-2 | TWW-1 | TWW-2 | ст. 7356 |
|---|---|---|---|---|---|
| Температура, °С | 1.24 (0.26) | 1.35 (0.37) | 0.01 (0.23) | 0.06 (0.53) | 0.88 |
| Соленость | 34.35 (0.07) | 34.28 (0.17) | 34.55 (0.01) | 34.52 (0.01) | 34.41 |
| Нитраты, μМ | 27.63 (3.53) | 27.06 (0.85) | 27,15 (3,04) | 28.63 (2.78) | н/д |
| Фосфаты, μМ | 1.86 (0.08) | 1.77 (0.09) | 1.93 (0.03) | 1.92 (0.01) | н/д |
| Кремний, μМ | 75.22 (7.13) | 72.52 (3.04) | 72.40 (1.56) | 74.48 (8.84) | н/д |
| N : P | 14.8 (2.2) | 15.3 (0.6) | 14.0 (1.4) | 14.6 (1.5) | н/д |
Примечание. TBW-1 – модифицированная вода моря Беллинсгаузена в восточной части пролива (разрез 1), TBW-2 – модифицированная вода моря Беллинсгаузена в средней части пролива (разрез 2), TWW-1 – модифицированная вода моря Уэдделла в восточной части пролива (разрез 1), TWW-2 – модифицированная вода моря Уэдделла в средней части пролива (разрез 2).
В отличие от гидрофизических параметров, содержание основных биогенных элементов немного различалось не только в разных водных массах, но и в разных субрегионах в каждой из них (табл. 1). Средние поверхностные концентрации нитратов, фосфатов и кремния были высокими (>27, >1,7 и >72 μМ, соответственно) во всем районе исследований. Тем не менее, содержание фосфатов в TBW было ниже, чем в TWW (1.80 и 1.93 μМ, соответственно). Содержание кремния варьировало в пределах обоих водных масс, а содержание нитратов было выше в субрегионе TWW-2 (28.63 μМ) по сравнению с другими субрегионами (27.06–27.63 μМ).
Глубина эвфотического слоя в районе исследований варьировала от 61 до 93 м. Наиболее глубоким эвфотический слой был в глубоководной области северо-восточной части района на станциях 7356 и 7301, наименьшим – в прибрежной области этой же части района на станциях 7305 и 7314.
Распределение хлорофилла “а”. Концентрация хл “а” на разных глубинах эвфотического слоя варьировала от 0.11 до 1.41 мг/м3 (в среднем 0.65 ± ± 0.30 мг/м3). Значения поверхностных концентраций хл “а”изменялись в пределах от 0.39 до 1.41 мг/м3. Максимальные значения были на поверхности на ст. 7356 и 7316 (1.41 и 1.28 мг/м3, соответственно). Хлорофильный максимум наблюдался на поверхности на 9 станциях и в слое 25–50 м – на 6 станциях (табл. 2).
Таблица 2.
Распределение хлорофилла “а” в проливе Брансфилда
| Станции | Хло | Хлэв | Хлинт | Хлмакс/Хлср | ГХМ | Ф, % |
|---|---|---|---|---|---|---|
| Разрез 1 | ||||||
| 7294 | 0.655 | 55 | 67 | 1.16 | 25 | 24 |
| 7296 | 0.783 | 48 | 52 | 1.52 | 0 | 23 |
| 7297 | 0.965 | 63 | 66 | 1.61 | 25 | 19 |
| 7299 | 0.731 | 39 | 49 | 1.56 | 0 | 24 |
| 7301 | 0.394 | 22 | 23 | 1.77 | 0 | 42 |
| 7305 | 0.687 | 36 | 54 | 1.25 | 0 | 34 |
| 7306 | 0.398 | 20 | 37 | 1.88 | 0 | 34 |
| Разрез 2 | ||||||
| 7308 | 0.750 | 61 | 105 | 1.17 | 27 | 24 |
| 7310 | 0.504 | 26 | 33 | 2.13 | 0 | 45 |
| 7311 | 0.687 | 35 | 59 | 1.45 | 0 | 41 |
| 7314 | 0.861 | 57 | 57 | 1.23 | 35 | 35 |
| 7316 | 1.281 | 53 | 62 | 1.98 | 0 | 29 |
| Разрез 3 | ||||||
| 7319 | 0.635 | 25 | 35 | 2.12 | 0 | 41 |
| 7320 | 0.632 | 51 | 59 | 1.78 | 40 | 31 |
| 7323 | 0.679 | 20 | 58 | 1.70 | 50 | 34 |
| Район восточнее пролива | ||||||
| 7356 | 1.409 | 46 | 71 | 2.83 | 0 | 32 |
Примечание. Хлo – концентрация хл “а” на поверхности, мг/м3; Хлэв – содержание хл “а” в эвфотическом слое, мг/м2; Хлинт – общее содержание хл “а” в водном столбе, мг/м2; Хлмакс/Хлср – степень выраженности хлорофильного максимума, ГХМ – глубина хлорофильного максимума, м; Ф – средняя для эвфотического слоя доля феофитина в суммарном количестве хл “а” и феофитина, %.
Доля хл “а”, сосредоточенного в слое максимума, от общего содержания этого пигмента в водной толще существенно варьирует на разных станциях. Для количественной характеристики выраженности пика концентрации хлорофилла использовалось отношение величин концентрации хл “а” в слое максимума и средней концентраций для столба воды на конкретной станции (Хлмакс/Хлср). В районе исследований это отношение варьировало от 1.16 до 2.83. Наиболее выраженным хлорофильный максимум был на ст. 7356, где поверхностное содержание хл “а” превышало среднее для столба значение почти в три раза. На станциях, расположенных в проливе, эта величина была максимальной (более чем в два раза) на ст. 7310 и 7319. Отсутствие выраженного хлорофильного максимума, т.е. равномерное распределение хл “а” по вертикали наблюдалось на ст. 7294 и 7308.
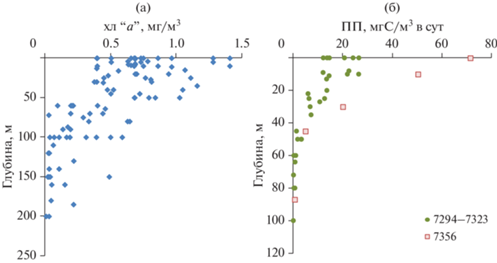
Вертикальное распределение значений концентрации хл “а” на всех рассматриваемых станциях показано на рис. 3а. Максимальные наблюдаемые значения для конкретных слоев водной толщи постепенно снижаются с глубиной. Как видно из рисунка, в верхнем 50-м слое максимальные среди всех станций значения концентрации хл “а” достигали более чем 1 мг/м3. Минимальные, в свою очередь, не опускались ниже 0.40 мг/м3. В слое 50–100 м концентрация хл “а” варьировала от крайне низких значений (0.025 мг/м3) до умеренных (0.62 мг/м3). Ниже 100 м эта величина варьировала от 0.01 до 0.21 мг/м3.
Рис. 3.
Вертикальное распределение параметров первичной продуктивности: (а) хлорофилл “а”, (б) первичная продукция.
Концентрация хл “а” на поверхности для большинства станций в проливе Брансфилда согласуется с его интегральным содержанием в столбе воды 0–200 м (рис. 4). Отклонения от этой зависимости наблюдаются только на трех станциях. На ст. 7308 при умеренной концентрации хл “а” на поверхности интегральная величина почти в два раза выше, чем на других станциях, что связано с высоким содержанием хл “а” вплоть до глубины 185 м (0.22 мг/м3). На ст. 7316 и 7356 наоборот, при высоких поверхностных значениях концентрация хл “а” резко уменьшалась на глубинах более 30 м.
Рис. 4.
Соотношение между поверхностной концентрацией хл “а” и его интегральными значениями для водной толщи. Отдельно обозначены станции, соотношение для которых отклоняется от общей зависимости (объяснения см. в тексте).
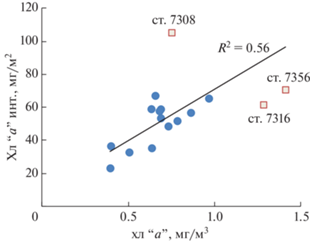
Интегральное содержание хл “а” в столбе воды различалось на разных станциях более чем в шесть раз, варьируя от 23 до 105 мг/м2 (табл. 1), составляя в среднем 55 ± 19 мг/м2. Максимальное величина интегрального по глубине содержания хл “а” (150 мг/м2) было определено на ст. 7308 в южной части разреза 1 на шельфе Антарктического полуострова. Минимальные величины (менее 40 мг/м2) наблюдались в центральной глубоководной части пролива (ст. 7301, 7306, 7310 и 7319). Доля хл “а” в эвфотическом слое (относительно всей водной толщи) варьировала от 35 до 100%, составляя в среднем 75 ± 18%. В наибольшей степени сконцентрированность хл “а” в эвфотическом слое (более 80% от суммарного содержания в столбе воды) была в южной и центральной части разреза 1 (ст. 7294–7301), в северной части разреза 2 (ст. 7314, 7316) и в центре разреза 3 (ст. 7320).
Доля феофитина (неактивной части хл “а”) в общей сумме хл “а” и феофитина в проливе Брансфилда на разных глубинах эвфотического слоя изменялась от 15 до 55%. Средняя величина этого показателя в эвфотическом слое варьировала между станциями от 19 до 45%. Значения доли феофитина, не превышающие 25% (что свидетельствует об активном состоянии хл “а”), были приурочены к станциям на шельфе Антарктического полуострова (ст. 7394–7399, 7308) в зоне модифицированной воды моря Уэдделла.
Первичная продукция. Основная часть ПП (60–84%) в районе исследований была сосредоточена в верхнем 25-м слое водной толщи. График распределения значений скорости ПП по вертикали на разных станциях, представленный на рис. 3б, показывает, что наиболее высокие значения для акватории пролива (более 14 мг С/м3 в сут) были определены в верхнем 10-м слое. В слое 10–35 м значения ПП варьировали от 6.5 до 13.7 мг С/м3 в сут, а в слое глубже 35 м – не превышали 1 мг С/м3 в сут. На ст. 7356 (восточнее пролива) значения ПП в верхнем 30-м слое в несколько раз превышали уровень ПП в проливе (см. рис. 3б). Различие на поверхности достигало почти 3-х кратного значения.
Уровень интегральной продуктивности на разрезе 1 был ниже, чем на разрезе 2 (503 ± 66 и 709 ± ± 45 мг С/м2 в сут, соответственно) (табл. 3). На ст. 7356 интегральная ПП была на уровне 1618 мг С/м2 в сут.
Таблица 3.
Продукционные характеристики фитопланктона в проливе Брансфилда
| Станции | ППо | ППинт | АЧмакс | АЧср | ФС |
|---|---|---|---|---|---|
| Разрез 1 | |||||
| 7294 | 12.2 | 435 | 1.10 | 0.60 | 80 |
| 7297 | 14.7 | 594 | 0.89 | 0.62 | 72 |
| 7301 | 13.8 | 497 | 2.05 | 1.20 | 93 |
| 7305 | 24.2 | 487 | 2.07 | 0.98 | 61 |
| Разрез 2 | |||||
| 7308 | 20.7 | 677 | 1.72 | 0.87 | 70 |
| 7314 | 26.6 | 741 | 1.81 | 0.99 | 63 |
| Район восточнее пролива | |||||
| 7356 | 71.4 | 1618 | 2.98 | 1.47 | 90 |
Примечание. ППо – первичная продукция на поверхности, мг С/м3 в сут; ППинт – интегральная первичная продукция, мг С/м2 в сут, АЧмакс – максимальное ассимиляционное число для столба воды, мг С/мг Хл в час; АЧср – среднее для эвфотического слоя ассимиляционное число, мг С/мг Хл в час; ФС – глубина эвфотического слоя, м.
Максимальные для столба воды значения ассимиляционного числа (АЧмакс), характеризующего удельную фотосинтетическую активность фитопланктона, варьировали на разных станциях от 0.89 до 2.98 мг С/мг Хл в час (в среднем, 1.80 ± ± 0.69 мг С/мг Хл в час) и были приурочены к поверхностному горизонту. Наиболее высокие значения (более 2 мг С/мг Хл в час) были установлены в районе восточнее пролива (ст. 7356) и в северной части разреза 1 (ст. 7301 и 7305). Наиболее низкое значение АЧ было на ст. 7297.
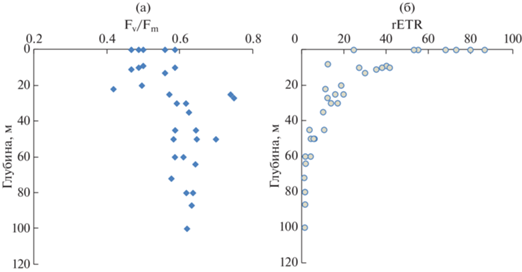
Квантовый выход фотосистемы II фитопланктона (Fv/Fm), который характеризует потенциальную фотосинтетическую способность фитопланктона, был на высоком уровне в пределах эвфотического слоя (0.418–0.749). Зона максимальных величин Fv/Fm (0.571–739) располагалась в слое 25–100 м, тогда как в верхнем 25-м слое значения были существенно ниже (0.418–0.587 о.е.) (рис. 5а). Значения rETR в пределах эвфотического слоя изменялись в пределах 1.05–86.5 о.е., закономерно уменьшаясь с глубиной по мере ослабления проникающего света (рис. 5б).
Рис. 5.
Вертикальное распределение значений потенциальной фотосинтетической способности фитопланктона (Fv/Fm) (а) и относительно скорости электронного транспорта (rETR) (б).
Численность, биомасса и продукция бактериопланктона. Численность бактериопланктона (ЧБ) в пределах 100-м слоя исследованных станций варьировала от 80 до 690 тыс. кл/мл, при среднем значении 300 ± 135 тыс. кл/мл. Максимальные значения ЧБ отмечались в прибрежной зоне на ст. 7314 – среднее 538 ± 108 тыс. кл/мл, минимальные – на ст. 7301 (среднее 206 ± 60 тыс. кл/мл). Биомасса бактерий (ББ) в пределах 100-м слоя варьировала от 1.10 до 9.10 мг С/м3 (в среднем, 3.61 ± 1.86 мг С/м3). При этом средние значения для конкретных станций на разрезе 1 были близки, а на разрезе 2 – существенно различались (табл. 4). Максимальный уровень биомассы был в северной части пролива в прибрежной зоне Южных Шетландских островов (ст. 7314). Распределение ББ по глубине в пределах 100-м слоя на каждой станции имело свои особенности, но в целом характеризовалось более высокими значениями в верхнем слое (глубиной от 30 до 80 м) и снижением в глубоководной зоне. Исходя из отношения биомассы к численности, можно сказать, что средний размер клеток бактерий варьировал незначительно, с небольшим максимумом на ст. 7314.
Таблица 4.
Средние значения численности (ЧБ, тыс. кл/мл) и биомассы бактерий (ББ, мг С/м3), отношения биомассы к численности бактерий (ББ/ЧБ, нг/млн кл), удельной скорости роста (УдББ, мг С/м3 в час) и продукции бактерий (ПБ, мг С/м3 в час) в слое 0–100 м на станциях в проливе Брансфилда
| Станции | ЧБ | ББ | ББ/ЧБ | УдББ | ПБ |
|---|---|---|---|---|---|
| Разрез 1 | |||||
| 7294 | 270 | 3.32 | 12.3 | 0.026 | 2.18 |
| 7301 | 230 | 2.90 | 12.5 | 0.015 | 1.12 |
| 7305 | 380 | 3.85 | 10.1 | 0.020 | 1.85 |
| Разрез 2 | |||||
| 7308 | 217 | 2.30 | 10.5 | 0.043 | 2.28 |
| 7314 | 538 | 7.30 | 13.7 | 0.017 | 3.18 |
| Район восточнее пролива | |||||
| 7356 | 258 | 2.98 | 11.7 | 0.090 | 6.50 |
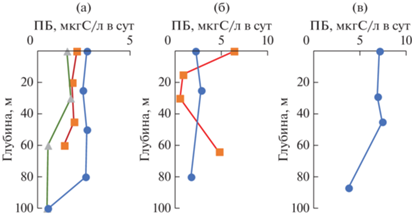
Значения ПБ (средние для слоя 0–100 м) значительно различались в пределах района исследований (табл. 4). Наиболее высокие средние значения ПБ был на ст. 7356 и 7314. На станциях разреза 1 общий уровень ПБ был ниже, чем на остальных станциях. Почти на всех станциях в верхнем слое (глубиной от 30 до 80 м) значения ПБ были выше, чем в более глубоком слое (рис. 6). По характеру вертикального распределения ПБ ст. 7314 значительно отличалась от остальных станций резким снижением значений в слое 15–30 м и существенным увеличением на горизонте 64 м.
ОБСУЖДЕНИЕ
Распределение хлорофилла “а” (интегральные по глубине в слое 0–100 м величины) в проливе Брансфилда варьировало в широких пределах 23–105 мг/м2 и было сопоставимо с результатами предыдущих исследований [38, 42]. Многолетние результаты исследований распределения хл “а” в проливе Брансфилда показывают, что в большинстве случаев в летний период наблюдается более высокая его концентрация в северной части пролива (в водной массе TBW) [21, 24, 30, 38]. Однако в период наших исследований подобная зональность в распределении хл “а” была не очевидной. Поверхностные значения хл “а” на разрезе 1 были выше в TBW (в среднем 0.78 ± 0.13 мг/м3) по сравнению с TWW (среднем 0.49 ± 0.16 мг/м3), однако на разрезе 2 картина была иной – высокие значения в южной части разреза и более низкие в северной (0.62 ± 0.17 и 0.94 ± 0.31 мг/м3, соответственно) (табл. 2).
Полученные нами величины ППинт на станциях в проливе Брансфилда варьировали в пределах 435–741 мгС/м2 в сут и также были сопоставимы с результатами предыдущих исследований в этом районе Антарктики [2, 8, 38, 44]. В пределах каждого из разрезов (пересекавших обе водные массы) вариация значений ППинт не была связана с водными массами, но между разрезами различия были заметными (503 ± 66 и 709 ± 45 мг С/м2 в сут, на разрезах 1 и 2 соответственно). Ранее описанные величины ПП в летний период составляли 117–206 мгС/м2 в сут в восточной его части [2] и 800 мгС/м2 в сут в западной части пролива [44]. Отдельно следует отметить ст. 7356, где наблюдалась высокая первичная продуктивность, определяемая высокими значениями ПП (в 2–4 раз выше, чем на станциях в проливе) и концентрации поверхностного хл “а” (в 1.5–3.5 раза выше). Различия в содержании биогенных элементов в четырех субрегионах не определяли вариабельность ПП, т.к. их концентрация была выше лимитирующего фотосинтез уровня.
Величина Fv/Fm, отражающая потенциальную фотосинтетическую способность фитопланктона (можно сказать, “здоровье” фитопланктона), была на высоком уровне на всех станциях в слое 0–150 м. Небольшое увеличение потенциала наблюдали на станциях 7294 и 7308 (шельфовая зона в районе водной массы TWW). На этих же станциях доля феофитина была минимальной (не более 25%). Показатель доли феофитина от общей суммы хлорофилла и феофитина можно использовать в качестве первичной оценки активности хл “а”. Ранее в работе [5] для арктических морей было показано, что доля феофитина менее 40% соответствует активному состоянию хлорофилла с высоким продукционным потенциалом.
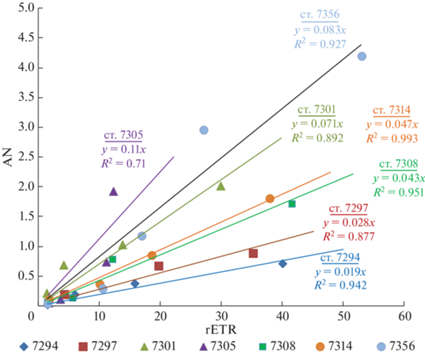
Между параметрами продуктивности – rETR и АЧ – наблюдалась сильная положительная корреляция (r = 0.63, n = 35, P = 0.05). Их можно рассматривать как величины, отражающие интенсивность двух основных этапов фотосинтеза – световых и темновых стадий соответственно. Линейная корреляция между rETR и валовой фиксацией углерода и/или продукцией О2 была установлена в различных регионах Мирового океана [28, 29, 41]. В нашем исследовании для проб с разных горизонтов на конкретных станциях связь была еще более сильная (рис. 7). Коэффициент а в уравнениях регрессии может служить показателем эффективности использования энергии, запасенной в реакционных центрах фотосистемы и выражаемой как rETR, в процессе синтеза органического вещества на темновой стадии. Очевидно, что эта эффективность на разных станциях в той или иной степени различается. Наиболее высокие показатели (0.07–0.11) были на ст. 7356 восточнее пролива, где также высокими были значения ПП и содержания хл “а”, и на станциях 7301 и 7305 в северной части разреза 1. Станции 7308 и 7314 на разрезе 2 находились в разных водных массах (TWW и TBW, соответственно), однако показатели эффективности здесь были почти одинаковые (0.043 и 0.047). Минимальные значения данного показателя (0.019–0.028) были на станциях 7294 и 7297 в южной части разреза 1 (водная масса TWW). Определенная связь между показателем эффективности использования энергии света в фотосинтезе и водными массами была установлена только в восточной части пролива Брансфилда (разрез 1), тогда как в средней части (разрез 2) такой связи не было.
Рис. 7.
Соотношение между первичной продукцией (АЧ) и относительной скоростью электронного транспорта в фотосистеме 2 (rETR) на конкретных станциях района исследований.
Аналогично распределению ПП, интегральные значения ПБ на ст. 7356 были выше более чем в два раза по сравнению с другими станциями. Водные массы пролива (TWW и TBW) по этому показателю также существенно не различались.
Полученные нами значения ПБ в целом согласуются со значениями, полученными ранее в этом же или близлежащих районах исследований [8, 27, 32, 42]. Следует отметить, что указанные авторы определяли бактериальную продукцию с помощью изотопных методов. Применялись: либо 3H-тимидин [8, 17] либо 3H-лейцин [32, 42]. Изотопные методы имеют ряд преимуществ: короткое время экспозиции пробы, отсутствие предварительной фильтрации пробы и связанного с этим возможного повреждения бактериальных клеток c обогащением пробы легкоокисляемым органическим веществом. В тоже время их существенным недостатком является большое количество допущений при пересчетах на продукцию бактериопланктона [17]. Метод “разбавления проб” более трудоемок, возникают опасения “скляночных эффектов” при длительной экспозиции пробы, а также разрушения клеток во время фильтрации пробы. Однако, в работах [15, 17] показано, что результаты определения БП, полученные методом “разбавления проб”, вполне сопоставимы с результатами изотопных методов.
Чистая ПП включает образование взвешенного органического вещества и растворенных продуктов фотосинтеза (РОВ), которые выделяются клетками фитопланктона. РОВ является количественно важным и легко усваиваемым источником лабильного и полулабильного органического вещества для гетеротрофного морского бактериопланктона [35]. Кроме того, благодаря ПБ растворенные продукты фотосинтеза, не используемые большинством гидробионтов, возвращаются в пищевую цепь (т.н. микробная петля [3, 11]). Учитывая различное качество фитопланктона и бактерий как пищевых ресурсов, изменение соотношения ПП и ПБ может характеризовать изменение эффективности пищевых трофических цепей и общей продуктивности планктонного сообщества [33, 35]. Кроме того, для верхних освещенных слоев водной толщи увеличение доли ПБ в общей продукции вероятно отражает сукцессионные изменения в микропланктоном сообществе. Пик активности бактерий во многих случаях следует за пиком активности фитопланктона, что может быть связано с ограничениями в скорости потребления РОВ, выделяемых фитопланктоном в большом количестве в активный период [35].
Общая интегральная продукция фито- и бактериопланктона в эвфотическом слое на ст. 7356 была в 3.5 и 2.5 раза выше, чем на станциях разреза 1 и 2, соответственно (рис. 8а). Доля ПП в общей интегральной продукции составляла 74%. На станциях разреза 1 и 2 доля ПП была выше (в среднем, 82 и 80%, соответственно). При этом следует отметить, что на обоих разрезах, пересекавших две водные массы различного генезиса и гидрофизических характеристик (TWW и TBW), различий между северными и южными станциями не обнаружено. Однако были небольшие различия в значениях общей продукции и доли ПП между разрезами (рис. 8).
Рис. 8.
Интегральные величины первичной и бактериальной продукции (а) и вертикальное распределение доли первичной продукции в общей продукции (б) в проливе Брансфилда.
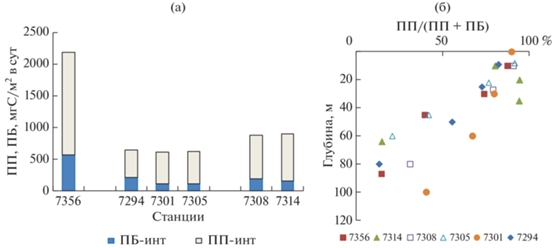
Рассчитанная для конкретных горизонтов доля ПП в общей продукции района в верхнем 10-м слое составляла 82–91% и равномерно снижалась в пределах эвфотического слоя до 15–31% на всех станциях района (рис. 8б). В верхнем 20-м слое, где формировалась основная часть ПП, баланс между автотрофной (фитопланктон) и гетеротрофной (бактерии) продукцией на разных станциях практически не различался при высокой доле ПП. Доминирование автотрофной продукции на всей исследованной акватории определяет равно высокую эффективность пищевой цепи в проливе Брансфилда в этот период, несмотря на присутствие двух разных водных масс. Очевидно также, что микропланктонное сообщество в разных зонах пролива Брансфилда находится на сукцессионной стадии активного накопления органического вещества.
ЗАКЛЮЧЕНИЕ
Верхний слой водной толщи в проливе Брансфилда представлен двумя основными водными массами, различающимися по генезису и гидрофизическим характеристикам. Однако в период наших исследований для продукционных параметров в этих водных массах не было установлено значимых различий между северной и южной частями пролива. С другой стороны, в западной части пролива в обеих водных массах интегральная первичная продукция была в полтора раза выше, чем в восточной. Но максимальной интегральная ПП была на ст. 7356 в районе восточнее пролива.
Установлена тесная связь между параметрами первичной продукции – rETR и AЧ – отражающими соответственно интенсивности световой и темновой стадий фотосинтеза на конкретных станциях. Станции, сгруппированные по показателю эффективности использования энергии при синтезе органического вещества (коэффициент а в уравнении регрессии или отношение АЧ/rETR), были приурочены к четырем выделенным субрегионам. Наиболее высокий показатель был на ст. 7356 восточнее пролива, где также высокими были значения ПП и содержания хл “а”.
Аналогично распределению ПП, интегральные значения ПБ на ст. 7356 были выше более чем в два раза по сравнению с другими станциями. Водные массы пролива (TWW и TBW) по этому показателю существенно не различались. Общая интегральная продукция фито- и бактериопланктона в эвфотическом слое на ст. 7356 была в 3.5 и 2.5 раза выше, чем в восточной и западной частях пролива, соответственно. Доля ПП в общей продукции района в верхнем 10-м слое составляла 82–91%.
Источники финансирования. Работа выполнена в рамках госзадания FMWE-2021-0016 (ИО РАН). Обработка CTD данных и анализ термохалинной структуры выполнены при поддержке гранта РНФ 22-77-10 004. Гидрооптические измерения и расчет подводной освещенности выполнены в рамках госзадания FNNN-2021-0003 (МГИ РАН).
Список литературы
Бордовский О.К., Чернякова А.М. Современные методы гидрохимических исследований океана. М.: ИО РАН, 1992. 200 с.
Воробьева О.В., Романова Н.Д., Мошаров С.А. и др. Продукционные характеристики фитопланктона пролива Брансфилд в летний период // Труды ВНИРО. 2020. Т. 181. С. 178–186.
Копылов А.И., Косолапов Д.Б. Микробная петля в планктонных сообществах морских и пресноводных экосистем. Ижевск: КнигоГрад., 2011. 332 с.
Мошаров С.А., Гонтарев С.В., Корсак М.Н. Новый фитоинкубатор с регулировкой температуры и освещенности для определения первичной продукции // Безопасность в техносфере. 2015. № 4. С. 3–9.
Мошаров С.А., Сергеева В.М. Оценка функционального состояния морского фитопланктона по флуоресцентным показателям и соотношению концентраций феофитина и хлорофилла а // Вопросы современной альгологии. 2018. С. 10.
РД 52.24.380-2006 “Массовая концентрация нитратов в водах. Методика выполнения измерений фотометрическим методом после восстановления в кадмиевом редукторе”.
РД 52.24.382-2006 “Массовая концентрация фосфатов и полифосфатов в водах. Методика выполнения измерений фотометрическим методом”.
Серегин С.А., Чмыр В.Д., Кузьменко Л.В. Микропланктон западной части пролива Брансфилда: первичная и бактериальная продукция // Морской экологический журнал. 2006. Т. 5. № 4. С. 73–84
Alderkamp A.-C., Garcon V., de Baar H.J.W., Arrigo K.R. Short-term photoacclimation effects on photoinhibition of phytoplankton in the Drake Passage (Southern Ocean) // Deep Sea Research Part I: Oceanographic Research Papers. 2011. V 58. P. 943–955. https://doi.org/10.1016/j.dsr.2011.07.001
Alderkamp A.-C., Kulk G., Buma A.G.J. et al. The effect of iron limitation on the photophysiology of Phaeocystis antarctica (Prymnesiophyceae) and Fragilariopsis cylindrus (Bacillariophyceae) under dynamic irradiance: photophysiology under iron limitation // Journal of Phycology. 2012. V. 48. P. 45–59. https://doi.org/10.1111/j.1529-8817.2011.01098.x
Azam F., Fenchel T., Field J.G. et al. The ecological role of water-column microbes in the sea // Mar Ecol Prog Ser. 1983. V. 10. P. 257–263. https://doi.org/10.3354/meps010257
Behrenfeld M.J., Bale A.J., Kolber Z.S. et al. 1996. Confirmation of iron limitation of phytoplankton photosynthesis in the equatorial Pacific Ocean // Nature. 1997. V. 383. P. 508–511. https://doi.org/10.1038/383508a0
Boyd P.W., Strzepek R., Fu F. et al. Environmental control of open-ocean phytoplankton groups: Now and in the future // Limnol. Oceanogr. 2010. V. 55. P. 1353–1376. https://doi.org/10.4319/lo.2010.55.3.1353
Clowes A.J. Hydrology of the Bransfield Strait // Discovery Reports. 1934. V.9. P. 1–64.
Ducklow H.W., Hill S.M. The growth of heterotrophic bacteria in the surface waters of warm core rings // Limnol. Oceanogr. 1985. V. 30. № 2. P. 239–259. https://doi.org/10.4319/lo.1985.30.2.0239
Frey D.I., Krechik V.A., Morozov E.G. et al. Water exchange between deep basins of the Bransfield Strait // Water MDPI. 2022. Vol. 14. P. 3193. https://doi.org/10.3390/w14203193
Fuhrman J.A., Azam F. Bacterioplankton secondary production estimates for coastal waters of British Columbia, Antarctica, and California // Appl. Environ. Microbiol. 1980. V. 39. № 6. P.1086–1095. https://doi.org/10.1128/AEM.39.6.1085-1095.1980
Galbraith E.D., Gnanadesikan A., Dunne J.P. et al. Regional impacts of iron-light colimitation in a global biogeochemical model // Biogeosciences. 2010. V. 7. P. 1043–1064. https://doi.org/0.5194/bg-7-1043-2010
García M.A., López O., Sospedra J. et al. Mesoscale variability in the Bransfield Strait region (Antarctica) during Austral summer // Annales Geophysicae. 1994. V. 12. No. 9. P. 856–867. https://doi.org/10.1007/s00585-994-0856-z
Genty B., Briantais J.-M., Baker N.R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence // Biochim. Biophys. Acta. 1989. V. 990. P. 87–92.
Gonçalves-Araujo, R., de Souza, M.S., Tavano, V.M. et al. Influence of oceanographic features on spatial and interannual variability of phytoplankton in the Bransfield Strait, Antarctica // J. Mar. Syst. 2015. V. 142. P. 1–15.
Hobbie L.E., Daley R.I. Use of nucleopore filters for counting bacteria by fluorescence microscopy // Appl. and Environ. Microbiol. 1977. V. 33(5). P. 1225–1228. https://doi.org/10.1128/AEM.33.5.1225-1228.1977
Holm-Hansen O., Riemann B. Chlorophyll a determination: improvements in methodology // Oikos. 1978. V. 30. P. 438–447.
Holm-Hansen O., Naganobu N., Kawaguchi S. et al. Factors influencing the distribution, biomass, and productivity of phytoplankton in the Scotia Sea and adjoining waters // Deep-Sea Res. II. 2004. V. 51. P. 1333–1350.
JGOFS (Joint Global Ocean Flux Study Protocols), 1994. Protocols for the Joint Global Ocean Flux Study Protocols (JGOFS) Core Measurements. UNESCO, Paris, pp. 119–122.
Khimchenko E.E., Frey D.I., Morozov E.G. Tidal internal waves in the Bransfield Strait, Antarctica // Russian Journal of Earth Sciences, 2020. V. 20. ES2006. https://doi.org/10.2205/2020ES000711
Kogure K., Fukami K., Simidu U., Taga N. Abundance and production of bacterioplankton in the Antarctic // Mem. Natl. Inst. Polar Res. Spec. Issue. 1986. V. 40. P. 414–422.
Kromkamp J.C., Dijkman N.A., Peene J. et al. Estimating phytoplankton primary production in Lake IJsselmeer (The Netherlands) using variable fluorescence (PAM-FRRF) and C uptake techniques // Eur. J. Phycol. 2008. V. 43. P. 327–344.
Lawrenz E., Silsbe G., Capuzzo E. et al. Predicting the electron requirement for carbon fixation in seas and oceans // PLoS One. 2013. V. 8(3). e58137. https://doi.org/10.1371/journal.pone.0058137
Mendes C.R.B., de Souza M.S., Tavano V.M. et al. Dynamics of phytoplankton communities during late summer around the tip of the Antarctic Peninsula // Deep-Sea Res. I. 2012. V. 65. P. 1–14.
Meon B., Amon R.M.W. Heterotrophic bacterial activity and fluxes of dissolved free amino and glucose in the Arctic rivers Ob, Yenisei and the adjacent Kara Sea // Aquatic Microbial Ecology. 2004. V. 37. P. 121–135. https://doi.org/10.3354/ame037121
Morán X.A.G, Gasol J.M., Pedrós-Alió C. et al. Dissolved and particulate primary production and bacterial production in offshore Antarctic waters during austral summer: coupled or uncoupled? // Mar. Ecol. Prog. Ser. 2001. V. 222. P. 25–39.
Morozov E.G., Flint M.V., Orlov A.M. et al. Oceanographic and Ecosystem Studies in the Atlantic Sector of Antarctica (Cruise 87 of the Research Vessel Akademik Mstislav Keldysh) // Oceanology. 2022. V. 62. No. 5. P. 721–723.
Norland S. The relationship between biomass and volume of bacteria. In: Kemp P. F., Cole J.J., Sherr B.F., Sherr E.B. (Eds.), Handbook of Methods in Aquatic Microbial Ecology. Lewis Publ, Boca Raton, 1993. P. 303–308. https://doi.org/10.1201/9780203752746-36
Piontek J., Endres S., Le Moigne F.A.C. et al. Relevance of nutrient-limited phytoplankton production and its bacterial remineralization for carbon and oxygen fluxes in the Baltic Sea // Frontiers in Marine Science. 2019. V. 6. Article 581.
Porter K.G., Feig Y.S. The use DAPI for identifying and counting of aquatic microflora // Limnol. Oceanogr. 1980. V. 25. № 5. P. 943−948.
Posch T., Loferer-Krӧßbacher M., Gao G. et al. Precision of bacterioplankton biomass determination: a comparison of two fluorescent dyes, and of allometric and linear volume-to carbon conversion factors // Aquat. Microb. Ecol. 2001. V. 25. P. 55–63. https://doi.org/10.3354/AME025055
Russo A.D.P.G., de Souza M.S., Mendes C.R.B. et al. Spatial variability of photophysiology and primary production rates of the phytoplankton communities across the western Antarctic Peninsula in late summer 2013 // Deep-Sea Res. Part II. 2018. V. 149. P. 99–110. https://doi.org/10.1016/j.dsr2.2017.09.021
Sangrà P., Gordo C., Hernández-Arencibia M. et al. The Bransfield Current system. Deep-Sea Res. I. 2011. V. 58. No. 4. P. 390–402. https://doi.org/10.1016/j.dsr.2011.01.011
Steemann-Nielsen E. The use of radio-active carbon (C14) for measuring organic production in the sea // Journal du Conseil/Conseil Permanent International pour l’Exploration de la Mer. 1952. V. 18. P. 117–140.
Suggett D.J., MacIntyre H.L., Kana T.M. et al. Comparing electron transport with gas exchange: parameterising exchange rates between alternative photosynthetic currencies for eukaryotic phytoplankton // Aquat. Microb. Ecol. 2009. V. 56. P. 147–162. https://doi.org/10.3354/ame01303
Teira E., Mourino-Carballido B., Martinez-Garcia S. et al. Primary production and bacterial carbon metabolism around South Shetland Island in the Southern Ocean // Deep-Sea Res I. 2012. V. 69. P. 70–81. https://doi.org/10.1016/j.dsr.2012.07.002
Tokarczyk R. Classification of water masses in the Bransfield Strait and Southern part of the Drake Passage using a method of statistical multidimensional analysis // Polish Polar Research. 1987. V. 8. P. 333–336.
Valera M., Fernandes E., Serret P. Size-fractionated phytoplankton biomass and primary production in the Gerlache and south Bransfield Straits (Antarctic Peninsula) in Austral summer 1995–1996 // Deep-Sea Res. II. 2002. V. 49. P. 749–768.
Zhou M., Niiler P.P., Hu J.-H. Surface currents in the Bransfield and Gerlache Straits, Antarctica // Deep Sea Res. I. 2002. V. 49. No. 2. P. 267–280. https://doi.org/10.1016/S0967-0637(01)00062-0
Zhou X., Zhu G., Hu S. Influence of tides on mass transport in the Bransfield Strait and the adjacent areas, Antarctic // Polar Science. 2020. V. 23. 100506. https://doi.org/10.1016/j.polar.2020.100506
Дополнительные материалы отсутствуют.