Журнал общей биологии, 2023, T. 84, № 4, стр. 313-326
Влияние выжигания ветоши на альпийские пестроовсяницевые луга Северо-Западного Кавказа
В. Г. Онипченко 1, 2, 3, *, Ф. С. Бостанова 2, О. А. Токарева 4, М. И. Макаров 1, Т. Г. Елумеева 1, А. А. Ахметжанова 1, Д. К. Текеев 3, Т. И. Малышева 1, М. С. Кадулин 1
1 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Ленинские горы, 1/12, Россия
2 Карачаево-Черкесский государственный университет им. У.Д. Алиева
369202 Карачаевск, ул. Ленина, 29, Россия
3 Тебердинский национальный парк
369210 Теберда, Бадукский пер., 1, Россия
4 Институт географии РАН
119017 Москва, Старомонетный пер., 29, Россия
* E-mail: vonipchenko@mail.ru
Поступила в редакцию 06.03.2023
После доработки 22.04.2023
Принята к публикации 01.08.2023
- EDN: EENOSQ
- DOI: 10.31857/S004445962304005X
Аннотация
Пожары играют большую роль в формировании и функционировании наземных экосистем, но их длительное влияние на состав и структуру растительных сообществ гумидных высокогорий практически не изучено. На наиболее сухих альпийских лугах с доминированием плотнодерновинного злака Festuca varia, накапливающих значительное количество неразложившейся ветоши, проведен 23-летний эксперимент с регулярным (раз в 2 года) выжиганием ветоши. Состав растительного сообщества существенно изменился. Значительно уменьшились запасы мортмассы (ветоши), надземная биомасса сосудистых растений и относительное участие доминантов. В надземной биомассе резко снизилась доля злаков и увеличилась доля разнотравья. Для Anthemis cretica, Campanula collina, Deschampsia flexuosa, Festuca ovina, Nardus stricta и Veronica gentianoides отмечено значимое увеличение числа побегов при выжигании. Отмечено двукратное повышение альфа-разнообразия сосудистых растений на выжигаемых площадках по сравнению с исходным состоянием и значительное превышение в сравнении с контролем. Длительное выжигание существенно не изменило среднее содержание P, Ca, Mg в надземной биомассе большинства изученных видов, лишь содержание K снижалось у ряда видов, в то время как для Mg отмечено увеличение содержания у Festuca varia и Nardus stricta. Отмечено увеличение содержания P и Mg в мортмассе. При длительном выжигании отмечается небольшое подкисление почвы и снижение содержания Са, а также существенное снижение содержания азота и интенсивности процессов его трансформации. В целом, полученные закономерности сходны с таковыми, полученными при изучении пожаров в других травяных сообществах, однако снижение содержания K при хроническом выжигании ранее не отмечалось.
Пожары являются важным экологическим фактором, оказывающим огромное влияние на состав, структуру, функционирование и динамику экосистем на всех континентах, кроме Антарктиды (Bond, Wilgen, 1996; Bond et al., 2005). Хорошо изучены пожары в лесных сообществах (напр., Peet, 1992; Gibson et al., 2016), но существенно меньше известно о влиянии палов на сообщества холодных биомов – тундр и высокогорий. Пожары в тундре были редким явлением до голоцена, но затем их частота увеличилась, особенно в последние 2000 лет (Higuera et al., 2011). Они могут охватывать большие площади, например, в экстремально сухой год один из наиболее сильных пожаров на Аляске продолжался около трех месяцев, в результате выгорело более 100 000 гектаров тундры, средние потери углерода составили около 2 кг/м2 (Jones et al., 2009; Mack et al., 2011). Помимо прямого влияния на растительность и почвы тундровых экосистем, пожары вызывают снижение уровня вечной мерзлоты (протаивание) в мерзлотных районах. Например, через 5 лет после пожара на Аляске покрытие вечнозеленых кустарничков, мохообразных и лишайников было резко сниженным, оно не восстановилось до контроля и через 10 лет после выгорания. С другой стороны, после пожара возросло покрытие Eriophorum vaginatum и Vaccinium uliginosum. После пожара существенно увеличилась глубина протаивания, однако при пышном развитии E. vaginatum она восстановилась через 10 лет до контрольного уровня (Narita et al., 2015).
В травяных сообществах Альп и Кавказа пожары также являются древними факторами, влияющими на состав растительных сообществ и свойства почв с миоцена, но наибольшей частоты пожары достигают в голоцене (Colombaroli et al., 2010; Feurdean, Vasiliev, 2019).
Влияние палов на состав и структуру травяных сообществ
Распространение пожара в значительной степени зависит от свойств растительного материла, таких как его запас, влажность и выделение тепла (Бахтиярова, 2018). Пожары в травяных сообществах обычно происходят при накоплении ветоши более 50 г/м2 при влажности ниже 30% (Bond, Wilgen, 1996). В зависимости от жизненной формы, различные виды растений по-разному реагируют на пожары. Большое значение для выживания и возобновления после огня имеет запас почек и питательных веществ в подземных органах и/или семян в почвах. Выделяют три стратегии горения отдельных растений в экосистемах: 1) не- горючесть, 2) быстрое воспламенение и прохождение огня, 3) горение с высоким выделением тепла. Травянистые растения обычно имеют вторую стратегию и выживают за счет уцелевших после пожара почек (Pausas et al., 2017).
Во многих работах показано увеличение участия злаков, особенно корневищных, после пожаров в травяных сообществах. Злаки могут также способствовать накоплению трудно разлагаемой ветоши и увеличивать вероятность палов. Так, для высокотравной прерии США показано, что злаки увеличивают скорость распространения огня в сравнении с аналогичным по биомассе или покрытию разнотравьем за счет возрастания температуры пламени вдвое выше по сравнению с участками, имеющими сходную биомассу чистого разнотравья (Wragg et al., 2018). Выжигание в степных сообществах Северо-Восточного Китая увеличивает биомассу злаков и снижает – разнотравья (Huang et al., 2018).
В высокогорных сообществах пожары также могут способствовать усилению роли злаков, что наблюдается, например, на Тайване, где на высокогорных лугах после пожаров доминируют злаки Miscanthus transmorrisonensis и Yushania niitakayamensis, играющие большую роль в защите почв от эрозии (Lee et al., 2021). В Гималаях пожары ослабляют роль кустарников и усиливают роль злаков (Paudel et al., 2020), что отмечается также и для тундровых сообществ на Аляске (Hollingsworth et al., 2021). В североамериканской пустыне Чиуауа пожары усиливают роль злаков и снижают роль кустарников за счет перераспределения содержания C и N в почве между участками, занятыми разными растениями (Wang et al., 2019).
Однако в других высокогорных регионах пожары могут поддерживать или даже увеличивать участие кустарников, адаптированных к выжиганию (Beck et al., 1986; Camac et al., 2017). В ряде альпийских сообществ пожары происходят регулярно и не вызывают долговременных существенных изменений их состава и структуры (Williams et al., 2008; Suazo et al., 2018).
Отдельным важным аспектом влияния пожаров в травяных сообществах является изменение видового богатства (флористической насыщенности) при разной частоте горения. Многочисленные эксперименты дают противоречивые результаты. Так, во влажных и сухих прериях в Северной Каролине наибольшее видовое богатство наблюдалось при ежегодном выжигании, в то время как выжигание через 3–4 года снижало флористическую насыщенность на площадках различного размера (от 0.25 до 625 м2) (Wolf, Peet, 1980; Peet et al., 1983). В высокотравной прерии в США прекращение выжигания приводило к потере 50% видового разнообразия растений (Leach, Givnish, 1996). На участках прерий в других регионах наибольшее видовое разнообразие наблюдалось в условиях нечастого выжигания в сочетании с выпасом бизонов, а наиболее низкое – на часто выжигаемых склонах без выпаса. Частое выжигание благоприятствовало доминированию С4-злаков и подавлению С3-разнотравья (Collins, Calabrese, 2012). В Европе периодическое выжигание травяных сообществ используется для повышения видового разнообразия и контроля участия нежелательных видов (Ryser et al., 1995; Valko et al., 2014).
Влияние палов на продукцию и содержание биогенов в растениях
Непосредственно после палов в травяных экосистемах возрастает доступность элементов минерального питания для растений в почве, особенно Р и К, поэтому может повышаться продукция и качество корма для скота (оно выше при более высоком содержании элементов минерального питания в биомассе), с чем связано использование палов в сельскохозяйственной практике (Schulze et al., 2005). Например, в австралийских кустарниковых сообществах (квонган) в ходе восстановления растений спустя 18 месяцев после пожара наблюдалась аккумуляция в фитомассе K, Ca, Mg и P, сопоставимая с их содержанием в золе. Развивающиеся после пожара эфемеры содержали существенно больше Р, чем другие растения (Pate, Dell, 1984). Выжигание может увеличить содержание биогенов в доминантах, переживших пожар за счет поступления из золы недоминирующих видов растений, пострадавших от пожара. Например, в пустыне Мохаве через 6 лет после выжигания наблюдалось снижение покрытия кустарников на 86% и разнообразия на 42%. При этом у доминантов Yucca brevifolia и Larrea tridentata возросло содержание N и Р в листьях, в том числе и за счет гибели при пожарах многих конкурентов (Horn et al., 2015).
В то же время регулярное выжигание ведет к значительным потерям биогенов (особенно азота) и прогрессирующему обеднению почвы. Так, растения на выжигаемых участках саванн Серенгети содержали меньше азота и фосфора в связи с изменением состава растительных сообществ. На выжигаемых участках увеличивалось участие Themeda triandra, для которой характерно меньшее содержание элементов минерального питания в листьях, чем у других злаков (Anderson et al., 2007а). В 40-летнем эксперименте в австралийском лесу было показано, что выжигание раз в 4 года вызывает дефицит Р, а выжигание раз в 2 года – N в листьях, по сравнению с невыжигаемыми участками (Butler et al., 2019). Выжигание прерий Техаса снижало надземную продукцию уже в масштабе ближайших 4 месяцев после пожара, долговременно снижалась продукция разнотравья (Hannusch et al., 2020).
Влияние палов на подземную продукцию и свойства почвы
Пожары влияют и на продукцию тонких корней. В течение нескольких месяцев после пожара она обычно увеличивается, а затем снижается до исходного уровня. Так, в высокотравной прерии Канзаса при 13-летнем ежегодном выжигании увеличивалась общая биомасса тонких корней (на 48%) и запас С в корнях (на 47%) по сравнению с невыжигаемыми участками, при этом выжигание снижало содержание азота в корнях на 15–25% (Kitchen et al., 2009). В лесных сообществах послепожарная динамика тонких корней проявляется особенно ярко. В таежной сукцессионной системе в Канаде биомасса тонких корней возрастала с 3 до 94 лет после пожара, а затем снижалась. Продукция и оборот корней увеличивались от 3 к 11 годам, а затем снижались (Yuan, Chen, 2012).
Изменение состава сообществ, а также динамики надземной и подземной биомассы растений после пожара во многом определяется изменением свойств почвы. Содержание в почве минерального азота кратковременно повышается (всплеск минерализации отмирающих органов), а затем снижается с значительными потерями общего азота при частых пожарах (Goodridge et al., 2018; Pellegrini et al., 2020).
В отличие от азота, содержание подвижных форм фосфора в почве после пожара обычно стабильно увеличивается за счет поступления с золой. Это было показано как для отдельных лесных (Schaller et al., 2015) и травяных сообществ (Reinhart et al., 2016), так и в результате обобщающего мета-анализа многих наблюдений (Butler et al., 2018). Пожары также изменяют многие физические, химические и биологические свойства почвы, такие как плотность, влагоемкость, структура, катионообменная способность, рН, содержание C и N и состав микробных сообществ (Габбасова и др., 2019; Deng et al., 2020; McLauchlan et al., 2020). Пожары имеют разнонаправленное влияние на содержание органических веществ. С одной стороны, выжигание ветоши, а иногда и верхнего слоя почвы, создает более благоприятные условия для разложения опада и вызывает снижение содержания органических веществ в почве, с другой – снятие лимитирования элементами минерального питания почвенных микроорганизмов и термическая трансформация ряда органических соединений в почве повышают их устойчивость к разложению (Pellegrini et al., 2022).
Таким образом, влияние пожаров на лесные, степные и кустарниковые экосистемы изучалось многими исследователями, что позволило установить основные закономерности изменения и восстановления сообществ после воздействия огня. Но сведения о влиянии пожаров на высокогорные экосистемы немногочисленны и фрагментарны, хотя даже в гумидных высокогорьях Кавказа пожары – нередкое явление. Высокогорные луга с доминированием плотнодерновинных злаков, главным образом пестрой овсяницы Festuca varia Haenke, – удобный объект для изучения изменения растительных сообществ и почв под влиянием палов, поскольку они накапливают большое количество сухой ветоши и выжигаются в производственных целях. Они обладают наибольшим набором признаков, характерных для пирогенных экосистем. Эти луга занимают хорошо прогреваемые склоны южных экспозиций с умеренным накоплением снега зимой в субальпийском и альпийском поясах гор. Они характеризуются наибольшим накоплением ветоши: надземная мортмасса может составлять около 900 г/м2 при втрое меньшей надземной биомассе (Онипченко, 1990). На неиспользуемых лугах процент отмерших, но не разложившихся стеблей и листьев прошлых лет может достигать 70–72%, тогда как на скашиваемых всего 25–30% (Гогина, 1961). Даже при однократном выжигании эти луга изменяют свою структуру в связи с увеличением численности побегов основного доминанта (Буш, 1940). В альпийском поясе Северо-Западного Кавказа мы провели долговременный (22 года) эксперимент с осенним выжиганием небольших участков пестроовсяницевого луга. В задачи нашей работы входило изучение изменения состава растительного сообщества, видовой насыщенности (альфа-разнообразия), содержания элементов минерального питания и свойств почвы под влиянием экспериментального выжигания ветоши, а также сравнение реакции на пожары альпийского луга с таковой для экосистем других типов. Кроме того, мы исследовали изменение почвенных свойств после однократного естественного пожара высокой интенсивности, который произошел близ экспериментальных площадок осенью 2015 г.
МАТЕРИАЛЫ И МЕТОДЫ
Полевые исследования
Работа выполнена в Тебердинском национальном парке (ТНП) (Карачаево-Черкесская Республика) на северо-восточном отроге горы Малая Хатипара, высота 2750–2800 м над ур. м. Первые результаты эксперимента по выжиганию были опубликованы в работе Т.Г. Елумеевой и В.Г. Онипченко (2009).
Объект исследований – пестроовсяницевые луга с доминированием плотнодерновинных злаков овсяницы пестрой Festuca varia Haenke и белоуса торчащего Nardus stricta L. на территории ТНП. В эксперименте с выжиганием было заложено 10 площадок площадью 1 м2. Площадки находились на расстоянии 3–5 м друг от друга. Вверх по склону располагались 5 контрольных площадок, а ниже – 5 экспериментальных. На каждой из площадок были отмечены алюминиевой проволокой по 3 квадрата 25 × 25 см, размещавшиеся в одну линию поперек склона. Итого было заложено 30 квадратов.
Эксперимент проведен с 1995 по 2016 год. Раз в 2 года ранней осенью (сентябрь) в сухую погоду на экспериментальных площадках поджигали ветошь на площади 1.5–2 м2. Последнее выжигание проводили в 2015 г., т.е. всего выжигали 11 раз в течение 23 лет. С 1994 по 2016 год на контрольных и опытных квадратах ежегодно проводили подсчет побегов всех видов сосудистых растений. В анализ включены 13 видов, у которых среднее по годам число побегов на вариант (т.е. суммарно по всем 15 площадкам варианта) составляет более 15: Anthoxanthum odoratum, Anthemis cretica, Campanula collina, Deschampsia flexuosa, Euphrasia ossica, Festuca ovina, F. varia, Gentiana pyrenaica, Leontodon hispidus, Minuartia aizoides, Nardus stricta, Veronica gentianoides, Scorzonera cana (номенклатура по В.Г. Онипченко и А.С. Зернову (2022)).
В 2016 г. была проведена оценка надземной биомассы по видам и ветоши на каждом квадрате методом укоса. Девять преобладающих по массе и встречаемости видов (Antennaria dioica, Anthoxanthum odoratum, Campanula collina, Carex umbrosa, Deschampsia flexuosa, Festuca ovina, F. varia, Gentiana pyrenaica, Nardus stricta) были отобраны для химического анализа.
Образцы горно-луговой почвы отбирали с помощью бура диаметром 5 см с глубины 0–5 см, затем, не позднее чем через 4 ч, доставляли в лабораторию и замораживали.
В непосредственной близости к местам исследований на горе Малая Хатипара в экстремально сухую осень 2015 г. произошел сильный пожар при естественном возгорании (молния), затронувший участки пестроовсяницевого луга. Мы воспользовались этим случаем и в 2016 г. взяли по 10 почвенных проб на участках горения и соседних контрольных участках, которые также были проанализированы (однократное выжигание).
Лабораторные измерения
Собранные с каждого квадрата в конце полевого эксперимента растения и ветошь высушивали в сушильном шкафу при температуре 80°C 24 ч и взвешивали. Затем образцы перемалывали в вибрационной мельнице Retsch MM 200 и сжигали мокрым озолением в печи для микроволновой подготовки проб Milestone Ethos D. Концентрации фосфора, калия, кальция и магния в растительном материале определяли на масс-спектрометре с индуктивно-связанной плазмой Agilent ICP-MS 7500a.
После размораживания почвы производили ручное удаление камней и корней из образцов с полевой влажностью и далее определяли в них следующие показатели:
1) Естественная влажность – весовым методом.
2) Содержание аммонийного азота $({\text{N - NH}}_{4}^{ + })$ – салицилат-нитропруссидным методом (Kandeer, 1996), а нитратного азота $({\text{N - NO}}_{3}^{ - })$ – при восстановлении ${\text{NO}}_{3}^{ - }$ до ${\text{NO}}_{2}^{ - }$ на кадмиевой колонке и последующим получении окрашенного азотсоединения при реакции с сульфаниламином и N-(1-Нафтил)-этилендиамин дигидрохлоридом (Dorich, Nelson, 1984). Минеральные (неорганические) формы азота определяли колориметрически на спектрофотометре GENESYS 10UV. Экстракцию осуществляли раствором 0.05 М K2SO4 при взбалтывании суспензии в течение 1 ч и соотношении почвы к раствору – 1 : 5.
3) Содержание экстрагируемых форм азота (Nэкстр) и органического углерода (Сорг-экстр) определяли на элементном жидкостном анализаторе TOC-VCPN (Shimadzu).
4) Содержание экстрагируемого органического азота (Nорг-экстр) рассчитывали по разности между Nэкстр и суммой неорганических соединений $\left( {{\text{N - }}} \right.{\text{NH}}_{4}^{ + }$ + ${\text{N - NO}}\left. {_{3}^{ - }} \right).$
5) Содержание углерода (Cмикр) и азота (Nмикр) микробной биомассы определяли методом фумигации-экстракции (Brookes et al., 1985; Vance et al., 1987).
6) Активность минерализации углерода и азота определяли инкубированием почв при 22°C в течение 21 сут в климатической камере SANYO MIR-153. Минерализацию рассчитывали двумя способами:
6.1) Nминер-минерализацию – как разницу содержания экстрагируемого азота неорганических соединений $\left( {{\text{N - }}} \right.{\text{NH}}_{4}^{ + }$ + ${\text{N - NO}}\left. {_{3}^{ - }} \right)$ в почве после и до инкубации;
6.2) Nорг-минерализацию – как разницу содержания азота органических соединений (Nорг-экстр) в почве после и до инкубации;
6.3) Сорг-минерализацию – как разницу содержания экстрагируемого углерода органических соединений (Сорг-экстр) в почве после и до инкубации.
После высушивания образцов до воздушно-сухого состояния почву просеивали через сито с диаметром отверстий 2 мм и далее определяли: 1) ${\text{p}}{{{\text{Н}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ в почвенной суспензии – потенциометрически на pH-метре HANNA pH213; 2) содержание подвижного фосфора (Pподв) и обменного калия по методу Кирсанова (ГОСТ Р 54650-2011) (Pподв определяли колориметрически на спектрофотометре GENESYS 10UV, а обменный К – на пламенном спектрофотометре LEKI FP-640); 3) обменные Ca и Mg – по ГОСТ 26487-85 с аналитическим окончанием на атомно-адсорбционном спектрофотометре UNICAM 929.
Статистическая обработка
Значимость отличий между вариантами по химическому составу, биомассе растений и массе ветоши оценивали по t-критерию Стьюдента, если распределение не отличалось от нормального, или по непараметрическому критерию Манна–Уитни (для фитомассы и свойств почвы) и парному критерию Вилкоксона (для химического состава растений). Для 13 видов растений значимость изменения численности по годам в каждом варианте оценили с помощью регрессионных моделей по методу генерализованных наименьших квадратов с учетом автокорреляции первого порядка (corAR1). Чтобы выяснить, отличаются ли регрессионные коэффициенты в эксперименте и в контроле, анализировали две регрессионные модели, из которых одна модель включала порядковый номер года, вариант и условие взаимодействия между ними, а вторая – только год и вариант. Значимость различий между моделями оценили по отношению логарифмов функции максимального правдоподобия. Анализ был проведен в пакете nlme в статистической среде R (Pinheiro et al., 2016).
РЕЗУЛЬТАТЫ
Изменение структуры фитоценоза при длительном выжигании
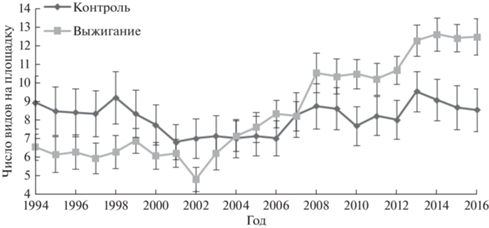
Всего на экспериментальных участках пестроовсяницевого луга было встречено 42 вида сосудистых растений, относящиеся к 16 семействам, а также мхи и лишайники. На контрольных участках отмечено 28 видов сосудистых растений. Флористическая насыщенность (среднее число видов на площадке 25 × 25 см) в контроле практически не менялась за 23 года наблюдений, оставаясь на уровне около 9 видов (1994 г.: 8.9 ± 1.4; 2016 г.: 8.5 ± 1.2 – среднее и его ошибка здесь и далее) (рис. 1). В то же время на выжигаемых участках она исходно была ниже, чем в контроле, мало менялась в течение первых 8 лет наблюдений, резко снизилась в засушливый 2002 г., а затем повышалась до конца периода наблюдений, почти вдвое превысив начальные показатели и значимо превышая показатели в контроле (1994 г.: 6.5 ± 0.7; 2016 г.: 12.5 ± 1.0).
Рис. 1.
Динамика изменения флористической насыщенности (альфа-разнообразие, среднее число видов на площадку 25 × 25 см и ошибка среднего, n = 15) на участках с многократным выжиганием ветоши и в контроле за 23 года эксперимента.
Выжигание положительно влияло на численность 6 видов из 13 изученных: Anthemis cretica, Campanula collina, Deschampsia flexuosa, Festuca ovina, Nardus stricta, Veronica gentianoides (рис. 2, табл. 1). У A. cretica, C. collina и D. flexuosa положительные тренды наблюдались и в естественной динамике, но при выжигании численность возрастала быстрее (табл. 1). У F. ovina, N. stricta и V. gentianoides в контроле численность незначимо снижалась, а в опыте – повышалась, в результате чего разница в углах наклона линий регрессии оказалась значимой. Также следует отметить появление 12 новых видов, тогда как 5 видов (Festuca brunnescens, Anthemis marschalliana, Eritrichium caucasicum, Myosotis alpestris и Senecio aurantiacus) полностью исчезли с выжигаемых участков.
Рис. 2.
Численность побегов отдельных видов растений по годам. Линия тренда в контроле обозначена пунктиром, а в опыте (многократное выжигание) – сплошной линией. Черными точками обозначено число побегов вида на опытных участках, белыми – на контрольных.
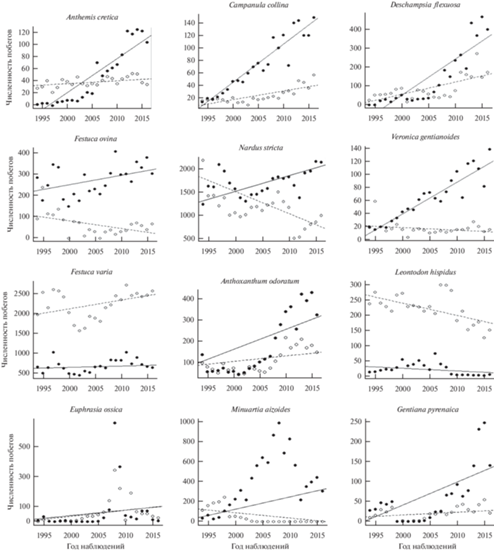
Таблица 1.
Параметры генерализованных линейных моделей (коэффициенты (B) и стандартные ошибки (StE B)) разногодичной динамики численности побегов и результаты попарного сравнения моделей (контроль и опыт с учетом и без учета взаимодействия между фактором времени и вариантом эксперимента многократного выжигания)
| Вид | Вариант | Регрессионные коэффициенты по годам | Результаты сравнения моделей | |||
|---|---|---|---|---|---|---|
| B | StE B | p | L-ratio | p | ||
| Злаки | ||||||
| Anthoxanthum odoratum | Контроль Опыт |
3.25 8.99 |
3.79 10.29 |
0.401 0.392 |
3.05 | 0.081 |
| Deschampsia flexuosa | Контроль Опыт |
6.52 19.17 |
2.51 5.05 |
0.017 0.001 |
7.04 | 0.008 |
| Festuca ovina | Контроль Опыт |
–3.56 4.51 |
2.14 2.87 |
0.111 0.131 |
5.84 | 0.016 |
| Festuca varia | Контроль Опыт |
23.04 5.59 |
26.97 8.73 |
0.403 0.529 |
0.61 | 0.433 |
| Nardus stricta | Контроль Опыт |
–54.0 30.2 |
55.4 19.2 |
0.341 0.131 |
8.44 | 0.004 |
| Разнотравье | ||||||
| Anthemis cretica | Контроль Опыт |
0.62 5.42 |
0.26 1.37 |
0.029 <0.001 |
12.61 | <0.001 |
| Campanula collina | Контроль Опыт |
1.60 6.12 |
0.60 0.37 |
0.015 <0.001 |
21.81 | <0.001 |
| Euphrasia ossica | Контроль Опыт |
4.00 3.68 |
4.49 8.25 |
0.384 0.660 |
0.001 | 0.977 |
| Gentiana pyrenaica | Контроль Опыт |
1.01 5.67 |
0.73 4.67 |
0.182 0.238 |
3.18 | 0.074 |
| Leontodon hispidus | Контроль Опыт |
–4.03 –0.83 |
2.24 1.22 |
0.086 0.505 |
2.35 | 0.126 |
| Minuartia aizoides | Контроль Опыт |
–6.87 12.27 |
3.85 34.15 |
0.088 0.723 |
2.26 | 0.133 |
| Scorzonera cana | Контроль Опыт |
–0.44 0.91 |
0.48 1.10 |
0.366 0.419 |
3.31 | 0.069 |
| Veronica gentianoides | Контроль Опыт |
–0.37 4.86 |
0.38 0.35 |
0.335 <0.001 |
34.27 | <0.001 |
Запасы различных фракций надземной фитомассы значимо снизились после долговременного выжигания по сравнению с контролем (кроме лишайников, роль которых незначительна). Так, биомасса сосудистых растений снизилась с 225 ± 17 до 110 ± 11 г/м2, запасы ветоши (мортмасса) – с 752 ± 135 до 148 ± 21 г/м2, общая фитомасса (биомасса + мортмасса) – с 949 ± 137 до 266 ± 31 г/м2 (табл. 2). Мохообразные имели невысокое участие, но их масса значимо снизилась при выжигании (c 18 ± 6 до 2 ± 1 г/м2).
Таблица 2.
Надземная биомасса массовых видов сосудистых растений, мхов, лишайников и масса ветоши на контрольных и опытных участках многократного выжигания (г/м2, сухой массы, р – уровень значимости различий опыта и контроля, n = 15)
| Вид | Выжигание | Контроль | p | ||
|---|---|---|---|---|---|
| среднее | стандартная ошибка | среднее | стандартная ошибка | ||
| Anthoxanthum odoratum | 7.00 | 1.30 | 4.11 | 0.89 | 0.115 |
| Deschampsia flexuosa | 7.98 | 7.34 | 5.73 | 3.15 | 0.836 |
| Festuca ovina | 3.93 | 1.08 | 7.85 | 3.07 | 0.844 |
| Festuca varia | 21.2 | 8.9 | 113.7 | 31.7 | 0.056 |
| Nardus stricta | 21.5 | 6.4 | 68.9 | 17.2 | 0.078 |
| Carex umbrosa | 1.46 | 0.92 | 5.70 | 1.89 | 0.089 |
| Antennaria dioica | 5.81 | 3.16 | 0.89 | 0.62 | 0.648 |
| Anthemis cretica | 4.67 | 2.24 | 1.87 | 1.60 | 0.199 |
| Campanula collina | 6.26 | 2.23 | 0.47 | 0.19 | 0.031 |
| Campanula tridentata | 2.81 | 1.43 | 0.22 | 0.16 | 0.443 |
| Gentiana pyrenaica | 2.90 | 1.74 | 3.73 | 1.93 | 0.836 |
| Ranunculus oreophilus | 2.06 | 0.89 | 0.04 | 0.03 | 0.017 |
| Scorzonera cana | 1.22 | 0.32 | 0.74 | 0.27 | 0.254 |
| Vaccinium vitis-idaea | 0.31 | 0.22 | 7.80 | 4.62 | 0.191 |
| Veronica gentianoides | 5.40 | 2.20 | 0.77 | 0.57 | 0.029 |
| Viola altaica | 0.08 | 0.05 | 0.45 | 0.26 | 0.590 |
| Всего сосудистые | 110.3 | 10.8 | 224.7 | 17.1 | 0.000 |
| Мохообразные | 2.24 | 0.71 | 17.76 | 6.12 | 0.011 |
| Лишайники | 5.86 | 3.31 | 4.53 | 2.94 | 1.000 |
| Ветошь | 148 | 21 | 752 | 135 | 0.009 |
| Фитомасса | 266 | 31 | 949 | 137 | 0.001 |
| Доля злаков, % | 51.0 | 5.0 | 88.3 | 3.6 | 0.000 |
| Доля разнотравья, % | 46.2 | 5.1 | 8.8 | 3.0 | 0.000 |
| Доля осок, % | 2.7 | 1.4 | 2.8 | 1.0 | 0.512 |
Среди функциональных групп сосудистых растений также произошли существенные изменения, связанные со значимым снижением доли злаков в надземной биомассе (с 88 до 51%) и повышением доли разнотравья (с 9 до 46%). Участие осок не изменилось. Отмечено значимое увеличение биомассы для трех видов разнотравья – Campanula collina (с 0.5 до 6.3 г/м2), Ranunculus oreophilus (с 0.04 до 2.1 г/м2) и Veronica gentianoides (с 0.8 до 5.4 г/м2). Доминирующие виды злаков резко (хотя и с пограничной значимостью; табл. 2) снизили свое участие: Festuca varia – cо 114 до 21 г/м2, Nardus stricta – c 69 до 21 г/м2. Эти конечные результаты хорошо согласуются с динамикой численности побегов, изученной в ходе эксперимента. Лишь биомасса N. stricta снижалась на фоне увеличения численности побегов, что связано с уменьшением размеров побегов при выжигании.
Изменение химического состава растений
Содержание P, K, Ca, Mg в надземной биомассе 9 видов растений на контрольных и опытных площадках в конце эксперимента различалось незначительно. Для P, K и Са отмечается тенденция к снижению содержания на площадках выжигания (среднее содержание по видам Р 1760 ± 176 и 1540 ± 86 мг/кг, K 15 300 ± 1900 и 12 700 ± 1900 мг/кг, Са 9300 ± 2130 и 7510 ± 173 мг/кг, контроль и выжигание соответственно, среднее и ошибка, р > 0.05, различия не значимы). Среднее содержание Mg было очень сходным в растениях в контроле и опыте (2940 ± 630 и 3380 ± 960 мг/кг, контроль и выжигание соответственно).
Содержание изученных элементов в мортмассе изменилось незначительно. Значимо увеличилось содержание Р (828 ± 39 и 979 ± 71 мг/кг, контроль и выжигание соответственно, p = 0.043, парный критерий Вилкоксона). Отмечена тенденция к увеличению содержания Mg в мортмассе (1480 ± 130 и 2170 ± 350 мг/кг, контроль и выжигание соответственно, p = 0.084, t-тест). Содержание Са и К значимо не изменилось.
Содержание Р в растениях значимо не изменилось, для доминанта Nardus stricta отмечено пограничное по значимости увеличение содержания Р при выжигании (1374 ± 45 и 1512 ± 50 мг/кг, контроль и выжигание соответственно, t-тест, p = = 0.075). У многих изученных видов после выжигания снизилось содержание К, для трех видов отмечено практически значимое снижение: Anthoxanthum odoratum (18 600 ± 1500 и 14 700 ± ± 700 мг/кг, контроль и опыт, t-тест, p = 0.051), Festuca varia (13 400 ± 700 и 9300 ± 370 мг/кг, t-тест, p = 0.006), N. stricta (10 900 ± 700 и 8300 ± 330 мг/кг, t‑тест, p = 0.014). Содержание Са изменялось незначительно, для N. stricta отмечено пограничное увеличение после пожаров (4060 ± 230 и 4770 ± ± 390 мг/кг, контроль и выжигание соответственно, p = 0.080, парный критерий Вилкоксона). Содержание Mg после длительного выжигания увеличилось у многих видов, значимые различия получены для доминирующих злаков – F. varia (1240 ± ± 60 и 1570 ± 60 мг/кг, контроль и выжигание, t‑тест, p = 0.002) и N. stricta (1390 ± 90 и 1900 ± ± 220 мг/кг, p = 0.043, парный критерий Вилкоксона).
Изменение почвенных свойств
В случае однократного выжигания растительного покрова наблюдалось существенное изменение свойств почвы (табл. 3). При этом значимо возрастало (в 2 раза) содержание Pподв и Ca и в 1.5 раза – Mg. Cодержание экстрагируемого углерода и микробного углерода в почве, напротив, снижалось в 1.5 раза, а также происходило накопление легкодоступных для микробов минеральных форм азота в почве – в 1.3 раза аммонийных (p = 0.105) и в 2.5 раза нитратных (p = 0.063).
Таблица 3.
Свойства горно-луговой почвы после выжигания в сравнении с контролем на пестроовсяницевом лугу (р – уровень значимости различий опыта и контроля)
| Показатель | Однократное выжигание, n = 10 | Многократное выжигание, n = 15 | ||||
|---|---|---|---|---|---|---|
| контроль | опыт | р | контроль | опыт | р | |
| Влажность (объемные %) | 40.2 ± 3.1 | 45.2 ± 5.4 | 0.684 | 57.3 ± 4.0 | 50.4 ± 3.7 | 0.412 |
| ${\text{p}}{{{\text{Н}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | 4.50 ± 0.06 | 4.66 ± 0.13 | 0.684 | 4.43 ± 0.03 | 4.32 ± 0.04 | 0.061 |
| Pподв, мг/кг | 12.0 ± 1.2 | 36.4 ± 7.7 | <0.001 | 9.7 ± 1.1 | 8.0 ± 0.6 | 0.539 |
| К, мг/кг | 10.1 ± 0.1 | 10.3 ± 0.8 | 0.529 | 10.2 ± 0.8 | 9.9 ± 0.5 | 0.106 |
| Са, мг/кг | 90.7 ± 0.9 | 151 ± 23 | 0.052 | 80.6 ± 4.6 | 70.2 ± 4.2 | 0.041 |
| Mg, мг/кг | 20.3 ± 0.3 | 30.6 ± 3.6 | 0.015 | 20.04 ± 1.0 | 10.80 ± 0.8 | 0.202 |
| Сорг-экстр, мг/кг | 423 ± 38 | 319 ± 23 | 0.052 | 231 ± 11 | 242 ± 17 | 0.624 |
| Nорг-экстр, мг/кг | 56.2 ± 7.8 | 68.1 ± 7.7 | 0.393 | 46.0 ± 3.5 | 32.2 ± 2.6 | 0.011 |
| С : Nорг-экстр | 9.0 ± 1.5 | 5.2 ± 0.6 | 0.043 | 5.3 ± 0.3 | 8.0 ± 0.7 | 0.000 |
| N-NO3, мг/кг | 0.06 ± 0.02 | 0.15 ± 0.04 | 0.063 | 0.12 ± 0.11 | 0.02 ± 0.01 | 0.967 |
| N-NH4, мг/кг | 1.27 ± 0.14 | 1.63 ± 0.10 | 0.105 | 1.10 ± 0.08 | 0.80 ± 0.09 | 0.161 |
| Смикр, мг/кг | 2820 ± 320 | 1870 ± 200 | 0.029 | 2190 ± 180 | 2390 ± 147 | 0.486 |
| Nмикр, мг/кг | 205 ± 25 | 176 ± 29 | 0.353 | 250 ± 21 | 207 ± 10 | 0.106 |
| С : Nмикр | 14.4 ± 1.2 | 11.9 ± 1.3 | 0.218 | 8.8 ± 0.2 | 11.5 ± 0.4 | 0.000 |
| Cорг-минерализация, мг/кг/сут | –14.61 ± 2.18 | –9.01 ± 1.63 | 0.075 | –3.41 ± 0.88 | –6.07 ± 0.95 | 0.250 |
| Nорг-минерализация, мг/кг/сут | –1.70 ± 0.33 | 0.25 ± 0.48 | 0.007 | 3.09 ± 0.71 | –0.02 ± 0.21 | 0.000 |
| Nминер-минерализация, мг/кг/сут | 0.01 ± 0.01 | 0.08 ± 0.03 | 0.105 | 0.13 ± 0.03 | 0.07 ± 0.01 | 0.137 |
При длительном многократном выжигании ветоши свойства почвы в контрольном и опытном вариантах практически не отличаются. Отсутствие ветоши при низкой интенсивности осадков усиливает промывной водный режим, поэтому на выжигаемых участках наблюдается даже тенденция к потере элементов минерального питания. Это выражается в снижении содержания (на 15%) обменных форм Ca (p = 0.041) и K (p = 0.106), а также в небольшом подкислении почвы $\left( {\text{р}} \right.{{{\text{Н}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ снижается с 4.43 до 4.32; p = 0.061). В наибольшей степени снижается содержание Nорг-экстр в 1.5 раза (p = 0.011), в результате чего возрастает соотношение C : Nорг-экстр (p < 0.001). Последнее косвенно свидетельствует о деградации органического вещества почвы, вероятной причиной которой может быть потеря азота при выгорании.
При многолетнем выжигании также наблюдается значимое снижение интенсивности Nорг-минерализации практически до нулевого уровня, как и при однократном. То есть микробная активность трансформации азота снижается. Однако при длительном выжигании не наблюдается снижения Смикр. Это можно объяснить адаптацией микробного сообщества к длительной стрессовой нагрузке, в том числе, вероятно, и за счет изменения его структуры.
ОБСУЖДЕНИЕ
В ходе длительного периодического выжигания ветоши произошли существенные изменения состава и структуры пестроовсяницевого луга: уменьшились запасы мортмассы и живой биомассы сосудистых растений, уменьшилось участие доминирующих видов злаков и увеличилось – разнотравья, прогрессивно возрастало видовое богатство (флористическая насыщенность) экспериментальных площадок.
Уменьшение надземной продукции после пожаров отмечалось и в растительных сообществах, ранее не испытывавших воздействие огня, таких как высокогорные луга в Новой Зеландии. Выжигание здесь приводит к быстрой деградации этих сообществ, потере большого количества биомассы и биогенов (Mark, 1994). Повторяющиеся палы в заповедной мелкодерновинной степи в Хакасии также препятствуют естественному ходу восстановления растительности и замедляют рост надземной фитомассы (Кандалова, 2009).
Многолетние представители разнотравья Ranunculus oreophilus, Campanula collina, Veronica gentianoides увеличили свое участие после периодического выжигания. Это может быть связано с накоплением органических веществ и элементов минерального питания в подземных органах – корнях и корневищах. Так, для V. gentianoides характерно относительно глубокое расположение корневищ (2.5–3 см) (Семенова-Тян-Шанская, 1948), что способствует переживанию кратковременного воздействия высоких температур. Наличие ползучих корневищ у C. collina может способствовать активному зарастанию выгоревших участков. Кроме того, в экспериментах по удалению доминанта Festuca varia показано, что у этих видов высока способность к семенному возобновлению (Елумеева, 2004).
В целом, возрастание роли разнотравья после выжигания, уничтожившего ветошь, отмечается рядом авторов. Например, Д.Ф. Федюнькин (1953) показал, что урожайность разнотравья на выгоревших участках лесостепного Зауралья выше, чем в контроле, в 2 раза. В экспериментах при одновременном воздействии пожара и засухи в высокотравной прерии Канзаса наблюдается резкое сокращение покрытия злаков на 80%, увеличение покрытия разнотравья на 50% и увеличение разнообразия растений (Ratajczak et al., 2019). А Бонд (Bond, 2016) обращает внимание на то, что долговременная защита от пожара ведет к выпадению многих представителей многолетних двудольных за счет затенения. Таким образом, подавление доминантов при выжигании дает возможность развиваться недоминантным видам, в частности разнотравью, и способствует появлению новых видов, что подтверждается рядом других авторов (Сулейманова, 2012; Уфимцев и др., 2013).
Вследствие регулярного осеннего выжигания ветоши ее масса сокращается. Аналогичные данные получены в высокогорных степных пастбищах Восточной Анатолии (Турция), где также наблюдалось снижение массы подстилки после пожара и ее последующее восстановление до уровня контрольных участков в течение двух последующих лет (Gullap et al., 2018).
Возрастание флористической насыщенности при выжигании в изученном сообществе продолжило общую тенденцию, отмеченную в первые годы данного эксперимента (Елумеева, Онипченко, 2009). Поддержание высокой флористической насыщенности при большой частоте пожаров отмечается во многих исследованиях (Wolf, Peet, 1980; Peet et al., 1983).
Длительное выжигание существенно не изменило среднее содержание минеральных элементов (P, Ca, Mg) в надземной биомассе большинства изученных видов, лишь содержание K снижалось у ряда видов, в то время как для Mg отмечено увеличение содержания у Festuca varia и Nardus stricta, а N. stricta показал также пограничное по уровню значимости увеличение содержания Ca и P. В мортмассе также увеличилось содержание P и Mg. Эти данные говорят о том, что растения имеют довольно постоянное содержание элементов минерального питания, на которые пожар влияет через прогрессирующее обеднение почв азотом и обогащение фосфором. Но поскольку отношение N : P в растениях довольно консервативно, оно слабо меняется после пожаров, несмотря на снижение доступного азота и увеличение доступного фосфора (Lü et al., 2017), также может происходить и общее снижение содержания обоих элементов (Anderson et al., 2007b). Поэтому некоторое увеличение содержания Р в растениях и ветоши после пожаров в нашем эксперименте хорошо согласуется с данными других авторов. Снижение содержания К у ряда видов после выжигания в нашем эксперименте получено впервые, в других работах отмечалось увеличение содержания этого элемента (Pate, Dell, 1984; Schulze et al., 2005). Возможно, такое снижение содержания K связано с более напряженным водным режимом растений на участках выжигания, где не покрытая ветошью почва может быстрее высыхать, хотя однократное измерение влажности в наших условиях этого не подтвердило.
В нашем эксперименте отмечено небольшое подкисление почвы и снижение содержания обменного Са, а также снижение содержания азота и интенсивности процессов трансформации его соединений.
Подкисление почвы и снижение Са можно объяснить снижением участия и, соответственно, корневой активности плотнодерновинных злаков. Как показали наши ранние эксперименты (Onipchenko et al., 2001), Festuca varia в монокультуре увеличивает содержание обменных оснований, включая Са, в верхнем горизонте почвы за счет его мобилизации. Также возрастание кислотности почвы после пожара может быть обусловлено вымыванием зольных элементов из почвы (Potthast et al., 2017) и снижением поступления органического вещества из опада (Dai et al., 2021).
При однократном сильном пожаре свойства почв на следующий год изменились довольно существенно, снизилось содержание экстрагируемого углерода и микробного углерода. На основании этого можно предположить, что высвобождение зольных элементов может в некоторой степени происходить как за счет окисления органического вещества почвы, так и лизиса микробных клеток. Снижение интенсивности Nорг-минерализации можно трактовать как признак ингибирования микробной активности в почве. Кроме повреждения микробных клеток в результате термического воздействия можно также предположить, что деструкция азотсодержащих органических соединений может быть замедлена по принципу обратной связи (снижение минерализации органического вещества при накоплении легкодоступных для микробов минеральных форм азота в почве).
При проведении регулярного выжигания ветоши ее накопления в большом количестве не происходит и, следовательно, интенсивность пожара может быть существенно ниже, чем при однократном сильном пожаре. Почва является консервативным образованием, для существенного изменения свойств которого требуется сильное воздействие. Кроме этого, почва способна к поддержанию гомеостаза, т.е. после прекращения воздействия свойства довольно быстро могут восстанавливаться. Таким образом, многолетнее, но слабое воздействие на почву может влиять на ряд ее свойств в меньшей степени, чем однократное, но недавнее и сильное.
Снижение содержания различных форм азота – типичное явление при регулярном выжигании в естественных сообществах, связанное с прогрессирующими потерями азотных соединений при повторяющихся пожарах. Такое снижение содержания азота при длительных периодических выжиганиях отмечено для многих сообществ (Goodridge et al., 2018; Pellegrini et al., 2020). Мы не наблюдали значимого увеличения содержания подвижного Р в почве после долговременного выжигания, однако сильный однократный пожар увеличил его содержание, что было отмечено в ряде исследований (Schaller et al., 2015; Reinhart et al., 2016; Butler et al., 2018).
ЗАКЛЮЧЕНИЕ
После долговременного выжигания ветоши состав фитоценоза пестроовсяницевого луга существенно изменяется. Резко снижаются запасы ветоши, надземная биомасса сосудистых растений, участие доминантов. В надземной биомассе резко снижается доля злаков и увеличивается доля разнотравья. Для Anthemis cretica, Campanula collina, Deschampsia flexuosa, Festuca ovina, Nardus stricta и Veronica gentianoides отмечено значимое увеличение числа побегов при выжигании.
В ходе эксперимента прогрессивно увеличивалось альфа-разнообразие (флористическая насыщенность, среднее число видов сосудистых растений на площадках). Через 23 года эксперимента альфа-разнообразие примерно вдвое превышало исходное и значимо превышало показатели в контроле.
Длительное выжигание существенно не изменило среднее содержание минеральных элементов (P, Ca, Mg) в надземной биомассе большинства изученных видов, лишь содержание K снижалось у ряда видов, в то время как для Mg отмечено увеличение содержания у Festuca varia и Nardus stricta, а N. stricta показал также пограничное увеличение содержания Ca и P. В мортмассе также увеличилось содержание P и Mg.
При однократном выжигании наблюдалось существенное изменение свойств почвы – возрастание содержания Pподв, Ca и Mg, происходило накопление минеральных форм азота, но содержание экстрагируемого углерода и микробного углерода, напротив, снижалось. При длительном выжигании отмечается небольшое подкисление почвы и снижение содержания Са, а также существенное снижение содержания азота и интенсивности процессов его трансформации.
Список литературы
Бахтиярова О.Н., 2018. Методика расчета скорости распространения пожара с учетом влияния скорости ветра и рельефа местности // Науч. и образоват. проблемы гражданской защиты. № 1 (36). С. 62–68.
Буш Е.А., 1940. О результатах научных работ Юго-Осетинского горно-лугового стационара БИН АН СССР // Сов. ботаника. № 2. С. 11–29.
Габбасова И.М., Гарипов Т.Т., Сулейманов Р.Р., Комиссаров М.А., Хабиров И.К. и др., 2019. Влияние низовых пожаров на свойства и эрозию лесных почв Южного Урала (Башкирский государственный природный заповедник) // Почвоведение. № 4. С. 412–421.
Гогина Е.Е., 1961. К биоморфологии Festuca varia Haenke // Бот. журн. Т. 46. № 6. С. 824–841.
Елумеева Т.Г., 2004. Влияние удаления доминирующих видов Festuca varia Haenke и Nargus stricta L. на состав пестроовсяниценого луга // Комплексные исследования альпийских экосистем Тебердинского заповедника / Тр. Теберд. гос. биосферного заповедника. Вып. 21. М.: б.и. С. 55–61.
Елумеева Т.Г., Онипченко В.Г., 2009. Пирогенная динамика высокогорного пестроовсяницевого луга Тебердинского заповедника: многолетний эксперимент с выжиганием ветоши // Бюл. МОИП. Отд. биол. Т. 114. № 5. С. 15–20.
Кандалова Г.Т., 2009. Степи Хакасии: трансформация, восстановление, перспективы использования. Новосибирск: СО РАСХН. 163 с.
Онипченко В.Г., 1990. Фитомасса альпийских сообществ северо-западного Кавказа // Бюл. МОИП. Отд. биол. Т. 95. № 6. С. 52–62.
Онипченко В.Г., Зернов А.С., 2022. Сосудистые растения Тебердинского национального парка (аннотированный список видов). М.: Изд. Комиссии РАН по сохранению биологического разнообразия и ИПЭЭ РАН. 177 с.
Семенова-Тян-Шанская А.М., 1948. Корневые системы растений субальпийских лугов Юго-Осетии // Тр. БИН АН СССР. Сер. 3. Геоботаника. Вып. 5. С. 89–121.
Сулейманова Г.Ф., 2012. Особенности восстановления после пожара популяций пиона тонколистного (Paeonia tenuifolia L.) в национальном парке “Хвалынский” // Раритеты флоры Волжского бассейна. Тез. докл. II Росс. науч. конф. г. Тольятти, 11–13 сентября 2012 г. Тольятти: “Кассандра”. С. 241–249.
Уфимцев В.И., Куприянов О.А., Стрельникова Т.О., 2013. Влияние пожаров на продуктивность лесных лугов Караканского хребта // Вестн. КемГУ. Т. 1. № 4 (56). С. 8–12.
Федюнькин Д.Ф., 1953. Влияние мертвых растительных остатков и степных пожаров на развитие растительности лесостепного Зауралья // Изв. Естеств.-науч. ин-та при Молотовском гос. ун-те им. А.М. Горького. Т. 13. Вып. 7. С. 621–639.
Anderson T.M., Ritchie M.E., Mayemba E., Eby S., Grace J.B., McNaughton S.J., 2007a. Forage nutritive quality in the Serengeti ecosystem: The roles of fire and herbivory // Am. Nat. V. 170. № 3. P. 343–357.
Anderson T.M., Ritchie M.E., McNaughton S.J., 2007b. Rainfall and soils modify plant community response to grazing in Serengeti National Park // Ecology. V. 88. № 5. P. 1191–1201.
Beck E., Scheibe R., Schulze E.-D., 1986. Recovery from fire: Observations in the alpine vegetation of western Mt. Kilimanjaro (Tanzania) // Phytocoenologia. V. 14. № 1. P. 55–77.
Bond W.J., 2016. Ancient grasslands at risk: Highly biodiverse tropical grasslands are at risk from forest-planting efforts // Science. V. 351. № 6269. P. 120–122.
Bond W.J., Wilgen B.W., van, 1996. Fire and Plants. L.: Chapman & Hall. 253 p.
Bond W.J., Woodward F.I., Midgley G.F., 2005. The global distribution of ecosystems in a world without fire // New Phytol. V. 165. № 2. P. 525–538.
Brookes P.C., Landman A., Pruden G., Jenkinson D.S., 1985. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil // Soil Biol. Biochem. V. 17. № 6. P. 837–842.
Butler O.M., Elser J.J., Lewis T., Mackey B., Chen C., 2018. The phosphorus-rich signature of fire in the soil-plant system: A global meta-analysis // Ecol. Lett. V. 21. № 3. P. 335–344.
Butler O.M., Lewis T., Rashti M.R., Maunsell S.C., Elser J.J., Chen C., 2019. The stoichiometric legacy of fire regime regulates the roles of micro-organisms and invertebrates in decomposition // Ecology. V. 100. № 7. Art. e02732. https://doi.org/10.1002/ecy.2732
Camac J.S., Williams R.J., Wahren C.-H., Hoffmann A.A., Vesk P.A., 2017. Climatic warning strengthens a positive feedback between alpine shrubs and fire // Global Change Biol. V. 23. № 8. P. 3249–3258.
Collins S.L., Calabrese L.B., 2012. Effects of fire, grazing and topographic variation on vegetation structure in tallgrass prairie // J. Veg. Sci. V. 23. № 3. P. 563–575.
Colombaroli D., Henne P.D., Kaltenrieder P., Gobet E., Tinner W., 2010. Species responses to fire, climate, and human impact at tree line in the Alps as evidenced by paleo-environmental records and a dynamic simulation model // J. Ecol. V. 98. № 6. P. 1346–1357.
Dai W., Peng B., Liu J., Wang C., Wang X. et al., 2021. Four years of litter input manipulation changes soil microbial characteristics in a temperate mixed forest // Biogeochemistry. V. 154. № 2. P. 371–383.
Deng B., Zheng L., Ma Y., Zhang L., Liu X. et al., 2020. Effects of mixing biochar on soil N2O, CO2, and CH4 emissions after prescribed fire in alpine meadows of Wugong Mountain, China // J. Soil Sediments. V. 20. № 8. P. 3062–3072.
Dorich R.A., Nelson D.W., 1984. Evaluation of manual cadmium reduction methods for determination of nitrate in potassium chloride extracts of soils // Soil Sci. Soc. Am. J. V. 48. № 1. P. 72–75.
Feurdean A., Vasiliev I., 2019. The contribution of fire to the late Miocene spread of grasslands in eastern Eurasia (Black Sea region) // Sci. Rep. V. 9. Art. 6750. https://doi.org/10.1038/s41598-019-43094-w
Gibson C.M., Turetsky M.R., Cottenie K., Kane E.S., Houle G., Kasischke E.S., 2016. Variation in plant community composition and vegetation carbon pools a decade following a severe fire season in interior Alaska // J. Veg. Sci. V. 27. № 6. P. 1187–1197.
Goodridge B.M., Hanan E.J., Aquilera R., Wetherley E.B., Chen Y.-J. et al., 2018. Retention of nitrogen following wildfire in a chaparral ecosystem // Ecosystems. V. 21. № 8. P. 1608–1622.
Gullap M.K., Erkovan S., Erkovan H.I., Koc A., 2018. Effects of fire on litter, forage dry matter production, and forage quality in steppe vegetation of Eastern Anatolia, Turkey // J. Agric. Sci. Technol. V. 20. № 1. P. 61–70.
Hannusch H.J., Rogers W.E., Lodge A.G., Starns H.D., Tolleson D.R., 2020. Semi-arid savanna herbaceous production and diversity responses to interactive effects of droght, nitrogen deposition, and fire // J. Veg. Sci. V. 31. № 2. P. 255–265.
Higuera P.E., Chipman M.L., Barnes J.L., Urban M.A., Hu F.S., 2011. Variability of tundra fire regimes in Arctic Alaska: Millennial-scale patterns and ecological implications // Ecol. Appl. V. 21. № 8. P. 3211–3226.
Hollingsworth T.N., Breen A.L., Hewitt R.E., Mack M.C., 2021. Does fire always accelerate shrub expansion in Arctic tundra? Examining a novel grass-dominated successional trajectory on the Seward Peninsula // Arct. Antarct. Alp. Res. V. 53. № 1. P. 93–109.
Horn K.J., Wilkinson J., White S., Clair S.B.St., 2015. Desert wildfire impacts on plant community function // Plant Ecol. V. 216. № 12. P. 1623–1634.
Huang Y., Wang K., Deng B., Sun X., Zeng D.-H., 2018. Effects of fire and grazing on above-ground biomass and species diversity in recovering grasslands in northeast China // J. Veg. Sci. V. 29. № 4. P. 629–639.
Jones B.M., Kolden C.A., Jandt R., Abatzoglou J.T., Urban F., Arp C.D., 2009. Fire behavior, weather, and burn severity of the 2007 Anaktuvuk River Tundra Fire, North Slope, Alaska // Arct. Antarct. Alp. Res. V. 41. № 3. P. 309–316.
Kandeer E., 1996. Ammonium // Methods in Soil Biology. Berlin; Heidelberg: Springer-Verlag. P. 406–448.
Kitchen D.J., Blair J.M., Callahan M.A.Jr., 2009. Annual fire and mowing alter biomass, depth distribution, and C and N content of roots and soil in tallgrass prairie // Plant Soil. V. 323. № 1–2. P. 235–247.
Leach M.K., Givnish T.J., 1996. Ecological determinants of species loss in remnant prairies // Science. V. 273. P. 1555–1558.
Lee J.T., Tsai S.-M., Wu Y.-J., Lin Y.-S., Chu M.-Y., Lee M.-J., 2021. Root characteristics and water erosion-reducing ability of Alpine silver grass and Yushan cane for alpine grassland soil conservation // Sustainability. V. 13. Art. 7633. P. 1–15.
Lü X.T., Reed S., Hou S.L., Hu Y.Y., Wei H.W. et al., 2017. Temporal variability of foliar nutrients: responses to nitrogen deposition and prescribed fire in a temperate steppe // Biogeochemistry. V. 133. № 3. P. 295–305.
Mack M.C., Bret-Harte M.S., Hollingsworth T.N., Jandt R.R., Schuuur E.A.G. et al., 2011. Carbon loss from an unprecedented Arctic tundra wildfire // Nature. V. 475. Art. 7357. P. 489–492.
Mark A.F., 1994. Effects of burning and grazing on sustainable utilization of upland snow tussock (Chionochloa spp.) rangelands for pastoralism in South Island, New Zealand // Aust. J. Bot. V. 42. № 2. P. 149–161.
McLauchlan K.K., Higuera P.E., Miesel J., Rogers B.M., Schweitzer J. et al., 2020. Fire as a fundamental ecological process: Research advances and frontiers // J. Ecol. V. 108. № 5. P. 2047–2069.
Narita K., Harada K., Saito K., Sawada Y., Fukuda M., Tsuyuzaki S., 2015. Vegetation and permafrost thaw depth 10 years after a tundra fire in 2002, Seward Peninsula, Alaska // Arct. Antarct. Alp. Res. V. 47. № 3. P. 547–559.
Onipchenko V.G., Makarov M.I., Maarel E., van der, 2001. Influence of alpine plants on soil nutrient concentrations in a monoculture experiment // Folia Geobot. V. 36. № 3. P. 225–241.
Pate J.S., Dell B., 1984. Economy of mineral nutrients in Sandplain species // Kwongan: Plant Life of the Sandplain. Nedlands: Univ. Western Australia. P. 227–252.
Paudel A., Markwith S.H., Konchar K., Shrestha M., Ghimire S.K., 2020. Anthropogenic fire, vegetation structure and ethnobotanical uses in an alpine shrubland of Nepal’s Himalaya // Int. J. Wildland Fire. V. 29. № 3. P. 201–214.
Pausas J.G., Keeley J.E., Schwilk D.W., 2017. Flammability as an ecological and evolutionary driver // J. Ecol. V. 105. № 2. P. 289–297.
Peet K.R., 1992. Community structure and ecosystem function // Plant Succession: Theory and Prediction. L.: Chapman and Hall. P. 103–151.
Peet R.K., Glenn-Lewin D.C., Wolf J.W., 1983. Prediction of man’s impact on plant species diversity // Man’s Impact on Vegetation. Hague: Junk. P. 41–54.
Pellegrini A.F.A., Harder J., Georgiou K., Hemes K.S., Malhotra A. et al., 2022. Fire effects on the persistence of soil organic matter and long-term carbon storage // Nat. Geosci. V. 15. P. 5–13.
Pellegrini A.F.A., Hobbie S.E., Reich P.B., Jumpponen A., Brookshire E.N.J. et al., 2020. Repeated fire shifts carbon and nitrogen cycling by changing plant inputs and soil decomposition across ecosystems // Ecol. Monogr. V. 90. № 4. Art. e01409. https://doi.org/10.1002/ecm.1409
Pinheiro J., Bates D., DebRoy S., Sarkar D., R Core Team, 2016. nlme: Linear and nonlinear mixed effects models. R package version 3.1-128. http://CRAN.R-project.org/package=nlme
Potthast K., Meyer S., Crecelius A.C., Schubert U.S., Tischer A., Michalzik B., 2017. Land-use and fire drive temporal patterns of soil solution chemistry and nutrient fluxes // Sci. Total Environ. V. 605–606. P. 514–526.
Ratajczak Z., Churchill A.C., Ladwig L.M., Taylor J.H., Collins S.L., 2019. The combined effects of an extreme heatwave and wildfire on tallgrass prairie vegetation // J. Veg. Sci. V. 30. № 4. P. 687–697.
Reinhart K.O., Dangi S.R., Vermeire L.T., 2016. The effect of fire intensity, nutrients, soil microbes, and spatial distance on grassland productivity // Plant Soil. V. 409. № 1–2. P. 203–216.
Ryser P., Langenauer R., Gigon A., 1995. Species richness and vegetation structure in a limestone grassland after 15 years management with six biomass removal regimes // Folia Geobot. Phytotax. V. 30. № 2. P. 157–167.
Schaller J., Tischer A., Struyf E., Bremen M., Belmonte D.U., Potthast K., 2015. Fire enhances phosphorus availability in topsoils depending on binding properties // Ecology. V. 96. № 6. P. 1598–1606.
Schulze E.-D., Beck E., Müller-Hohenstein K., 2005. Plant Ecology. Berlin: Springer. 702 p.
Suazo M.M., Collins S.L., Parmenter R.R., Muldavin E., 2018. Montane valley grasslands are highly resistant to summer wildfire // J. Veg. Sci. V. 29. № 6. P. 1017–1028.
Valko O., Torok P., Deak B., Tothmeresz B., 2014. Review: Prospects and limitation of prescribed burning as a management tool in European grasslands // Basic Appl. Ecol. V. 15. № 1. P. 26–33.
Vance E.D., Brookes P.C., Jenkinson D.S., 1987. An extraction method for measuring soil microbial biomass C // Soil Biol. Biochem. V. 19. № 6. P. 703–707.
Wang G., Li J., Ravi S., Dukes D., Gonzales H.B., Sankey J.B., 2019. Post-fire redistribution of soil carbon and nitrogen at a grassland-shrubland ecotone // Ecosystems. V. 22. № 1. P. 174–188.
Williams R.J., Wahren C.-H., Tolsma A.D., Sanecki G.M., Papst W.A. et al., 2008. Large fire in Australian alpine landscapes: Their part in the historical fire regime and their impacts on alpine biodiversity // Int. J. Wildland Fire. V. 17. № 6. P. 793–808.
Wolf J.W., Peet R.K., 1980. Production and diversity in southeastern coastal plain savannas // Bull. Ecol. Soc. Amer. V. 61. № 2. P. 77.
Wragg P.D., Mielke T., Tilman D., 2018. Forbs, grasses, and grassland fire behaviour // J. Ecol. V. 106. № 5. P. 1983–2001.
Yuan Z.Y., Chen H.Y.H., 2012. Fine root dynamics with stand development in the boreal forest // Funct. Ecol. V. 26. № 4. P. 991–998.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


