Журнал общей биологии, 2023, T. 84, № 1, стр. 49-66
Эволюция вирусов в иммунизированных популяциях позвоночных животных
П. Л. Панченко *
Московский государственный университет им. М.В. Ломоносова, биологический факультет,
кафедра биологической эволюции
119991 Москва, Ленинские горы, 1, Россия
* E-mail: 15Panha@rambler.ru
Поступила в редакцию 10.06.2022
После доработки 02.12.2022
Принята к публикации 11.01.2023
- EDN: ANHFRO
- DOI: 10.31857/S0044459623010062
Аннотация
Учеными описаны тысячи видов вирусов, многие из которых являются патогенами позвоночных животных. При этом взаимодействие с адаптивной иммунной системой позвоночных теоретически должно быть одним из важнейших факторов, влияющих на ход эволюции вирусов. Обзор посвящен тому, как приобретенный иммунитет (постинфекционный и вакцинальный) влияет на важнейшие медицинские характеристики вирусных патогенов – трансмиссивность, инфекционность и вирулентность. В обзоре рассмотрены как известные реальные примеры эволюции вирусов в иммунизированных популяциях, так и теоретические статьи и результаты математического моделирования. Отдельное внимание уделено пандемии SARS-CoV-2. В конце обзора даются методические рекомендации по созданию вакцин и проведению вакцинационных кампаний в свете эволюционной проблематики.
На сегодняшний день счет описанных видов вирусов идет на тысячи (Dimmock et al., 2007), причем многие из них являются патогенами позвоночных животных, в том числе и человека. При этом двухстороннее взаимодействие с хорошо развитой адаптивной иммунной системой позвоночных должно быть одним из важнейших факторов, влияющих на ход эволюции вирусов. Вообще, многие люди традиционно полагают, что, в отличие от лекарственных средств, иммунизация практически “непробиваема” для адаптивной эволюции патогенов. Это убеждение основано на нескольких широко известных исторических примерах (натуральная оспа, чума крупного рогатого скота, корь в американском регионе ВОЗ и др.), когда с помощью широкомасштабных вакцинационных кампаний удавалось либо полностью искоренить патоген, либо значительно снизить его распространение. Кроме того, патогены действительно гораздо хуже адаптируются к вакцинации, чем к лекарственным средствам (Kennedy, Read, 2017). Однако к настоящему времени накоплен огромный массив свидетельств того, что и к иммунизации возможна эволюционная адаптация.
Но прежде чем мы перейдем к обсуждению конкретных примеров и моделей эволюции вирусов в иммунизированных популяциях, необходимо прояснить ключевую терминологию и сформировать общее понимание протекающих в этой системе процессов.
Эпидемиологически важные параметры патогенов
У вирусов (и вообще любых патогенных организмов) есть три ключевых параметра, важных с точки зрения эпидемиологии: трансмиссивность, инфекционность и вирулентность. Они тесно связаны друг с другом, но в строгом смысле могут быть определены следующим образом.
Трансмиссивность (передаваемость) – это способность передаваться от хозяина к хозяину. С функциональной точки зрения выражает количество выделяемых вовне вирусных частиц и их распространение и выживаемость в тех или иных средах.
Инфекционность (заразность) – это способность непосредственно заражать нового хозяина. С функциональной точки зрения отражает способность патогена тем или иным образом преодолевать защитные системы хозяина и закрепляться в нем.
Вирулентность (патогенность) – это способность наносить хозяину ущерб. С функциональной точки зрения отражает в первую очередь активность репликации вируса в тканях хозяина и разрушительное влияние на его иммунитет.
Следует отметить, что некоторые авторы иногда перемешивают значения этих терминов. Так, трансмиссивность и инфекционность часто являются взаимозаменяемыми и обозначают суммарную способность патогена передаваться и заражать хозяина (это связано с практической сложностью разделения этих процессов при исследовании патогенов в живом материале). Вирулентностью, в свою очередь, иногда называют способность преодолевать защитные системы хозяина – по сути все ту же инфекционность. Однако в данном обзоре я буду придерживаться, насколько это возможно, представленного выше строгого понимания этих терминов, а все отклонения (например, при цитировании статей других авторов) указывать отдельно в явном виде.
Совершенная и несовершенная иммунизация
Следует также учитывать, что вырабатываемый к патогену иммунитет хозяина бывает разным. С эпидемиологической точки зрения выделяются два основных типа иммунитета – совершенный (“perfect”), он же стерилизующий (“sterilizing”), и несовершенный (“imperfect”), он же протекающий (“leaky”).
Совершенный (стерилизующий) иммунитет – это иммунитет, препятствующий инфицированию иммунизированного носителя и/или распространению (по крайней мере достаточно долгому и обильному) патогена иммунизированным носителем. Примеры патогенов, к которым возможен практически совершенный иммунитет (95%+): натуральная оспа, чума КРС, полиомиелит.
Несовершенный (протекающий) иммунитет – это иммунитет, не мешающий патогену инфицировать иммунизированного носителя и/или распространяться им, хотя, возможно, снижающий симптоматику заболевания (например, через связывание токсинов или частичное снижение репликации). Примеры патогенов, к которым показан только несовершенный иммунитет: MDV, IBV, SARS-CoV-2 (штамм Дельта).
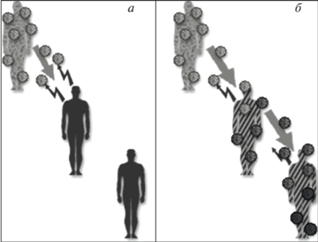
Нетрудно заметить (рис. 1), что совершенная иммунизация, блокируя освоение патогеном иммунизированных хозяев, во-первых, способна привести популяцию к групповому иммунитету, а во-вторых, по сути делает эволюцию вируса в такой популяции невозможной (нет репликации – нет эволюции).
Рис. 1.
Совершенный и несовершенный иммунитет и эволюция вирусов: a – совершенный иммунитет, передача практически невозможна, как следствие – адаптивная эволюция практически невозможна, групповой иммунитет возможен; б – несовершенный иммунитет, передача ограничена недостаточно (эффективное репродуктивное число не опускается ниже 1), как следствие – адаптивная эволюция практически неизбежна, групповой иммунитет невозможен.
Несовершенная иммунизация, в свою очередь, может оказаться не только неспособной дать групповой иммунитет и, соответственно, остановить адаптивную эволюцию вируса, но и потенциально может ей способствовать. Вообще, эффективность иммунизации в создании группового иммунитета в отсутствии эволюционной адаптации вируса будет зависеть не только от ее собственных характеристик, но и от R0 (базового репродуктивного числа) вируса – чем выше R0, тем более совершенный иммунитет и/или больший охват иммунизации нужен для элиминации патогена (Plans Rubió, 2012).
По аналогии с иммунитетом выделяют два типа вакцин – совершенные и протекающие. Впрочем, следует отметить, что и в случае с иммунитетом, и в случае с вакцинами корректнее говорить не о двух типах, а скорее о двух краях спектра, а способность блокировать трансмиссию и/или заражение рассматривать вероятностно (например, в процентном выражении – какой процент предварительно иммунизированных особей оказался незаразен при инфицировании или вовсе невосприимчив к заражению).
Эволюционные стратегии вирусов в иммунизированных популяциях и эволюционный динамический баланс вирулентности
В адаптации вирусов к иммунизированным хозяевам можно выделить две основные стратегии, не исключающие друг друга (рис. 2).
Рис. 2.
Две принципиальные (но не взаимоисключающие) эволюционные стратегии вирусов в иммунизированных популяциях. Избегание – вирус эволюционирует в направлении избегания узнавания иммунитетом хозяина (antigenic escape) или избегания контакта с иммунитетом как такового (например, через изменение тканевого тропизма на иммунопривилегированные ткани) => если общая вирулентность и меняется, то по косвенным причинам. Борьба – вирус эволюционирует в направлении активной борьбы с иммунитетом хозяина, наращивает активность репликации и т.д. => повышение вирулентности (и зачастую инфекционности) является прямым следствием адаптаций вируса.

Первая стратегия – которую можно условно назвать “избегание” – представлена в первую очередь механизмом, называемым “антигенное ускользание” (“antigenic escape”), суть которого состоит в постоянном положительном отборе таких мутаций в антигенных локусах вируса, которые снижают их узнавание иммунитетом организма-хозяина. При этом вирулентность вируса хотя и может меняться, но по косвенным причинам. В теории, впрочем, есть и более агрессивный (способствующий вирулентности) механизм избегания – изменение тканевого тропизма вируса на иммунопривилегированные ткани, например, на нервную.
Вторая стратегия – которую можно условно назвать “борьба” – основана на механизмах наращивания активности репликации и подавления иммунитета хозяина, что неизбежно будет приводить к повышению вирулентности.
Для более полного понимания эволюционного наращивания вирулентности рассмотрим баланс процессов, определяющих оптимальную вирулентность патогена (рис. 3).
Рис. 3.
Баланс процессов, определяющих вирулентность. a – процессы, протекающие внутри хозяина: 1 – репликация; 2 – избегание и/или подавление иммунитета при репликации; 3 – различные побочные реакции организма на вирус, его фрагменты и/или метаболиты зараженных клеток. б – процессы, протекающие между хозяевами: 4 – трансмиссия; 5 – избегание и/или подавление иммунитета при заражении.

В первом приближении можно представить, что процессы, протекающие внутри хозяина (репликация и борьба с иммунитетом хозяина), создают давление отбора на наращивание вирулентности, в то время как трансмиссия между хозяевами – на снижение до определенного значения, при котором у вызываемого патогеном заболевания остаются только те симптомы, которые способствуют трансмиссии (кашель, заразные выделения и т.д.), причем это значение будет непосредственно зависеть от способа трансмиссии (Ewald, 1991, 1993; Day, 2001). Однако при более подробном рассмотрении мы увидим, что ситуация на деле оказывается сложнее. Во-первых, не стоит забывать о вирулентности, которая не несет никакой очевидной пользы для патогена и, скорее всего, является просто побочным результатом его жизнедеятельности (рис. 3a, 3) – например, цитокиновый шторм, вызываемый некоторыми штаммами вируса гриппа, лихорадкой денге, геморрагической лихорадкой Эбола и другими вирусами (Liu et al., 2016; Wong et al., 2017), способен очень быстро убить носителя вируса, что может быть даже вредно для патогена с точки зрения трансмиссии. Такую вирулентность, хотя она и порождается его жизнедеятельностью внутри хозяина, вирус, при ее значимости, будет снижать под действием отбора – если, конечно, ему это позволит его генетическая архитектура. Во-вторых, в отсутствие смертности, иммобилизации и других явно снижающих трансмиссию патологий, процесс передачи (рис. 3б, 4) будет идти тем лучше, чем выше вирусная нагрузка (и, соответственно, интенсивнее репликация), а процесс заражения может быть напрямую связан с подавлением иммунитета хозяина (рис. 3б, 5) – таким образом, оптимальной для передачи может являться и весьма высокая вирулентность, особенно если плотность носителей достаточно высока, чтобы пренебречь их состоянием вовсе. При этом надо понимать, что оптимальный баланс, если он вообще достижим для конкретного патогена с конкретной генетической архитектурой, не стабилен – он будет постоянно изменяться вслед за изменением условий жизни хозяев и их собственной эволюцией или замещением, вслед за климатическими изменениями среды и другими внешними факторами, влияющими на данную систему.
Учитывая вышеизложенное, можно заключить, что массовая несовершенная иммунизация носителей может способствовать эволюционному повышению вирулентности патогена в ходе эволюции, причем двумя способами. Во-первых, давление со стороны иммунитета внутри носителя усиливает отбор на его подавление и избегание. Во-вторых, более высокая выживаемость иммунизированных носителей ослабляет отбор против патогенов, чрезмерно вирулентных против наивных носителей. Оба этих механизма действуют однонаправленно.
ИЗВЕСТНЫЕ ПРИМЕРЫ ЭВОЛЮЦИИ ВИРУСОВ В ИММУНИЗИРОВАННЫХ ПОПУЛЯЦИЯХ
Рассмотрев общую логику взаимодействий вирусов и адаптивного иммунитета позвоночных животных, перейдем к рассмотрению конкретных примеров, противоречащих традиционной концепции “эволюциенепробиваемости” иммунизации (Kennedy, Read, 2017). При ознакомлении с примерами следует обратить внимание, что в то время как часть вирусов (например, MDV) идет по пути наращивания вирулентности, другая (вероятно, бо́льшая) – по пути антигенного убегания, а иногда вирус идет по обоим путям сразу, поскольку они в общем случае друг другу не противоречат. Важно также и то, что предсказать путь a priori, из общих соображений – весьма затруднительно, потому что все зависит от генетической архитектуры вируса и от непосредственных взаимодействий вируса с иммунитетом хозяев.
Вирус болезни Марека (MDV)
Вирус болезни Марека (MDV, сем. Herpesviridae, дцДНК-содержащий) – альфагерпесвирус кур, передающийся через перхоть инфицированных птиц, которую новый носитель должен вдохнуть для заражения. Как и другие герпесвирусы, имеет латентную фазу в жизненном цикле и способен к трансформации клеток хозяина.
В силу своего хозяйственного значения MDV имеет хорошо задокументированную историю эволюционного наращивания вирулентности в ответ на изменение условий содержания хозяев и на проведение массовых вакцинационных кампаний (Davison, Nair, 2004; Aviagen, 2017), в том числе с прямыми экспериментальными подтверждениями влияния иммунизации хозяев на эволюцию вируса (Read et al., 2015).
Рассмотрим общую хронологию событий (по: Davison, Nair, 2004; Aviagen, 2017) – от первого описания вируса до его современного состояния (актуальна в первую очередь для США):
– 1907 г. – первое описание, принадлежащее перу венгерского ветеринара Йожефа Марека. Описанный вирус поражает в основном старых кур, вызывает воспаление периферических нервов. Летальные случаи крайне редки.
– 1960-е – интенсификация птицеводства, из-за которой птицы начинают жить большими, тесными скоплениями, но при этом куда быстрее идут на убой, приводит к первичному наращиванию агрессивности вируса и изменению клинической картины. Вирус начинает вызывать лимфомы в нервной ткани, внутренних органах и коже, в том числе у молодых кур, летальность возрастает (в некоторых популяциях яйценосных кур – до 60% в течение нескольких месяцев, но у бройлеров – низкая в связи с их и без того недолгим сроком жизни).
– 1970-e – в США разработана и внедрена первая вакцина на основе герпесвируса индеек (HVT), близкородственного MDV. Вакцина оказывается протекающей, но успешно защищает от образования опухолей и смерти.
– 1980-е – привитые куры (в том числе бройлеры) активно болеют новыми штаммами MDV, что приводит к разработке новой вакцины – на основе HVT и штамма SB-1 MDV (HVT+SB-1).
– 1990-е – привитые HVT+SB-1 куры снова болеют новыми штаммами, что приводит к массовому использованию вакцины на основе авирулентного штамма Rispens CVI-988 (в Европе известен с 1972 г.).
– XXI в. – новые штаммы и новые вакцины, хотя старые (в том числе самая первая на основе чистого HVT) тоже применяются до сих пор (в основном для бройлеров). Современные штаммы MDV поражают кур любого возраста, способны нарушать регуляцию иммунной системы, вызывая иммунодефицит, в том числе вообще без образования опухолей, что затрудняет раннюю диагностику. Летальность некоторых современных штаммов для непривитых кур – 100% в течение 10 дней. При этом вакцинация защищает от образования опухолей и быстрой смерти, но не защищает от постепенно развивающегося иммунодефицита.
Анализ хронологии показывает два кардинальных эволюционных подъема вирулентности вируса: в 1960-х, во время интенсификации птицеводства и, по сути, появления этой индустрии в том виде, в котором мы знаем ее сейчас, и с 1980-х по наши дни, во время массового внедрения протекающих вакцин от MDV.
Первый подъем вирулентности представляется логичным следствием скученного проживания множества бройлеров и их раннего убоя: во-первых, такой метод ведения хозяйства значительно снизил давление отбора против излишне патогенных штаммов, во-вторых, он мог даже поспособствовать штаммам, способным в кратчайшие сроки использовать максимум ресурсов своих хозяев и нарастить максимально возможную вирусную нагрузку для наиболее активного распространения.
Гораздо больший интерес в контексте данного обзора представляет второй подъем вирулентности, который, следуя описанным в первом разделе принципам, можно отнести на счет массовой вакцинационной кампании с применением протекающих вакцин. При этом вклад вакцинации носителей в эволюцию вирусов показан экспериментально (Read et al., 2015). Например, показано, что иммунизация протекающими вакцинами, компенсируя гиперпатогенность особо вирулентных штаммов и защищая их носителей от слишком быстрой смерти, дает инфицированным такими штаммами вакцинированным птицам возможность распространить значительное количество вирусных частиц, в то время как невакцинированные птицы умирают слишком быстро (рис. 4). Примечательно, что единственным использованным в данной работе штаммом, для которого вакцинация снижает количество выделяемых вирусных частиц, оказывается наименее вирулентный из них (HPRS-B14), в то время как все остальные использованные штаммы от вакцинации по сути только выигрывают.
Рис. 4.
Влияние вакцинации на смертность кур и распространение вирионов пяти штаммов MDV (по: Read et al., 2015, с изменениями). Группы из 20 цыплят породы Красный род-айланд были вакцинированы HVT (сплошные линии, черное затенение) или не вакцинированы (пунктирные линии, серое затенение) в возрасте 1 дня и заражены штаммами HPRS-B14, 571, 595, Md5 или 675A через 8 дней. Штаммы MDV различаются по вирулентности у невакцинированных хозяев, вакцинация защищает от смерти (верхние панели, штаммы расположены слева направо в порядке возрастания вирулентности). Вакцинация снижает концентрацию вируса в перхоти, но, поддерживая жизнь хозяев, продлевает инфекционные периоды гиперпатогенных штаммов MDV (средние панели). Это означает, что общее количество копий генома вируса, выделяемых одной инфицированной птицей, снижается вакцинацией в случае заражения наименее вирулентным штаммом и увеличивается на несколько порядков при заражении наиболее вирулентным (нижние панели). Планки погрешностей и затененные области показывают 95%-ный доверительный интервал.

Помощь иммунизации в распространении гиперпатогенных штаммов показана и напрямую, в экспериментах с зараженными вакцинированными и невакцинированными птицами и совместно содержащимися с ними птицами-часовыми (рис. 5). Также показано положительное влияние вакцинации материнских птиц на распространение вируса дочерними (из-за передачи материнских антител, работающих аналогично несовершенной иммунизации самих дочерних птиц) и передача гиперпатогенных штаммов непосредственно HVT-вакцинированными коммерческими бройлерами, полученными от Rispens-вакцинированных матерей. Все это указывает на то, что массовая несовершенная иммунизация в данном случае создает благоприятные условия для распространения гипервирулентных штаммов, подавляя при этом штаммы меньшей вирулентности.
Рис. 5.
Вакцинация усиливает трансмиссию гиперпатогенных штаммов MDV (по: Read et al., 2015, с изменениями). Группы из 10 птиц были вакцинированы HVT (сплошные линии) или не вакцинированы (пунктирные линии) и экспериментально инфицированы одним из трех особо вирулентных штаммов MDV, 595 (белый), Md5 (серый) и 675A (черный), после чего поселены вместе с 10 невакцинированными птицами-часовыми. Вакцинация продлила выживание экспериментально инфицированных птиц (а) и привела к тому, что птицы-часовые заразились (б) и вследствие этого погибли (в). На б и в сплошными линиями обозначены группы часовых, содержащиеся вместе с вакцинированными экспериментально инфицированными птицами, а пунктирными линиями обозначены группы часовых, содержащиеся вместе с невакцинированными экспериментально инфицированными птицами.

Интересно, что сравнительный генетический анализ различных штаммов MDV (Shamblin et al., 2004) показывает, что мутации, повышающие вирулентность некоторых особо агрессивных штаммов, находятся по большей части не в связанных с литической фазой антигенах, на которые нацелены вакцины, а в гене Meq, который экспрессируется в основном в латентной фазе и обеспечивает трансформацию клеток хозяина (Liu, Kung, 2000). Это позволяет предположить, что наращивание вирулентности в данном случае не является побочным эффектом антигенного ускользания, а является непосредственным результатом отбора на сопротивление иммунной системе в ответ на иммуннизацию популяции носителей, а также, вероятно, на увеличение трансмиссивности в условиях сниженного иммунизацией давления отбора против вирулентности.
Вирус кошачьего калицивироза (FCV)
Вирус кошачьего калицивироза (FCV, сем. Caliciviridae, +РНК-содержащий) – калицивирус кошек, способный распространяться множеством способов: с выделениями, по воздуху, через контаминированные предметы (Radford et al., 2006, 2007).
Для FCV характерно большое генетическое и антигенное разнообразие, но высокая кросс-реактивность иммунитета между штаммами заставляет считать их одной геногруппой и одним серотипом. FCV способен к рекомбинации внутри носителя при одновременном поражении последнего несколькими штаммами вируса (Coyne et al., 2006).
Существующие на данный момент вакцины – протекающие, и защищают в основном от клинических проявлений заболевания, не мешая распространению вируса. Впрочем, в норме FCV и так не слишком вирулентен и опасен в основном для молодых кошек, вызывая, в зависимости от штамма, целый спектр симптомов – от типичных язв на слизистых рта и носоглотки, а также признаков заболевания верхних дыхательных путей, до неявных инфекций и хромоты. Существуют и хронические формы (Radford et al., 2006).
В последние годы в питомниках стали регулярно случаться вспышки штаммов VS-FCV (virulent systemic FCV), обладающих крайне высокой вирулентностью и летальностью даже среди взрослых вакцинированных животных (Read, 2016). Филогенетический анализ показывает, что штаммы VS-FCV не формируют единую кладу и регулярно возникают независимо, причем вирулентность, судя по всему, каждый раз наращивается разными мутациями (Ossiboff et al., 2007).
Кроме того, показано, что FCV активно эволюционирует во время длительных инфекций, причем множественные мутационные изменения в антигенных локусах и ассоциированные изменения непосредственно антигенности вируса говорят об адаптации к иммунитету хозяина как одном из важнейших направлений такой эволюции (Radford et al., 2006). Причем успешное антигенное ускользание от иммунитета позволяет вирусу продлить срок инфекции, что, в свою очередь, позволяет ему эволюционировать в том же хозяине еще какое-то время, в итоге, при достаточно высокой вирусной нагрузке, превращая хронически больных кошек в своего рода “эволюционный реактор”. Кроме того, некоторые постоянно больные кошки, вероятно, болеют не хронически одним и тем же штаммом, а подвержены регулярным реинфекциям разными штаммами. Как итог – популяции кошек оказываются вместилищем множества разнообразных штаммов FCV (до 19% разницы между штаммами внутри одной популяции при типичных различиях между штаммами из разных популяций в 20–40%). При этом как регулярная вакцинация, так и постинфекционная иммунизация оказываются неспособны справиться с постоянным присутствием патогена в популяциях носителей (Radford et al., 2006).
Вирус инфекционного бронхита птиц (IBV)
Вирус инфекционного бронхита птиц (IBV, сем. Coronaviridae, +РНК-содержащий) – гаммакоронавирус птиц, распространяемый воздушно-капельным путем, а также через зараженные еду, воду и фекалии. Вызывает различные респираторные симптомы и поражение мочеполовой системы, также способен поражать кишечник. Особенно тяжело поражаются молодые особи. IBV вызывает осложнения у 100% заболевших невакцинированных кур, летальность – до 60% (в зависимости от штамма) у невакцинированных кур (Franzo et al., 2019; Legnardi et al., 2020).
По современной классификации IBV представлен 32 линиями, объединяемыми в 6 геногрупп (Legnardi et al., 2020). Кросс-реактивность иммунитета между линиями довольно низкая (Franzo et al., 2019), поэтому сейчас разработаны живые вакцины, состоящие из нескольких штаммов сразу. При этом, как и другие коронавирусы, IBV способен к рекомбинации внутри хозяина при одновременном поражении последнего несколькими разными штаммами (Lai, 1996).
Существует ряд наблюдений (Legnardi et al., 2020), которые говорят о том, что разные штаммы IBV имеют разную тропность к разным тканям носителя: например, штамм, количественно доминирующий в подготовленной полиштаммовой вакцине, после инъекции в организм носителя может занять весьма ограниченное пространство в пределах ткани конкретного типа. В связи с этим можно предположить, что на эволюцию вируса может оказывать влияние не только носитель и его иммунитет в целом, но и условия конкретной тканевой микросреды.
Одним из самых изменчивых участков генома IBV в частноти и коронавирусов в целом является субъединица S1 S-белка, которая содержит по крайней мере два участка, задействованных в связывании с рецепторами клеток хозяина, и является главной мишенью вируснейтрализующих антител (Legnardi et al., 2020). Биоинформатический анализ показывает явные следы отбора в этом локусе при проведении вакцинационных кампаний среди бройлеров, зараженных IBV (Franzo et al., 2019). При сравнении мутаций, возникающих у вируса при проведении через вакцинированных и невакцинированных кур, оказывается, что несинонимичные мутации возникают только внутри вакцинированных птиц (Legnardi et al., 2020).
Все это позволяет сделать вывод о том, что для IBV иммунный отбор является одним из важнейших эволюционных факторов, определяющих разнообразие и эволюционную динамику штаммов. Примечательно, что вирус, судя по всему, в большой степени идет по пути антигенного убегания, нежели чем по пути наращивания вирулентности.
Другие примеры, заслуживающие внимания
Вирус гепатита C (HCV, сем. Flaviviridae, +РНК-содержащий) – флавивирус человека и шимпанзе, вызывающий хроническое поражение печени, некоторых иммунных клеток, кардиомиоцитов и микроглии. Постоянно эволюционирует во взаимодействии с иммунитетом хозяина. Одно из примечательных исследований последних лет показало, что на нейтрализацию вируса антителами, аффинными к консервативным эпитопам, могут оказывать влияние экстраэпитопные мутации в неконсервативных участках – за счет изменения взаимодействий целевого белка с ко-рецептором на структурном уровне (El-Diwany et al., 2017). Это исследование представляется крайне важным в контексте разработки вакцин и препаратов на основе моноклональных антител и в очередной раз говорит о важности учета генетической архитектуры патогена.
Птичий метапневмовирус (AMPV, сем. Pneumoviridae, –РНК-содержащий) – пневмовирус птиц, вызывающий в первую очередь респираторное заболевание, но также иногда поражающий глаза. Особенно активно поражает индеек. Показано, что вирус изменил некоторые эпитопы, узнаваемые Т-клетками, после начала использования вакцин (Cecchinato et al., 2010).
Цирковирус свиней 2 типа (PCV2, сем. Circoviridae, оцДНК-содержащий) – цирковирус свиней, поражающий множество разных типов клеток, включая гепатоциты, кардиомиоциты и макрофагов, и вызывающий целый спектр симптомов, в первую очередь у поросят. Исследования на привитых и непривитых домашних свиньях, а также на диких кабанах, показали, что эпитопы капсида вируса подверглись сильному иммунному отбору в популяциях вакцинированных свиней и привели к антигенному ускользанию (Franzo et al., 2016).
Ключевые выводы из раздела
Рассмотренные примеры эволюции вирусов в иммунизированных популяциях показывают, что для разных вирусов, в зависимости от их генетической архитектуры, жизненного цикла, доступных для иммунитета хозяина антигенов и других частных параметров, характерно разное соотношение избегания и борьбы в их эволюции. Тем не менее все описанные в данном разделе патогены так или иначе успешно адаптируются к иммунизированным носителям и не могут быть полностью искоренены проводимыми в настоящий момент вакцинационными кампаниями, хотя вакцинация и снижает проявления вызываемых ими заболеваний и связанные с ними экономические издержки. В связи с этим можно сделать вывод, что для предсказания наиболее вероятных путей эволюции того или иного патогена надо четко представлять его и его среду на структурном и функциональном уровнях – общие соображения позволят представить лишь первое приближение.
КОНЦЕПЦИИ И МОДЕЛИРОВАНИЕ ЭВОЛЮЦИИ ВИРУСОВ В ИММУНИЗИРОВАННЫХ ПОПУЛЯЦИЯХ
В предыдущем разделе рассмотрены некоторые известные реальные примеры эволюции вирусов в иммунизированных популяциях. В настоящем разделе мы рассмотрим некоторые обобщающие концепции и математические модели, разработанные эволюционной эпидемиологией на данный момент.
Филодинамический подход и “иммунная Златовласка”
Филодинамический подход (Grenfell et al., 2004) является попыткой связать влияние иммунитета носителя, эпидемиологических параметров (например, структуры популяции носителей) и эволюционных событий (например, бутылочных горлышек при передаче вируса следующему носителю) в единую концепцию и объяснить с их помощью различные филогенетические паттерны, наблюдаемые у РНК-содержащих вирусов позвоночных животных. Так, авторы показывают, что структура филогенетических деревьев вирусов, не способных адаптироваться к иммунизированным носителям (например, кори), будет определяться только эпидемиологией заболевания и выглядеть относительно случайной (рис. 6г). Структура филогенетических деревьев быстро передающихся вирусов, постоянно находящихся в процессе антигенного ускользания (например, вируса гриппа А), напротив, будет определяться в первую очередь иммунным отбором и выглядеть как четкая последовательность ответвляющихся друг от друга клад (рис. 6д). Структуру филогенетических деревьев вирусов, передающихся относительно редко и вызывающих длительные, хронические заболевания (например, ВИЧ-1), следует представлять на двух уровнях: на уровне популяции вируса в целом, на котором структура определяется скорее эпидемиологией (рис. 6е), и на уровне субпопуляции, взятой из одного носителя, на котором в структуре видны четкие следы иммунного отбора (рис. 6ж). Наконец, следует отдельно выделить вирусы, для которых характерно антителозависимое усиление инфекции (АЗУИ), способствующее чрезмерно быстрой иммобилизации и смерти носителя (например, вирус денге) – для структуры филогенетических деревьев таких вирусов характерно быстрое антигенное разбегание штаммов друг от друга (рис. 6з).
Рис. 6.
Филодинамический подход (по: Grenfell et al., 2004, с изменениями). а – вспышки кори до массовой вакцинации: еженедельные отчеты о случаях заболевания в Лидсе, Великобритания. б – еженедельные отчеты о гриппоподобных заболеваниях во Франции. в – диагностированные случаи ВИЧ в Великобритании по годам. г – филогения кори: ген нуклеокапсида вируса кори. д – филогения гриппа: ген гемагглютинина (HA1) вируса гриппа человека А (подтип H3N2), данные собирались в течение 32 лет. е – филогения ВИЧ-1: ген оболочки подтипа B (E), взятый у разных пациентов. ж – филогения ВИЧ-1 внутри одного хозяина: ген оболочки (E), образцы собирались из одного пациента в течение 5.8 лет. з – филогения вируса денге: ген оболочки вируса денге (всех четырех серотипов). Все последовательности были собраны из GenBank и построены деревья с максимальной вероятностью в PAUP*. Длины горизонтальных ветвей пропорциональны числу замен на локус.

Идея о неслучайности филогенетических паттернов в эволюции вирусов может оказаться продуктивной с практической точки зрения – понимание принципов формирования паттернов может помочь, например, понять, способен ли тот или иной вирус к адаптации к иммунизированным носителям, просто построив качественное филогенетическое дерево по разумно подобранным генам.
Еще одной перспективной идеей, разработанной в рамках филодинамического подхода, представляется концепция, которую можно, по аналогии с астрономической “зоной Златовласки”, назвать зоной “иммунной Златовласки”. Авторы (Grenfell et al., 2004) определяют так называемый Профиль Эволюционной Инфекционности (ПЭИ), который, объединяя давление отбора со стороны иммунитета, вирусную нагрузку и адаптированность вирусов к иммунитету хозяина, показывает темпы трансмиссии иммунологически отобранных штаммов. Далее авторы демонстрируют, что наиболее высоким ПЭИ будет в случае промежуточной иммунизации носителей, поскольку при полном отсутствии иммунизации будет недостаточно силен отбор, а при полной иммунизации – недостаточно высока вирусная нагрузка (рис. 7). Соответственно, в той или иной конкретной ситуации повышение давления со стороны иммунитета может как увеличить, так и снизить скорость адаптации патогена.
Рис. 7.
Концепция иммунной Златовласки (по: Grenfell et al., 2004, с изменениями). а – схематическая диаграмма статической филодинамической модели адаптации вируса как функции среднего иммунного давления. Цифры соответствуют филодинамическим паттернам: 1) отсутствие эффективного ответа и отсутствие адаптации; 2) низкое иммунное давление и низкая адаптация; 3) средняя иммунная нагрузка и высокая адаптация; 4) высокое иммунное давление и низкая адаптация; и 5) чрезмерное иммунное давление и отсутствие адаптации. б – филодинамическая модель, учитывающая вирусную и иммунную кинетику внутри хозяина. Время измеряется в днях от заражения. Вверху: схематическая вирусная и иммунологическая траектории у отдельных хозяев, основанная на экспериментальном заражении лошадей лошадиным вирусом гриппа. Внизу: соответствующие ПЭИ. Левая, центральная и правая колонки соответственно показывают течение инфекции у наивных, промежуточно иммунных и полностью иммунных носителей.

Математические модели эволюции вирусов в иммунизированных популяциях
В настоящее время эволюционными эпидемиологами разработан целый ряд моделей эволюции вирусов в ответ на вакцинацию. Рассмотрим некоторые из них.
Модель эволюции активности репликации вируса в ответ на вакцинацию (André, Gandon, 2006) интересна тем, что пытается отразить динамику внутри хозяев – репликация вируса представлена не просто неким выходным числом, но функцией, а иммунитет носителя, в свою очередь, смоделирован в форме функции репликации иммунных клеток. Однако в данной модели единственный возможный эволюционный ответ вируса на давление со стороны иммунитета – это наращивание активности репликации, в то время как ни подавление иммунитета, ни его избегание не учтены (хотя авторы и приводят некоторые доводы в пользу того, что антигенное ускользание можно было бы смоделировать аналогичным образом).
Эта модель дает несколько стоящих внимания выводов, которые можно было бы попытаться проверить экспериментально. Во-первых, при ее допущениях вакцинация протекающими вакцинами способна приводить к появлению более вирулентных штаммов, в то время как дающие достаточно сильный иммунитет вакцины способны полностью искоренить патоген. Во-вторых, при определенной степени провакцинированности в популяции могут сосуществовать штаммы с разным уровнем вирулентности – слабовирулентные, адаптированные к наивным хозяевам, и сильновирулентные, адаптированные в той или иной степени и к наивным, и к иммунизированным хозяевам. В-третьих, наименьшая смертность носителей в ряде случаев может достигаться промежуточной степенью провакцинированности, а не полной вакцинацией всей популяции.
Модель эволюции вирулентности при различной пространственной структуре популяции носителей (Zurita-Gutiérrez, Lion, 2015) подробно прорабатывает вопрос о разном влиянии гомогенных и гетерогенных пространств, в которых размещены вакцинированные и невакцинированные носители, на эволюцию вирусов. Хотя в этой модели никак не проработана динамика внутри носителей, а допущение о том, что однажды заболевшие носители в принципе не выздоравливают, может показаться странным с биологической точки зрения (по крайней мере, если мы говорим о патогенах с высокой частотой передачи и острым вызываемым заболеванием), она ценна выводом о том, что вакцины с одинаковым уровнем эффективности по-разному влияют на эволюцию вирусов в разных пространствах. Как минимум, она указывает на то, что организация пространства является фактором, заслуживающим внимания в эволюционно-эпидемиологических моделях.
Модель эволюции вирулентности при антигенном ускользании (Sasaki et al., 2022) хороша в первую очередь тем, что не пытается моделировать ситуацию установившегося баланса для эндемичного патогена, как это делают многие классические модели, вместо этого авторы подошли к проблеме более широко.
Ключевым выводом этой модели можно считать то, что система с патогеном, способным к антигенному ускользанию, может в принципе не достигать равновесия (эндемичности) и генерировать постоянные вспышки заболеваемости новыми штаммами, причем начало каждой такой вспышки, открывая перед вирусом новую нишу (ранее иммунных носителей), может способствовать наращиванию вирулентности, позволяющей освоить эту нишу быстрее других, конкурентных линий. Таким образом, даже антигенное ускользание может косвенно способствовать наращиванию вирулентности – по сути, оно раз за разом “перезапускает” эпидемию с начала.
Комментарии к разделу
Филодинамический подход и вытекающие из него идеи выглядят весьма перспективными как с фундаментальной, так и с практической точек зрения, и кажутся шагом в правильном направлении.
Что касается имеющихся на данный момент математических моделей, то они оставляют двоякие ощущения. С одной стороны, в них достаточно подробно проработаны отдельные аспекты (взаимодействие иммунитета и хозяина, влияние пространственной гетерогенности популяции носителей и т.д.), с другой стороны, каждая из рассмотренных моделей имеет огромное количество допущений и упрощений, подрывающих как их прогностическую ценность даже в качестве “первого приближения”, так и их описательную ценность как собственно исследовательских моделей, поскольку они, в сущности, моделируют нечто совсем иное, не соответствующее или не вполне соответствующее биологическим реалиям.
Эту проблему можно было бы решить созданием значительно более сложных моделей, учитывающих максимум параметров и процессов, протекающих как внутри, так и между носителями, однако такие модели будут крайне требовательными с точки зрения вычислительных мощностей, если мы попытаемся смоделировать реальные популяции носителей с минимальным временным шагом, насчитывающие подчас десятки и сотни миллионов непрерывно взаимодействующих в сложных пространствах особей (Thomine et al., 2021; Crépey et al., 2022), а также постоянные точечные мутации вирусных патогенов, изменяющие те или иные их характеристики, и взаимодействие патогенов с иммунной системой носителей. С другой стороны, проблему вычислительных мощностей можно обойти при помощи различных методов. В простейшем виде – при помощи разбиения сложной модели на более простые, с высчитыванием таблиц (либо простых аппроксимационных функций), сопоставляющих входные и выходные значения для этих простых моделей, и объединением таких таблиц (функций) в единую систему – хотя каждую простую модель все равно придется реализовать отдельно некоторое количество раз, сборная модель будет значительно менее требовательной (за счет снятия необходимости полностью просчитывать простые модели для индивидуумов в реальном времени) и позволит имитировать гораздо больше объектов и процессов при тех же мощностях. На данный момент существует множество способов упрощения вычислений (аппроксимаций) моделей без значимого изменения их поведения, объединенных под общим понятием Model Order Reduction (MOR) (Antoulas, 2004; Chinesta et al., 2017), ждущих своего применения в эволюционной эпидемиологии.
SARS-COV-2: ЭВОЛЮЦИЯ ПОД ПРИСТАЛЬНЫМ НАБЛЮДЕНИЕМ
Новая коронавирусная инфекция (SARS-CoV-2, сем. Coronaviridae, +РНК-содержащий) – бетакоронавирус человека и животных, распространяемый в первую очередь воздушно-капельным путем. Вызывает болезнь COVID-19, проявляющуюся в типе в виде ОРЗ с потерей обоняния и вкуса либо в виде кишечной инфекции. У абсолютного большинства носителей проходит в легкой форме или вообще бессимптомно, но у небольшого процента людей вызывает тяжелые системные поражения организма вплоть до летального исхода. У некоторых переболевших (в первую очередь тяжелой формой) COVID-19 людей развивается так называемый постковидный синдром (“long COVID”), характеризующийся длительным (в отдельных случаях до шести месяцев и более) сохранением тех или иных симптомов заболевания.
Для тяжелой формы заболевания показаны четкие факторы риска – пожилой возраст (старше 60 лет), ожирение, гипертония и болезни сердечно-сосудистой системы, диабет, хронические респираторные заболевания и раковые заболевания (WHO, 2020).
Ключевой рецептор, необходимый для попадания в клетку, – ангиотензинпревращающий фермент 2 (АПФ2/ACE2), но также необходим TMPRSS2 (Ragia, Manolopoulos, 2020; Scudellari, 2021).
В настоящее время существует несколько широко используемых вакцин от SARS-CoV-2. Они не дают совершенного иммунитета, и их эффективность снижается с распространением новых штаммов вируса (подробнее см. в соответствующих подразделах).
SARS-CoV-2: “неправильный” патоген
SARS-CoV-2 и вызываемое им заболевание COVID-19 имеют ряд особенностей, резко выделяющих их среди других ОРВИ.
Первой особенностью является форма кривой смертности от COVID-19, которая по сути повторяет форму кривой естественной смертности от всех причин, за тем исключением, что от COVID-19 практически не умирают дети младшего возраста (Swiss Policy Research, 2020, 2021). Такая форма кривой весьма необычна и резко контрастирует, например, с формой кривой смертности от гриппа. И если объяснения чрезвычайно низкой детской смертности можно по крайней мере попытаться найти в низкой экспрессии АПФ2 и TMPRSS2 в воздухоносных путях детей (Sharif-Askari et al., 2020), кросс-реактивности антигенов SARS-CoV-2 с антигенами из детских вакцин от других заболеваний (например, с MMR (Marakasova et al., 2021)) и особенностях функционирования детского иммунитета, то совпадение формы правой части кривой с формой кривой естественной смертности объяснить на первый взгляд гораздо сложнее, по крайней мере если предполагается, что смерть наступает непосредственно из-за виремии, а не каких-то дополнительных механизмов.
Второй интересной особенностью представляется так называемый Африканский парадокс (Ghosh et al., 2020), суть которого состоит в чрезвычайно низкой относительной смертности от COVID-19 в Африке, несмотря на ее низкий уровень жизни в целом и медицины в частности. Для объяснения этого парадокса предлагается целый ряд невзаимоисключающих причин:
– Некачественный сбор данных;
– В среднем значительно более молодое население, чем в других регионах;
– Меньше гипертоников, диабетиков, людей с ожирением и т.д.;
– Кросс-реактивность (эндемичные коронавирусы, вакцины типа БЦЖ и т.д.);
– Меньшая плотность населения (меньше городов, больше сел);
– Климат;
– Особенности генетики;
– Привычка населения к противоэпидемическим мерам;
– Массовое применение тех или иных лекарств (например, средств от малярии), обладающих профилактическим или лечебным эффектом и в случае с SARS-CoV-2.
В свете изложенных в этом и предыдущем подразделах свойств вируса весьма любопытной представляется аутоиммунная теория тяжелого COVID-19 (McMillan et al., 2021), суть которой вкратце сводится к следующему: было показано, что эктодомен АПФ2 способен отделяться от клеток и попадать в кровеносное русло, причем его количество коррелирует с возрастом человека, а также увеличено у больных ожирением, гипертонией, диабетом и другими болезнями, являющимися факторами риска для тяжелого COVID-19. Предполагается, что такой растворенный АПФ2 способен присоединяться к вирионам SARS-CoV-2 и попадать внутрь антигенпрезентирующих клеток, что, в свою очередь, приводит к тяжелым аутоиммунным реакциям (причем не только на АПФ2, но и на сходные с ним белки, в первую очередь на АПФ1) и системному поражению организма. Вероятность тяжелого течения COVID-19, таким образом, напрямую зависит не только и не столько от виремии, сколько от концентрации АПФ2 в крови, которая хорошо коррелирует с возрастом и факторами риска, а также от определяемого генетически сродства АПФ2 к S-белку SARS-CoV-2. Следует отметить, что аутоиммунная теория хорошо объясняет и постковидный синдром, поскольку аутоиммунная реакция может продолжаться и после полной эрадикации вируса.
Кроме того, было показано, что у пациентов с ожирением, у которых COVID-19 протекает тяжело, антитела по большей части являются не вируснейтрализующими, а аутоиммунными, нацеленными на маркеры оксидативного стресса и на белки жировой ткани (Frasca et al., 2022).
Согласующаяся с аутоиммунной теорией медицинская практика показала весьма многообещающие результаты (Morán Blanco et al., 2021).
SARS-CoV-2: эволюция
Существующие оценки того, насколько легко SARS-CoV-2 дается антигенное ускользание, разнятся в зависимости от авторов, методик и исследуемых эпитопов (Egeren et al., 2021; Hie et al., 2021; Yuan et al., 2021). Тем не менее первые штаммы, успешно ускользающие от сыворотки вакцинированных препаратами Pfizer–BioNTech и Moderna появились еще в 2020 г., в том числе штамм Бета, узнаваемость которого такой сывороткой крайне низка и сравнима с узнаваемостью ею SARS-Cov и WIV1-Cov (Garcia-Beltran et al., 2021). Иммунорезистентные штаммы возможно получить и экспериментальным путем (Andreano et al., 2021).
Как и другие коронавирусы, SARS-CoV-2 оказался способен к рекомбинации внутри хозяина, причем было напрямую показано наследование рекомбинантами способствующего более высокой трансмиссивности варианта S-белка (Jackson et al., 2021).
Еще одним важным, в первую очередь с практической точки зрения, аспектом представляется вклад иммуносупрессивных пациентов в эволюцию вируса (Hoffman et al., 2021; Kemp et al., 2021; Cele et al., 2022). В целом ряде случаев показано, что больные ВИЧ/СПИД, а также страдающие другими иммуносупрессивными состояниями, оказываются длительными хроническими носителями SARS-CoV-2, а постоянная терапия моноклональными антителами и плазмой иммунизированных людей приводит к появлению иммунорезистентных мутантов – “иммунная Златовласка” в действии.
Штамм Дельта
Штамм Дельта, впервые описанный в декабре 2020 г. в Индии, характеризуется целым рядом мутаций, повышающих его вирулентность, трансмиссивность и инфекционность (Mlcochova et al., 2021; Scudellari, 2021). В первую очередь следует выделить:
– Мутации в RBD, увеличивающие аффинность к AПФ2;
– Мутации, ухудшающие узнавание иммунитетом, нацеленным на Уханьский штамм (in vitro вирионы Дельты в 6 раз менее уязвимы для сыворотки переболевших и в 8 раз менее уязвимы для сыворотки вакцинированных);
– Мутация P681R в фуриновом сайте, облегчающая узнавание фурином и, как следствие, увеличивающая количество (с ~50% до более чем 75%) разрезанных на субъединицы S-белков (разрезанный S-белок, используя связанный с TMPRSS2 механизм, позволяет заражать клетки куда быстрее, чем не разрезанный);
– На порядки увеличенная вирусная нагрузка (и, соответственно, репликация).
Учитывая такой генетический профиль, не удивительно, что штамм Дельта оказался весьма устойчив к вакцинации. Так, исследование, проведенное на британских домохозяйствах, показало, что шанс заразиться у вакцинированных (в работе фигурируют препараты Pfizer–BioNTech, Oxford–AstraZeneca и Sinovac) составляет 25% против 38% у невакцинированных, в то время как шанс передать вирус дальше – 25% для вакцинированных против 23% для невакцинированных (Singanayagam et al., 2022). Таким образом, вакцинация лишь отчасти защищает от заражения и совсем не предохраняет от дальнейшей передачи вируса.
Примечательно, что на момент регистрации и распространения штамма Дельта в Индии массовых вакцинационных кампаний не проводилось, так что мы можем заключить, что наблюдаемые мутации представляют из себя, с одной стороны, адаптацию к естественной иммунизации, а с другой – увеличивают трансмиссивность в индийской (а затем и во многих других) популяции в целом.
Штамм Омикрон
Штамм Омикрон – самый необычный из всех зарегистрированных на данный момент штаммов. Хотя он превзошел все прочие штаммы по скорости распространения (Arora et al., 2022; Grabowski et al., 2022), он обладает заметно сниженной патогенностью и несколько иной клинической картиной (Arora et al., 2022; Suzuki et al., 2022), а его уникальный мутационный профиль (Arora et al., 2022; Sun et al., 2022) содержит ряд специфических мутаций, указывающих на возможную адаптацию к мышам (Sun et al., 2022).
Необычные клинические и эпидемиологические свойства штамма Омикрон, судя по всему, проистекают, с одной стороны, из значительно сниженной кросс-нейтрализации иммунитетом к другим штаммам (Zhang et al., 2021; Grabowski et al., 2022; VanBlargan et al., 2022), а с другой – из отличной от других распространенных штаммов стратегии адаптации к хозяевам (Du et al., 2022).
Первым ключевым отличием является измененный тканевый тропизм (Arora et al., 2022; Hui et al., 2022) – хотя Омикрон размножается в тканях верхних дыхательных путей и бронхов не менее активно, чем Дельта, в паренхиме легких он делает это значительно хуже, чем даже дикий тип, что само по себе должно снижать его общую вирулентность для организма как целого, не снижая при этом локальную, или тканевую, вирулентность в верхних дыхательных путях, критических для воздушно-капельной передачи вируса.
Вторым ключевым отличием, тесно связанным с предыдущим, является уход от TMPRSS2-опосредованного механизма проникновения в клетку как главного и переход к связанному с эндоцитозом катепсин-зависимому (Du et al., 2022), обладающему меньшей фузогенностью, вызывающему меньший воспалительный ответ и, как следствие, менее патогенному (Suzuki et al., 2022). При этом если S-белок штамма Дельта легче, чем у дикого типа, подвергался разрезанию в фуриновом сайте, то S-белок штамма Омикрон делает это хуже (Du et al., 2022; Suzuki et al., 2022). Примечательно, что Омикрон при этом стал чаще заражать детей (Cloete et al., 2022), хотя тяжесть протекания болезни у них все еще крайне низка и ниже, чем при заражении штаммом Дельта (Butt et al., 2022).
Почему эволюция Омикрона пошла принципиально иным от прочих широко распространившихся штаммов путем – один из ключевых вопросов эволюционной эпидемиологии в приложении к SARS-CoV-2.
Ключевые выводы из раздела
История SARS-CoV-2/COVID-19 учит нас нескольким важным выводам.
Во-первых, необходимо тщательно исследовать не только патогены, но и вызываемые ими заболевания – например, если аутоиммунная теория верна, то значительная доля вирулентности SARS-CoV-2 при тяжелом течении COVID-19 оказывается побочной и, скорее всего, не выгодной для самого вируса.
Во-вторых, не стоит недооценивать способность вирусов к быстрой адаптации к иммунизированным носителям – устойчивые к плазме иммунизированных людей мутанты возникли и распространились в кратчайшие сроки.
В-третьих, на структурно-физиологическом уровне эволюция разных штаммов одного и того же вируса может пойти принципиально разными путями. В итоге один и тот же вирус может как наращивать общую вирулентность для организма (штамм Дельта), так и снижать ее (штамм Омикрон), при этом локальная/тканевая вирулентность может возрастать в обоих случаях.
КАК СОЗДАТЬ “ЭВОЛЮЦИЕНЕПРОБИВАЕМУЮ” ВАКЦИНУ?
Как создать вакцину, при использовании которой будет максимально затруднена адаптация вирусов к иммунизированным особям?
Исходя из изложенного в предыдущих разделах, можно предположить, что для создания “эволюциенепробиваемой” вакцины необходимо:
0. Выбрать подходящий патоген – проведенный обзор вирусных патогенов показывает, что у нас нет оснований априорно считать, что “эволюциенепробиваемые” вакцины возможны для каждого из них. С одной стороны, есть широкоизвестные исторические примеры (натуральная оспа, чума крупного рогатого скота и др.), которые удалось полностью или практически полностью уничтожить при помощи вакцинации. С другой – такие вирусы, как IBV или MDV, которым раз за разом удается успешно адаптироваться к иммунизированным популяциям.
1. Позаботиться о том, чтобы вакцина давала совершенный иммунитет как можно большему числу вакцинированных.
2. Использовать как можно больше разнообразных антигенов, но таких, которые иммунитет будет способен распознать при реальной инфекции.
3. Использовать платформу, стимулирующую как можно более разнообразный иммунный ответ, но такой, который характерен (или по меньшей мере возможен) при реальной инфекции. Например, для респираторных инфекций предпочтительным вариантом будут скорее интраназальные, чем инъекционные вакцины.
4. При невозможности использовать разнообразные антигены – использовать максимально консервативные между разными штаммами. При этом надо учитывать возможное влияние на их доступность, оказываемое мутациями в экстраэпитопных доменах.
5. Использовать несколько вариантов антигенов от разных штаммов. А при борьбе против нового, еще не накопившего разнообразие заболевания, можно попробовать смоделировать наиболее вероятные пути эволюции антигенных регионов.
При этом в применении созданной вакцины следует по возможности учитывать, если не доказано иное, ряд правил, а именно:
1. Отказ от вакцинации иммуносупрессивных особей, поскольку они создают идеальную “переходную зону” для эволюции устойчивости.
2. Грамотная организация вакцинационной кампании: не допускать заражений свежевакцинированных носителей с не до конца сформированным иммунитетом (Jacobson et al., 2021), так как они тоже могут служить “переходной зоной”. При этом срок карантина должен устанавливаться в соответствии с данными клинических испытаний конкретной вакцины.
ЗАКЛЮЧЕНИЕ
Широкий спектр ветеринарных и медицинских примеров показывает, что вакцины per se не являются “эволюциенепробиваемыми” – в ряде случаев вирусные патогены способны успешно адаптироваться к иммунизированным носителям как путем так называемого антигенного ускользания (т.е. через снижение узнаваемости антигенных регионов за счет накопления мутаций в них или в сопряженных с ними структурах), так и через наращивание вирулентности (увеличении темпов репликации, подавление иммунитета носителя и т.д.). Соотношение этих стратегий в эволюции конкретного патогена, судя по всему, во многом зависит от его частной генетической архитектуры.
При этом существующие модели эволюционной эпидемиологии в приложении к вакцинации весьма неполны и не могут обеспечить надежные предсказания эволюционных последствий вакцинационных кампаний даже в общем виде, не говоря уже об исследованиях генетической структуры и эволюционируемости конкретных патогенов. Однако хорошие модели в этой области критически необходимы и должны стать приоритетным направлением работы эволюционных эпидемиологов.
Важно также отметить, что вакцинация, не опускающая репродуктивное число ниже 1, хотя и дает снижение смертности в краткосрочной перспективе, способна приводить к серьезным проблемам в долгосрочной. Например – к возвращению эпидемической ситуации к исходной позиции, только с постоянной нагрузкой вакцинацией (Franceschi et al., 1999; Ginaldi et al., 2005; Kostoff et al., 2020). Поэтому вакцинация значительно протекающими вакцинами, особенно при высоком R0 вируса, не может рассматриваться в качестве универсального способа победы над эпидемией или эпизоотией и зачастую является лишь способом выиграть время для разработки более совершенных вакцин и/или иных методов борьбы с заболеванием. Только вакцины, надежно блокирующие распространение патогена (инфекцию либо трансмиссию), способны сформировать групповой иммунитет у носителей и остановить эпидемию. Другим, не менее важным аспектом является генетическая архитектура самого вируса – по-видимому, те вирусы, которые удалось полностью или практически полностью искоренить при помощи вакцинации, отличаются значительным снижением жизнеспособности при изменении антигенности, в то время как вирусы, способные изменять антигенность без значимых потерь в жизнеспособности, раз за разом адаптируются к иммунизированным носителям.
Перед проведением массовых вакцинационных кампаний, особенно на людях, необходимо осмыслять проблематику и формировать концептуальное понимание структуры патогена и патогенеза вызываемого им заболевания. Это критически важно для того, чтобы разработанные вакцины имели минимум нежелательных побочных реакций со стороны иммунитета и максимум эффективности в ситуации реальной инфекции.
Наконец, хочется отметить, что практическая (в первую очередь – медицинская и ветеринарная) эволюционная проблематика требует большего внимания от научного сообщества, чем ей уделяется в настоящее время. Причем внимание ей должны уделить как специалисты из практических областей (медики, ветеринары, биотехнологи и т.д.), так и теоретики-эволюционисты, поскольку для развития любой молодой научной области требуется синтез теории и практики.
Список литературы
André J.-B., Gandon S., 2006. Vaccination, within-host dynamics, and virulence evolution // Evolution. V. 60. P. 13–23. https://doi.org/10.1111/j.0014-3820.2006.tb01077.x
Andreano E., Piccini G., Licastro D., Casalino L., Johnson N.V., et al., 2021. SARS-CoV-2 escape from a highly neutralizing COVID-19 convalescent plasma // Proc. Natl Acad. Sci. V. 118. № 36. https://doi.org/10.1073/pnas.2103154118
Antoulas A.C., 2004. Approximation of large-scale dynamical systems: An overview // IFAC Proc. Volumes. V. 37. № 11. P. 19–28. https://doi.org/10.1016/s1474-6670(17)31584-7
Arora S., Grover V., Saluja P., Algarni Y.A., Saquib S.A., et al., 2022. Literature review of Omicron: A grim reality amidst COVID-19 // Microorganisms. V. 10. № 2. https://doi.org/10.3390/microorganisms10020451
Aviagen, 2017. Marek’s Disease Virus. https://en.aviagen.com/assets/Tech_Center/Broiler_Breeder_Tech_Articles/English/MareksDiseaseVirus-2017-EN.pdf
Butt A.A., Dargham S.R., Loka S., Shaik R.M., Chemaitelly H., et al., 2022. COVID-19 disease severity in children infected with the Omicron variant // Clin. Infect. Dis. V. 75. № 1. P. e361–e367. https://doi.org/10.1093/cid/ciac275
Cecchinato M., Catelli E., Lupini C., Ricchizzi E., Clubbe J., et al., 2010. Avian metapneumovirus (AMPV) attachment protein involvement in probable virus evolution concurrent with mass live vaccine introduction // Vet. Microbiol. V. 146. № 1–2. P. 24–34. https://doi.org/10.1016/j.vetmic.2010.04.014
Cele S., Karim F., Lustig G., San J.E., Hermanus T., et al., 2022. SARS-CoV-2 prolonged infection during advanced HIV disease evolves extensive immune escape // Cell Host Microbe. V. 30. № 2. P. 154–162. https://doi.org/10.1016/j.chom.2022.01.005
Chinesta F., Huerta A., Rozza G., Wilcox K., 2017. Model reduction methods // Encyclopedia of Computational Mechanics, Second Edition / Eds Stein E., Borst R., Hughes T.J.R. Hoboken: Wiley. https://doi.org/10.1002/9781119176817.ecm2110
Cloete J., Kruger A., Masha M., Du Plessis N.M., Mawela D., et al., 2022. Paediatric hospitalisations due to COVID-19 during the first SARS-CoV-2 omicron (B.1.1.529) variant wave in South Africa: A multicentre observational study // Lancet Child Adolesc. Health. V. 6. № 5. P. 294–302. https://doi.org/10.1016/S2352-4642(22)00027-X
Coyne K.P., Reed F.C., Porter C.J., Dawson S., Gaskell R.M., Radford A.D., 2006. Recombination of Feline calicivirus within an endemically infected cat colony // J. Gen. Virol. V. 87. № 4. P. 921–926. https://doi.org/10.1099/vir.0.81537-0
Crépey P., Noël H., Alizon S., 2022. Challenges for mathematical epidemiological modelling // Anaesth. Crit. Care Pain Med. V. 41. № 2. https://doi.org/10.1016/j.accpm.2022.101053
Davison F., Nair V., 2004. Marek’s Disease: An Evolving Problem. Amsterdam: Elsevier. 208 p.
Day T., 2001. Parasite transmission modes and the evolution of virulence // Evolution. V. 55. P. 2389–2400. https://doi.org/10.1111/j.0014-3820.2001.tb00754.x
Dimmock N.J., Easton A.J., Leppard K.N., 2007. Introduction to Modern Virology. 6th ed. Malden: Blackwell Publishing. 516 p.
Du X., Tang H., Gao L., Wu Z., Meng F., et al., 2022. Omicron adopts a different strategy from Delta and other variants to adapt to host // Signal Transduct. Target Ther. V. 7. № 1. https://doi.org/10.1038/s41392-022-00903-5
Egeren D., van, Novokhodko A., Stoddard M., Tran U., Zetter B., et al., 2021. Risk of rapid evolutionary escape from biomedical interventions targeting SARS-CoV-2 spike protein // PLoS One. V. 16. № 4. https://doi.org/10.1371/journal.pone.0250780
El-Diwany R., Cohen V.J., Mankowski M.C., Wasilewski L.N., Brady J.K., et al., 2017. Extra-epitopic hepatitis C virus polymorphisms confer resistance to broadly neutralizing antibodies by modulating binding to scavenger receptor B1 // PLoS Pathog. V. 13. № 2. https://doi.org/10.1371/journal.ppat.1006235
Ewald P.W., 1991. Transmission modes and the evolution of virulence // Human Nature. V. 2. P. 1–30. https://doi.org/10.1007/BF02692179
Ewald P.W., 1993. The evolution of virulence // Sci. Am. V. 268. № 4. P. 86–93. http://www.jstor.org/stable/24941444
Franceschi C., Valensin S., Fagnoni F., Barbi C., Bonafè M., 1999. Biomarkers of immunosenescence within an evolutionary perspective: The challenge of heterogeneity and the role of antigenic load // Exp. Gerontol. V. 34. № 8. P. 911–921. https://doi.org/10.1016/S0531-5565(99)00068-6
Franzo G., Tucciarone C., Cecchinato M., Drigo M., 2016. Porcine circovirus type 2 (PCV2) evolution before and after the vaccination introduction: A large scale epidemiological study // Sci. Rep. V. 6. https://doi.org/10.1038/srep39458
Franzo G., Legnardi M., Tucciarone C.M., Drigo M., Martini M., Cecchinato M., 2019. Evolution of infectious bronchitis virus in the field after homologous vaccination introduction // Vet. Res. V. 50. https://doi.org/10.1186/s13567-019-0713-4
Frasca D., Reidy L., Romero M., Diaz A., Cray C., et al., 2022. The majority of SARS-CoV-2-specific antibodies in COVID-19 patients with obesity are autoimmune and not neutralizing // Int. J. Obes. V. 46. P. 427–432. https://doi.org/10.1038/s41366-021-01016-9
Garcia-Beltran W.F., Lam E.C., St Denis K., Nitido A.D., Garcia Z.H., et al., 2021. Multiple SARS-CoV-2 variants escape neutralization by vaccine-induced humoral immunity // Cell. V. 184. № 9. P. 2372–2383. https://doi.org/10.1016/j.cell.2021.03.013
Ghosh D., Bernstein J.A., Mersha T.B., 2020. COVID-19 pandemic: The African paradox // J. Global Health. V. 10. № 2. https://doi.org/10.7189/jogh.10.020348
Ginaldi L., Martinis M., de, Monti D., Franceschi C., 2005. Chronic antigenic load and apoptosis in immunosenescence // Trends Immunol. V. 26. № 2. P. 79–84. https://doi.org/10.1016/j.it.2004.11.005
Grabowski F., Kochańczyk M., Lipniacki T., 2022. The spread of SARS-CoV-2 variant Omicron with a doubling time of 2.0-3.3 days can be explained by immune evasion // Viruses. V. 14. № 2. https://doi.org/10.3390/v14020294
Grenfell B.T., Pybus O.G., Gog J.R., Wood J.L.N., Daly J.M., et al., 2004. Unifying the epidemiological and evolutionary dynamics of pathogens // Science. V. 303. № 5656. P. 327–332.
Hie B., Zhong E.D., Berger B., Bryson B., 2021. Learning the language of viral evolution and escape // Science. V. 371. № 6526. P. 284–288. https://doi.org/10.1126/science.abd7331
Hoffman S.A., Costales C., Sahoo M.K., Palanisamy S., Yamamoto F., et al., 2021. SARS-CoV-2 neutralization resistance mutations in patient with HIV/AIDS, California, USA // Emerg. Infect. Dis. V. 27. № 10. P. 2720−2723. https://doi.org/10.3201/eid2710.211461
Hui K.P.Y., Ho J.C.W., Cheung M.C., Ng K.C., Ching R.H.H., et al., 2022. SARS-CoV-2 Omicron variant replication in human bronchus and lung ex vivo // Nature. V. 603. № 7902. P. 715−720. https://doi.org/10.1038/s41586-022-04479-6
Jackson B., Boni M.F., Bull M.J., Colleran A., Colquhoun R.M., et al., 2021. Generation and transmission of interlineage recombinants in the SARS-CoV-2 pandemic // Cell. V. 184. № 20. P. 5179−5188. https://doi.org/10.1016/j.cell.2021.08.014
Jacobson K.B., Pinsky B.A., Rath M.E.M., Wang H., Miller J.A., et al., 2021. Post-vaccination SARS-CoV-2 infections and incidence of the B.1.427/B.1.429 variant among healthcare personnel at a northern California academic medical center // medRxiv. https://doi.org/10.1101/2021.04.14.21255431
Kemp S.A., Collier D.A., Datir R.P., Ferreira I.A.T.M., Gayed S., et al., 2021. SARS-CoV-2 evolution during treatment of chronic infection // Nature. V. 592. № 7853. P. 277−282. https://doi.org/10.1038/s41586-021-03291-y
Kennedy D.A., Read A.F., 2017. Why does drug resistance readily evolve but vaccine resistance does not? // Proc. Roy. Soc. B. V. 284. № 1851. https://doi.org/10.1098/rspb.2016.2562
Kostoff R.N., Kanduc D., Porter A.L., Shoenfeld Y., Briggs M.B., 2020. COVID-19 Vaccine Safety Considerations. Atlanta: Georgia Institute of Technology. 46 p. http://hdl.handle.net/1853/63710
Lai M.M.C., 1996. Recombination in large RNA viruses: Coronaviruses // Semin. Virol. V. 7. № 6. P. 381−388. https://doi.org/10.1006/smvy.1996.0046
Legnardi M., Tucciarone C.M., Franzo G., Cecchinato M., 2020. Infectious bronchitis virus evolution, diagnosis and control // Vet. Sci. V. 7. № 2. https://doi.org/10.3390/vetsci7020079
Liu J.L., Kung H.J., 2000. Marek’s disease herpesvirus transforming protein MEQ: A c-Jun analogue with an alternative life style // Virus Genes. V. 21. № 1–2. P. 51−64.
Liu Q., Zhou Y.H., Yang Z.Q., 2016. The cytokine storm of severe influenza and development of immunomodulatory therapy // Cell. Mol. Immunol. V. 13. № 1. P. 3–10. https://doi.org/10.1038/cmi.2015.74
Marakasova E., Baranova A., Pirofski L., 2021. MMR vaccine and COVID-19: Measles protein homology may contribute to cross-reactivity or to complement activation protection // mBio. V. 12. № 1. https://doi.org/10.1128/mBio.03447-20
McMillan P., Dexhiemer T., Neubig R.R., Uhal B.D., 2021. COVID-19 – A theory of autoimmunity against ACE-2 explained // Front. Immunol. V. 12. https://doi.org/10.3389/fimmu.2021.582166
Mlcochova P., Kemp S.A., Dhar M.S., Papa G., Meng B., et al., 2021. SARS-CoV-2 B.1.617.2 Delta variant replication and immune evasion // Nature. V. 599. P. 114–119. https://doi.org/10.1038/s41586-021-03944-y
Morán Blanco J.I., Alvarenga Bonilla J.A., Homma S., Suzuki K., Fremont-Smith P., Villar Gómez de las Heras K., 2021. Antihistamines and azithromycin as a treatment for COVID-19 on primary health care – A retrospective observational study in elderly patients // Pulm. Pharmacol. Ther. V. 67. https://doi.org/10.1016/j.pupt.2021.101989
Ossiboff R.J., Sheh A., Shotton J., Pesavento P.A., Parker J.S.L., 2007. Feline caliciviruses (FCVs) isolated from cats with virulent systemic disease possess in vitro phenotypes distinct from those of other FCV isolates // J. Gen. Virol. V. 88. № 2. P. 506−517. https://doi.org/10.1099/vir.0.82488-0
Plans Rubió P., 2012. Is the basic reproductive number (R0) for measles viruses observed in recent outbreaks lower than in the pre-vaccination era? // Euro Surveill. V. 17. № 31. P. 20233. https://doi.org/10.2807/ese.17.31.20233-en
Radford A.D., Dawson S., Coyne K.P., Porter C.J., Gaskell R.M., 2006. The challenge for the next generation of feline calicivirus vaccines // Vet. Microbiol. V. 117. № 1. P. 14–18. https://doi.org/10.1016/j.vetmic.2006.04.004
Radford A.D., Coyne K.P., Dawson S., Porter C.J., Gaskell R.M., 2007. Feline calicivirus // Vet. Res. V. 38. № 2. P. 319−335. https://doi.org/10.1051/vetres:2006056
Ragia G., Manolopoulos V.G., 2020. Inhibition of SARS-CoV-2 entry through the ACE2/TMPRSS2 pathway: A promising approach for uncovering early COVID-19 drug therapies // Eur. J. Clin. Pharmacol. V. 76. P. 1623–1630. https://doi.org/10.1007/s00228-020-02963-4
Read A.F., 2016. Pathogen evolution in a vaccinated world. https://www.youtube.com/watch?v=TeyxhehhEuo
Read A.F., Baigent S.J., Powers C., Kgosana L.B., Blackwell L., et al., 2015. Imperfect vaccination can enhance the transmission of highly virulent pathogens // PLoS Biol. V. 13. № 7. https://doi.org/10.1371/journal.pbio.1002198
Sasaki A., Lion S., Boots M., 2022. Antigenic escape selects for the evolution of higher pathogen transmission and virulence // Nat. Ecol. Evol. V. 6. P. 51–62. https://doi.org/10.1038/s41559-021-01603-z
Scudellari M., 2021. How the coronavirus infects cells – and why Delta is so dangerous // Nature News Feature. https://www.nature.com/articles/d41586-021-02039-y
Shamblin C.E., Greene N., Arumugaswami V., Dienglewicz R.L., Parcells M.S., 2004. Comparative analysis of Marek’s disease virus (MDV) glycoprotein-, lytic antigen pp38- and transformation antigen Meq-encoding genes: Association of meq mutations with MDVs of high virulence // Vet. Microbiol. V. 102. № 3–4. P. 147−167. https://doi.org/10.1016/j.vetmic.2004.06.007
Sharif-Askari N.S., Sharif-Askari F.S., Alabed M., Temsah M., Heialy S.A., et al., 2020. Airways expression of SARS-CoV-2 receptor, ACE2, and TMPRSS2 is lower in children than adults and increases with smoking and COPD // Mol. Ther. Methods Clin. Dev. V. 18. P. 1−6. https://doi.org/10.1016/j.omtm.2020.05.013
Singanayagam A., Hakki S., Dunning J., Madon K.J., Crone M.A., et al., 2022. Community transmission and viral load kinetics of the SARS-CoV-2 delta (B.1.617.2) variant in vaccinated and unvaccinated individuals in the UK: A prospective, longitudinal, cohort study // Lancet Infect. Dis. V. 22. № 2. P. 183−195. https://doi.org/10.1016/S1473-3099(21)00648-4
Sun Y., Lin W., Dong W., Xu J., 2022. Origin and evolutionary analysis of the SARS-CoV-2 Omicron variant // J. Biosaf. Biosecur. V. 4. № 1. P. 33−37. https://doi.org/10.1016/j.jobb.2021.12.001
Suzuki R., Yamasoba D., Kimura I., Wang L., Kishimoto M., et al., 2022. Attenuated fusogenicity and pathogenicity of SARS-CoV-2 Omicron variant // Nature. V. 603. № 7902. P. 700−705. https://doi.org/10.1038/s41586-022-04462-1
Swiss Policy Research, 2020. https://swprs.org/why-covid-19-is-a-strange-pandemic/
Swiss Policy Research, 2021. https://swprs.org/covid-versus-the-flu-revisited/
Thomine O., Alizon S., Boennec C., Barthelemy M., Sofonea M., 2021. Emerging dynamics from high-resolution spatial numerical epidemics // eLife. V. 10. https://doi.org/10.7554/eLife.71417
VanBlargan L.A., Errico J.M., Halfmann P.J., Zost S.J., Crowe J.E., Jr., et al., 2022. An infectious SARS-CoV-2 B.1.1.529 Omicron virus escapes neutralization by therapeutic monoclonal antibodies // Nat. Med. V. 28. № 3. P. 490−495. https://doi.org/10.1038/s41591-021-01678-y
WHO, 2020. Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19). https://www.who. int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
Wong J.P., Viswanathan S., Wang M., Sun L.Q., Clark G.C., D’Elia R.V., 2017. Current and future developments in the treatment of virus-induced hypercytokinemia // Future Med. Chem. V. 9. № 2. P. 169–178. https://doi.org/10.4155/fmc-2016-0181
Yuan M., Huang D., Lee C.D., Wu N.C., Jackson A.M., et al., 2021. Structural and functional ramifications of antigenic drift in recent SARS-CoV-2 variants // Science. V. 373. P. 818−823. https://doi.org/0.1126/science.abh1139
Zhang X., Wu S., Wu B., Yang Q., Chen A., et al., 2021. SARS-CoV-2 Omicron strain exhibits potent capabilities for immune evasion and viral entrance // Signal Transduct. Target Ther. V. 6. № 1. https://doi.org/10.1038/s41392-021-00852-5
Zurita-Gutiérrez Y.H., Lion S., 2015. Spatial structure, host heterogeneity and parasite virulence: Implications for vaccine-driven evolution // Ecol. Lett. V. 18. P. 779–789. https://doi.org/10.1111/ele.12455
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


