Журнал общей биологии, 2021, T. 82, № 2, стр. 83-111
Вторичные половые признаки, иммунитет и выбор полового партнера самкой. Гипотеза “иммунного гандикапа” сегодня
К. А. Роговин 1, *, Н. Ю. Васильева 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: krogovin@yandex.ru
Поступила в редакцию 11.10.2020
После доработки 17.10.2020
Принята к публикации 16.12.2020
Аннотация
В обзоре рассмотрена судьба гипотезы иммунного гандикапа (ГИГ) – одной из наиболее популярных в эволюционной экологии и экологической физиологии за почти 30 лет с момента ее появления. Обсуждаются ее истоки и результаты многочисленных проверок, смежные и альтернативные гипотезы. Согласно ГИГ, обусловленная тестостероном иммуносупрессия делает невозможным для самцов низкого генетического качества иметь повышенную экспрессию вторичных половых признаков (ВПП), не ставя под угрозу собственное здоровье и будущий репродуктивный успех. В результате только самцы высокого генетического качества (с врожденным хорошим здоровьем) могут позволить себе поддерживать высокие уровни тестостерона, необходимые для развития сложных орнаментов и демонстраций. Ключевая роль, которую отводила ГИГ тестостерону, определила и направление проверок гипотезы, как экспериментальных, так и направленных на поиск корреляций между уровнями андрогена и состоянием иммунных функций, активированных и в состоянии покоя у разных видов позвоночных животных в природе и в лаборатории. В обзоре обсуждаются результаты мета-аналитических проверок валидности ГИГ и ограничения подхода. Неоднозначные результаты проверок предсказаний ГИГ и растущее понимание сложности нейро-гуморальных взаимодействий в регуляции иммунных ответов, различий в реакциях на тестостерон разных ветвей общей системы иммунитета вызвали интерес эволюционных экологов к молекулярным процессам в клетке и в ее органеллах, в частности в митохондриях. Послужит ли внимание последних лет к митохондриальным биохимическим траекториям ключом к пониманию сложной системы связей между половыми стероидами, физическим состоянием особи и иммунными функциями, и позволит ли это решить проблему нечестного сигнала и иммунного гандикапа как способа его исключения, покажет время. За прошедшие почти три десятилетия ГИГ была конкретизирована по разным направлениям, была подтверждена ее работоспособность, она выигрывает по результатам проверок по сравнению с другими предложенными объяснениями эволюции ВПП под действием межполового отбора. Тем не менее ГИГ остается частной гипотезой, предлагающей лишь один из нескольких возможных сценариев эволюции ВПП.
У каждого животного существует немного выразительных черт или особенностей, которые с готовностью привлекают и приковывают внимание [партнера]; и некоторые среди них, вполне вероятно, будут более заметными у здоровых, активных и биологически полноценных особей, в то время как другие особенности более заметны у тех, кто менее здоров и бодр. R.A. Fisher, 1915
В 1975 г. Амос Захави, изучавший в Израиле коммунальных птиц – арабских дроздовидных тимелий (Argya squamiceps), опубликовал гипотезу, которая в своих ключевых положениях отличалась от прочно утвердившейся модели межполового отбора Фишера (Fisher, 1915, 1930), объясняющей эволюцию вторичных половых признаков (ВПП) действием механизма положительной обратной связи (“runaway mo-del” или “Fisherian process”) и основанной на идее генетического, а следовательно сигнального и перцептивного единства самцов и самок. Модель Захави известна как “гипотеза гандикапа” (стартовой форы, здесь – обременения) (Zahavi, 1975, 1977). Основные ее положения следующие:
1. Отбор поддерживает признак, если он указывает на лучшее качество, лучшую потенциальную приспособленность потомков;
2. Экстравагантные признаки самца не случайны. Они служат сигналами для выбора хороших (генетически) самцов самкой;
3. Отбор поддерживает такие признаки, несмотря на их высокую стоимость;
4. Сигнал должен быть честным, а его стоимость – высокой. Дешевизна будет плодить “обманщиков”, но обман наказуем отбором;
5. Самка – активный игрок, она выбирает лучшего самца, ориентируясь на его честные сигналы.
По Захави более интенсивный сигнал демонстрирует способность самца тратить больше ресурсов на поддержание того свойства, о котором самец сигнализирует самке. Идеи Захави долгое время не принимали всерьез за их внешний антропоморфизм и механистичность (например, Getty, 2006). Это продолжалось до тех пор, пока Графен (Grafen, 1990a, b) не предложил им математическое обоснование, после чего гипотеза сделалась весьма популярной, хотя и активно критикуемой (Bullock, 1999; Eshel et al., 2000; Kokko et al., 2003; Getti, 2006, и др.).
Одна из основных трудностей в моделях Захави–Графена состоит в том, что у видов, у которых самка активно выбирает партнера (например, у видов, формирующих в брачный период тока), устойчивое предпочтение самками партнеров с “хорошими генами” должно вести к падению генетической изменчивости отбираемых признаков. В итоге выгода, которую извлекает самка из дорогостоящего выбора, должна в результате отбора постепенно утрачиваться. В этом состоит так называемый парадокс тока (lek paradox; Borgia, 1979; Taylor, Williams, 1982; Kirkpatrick, Ryan, 1991). Механизм, объясняющий, почему парадокс тока не реализуется, предложили Гамильтон и Зук (Hamilton, Zuk, 1982). Половые сигналы самца могут быть связаны с генами, которые кодируют повышенную устойчивость к паразитам. Согласно их гипотезе, генетическая изменчивость самца поддерживается посредством коэволюционной “гонки вооружений”. Гены, кодирующие хорошее здоровье, распространяются в популяции хозяина паразита (возбудителя болезни), в то время как паразиты (возбудители) эволюционируют в направлении усиления вирулентности по мере улучшения механизмов иммунной защиты хозяина (Hamilton, Zuk, 1982). Основанием для гипотезы послужили данные по североамериканским воробьиным птицам о связи паразитарной нагрузки (зараженность крови простейшими пяти родов и одним видом нематод) c экспрессией ВПП (яркость самца, песня и яркость самки).
Дальнейшее развитие идея Гамильтона и Зук получила в вышедшей спустя 10 лет статье Фольстада и Картера (Folstad, Karter, 1992), которые предположили, что мужские половые гормоны, конкретно тестостерон, обеспечивают связь между половыми сигналами и хорошим здоровьем самца через влияние тестостерона как на развитие сигнала, так и на иммунитет. Гипотеза, получившая название “гипотеза гандикапа иммунокомпетентности” (immunocompetence handicap hypothesis), или в русскоязычном варианте “гипотеза иммунного гандикапа” (ГИГ), оказалась чрезвычайно привлекательной для объяснения непосредственных (proximate) причин эволюции вторичных половых признаков (цветовых и структурных орнаментов и экстравагантных демонстраций) на основе принципа гандикапа Захави, возродив его для новой жизни.
В соответствии с ГИГ, половые украшения самца обеспечивают честные сигналы о состоянии иммунной системы их владельца по причине дорогостоящего компромисса (трейдоффа) между развитием орнамента и иммунным здоровьем, и это опосредовано подавляющими иммунитет эффектами тестостерона. Это ключевое положение гипотезы. Основанием для такого предположения послужили существовавшие к тому времени эмпирические данные о негативном влиянии тестостерона на иммунные функции людей и лабораторных животных, а также свидетельства того, что паразиты снижают приспособленность хозяина, что устойчивость к заражению часто наследуется, что экспрессия вторичных половых признаков зависит от состояния здоровья/тяжести заболевания и, наконец, что самка предпочитает здоровых самцов (Roberts et al., 2004). На какие конкретно ветви общей системы иммунной защиты организма распространяется эффект тестостерона как иммуносупрессора, гипотеза не уточняла. Согласно гипотезе, обусловленная тестостероном иммуносупрессия делает невозможным для самцов низкого генетического качества иметь повышенную экспрессию орнаментов (ВПП), не ставя под угрозу собственное здоровье и будущий репродуктивный успех. В результате только самцы высокого генетического качества (с врожденным хорошим здоровьем) могут позволить себе поддерживать высокие уровни тестостерона, необходимые для развития сложных орнаментов и демонстраций.
Ключевая роль, которую отводила ГИГ тестостерону, определила и направление проверок гипотезы, как экспериментальных, так и направленных на поиск корреляций между уровнями тестостерона и состоянием иммунных функций, как активированных, так и в состоянии покоя у разных видов позвоночных животных в природе и в лаборатории. Экспериментальные проверки гипотезы проводились в двух направлениях: путем модуляции уровня тестостерона в организме и наблюдения изменений иммунных реакций, а также путем активации иммунных ответов и регистрации уровней тестостерона. Несколько позже пробудился интерес эко-иммунологов к исследованиям влияния на иммунитет женских половых гормонов (эстрогенов) у разных видов в природе и лаборатории (Roved et al., 2017), а также роли стресса в модуляции иммунных ответов и уровней половых гормонов (Leary, Knapp, 2014; Moore et al., 2016; Leary, Baugh, 2020).
Неоднозначные результаты проверок предсказаний ГИГ и растущее понимание сложности нейрональных и гуморальных взаимодействий в регуляции иммунных ответов, различий в реакциях на тестостерон разных ветвей общей системы иммунитета вызвали в последние годы пристальный интерес эко-иммунологов и эволюционных экологов к достижениям биомедицинских наук, заставили исследователей обратить внимания на молекулярные процессы в клетке и ее органеллах в надежде, что именно на этом уровне организации биологических процессов будет найден ключ к пониманию того, как природа создала столь диковинный хвост у павлина.
Обсуждению этих исследований посвящен предлагаемый вниманию читателей обзор. Поскольку связанная с ГИГ литература на сегодня поистине огромна, наш обзор сосредоточен в основном на обобщающих и предлагающих новые подходы публикациях. И в этом смысле он может претендовать лишь на статус обобщения итогов. Рассматривая перспективы направления, мы более подробно обсуждаем отдельные современные исследования, выполненные на диких животных, примеры работ, которые, как нам кажется, свидетельствуют о возможностях эколого-физиологических исследований эволюционной направленности в настоящем и будущем.
ТЕСТОСТЕРОН: СИНТЕЗ И МЕХАНИЗМ ДЕЙСТВИЯ
Тестостерон – один из важнейших физиологических регуляторов, посредством которого реализуются сценарии жизненного цикла (Ketterson et al., 1992). Наряду с другими стероидными и тирреоидными гормонами тестостерон участвуют в энергоемких метаболических процессах – роста, развития, обеспечения сезонных функций и др. (Nelson, Kriegsfeld, 2016). Гормон вырабатывается в основном в клетках Лейдига семенников у самцов и в малых дозах в яичниках у самок (Burger, 2002). И у самцов, и у самок тестостерон также синтезируется в коре надпочечников. В дополнение к классическим стероидогенным органам (Розен, 1994; Dohle et al., 2003; Luetjens, Weinbauer, 2012) в мозге также происходит биосинтез тестостерона и других стероидов (Mellon et al., 2001). Синтез в норме осуществляется из холестерола через такие стероиды, как дезоксикортикостерон и прогестерон. Тестостерон легко превращается в эстрадиол с помощью фермента ароматазы или в дигидротестостерон с помощью редуктазы (Celec et al., 2015). Ключевую роль в синтезе тестостерона играют митохондрии, где транспортный белок StAR (стероидогенный острый регуляторный белок) обеспечивает передачу холестерола с внешней на внутреннюю митохондриальную мембрану, где холестерол может быть далее обработан соответствующими ферментами (Miller, Auchus, 2011; Luetjens, Weinbauer, 2012). Ген StAR экспрессируется исключительно в стероидогенных тканях, в том числе в мозге (Celec et al., 2015). Поскольку стероидогенные клетки практически не обладают способностью хранить гормоны, уровень тестостерона контролируется в первую очередь на стадии синтеза в митохондриях (Bose et al., 2002).
Взаимосвязь тестостерона (как и других стероидных гормонов и гормонов щитовидной железы) с митохондриями двунаправлена: с одной стороны, митохондрии играют ведущую роль в биосинтезе и контроле стероидных гормонов (Bose et al., 2002), с другой – половые стероиды регулируют экспрессию ДНК, обеспечивающую окислительное фосфорилирование (Psarra et al., 2006; Vasconsuelo et al., 2013). Митохондрии имеют рецепторы как андрогенов, так и эстрогенов (Psarra, Sekeris, 2008; Vasconsuelo et al., 2013). Недавно показано, что рецепторы андрогенов в митохондриях контролируют многие митохондриальные функции и митонуклеарную коммуникацию (Bajpai et al., 2019). Таким образом, половые гормоны могут напрямую менять митохондриальную активность для обеспечения энергией физиологических процессов. Центральная же роль митохондрий в производстве гормонов гарантирует, что энергетически дорогие процессы могут быть запущены только при адекватном митохондриальном обеспечении (Demonacos et al., 1996; Gavrilova-Jordan, Price, 2007; Manoli et al., 2007; Psarra, Sekeris, 2008; Du et al., 2009; Vasconsuelo et al., 2013).
Известны два механизма действия тестостерона. Основной медленный механизм – геномный, связанный с активацией ядерных и митохондриальных генов. После транслокации в цитоплазму клетки тестостерон связывает рецептор андрогена, а затем после транспорта связывается с элементом гормонального ответа в ДНК, где активирует или тормозит экспрессию генов и последующий синтез белка (Koch et al., 2017). Действие быстрого негеномного механизма разнообразно, начиная с активации мембранных рецепторов, связанных с G-белком, или рецепторов глобулина, связывающего тестостерон, и заканчивая стимуляцией различных протеинкиназ и прямой модуляцией активности ионных каналов и транспортных белков (Michels, Hoppe, 2008).
Синтез тестостерона, как и других половых гормонов, контролируется гонадотропин-рилизинг-гормоном (ГРГ), который вырабатывается гипоталамусом и стимулирует гипофиз к выделению фолликулостимулирующего и лютеинизирующего гормонов (ЛГ); последний увеличивает экспрессию белка StАR в клетках-мишенях (Ubuka et al., 2014). Однако эффект количества ЛГ в отношении гонад неоднозначен, и повышенный синтез тестостерона клетками Лейдига может, по-видимому, происходить за счет временного увеличения чувствительности семенников к ЛГ (Chichinadze K., Chichinadze N., 2008). Секреция ГРГ пульсирует. У людей она наиболее высока во время сна с последующими самыми высокими пиками тестостерона, приходящимися на ранние утренние часы (Lord et al., 2014). Уровни тестостерона постепенно снижаются с возрастом, главным образом из-за истощения клеток Лейдига и замедления генерации выбросов ГРГ в гипоталамусе (Celec et al., 2015).
ИММУННАЯ СИСТЕМА ПОЗВОНОЧНЫХ
У позвоночных животных иммунная система весьма консервативна и представлена двумя ветвями. Врожденный иммунитет – это система быстрого иммунного ответа на инфекции, основанная на распознавании консервативных, уникальных для патогенов признаков. Другая ветвь – адаптивный иммунитет – обеспечивает антиген-специфические ответы, которые активируются при инфекции. Высокая специфичность и гибкость адаптивных иммунных реакций основана на специфических рецепторах антигенов на Т- и В-лимфоцитах (Ройт и др., 2000; Cooper, Alder, 2006; Murphy, Weaver, 2016). Клеточный пул врожденного иммунитета представлен моноцитами, макрофагами, дендритными клетками (ДК), гранулоцитами (нейтрофилы, эозинофилы, тучные клетки и базофилы), натуральными киллерными клетками (НК), тромбоцитами и эндотелиальными клетками. Взаимодействие между врожденной и адаптивной иммунной системами в значительной степени опосредовано регуляторными молекулами – цитокинами, которые координируют действия различных иммунных функций, нацеливая их на конкретные виды патогенов (Ройт и др., 2000; Abbas et al., 2014).
Адаптивная иммунная система позвоночных включает клеточный и гуморальный иммунитет. Клеточные иммунные реакции ориентированы на борьбу с патогенами внутри клеток. Их осуществляют цитотоксические Т-лимфоциты (или цитотоксические Т-клетки, CD8+); они убивают инфицированные клетки хозяина. Другие Т-лимфоциты (Т-хелперы, CD4+) стимулируют макрофаги к уничтожению микробов. В гуморальном адаптивном иммунитете эффекторными клетками являются В-лимфоциты (или В-клетки), которые стимулируются другими CD4+ хелперными Т-клетками. В-клетки продуцируют антитела, которые связывают внеклеточные патогены и обеспечивают их обезвреживание (Murphy, Weaver, 2016). Четыре основных функциональных группы хелперных Т-клеток (CD4+) известны как Th1, Th2, Th17 и Treg (T-регуляторные клетки) (Murphy, Weaver, 2016). Клетки Th1, Th2 и Th17 инициируют три различных типа адаптивных иммунных ответов. Th1-ответ включает в основном активацию макрофагов и цитотоксических клеток, Th17 – выработку воспалительных цитокинов, Th2-ответ стимулирует В-клетки к производству антител. Treg-клетки участвуют в регуляции иммунных ответов, предотвращая, например, иммунопатологии (Murphy, Weaver, 2016). При Th1-ответе выделяемый Тh1-лимфоцитами интерферон γ (IFN-γ) активирует макрофаги к уничтожению микробов, цитотоксические клетки к убийству инфицированных клеток; у человека Th1-клетки также стимулируют производство B-клетками IgG3 антител (Murphy, Weaver, 2016). Иммунный ответ Th2-типа направлен на активацию гуморального иммунитета; у людей секретирующие IL-4 и IL-5 Th2-клетки стимулируют В-клетки продуцировать другие классы антител (IgA, IgE, IgG1, IgG2, IgG4) (Murphy, Weaver, 2016). При Th17-ответе клетки Th17 продуцируют цитокины, которые вызывают сильные воспалительные реакции (особенно IL-17 и IL-22) и в основном участвуют в борьбе с инфекциями на слизистых поверхностях. Клетки Th17 также работают вместе с клетками Treg, обеспечивая увеличение секреции антител IgA в просвет кишечника (Cao et al., 2012).
При инициации врожденного иммунного ответа сигналы цитокинов, выделяемых макрофагами и дендритными клетками, индуцируют дифференциацию наивных CD4+ Т-клеток в Th1, Th2 или Th17, тем самым инициируя определенный тип адаптивного иммунного ответа (Zhu, Paul, 2008; Murphy, Weaver, 2016). Цитокины IL-12 и IFN-γ индуцируют дифференцировку Th1, цитокины IL-2 и IL-4 индуцируют Th2, а дифференцировка Th17 индуцируется цитокинами TGF-β, IL-1, IL-6, IL-21 и IL-23 (Murphy, Weaver, 2016). Цитокиновые сигналы усиливаются положительными обратными связями от дифференцирующихся Т-хелперов. Однако сигналы цитокинов, связанных с одним типом Т-хелперных клеток (например, Th1), подавляют дифференцировку других типов (например, Th2 или Th17). В результате этих конкурентных отношений адаптивные иммунные ответы того или иного типа могут стать преобладающими, будучи однажды запущенными (Murphy, Weaver, 2016).
ТЕСТОСТЕРОН, ВПП И ПОВЕДЕНИЕ
У самцов позвоночных животных тестостерон необходим для производства сперматозоидов, осуществления полового акта, для развития и экспрессии многих вторичных половых признаков, делающих самца привлекательным для самки (Ketterson et al., 1992, 1996; Owens, Short, 1995; Saino, Møller, 1995; Enstrom et al., 1997; Ketterson, Nolan, 1999; Ardia et al., 2010). Известно также, что не все ВПП, в том числе поведенческие, контролируются тестостероном (Wingfield, Farner, 1993; Kimball, Ligon, 1999). Тестостерон усиливает проявление территориальности (Moore, Marler, 1987; Hau, 2007), с ним связывают внутриполовую агрессивность самцов и конкурентоспособность в борьбе за обладание самкой (Salvador et al., 1997; Hau, 2007; McGlothlin et al., 2007, 2008; Ardia et al., 2010; Bartos et al., 2012).
В соответствии с “гипотезой вызова” (challenge hypothesis) (Wingfield et al., 1990, 2001), стабильно высокий уровень тестостерона имеет дезадаптивные последствия. Поэтому высокие уровни гормона должны быть ограничены периодами жизненного цикла с высоким репродуктивным усилием. Предсказания гипотезы в целом поддерживаются результатами многих исследований (Archer, Carré, 2016; Carré, Archer, 2018). Уровень тестостерона высоко изменчив и на более коротких временных интервалах (суточный ритм, социальный контекст и индивидуальные особенности реагирования) (Archer, Carré, 2016). Это объясняет, почему уловить связь между гормональным фоном и относительно стабильной экспрессией ВПП удается далеко не всегда (Weatherhead et al., 1993; Evans et al., 2000; Stoehr, Hill, 2001; McGlothlin et al., 2008, и др.). Важно также иметь в виду, что корреляции между гормоном и регулируемым признаком можно наблюдать только при концентрациях ниже уровня насыщения на кривых доза-эффект. Эти уровни могут различаться для разных андроген-зависимых признаков.
Тестостерон, по-видимому, оказывает непосредственное влияние на функции мозга. Известно его влияние на когнитивные способности и эмоции у человека (Celec et al., 2015). Значительная часть биомедицинских исследований подтверждает его активность как анксиолитика и антидепрессанта, его способность улучшать пространственную ориентацию – способности, которые ослабевают с возрастом (Celec et al., 2015).
ТЕСТОСТЕРОН И ИММУННЫЕ ФУНКЦИИ
Иммуносупрессивная роль тестостерона известна давно (Cohn, 1979; Folstad, Karter, 1992; Marsh, 1996; Klein, 2000; Moshkin et al., 2000; Skau, Folstad, 2004, и др.). Однако эффекты и конкретные механизмы его действия на разные ветви общей системы иммунной защиты организма относительно отчетливо начинают вырисовываться лишь к настоящему времени (Koch et al., 2017; Roved et al., 2017; Taneja, 2018). Наиболее популярное объяснение иммуносупрессивной роли тестостерона состоит в снижении вероятности аутоиммунной атаки развивающихся сперматозоидов (Skau, Folstad, 2004). Производство высококачественного эякулята связано со значительными затратами. Гаплоидные сперматозоиды воспринимаются иммунной системой как чужое и подвергаются аутоиммунной атаке уже в половых органах самца. Это снижает качество спермы и, следовательно, ее фертильность. Таким образом, успех самца зависит от способности семенников выполнять барьерную функцию в отношении собственных антител. Мета-анализ результатов лечения кортикостероидами мужского бесплодия, направленного на иммуносупрессию, показал, что лечение снижало уровень антиспермальных антител, улучшало подвижность сперматозоидов и их количество, а также сокращало время зачатия (Skau, Folstad, 2004).
Негативная роль тестостерона в отношении отдельных иммунных функций может быть связана с его ролью в обеспечении перераспределения пластических и энергетических ресурсов между иммунной и генеративной системами (Wedekind, Folstad, 1994). Тестостерон выступает в качестве регулятора функций внутри иммунной системы, однако его влияние на механизмы врожденного и адаптивного иммунитета неоднозначно.
Экспериментально добавленный тестостерон оказывает негативное влияние на клеточный иммунитет (Foo et al., 2017). Однако подробное исследование биомедицинской литературы свидетельствует о том, что тестостерон в основном подавляет адаптивные иммунные ответы Th2- и Th17-типов путем подавления функций, связанных с дифференциацией Th2 и Th17 (Roved et al., 2017). В то же время, помимо иммуносупрессивных эффектов, он также может усиливать клеточный иммунитет Th1-типа; самцы в целом имеют более высокое соотношение цитокинов Th1/Th2, чем самки (Girón-González et al., 2000). Неоднозначны также и результаты исследований влияния тестостерона на индукцию дифференцировки Th1-клеток, обобщенные в обзоре Роведа с соавт. (Roved et al., 2017). Отмечалось как уменьшение продукции Th1-индуцированного цитокина IFN-γ (Kissick et al., 2014), так и отсутствие такого эффекта (Girón-González et al., 2000; Posma et al., 2004). В целом направленность действия тестостерона при иммунных ответах Th1-типа остается невыясненной (Roved et al., 2017).
Тестостерон обладает негативным действием в отношении гуморальной компоненты адаптивного иммунитета, уменьшая как антителообразование, так и пролиферацию В-клеток (Foo et al., 2017).
В отношении врожденного иммунитета тестостерон, по-видимому, имеет демпфирующий эффект, хотя действие его не вполне однозначно (Roved et al., 2017). В моноцитах тестостерон увеличивает выработку Th1 цитокина IL-12 (Posma et al., 2004), хотя он оказывает различный эффект на цитокины, индуцирующие Th17-ответ; он подавляет продукцию IL-6 (O’Connor et al., 2007), но увеличивает продукцию IL-1 (Posma et al., 2004). В дендритных клетках, которые играют важную роль в качестве антигенпрезентирующих клеток гуморального иммунитета, тестостерон ингибирует или уменьшает продукцию Тh2 цитокинов (IL-4, IL-10 и IL-13) (Hepworth et al., 2010), Th17-индуцирующих цитокинов IL-1 и IL-6 (Corrales et al., 2009), а также может подавлять экспрессию рецепторов главного комплекса гистосовместимости (MHC) класса II и ко-стимулирующих молекул (Koh et al., 2009; Hepworth et al., 2010). Исследования влияния тестостерона на гранулоциты предполагают, что он усиливает активность нейтрофилов и тучных клеток, но описан и ингибирующий эффект в отношении нейтрофилов (Roved et al., 2017).
Еще один важный аспект, связанный с первой линией обороны от инфекций – это заживление ран. Здесь исследования показывают, что тестостерон усиливает агрегацию тромбоцитов (Ajayi et al., 1995; Li et al., 2007), которая способствует заживлению раны и поврежденных тканей. Это особенно интересно, потому что было высказано предположение, что увеличение скорости заживления ран (одновременно с усилением Th1-реакций клеточного иммунитета) должно быть адаптивным у самцов из-за более высокого риска травм во время конкурентной борьбы за доминантный ранг и при защите территории (Zuk, Johnsen, 1998; Hasselquist, 2007).
Влияние тестостерона на эндотелиальные клетки неоднозначно. Исследования дают основания предположить как усиление, так и подавление адгезии и миграции лейкоцитов, либо отсутствие эффекта (Roved et al., 2017). Было также обнаружено снижение экспрессии IL-6 и рецепторов TLR-4, что указывает на противовоспалительное действие тестостерона на эндотелиальные клетки (Norata et al., 2006). Влияние тестостерона на дендритные клетки и эндотелиальные клетки находится в соответствии с его подавляющим влиянием на дифференцировку Th2 и Th17 (Roved et al., 2017).
Таким образом, исследования действия тестостерона на разные ветви общей системы иммунной защиты организма свидетельствуют о его неоднозначных эффектах. Подавление адаптивного иммунитета можно считать подтвержденным лишь в отношении клеточных ответов Th2, Th17 и гуморальной компоненты Th2, но не Th1-ответов. В отношении реакций врожденного иммунитета эффект тестостерона различен. Различная роль разного типа клеточных (Тh) ответов в зависимости от условий жизни, стадии жизненного цикла, состояния организма – результат адаптивной эволюции. Усиление Тh1, например весной, в период гона, на фоне подавления Тh2 и гуморальной иммунореактивности может рассматриваться как вполне адаптивная реакция и свидетельство того, что реальная цена адаптации формируется на основании более сложных компромиссных решений, нежели это предлагается ГИГ (Hasselquist, 2007).
ПРОВЕРКИ ГИГ, ОСНОВАННЫЕ НА АНАЛИЗЕ КОРРЕЛЯЦИЙ (СРАВНИТЕЛЬНЫЙ ПОДХОД)
В соответствии с ГИГ, иммунный гандикап, обусловливающий честность сигнала, может действовать, если увеличение уровня тестостерона вызывает снижение индивидуальной иммунокомпетентности. Однако положительные связи между качеством сигнала, тестостероном и иммунокомпетентностью не могут рассматриваться как противоречащие ГИГ (Roberts et al., 2004; Getty, 2006). Положительная связь или отсутствие связи могут существовать в том случае, если особи высокого генетического качества способны справляться с обусловленным тестостероном подавлением иммунной функции. Напротив, отрицательная связь может свидетельствовать о том, что здоровые особи жертвуют своей индивидуальной приспособленностью. Это может быть причиной противоречивых результатов исследований. Например, у мужчин прослежена положительная связь между уровнем тестостерона, привлекательностью лица для женщин и иммунореактивностью на вакцину против гепатита В (Rantala et al., 2012а). Пример отсутствия связи дают краснокрылые трупиалы (Agelaius phoeniceus), у которых адаптивная гуморальная иммунокомпетентность в три разных периода годового цикла никак не была связана с физиологическими показателями уровня тестостерона (Hasselquist et al., 1999).
Теоретически иммунокомпетентные самцы, как более здоровые, могут выдерживать бóльшую паразитарную нагрузку, чем более иммунологически слабые самцы. В этом смысле акцент на паразитарной нагрузке как показателе иммунокомпетентности (отрицательная связь) при тестировании ГИГ малопродуктивен (Getty, 2002). Тем не менее при межвидовых сравнениях высокая зараженность паразитами часто бывала связанной с пониженной иммунокомпетентностью и использовалась в качестве ее показателя (Poulin, 1996; Schalk, Forbes, 1997; Klein, 2000, и др.). Положительная корреляция между зараженностью клещами, уровнем тестостерона и размером красных эполет на крыльях была обнаружена у краснокрылых трупиалов. Однако взаимосвязь между тестостероном, зараженностью другими паразитами и такими ВПП, как песня и общий цвет оперения, отсутствовала (Weatherhead et al., 1993). Размер рогов у белохвостого оленя положительно коррелировал с уровнем тестостерона, но вопреки ожиданию отрицательно – с зараженностью нематодами. При этом корреляции между тестостероном и зараженностью гельминтами не было (Ditchkoff et al., 2001). Один и тот же вид паразита может по-разному влиять на иммунные функции, а разные виды паразитов могут оказывать разное влияние на одну и ту же иммунную функцию (Foo et al., 2017). Это может быть связано с разной стоимостью для организма разных видов паразитов. Так, у красных полевок в природной обстановке зараженность цестодами (Arostrilepis horrida) значимо влияла на уровень базального метаболизма, однако иммунизация бараньими эритроцитами, зараженность таежным клещом (Ixodes persulcatus) и нематодой (Heligmosomum mixtum) самостоятельного влияния на базальный метаболизм не оказывали. Вместе с тем красные полевки – носители нематод – после иммунизации эритроцитами демонстрировали значимо более низкий максимальный уровень потребления кислорода в тесте острого охлаждения по сравнению с зараженными нематодой полевками, инъецированными физиологическим раствором (Novikov et al., 2015).
Если зараженность паразитами отрицательно связана с иммунокомпетентностью, а тестостерон подавляет иммунные функции, то зараженность паразитами самцов теоретически должна быть более высокой, чем самок. Давно известно, что женщины больше склонны к определенным аутоиммунным расстройствам, а мужчины показывают бóльшую восприимчивость к паразитам и микробным инфекциям (Grossman, 1990; Klein, 2000). Однако проведенный МакКарди с соавторами (McCurdy et al., 1998) мета-анализ 33 исследований птиц показал, что зараженность Haemoproteus (паразит крови) более распространена среди самок, как вне зависимости от системы спариваний, так и в пределах только полигинных видов. При этом существуют значительные различия между видами в восприимчивости одних и тех же паразитов и в эффектах, оказываемых разными видами паразитов (Moore, Wilson, 2002). Эти результаты, основанные на регистрации фоновых показателей иммунитета, половых гормонов и зараженности паразитами трудно интерпретировать еще и потому, что поведенческие особенности полов могут обусловливать их разную подверженность атакам паразитов (Klein, 2000). Поведение самца отличается повышенной активностью и подвижностью, что повышает вероятность заражения (Zuk, Stoehr, 2002).
Ограниченные возможности сравнительного коррелятивного подхода для тестирования ГИГ хорошо видны из широко цитируемого элегантного сравнительного анализа роли паразитов в половом отборе у млекопитающих (Moore, Wilson, 2002). Авторам удалось весьма убедительно продемонстрировать наличие положительной связи между величиной диморфизма в размерах тела и уровнем зараженности паразитами самцов в сравнительном ряду таксонов млекопитающих. Система спариваний в этой сравнительной работе была использована как показатель интенсивности действия полового отбора в эволюции таксонов. Оказалось, что такая же положительная связь прослеживается между паразитарными нагрузками и показателем степени выраженности полигинии. Смертность среди самцов по сравнению с самками была выше в таксонах млекопитающих с большими паразитарными нагрузками. Это исследование показало, что паразиты могли играть важную роль в эволюции млекопитающих, в тех таксонах, которые находились под сильным давлением полового отбора. Однако сравнительный анализ корреляций не дает возможность объяснить непосредственный механизм выявленных трендов. Эти тренды могли быть обусловлены иммуносупрессией под влиянием повышенных уровней андрогенов у самцов у видов с выраженным половым диморфизмом и испытавших мощное давление полового отбора. Однако вклад паразитарной инфекции в соматические инвестиции мог быть не менее вероятным гандикапом, чем иммуносупрессия андрогенами (Moore, Wilson, 2002).
Среди внешних факторов, обусловливающих возможность разнонаправленности корреляций между андрогенами, ВПП и иммунитетом, особую роль играет доступность корма (Ohlsson et al., 2003; Strandin et al., 2018). Обеспеченность кормом влияет на иммунитет, уровень андрогенов и ВПП через энергетику и как источник важнейших субстратов, таких, например, как каротиноиды (Blount et al., 2003). С другой стороны, внутреннее состояние организма, меняющееся по ходу жизненного цикла, также существенно влияет на направленность связей между иммунными функциями и андроген-зависимыми признаками (Zuk, Stoehr, 2002). На разных этапах цикла меняется не только уровень тестостерона, но и величина его доза-эффекта для различных андроген-зависимых процессов (Wingfield et al., 1990). Это может быть связано с величиной результирующего эффекта разнонаправленно воздействующих на иммунитет гормонов гипоталамо-гипофизарно-гонадной системы. Если тестостерон подавляет иммунные функции, то гонадотропин-релизинг-гормон, наоборот, стимулирует (Jacobson, Ansari, 2004). Баланс этих гормонов может меняться по ходу жизненного цикла в зависимости от эфективности механизмов стероидогенеза, связывающей емкости байндинг-протеинов, активности систем, метаболизирующих андрогены.
Набор обсуждаемых факторов, которые способны обусловливать разнонаправленность связей между андрогенами, ВПП и иммунитетом при проверках ГИГ на основе корреляций, можно продолжить, но это лишь увеличит громоздкость нашего обзора. Важно, однако, отметить, что при сравнении наборов видов при коррелятивном подходе влияние разных факторов, в том числе водоспецифичных, оценить крайне трудно, если вообще возможно.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОВЕРКИ
Экспериментальные проверки имеют безу-словное преимущество перед сравнительными корреляционными исследованиями, поскольку дают возможность для дифференцированной оценки влияния одних факторов при исключении влияния других. Были проведены многочисленные эксперименты и на лабораторных, и на диких видах различных позвоночных (в основном млекопитающие и птицы), включавшие как манипулирование уровнем тестостерона путем кастрации, использования тестостероновых имплантов и антагонистов тестостерона, которые подавляют продуцирование тестостерона (Ketterson et al., 1996; Roberts et al., 2004; Mills et al., 2009; Foo et al., 2017), так и активацию иммунитета патогенными микроорганизмами и непатогенными антигенами с оценками их влияния на уровень андрогенов (Boonekamp et al., 2008). Проверялись в экспериментах эффекты разных уровней паразитарных нагрузок (например, Mills et al., 2010). Одним из лучших экспериментальных подходов к проверке ГИГ было использование линий животных, прошедших селекцию на различные уровни иммунокомпетентности. Верхальст и соавторы (Verhulst et al., 1999) обнаружили, что самцы кур (Gallus gallus domesticus), отобранные в череде поколений на низкий уровень гуморального иммунного ответа (продукция антител), имели относительно большие размеры гребней (ВПП) и более высокий уровень тестостерона, чем самцы, отобранные на высокий уровень иммунного ответа на антигенную стимуляцию. Это исследование остается одним из наиболее убедительных доказательств генетической связи между тестостероном и иммунной функцией, которая может объяснить иммунный гандикап в развитии ВПП. Селекционный подход был использован и в экспериментах с дикими рыжими полевками (Myodes glareolus), но лишь в поколениях родителей и их непосредственных потомков в условиях, приближенных к естественным (Mills et al., 2010). К сожалению, направленная селекция по признакам низкой и высокой иммунореактивности по одному или нескольким направлениям иммунного реагирования может вести к быстрому ослаблению других системных функций, включая репродуктивную. Так, в нашем эксперименте с селекцией хомячков Кэмпбелла (Phodopus campbelli) в трех поколениях на высокий и низкий гуморальный иммунный ответ на введение эритроцитов барана, повторная иммунизация F2 поколения отобранных хомячков не вела к различиям в уровне тестостерона как фонового, так и на пике вторичного иммунного ответа. Однако низкоиммунные самцы отличались повышенным фоновым уровнем кортизола, были менее агрессивными, а самки в парах с такими самцами имели меньшие по размеру выводки (Роговин и др., 2014). Дальнейшая же селекция вела к быстрому угнетению репродуктивной функции.
Безусловно, перспективным подходом к экспериментальным проверкам ГИГ и связанных с гипотезой вопросов является использование генетически модифицированных животных. Так, нокаут по генам интерлейкина 1 – IL-1α/β (IL1-KO) – у мышей линии BALB/cA вел к росту агрессивности и уровня тестостерона, измерявшегося в фекалиях у самцов. При этом генетически модифицированные мыши не отличались от контрольных BALB/cA по динамике кортикостерона после контактов с молодыми самцами (Tamagawa et al., 2007). Использование иммунодефицитных по Foxn1 генам аутбредных CD-1 и инбредных BALB/c мышей в экспериментах по выбору самца самками показало, что инбредные (BALB/c) самки предпочитали мочу и экскрет препуциальных желез здоровых, не модифицированных самцов (Zhang et al., 2010).
Наибольший интерес представляют биомедицинские исследования с использованием генетически модифицированных мышей с нокаутом по генам, кодирующим рецепторы андрогенов. Так, исследования ген-модифицированных мышей c нокаутом по специфичному в отношении иммунных клеток рецептору андрогена (immune cell-specific androgen receptor, AR) убедительно продемонстрировали, что андроген и его рецептор (А/AR) играют важную роль в регуляции разных иммунных функций (Lai et al., 2012). Ген AR расположен на Х-хромосоме в геноме человека и домовой мыши. Кодируемый им рецептор после связывания c лигандом (тестостерон или 5-дигидротестостерон) транслоцируется в ядро, связывается с андроген-реактивными элементами в промоторах или усилителях целевых генов и включает их экспрессию. Экспрессия AR была обнаружена в различных популяциях (линиях) иммунных клеток, включая нейтрофилы, тучные клетки, макрофаги, В- и Т-клетки (Viselli et al., 1997; Mantalaris et al., 2001; Chen et al., 2010).
Исследования с использованием направленного (conditional) нокаута AR (ARKO), т.е. мышей с AR-нокаутом в определенных группах иммунных клеток, определили новые перспективы для исследования не связанных с репродукцией ролей A/AR, в частности их участия в иммунной регуляции; эти исследования имеют также большой потенциал для развития новых терапевтических технологий для лечения заболеваний иммунной системы (Yeh et al., 2002; Altuwaijri et al., 2009). С помощью методов направленного нокаута было показано, что во врожденном иммунитете А/АR необходим для генерации и правильного функционирования нейтрофилов; А/AR также регулирует заживление ран с участием макрофагов и через продукцию провоспалительных цитокинов. В адаптивном иммунитете A/AR оказывают подавляющее действие на развитие и активацию Т- и В-клеток. Исключение эффекта подавления ведет к увеличению тимуса и росту экспорта незрелых В-клеток (Lai et al., 2012).
СРАВНИТЕЛЬНЫЙ АНАЛИЗ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ – МЕТА-АНАЛИТИЧЕСКИЙ ПОДХОД
Термин “мета-анализ” в настоящее время обычно используется для обозначения ряда статистических процедур, которые оценивают результаты различных исследований по одной или смежным темам через стандартизированный размер эффекта статистических показателей, таких как коэффициенты корреляции, дистанции, отношение шансов (Hedges, Olkin, 1985; Arnqvist, Wooster, 1995). Мета-анализ стал широко распространенным инструментом проверки научных гипотез и устойчивости результатов независимых эмпирических исследований. Его процедуры уже давно и успешно используются в социальных и медицинских науках (Egger et al., 2001). Проник он и в экологию и эволюционную биологию под маркой мощного инструмента синтеза и проверок результатов опубликованных эмпирических исследований (Gurevitch, Hedges, 1999; Koricheva et al., 2013). Математический аппарат мета-анализа продолжает совершенствоваться (Nakagawa, Santos, 2012; Cooper et al., 2019). Все чаще подход противопоставляется традиционному “наративному” обсуждению гипотез. Считается, что мета-анализ превосходит сравнительно-описательные обзоры в возможностях проверки гипотезы, выявления причин неоднородности результатов эмпирических проверок, оценки публикационной предвзятости, и даже для генерирования новых гипотез и будущих направлений исследований (Nakagawa, Poulin, 2012). Однако мета-аналитический подход в эволюционной экологии таит в себе серьезную опасность “не заметить ребенка”. Это связано с особенностями исследований в этой области биологии. На сегодня не существует объективных способов формальной оценки качества каждого эмпирического исследования; по существу качество оценивается только через размер выборки (Poulin, Forbes, 2012). Неизбежный формализм мета-аналитического подхода ведет к недоучету биологического базиса, присутствующего в эмпирических исследованиях (Ioannidis, 2010). Кроме того, литература по экологии и поведению изобилует неадекватным для мета-аналитического подхода представлением основных статистических данных в эмпирических исследованиях (часто отсутствует возможность преобразования их в статистические показатели размера эффекта; Poulin, Forbes, 2012). Существуют и объективные трудности стандартизации результатов экологических и поведенческих исследований эволюционной направленности, в отличие, например, от медицины. Это и различные неучтенные условия (факторы), в особенности при исследованиях в природе, и исследование одних и тех же явлений на разных популяциях или видах со своей спецификой (Hadfield, Nakagawa, 2010; Lajeunesse, 2010). Ограничение возможности однозначной интерпретации результатов мета-анализа эко-физиологических, эко-иммунологических и поведенческих данных обусловлено низкой величиной эффектов и статистическими ограничениями из-за обычно малых размеров выборок в исследованиях, в особенности если эти исследования проводятся в природе (Gaigher et al., 2019). Тем не менее, хотя мета-аналитический подход не является панацеей, использование его для обобщения эмпирических исследований, в которых так или иначе оценивается валидность ГИГ, позволило получить интересные обобщения и способствовало формированию новых взглядов на проблему связей между экспрессией ВПП, эндокринными и иммунными механизмами и поведением, связанным с выбором полового партнера.
Первый мета-анализ результатов проверок ГИГ был посвящен оценке значимости и направления связи между уровнем тестостерона и иммунокомпетентностью (Roberts et al., 2004). К 2004 г. иммуносупрессия, вызванная тестостероном, была отмечена в ряде исследований, хотя эффект был незначительным, и при контроле исследований, проведенных на одном и том же виде, статистически значимая связь утрачивалась. В этом исследовании не было выявлено влияние тестостерона на прямые измерения иммунной функции (количество лейкоцитов, вырабатываемых антител или реакция кожной гиперчувствительности на растительный белок – фитогемагглютинин), но тестостерон положительно влиял на зараженность эктопаразитами, особенно у рептилий (Roberts et al., 2004).
Проведенный недавно Йонг Жи Фу с соавторами (Foo et al., 2017) мета-анализ результатов большого числа публикаций по эффектам половых гормонов у разных видов позвоночных животных (тестостерона самцов и эстрогена самок) на разные ветви иммунной системы свидетельствует в целом в пользу ГИГ. Результаты экспериментальных исследований (n = 66) как клеточного, так и гуморального адаптивного иммунитета, равно как и мета-аналитические средние, свидетельствуют в пользу подавляющего адаптивный иммунитет эффекта тестостерона. В отличие от экспериментальных работ, мета-анализ исследований, авторы которых анализировали корреляции уровней циркулирующего тестостерона с показателями иммунореактивности (n = 38), не дал однозначного результата. В то время как для гуморального иммунного ответа эффект тестостерона оказался статистически незначимым, для клеточного иммунитета эффект оказался положительным. Мета-аналитическое среднее эффекта тестостерона в корреляционных исследованиях оказалось статистически незначимым. Отсутствие подтвержденного эффекта в исследованиях уровней циркулилирующего гормона объяснимо с позиции их доказательной слабости по сравнению с контролируемыми экспериментами.
Число исследований, в которых проверялись эффекты эстрогена самок, существенно меньшее (Foo et al., 2017). Тенденция к положительному влиянию эстрогена на иммунитет в экспериментальных исследованиях (n = 38) осталась неподтвержденной – мета-аналитическое среднее оказалось статистически незначимым. В экспериментальных исследованиях статистически незначимым оказался эффект эстрогена в отношении гуморального иммунитета, в то время как в отношении клеточного иммунитета эффект оказался статистически значимым, но не положительным, как можно было ожидать, а отрицательным. Корреляционных связей эффектов эстрогена было проанализировано всего четыре, и, хотя мета-аналитическое среднее свидетельствовало о положительном эффекте эстрогена, этот эффект утрачивался при учете филогенетического сигнала. Если к этому добавить малый размер выборки и ограниченные возможности корреляционных исследований, то к полученному результату следует относиться с большой осторожностью.
Другое направление проверок валидности ГИГ с помощью мета-анализа включало экспериментальные проверки влияния активации иммунитета патогенными микроорганизмами и непатогенными антигенами на уровень андрогенов (Boonekamp et al., 2008). Мета-анализ 13 таких проверок, опубликованных разными авторами, показал средний по силе подавляющий эффект экспериментальной активации адаптивного иммунитета на уровень тестостерона в крови (r = –0.52), независимо от того, патогенные или непатогенные антигены были использованы в качестве активирующих иммунитет агентов. Последний результат особенно важен, поскольку показывает, что иммунная активность сама по себе вызывает подавление уровня тестостерона (Boonekamp et al., 2008).
РАЗВИТИЕ ГИПОТЕЗЫ ИММУННОГО ГАНДИКАПА И АЛЬТЕРНАТИВНЫЕ ГИПОТЕЗЫ
Гипотеза иммунного гандикапа тесно связана с генетически близкими гипотезами физиологических взаимодействий. Первая из них – “гипотеза перераспределения ресурсов”, или “гипотеза трейдоффа” (“resource allocation hypothesis”, или “resource trade-off hypothesis”) – по существу представляет собой переосмысленный вариант ГИГ. Впервые гипотеза перераспределения была предложена Брауде с соавторами (Braude et al., 1999) как альтернатива ГИГ. Авторы предположили, что тестостерон является не столько иммуносупрессором, сколько влияет на распределение иммунных клеток в организме (immunoredistribution hypothesis). Тестостерон способен уменьшать количество циркулирующих лейкоцитов, но на самом деле лейкоциты уходят из русла крови в целевые ткани. Это объясняет неубедительные результаты ряда исследований, проверяющих роль тестостерона как иммуносупрессора. Эти же авторы предположили, что тестостерон может взаимодействовать с кортикостероидами, которые, в свою очередь, влияют на распределение иммунных клеток. Если тестостерон не является иммуносупрессором, то самец “не платит за развитие ВПП”. Однако Курц с соавторами (Kurtz et al., 2000) предложили вариант, при котором “иммуноперераспределение” может вполне быть встроено в модель гандикапа. В стрессовых условиях повреждение тканей (экстремальные физические нагрузки, увеличение скорости обмена веществ и, соответственно, накопление продуктов обмена) может отвлечь ресурсы организма от защиты от паразитов и инфекций. В этом случае компромисс достигается между различными компонентами иммунной системы (Kurtz et al., 2000).
В общем виде “гипотеза трейдоффа” исходит из постулата об ограниченности ресурсов (энергия и субстраты) в организме животного. Ожидается, что естественный отбор будет поддерживать их оптимальное распределение в зависимости от ситуации, что ведет к компромиссам между различными компонентами приспособленности (Stearns, 1989, 1992), в частности между дорогостоящей иммунной защитой организма и различными аспектами репродукции (Лохмиллер, Мошкин, 1999; Rolff, 2002; Zuk, Stoehr, 2002). Выживание для самок имеет большее значение, чем для самцов (у птиц, однако, эмпирические данные по выживаемости полов свидетельствуют об обратном; Паевский, 2020). Поэтому самки больше, чем самцы, инвестируют в долголетие, т.е. в иммунные функции, повышая вероятность выживания. Самцы же жертвуют иммунной защитой, так как увеличение прекопуляционных затрат приносит им большую пользу в плане роста приспособленности (Rolff, 2002). Гипотеза не акцентирует внимание на иммуносупрессии под воздействием тестостерона и предсказывает, что только особи с большим запасом ресурсов могут позволить себе выделять значительную их часть на орнаменты не в ущерб своему здоровью, не ограничивая потребностей функциональных систем организма, конкурирующих за энергию и субстраты (Lozano, 1994; Schantz et al., 1999; Møller et al., 2000; Alonso-Alvarez et al., 2008; McGraw et al., 2010). Несмотря на популярность этой гипотезы, прогнозы на ее основе остаются спорными, поскольку как сами доступные ресурсы, так и все направления их распределения в организме оценить далеко не просто.
В качестве альтернативы гипотезе трейдоффа (перераспределения) была выдвинута “гипотеза общих траекторий” (“shared pathway hypothesis”). В ее основе лежит идея о том, что индивидуальное состояние (статус здоровья особи) зависит от функционального единства ключевых систем организма (Hill, 2011). В соответствии с этой гипотезой, не конкуренция за ресурсы и, как результат, их перераспределение, а взаимодействие ключевых траекторий биохимических процессов может объяснить корреляции между качеством орнамента (ВПП) и основных функций организма, включая иммунокомпетентность (Hill, 2011, 2014). В формировании этих траекторий на уровне клетки ключевая роль принадлежит митохондриям (Koch et al., 2017). Основу для этой митохондриальной функциональной гипотезы предоставляет богатая биомедицинская литература, связывающая сигнальные траектории иммунной системы и эффекторные функции митохондриальной активности. Воздействие патогенов или других стрессоров стимулирует гормональные и негормональные сигнальные пути, которые опираются непосредственно на митохондриальные белки, запускающие процессы, необходимые для эффективного иммунного ответа. Некоторые специфические сигнальные белки митохондрий (MAVS, ECSIT), окислительное фосфорилирование и биосинтез имеют решающее значение для систем врожденного и адаптивного иммунитета. Митохондрии также являются центрами синтеза стероидных и тиреоидных гормонов, и их активность зависит от митохондриальной регуляции продукции энергии, что, в свою очередь, влияет на состояние иммунной системы и экспрессию орнамента (Koch et al., 2017). Высокое качество орнамента и демонстрации зависят от нормального функционирования митохондрий; помимо энергетического обеспечения, в митохондриях происходит превращение каротиноидов в пигменты украшений (превращение желтых каротиноидов, поступающих с пищей, в красные, участвующие в формировании орнаментов); необходимые для этого ферменты действуют в тесной связи с комплексами окислительного фосфорилирования. Тщательно регулируемая продукция АТФ, а также другие митохондриальные сигналы играют исключительно важную роль в регуляции нейрогенеза и в экспрессии когнитивно сложных (пение птиц) или моторных (athletic) демонстраций. Таким образом, митохондриальные процессы представляют собой “общий путь”, который определяет возникновение корреляций высшего порядка (Koch et al., 2017). В итоге митохондрии являются центрами обеспечения и протекания биохимических процессов в клетке, а происходящие в них процессы способны объяснить связь между сигнальными и регуляторными функциями гормонов, иммунными защитными функциями организма, его физическим состоянием и экспрессией ВПП (орнаментов, демонстраций). Авторы гипотезы считают, что подход, в центре внимания которого лежит оценка состояния митохондрий и рассмотрение митохондриальных биохимических траекторий, должен стать ключевым в понимании сложных систем связей “половые стероиды – физическое состояние” и “ВПП особи – иммунитет”; данный подход вообще снимает проблему возможности нечестного сигнала и иммунного гандикапа как способа его исключения (Hill, 2011, 2014).
ИММУННЫЙ ГАНДИКАП И ОКСИДАТИВНЫЙ ГАНДИКАП
Тестостерону принадлежит сигнальная роль в обеспечении связи между митохондриальной функцией и производством орнамента, но орнаменты могут быть и напрямую связаны с функцией митохондрий, независимо от гормонального контроля (Johnson, Hill, 2013). Механизмы, связанные с экспрессией зависящих от состояния хозяина ВПП, включая метаболическую конверсию каротиноидов, развитие нервной системы, когнитивную и моторную функции, хемилюминесцентные световые демонстрации и собственно структуры орнаментов, состоящие из большого количества белка, должны быть напрямую связаны с эффективностью клеточного дыхания (Hill, 2014).
Митохондриальная функция может быть отражена в орнаментации не только потому, что митохондрии производят АТФ, необходимую для обеспечения энергозатратных процессов и синтеза сложных белков (Lane, Martin, 2010), но и потому, что экспрессия орнамента может быть чувствительна к окислительно-восстановительному гомеостазированию организма, которое в значительной степени опосредуется митохондриями (Ježek, Hlavatá, 2005; Cecarini et al., 2007; Hill, Johnson, 2012). Эти отношения между окислительным стрессом и состоянием орнаментов являются предметом растущего интереса в области экологии окислительного стресса (Monaghan et al., 2009; McGraw et al., 2010; Costantini, 2014). Поскольку животные не могут сами синтезировать каротиноидные пигменты, используемые для окраски каротиноиды поступают в организм с пищей. Диеты большинства животных содержат преимущественно желтые, а не красные каротиноиды (McGraw, 2006), поэтому красная пигментация требует метаболической конверсии желтых пищевых каротиноидов в красные через реакцию кетолации (ketolation) (Brush, 1990). Кетолация каротиноидов происходит в митохондриях в ассоциации с комплексами электрон-транспортной цепи (Johnson, Hill, 2013; Ge et al., 2015; Lopes et al., 2016). Таким образом, способность животного генерировать красный или желтый цвет может зависеть от окислительного статуса и мембранного потенциала митохондрий; митохондриальная дисфункция нарушает процесс кетолации и вызывает утрату красного цвета орнамента.
Кроме того, было высказано предположение, что энергетические ограничения во время развития нервной системы могут стать ключевым фактором, определяющим качество песни птиц; характеристики песни могут быть непосредственно связаны с неврологическим качеством особи, его когнитивными возможностями (Peters et al., 2014). С учетом того, что производство АТФ необходимо для поддержания энергетически дорогого процесса нейрогенеза, функциональное состояние митохондрий может быть ключевым в определении связи состояния организма с качеством песни. Роль качества митохондрий как детерминанта когнитивных способностей была неоднократно продемонстрирована у людей (Cheng et al., 2010; Wallace, Fan, 2010; Massaad, Klann, 2011; Morava, Kozicz, 2013). Все это говорит о том, что высоко функциональные митохондрии необходимы для полноценной экспрессии сигнальных признаков (Hill, 2014).
Тестостерон может выступать не только в роли потенциального иммуносупрессора (Folstad, Karter, 1992) и стимулятора развития и экспрессии орнаментов у самцов, но и быть причиной увеличения продукции реактивных форм кислорода (ROS) (Alonso-Alvarez et al., 2007; Mougeot et al., 2009). Происходит это от того, что высокий уровень тестостерона связан с высоким уровнем метаболизма (Buchanan et al., 2001) и активной локомоцией (Wikelski et al., 1999). В норме высокая скорость метаболизма и повышенная мышечная активность могут не вызывать изменения уровня ROS или даже снижать продукцию ROS в процессе окислительного фосфорилирования (Murphy, 2009; Jastroch et al., 2010). Однако в случае нарушения нормальной работы митохондрий опосредованное тестостероном повышение уровня активности и спроса на АТФ могут усугубить продукцию ROS и окислительное повреждение (Lane, 2011).
Альтернативная ГИГ “гипотеза оксидативного гандикапа” (Alonso-Alvarez et al., 2007) утверждает, что сексуально отобранные признаки остаются честными, потому что тестостерон повышает чувствительность (или подверженность) индивида к оксидативному стрессу. Тестостерон может влиять на способность особи защищать себя (восстанавливать клеточные механизмы) от окислительного повреждения, а также влиять на скорость образования активных форм кислорода, причем эти действия могут происходить независимо друг от друга (Alonso-Alvarez et al., 2007). Андроген опосредует компромисс между экспрессией вторичных половых признаков и борьбой со свободными радикалами или реактивными формами кислорода, формирующимися в основном как побочные продукты клеточного дыхания. Цветные орнаменты, контролируемые тестостероном, часто обусловлены каротиноидными пигментами (желто-оранжево-красная окраска). Однако каротиноиды являются мощными антиоксидантами, помогающими клетке бороться со свободными радикалами. Тестостерон может положительно влиять на концентрацию циркулирующих каротиноидов, обусловливая отток каротиноидов от резервуаров пигментов в цветовых орнаментах для борьбы с окислительным стрессом (Alonso-Alvarez et al., 2008). В некоторых исследованиях, в которых непосредственно проверялась гипотеза оксидативного гандикапа, получена поддержка гипотезы (Alonso-Alvarez et al., 2007, 2008; Mougeot et al., 2009; Hoogenboom et al., 2012), тогда как результаты других проверок гипотезу не поддерживают (Isaksson et al., 2011; Casagrande et al., 2012; Taff, Freeman-Gallant, 2014; Baldo et al., 2015).
Учитывая, что половые стероиды способны связываться с внутриклеточными рецепторами и действовать как факторы транскрипции (Ketterson, Nolan, 1999; Nelson, Kriegsfeld, 2016), измерение взаимосвязи между тестостероном и транскрипцией может пролить свет на непосредственные каналы влияния тестостерона. Современные подходы к секвенированию, такие как РНК-секвенирование (RNA-seq), позволяют оценивать скоординированные, крупномасштабные транскрипционные ответы (транскриптомный анализ), не фокусируя внимание на целевых генах-кандидатах (например, через qПЦР). Методы RNA-seq были использованы для изучения роли андрогенов в экспрессии генов, особенно в контексте половых различий (Gao et al., 2015; Cox et al., 2017) и развития гонад (Monson et al., 2017; Zheng et al., 2019). Для оценки молекулярных последствий экспериментально повышенного уровня тестостерона с помощью имплантов Ньюхаус и Вернаско (Newhouse, Vernasco, 2019) использовали ранее опубликованные данные RNA-seq двух исследований. Результаты этих исследований, включавших два вида птиц и три типа тканей, свидетельствовали в пользу ГИГ, но не поддержали гипотезу оксидативного гандикапа. У особей птиц, получавших экзогенный тестостерон, наблюдались сильные признаки иммуносупрессии, охватывающие как клеточный, так и гуморальный иммунитет. Транскриптомный анализ свидетельствовал о том, что тестостерон влияет на иммунокомпетентность индивида, обеспечивая, как заключают авторы, честность поддерживаемых половым отбором признаков, но не влияет на подверженность индивида окислительному стрессу.
ВЛИЯНИЕ ФИЗИОЛОГИЧЕСКОГО СТРЕССА НА УРОВЕНЬ ПОЛОВЫХ ГОРМОНОВ, РАЗВИТИЕ И ЭКСПРЕССИЮ ВПП И ИММУНИТЕТ
Роль гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) в мобилизации и перераспределении ресурсов организма под воздействием стрессоров для адаптации к новым условиям и восстановления нарушенного равновесия организма хорошо известна (Sapolsky, 1992; Wingfield, Sapolsky, 2003; Chand, Lovejoy, 2011, и др.). Хотя повышение уровня глюкокортикоидов (ГК; гормонов стресса) способствует выживанию в краткосрочной перспективе, их хронически повышенный уровень подавляет репродуктивную и иммунную функции (Sapolsky et al., 2000; Martin, 2009). Наиболее популярна идея о том, что иммунитет ослабевает во время стрессовых состояний, способствуя перераспределению ресурсов организма для обеспечения функций, необходимых для выживания в данный момент, в данной стрессовой ситуации (Sapolsky et al., 2000).
Другое объяснение ослабления иммунитета при стрессе предполагает минимизацию аутоиммунного повреждения. Выброс гормонов стресса косвенно приводит к появлению новых аутоантигенов из-за деградации тканей; предполагается, что иммунная активность должна быть подавлена, чтобы уменьшить побочный ущерб от аутоиммунного повреждения (Råberg et al., 1998).
Иммуносупрессия возникает в долговременных стрессовых ситуациях при недостатке пищи, при суровых погодных условиях, при смене социального статуса в группе в результате долговременного социального давления (Лохмиллер, Мошкин, 1999; Martin, 2009). Чувствительность к ГК может быть эпигенетически запрограммирована в раннем возрасте; повышенная подверженность стрессорам до наступления зрелости повышает влияние ГК на иммунитет в зрелом возрасте (Shanks et al., 2000).
Одни и те же экологические и социальные факторы могут по-разному влиять на связи стресса с иммунитетом у видов с разным образом жизни. Например, виды, живущие группой, испытывают разный набор стрессоров по сравнению с одиночными видами. У видов с постоянными парами удаление партнера ведет к повышению уровня ГК и сказывается на скорости заживления ран; у промискуитетных видов подобные иммунные эффекты отсутствуют (Glasper, Devries, 2005). Стресс, однако, не обязательно обусловливает иммуносупрессию; в ответ на преходящие, непредсказуемые стрессоры, иммунная активность может усиливаться, особенно в тех местах (органах и системах органов), где требуется повышенная иммунная защита. Усиление иммунного реагирования у животных наблюдается в ответ на острые стрессовые состояния (агрессивные взаимодействия, соприкосновение с паразитом, с хищником, при развитии инфекции, при ранениях) (Martin, 2009).
Активированная стрессором ГГНС может влиять на экспрессию ВПП (Buchanan, 2000) как косвенно, через воздействие на иммунную систему (Møller, 1995; Buchanan, 2000), влияя на физический статус организма (Husak, Moore, 2008), так и напрямую, через митохондриальную функцию (Manoli et al., 2007; Shutt, McBride, 2013), и во взаимодействии с тестостероном (Buchanan, 2000; Roberts et al., 2007; Husak, Moore, 2008).
Одной из причин того, что тестостерон по-разному влияет на экспрессию ВВП у разных видов позвоночных животных, может быть эффект глюкокортикоидов (Roberts et al., 2004). С другой стороны, вторичные половые признаки могут сами служить сигналами индивидуальных различий в стресс-реактивности или эффективности срабатывания регуляторных контуров отрицательной обратной связи в ГГНС (Pfaff et al., 2007; Roberts et al., 2007; Husak, Moore, 2008; Bortolotti et al., 2009). Стресс-реактивность сама может находиться под давлением полового отбора (Schmidt et al., 2012). Еще в 1990-е годы на мышах линий BALB/cLac и C57Bl/6J было показано, что выраженная адренокортикальная реакция при физическом стрессе в ответ на низкую температуру сочетается с более эффективным формированием специфических механизмов холодовой адаптации у мышей C57Bl/6J. При этом мыши C57Bl/6J чаще доминировали при экспериментальном социальном конфликте (Moshkin et al., 1993). Отсюда следует, что манифестация доминантного поведения, которое, в принципе, может рассматриваться как андроген-зависимый ВПП, коррелирует с морфофункциональной адекватностью особи к текущим условиям среды. На людях показано, что женщины предпочитают лица мужчин с пониженным уровнем кортизола; такие лица воспринимались как более здоровые, по сравнению с лицами мужчин с высоким уровнем кортизола. Когда статистическая модель учитывала эффект взаимодействия показателей уровня тестостерона и кортизола, предпочтение женщинами черт лица мужчины с высоким уровнем тестостерона утрачивалось (Moore et al., 2011).
Хронические воздействия стрессоров и повышенная активность ГГНС ведут к подавлению продукции тестостерона в семенниках через супрессию продукции лютеинизирующего гормона (Roberts et al., 2004). Однако у некоторых видов млекопитающих замечено, что острая фаза развития ответа на стрессор сопровождается, помимо мобилизации энергоресурсов и усиления катаболических процессов, резким увеличением уровня тестостерона в периферической крови (Sapolsky, 1986; Sapolsky, Ray, 1989; Cavigelli, Pereira, 2000; Hardy et al., 2002; Buck, Barnes, 2003; Oyegbile, Marler, 2005). Это явление, по-видимому, связано с активностью гипоталамо-симпато-адреналовой оси стресса, а конкретно с активацией норадренергической системы и опосредовано участием норадреналина как нейромедиатора. Это может происходить на фоне повышения чувствительности семенников к лютеинизирующему гормону, концентрация которого в острой фазе воздействия стрессоров социальной природы еще не начала падать (Chichinadze K., Chichinadze N., 2008).
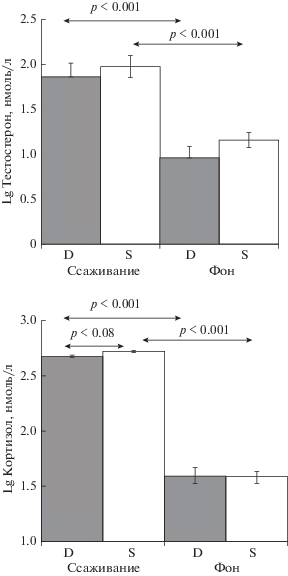
Доминирующие особи и особи, имеющие опыт побед, чаще, чем другие, реагируют на стресс повышенным уровнем тестостерона в крови (Sapolsky, 1986; Sapolsky, Ray, 1989; Hardy et al., 2002; Oyegbile, Marler, 2005). Это может быть связано с тем, что доминанты характеризуются преимущественно норадренергическим ответом на стрессоры социальной природы (Chichinadze K., Chichinadze N., 2008). Симпатическая стимуляция во время стресса может повышать уровень циркулирующего тестостерона не только у доминантов. Это может зависеть от типа социальной системы вида. Гормональные и нейромедиаторные эффекты в острой фазе развития социогенного стрессорного ответа могут указывать на взаимосвязанность вызванного внешними стрессорами гормонального ответа с интенсификацией обменных процессов, в которых тестостерон также принимает участие. В наших исследованиях хомячков Кэмпбелла (Phodopus campbelli) социальный конфликт двух самцов, переходящий затем в конкурентную борьбу за обладание рецептивной самкой, вызывал одинаковое повышение уровня тестостерона в крови как у доминанта, так и у субмиссивного самца, на фоне резкого повышения у них уровня стрессированности при тенденции к более высокому уровню кортизола у субмиссивного самца (рис. 1; Роговин К.А., неопубл. данные).
Рис. 1.
Кортизол и тестостерон в крови у самцов хомячков Кэмпбелла после ссаживания (5 мин) и последующей подсадки к ним рецептивной самки (10 мин). Доминант выделен по агрессивности в 5 мин ссаживаниях. Показана вероятность ошибочного прогноза по результатам парного t-теста с поправкой Бонферрони для 4 сравнений; n = 22. D – доминант, S – проигравший самец.
Эмпирические данные о влиянии стресса на экспрессию ВПП весьма противоречивы – от негативных эффектов (например, Douglas et al., 2009) до положительных (например, Fitze et al., 2009) или отсутствия связи (например, Setchell et al., 2010). Мета-анализ связей фонового и/или модулированного стрессором уровня глюкокортикоидов (4 показателя) с ВПП (118 результатов из 38 исследований на 26 видах позвоночных (млекопитающих, птиц, рептилий и амфибий)) с контролем филогенетического сигнала был проведен сравнительно недавно (Moore et al., 2016). Результаты мета-анализа свидетельствуют о том, что реакция на стрессоры у позвоночных подавляет инвестиции в репродуктивную и иммунную системы и может также вести к сокращению инвестиций в производство ВПП. Однако мета-анализ в целом не дал авторам исследования возможность однозначно оценить роль стресса в половом отборе из-за противоречивых результатов эмпирических исследований о влиянии стресса на экспрессию ВПП. Значимая связь между физиологическими показателями стрессированности и половыми сигналами (вокализация, размерные признаки, признаки окраски и предпочтения противоположного пола) отсутствовала. Средняя величина эффекта, однако, значительно варьировала по четырем типам признаков, подверженных половому отбору. Авторы объясняют полученный результат влиянием на экспрессию признака таких факторов, как экология вида, тип исследуемого признака (структурный или поведенческий), экологический контекст и сложный характер физиологического ответа при стрессе. Очевидно, что эти факторы должны быть учтены объяснительной моделью, но их трудно учесть при мета-аналитическом подходе в силу ограничений со стороны эмпирического материала.
Совсем недавний традиционный, но очень тщательно проведенный сравнительный анализ опубликованных работ о связях уровня глюкокортикоидов (ГК) с половыми сигналами самцов и с выбором самками партнера показал, что взаимосвязь между концентрациями ГК и качеством половых признаков самца также неоднозначна (Leary, Baugh, 2020). Эта неоднозначность сохранялась независимо от того, были исследования сфокусированы на структурных признаках (окраска), на поведении рекламирования (вокализация), рассматривались ли отношения между ГК и сигналами в контексте развития признака или его активации. Тем не менее некоторые эксперименты по выбору партнера, которые были методологически наиболее выдержаны (7 работ), показали, что самки предпочитают самцов с низким уровнем ГК. В этих исследованиях признаки ухаживания самцов были прослежены в их динамике (например, изменение свойств вокализации или электрических сигналов во времени), а уровень ГК изменялся экспериментатором.
Однако выявленная тенденция отнюдь не означает, что половой отбор будет неизменно поддерживать низкую стресс-реактивность. Низкая реактивность будет повышать риск гибели от хищника (Baugh et al., 2017). Это была бы дорогая плата для наиболее экстравагантных самцов (Bernal et al., 2007; Dapper et al., 2011; Leary, Crocker-Buta, 2018). Как считают Лири и Бо (Leary, Baugh, 2020), половой отбор, скорее всего, может благоприятствовать различным гормональным фенотипам с различными репродуктивными стратегиями (например, альтернативными тактиками спаривания). Это разумная мысль, но она не следует непосредственно из результатов анализа. Остается непонятным, насколько результаты экспериментов (предпочтение самцов с пониженной стрессированностью) не являются следствием влияния стрессовой обстановки эксперимента, стресса, наведенного экспериментальными манипуляциями, и насколько широко можно экстраполировать выявленную тенденцию. Например, у кооперативно размножающихся видов (главным образом работы по млекопитающим) именно доминирующие самцы, обладающие наибольшим репродуктивным успехом, отличаются повышенной стрессированностью (Creel, 2001; Creel et al., 2013). Правда, в этих случаях речь может идти об эффектах внутриполового отбора; рекрутирование самок доминантом может осуществляться по праву сильного. С другой стороны, факты измен гаремными самками или самками у социально моногамных видов широко известны (Hill et al., 1994; Clutton-Brock, Kavita, 2006; Platek, Shackelford, 2006; Kokko, 2015, и др.). В наших экспериментах с хомячком Кэмпбелла (промискуитетный вид, но с признаками социальной моногамии) по выбору партнера сексуально мотивированными самками из пар самцов-сибсов, отличавшихся по экспресии ВПП, оказалось, что самки предпочитали спариваться с самцами, не проявлявшими признаков грубого насилия. Ни уровень глюкокортикоидов, ни экспрессия ВПП, ни тестостерон, ни показатели состояния адаптивного иммунитета не влияли на выбор партнера самкой (Rogovin et al., 2017; Васильева и др., 2017).
Анализ немногочисленных работ, в которых исследовались стрессированность самок и их реакция на половые сигналы самцов, свидетельствует об умеренном, демпфирующем влиянии повышенного уровня ГК на сексуальную активность самок (Leary, Baugh, 2020). Однако даже очень высокие уровни ГК в крови и сильные стрессоры далеко не всегда способны подавить сексуальную мотивацию самок. Учитывая более ограниченную временем фертильность самок по сравнению с самцами у многих позвоночных и часто повышенные у самок уровни ГК на пике сексуальной активности, можно предположить, что самки должны быть менее чувствительны к высоким уровням ГК, чем самцы (Wingfield, Sapolsky, 2003). Повышенные уровни ГК, видимо, могут также ослаблять типичные видовые предпочтения в отношении ВПП самца (Leary, Baugh, 2020). Накопление данных такого рода, возможно, расширит наше понимание того, в какой мере ГК способны влиять на интенсивность межполового отбора в отношении ВПП самца.
В исследованиях отношений между орнаментом и ГГНС внимание было сосредоточено на воздействии гормонов стресса на организменные функции и фенотипические признаки. Собственно молекулярный механизм взаимодействия оставался без внимания. Однако, как считает Хилл (Hill, 2014), смещение акцента на процессы, происходящие в клетке, дает возможность конкретизировать и лучше понять природу связи между стрессом, состоянием организма, орнаментом и поведением.
Глюкокортикоиды активно влияют на энергетические процессы в организме. На субклеточном уровне одними из основных мишеней глюкокортикоидов как сигнальных молекул (наряду с другими стероидами и гормонами щитовидной железы) являются митохондрии (Koufali et al., 2003; Psarra et al., 2006; Du et al., 2009; Lee et al., 2013; Shutt, McBride, 2013). Именно митохондрии ответственны за удовлетворение энергетических запросов, обусловленных реакцией на стрессоры – богатые энергией молекулы мобилизуются из энергетических резервов организма. Влияние глюкокортикоидов на функциональную активность митохондрий осуществляется через их воздействие на транскрипцию ядерных генов (Psarra et al., 2006; Scheller, Sekeris, 2013). Однако глюкокортикоидные рецепторы присутствуют и в самих митохондриях (Lee et al., 2013). Таким образом, митохондриальная активность может регулироваться глюкокортикоидами либо посредством прямого воздействия на митохондриальные гены окислительного фосфорилирования, либо косвенным путем через взаимодействие с ядерными генами, которые кодируют комплексы OXPHOS (Lee et al., 2013). Изменения функциональной активности митохондрий, в свою очередь, влияют на целый ряд ключевых аспектов физического состояния организма, включая производство АТФ, теплопродукцию, скорость метаболизма, липогенез, иммунные реакции и окислительный статус (Hill, 2014).
ИММУННЫЙ ГАНДИКАП У ЛЮДЕЙ
В последние годы пробудился настойчивый интерес к проверкам ГИГ на людях. Эти исследования связаны с уже довольно долго продолжающимися поисками критериев выбора партнера женщинами по внешним фенотипическим проявлениям (маскулинность черт лица, тела, голоса, признаки флуктуирующей асимметрии) (Roberts, Little, 2008; Rosenthal, 2017). Показана положительная связь между маскулинностью лица мужчины и антителообразованием в ответ на вакцину против гепатита В (Skrinda et al., 2014). Уровень тестостерона у мужчин был положительно связан как с иммунной чувствительностью к вакцине, так и с привлекательностью мужского лица для женщин. Эта связь была самой сильной среди мужчин с низким уровнем кортизола (Rantala et al., 2012a). Однако в другом исследовании совместного эффекта тестостерона и кортизола на аттрактивность мужского лица для женщин обнаружено не было (Kandrik et al., 2017). Маскулинность лица и тела мужчин принято интерпретировать как ВПП. Однако женщины далеко не всегда предпочитают мужчин с мужественными чертами, а эти черты, как показывают исследования, весьма мало связаны со здоровьем (Nowak et al., 2018). В исследовании Ранталы с соавторами (Rantala et al., 2012b) показано, что не маскулинность, а жировые отложения статистически значимо опосредуют связь силы иммунного ответа (антитела к гепатиту B) с привлекательностью мужского тела и лица для женщин. В этом случае гуморальная иммунореактивность отрицательно связана с жировыми отложениями, а они, в свою очередь, отрицательно связаны с привлекательностью мужчины. Циркулирующий тестостерон также оказался более тесно связанным с количеством жировых накоплений, нежели с маскулинностью.
При изучении непосредственных отношений между маркерами иммунокомпетентности и мужского голоса, Скринда и соавторы (Skrinda et al., 2014) не нашли связи уровня тестостерона или гуморального иммунного ответа на вакцину против гепатита В с основной частотой и формантными частотами мужского голоса. В другом исследовании на двух выборках мужчин было показано, что более высокий уровень циркулирующего тестостерона и более низкий уровень кортизола предсказывают более низкую основную частоту голоса (Puts et al., 2016).
Ходжес-Симеон с соавторами (Hodges-Simeon et al., 2015, 2019) исследовали большую выборку подростков из племени охотников-собирателей Цимане (Tsimane) в Боливии. Возраст наступления пубертата оценивали по кривым динамики индекса массы тела (BMI). Исследователей интересовала связь секреторного иммуноглобулина А (sIgA – антитела, продуцируемые лимфоцитами, которые выделяются на поверхности слизистых – так называемый мукозный иммунитет) и уровня тестостерона в слюне. Результаты свидетельствовали о влиянии тестостерона на связь между состоянием здоровья (BMI и sIgA) и вокальной маскулинностью (об отсутствии связи sIgA с тестостероном у мужчин см. Anders, 2010). На уровне двухфакторных взаимодействий sIgA коррелировал положительно с тестостероном, слабо и положительно с жировыми отложениями, но не коррелировал с основной частотой голоса, ее изменчивостью и формантными характеристиками (Hodges-Simeon et al., 2015). Если у парней уровень свободного тестостерона положительно коррелировал с уровнем иммуноглобулина А в слюне, то у девушек более высокое содержание эстрадиола 2 (Е2) было связано с более низким уровнем sIgA (Hodges-Simeon et al., 2019). Слабые и противоречивые связи между состоянием мукозного иммунитета (ImA), тестостероном в слюне и вокальными характеристиками мужского голоса продемонстрировало недавнее исследование Арноки с соавт. (Arnocky et al., 2018).
Поддерживают ли перечисленные выше исследования ГИГ? Скорее нет. Эти исследования ориентированы в основном на оценки связи между уровнем андрогенизированности, фенотипическими чертами мужчины и выбором партнера женщинами, а иммунная функция в них оценивается по отдельным показателям. В этом смысле запоздалый интерес к ГИГ в недавних исследованиях на людях ставит эти работы в ряд экспериментов по тестированию ГИГ конца 1990-х–начала 2000-х годов. Исследования, в которых иммунокомпетентность у людей в контексте ГИГ оценивается по нескольким параметрам, практически отсутствуют. В первом таком исследовании оценивали связи между рядом показателей врожденного и адаптивного иммунитета (функции нейтрофилов, активность комплемента, активность лизоцима, качественный и количественный анализ В- и Т-лимфоцитов) и уровнем свободного тестостерона, общего тестостерона, дигидроэпиандростенона (DHEA) и дигидротестостерона (DHT) в сыворотке крови здоровых мужчин (Nowak et al., 2018). Сделанные авторами выводы по результатам исследования не свидетельствуют в пользу ГИГ. Уровни свободного тестостерона и отчасти DHT положительно коррелировали с силой иммунного ответа на вакцину против гриппа. Общий тестостерон и DHEA вообще не показали иммуномодулирующих свойств. Авторы приходят к заключению, что у людей андрогены следует рассматривать скорее как иммуномодуляторы, нежели как прямые иммуносупрессоры (Nowak et al., 2018).
ПРОБЛЕМЫ ТЕСТИРОВАНИЯ ГИГ И ПЕРСПЕКТИВЫ ИССЛЕДОВАНИЙ
Многие факторы могут влиять на результаты проверок валидности ГИГ. К ним относятся:
1) различный эффект тестостерона в отношении разных иммунных функций (Лохмиллер, Мошкин, 1999; Braude et al., 1999; Moshkin et al., 2000; Roberts et al., 2004; Litvinova et al., 2010; Foo et al., 2017), тесно связанный с проблемой ресурсной (энергетической и субстратной) стоимости иммунных реакций (Ksiazek et al., 2003; Sandland, Minchella, 2003; Martin et al., 2008; Hasselquist, Nilsson, 2012);
2) видовая специфика хозяина: его экологические требования, система спариваний, устойчивость брачных связей, социальная роль в группе и т.п. (Klein, Nelson, 1998; Лохмиллер, Мошкин, 1999; Moore, Wilson, 2002; Bielby et al., 2015);
3) видовая специфика паразитов и возбудителей болезней (Moshkin et al., 2002; Novikov et al., 2015; Budischak et al., 2018);
4) стадия репродуктивного жизненного цикла (Martin et al., 2008), возраст (Peters et al., 2019);
5) сезонные эффекты (Nava et al., 2001; Nelson et al., 2002; Nelson, 2004; Martin et al., 2008);
6) фаза популяционного цикла, популяционная плотность (Svensson et al., 2001; Calsbeek et al., 2008);
7) пространственная гетерогенность (Albery et al., 2019), качество местообитания (Audet et al., 2015);
8) географическое положение (Martin et al., 2008);
9) климат (Martin et al., 2008; Mignatti et al., 2016; Rollins-Smith, 2017).
Действие перечисленных факторов в большой степени опосредовано механизмом стресса (Nelson, 2004; Zysling, Demas, 2007; Martin, 2009). К стрессорам, влияющим на отношения между тестостероном, ВПП, иммунитетом и репродуктивными качествами, следует отнести и пресс хищников (Roy, Holt, 2008). К этому необходимо добавить проблему несовместимости временных шкал при тестировании ГИГ на уровне межвидовых сравнений. Экспрессия ВПП и зараженность паразитами могут быть не скоррелированы, поскольку ВПП являются относительно устойчивым результатом длительной эволюции, а паразитарные нагрузки широко варьируют во времени и оцениваются в момент исследования. То, что работает на внутривидовом или даже внутрипопуляционном уровне, не обязательно должно работать на уровне межвидовых сравнений.
Получивший популярность мета-анализ как способ проверки валидности ГИГ не способен учесть влияние многих из перечисленных выше факторов, просто в силу ограниченности числа исследований. Неизбежный формализм подхода ведет к недоучету биологического базиса, присутствующего в хорошо спланированных, с удачным выбором объекта эмпирических исследованиях (Ioannidis, 2010). В биомедицинских науках доверие к результатам мета-анализа оправдано существующими стандартами тестирования препаратов и медицинских практик. Перенесенный в эволюционную экологию этот подход таит в себе опасность ошибки первого рода. Это связано с отсутствием строгих стандартов в исследованиях, а также со статистическими ограничениями, обусловленными малыми размерами выборок (Poulin, Forbes, 2012). Не отрицая положительного значения мета-аналитического подхода, нам представляется важным развитие сочетающих сравнительный корреляционный и экспериментальный подходы исследований с хорошо проработанным биологическим базисом. Примеры таких работ существуют как среди сравнительно описательных долговременных индивидуально ориентированных исследований, основанных на анализе связей фоновых показателей иммунокомпетентности, эндокринного статуса, репродуктивного усилия и репродуктивного успеха, так и среди экспериментальных исследований, в которых помимо вышесказанного осуществляются манипуляции с иммунной активностью, гормональным фоном, проводятся поведенческие тесты как в лаборатории, так и в природной обстановке.
Примером первых могут служить недавно опубликованные результаты исследования южноафриканских социальных виверовых – сурикат (Smyth et al., 2018). В их семейных кланах поддерживается система доминантных рангов среди самок. Различия в иерархическом статусе среди членов группы связаны с асимметрией в репродуктивных возможностях, морфологии, поведении, коммуникации и физиологии. Сурикаты уникальны еще и тем, что доминирующие самки характеризуются высокой (наибольшей среди других самок) суммарной концентрацией андрогенов (андростендиона и тестостерона). Для изучения связей иерархического статуса, андрагенизированности организма с врожденной иммунокомпетентностью у самцов и самок сурикат были использованы прямые показатели состояния врожденного иммунитета – активность комплемента и титры природных антител (Smyth et al., 2018). На этом уникальном виде в природе удалось показать, что, по сравнению с подчиненными особями, доминантные животные имели пониженную способность сыворотки крови к уничтожению бактерий, а у доминантных самок относительно подчиненных наблюдалась пониженная гемолитическая активность комплемента. Независимо от пола или социального статуса особи концентрация андростендиона отрицательно предсказывала иммунный статус. Врожденная иммунокомпетентность по названным показателям не была связана ни с внешним состоянием организма, ни c возрастом, ни с репродуктивной активностью. Оказалось, что доминирующие особи обоих полов отличались иммунодефицитом, что позволяет рассматривать иммуносупрессию в качестве платы за ранг. Андростендион самок сурикат может обусловливать доминирование и репродуктивный успех, и достигается это ценой подавления иммунной функции. Следствием подавления иммунитета является увеличение паразитарной нагрузки. К этому нужно добавить, что у самок сурикат хорошо развиты сигнальные средства передачи информации о статусе доминирования. Все сказанное с учетом уникальности социальной системы вида ставит полученные результаты в ряд убедительных свидетельств валидности ГИГ, несмотря на то, что основаны эти результаты на наблюдениях и анализе связей. Эта работа также показала, что эндокринный механизм регуляции иммунитета не обязательно должен быть опосредован исключительно тестостероном.
Другим примером уже экспериментального подхода, сочетающего манипуляции гормонами, паразитарной нагрузкой или иммунокомпетентностью с оценкой конкурентоспособности самцов (репродуктивного усилия в борьбе за самку и приспособленности (репродуктивного успеха)) могут служить замечательные исследования на рыжей полевке (Myodes glareolus), выполненные международным коллективом ученых в Финляндии (Mills et al., 2009, 2010). В этих работах физиологические и поведенческие механизмы, лежащие в основе компромиссов жизненного цикла, были исследованы в условиях, приближенных к естественным. Сначала исследовали эффект тестостерона как физиологического медиатора компромисса между воспроизводством и выживанием (Mills et al., 2009). Самки рыжих полевок в состоянии послеродового эструса предпочитают доминантных самцов, выбирая их мочу (Kruczek, 1997), а препуциальные железы самцов являются тестостерон-зависимыми органами; их секрет привлекает самок (Radwan et al., 2006). У самцов полевок в первом поколении лабораторного разведения определяли фоновый уровень тестостерона; половине из них вшивали имплант с тестостероном, другой половине – плацебо. Доминантный статус самцов оценивали по их успеху в спариваниях с эстральными самками. Иммунокомпетентность самцов определяли по двум показателям гуморального иммунитета – специфическому иммунному ответу на бычий альбумин и по природному иммуноглобулину G (неспецифическая защита организма до иммунизации чужеродным антигеном). Затем был проведен двухфакторный полевой эксперимент в 25 уличных вольерах по 0.2 га каждый, куда помещали четырех самцов – двух с низким и высоким естественным уровнем тестостерона и двух с тестостероновым имплантом и плацебо. К каждой группе самцов подсаживали по шесть уже рожавших самок. Репродуктивный успех самцов оценивали по ДНК родителей и детенышей; беременных самок отлавливали и переносили для рождения детенышей в лабораторию. Эксперименты показали, что самцы с естественно высоким уровнем тестостерона имели более высокий социальный статус (доминирование в условиях лаборатории), большую мобильность в природе (расстояние между точками отлова) в сравнении с самцами с низким уровнем тестостерона. Влияние тестостерона на иммунный ответ также было группоспецифичным; тестостероновые импланты снижали уровень иммунореактивности на бычий альбумин. Экзогенный тестостерон повышал социальный статус, площадь поиска партнера (полигон по точкам отловов), мобильность и репродуктивный успех (число рожденных детенышей). Авторы интерпретировали полученные результаты в терминах платы и выигрыша (иммуносупрессия как плата за репродуктивный успех, опосредованный тестостероном), но возможно и другое объяснение – существование разных поведенческих стратегий и дифференцированная чувствительность поведенческих стратегий к тестостерону. В этом же исследовании было показано, что уровни циркулирующего тестостерона наследуются. Следовательно, как считают авторы, самки полевок могли получать косвенные генетические выгоды от спаривания с самцами – носителями “хороших генов”, ориентируясь на сигналы об их доминантности.
В другой серии аналогичных по постановке экспериментов на рыжих полевках эта же группа исследователей изучала приспособленность (fitness) предварительно искусственно отселектированных в двух поколениях (P и F1) самцов рыжих полевок на низкую (Н) и высокую (В) иммунокомпетентность по тем же показателям состояния гуморального иммунитета (общий иммуноглобулин G и антитела к бычьему иммуноглобулину), а также по показателю состояния клеточного иммунитета (кожная реакция гиперчувствительности замедленного типа на фитогемагглютинин). Предварительно была подтверждена хорошая наследуемость иммунологических показателей, причем результаты селекции влияли на уровень циркулирующего тестостерона. Репродуктивное усилие оценивали по агрессивному доминированию и презиготическому репродуктивному успеху в лабораторных тестах. Полевой двухфакторный эксперимент был проведен в 14 уличных вольерах площадью по 0.2 га каждый. В течение года в вольерах контролировали смертность и репродуктивный успех самцов с помощью анализа ДНК родителей и потомков. В каждый из вольеров помещали по 8 самцов и 8 самок полевок после предварительной лабораторной подготовки, причем вольеры были сгруппированы следующим образом: 1) группа с преобладанием самцов с высокой иммунокомпетентностью (6В : 2Н) и отсутсвием паразитарной нагрузки; 2) группа самцов с преобладанием самцов с низкой иммунокомпетентностью (6Н : 2В) и паразитарной нагрузкой; 3) группа самцов 6В : 2Н с паразитами и 4) группа самцов 6Н : 2В, свободных от паразитов. Авторам удалось убедительно показать, что компромисс между репродуктивным усилием и выживанием опосредован иммунокомпетентностью и паразитами. Оказалось, что в уличном эксперименте в условиях отсутствия паразитарной нагрузки (т.е. гандикапа, опосредованного тестостероном) репродуктивное усилие было высоким у низкоиммунных и низким у высокоиммунных самцов, а смертность в этих группах значимо не отличалась. При этом приспособленность, которую оценивали через успех размножения в природе, была ниже у высокоиммунных самцов. Однако в условиях паразитарной нагрузки приспособленность у низкоиммунных и высокоиммунных самцов оказалась сходной. У первых это было обусловлено высоким репродуктивным усилием и высокой смертностью, а у вторых – низким репродуктивным усилием и низкой смертностью. Это означает, что самки могли получать косвенные генетические выгоды, спариваясь с самцом, генетически устойчивым к заболеваниям, либо с самцом с высоким репродуктивным усилием. Отсутствие сочетания выгод того и другого опосредовано трейдоффом между иммунокомпетентностью и тестостероном. Это замечательное исследование показало, что иммунный ответ генетически обусловлен и вариативен, физиологически связан с тестостероном и, таким образом, может обусловливать генетическую изменчивость подверженных половому отбору признаков.
Весьма перспективным для тестирования ГИГ и смежных с ней гипотез является экспериментальный подход, в котором моделируется интенсивность полового отбора. Такие экспериментальные модели используются в работах с насекомыми (Lieshout et al., 2014; Syed et al., 2020), но могут быть применены и к позвоночным животным (рыбы и грызуны). Например, на жуках Callosobruchus maculatus интенсивность полового отбора моделировали последовательной селекцией в ряду поколений в двух линиях со смещенным в сторону самцов или самок соотношением полов (80 самцов и 40 самок, 40 самцов и 80 самок). Предполагалось, что интенсивность полового отбора выше в линии с соотношением полов, смещенным в сторону преобладания самцов. Манипулирование интенсивностью полового отбора показало, что интенсивный отбор в отношении важных при копуляции морфологических признаков и соответствующего репродуктивного поведения ведет к снижению иммунокомпетентности как у самцов, так и у самок. Авторы интерпретируют это как свидетельство увеличения затрат, связанных с репродукцией при интенсивном отборе половых признаков. Эти результаты подчеркивают, что репродуктивные стратегии как самцов, так и самок формируются за счет взаимодействия между фенотипической пластичностью и генетическими механизмами экспрессии половых признаков.
Последние годы ознаменовались поиском решения проблемы иммунного гандикапа на уровне молекулярных процессов в клетке (Koch et al., 2017). Послужит ли внимание последних лет к митохондриальным биохимическим траекториям ключом к пониманию сложной системы связей между половыми стероидами, физическим состоянием особи и иммунными функциями, и позволит ли это решить проблему нечестного сигнала и иммунного гандикапа как способа его исключения, покажет время. Акцент на внутриклеточные биохимические процессы переключает внимание исследователя с организменного на клеточный уровень. Учет внутриклеточных процессов, безусловно, расширяет наше понимание взаимосвязанности и взаимообусловленности физиологических процессов в организме, но не следует забывать и то, что половой отбор действует на уровне организма. Выбирающую партнера самку (если она действительно выбирает) “интересуют” именно внешние черты или особенности поведения самца, которые являются прямыми либо косвенными индикаторами его приспособленности.
ЗАКЛЮЧЕНИЕ
За прошедшие почти три десятилетия ГИГ была конкретизирована по разным направлениям (Westneat, Birkhead, 1998; Buchanan, 2000; Møller et al., 2000; Alonso-Alvarez et al., 2008; Hill, 2014, и др.). Была подтверждена в общем виде ее работоспособность (Boonekamp et al., 2008; Foo et al., 2017). ГИГ выигрывает по результатам проверок по сравнению с другими предложенными объяснениями (Newhouse, Vernasco, 2019). Часто ГИГ ставится в вину, что ей не удается в общем виде объяснить, за счет чего украшения (проксимальный механизм) могут служить честным показателем здоровья; в частности, она не может объяснить орнаменты, экспрессия которых не регулируется тестостероном (Kimball, Ligon, 1999), и тот факт, что тестостерон не является универсальным иммуносупрессором (Ros et al., 1997; Hasselquist et al., 1999; Peters, 2000; Lindstrom et al., 2001; Roberts et al., 2004). Тем не менее именно благодаря ГИГ, стимулировавшей многочисленные исследования, отчетливо обозначилась дифференцированная роль половых стероидных гормонов в отношении иммунных функций, в развитии и экспрессии многих орнаментов и демонстраций. По сей день ГИГ остается ведущей в непрекращающихся дискуссиях о том, в какой мере качество орнаментов и демонстраций может честно информировать самку о здоровье партнера. Полученные результаты в целом свидетельствуют в пользу существования такой сигнальной функции ВПП. Вопрос в том, насколько такие сигналы универсальны.
Недавно пробудившийся интерес среди эко-иммунологов и эволюционных экологов к молекулярным механизмам, обусловливающим сложные взаимосвязи физиологических процессов в организме, и привлечение огромных достижений из области биомедицинских наук несомненно позитивен и заставляет экологов задуматься о том, насколько сложной и взаимообусловленной является система корреляций физиологических функций в организме, внешним проявлением которой является экспрессия ВПП.
ГИГ и смежные с ней гипотезы акцентируют внимание на непрямых выгодах, которые извлекает самка при выборе полового партнера (устойчивость к болезням, хорошие гены), результаты которого оцениваются через приспособленность следующего поколения (indirect mate choice). Как эволюционная гипотеза, ГИГ рассматривает лишь один из нескольких возможных сценариев эволюции ВПП, предлагая физиологический механизм в качестве объяснения. Варианты выбора партнера самкой на самом деле гораздо шире схемы, предлагаемой ГИГ. Предпочтение самкой орнамента самца может быть результатом прямых выгод, например, если ВПП отражают способность самца обеспечивать такие непосредственно доступные самке преимущества, как качественная территория, доступность корма или защита от хищника (Møller, Jennions, 2001). Выбор самкой партнера может также отражать результат противодействия прямому ущербу, обусловленному поведением самца (Rogovin et al., 2017); в ряде исследований показано, что самка оказывает предпочтение самцам с меньшей экспрессией ВПП (Arnqvist, Rowe, 2005). Предпочтение самкой украшения самца может изначально развиваться под действием естественного отбора по причинам, не связанным с половым отбором, например в связи с добыванием пищи или избеганием хищников (Ryan, 1998; Endler, Basolo, 1998). Такой путь известен под названием сенсорного сдвига (sensory bias; Andersson, Simmons, 2006) или перцептивного влияния (perceptive bias; Ryan, Cummings, 2013). Брачные предпочтения среди сородичей (например, выбор партнера) часто зависят от перцептивных особенностей, которые развивались в других контекстах. Эти перцептивные адаптации и ограничения, влияющие на выбор, во многих случаях приносят прямые выгоды и не должны быть дорогостоящими для самок (Ryan, Cummings, 2013). Еще одно направление выбора партнера основано на механизме генетической совместимости, который предполагает выгоды от выбора партнера с аллелями, комплементарными или расширяющими геном выбирающей самки (Tregenza, Wedell, 2000; Colegrave et al., 2002; Mays, Hill, 2004; Neff, Pitcher, 2005; Roberts, Little, 2008, и др.). Пример этому дает комплекс генов гистосовместимости (ГКГ); преимущество от совместимости аллелей ГКГ может объяснять причину множественных спариваний (Penn, Potts, 1999; Tregenza, Wedell, 2000; Kamiya et al., 2014; Winternitz et al., 2017). Эти механизмы взаимосовместимы и могут действовать одновременно или сменять друг друга во времени, что делает эволюцию брачных предпочтений и ВПП проблемой множественной причинности (Andersson, Simmons, 2006).
В рассмотренных выше случаях речь шла о межполовом отборе, т.е. выборе самца самкой. Но многие ВПП формируются под действие естественного отбора как результат конкуренции самцов. Межполовой и внутриполовой отбор могут действовать независимо или совместно усиливая друг друга, либо в противоположных направлениях (Hunt et al., 2009).
Все сказанное делает ГИГ частной гипотезой, объясняющей лишь один их возможных сценариев действия полового отбора. Почему же все-таки до сих пор ГИГ пользуется таким авторитетом? Возможно, это связано с тем, что ГИГ – это гипотеза о проксимальном механизме, частично переключившая внимание из области ультимативных объяснений адаптивной эволюции в область функциональных проксимальных объяснений, дающих ответ на вопрос, как это работает? Но ГИГ не просто переключила внимание и привлекла специалистов из другой области знания, а соединила чисто эволюционную проблематику с исследованиями функциональных физиологических механизмов.
За прошедшие 28 лет существования ГИГ подтвердила свою актуальность как работотоспособная гипотеза. Может ли она служить объяснительной панацеей на все случаи? Конечно же, нет. В биологии, в особенности когда уровень рассмотрения явлений касается систем высшего уровня организации, универсальных решений вообще крайне мало.
Авторы признательны профессору М.П. Мошкину за ценные замечания, позволившие улучшить статью. Работа выполнена в соответствии с планом НИР ИПЭЭ РАН, тема “Экология организмов и сообществ”.
Список литературы
Васильева Н.Ю., Шекарова О.Н., Хрущова А.М., Роговин К.А., 2017. Выбор полового партнера самкой, конкуренция самцов и половые признаки. Экспериментальное исследование направленности механизмов полового отбора у хомячка Кэмпбелла (Phodopus campbelli Thomas 1905) // Журн. общ. биологии. Т. 78. № 2. С. 14–31.
Лохмиллер Р.Л., Мошкин М.П., 1999. Экологические факторы и адаптивная значимость изменчивости иммунитета мелких млекопитающих // Сиб. экол. журн. Т. 1. С. 37–58.
Паевский В.А., 2020. Половая структура и поло-специфическая выживаемость в популяциях птиц (обзор) // Журн. общ. биологии. Т. 81. № 4. С. 272–284.
Роговин К.А., Хрущова А.М., Шекарова О.Н., Бушуев А.В., Соколова О.В., Васильева Н.Ю., 2014. Иммунокомпетентность и репродуктивные качества самцов хомячка Кэмпбелла, селекционированных на низкий и высокий гуморальный иммунный ответ на эритроциты барана (SRBC). К проверке гипотезы “иммунного гандикапа” // Журн. общ. биологии. Т. 75. № 5. P. 372–384.
Розен Б.Б., 1994. Основы эндокринологии. М.: Изд-во МГУ. 384 с.
Ройт А., Бростофф Дж., Мейл Д., 2000. Иммунология. М.: Мир. 592 с.
Abbas A.K., Lichtman A.H., Pillai S., 2014. Basic Immunology: Functions and Disorders of the Immune System. 4th ed. Philadelphia: Elsevier Saunders. 319 p.
Ajayi A.A.L., Mathur R., Halushka P.V., 1995. Testosterone increases human platelet thromboxane A2 receptor density and aggregation responses // Circulation. V. 91. P. 2742–2747.
Albery G.F., Becker D.J., Kenyon F., Nussey D.H., Pemberton J.M., 2019. The fine-scale landscape of immunity and parasitism in a wild ungulate population // Integr. Comp. Biol. V. 59. № 5. P. 1165–1175.
Alonso-Alvarez C., Bertrand S., Faivre B., Chastel O., Sorci G., 2007. Testosterone and oxidative stress: The oxidation handicap hypothesis // Proc. R. Soc. Lond. Ser. B. Biol. Sci. V. 274. P. 819–825.
Alonso-Alvarez C., Perez-Rodriguez L., Mateo R., Chastel O., Viñuela J., 2008. The oxidation handicap hypothesis and the carotenoid allocation trade-off // J. Evol. Biol. V. 21. P. 1789–1797.
Altuwaijri S., Chuang K.H., Lai K.P., Lai J.J., Lin H.Y. et al., 2009. Susceptibility to autoimmunity and B cell resistance to apoptosis in mice lacking androgen receptor in B cells // Mol. Endocrinol. V. 23. P. 444–453.
Anders S.M., van, 2010. Gonadal steroids and salivary IgA in healthy young women and men // Am. J. Hum. Biol. V. 22. P. 348–352.
Andersson M., Simmons L.W., 2006. Sexual selection and mate choice // Trends Ecol. Evol. V. 21. № 6. P. 296–302.
Archer J., Carré J.M., 2016. Testosterone and aggression // The Social Psychology of Aggression and Violence. Frontiers of Social Psychology series / Ed. Bushman B. N.-Y.: Psychology Press. P. 90–104.
Ardia D.R., Broughton D.R., Gleicher M.J., 2010. Short-term exposure to testosterone propionate leads to rapid bill color and dominance changes in zebra finches // Horm. Behav. V. 58. № 3. P. 526–532.
Arnocky S., Hodges-Simeon C.R., Ouellette D., Graham A., 2018. Do men with more masculine voices have better immunocompetence? // Evol. Hum. Behav. V. 39. № 6. P. 602–610.
Arnqvist G., Rowe L., 2005. Sexual Conflict. New Jersey: Princeton Univ. Press. 365 p.
Arnqvist G., Wooster D., 1995. Meta-analysis: Synthesizing research findings in ecology and evolution // Trends Ecol. Evol. V. 10. P. 236–240.
Audet J.-N., Ducatez S., Lefebvre L., 2015. The town bird and the country bird: Problem solving and immunocompetence vary with urbanization // Behav. Ecol. V. 27. № 2. P. 637–644.
Bajpai P., Koc E., Sonpavde G., Singh R., Singh K.K., 2019. Mitochondrial localization, import, and mitochondrial function of the androgen receptor // J. Biol. Chem. V. 294. № 16. P. 6621–6634.
Baldo S., Mennill D.J., Guindre-Parker S., Gilchrist H.G., Love O.P., 2015. The oxidative cost of acoustic signals: Examining steroid versus aerobic activity hypotheses in a wild bird // Ethology. V. 121. P. 1081–1090.
Bartos L., Bubenik G.A., Kuzmova E., 2012. Endocrine relationships between rank-related behavior and antler growth in deer // Front. Biosci. V. 4. P. 1111–1126.
Baugh A.T., Senft R.A., Firke M., Lauder A., Schroeder J. et al., 2017. Risk-averse personalities have a systemically potentiated neuroendocrine stress axis: A multilevel experiment in Parus major // Horm. Behav. V. 93. P. 99–108.
Bernal X.E., Rand A.S., Ryan M.J., 2007. Sexual differences in the behavioral response of túngara frogs, Physalaemus pustulosos, to cues associated with increased predation risk // Ethology. V. 113. P. 755–763.
Bielby J., Fisher M.C., Clare F.C., Rosa G.M., Garner T.W.J., 2015. Host species vary in infection probability, sub-lethal effects and costs of immune response when exposed to an amphibian parasite // Sci. Rep. V. 5. № 1. P. 1–8.
Blount J.D., Metcalfe N.B., Birkhead T.R., Surai P.F., 2003. Carotenoid modulation of immune function and sexual attractiveness in zebra finches // Science. V. 300. № 5616. P. 125–127.
Boonekamp J.J., Ros A.H.F., Verhulst S., 2008. Immune activation suppresses plasma testosterone level: A meta-analysis // Biol. Lett. V. 4. № 6. P. 741–744.
Borgia G., 1979. Sexual selection and the evolution of mating systems // Sexual Selection and Reproductive Competition in Insects / Eds Blum M.S., Blum N.A. N.-Y.: Academic Press. P. 19–80.
Bortolotti G.R., Mougeot F., Martinez-Padilla J., Webster L.M., Piertney S.B., 2009. Physiological stress mediates the honesty of social signals // PLoS One. V. 4. P. e4983.
Bose H.S., Lingappa V.R., Miller W.L., 2002. Rapid regulation of steroidogenesis by mitochondrial protein import // Nature. V. 417. P. 87–91.
Braude S., Tang-Martinez Z., Taylor G.T., 1999. Stress, testosterone, and the immunoredistribution hypothesis // Behav. Ecol. V. 10. P. 345–350.
Brush A.H., 1990. Metabolism of carotenoid pigments in birds // FASEB J. V. 4. P. 2969–2977.
Buchanan K.L., 2000. Stress and the evolution of condition-dependent signals // Trends Ecol. Evol. V. 15. P. 156–160.
Buchanan K.L., Evans M.R., Goldsmith A.R., Bryant D.M., Rowe L.V., 2001. Testosterone influences basal metabolic rate in male house sparrows: A new cost of dominance signalling? // Proc. R. Soc. Lond. Ser. B. Biol. Sci. V. 268. P. 1337–1344.
Buck C.L., Barnes B.M., 2003. Androgen in free-living arctic ground squirrels: Seasonal changes and influence of staged male–male aggressive encounters // Horm. Behav. V. 43. P. 318–326.
Budischak S.A., O’Neal D., Jolles A.E., Ezenwa V.O., 2018. Differential host responses to parasitism shape divergent fitness costs of infection // Func. Ecol. V. 32. № 2. P. 324–333.
Bullock S., 1999. Jumping to bold conclusions // Adapt. Behav. V. 7. № 1. P. 129–134.
Burger H.G., 2002. Androgen production in women // Fertil. Steril. V. 77. Suppl. 4. P. S3–S5.
Calsbeek R., Bonneaud C., Smith T.B., 2008. Differential fitness effects of immunocompetence and neighbourhood density in alternative female lizard morphs // J. Anim. Ecol. V. 77. № 1. P. 103–109.
Cao A.T., Yao S., Gong B., Elson C.O., Cong Y., 2012. Th17 cells upregulate polymeric Ig receptor and intestinal IgA and contribute to intestinal homeostasis // J. Immunol. V. 189. P. 4666–4673.
Carré J.M., Archer J., 2018. Testosterone and human behavior: The role of individual and contextual variables // Curr. Opin. Psychol. V. 19. P. 149–153.
Casagrande S., Costantini D., Groothuis T.G.G., 2012. Interaction between sexual steroids and 342 immune response in affecting oxidative status of birds // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. V. 163. P. 296–301.
Cavigelli S.A., Pereira M.E., 2000. Mating season aggression and fecal testosterone levels in male ring-tailed lemurs (Lemur catta) // Horm. Behav. V. 37. P. 246–255.
Cecarini V., Gee J., Fioretti E., Amici M., Angeletti M. et al., 2007. Protein oxidation and cellular homeostasis: Emphasis on metabolism // Biochim. Biophys. Acta. V. 1773. P. 93–104.
Celec P., Ostatníková D., Hodosy J., 2015. On the effects of testosterone on brain behavioral functions // Front. Neurosci. V. 9. P. 12.
Chand D., Lovejoy D.A., 2011. Stress and reproduction: Controversies and challenges // Gen. Comp. Endocrinol. V. 171. № 3. P. 253–257.
Chen W., Beck I., Schober W., Brockow K., Effner R. et al., 2010. Human mast cells express androgen receptors but treatment with testosterone exerts no influence on IgE-independent mast cell degranulation elicited by neuromuscular blocking agents // Exp. Dermatol. V. 19. P. 302–304.
Cheng A., Hou Y., Mattson M.P., 2010. Mitochondria and neuroplasticity // ASN Neuro. V. 2. P. e00045.
Chichinadze K., Chichinadze N., 2008. Stress-induced increase of testosterone: Contributions of social status and sympathetic reactivity // Physiol. Behav. V. 94. № 4. P. 595–603.
Clutton-Brock T.H., Kavita I., 2006. Paternity loss in contrasting mammalian societies // Biol. Lett. V. 2. P. 513−516.
Cohn D.A., 1979. High sensitivity to androgen as a contributing factor in sex differences in the immune response // Arthritis Rheum. V. 22. № 11. P. 1217–1233.
Colegrave N., Kotiaho J.S., Tomkins J.L., 2002. Mate choice or polyandry: Reconciling genetic compatibility and good genes sexual selection // Evol. Ecol. Res. V. 4. P. 911–917.
Cooper M.D., Alder M.N., 2006. The evolution of adaptive immune systems // Cell. V. 124. P. 815–822.
Cooper H., Hedges L.V., Valentine J.C., eds., 2019. The Handbook of Research Synthesis and Meta-analysis. 3rd ed. N.-Y.: Russell Sage Foundation. 555 p.
Corrales J.J., Almeida M., Miralles J.M., Orfao A., 2009. Persistence of androgenic effects on the production of proinflammatory cytokines by circulating antigen-presenting cells after withdrawal of testosterone treatment in aging type 2 diabetic men with partial androgen deficiency // Fertil. Steril. V. 92. P. 311–319.
Costantini D., 2014. Oxidative Stress and Hormesis in Evolutionary Ecology and Physiology. A Marriage Between Mechanistic and Evolutionary Approaches. Berlin; Heidelberg: Springer-Verlag. 348 p.
Cox R.M., Cox C.L., McGlothlin J.W., Card D.C., Andrew A.L., Castoe T.A., 2017. Hormonally mediated increases in sex-biased gene expression accompany the breakdown of between-sex genetic correlations in a sexually dimorphic lizard // Am. Nat. V. 189. P. 315–332.
Creel S., 2001. Social dominance and stress hormones // Trends Ecol. Evol. V. 16. № 9. P. 491–497.
Creel S., Dantzer B., Goymann W., Rubenstein D.R., 2013. The ecology of stress: Effects of the social environment // Funct. Ecol. V. 27. № 1. P. 66–80.
Dapper A.L., Baugh A.T., Ryan M.J., 2011. The sounds of silence as an alarm cue in túngara frogs // Biotropica. V. 43. P. 380–385.
Demonacos C.V., Karayanni N., Hatzoglou E., Tsiriyiotis C., Spandidos D.A., Sekeris C.E., 1996. Mitochondrial genes as sites of primary action of steroid hormones // Steroids. V. 61. № 4. P. 226–232.
Ditchkoff S.S., Lochmiller R.L., Masters R.E., Hoofer S.R., Van Den Bussche R.A., 2001. Major-histocompatibilitycomplex-associated variation in secondary sexual traits of white tailed deer (Odocoileus virginianus): Evidence for good-genes advertisement // Evolution. V. 55. P. 616–625.
Dohle G.R., Smit M., Weber R.F., 2003. Androgens and male fertility // World J. Urol. V. 21. P. 341–345.
Douglas H.D. 3rd, Kitaysky A.S., Kitaiskaia E.V., Maccormick A., Kelly A., 2009. Size of ornament is negatively correlated with baseline corticosterone in males of a socially monogamous colonial seabird // J. Comp. Physiol. B. V. 179. P. 297–304.
Du J., Wang Y., Hunter R., Wei Y., Blumenthal R. et al., 2009. Dynamic regulation of mitochondrial function by glucocorticoids // Proc. Natl. Acad. Sci. USA. V. 106. P. 3543–3548.
Egger M., Smith G.D., Altman D.G., eds., 2001. Systematic Reviews in Health Care: Meta-Analysis in Context. 2nd ed. L.: BMJ. 475 p.
Endler J.A., Basolo A.L., 1998. Sensory ecology, receiver biases and sexual selection // Trends Ecol. Evol. V. 13. P. 415–420.
Enstrom D.A., Ketterson E.D., Nolan V., Jr., 1997. Testosterone and mate choice in the dark-eyed junco // Anim. Behav. V. 54. P. 1135–1146.
Eshel I., Volovik I., Sansone E., 2000. On Fisher–Zahavi’s handicapped sexy son // Evol. Ecol. Res. V. 2. P. 509–523.
Evans M.R., Goldsmith A.R., Norris S.R., 2000. The effects of testosterone on antibody production and plumage coloration in male house sparrows (Passer domesticus) // Behav. Ecol. Sociobiol. V. 47. P. 156–163.
Fisher R.A., 1915. The evolution of sexual preference // Eugenics Rev. V. 7. № 3. P. 184–192.
Fisher R.A., 1930. The Genetical Theory of Natural Selection. Oxford: Clarendon Press. 272 p.
Fitze P.S., Cote J., San-Jose L.M., Meylan S., Isaksson C. et al., 2009. Carotenoid-based colours reflect the stress response in the common lizard // PLoS One. V. 4. P. e5111.
Folstad I., Karter A.J., 1992. Parasites, bright males, and the immunocompetence handicap // Am. Nat. V. 139. № 3. P. 603–622.
Foo Y.Z., Nakagawa S., Rhodes G., Simmons L.W., 2017. The effects of sex hormones on immune function: A meta-analysis // Biol. Rev. Camb. Philos. Soc. V. 92. № 1. P. 551–571.
Gaigher A., Burri R., San-Jose L.M., Roulin A., Fumagalli L., 2019. Lack of statistical power as a major limitation in understanding MHC-mediated immunocompetence in wild vertebrate populations // Mol. Ecol. V. 28. № 23. P. 5115–5132.
Gao J., Liu S., Zhang Y., Yang Y., Yuan C. et al., 2015. Effects of 17 α-methyltestosterone on transcriptome, gonadal histology and sex steroid hormones in rare minnow Gobiocypris rarus // Comp. Biochem. Physiol. D. Genom. Proteom. V. 15. P. 20–27.
Gavrilova-Jordan L.P., Price T.M., 2007. Actions of steroids in mitochondria // Semin. Reprod. Med. V. 25. P. 154–164.
Ge R., Johnson J.D., Cobine P.A., McGraw K.J., Garcia R., Hill G.E., 2015. High concentrations of ketocarotenoids in hepatic mitochondria of Haemorhous mexicanus // Physiol. Biochem. Zool. V. 88. P. 444–450.
Getty T., 2002. Signalling health versus parasites // Am. Nat. V. 159. P. 363–371.
Getty T., 2006. Sexually selected signals are not similar to sports handicaps // Trends Ecol. Evol. V. 21. № 2. P. 83–88.
Girón-González J.A., Moral F.J., Elvira J., García-Gil D., Guerrero F. et al., 2000. Consistent production of a higher TH1:TH2 cytokine ratio by stimulated T cells in men compared with women // Eur. J. Endocrinol. V. 143. P. 31–36.
Glasper E.R., Devries A.C., 2005. Social structure influences effects of pair-housing on wound healing // Brain Behav. Immun. V. 19. P. 61–68.
Grafen A., 1990a. Biological signals as handicaps // J. Theor. Biol. V. 144. № 4. P. 517–546.
Grafen A., 1990b. Sexual selection unhandicapped by the Fisher process // J. Theor. Biol. V. 144. № 4. P. 473–516.
Grossman C.J., 1990. Are there underlying immune-neuroendocrine interactions responsible for immunological sexual dimorphism? // Progr. Neuroendocrinimmunol. V. 3. P. 75–82.
Gurevitch J., Hedges L.V., 1999. Statistical issues in ecological meta-analyses // Ecology. V. 80. P. 1142–1149.
Hadfield J. D., Nakagawa S., 2010. General quantitative genetic methods for comparative biology: Phylogenies, taxonomies and multi-trait models for continuous and categorical characters // J. Evol. Biol. V. 23. P. 494–508.
Hamilton W., Zuk M., 1982. Heritable true fitness and bright birds: A role for parasites? // Science. V. 218. № 4570. P. 384–387.
Hardy M.P., Sottas C.M., Ge R., McKittrick C.R., Tamashiro K.L. et al., 2002. Trends of reproductive hormones in male rats during psychosocial stress: Role of glucocorticoid metabolism in behavioral dominance // Biol. Reprod. V. 67. № 6. P. 1750–1755.
Hasselquist D., 2007. Comparative immunoecology in birds: Hypotheses and tests // J. Ornithol. V. 148. P. S571–S582.
Hasselquist D., Nilsson J.-Å., 2012. Physiological mechanisms mediating costs of immune responses: What can we learn from studies of birds? // Anim. Behav. V. 83. № 6. P. 1303–1312.
Hasselquist D., Marsh J.A., Sherman P.W., Wingfield J.C., 1999. Is avian humoral immunocompetence suppressed by testosterone? // Behav. Ecol. Sociobiol. V. 45. P. 167–175.
Hau M., 2007. Regulation of male traits by testosterone: Implications for the evolution of vertebrate life histories // Bioessays. V. 29. № 2. P. 133–144.
Hedges L., Olkin I., 1985. Statistical Methods for Meta-Analysis. N.-Y.: Academic Press. 75 p.
Hepworth M.R., Hardman M.J., Grencis R.K., 2010. The role of sex hormones in the development of Th2 immunity in a gender-biased model of Trichuris muris infection // Eur. J. Immunol. V. 40. P. 406–416.
Hill G.E., 2011. Condition-dependent traits as signals of the functionality of vital cellular processes // Ecol. Lett. V. 14. P. 625–634.
Hill G.E., 2014. Cellular respiration: The nexus of stress, condition, and ornamentation // Integr. Comp. Biol. V. 54. P. 645–657.
Hill G.E., Johnson J.D., 2012. The vitamin A-redox hypothesis: A biochemical basis for honest signaling via carotenoid pigmentation // Am. Nat. V. 180. P. E127–E150.
Hill G.E., Montgomerie R., Roeder C., Boag P., 1994. Sexual selection and cuckoldry in a monogamous songbird: Implications for sexual selection theory // Behav. Ecol. Sociobiol. V. 35. № 3. P. 193–199.
Hodges-Simeon C.R., Gurven M., Gaulin S.J.C., 2015. The low male voice is acostly signal of phenotypic quality among Bolivian adolescents // Evol. Hum. Behav. V. 36. № 4. P. 294–302.
Hodges-Simeon C.R., Asif S., Gurven M., Blackwell A.D., Gaulin S.J., 2019. Testosterone is positively and estradiol negatively associated with mucosal immunity in Amazonian adolescents // Am. J. Hum. Biol. V. 31. № 5. P. e23284.
Hoogenboom M.O., Metcalfe N.B., Groothuis T.G.G., Vries B., de, Costantini D., 2012. Relationship between oxidative stress and circulating testosterone and cortisol in pre-spawning female brown trout // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. V. 163. P. 379–387.
Hunt J., Breuker C.J., Sadowski J.A., Moore A.J., 2009. Male–male competition, female mate choice and their interaction: Determining total sexual selection // J. Evol. Biol. V. 22. № 1. P. 13–26.
Husak J.F., Moore I.T., 2008. Stress hormones and mate choice // Trends Ecol. Evol. V. 23. P. 532–534.
Ioannidis J.P., 2010. Meta-research: The art of getting it wrong // Res. Synth. Methods. V. 3. P. 169–184.
Isaksson C., While G., McEvoy J., Crommenacker J., van de, Olsson M. et al., 2011. Aggression, but not testosterone, is associated to oxidative status in a free-living vertebrate // Behaviour. V. 148. P. 713–731.
Jacobson J.D., Ansari M.A., 2004. Immunomodulatory actions of gonadal steroids may be mediated by gonadotropin-releasing hormone // Endocrinology. V. 145. № 1. P. 330–336.
Jastroch M., Divakaruni A.S., Mookerjee S., Treberg J.R., Brand M.D., 2010. Mitochondrial proton and electron leaks // Essays Biochem. V. 47. P. 53–67.
Ježek P., Hlavatá L., 2005. Mitochondria in homeostasis of reactive oxygen species in cell, tissues, and organism // Int. J. Biochem. Cell Biol. V. 37. P. 2478–2503.
Johnson J.D., Hill G.E., 2013. Is carotenoid ornamentation linked to the innermitochondria membrane potential? A hypothesis for the maintenance of signal honesty // Biochimie. V. 95. P. 436–444.
Kamiya T., O’Dwyer K., Westerdahl H., Senior A., Nakagawa S., 2014. A quantitative review of MHC-based mating preference: The role of diversity and dissimilarity // Mol. Ecol. V. 23. № 21. P. 5151–5163.
Kandrik M., Hahn A.C., Han C., Wincenciak J., Fisher C.I. et al., 2017. Does the interaction between cortisol and testosterone predict men’s facial attractiveness? // Adapt. Hum. Behav. Physiol. V. 3. № 4. P. 275–281.
Ketterson E.D., Nolan V., Jr., 1999. Adaptation, exaptation, and constraint: A hormonal perspective // Am. Nat. V. 154. P. S4–S25.
Ketterson E.D., Nolan V., Jr., Wolf L., Ziegenfus C., 1992. Testosterone and avian life histories: Effects of experimentally elevated testosterone on behavior and correlates of fitness in the dark-eyed junco (Junco hyemalis) // Am. Nat. V. 140. P. 980–999.
Ketterson E.D., Nolan V., Cawthorn J.M., Parker P.G., Ziegenfus C., 1996. Phenotypic engineering: Using hormones to explore the mechanistic and functional bases of phenotypic variation in nature // Am. Nat. V. 138. № 1. P. 70–86.
Kimball R.T., Ligon J.D., 1999. Evolution of avian plumage dichromatism from a proximate perspective // Am. Nat. V. 154. № 2. P. 182–193.
Kirkpatrick M., Ryan M.J., 1991. The evolution of mating preferences and the paradox of the lek // Nature. V. 350. P. 33–38.
Kissick H.T., Sanda M.G., Dunn L.K., Pellegrini K.L., On S.T. et al., 2014. Androgens alter T-cell immunity by inhibiting T-helper 1 differentiation // Proc. Natl. Acad. Sci. USA. V. 111. P. 9887–9892.
Klein S.L., 2000. The effect of hormones on sex differences in infection: From genes to behaviour // Neurosci. Behav. Rev. V. 24. P. 627–638.
Klein S.L., Nelson R.J., 1998. Adaptive immune responses are linked to the mating system of arvicoline rodents // Am. Nat. V. 151. № 1. P. 59–67.
Koch R.E., Josefson C.C., Hill G.E., 2017. Mitochondrial function, ornamentation, and immunocompetence // Biol. Rev. V. 92. № 3. P. 1459–1474.
Koh Y.T., Gray A., Higgins S.A., Hubby B., Kast W.M., 2009. Androgen ablation augments prostate cancer vaccine immunogenicity only when applied after immunization // Prostate. V. 69. P. 571–584.
Kokko H., 2015. Cuckoldry (human and nonhuman) // The International Encyclopedia of Human Sexuality. V. 3 / Eds Whelehan P., Bolin A. N.-Y.: John Wiley & Sons. P. 1–2.
Kokko H., Brooks R., Jennions M.D., Morley J., 2003. The evolution of mate choice and mating biases // Proc. R. Soc. Lond. Ser. B. V. 270. № 1515. P. 653–664.
Koricheva J., Gurevitch J., Mengersen K., eds., 2013. The Handbook of Meta-Analysis in Ecology and Evolution. Princeton: Princeton Univ. Press. 497 p.
Koufali M.-M., Moutsatsou P., Sekeris C.E., Breen K.C., 2003. The dynamic localization of the glucocorticoid receptor in rat C6 glioma cell mitochondria // Mol. Cell. Endocrinol. V. 209. P. 51–60.
Kruczek M., 1997. Male rank and female choice in the bank vole, Clethrionomys glareolus // Behav. Proc. V. 40. P. 171–176.
Ksiazek A., Konarzewski M., Chadzinska M., Cichon M., 2003. Costs of immune response in cold-stressed laboratory mice selected for high and low basal metabolism rates // Proc. R. Soc. Lond. Ser. B. V. 270. № 1528. P. 2025–2031.
Kurtz J., Reinhold K., Engqvist L., 2000. Immunosuppression under stress: Necessary for condition-dependant signalling // Trends Ecol. Evol. V. 15. P. 418–419.
Lai J.J., Lai K.P., Zeng W., Chuang K.H., Altuwaijri S., Chang C., 2012. Androgen receptor influences on body defense system via modulation of innate and adaptive immune systems: Lessons from conditional AR knockout mice // Am. J. Pathol. V. 181. № 5. P. 1504–1512.
Lajeunesse M.J., 2010. Achieving synthesis with meta-analysis by combining and comparing all available studies // Ecology. V. 91. P. 2561–2564.
Lane N., 2011. The costs of breathing // Science. V. 334. P. 184–185.
Lane N., Martin W., 2010. The energetics of genome complexity // Nature. V. 467. P. 929–934.
Leary C.J., Baugh A.T., 2020. Glucocorticoids, male sexual signals, and mate choice by females: Implications for sexual selection // Gen. Comp. Endocrinol. V. 288. P. 113354.
Leary C.J., Crocker-Buta S., 2018. Rapid effects of elevated stress hormones on male courtship signals suggest a major role for the acute stress response in intra- and intersexual selection // Func. Ecol. V. 32. P. 1214–1226.
Leary C.J., Knapp R., 2014. The stress of elaborate male traits: Integrating glucocorticoids with androgen-based models of sexual selection // Anim. Behav. V. 89. P. 85–92.
Lee S.R., Kim H.K., Song I.S., Youm J., Dizon L.A. et al., 2013. Glucocorticoids and their receptors: Insights into specific roles in mitochondria // Progr. Biophys. Mol. Biol. V. 112. № 1–2. P. 44–54.
Li S., Li X., Li J., Deng X., Li Y., 2007. Inhibition of oxidative-stress-induced platelet aggregation by androgen at physiological levels via its receptor is associated with the reduction of thromboxane A2 release from platelets // Steroids. V. 72. P. 875–880.
Lieshout E., van, McNamara K.B., Simmons L.W., 2014. Rapid loss of behavioural plasticity and immunocompetence under intense sexual selection // Evolution. V. 68. № 9. P. 2550–2558.
Lindstrom K.M., Krakower D., Lundstrom J.O., Silverin B., 2001. The effects of testosterone on a viral infection in greenfinches (Carduelis chloris): An experimental test of the immunocompetence-handicap hypothesis // Proc. R. Soc. Lond. Ser. B. V. 268. P. 207–211.
Litvinova E.A., Goncharova E.P., Zaydman A.M., Zenkova M.A., Moshkin M.P., 2010. Female scent signals enhance the resistance of male mice to influenza // PLoS One. V. 5. № 3. P. e9473.
Lopes R.L., Johnson J.D., Toomey M.B.B., Ferreira S.M., Araujo P.M. et al., 2016. Genetic basis for red coloration in birds // Curr. Biol. V. 26. P. 1–8.
Lord C., Sekerovic Z., Carrier J., 2014. Sleep regulation and sex hormones exposure in men and women across adulthood // Pathol. Biol. V. 62. P. 302–310.
Lozano G.A., 1994. Carotenoids, parasites, and sexual selection // Oikos. V. 70. P. 309–311.
Luetjens C.M., Weinbauer G.F., 2012. Chapter 2. Testosterone: Biosynthesis, transport, metabolism and (non-genomic) actions // Testosterone: Action, Deficiency, Substitution. 4th ed. / Eds Nieschlag E., Behre H.M., Nieschlag S. Cambridge: Cambridge Univ Press. P. 15–32.
Manoli I., Alesci S., Blackman M.R., Su Y.A., Rennert O.M., Chrousos G.P., 2007. Mitochondria as key components of the stress response // Trends Endocrinol. Metabol. V. 18. P. 190–198.
Mantalaris A., Panoskaltsis N., Sakai Y., Bourne P., Chang C. et al., 2001. Localization of androgen receptor expression in human bone marrow // J. Pathol. V. 193. P. 361–366.
Marsh J.A., 1996. The integration of the neuroendocrine andimmune systems: A marriage of convenience or necessity? // Poultry Immunology / Eds Davison T.F., Morris T.R., Payne L.V. Abingdon: Carfax. P. 357–374.
Martin L.B., 2009. Stress and immunity in wild vertebrates: timing is everything // Gen. Comp. Endocrinol. V. 163. № 1–2. P. 70–76.
Martin L.B., Weil Z.M., Nelson R.J., 2008. Seasonal changes in vertebrate immune activity: Mediation by physiological trade-offs // Phil. Trans. R. Soc. Lond. B. V. 363. № 1490. P. 321–339.
Massaad C.A., Klann E., 2011. Reactive oxygen species in the regulation of synaptic plasticity and memory // Antioxid. Redox Signal. V. 14. P. 2013–2054.
Mays H.L., Hill G.E., 2004. Choosing mates: Good genes versus genes that are a good fit // Trends Ecol. Evol. V. 19. P. 554–559.
McCurdy D.G., Shutler D., Mullie A., Forbes M.R., 1998. Sex-biased parasitism of avian hosts: Relations to blood parasite taxon and mating system // Oikos. V. 82. № 2. P. 303–312.
McGlothlin J.W., Jawor J.M., Ketterson E.D., 2007. Natural variation in testosterone mediated trade-off between mating effort and parental effort // Am. Nat. V. 170. P. 864–875.
McGlothlin J.W., Jawor J.M., Greives T.J., Castro J.M., Phillips J.L., Ketterson E.D., 2008. Hormones and honest signals: Males with larger ornaments elevate testosterone more when challenged // J. Evol. Biol. V. 21. P. 39–48.
McGraw K.J., 2006. Mechanics of carotenoid coloration // Bird Coloration. V. 1: Measurements and Mechanisms / Eds Hill G.E., McGraw K.J. Cambridge: Harvard Univ. Press. P. 177–242.
McGraw K.J., Cohen A.A., Costantini D., Hõrak P., 2010. The ecological significance of antioxidants and oxidative stress: A marriage between mechanistic and functional perspectives // Func. Ecol. V. 24. P. 947–949.
Mellon S.H., Griffin L.D., Compagnone N.A., 2001. Biosynthesis and action of neurosteroids // Brain Res. Rev. V. 37. P. 3–12.
Michels G., Hoppe U.C., 2008. Rapid actions of androgens // Front. Neuroendocrinol. V. 29. № 2. P. 182–198.
Mignatti A., Boag B., Cattadori I.M., 2016. Host immunity shapes the impact of climate changes on the dynamics of parasite infections // Proc. Natl. Acad. Sci. USA. V. 113. № 11. P. 2970–2975.
Miller W.L., Auchus R.J., 2011. The molecular biology, biochemistry, and physiology of human steroidogenesis and its disorders // Endocr. Rev. V. 32. P. 81–151.
Mills S.C., Grapputo A., Jokinen I., Koskela E., Mappes T. et al., 2009. Testosterone-mediated effects on fitness-related phenotypic traits and fitness // Am. Nat. V. 173. № 4. P. 475–487.
Mills S.C., Grapputo A., Jokinen I., Koskela E., Mappes T., Poikonen T., 2010. Fitness trade-offs mediated by immunosuppression costs in a small mammal // Evolution. V. 64. № 1. P. 166–179.
Monaghan P., Metcalfe N.B., Torres R., 2009. Oxidative stress as a mediator of life history trade-offs: Mechanisms, measurements and interpretation // Ecol. Lett. V. 12. P. 75–92.
Monson C., Forsgren K., Goetz G., Harding L., Swanson P., Young G., 2017. A teleost androgen promotes development of primary ovarian follicles in coho salmon and rapidly alters the ovarian transcriptome // Biol. Reprod. V. 97. P. 731–745.
Moore F.R., Shuker D.M., Dougherty L., 2016. Stress and sexual signaling: A systematic review and meta-analysis // Behav. Ecol. V. 27. P. 363–371.
Moore F.R., Al Dujaili E.A.S., Cornwell R.E., Smith M.J.L., Lawson J.F. et al., 2011. Cues to sex- and stress-hormones in the human male face: Functions of glucocorticoids in the immunocompetence handicap hypothesis // Horm. Behav. V. 60. № 3. P. 269–274.
Moore M.C., Marler C.A., 1987. Effects of testosterone manipulations on nonbreeding season territorial aggression in free living male lizard, Sciloporus jarrovi // Gen. Comp. Endocrinol. V. 65. P. 225–232.
Moore S.L., Wilson K., 2002. Parasites as a viability cost of sexual selection in natural populations of mammals // Science. V. 297. P. 2015–2018.
Morava Ě., Kozicz T., 2013. Mitochondria and the economy of stress (mal) adaptation // Neurosci. Biobehav. Rev. V. 37. P. 668–680.
Moshkin M.P., Gerlinskaya L.A., Evsikov V.I., 2000. The role of the immune system in behavioral strategies of reproduction // J. Reprod. Devel. V. 46. № 6. P. 341–365.
Moshkin M.P., Potapov M.A., Frolova O.F., Evsikov V.I., 1993. Changes in aggressive behavior, thermoregulation, and endocrine responses in BALB/cLac and C57Bl/6J mice under cold exposure // Physiol. Behav. V. 53. № 3. P. 535–538.
Moshkin M., Gerlinskaya L., Morozova O., Bakhvalova V., Evsikov V., 2002. Behaviour, chemosignals and endocrine functions in male mice infected with tick-borne encephalitis virus // Psychoneuroendocrinology. V. 27. № 5. P. 603–608.
Mougeot F., Martínez-Padilla J., Webster L.M., Blount J.D., P’erez-Rodríguez L., Piertney S.B., 2009. Honest sexual signalling mediated by parasite and testosterone effects on oxidative balance // Proc. R. Soc. Lond. Ser. B. V. 276. P. 1093–1100.
Møller A.P., 1995. Hormones, handicaps and bright birds // Trends Ecol. Evol. V. 10. P. 121.
Møller A., Jennions M., 2001. How important are direct fitness benefits of sexual selection? // Naturwissenschaften. V. 88. № 10. P. 401–415.
Møller A.P., Biard C., Blount J.D., Houston D.C., Ninni P. et al., 2000. Carotenoid-dependent signals: Indicators of foraging efficiency, immunocompetence or detoxification ability? // Avian Poult. Biol. Rev. V. 11. P. 137–159.
Murphy K., Weaver C., 2016. Janeway’s Immunobiology. N.-Y.: Garland Science. 904 p.
Murphy M.P., 2009. How mitochondria produce reactive oxygen species // Biochem. J. V. 417. P. 1–13.
Nakagawa S., Poulin R., 2012. Meta-analytic insights into evolutionary ecology: An introduction and synthesis // Evol. Ecol. V. 26. № 5. P. 1085–1099.
Nakagawa S., Santos E.S.A., 2012. Methodological issues and advances in biological meta-analysis // Evol. Ecol. V. 26. № 5. P. 1253–1274.
Nava M.P., Veiga J.P., Puerta M., 2001. White blood cell counts in house sparrows (Passer domesticus) before and after moult and after testosterone treatment // Can. J. Zool. V. 79. P. 145–148.
Neff B., Pitcher T.E., 2005. Genetic quality and sexual selection: An integrated framework for good genes and compatible genes // Mol. Ecol. V. 14. P. 19–38.
Nelson R.J., 2004. Seasonal immune function and sickness responses // Trends Immunol. V. 25. № 4. P. 187–192.
Nelson R.J., Kriegsfeld L.J., 2016. An Introduction to Behavioral Endocrinology. 5th ed. Oxford: Oxford Univ. Press, Sinauer Associates. 722 p.
Nelson R.L., Demas G.E., Klein S.L., Kriegsfeld L.J., 2002. Seasonal Patterns of Stress, Immune Function, and Disease. Cambgidge: Cambridge Univ. Press. 287 p.
Newhouse D.J., Vernasco B.J., 2019. Transcriptomic support for the immunocompetence handicap hypothesis but not the oxidation handicap hypothesis // BioRxiv. Art. 814178.
Norata G.D., Tibolla G., Seccomandi P.M., Poletti A., Catapano A.L., 2006. Dihydrotestosterone decreases tumor necrosis factor-alpha and lipopolysaccharide-induced inflammatory response in human endothelial cells // J. Clin. Endocrinol. Metab. V. 91. P. 546–554.
Novikov E., Kondratyuk E., Petrovski D., Krivopalov A., Moshkin M., 2015. Effects of parasites and antigenic challenge on metabolic rates and thermoregulation in northern red-backed voles (Myodes rutilus) // Parasitol. Res. V. 114. № 12. P. 4479–4486.
Nowak J., Pawłowski B., Borkowska B., Augustyniak D., Drulis-Kawa Z., 2018. No evidence for the immunocompetence handicap hypothesis in male humans // Sci. Rep. V. 8. P. 7392.
O’Connor M.-F., Motivala S.J., Valladares E.M., Olmstead R., Irwin M.R., 2007. Sex differences in monocyte expression of IL-6: Role of autonomic mechanisms // Am. J. Physiol. Regul. Integr. Comp. Physiol. V. 293. P. R145–R151.
Ohlsson T., Smith H.G., Råberg L., Hasselquist D., 2003. Effects of nutrition on sexual ornaments and humoral immune responsiveness in adult male pheasants // Ethol. Ecol. Evol. V. 15. № 1. P. 31–42.
Owens I.P.F., Short R.V., 1995. Hormonal basis of sexual dimorphism in birds: Implications for new theories of sexual selection // Trends Ecol. Evol. V. 10. № 1. P. 44–47.
Oyegbile T.O., Marler C.A., 2005. Winning fights elevates testosterone levels in California mice and enhances future ability to win fights // Horm. Behav. V. 48. № 3. P. 259–267.
Penn D.J., Potts W.K., 1999. The evolution of mating preferences and major histocompatibility complex genes // Am. Nat. V. 153. № 2. P. 145–164.
Peters A., 2000. Testosterone treatment is immunosuppressive in superb fairy-wrens, yet free-living males with high testosterone are more immunocompetent // Proc. R. Soc. L. Ser. B. V. 267. P. 883–889.
Peters A., Delhey K., Nakagawa S., Aulsebrook A., Verhulst S., 2019. Immunosenescence in wild animals: Meta-analysis and outlook // Ecol. Lett. V. 22. № 10. P. 1709–1722.
Peters S., Searcy W.A., Nowicki S., 2014. Developmental stress, song-learning, and cognition // Integ. Comp. Biol. V. 54. P. 555–567.
Pfaff J.A., Zanette L., MacDougall-Shackleton S.A., MacDougall-Shackleton E.A., 2007. Song repertoire size varies with HVC volume and is indicative of male quality in song sparrows (Melospiza melodia) // Proc. Biol. Sci. V. 274. P. 2035–2040.
Platek S.M., Shackelford T.K., eds., 2006. Female Infidelity and Paternal Uncertainty: Evolutionary Perspectives on Male Anti-Cuckoldry Tactics. Cambridge: Cambridge Univ. Press. 248 p.
Posma E., Moes H., Heineman M.J., Faas M.M., 2004. The effect of testosterone on cytokine production in the specific and non-specific immune response // Am. J. Reprod. Immunol. V. 52. P. 237–243.
Poulin R., 1996. Sexual inequalities in helminth infections: A cost of being male? // Am. Nat. V. 147. P. 287–295.
Poulin R., Forbes M.R., 2012. Meta-analysis and research on host–parasite interactions: Past and future // Evol. Ecol. V. 26. P. 1169–1185.
Psarra A.M.G., Sekeris C.E., 2008. Steroid and thyroid hormone receptors in mitochondria // IUBMB Life. V. 60. № 4. P. 210–223.
Psarra A.M.G., Solakidi S., Sekeris C.E., 2006. The mitochondrion as a primary site of action of steroid and thyroid hormones: Presence and action of steroid and thyroid hormone receptors in mitochondria of animal cells // Mol. Cell. Endocrinol. V. 246. № 1–2. P. 21–33.
Puts D.A., Hill A.K., Bailey D.H., Walker R.S., Rendall D. et al., 2016. Sexual selection on male vocal fundamental frequency in humans and other anthropoids // Proc. R. Soc. Lond. Ser. B. V. 283. № 1829. P. 20152830.
Råberg L., Grahn M., Hasselquist D., Svensson E., 1998. On the adaptive significance of stress-induced immunosuppression // Proc. R. Soc. Lond. Ser. B. V. 265. № 1406. P. 1637–1641.
Radwan J., Chadzinska M., Cichon M., Mills S.C., Matula B. et al., 2006. Metabolic costs of sexual advertisement in the bank vole, Clethrionomys glareolus // Evol. Ecol. Res. V. 8. P. 859–869.
Rantala M.J., Moore F.R., Skrinda I., Krama T., Kivleniece I. et al., 2012a. Evidence for the stress-linked immunocompetence handicap hypothesis in humans // Nat. Commun. V. 3. № 1. P. 1–5.
Rantala M.J., Coetzee V., Moore F.R., Skrinda I., Kecko S. et al., 2012b. Adiposity, compared with masculinity, serves as a more valid cue to immunocompetence in human mate choice // Proc. Biol. Sci. V. 280. № 1751. P. 20122495.
Roberts M.L., Buchanan K.L., Evans M.R., 2004. Testing the immunocompetence handicap hypothesis: A review of the evidence // Anim. Behav. V. 68. № 2. P. 227–239.
Roberts M L., Buchanan K.L., Bennett A.T.D., Evans M.R., 2007. Mate choice in zebra finches: Does corticosterone play a role? // Anim. Behav. V. 74. № 4. P. 921–929.
Roberts S.C., Little A.C., 2008. Good genes, complementary genes and human mate preferences // Genetica. V. 134. № 1. P. 31–43.
Rogovin K.A., Khrushchova A.M., Shekarova O.N., Vasilieva N.A., Vasilieva N.Y., 2017. Females choose gentle, but not healthy or macho males in Campbell dwarf hamsters (Phodopus campbelli Thomas 1905) // Curr. Zool. V. 63. № 5. P. 545–554.
Rolff J., 2002. Bateman’s principle and immunity // Proc. R. Soc. Lond. Ser. B. V. 269. P. 867–872.
Rollins-Smith L.A., 2017. Amphibian immunity–stress, disease, and climate change // Dev. Comp. Immunol. V. 66. P. 111–119.
Ros A.F.H., Groothuis T.G.G., Apanius V., 1997. The relation among gonadal steroids, immunocompetence, body mass, and behavior in young black-headed gulls (Larus ridibundus) // Am. Nat. V. 150. P. 201–219.
Rosenthal G.G., 2017. Mate Choice: The Evolution of Sexual Decision Making from Microbes to Humans. Princeton: Princeton Univ. Press. 648 p.
Roved J., Westerdahl H., Hasselquist D., 2017. Sex differences in immune responses: Hormonal effects, antagonistic selection, and evolutionary consequences // Horm. Behav. V. 88. P. 95–105.
Roy M., Holt R.D., 2008. Effects of predation on host–pathogen dynamics in SIR models // Theor. Pop. Biol. V. 73. № 3. P. 319–331.
Ryan M.J., 1998. Sexual selection, receiver biases, and the evolution of sex differences // Science. V. 281. P. 1999–2003.
Ryan M.J., Cummings M.E., 2013. Perceptual biases and mate choice // Annu. Rev. Ecol. Evol. Syst. V. 44. P. 437–459.
Saino N., Møller A.P., 1995. Testosterone correlates of mate guarding, singing and aggressive behaviour in male barn swallows, Hirundo rustica // Anim. Behav. V. 49. № 2. P. 465–472.
Salvador A., Veiga J.P., Martin J., Lopes P., 1997. Testosterone supplementation in subordinate, small male lizards: Consequences for aggressiveness, color development, and parasite load // Behav. Ecol. V. 8. P. 135–139.
Sandland G.J., Minchella D.J., 2003. Costs of immune defense: An enigma wrapped in an environmental cloak? // Trends Parasitol. V. 19. № 12. P. 571–574.
Sapolsky R.M., 1986. Stress-induced elevation of testosterone concentration in high ranking baboons: Role of catecholamines // Endocrinology. V. 118. № 4. P. 1630–1635.
Sapolsky R.M., 1992. Stress, the Aging Brain, and the Mechanisms of Neuron Death. Cambridge: MIT Press. 429 p.
Sapolsky R.M., Ray J.C., 1989. Styles of dominance and their endocrine correlates among wild olive baboons (Papio anubis) // Am. J. Primatol. V. 18. № 1. P. 1–13.
Sapolsky R.M., Romero L.M., Munck A.U., 2000. How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions // Endocr. Rev. V. 21. P. 55–89.
Schalk G., Forbes M.R., 1997. Male biases in parasitism of mammals: Effects of study type, host age and parasite taxon // Oikos. V. 78. P. 67–74.
Schantz T., von, Bensch S., Grahn M., Hasselquist D., Wittzell H., 1999. Good genes, oxidative stress and condition-dependent sexual signals // Proc. R. Soc. Lond. Ser. B. Biol. Sci. V. 266. № 1414. P. 1–12.
Scheller K., Sekeris C.E., 2013. The effects of steroid hormones on the transcription of genes encoding enzymes of oxidative phosphorylation // Exp. Physiol. V. 88. P. 129–140.
Schmidt K.L., Furlonger A.A., Lapierre J.M., MacDougall-Shackleton E.A., MacDougall-Shackleton S.A., 2012. Regulation of the HPA axis is related to song complexity and measures of phenotypic quality in song sparrows // Horm. Behav. V. 61. P. 652–659.
Setchell J.M., Smith T., Wickings E.J., Knapp L.A., 2010. Stress, social behaviour, and secondary sexual traits in a male primate // Horm. Behav. V. 58. P. 720–728
Shanks N., Windle R.J., Perks P.A., Harbuz M.S., Jessop D.S. et al., 2000. Early-life exposure to endotoxin alters hypothalamic–pituitary–adrenal function and predisposition to inflammation // Proc. Natl. Acad. Sci. USA. V. 97. P. 5645–5650.
Shutt T.E., McBride H.M., 2013. Staying cool in difficult times: Mitochondrial dynamics, quality control and the stress response // Biochim. Biophys. Acta. V. 1833. № 2. P. 417–424.
Skau P.A., Folstad I., 2004. Does immunity regulate ejaculate quality and fertility in humans? // Behav. Ecol. V. 16. № 2. P. 410–416.
Skrinda I., Krama T., Kecko S., Moore F.R., Kaasik A. et al., 2014. Body height, immunity, facial and vocal attractiveness in young men // Naturwissenschaften. V. 101. № 12. P. 1017–1025.
Smyth K.N., Caruso N.M., Davies C.S., Clutton-Brock T.H., Drea C.M., 2018. Social and endocrine correlates of immune function in meerkats: Implications for the immunocompetence handicap hypothesis // R. Soc. Open Sci. V. 5. № 8. P. 180435.
Stearns S.C., 1989. Trade-offs in life history evolution // Func. Ecol. V. 3. P. 259–268.
Stearns S.C., 1992. The Evolution of Life Histories. Oxford: Oxford Univ. Press. 262 p.
Stoehr A.M., Hill G.E., 2001. The effects of elevated testosterone on plumage hue in male house finches // J. Avian Biol. V. 32. P. 153–158.
Strandin T., Babayan S.A., Forbes K.M., 2018. Reviewing the effects of food provisioning on wildlife immunity // Phil. Trans. R. Soc. B. Biol. Sci. V. 373. № 1745. P. 20170088.
Svensson E., Sinervo B., Comendant T., 2001. Density-dependent competition and selection on immune function in genetic lizard morphs // Proc. Natl. Acad. Sci. USA. V. 98. P. 12561–12565.
Syed Z.A., Gupta V., Arun M.G., Dhiman A., Nandy B., Prasad N.G., 2020. Absence of reproduction-immunity trade-off in male Drosophila melanogaster evolving under differential sexual selection // BMC Evol. Biol. V. 20. № 1. P. 1–10.
Taff C.C., Freeman-Gallant C.R., 2014. An experimental test of the testosterone mediated 493 oxidation handicap hypothesis in a wild bird // Horm. Behav. V. 66. P. 276–282.
Tamagawa A., Kolosova I., Endo Y., Gerlinskaya L., Iwakura Y., Moshkin M., 2007. Interleukin-1 deficiency and aggressiveness in male mice // Psychoneuroendocrinology Research Trends / Ed. Czerbska M.T. N.-Y.: Nova Biomedical Books. P. 343–360.
Taneja V., 2018. Sex hormones determine immune response // Front. Immunol. V. 9. P. 1931.
Taylor P.D., Williams G.C., 1982. The lek paradox is not resolved // Theor. Popul. Biol. V. 22. P. 392–409.
Tregenza T., Wedell N., 2000. Genetic compatibility, mate choice and patterns of parentage // Mol. Ecol. V. 9. P. 1013–1027.
Ubuka T., Son Y.L., Tobari Y., Narihiro M., Bentley G.E. et al., 2014. Central and direct regulation of testicular activity by gonadotropin-inhibitory hormone and its receptor // Front. Endocrinol. V. 5. № 8. P. 1–11.
Vasconsuelo A., Milanesi L., Boland R., 2013. Actions of 17β-estradiol and testosterone in the mitochondria and their implications in aging // Ageing Res. Rev. V. 12. № 4. P. 907–917.
Verhulst S., Parmentier H.K., Dieleman S.J., 1999. A trade-off between immunocompetence and sexual ornamentation in domestic fowl // Proc. Natl. Acad. Sci. USA. V. 96. P. 4478–4481.
Viselli S.M., Reese K.R., Fan J., Kovacs W.J., Olsen N.J., 1997. Androgens alter B cell development in normal male mice // Cell Immunol. V. 182. P. 99–104.
Wallace D.C., Fan W., 2010. Energetics, epigenetics, mitochondrial genetic // Mitochondrion. V. 10. P. 12–31.
Weatherhead P.J., Metz K.J., Bennett G.F., Irwin R.E., 1993. Parasite faunas, testosterone and secondary sexual traits in male red-winged blackbirds // Behav. Ecol. Sociobiol. V. 33. P. 13–23.
Wedekind C., Folstad I., 1994. Adaptive or nonadaptive immunosuppression by sex hormones? // Am. Nat. V. 143. № 5. P. 936–938.
Westneat D.F., Birkhead T.R., 1998. Alternative hypotheses linking the immune system and mate choice for good genes // Proc. R. Soc. Lond. Ser. B. V. 265. № 1401. P. 1065–1073.
Wikelski M., Lynn S., Breuner J., Wingfield J., Kenagy G., 1999. Energy metabolism, testosterone and corticosterone in white-crowned sparrows // J. Comp. Physiol. A. V. 185. № 5. P. 463–470.
Wingfield J.C., Farner D.S., 1993. Endocrinology of reproduction in wild species // Avian Biology. V. 9 / Eds Farner D.S., King J., Parkes K.C. N.-Y.: Academic Press. P. 163–327.
Wingfield J.C., Sapolsky R.M., 2003. Reproduction and resistance to stress: When and how // J. Neuroendocrinol. V. 15. № 8. P. 711–724.
Wingfield J.C., Lynn S.E., Soma K.K., 2001. Avoiding the ‘costs’ of testosterone: Ecological bases of hormone-behavior interactions // Brain Behav. Evol. V. 57. P. 239–151.
Wingfield J.C., Hegner R.E., Dufty A.M., Jr., Ball G.F., 1990. The “Challenge Hypothesis”: Theoretical implications for patterns of testosterone secretion, mating systems, and breeding strategies // Am. Nat. V. 136. № 6. P. 829–846.
Winternitz J., Abbate J.L., Huchard E., Havlíček J., Garamszegi L.Z., 2017. Patterns of MHC-dependent mate selection in humans and nonhuman primates: A meta-analysis // Mol. Ecol. V. 26 № 2. P. 668–688.
Yeh S., Tsai M.Y., Xu Q., Mu X.M., Lardy H. et al., 2002. Generation and characterization of androgen receptor knockout (ARKO) mice: An in vivo model for the study of androgen functions in selective tissues // Proc. Natl. Acad. Sci. USA. V. 99. P. 13498–13503.
Zahavi A., 1975. Mate selection – a selection for a handicap // J. Theor. Biol. V. 53. № 1. P. 205–214.
Zahavi A., 1977. The cost of honesty (further remarks on the handicap principle) // J. Theor. Biol. V. 67. № 3. P. 603–605.
Zhang J.X., Sun L., Zhang Y.H., 2010. Foxn1 gene knockout suppresses sexual attractiveness and pheromonal components of male urine in inbred mice // Chem. Senses. V. 35. № 1. P. 47–56.
Zheng Y., Yuan J., Meng S., Chen J., Gu Z., 2019. Testicular transcriptome alterations in zebrafish (Danio rerio) exposure to 17β-estradiol // Chemosphere. V. 218. P. 14–25.
Zhu J., Paul W.E., 2008. CD4 T cells: Fates, functions, and faults // Blood. V. 112. P. 1557–1569.
Zuk M., Johnsen T.S., 1998. Seasonal changes in the relationship between ornamentation and immune response in red jungle fowl // Proc. R. Soc. Ser. B. V. 265. P. 1631–1635.
Zuk M., Stoehr A.M., 2002. Immune defense and host life history // Am. Nat. V. 160. P. S9–S22.
Zysling D.A., Demas G.E., 2007. Metabolic stress suppresses humoral immune function in long-day, but not short-day, Siberian hamsters (Phodopus sungorus) // J. Comp. Physiol. B. V. 177. № 3. P. 339–347.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


