Журнал неорганической химии, 2022, T. 67, № 7, стр. 953-958
О синтезе комплекса серебра(I) [Ag2[B12H12]]
В. И. Салдин a, *, А. Б. Слободюк a, В. В. Суховей a
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
* E-mail: sald@ich.dvo.ru
Поступила в редакцию 23.11.2021
После доработки 10.01.2022
Принята к публикации 19.01.2022
- EDN: DWFOZE
- DOI: 10.31857/S0044457X22070212
Аннотация
Разработан способ получения комплекса серебра(I) [Ag2[B12H12]] высокой чистоты пиролизом при 300–450°С смесей NaВН4–KВF4 без использования органических растворителей с его осаждением из водного раствора нитратом серебра с последующей регенерацией Ag из избытка AgNO3. Все стадии синтеза контролировали с помощью химического и рентгенофазового анализа, ИК- и ЯМР-спектроскопии. Результаты исследования могут быть востребованы в фундаментальной и прикладной химии полиэдрических бороводородных соединений.
ВВЕДЕНИЕ
В настоящее время активно ведутся исследования гетероциклических азосоединений как экологически чистых материалов для пиротехники взамен нитросоединений и перхлоратных окислителей [1, 2]. Однако при чрезмерно высоком содержании азота и, соответственно, величине энтальпии образования азогетероциклов снижается их стабильность к механическому и термическому воздействию. Этот недостаток устраняется сочетанием стабильных (не пересыщенных азотом) гетероциклов с энергоемким додекагидро-клозо-додекаборатным анионом [B12H12]2– [3, 4]. Кроме того, додекагидро-клозо-додекабораты перспективны как термически и химически стабильные ионные жидкости [5]. К настоящему времени синтезирован и изучен довольно большой ряд подобных соединений в виде простых и комплексных солей с катионами переходных металлов [5–10]. Многие из них хорошо растворимы в воде. Чтобы не прибегать к органическим растворителям, что сводило бы на нет экологичность синтеза этих соединений, для их получения авторы [3] использовали обменную реакцию в водной среде между гидрохлоридами гетероциклов и комплексом серебра(I) [Ag2[B12H12]], взятыми в мольном соотношении 2 : 1. После отделения осадка образовавшегося хлорида серебра фильтрат сушили для получения целевого соединения высокой чистоты. Такой подход ставит целью получение [Ag2[B12H12]] из реакционных продуктов, содержащих анион [B12H12]2–, синтез которого можно проводить из различных исходных соединений разными способами [11–15]. Конечной стадией большинства разработанных методов является очистка аниона [B12H12]2– в виде додекагидро-клозо-додекабората цезия [16].
Цель настоящей работы – синтез [Ag2[B12H12]] высокой чистоты пиролизом смесей NaВН4–KВF4 без использования органических растворителей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
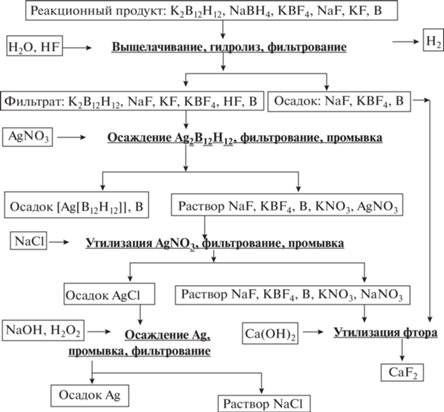
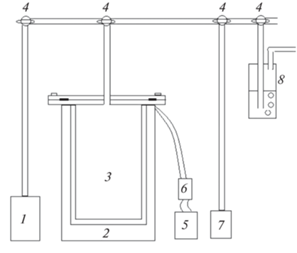
Для получения аниона [B12H12]2– проводили пиролиз смеси NaВН4–KВF4 в интервале температур 300–450°С согласно [15]. Для этого в герметичный цилиндрический реактор из нержавеющей стали (рис. 1) объемом 2.5 л загружали тщательно перемешанную смесь 947.7 г NaВН4 и 1246.4 г KВF4. В пересчете на 100%-ные реагенты мольное соотношение составляло 3.8 : 1.56. Через патрубок в крышке реактор вакуумировали и заполняли аргоном с помощью системы тройных кранов, после чего нагревали до температуры 300–450°С. После включения нагрева реактор соединяли с атмосферой через жидкостной затвор. Начало реакции, ее ход и окончание контролировали по пузырькам, выделяющимся в жидкостном затворе. После снижения скорости выделения газа до 5 пузырьков в мин нагрев прекращали и охлаждали реактор в атмосфере инертного газа. Далее 2122.5 г реакционного продукта в виде пемзообразного спека, содержащего 424.1 г Na2[B12H12], извлекали из реактора и растворяли в 5 л воды. Для разложения остаточного NaВН4 и образующихся промежуточных низших полиэдрических боргидридов [11‒15] к раствору добавляли плавиковую кислоту до рН 2. После отделения и промывания нерастворимого осадка получали 6 л объединенного раствора, содержащего 402.9 г Na2[B12H12], что соответствует его 95.0%-ному выходу из реакционного спека. Для получения [Ag2[B12H12]] отбирали 25 мл раствора и добавляли к нему нитрат серебра до образования устойчивого белого осадка, который отделяли от раствора, промывали водой и сушили при 105°С до постоянного веса. Получили 3.17 г [Ag2[B12H12]], что соответствует выходу 99.0% в пересчете на Na2[B12H12], содержащийся в аликвоте. Из раствора, полученного после отделения [Ag2[B12H12]] и содержащего избыток AgNO3, добавлением NaCl осаждали AgCl. После отделения и промывки осадка серебро регенерировали из хлорида действием известных восстановителей: NaBН4, гидразин-гидрата N2Н4 ⋅ Н2О, пероксида водорода Н2О2.
Рис. 1.
Схема установки пиролиза смесей NaВН4–KВF4: 1 – баллон с аргоном, 2 – печь, 3 – реактор, 4 – тройные краны, 5 – ЛАТР, 6 – задатчик температуры, 7 – вакуумный насос, 8 – жидкостной затвор.
Осадки из растворов отделяли центрифугированием с использованием напольной центрифуги K 70 D (ГДР) или фильтрованием.
В качестве исходных реагентов использовали NaВН4 (95.0%, АО “Авиабор”, Дзержинск); KВF4 (99.0%); плавиковую кислоту (х. ч., ОАО “Галоген”, Россия); AgNO3 (99.9%, OOO “Бертуз”); Н2О2 (мед. ТУ-2123-001-50908650-03, ГОСТ 177-88, НеваРеактив); сульфат гидразина 98.5%-ный (Реахим, Иркутск); NaCl (ч. д. а.); NaOH (ч. д. а.).
N2Н4 ⋅ Н2О получали отгонкой при нагревании смеси сульфата гидразина с NaOH по методике [17].
Анализ исходного NaВН4 и содержания его остатка в спеке проводили иодометрическим титрованием [18].
Количественное определение аниона [B12H12]2– в анализируемых образцах находили весовым методом в виде [Ag2[B12H12]] [19].
Рентгенофазовый анализ образцов проводили на дифрактометрах ДРОН-3 и Advance D8 по методу Брегга–Брентано (λCuKα).
ИК-спектры веществ регистрировали в области 400–4000 см–1 на ИК-спектрометре IFS Equinox-55S при комнатной температуре. Образцы для регистрации готовили в виде суспензий порошков в вазелиновом масле и в таблетках с KBr.
Cпектры MAS ЯМР 11B (T = 305 K, частота вращения образца 12 кГц) и жидких образцов записывали на многоядерных спектрометрах ЯМР Bruker Advance AV-300 (B0 = 7.04 Тл) и Bruker WP-80 (B0 = 1.09 Тл). Измерение химических сдвигов резонансных линий проводили с использованием в качестве внешнего стандарта (C2H5O)2 ⋅ BF3 (11B) с ошибкой ≤1 м.д.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ спека показал, что он содержит 1.98% остаточного NaВН4, что соответствует 95.6%-ной степени его разложения [15]. Содержание аниона [B12H12]2– в полученном спеке в пересчете на Na2[B12H12] составляет 19.98%. Это превышает количество Na2[B12H12], которое теоретически может образоваться из исходного NaВН4 по схеме: 12NaВН4 → Na2[B12H12]. Как предположили авторы [20], при пиролизе смесей NaBН4–NaBF4 образование аниона [B12H12]2– может проходить с участием бора тетрафторборатного компонента согласно уравнению реакции:
(1)
$\begin{gathered} {\text{19NaB}}{{{\text{Н}}}_{{\text{4}}}} + {\text{5NaB}}{{{\text{F}}}_{{\text{4}}}} \to \\ \to \,\,{\text{2N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{B}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}}}}} + {\text{20NaF + 26}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} \uparrow {\text{.}} \\ \end{gathered} $Это подтверждено и для смесей NaBН4–КВF4 [15, 21]:
(2)
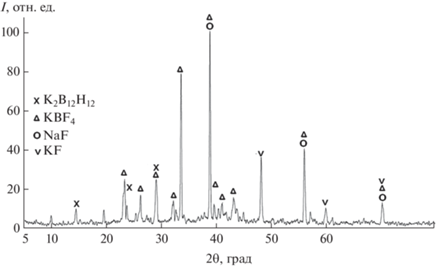
$\begin{gathered} {\text{19NaB}}{{{\text{Н}}}_{{\text{4}}}} + {\text{5KB}}{{{\text{F}}}_{{\text{4}}}} \to \\ \to \,\,{\text{2}}{{{\text{K}}}_{{\text{2}}}}\left[ {{{{\text{B}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}}}}}} \right] + {\text{19NaF + KF + 26}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} \uparrow {\text{.}} \\ \end{gathered} $По данным РФА (рис. 2), основными составляющими спека являются побочный NaF и KВF4. Наличие последнего объясняется тем, что для лучшего использования более дорогого реагента он был взят с избытком по отношению к NaBН4 (3.8 : 1.56) по сравнению со стехиометрией реакции (1) (3.8 : 1). Это обычный прием, используемый в гетерофазных реакциях. Кроме того, в спеке присутствуют целевой К2[B12H12], а также KF, являющийся побочным продуктом пиролиза этой смеси. Потемнение спека по сравнению с исходной смесью NaBН4–NaBF4 и его водных растворов говорит о наличии аморфного бора. Его образование происходит в ходе пиролиза по реакции, параллельно идущей по другому механизму, предложенному ранее в [22]:
(3)
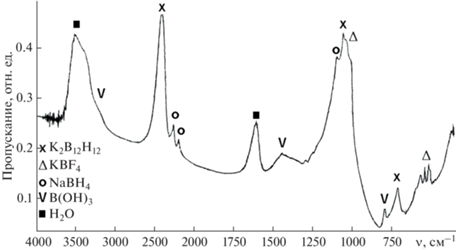
$\begin{gathered} {\text{36NaB}}{{{\text{Н}}}_{{\text{4}}}} + {\text{10NaB}}{{{\text{F}}}_{{\text{4}}}} \to \\ \to \,\,{\text{3N}}{{{\text{a}}}_{{\text{2}}}}{\text{[}}{{{\text{B}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}}}}}{\text{] + 40NaF}} + {\text{10В + 54}}{{{\text{H}}}_{{\text{2}}}} \uparrow {\text{.}} \\ \end{gathered} $Из анализа ИК-спектра спека (рис. 3) следует, что он содержит анион ${\text{BH}}_{4}^{ - }$ (полосы поглощения при 1122, 2224, 2294, 2386 см–1) [23] и анион ${\text{BF}}_{4}^{ - }$ (518, 533, 961, 1030, 1080 см–1) [24], а также анион [B12H12]2– (735, 1080, 2480 см–1 [11, 13, 22]). Наличие в смеси гигроскопичного фторида калия KF приводит к увлажнению спека и вызывает гидролиз остаточного NaВН4. Поэтому в ИК-спектре присутствуют полосы поглощения кислородных соединений бора (800, 1460 и 3230 см–1 [24]) и воды (1640, 3530 см–1 [24]).
Присутствие неразложившегося до конца тетрагидробората подтверждается довольно бурным выделением газа при обработке спека водой. Как правило, кроме остатков тетрагидробората в продуктах синтеза могут содержаться низшие полиэдрические боргидридные анионы: [B3H8]–, [B6H6]2–, [B10H10]2–, [B10H13]–, [B11H14]– [11–14]. В условиях выбранного способа получения [15, 21] в температурном интервале 300–450°С вероятность сохранения низших полиэдрических анионов мала, поскольку они все переходят в самый стабильный анион [B12H12]2–. Возможно, они все же присутствуют в спеке в небольшом количестве. Это подтверждается спектром MAS ЯМР 11B спека (рис. 4). Резонансный сигнал с химическим сдвигом в области –40 м.д. относится к остаточному NaBH4, а 0 м.д. – к избыточному KBF4. Резонансный сигнал с химическим сдвигом вблизи –15 м.д. характеризует анион [B12H12]2– [11, 13]. Явные сигналы других полиэдрических гидроборатов в спектре отсутствуют, хотя незначительная их примесь может маскироваться на фоне правого крыла сигнала аниона [B12H12]2–. Отмечается, что низшие полиэдрические боргидридные анионы гидролитически более устойчивы, чем тетрагидроборатный [11–14]. При приливании избытка AgNO3 к раствору спека, величина рН которого доведена до 4–5 для разложения остатков тетрагидробората, происходит образование светлого осадка. При отделении, промывке и сушке осадка он чернеет. Это подтверждает присутствие низших полиэдрических боргидридных анионов, которые также образуют плохо растворимые комплексы, как [Ag2[B12H12]]. По-видимому, они менее устойчивы на свету и постепенно разлагаются с выделением серебра. Однако в кислых условиях при рН 2–3 [11–14] низшие полиэдрические гидробораты разлагаются, поэтому осадок [Ag2[B12H12]] остается белым не только в растворе, но и после сушки. Следует иметь в виду, что в ходе гидролиза боргидридов идет защелачивание раствора. Поэтому надо периодически добавлять кислоту до установления устойчивой кислой среды с рН 2–3. Важно также помнить, что в более кислых средах возможно образование гидроксозамещенных клозо-гидроборатов [25], чего нельзя допускать и контролировать эту стадию выделения аниона [B12H12]2–.
Выбор кислоты для гидролиза боргидридных соединений определяется схемой выделения. Например, в известковой схеме [26] для выделения и очистки аниона [B12H12]2– удобно использовать фтористоводородную кислоту HF, чтобы не вносить дополнительные примеси и утилизировать фтористые соединения в виде СaF2, являющегося исходным сырьем для всей химии фтора. В отличие от концентрата флюорита, он не содержит примеси кремния, от которой трудно освободиться.
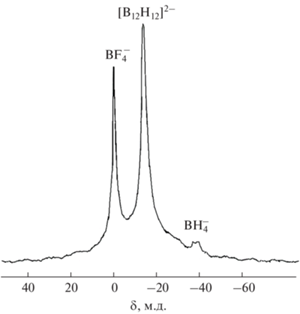
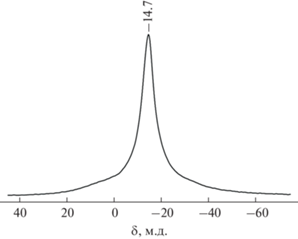
Фтористоводородная кислота подходит также для варианта очистки и выделения аниона [B12H12]2– в виде [Ag2[B12H12]], поскольку фторид серебра, в отличие от хлорида, хорошо растворим и не будет загрязнять целевое соединение. Осаждение [Ag2[B12H12] проводили (рис. 5) после гидролиза примесных боргидридных соединений и отделения осадка (весь КВF4, большая часть NaF, В). При добавлении к фильтрату, содержащему хорошо растворимые K2[B12H12] и КF (с незначительной примесью NaF, KВF4, HF и В), раствора AgNO3 выпадает осадок [Ag2[B12H12]]. Чистоту фильтрата от примесных полиэдрических боргидридных анионов контролировали с помощью 11B ЯМР-спектроскопии. Для осаждения [Ag2[B12H12]] следует использовать избыток азотнокислого серебра [19]. При недостатке AgNO3 образуется растворимый комплекс [Cat[AgВ12Н12]], в котором [B12H12]2– выступает в роли внутрисферного аниона [27]. Это же характерно и для других полиэдрических клозо-боратов [28, 29]. Кроме того, при избытке AgNO3 растворы хорошо осветляются, а осадки [Ag2[B12H12]] легче фильтруются. Благодаря нерастворимости получаемый [Ag2[B12H12]] отличается высокой чистотой. Его спектр MAS ЯМР 11B представлен на рис. 6. Резонансный сигнал с химическим сдвигом ‒14.7 м.д. относится к аниону [B12H12]2– [11, 13]. Спектр не содержит резонансных сигналов ни посторонних полиэдрических боргидридных анионов, ни кислородных соединений бора.
Чтобы этот способ был экономически приемлемым, необходимо избегать потерь серебра в виде AgNO3, взятого в избытке. Исследовано несколько вариантов его осаждения: под действием NaBН4, пероксида водорода Н2О2 и гидризин-гидрата N2Н4 ⋅ Н2О. Установлено, что из-за низкой концентрации AgNO3 в растворе, образующемся после отделения осадка [Ag2[B12H12]] и его тщательной отмывки, серебро восстанавливается с образованием ультрадисперсной трудно фильтруемой взвеси. Поэтому предварительно проводили концентрирование AgNO3 с помощью NaCl до AgCl (рис. 5), который хорошо фильтруется и отмывается. Наиболее пригодным для восстановления серебра показал себя Н2О2. После добавления к водной дисперсии AgCl пероксида водорода и NaOH серебро выпадает в виде темного, относительно крупного и легко фильтруемого порошка. Два других исследованных восстановителя – NaBН4 и N2Н4 ⋅ Н2О – являются более дорогими и токсичными по сравнению с Н2О2. После растворения полученного порошка в азотной кислоте образующийся нитрат серебра может быть возвращен на осаждение [B12H12]2– в виде [Ag2[B12H12]].
ЗАКЛЮЧЕНИЕ
Таким образом, использование нитрата серебра для выделения аниона [B12H12]2– в виде [Ag2[B12H12]] является вполне обоснованным. Следует отметить, что широко применяющийся способ очистки через стадию образования соли Cs2[B12H12] [16] не подходит из-за низкой растворимости тетрафтороборатов калия и цезия. Указанный подход также имеет преимущества по сравнению с известковой схемой [26]. Во-первых, выделение [Ag2[B12H12]] происходит в начале переработки реакционного спека и протекает с высоким выходом, поскольку он не теряется с промывными растворами благодаря его практически полной нерастворимости. В известковой схеме [26] растворы, содержащие растворимые додекагидро-клозо-додекабораты, теряются в сильнообводненных глинообразных осадках Са(ОН)2. Для повышения степени извлечения следует проводить многократную отмывку осадков, что приводит к накоплению в целевых додекагидро-клозо-додекаборатах примеси Са(ОН)2. Во-вторых, благодаря низкой растворимости [Ag2[B12H12]] обладает высокой чистотой, так как все примеси полностью удаляются при промывке. В-третьих, использование нитрата серебра по замкнутому циклу не приводит к заметному удорожанию конечного продукта.
Список литературы
Steinhauser G., Klapotke T.M. // Ang. Chem., Int. Ed. 2008. V. 47. P. 3330. https://doi.org/10.1002/anie.2007045
Wang H.-R., Zhang C., Hu B.-C. et al. // Molecules. 2020. V. 25. № 8. P. 1783. https://doi.org/10.3390/molecules25081783
Hanumantha M., Muralidharan K. // Dalton Trans. 2013. V. 42. № 24. P. 8854. https://doi.org/10.1039/c3dt32834a
Sharon P., Afri M., Mitlin S. et al. // Polyhedron. 2019. V. 157. № 1. P. 71. https://doi.org/10.1016/j.poly.2018.09.055
Sivaev I.B. // Chem. Heterocycl. Comp. 2017. V. 53. № 6–7. P. 638. [Сиваев И.Б. // Химия гетероцикл. соединений. 2017. Т. 53. № 6–7. С. 638]. https://doi.org/10.1007/s10593-017-2106-9
Zhang Z., Zhang Y., Li Z. et al. // Eur. J. Inorg. Chem. 2018. V. 2018. № 8. P. 981. https://doi.org/10.1002/ejic.201701206
Malinina E.A., Kochneva I.K., Avdeeva V.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 10. P. 1210. [Малинина Е.А., Кочнева И.К., Авдеева В.В. и др. // Журн. неорган. химии. 2019. Т. 64. № 10. С. 1031.] https://doi.org/10.1134/S0036023619100085
Malinina E.A., Korolenko S.E., Kubasov A.S. et al. // Polyhedron. 2020. V. 184. P. 114566. https://doi.org/10.1016/j.poly.2020.114566
Korolenko S.E., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2021. Т. 66. № 9. С. 1350. [Короленко С.Е., Авдеева В.В., Малинина E.A. и др. // Журн. неорган. химии. 2021. Т. 66. № 9. С. 1255.] https://doi.org/10.1134/S0036023621090047
Sivaev I.B. // Russ. J. Inorg. Chem. 2021. Т. 66. № 9. С. 1289. [Сиваев И.Б. // Журн. неорган. химии. 2021. Т. 66. № 9. С. 1192.] https://doi.org/10.1134/S0036023621090151
Ellis I.A., Gaines D.F., Schaeffer R. // J. Am. Chem. Soc. 1963. V. 85. № 23. P. 3885.
Кузнецов Н.Т., Солнцев К.А., Агафонов А.В. // Коорд. химия. 1979. Т. 5. № 9. С. 1297.
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czech. Chem. Commun. 2002. V. 67. № 6. P. 679.
Bykov A.Y., Mal’tseva N.N., Generalova N.B. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 11. P. 1321. [Быков А.Ю., Мальцева Н.Н., Генералова Н.Б. и др. // Журн. неорган. химии. 2013. Т. 58. № 11. С. 1474.] https://doi.org/10.1134/S003602361311003X
Салдин В.И., Суховей В.В., Игнатьева Л.Н. и др. // Хим. технология. 2019. Т. 20. № 13. С. 615. https://doi.org/10.31044/1684-5811-2019-20-13-615-619
Кузнецов Н.Т., Солнцев К.А., Куликова Л.Н. // Коорд. химия. 1976. Т. 2. № 11. С. 1574.
Химическая энциклопедия: в 5 т. / Под ред. Кнунянц И.Л. и др. М.: Сов. энцикл., 1998. Т. 1. 623 с.
Норкус П.К. // Журн. аналит. химии. 1968. Т. 23. № 6. С. 908.
Кузнецов Н.Т., Куликова Л.Н., Канаева О.А. // Журн. аналит. химии. 1976. Т. 31. № 7. С. 1382.
Rude L.H., Filso U., D' Anna V. et al. // Phys. Chem. Chem. Phys. 2013. V. 15. № 41. P. 18185. https://doi.org/10.1039/c3cp52815d
Saldin V.I., Sukhovey V.V., Savchenko N.N. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 5. P. 630. [Салдин В.И., Суховей В.В., Савченко Н.Н. и др. // Журн. неорган. химии. 2016. Т. 61. № 5. С. 661.] https://doi.org/10.1134/S0036023616050193
Кузнецов Н.Т. // Исследования по неорганической химии и химической технологиии. Сб. научн. тр. ИОНХ / Под ред. Цивадзе А.Ю. М.: Наука, 1988. 78 с.
Мальцева Н.Н., Хаин В.С. Борогидрид натрия. М.: Наука, 1985. 207 с.
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. / Пер. с англ. под ред. Пентина Ю.А. М.: Мир, 1991. 536 с.
Peymann T., Knobler C.B., Hawthorne M.F. // Inorg. Chem. 2000. V. 39. № 6. P. 1163.
Салдин В.И., Суховей В.В., Игнатьева Л.Н. и др. // Хим. технология. 2009. Т. 10. № 1. С. 1.
Drozdova V.V., Malinina E.A., Belousova O.N. et al. // Russ. J. Inorg. Chem. 2008. V. 53. № 7. P. 1024. [Дроздова В.В., Малинина Е.А., Белоусова О.Н. и др. // Журн. неорган. химии. 2008. Т. 53. № 7. С. 1105.] https://doi.org/10.1134/S0036023608070097
Avdeeva V.V., Buzanov G.A., Malinina E.A. et al. // Crystals. 2020. V. 10. № 5. P. 389. https://doi.org/10.3390/cryst10050389
Avdeeva V.V., Malinina E.A., Zhizhin K.Yu. et al. // Russ. J. Coord. Chem. 2021. V. 47. № 8. P. 519. [Авдеева В.В., Малинина Е.А., Жижин К.Ю. и др. // Коорд. химия. 2021. Т. 47. № 8. С. 457.] https://doi.org/10.1134/S1070328421080017
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии