Журнал неорганической химии, 2022, T. 67, № 7, стр. 916-924
О полиморфизме сульфата натрия
В. Ю. Пройдакова a, В. В. Воронов a, А. А. Пыненков b, С. В. Кузнецов a, М. П. Зыкова c, К. Н. Нищев b, П. П. Федоров a, *
a Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Россия
b Мордовский государственный университет им. Н.П. Огарева
430005 Саранск, Большевистская ул., 68/1, Россия
c Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, стр. 33, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 18.11.2021
После доработки 20.12.2021
Принята к публикации 27.12.2021
- EDN: BWGPOL
- DOI: 10.31857/S0044457X22070200
Аннотация
Термоаналитическим и рентгенофазовым методами анализа исследована кристаллическая структура безводного сульфата натрия, очищенного двукратной перекристаллизацией из водного раствора, в интервале температур от 25 до 300°C. При нагревании со скоростью 5 град/мин Na2SO4 претерпевает фазовый переход первого рода (начало при 240°C) от ромбической структуры, описываемой пр. гр. Fddd (фаза V), к гексагональной структуре (пр. гр. P63/mmc, фаза I). Однако при 225°C на рентгенограмме появляются линии ромбической фазы III (пр. гр. Cmcm), которая сосуществует с фазами V и I при 240°C.
ВВЕДЕНИЕ
Интерес к сульфату натрия (Na2SO4, минерал тенардит) не ослабевает на протяжении столетий [1, 2]. Это связано как с физическими и химическими свойствами самого соединения, так и с большим разнообразием структурных фазовых переходов. Начиная с первой половины XX в. было опубликовано много работ по исследованию полиморфизма и физических свойств сульфата натрия, но противоречивые данные и отсутствие контроля примесей в исходных препаратах не позволяют прекратить исследования этого соединения.
Полиморфные превращения сульфата натрия привлекают внимание исследователей при разработке термоаккумулирующих материалов [3]. В настоящее время все больший интерес вызывает переход мирабилита (Na2SO4 · 10H2O) в тенардит (Na2SO4) и обратно при изменении давления, влажности и температуры. Эти минералы встречаются, помимо морских отложений, в порах горных пород и строительных материалов (кирпич, бетон). При изменении температуры окружающей среды и относительной влажности в порах происходят процессы кристаллизации–растворения или гидратации–дегидратации, что приводит к повреждению как древних памятников, так и современных зданий [4–6].
Сульфат натрия имеет одну из самых сложных последовательностей полиморфизма, изучаемых множеством методов. Безводный сульфат натрия существует предположительно в пяти различных формах, обычно их называют фазами I–V [2, 7].
Природный минерал тенардит (Na2SO4) – фаза V – при комнатной температуре и относительно низкой влажности воздуха является стабильным соединением и имеет ромбическую сингонию с пр. гр. Fddd [8]. При нагревании выше 240°C безводный Na2SO4 переходит в высокотемпературную фазу I, которая имеет гексагональную сингонию с пр. гр. P63/mmc и остается стабильной до температуры плавления 859°C. Эта фаза известна в виде природного минерала метатенардита, содержащего значительное количество изо- и гетеровалентных примесей [9]. Подробное исследование кристаллической структуры высокотемпературной фазы I (Na2SO4), стабилизированной 1.2% сульфата иттрия, выполнено в работе [10] при комнатной температуре. Авторы [11] уточнили структурные детали нелегированной фазы при 423°C. Сульфат натрия при охлаждении ниже 235°C из фазы I сначала преобразуется в фазу II, которая имеет ромбическую сингонию (пр. гр. Pbnm) [12], затем при дальнейшем охлаждении ниже 220°C фаза II переходит в фазу III, которая имеет ромбическую сингонию с пр. гр. Cmcm [12, 13]. Сравнение кристаллических структур фаз I, II и III показало [14], что структура фазы II определяется вращением тетраэдров (SO4)2– и небольшим расширением решетки в фазе III. Указана взаимосвязь между супергруппами и подгруппами симметрии, причем атомы Na и S имеют одинаковое положение в трех фазах, основные различия заключаются в ориентации сульфатных групп (SO4)2– [14].
Фаза III считается метастабильной. В [15] исследован переход из фазы III в фазу V с помощью комбинационного рассеяния света. Показано, что образец Na2SO4 (III), хранящийся в эксикаторе без доступа воздуха, при комнатной температуре может существовать неопределенно долго. Однако если его вынуть и держать на воздухе при комнатной температуре и низкой влажности, фаза III будет постепенно переходить в фазу V. Эксперименты [16] по переходу от водной капли к кристаллу показали, что сначала идет зарождение метастабильной фазы III, а не фазы V. Кристаллизация в каплях происходит при большом пересыщении, и по правилу ступеней Оствальда метастабильные фазы, как правило, формируются быстрее, чем стабильные. При небольшом количестве воды фаза III все-таки переходит в фазу V. При относительной влажности воздуха ~83% происходит также полная конверсия фазы III в фазу V [5].
В литературе не утихают споры о существовании промежуточной фазы IV, которая при нагревании может находиться между фазами V и I. Авторы [17] проводили термостатирование сульфата натрия при 190–210°C в течение 20 сут, затем закаляли и утверждали, что фаза IV образуется, подтверждая свою теорию термодинамическими расчетами. В работах [18–20] авторы тоже выдерживали образец Na2SO4 при 200°C от 20 до 80 сут, закаляли в жидком азоте, возвращали к комнатной температуре и методами комбинационного рассеяния света и дифференциальной сканирующей калориметрии не обнаружили фазы IV. В недавней работе [7] выполнена дифференциальная сканирующая калориметрия сульфата натрия и утверждается, что обнаружена метастабильная фаза IV, но достоверные рентгенографические данные не приведены.
Информация о полиморфных модификациях Na2SO4 приведена в табл. 1. При термическом разложении при 180°С соединения Na3H(SO4)2 образуется смесь модификаций Na2SO4: I, III и V [21].
Таблица 1.
Полиморфные модификации сульфата натрия
| Обозначение | Сингония | Пр. гр. симметрии | Z |
|---|---|---|---|
| I, Na2SO4 (α-Na2SO4, метатенардит) | Гексагональная | P63/mmc | 2 |
| II, Na2SO4 | Ромбическая | Pbnm | 4 |
| III, Na2SO4 | Ромбическая | Cmcm | 4 |
| IV, Na2SO4 | ? | ? | |
| V, Na2SO4 (тенардит) | Ромбическая | Fddd | 8 |
Несмотря на то, что влияние примесей на полиморфизм во многих случаях является очевидным эффектом [22, 23], недостатком предшествующих работ является отсутствие количественной характеризации чистоты исследованных образцов сульфата натрия.
Цель настоящей работы – исследование фазовых переходов сульфата натрия c использованием препарата Na2SO4 с контролируемым содержанием примесей, предварительно дважды перекристаллизованного из водного раствора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактив сульфата натрия Na2SO4 марки “х. ч.” (Химмед, Россия) дополнительно очищали перекристаллизацией из воды, используя данные по растворимости солей [5, 6]. Брали коническую колбу, наливали 100 мл бидистиллированной воды и устанавливали на водяную баню, затем добавляли 49.5 г сульфата натрия при температуре 32.4°C и дожидались полного растворения. Затем теплый раствор фильтровали на складчатом фильтре (синяя лента) на водяной бане. Раствор после фильтрования охлаждали сначала на воздухе, а затем на ледяной бане до температуры 10°C. Полученный осадок отфильтровывали и сушили под лампой на воздухе при 60°C. Массовая доля выхода составила 40%. Перекристаллизацию из воды выполняли дважды.
Аналитические измерения содержания примесей в препаратах Na2SO4 проводили с использованием масс-спектрометра с индуктивно связанной плазмой (МС-ИСП) NexION 300D (Perkin Elmer, США). Анализируемые препараты растворяли в высокочистой воде (Aqua-MAX-Ultra 370, Южная Корея). Продукт растворения переносили в пробирку из полипропилена, затем производили отбор аликвоты с последующим разбавлением и анализом методом TotalQuant [24] для определения концентраций 65 химических элементов.
Исследование фазового состава полученного образца сульфата натрия проводили на дифрактометре Bruker D8 Advance (CuKα-излучение) с высокотемпературной приставкой (HTK 1200N) на воздухе. Скорость нагрева и охлаждения составляла 5–10 град/мин, время выдержки при каждой температуре – 15 мин, шаг сканирования 2θ – 0.01°, время выдержки на шаге – 0.3 с. Дифрактограммы обрабатывали с помощью программы EVA (версия 2.1), расшифровку проводили с помощью базы данных PDF-2 (версия 2011 года). Параметры решетки рассчитывали в программе TOPAS v.4.2.
Термоаналитические исследования проводили на дифференциальном сканирующем калориметре Netzsch DSC 404 F1 Pegasus в интервале температур 25–800°С со скоростью сканирования 2–10 град/мин на воздухе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По данным [5, 6], при 10°C из водного раствора выпадает осадок мирабилита Na2SO4 · 10H2O, но если охладить до более низкой температуры, то помимо мирабилита может выпасть метастабильная твердая фаза Na2SO4 · 7H2O. Мирабилит и тенардит довольно долго могут находиться в равновесии:
(1)
${\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}} \cdot {\text{10}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}} + {\text{10}}{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$По данным аналитических измерений, представленным в табл. 2, единственная примесь, находящаяся в полученном препарате сульфата натрия в заметном количестве, – это кальций (~0.1 мас. %). Следовые количества редкоземельных элементов, обнаруживаемые в препарате, по-видимому, связаны с многолетними исследованиями люминесцентных материалов, проводимыми в лаборатории ИОФ РАН. По результатам анализа, содержание элементов Rh, Pd, Ag, In, Pr, Dy, Lu, Hf, Ta, Re, Os, Ir, Au, Th, U находится ниже предела определения (0.1 ppm).
Таблица 2.
Результаты химического анализа образца Na2SO4, очищенного перекристаллизацией
| Элемент | ppm | Элемент | ppm | Элемент | ppm |
|---|---|---|---|---|---|
| Li | 1.5 | Ga | 0.9 | La | 0.3 |
| Be | 0.1 | Ge | 1.0 | Ce | 1.8 |
| B | 7.6 | As | 1.5 | Nd | 0.1 |
| Mg | 33.1 | Se | 47.2 | Sm | 0.1 |
| Al | 11.1 | Rb | 0.3 | Eu | 1.3 |
| Si | 248.7 | Sr | 215.5 | Gd | 98.6 |
| K | 38.4 | Y | 160.6 | Tb | 0.6 |
| Ca | 1186.0 | Zr | 0.2 | Ho | 1.5 |
| Sc | 0.4 | Nb | 0.1 | Er | 2.5 |
| V | 0.2 | Mo | 1.0 | Tm | 17.0 |
| Cr | 1.1 | Ru | 0.1 | Yb | 78.6 |
| Mn | 0.8 | Cd | 0.1 | W | 14.7 |
| Fe | 4.9 | Sn | 2.1 | Pt | 1.7 |
| Co | 0.1 | Sb | 0.2 | Hg | 0.3 |
| Ni | 1.1 | Te | 9.6 | Tl | 0.9 |
| Cu | 0.5 | Cs | 0.2 | Pb | 0.2 |
| Zn | 2.3 | Ba | 8.5 | Bi | 0.7 |
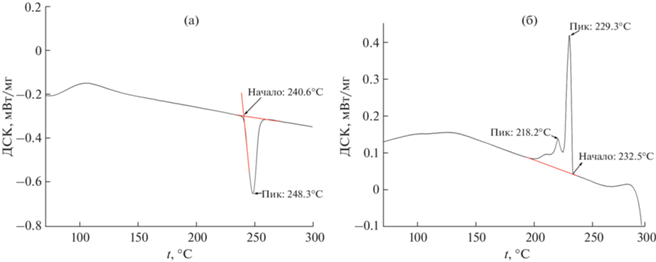
По нашим экспериментальным данным, дважды перекристаллизованный и хорошо высушенный образец сульфата натрия (тенардит) имеет на ДСК-кривых нагрева (рис. 1а) один эндотермический эффект, который соответствует переходу из фазы V в фазу I: начало превращения фиксируется при 240.6°C, пик – при 248.3°C. Мы не наблюдали на термограммах аномалий, отмеченных в работах [2, 7], которые относят к переходам V–IV и IV–I. Однако нельзя исключить, что наблюдаемый на термограмме термический эффект может иметь составной характер и представлять сумму нескольких процессов фазовых переходов. Кривые охлаждения (рис. 1б) имеют более сложный характер. Начало первого превращения фиксируется при 232.5°C, максимум – при 229.3°C, второе превращение имеет максимум при 218.2oС. Эти эффекты согласуются с результатами других работ [2, 7, 14–20] и соответствуют переходам из фазы I в фазу II и из фазы II в фазу III.
Рис. 1.
ДСК-кривые нагревания (a) и охлаждения (б) дважды перекристаллизованного Na2SO4 со скоростью сканирования 5 град/мин на воздухе. Масса навески 17 мг.
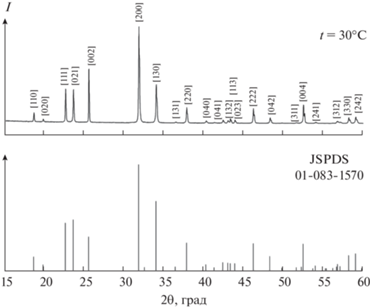
Для более детального изучения промежуточных фаз мы провели высокотемпературные рентгенофазовые исследования перекристаллизованного сульфата натрия и проследили за изменениями на дифрактограммах (рис. 2а и 3), связанными со структурными фазовыми переходами. Мы тщательно исследовали температурный интервал от 25 до 300°С. При температуре 25oС кристаллическая структура образца Na2SO4 относится к ромбической сингонии (пр. гр. Fddd), что согласуется с большинством работ [2, 8–10]. При повышении температуры от 25 до 210°С у сульфата натрия не происходит существенных изменений на дифрактограммах, индицирование показывает присутствие единственной фазы тенардита, а смещение рефлексов в сторону меньших углов (рис. 2б), вызванное увеличением параметров решетки и объема элементарной ячейки, подтверждается результатами расчета, приведенными в табл. 3.
Рис. 2.
Дифрактограммы дважды перекристаллизованного образца Na2SO4 при температурах от 25 до 210°С по сравнению с рентгенограммой тенардита, JCPDS card № 00-037-1465 (a) и участок рентгенограммы, демонстрирующий смещение рефлекса (351) при повышении температуры (б).
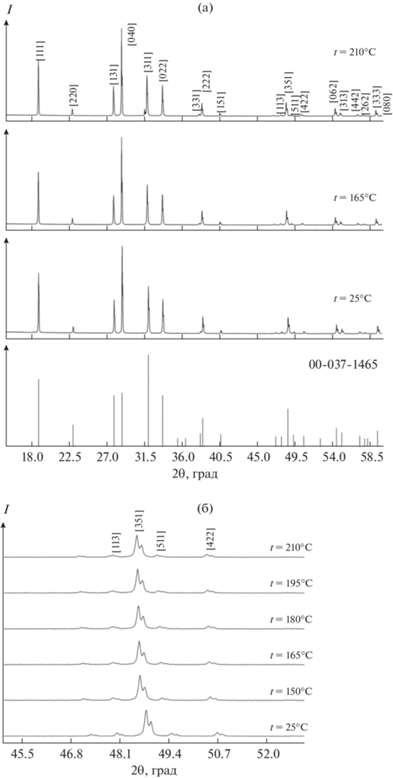
Таблица 3.
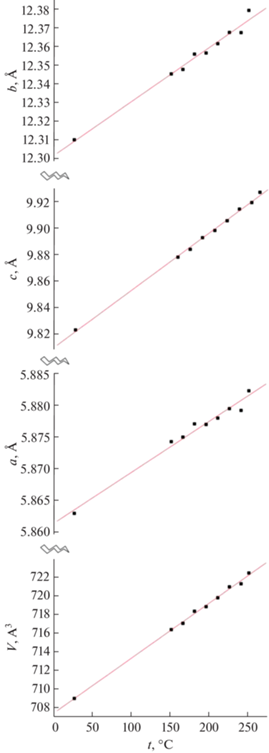
Параметры решетки и объем элементарной ячейки для образца Na2SO4 при температурах 25–300°C
| t, °C | a, Å | b, Å | c, Å | V, Å3 | V/Z |
|---|---|---|---|---|---|
| Ромбическая сингония, пр. гр. Fddd | |||||
| 25 | 5.8630 | 12.3098 | 9.8230 | 708.96 | 88.62 |
| 150 | 5.8743 | 12.3450 | 9.8780 | 716.33 | 89.54 |
| 165 | 5.8750 | 12.3474 | 9.8839 | 716.99 | 89.62 |
| 180 | 5.8769 | 12.3548 | 9.8927 | 718.29 | 89.79 |
| 195 | 5.8770 | 12.3562 | 9.8981 | 718.78 | 89.85 |
| 210 | 5.8780 | 12.3612 | 9.9055 | 719.738 | 89.97 |
| 225 | 5.8795 | 12.3672 | 9.9143 | 720.90 | 90.11 |
| 240 | 5.8792(3) | 12.3671(6) | 9.9192(6) | 721.22(6) | 90.15 |
| 250 | 5.8823(1) | 12.379(2) | 9.927(2) | 722.8(2) | 90.35 |
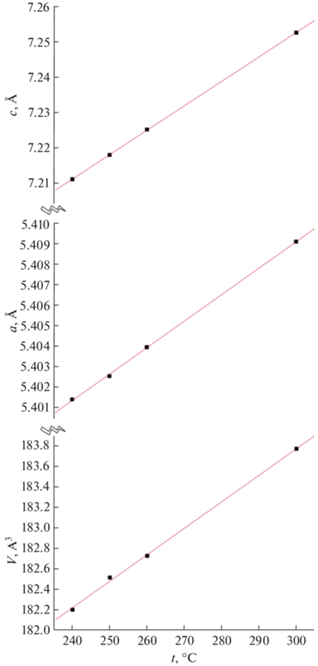
| Гексагональная сингония, пр. гр. P63/mmc | |||||
| 240 | 5.4001(2) | – | 7.2087(3) | 182.05(2) | 91.025 |
| 250 | 5.4031(1) | – | 7.2188(4) | 182.51(2) | 91.26 |
| 260 | 5.4034(2) | – | 7.2246(3) | 182.68(1) | 91.34 |
| 300 | 5.40911 | – | 7.2526 | 183.773 | 91.89 |
| Ромбическая сингония, пр. гр. Ccmc | |||||
| 240 | 5.604(2) | 9.047(3) | 6.947(3) | 352.2(3) | 88.05 |
| 30 | 5.6116(1) | 8.9511(3) | 6.968(2) | 350.02(2) | 87.51 |
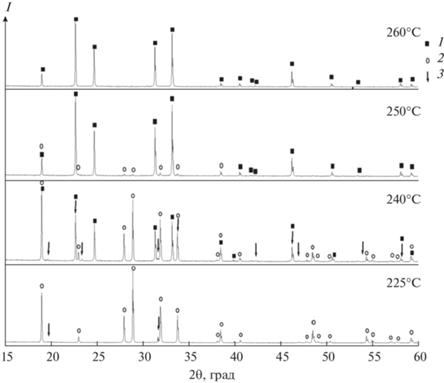
По данным высокотемпературного РФА (рис. 3), в интервале температур 225–300°C не наблюдается метастабильного фазового перехода в фазу IV, что согласуется с работами [12, 15, 18–20]. При температуре 225°C на дифрактограмме появляется незначительное количество рефлексов, относящихся к фазе III. Можно предположить, что при этой температуре начинается переход V → III и эти фазы сосуществуют до 240°C, причем переход происходит медленно. При температуре 225°C не удалось рассчитать параметры решетки из-за малой интенсивности рефлексов фазы III. При 240°C интенсивность рефлексов фаз увеличилась, что позволило рассчитать процентное соотношение фаз между собой, а именно: фаза III – 7.93%, фаза V –71.61%, фаза I – 20.46%. Следовательно, переход III → I происходит вблизи 240°C. Сравнивая дифрактограммы при 225 и 240°C, можно видеть, что интенсивность рефлексов фаз V и III практически не меняется, а вот интенсивность рефлексов фазы I сильно выросла. Из этого следует, что фаза V начинает медленно переходить в фазу III при температуре ~225°C, а затем в фазу I при температуре 240°C, т.е. фазовый переход выглядит следующим образом: V → III → I. При сравнении дифрактограмм при 240 и 250°C видно, что при повышении температуры на 10°C содержание тенардитовой фазы V резко уменьшается до 13.1%, а фазы I увеличивается до 86.9%. При 260°С существует единственная высокотемпературная фаза I. Таким образом, тенардитовая фаза (V) начинает резко переходить в высокотемпературную гексагональную фазу I выше 240°C, что согласуется с результатами ДСК. Полученные данные свидетельствуют о существовании двух механизмов твердофазных переходов у сульфата натрия: V → III → I и V → I.
Рис. 3.
Дифрактограммы дважды перекристаллизованного образца Na2SO4 при температурах от 225 до 260°C: 1 – фаза I, 2 – фаза V, 3 – фаза III.
Нами были рассчитаны параметры решетки и объем элементарной ячейки для всех фаз (табл. 3). Измерение объема в результате фазовых переходов, приходящегося на формульную единицу (V/Z), невелико (~1%).
Изменение с температурой параметров решетки и мольных объемов фаз I и V носит линейный характер. Параметры решетки высокотемпературной гексагональной фазы хорошо согласуются как с нашими данными, измеренными при более высокой температуре [25], так и с данными карточки JCPDS #01-078-1361.
Таким образом, в области температур от 225 до 260°C происходит фазовый переход первого рода. Этот переход носит заторможенный характер, что типично для фазовых переходов, протекающих в твердом состоянии. Он характеризуется такими явлениями, как сосуществование двух фаз (V и III) и рост новой фазы I из исходной фазы V. При фазовом переходе первого рода имеет место скачкообразное изменение параметра порядка. Система переходит из одного определенного равновесного фазового состава минерала тенардита в высокотемпературную фазу I.
После охлаждения образца Na2SO4 от 300 до 30°C происходит обратный фазовый переход, но не в исходную фазу V, а в фазу III (рис. 4). На дифрактограммах при 30°C индицирование показывает единственную фазу III (ромбическая сингония, пр. гр. Cmcm). Результаты расчета, приведенные в табл. 3, согласуются с большинством работ [12, 13].
По рассчитанным параметрам решетки были построены графики зависимости параметров решетки и объема элементарной ячейки от температуры для фазы V (температурный интервал от 25 до 240°C, рис. 5) и для фазы I (температурный интервал от 240 до 300°C, рис. 6).
ЗАКЛЮЧЕНИЕ
Подробное исследование дифрактограмм высокотемпературного рентгенографического исследования дало новую информацию о последовательности фазовых переходов в сульфате натрия в интервале температур от 25 до 300°C. Фазовый переход V → I приводит к резкому изменению кристаллической структуры, эти изменения могут идти двумя путями: во-первых, начальные изменения происходят при температуре 225°С, когда фаза V частично переходит в фазу III, а затем в фазу I около 240°С; во-вторых, параллельно с переходом V → III → I идет переход V → I при температуре 240°С, заканчивающийся при ~252°С. В интервале температур от 25 до 300°С отсутствует промежуточная метастабильная фаза IV. Таким образом, выявленная нами картина фазовых превращений для очищенного сульфата натрия Na2SO4 существенно проще, чем предлагавшаяся, например, в работах [13, 17]. Полученные данные ДСК согласуются с изображением полиморфизма Na2SO4 с единственным фазовым переходом при 240°C на исследованных нами фазовых диаграммах бинарных систем [25, 26] и находятся в противоречии с интерпретацией двух фазовых переходов при ~190 и 240°C, например, в работах [27, 28].
Список литературы
Миттова И.Я., Самойлов А.М. История химии с древнейших времен до конца ХХ в. В 2-х томах. М.: Интеллект, 2009. 2012 с.
Kracek F.C., Ksanda C.J. // J. Phys. Chem. 1929. V. 33. P. 1281.
Chen B., Liu T.-H., Jiao H., Jing X.-P. // Phase Transitions. 2014. V. 87. P. 629.
Wang Y., Chou I.-M., Zheng M., Hou X. // J. Chem. Thermodynamics. 2017. V. 111. P. 221.
Linnow K., Zeunert A., Steiger M. // Anal. Chem. 2006. V. 78. P. 4683.
Rodriguez-Navarro C., Doehne E., Sebastia E. // Cement Concrete Res. 2000. V. 30. P. 1527.
Bobade S.M., Gopalan P., Kulkarni A.R. // Ionics. 2009. V. 15. P. 353.
Nord A.G. // Acta Chem. Scand. 1973. V. 27. P. 814.
Pekov I.V., Shchipalkina N.V., Zubkova N.V. et al. // Can. Mineralogist. 2019. V. 57. P. 885. https://doi.org/10.3749/canmin.1900050
Eysel W., Hofer H.H., Keester K.L., Hahn Th. // Acta Crystallogr., Sect. B. 1985. V. 41. P. 5.
Naruse H., Tanaka K., Morikawa H. et al. // Acta. Crystallogr., Sect. B. 1987. V. 43. P. 143.
Rasmussen S.E., Jorgensen J.-E., Lundtoft B. // J. Appl. Crystallogr. 1996. V. 29. P. 42.
Mehorta B.N. // Z. Kristallogr. 1981. V. 155. P. 159.
Kobayashi K., Saito Y. // Thermo. Acta. 1982. V. 53. P. 299.
Davis J.E., Sandford W.F. // J. Chem. Soc., Dalton Trans. 1975. № 19. P. 1912. https://doi.org/10.1039/DT9750001912
Xu B., Schweiger G. // J. Aerosol. Sci. 1999. V. 30. P. 379.
Brodale G.E., Giauque W.F. // J. Phys. Chem. 1972. V. 76. P. 737.
Cody C.A., Dicarlo L., Darlington R.K. // J. Inorg. Nucl. Chem. 1981. V. 43. P. 398.
Choi B.K., Lockwood D.J. // J. Phys.: Condens. Matter. 2005. V. 17. P. 6095.
Choi B.K. // Phys. Status Solidi. B. 2008. V. 245. P. 946.
Dmitrieva N.V., Bubnova R.S., Filatov S.K. et al. // Glass Phys. Chem. 2019. V. 45. P. 395.
Sobolev B.P., Fedorov P.P., Steynberg D.B. et al. // J. Solid State Chem. 1976. V. 17. № 1/2. P. 191. https://doi.org/.10.1016/0022-4596(76)90220-6
Федоров П.П., Назаркин М.В., Закалюкин Р.М. // Кристаллография. 2002. Т. 47. № 2. С. 316. [Fedorov P.P., Nazarkin M.V., Zakalyukin R.M. // Crystallogr. Rep. 2002. V. 47. № 2. P. 281.] https://doi.org/10.1134/1.1466504
Pruszkowski E., Life P.E. Total quant analysis of teas and wines by ICP-MS. Perkin Elmer Life and Analytical Sciences. Field Application Report. ICP Mass Spectrometry. USA, 2004.
Fedorov P.P., Proydakova V.Yu., Kuznetsov S.V. et al. // J. Am. Ceram. Soc. 2020. V. 103. № 5. P. 3390. https://doi.org/10.1111/jace.16996
Федоров П.П., Пройдакова В.Ю., Кузнецов С.В., Воронов В.В. // Журн. неорган. химии. 2017. Т. 62. № 11. С. 1513. [Fedorov P.P., Proidakova V.Yu., Kuznetsov S.V., Voronov V.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 11. P. 1508.] https://doi.org/10.1134/S0036023617110067
Плющев В.Е., Самусева Р.Г., Полетаев И.Ф. // Журн. неорган. химии. 1962. Т. 7. № 4. С. 860.
Heed B., Lunden A., Schroeder K. // Electrochim. Acta. 1977. V. 22. P. 705.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии