Журнал неорганической химии, 2022, T. 67, № 7, стр. 991-999
Сорбенты с функциональной группой таурина: кинетика взаимодействия с ионами одно- и двухвалентных металлов в аммиачно-ацетатном буферном растворе
Ю. С. Петрова a, Л. М. к. Алифханова a, *, К. Я. Кузнецова a, Е. И. Капитанова a, Л. К. Неудачина a, А. В. Пестов a, b
a Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
b Институт органического синтеза им. И.Я. Постовского УрО РАН
620219 Екатеринбург, ул. Софьи Ковалевской, 22, Россия
* E-mail: alifkhanova@rambler.ru
Поступила в редакцию 22.11.2021
После доработки 08.02.2022
Принята к публикации 09.02.2022
- EDN: BHKBKJ
- DOI: 10.31857/S0044457X22070182
Аннотация
Исследована кинетика сорбции ряда ионов металлов из многокомпонентных растворов сорбентами с функциональной группой таурина на основе ряда аминополимеров: хитозана, полиаллиламина и полиэтиленимина. Установлено, что сорбенты на основе сульфоэтилированного полиаллиламина характеризуются наибольшей селективностью сорбции серебра(I) и наименьшим временем установления равновесия. В отличие от остальных исследованных сорбентов сульфоэтилированные полиэтиленимины в зависимости от рН аммиачно-ацетатного буферного раствора могут использоваться для группового извлечения ряда ионов переходных металлов или совместной сорбции серебра(I), меди(II) и никеля(II). Показано, что химическое строение полимерной матрицы и степень ее модифицирования не влияют значительным образом на начальную скорость сорбции серебра(I) из растворов сложного состава.
ВВЕДЕНИЕ
Аминополимеры являются классом соединений, которые широко используются в качестве матрицы для синтеза сорбционных материалов. Наличие большого количества аминогрупп в их составе определяет возможность извлечения целевых компонентов как за счет ионообменного взаимодействия, так и за счет образования комплексных соединений. Наиболее существенным образом изменить селективные свойства аминополимеров позволяет их модифицирование дополнительными функциональными группами [1, 2]. Кроме того, еще одним важным инструментом варьирования селективных свойств таких материалов является сама природа аминополимерной матрицы, которая значительно влияет на сорбцию ионов металлов [2].
Важнейшим свойством любого сорбционного материала является скорость достижения равновесия сорбции. Когда сорбция протекает медленно, увеличивается время, необходимое для концентрирования. В том случае, когда скорость сорбции ионов металлов значительно различается, появляется дополнительная возможность для их разделения [3]. По этой причине особый интерес представляет исследование кинетики сорбции ионов металлов при их совместном присутствии в растворе.
Важную информацию о механизме и параметрах сорбционного процесса позволяет получить математическая обработка интегральных кинетических кривых сорбции моделями диффузионной и химической кинетики. Несмотря на то, что разделение вклада диффузионной и химической стадий с помощью формальных кинетических уравнений весьма затруднительно и не всегда корректно [4, 5], такой подход довольно распространен среди отечественных и зарубежных ученых [1, 6–11]. Это отчасти связано с тем обстоятельством, что сравнение параметров, полученных при обработке соответствующих зависимостей для различных сорбционных материалов, позволяет выявить влияние различных факторов на кинетику сорбции ионов металлов. При этом необходимо отметить, что несмотря на достаточное количество работ, в которых исследуются закономерности влияния размера частиц, температуры и других условий проведения сорбционного эксперимента [6, 8, 9] на скорость достижения равновесия сорбции, влияние степени модифицирования и природы полимерной матрицы сорбента на кинетику сорбции до сих пор остается малоизученным.
Ранее нами исследованы свойства ряда сорбентов на основе сульфоэтилированных аминополимеров – хитозана [12], полиаллиламина [13] и полиэтиленимина [14] с различными степенями модифицирования по отношению к ряду ионов переходных и щелочноземельных металлов, образующих устойчивые комплексные соединения с таурином, функциональные группы которого содержат рассматриваемые сорбенты. Установлено, что в зависимости от условий эксперимента, содержания сульфоэтильных групп и природы полимерной матрицы исследуемые материалы способны селективно извлекать серебро(I) [13] или серебро(I) и медь(II) [12, 14] из растворов сложного состава или выступать в качестве сорбентов для группового извлечения ряда ионов переходных металлов [14]. При этом наибольшая селективность сорбции серебра(I) обеспечивается при использовании аммиачно-ацетатного буферного раствора, применение которого, помимо этого, предотвращает образование малорастворимых форм ионов металлов за счет образования устойчивых аммиакатов и позволяет исследовать извлечение в широком диапазоне рН. Для определения перспектив использования сульфоэтилированных аминополимеров в процессах разделения и концентрирования необходимо исследование кинетики сорбции ионов металлов.
Цель настоящей работы – исследование кинетики сорбции ионов металлов (меди(II), никеля(II), кобальта(II), цинка(II), кадмия(II), кальция(II), магния(II), стронция(II), бария(II), серебра(I)) при их совместном присутствии в аммиачно-ацетатном буферном растворе сорбентами на основе аминополимеров в зависимости от степени их модифицирования (СМ) сульфоэтильными группами и природы матрицы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
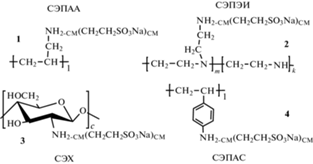
Объекты исследования. Сульфоэтилированные полиаллиламины со степенью модифицирования 0.5 и 1.0, сшитые эпихлоргидрином (СЭПАА 0.5 и СЭПАА 1.0 соответственно, схема 1 , структура 1), получали и идентифицировали по методикам, описанным в работах [13]. Синтез и идентификация сульфоэтилированных полиэтилениминов со степенью модифицирования 0.30, 0.58 и 0.74, сшитых диглицидиловым эфиром диэтиленгликоля (СЭПЭИ 0.30, СЭПЭИ 0.58 и СЭПЭИ 0.74 соответственно, схема 1 , структура 2), представлены в работах [14]. Сульфоэтилированные хитозаны со степенью модифицирования 0.3, 0.5, 0.7 и 1.0, сшитые глутаровым альдегидом (СЭХ 0.3, СЭХ 0.5, СЭХ 0.7 и СЭХ 1.0 соответственно, схема 1 , структура 3), получены и идентифицированы в соответствии с методиками, изложенными в [12].
Степень модифицирования (СМ) аминополимеров сульфоэтильными группами рассчитывали по формуле: СМ = nS/nN, где nS и nN – соответственно количество серы и азота по данным элементного анализа.
Схема 1 . Строение сорбционных материалов – производных таурина, где СМ – степень модифицирования аминогрупп полимера сульфоэтильными группами
Исследование кинетики сорбции ионов металлов сульфоэтилированными аминополимерами
Исходные растворы нитратов меди(II), никеля(II), кобальта(II), цинка(II), кадмия(II), кальция(II), магния(II), стронция(II), бария(II), серебра(I) с концентрацией 0.1 моль/л готовили из соответствующих нитратов ионов металлов квалификации “ч. д. а.” (АО “Вектон”). Растворы с меньшими концентрациями готовили последовательным разбавлением деионизованной водой аликвотных частей стандартного раствора.
Кинетику сорбции ионов серебра(I), меди(II), никеля(II), кобальта(II), цинка(II), кадмия(II), кальция(II), магния(II), стронция(II) и бария(II) сорбентами на основе сульфоэтилированных аминополимеров исследовали в статических условиях при постоянном перемешивании с использованием перемешивающего устройства Экрос 6410 М. С целью оценки возможности варьирования селективности сорбции ионов металлов из многокомпонентных растворов в зависимости от времени контакта фаз эксперимент проводили при совместном присутствии всех ионов металлов в растворе. Исходная концентрация ионов металлов в растворе составляла 1 × 10–4 моль/л. Значение рН поддерживали постоянным при помощи аммиачно-ацетатного буферного раствора. Кинетику сорбции ионов металлов СЭХ исследовали при рН 6.5, СЭПАА – рН 5.0, СЭПЭИ – рН 4.0 и 7.0. Исходные концентрации растворов уксусной кислоты и аммиака составляли 0.34 и 0.37 моль/л соответственно. Путем постепенного добавления по каплям раствора аммиака рН смеси доводили до конкретных значений. Кислотность растворов контролировали при помощи иономера И-160 МИ, оснащенного стеклянным комбинированным электродом ЭСК-10601/7. Деионизованную воду получали с помощью системы высокой очистки воды Millipore Milli-Q Academic. Объем исследуемого раствора составлял 50.0 мл, масса сорбента – 0.0200 г. По истечении определенного времени контакта сорбента и раствора фазы разделяли фильтрованием с использованием фильтра “синяя лента”. Содержание ионов металлов в растворах до и после сорбции определяли методом атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (iCAP 6500 “ThermoElectron”). По разности концентраций растворов до и после взаимодействия с сорбентом рассчитывали значения сорбции ионов металлов (a, ммоль/г) и строили кинетические кривые в координатах a = f(τ), где τ – время контакта фаз. Коэффициенты распределения ионов металлов (D) между раствором и сорбентом рассчитывали как отношение концентрации ионов металла в фазе сорбента к концентрации ионов в растворе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Кинетика сорбции ионов металлов сульфоэтилированными аминополимерами
Кинетика сорбции ионов металлов сорбентами на основе полиаллиламина с различными величинами СМ исследована при значении рН 5.0, соответствующем наибольшей селективности сорбции серебра(I) по сравнению с медью(II) [13]. В качестве примера на рис. 1 приведены зависимости, полученные для СЭПАА 0.5. Кинетические кривые сорбции ионов металлов СЭПАА 1.0 имеют аналогичный вид.
Рис. 1.
Интегральные кинетические кривые сорбции ионов металлов СЭПАА 0.5, при их совместном присутствии в аммиачно-ацетатном буферном растворе, рН 5.0. Исходная концентрация ионов металлов 1 × × 10–4 моль/л. 1 – Ag(I), 2–10 –Cu(II), Ba(II), Ca(II), Co(II), Cd(II), Ni(II), Mg(II), Sr(II), Zn(II).
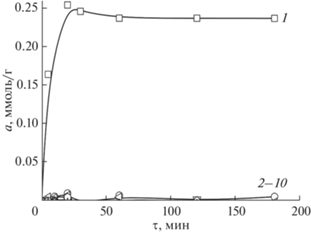
Установлено, что во всем исследуемом диапазоне времени контакта фаз СЭПАА избирательно извлекают ионы серебра(I). Остальные ионы металлов извлекаются СЭПАА в незначительной степени. Равновесие сорбции ионов серебра(I) устанавливается в течение 30 мин контакта фаз.
Для определения стадии, лимитирующей общую скорость процесса сорбции, была проведена математическая обработка полученных зависимостей моделями диффузионной и химической кинетики. На первом этапе при построении кинетических кривых в координатах ln(1 – F)–τ и aτ–τ1/2 (τ – время, F – степень достижения равновесия в системе, рассчитываемая как F = aτ/ae, где aτ – количество сорбированного вещества в момент времени τ, ммоль/г; ae – количество сорбированного вещества в состоянии равновесия, ммоль/г) установлено, что модели внешней и внутренней диффузии [15, 16] соответственно неудовлетворительно описывают экспериментальные данные для ионов серебра(I) при сорбции СЭПАА.
В качестве моделей химической кинетики для обработки соответствующих кривых сорбции серебра(I) СЭПАА нами использованы модели псевдопервого и псевдовторого порядка [17, 18] и Еловича [19, 20]. В результате математической обработки кинетических кривых сорбции серебра(I) СЭПАА с различными СМ определены следующие параметры: ae – количество сорбированного металла на единицу массы сорбента в состоянии равновесия, ммоль/г; k1 – константа скорости сорбции модели псевдопервого порядка, мин–1; k2 – константа скорости сорбции модели псевдовторого порядка г(ммоль мин)−1; α – начальная скорость сорбционного процесса, г(ммоль мин)–1; β – константа уравнения Еловича, соответствующая степени занятости поверхности сорбента и энергии активации хемосорбции, г ммоль–1, а также значения коэффициентов детерминации R2 (табл. 1).
Из определенных значений коэффициентов детерминации (табл. 1) следует, что сорбция серебра(I) СЭПАА наилучшим образом описывается моделью псевдопервого порядка. Следовательно, стадией, лимитирующей скорость, является взаимодействие серебра(I) с функциональными группами сорбента.
Таблица 1.
Параметры, полученные при математическом моделировании экспериментальных кривых сорбции ионов серебра(I) СЭПАА с разными СМ при pH 5.0 уравнениями химической кинетики
| Параметр | СЭПАА 0.5 | СЭПАА 1.0 |
|---|---|---|
| Модель псевдопервого порядка | ||
| k1 | 0.18 | 0.08 |
| ae | 0.23 | 0.24 |
| R2 | 0.932 | 0.907 |
| Модель псевдовторого порядка | ||
| k2 | 1.49 | 0.38 |
| ae | 0.25 | 0.28 |
| R2 | 0.921 | 0.857 |
| Модель Еловича | ||
| β | 45.9 | 18.5 |
| α | 15.5 | 0.07 |
| R2 | 0.885 | 0.792 |
Установлено, что константы скорости сорбции серебра(I) k1 с ростом СМ сорбента уменьшаются. Аналогичная закономерность характерна и для параметра k2 модели псевдовторого порядка, для которой также получены высокие коэффициенты детерминации. Значения сорбции серебра(I) СЭПАА в состоянии равновесия при этом возрастают.
Кинетика сорбции ионов металлов сульфоэтилированными хитозанами
Кинетика сорбции серебра(I) из растворов сложного состава СЭХ также исследована для материалов с различной СМ: 0.3, 0.5, 0.7 и 1.0 при рН 6.5. В качестве примера на рис. 2 приведены кинетические кривые сорбции ионов металлов сорбентом со средней степенью модифицирования – СЭХ 0.5. В отличие от СЭПАА, СЭХ из растворов сложного состава наряду с серебром(I) извлекает ионы меди(II). При этом с ростом СМ сорбента сорбция серебра(I) меняется незначительно, а меди(II) уменьшается. Это приводит к возрастанию селективности сорбции серебра(I) по сравнению с медью(II).
Рис. 2.
Интегральные кинетические кривые сорбции ионов металлов СЭХ 0.5 при их совместном присутствии в аммиачно-ацетатном буферном растворе, рН 6.5. Исходная концентрация ионов металлов 1 × 10–4 моль/л. 1 – Ag(I), 2 – Cu(II), 3–10 – Ni(II), Ba(II), Sr(II), Cd(II), Ca(II), Mg(II), Zn(II), Co(II).
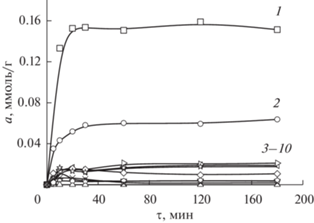
Установлено, что уже в первые 30 мин контакта фаз все исследуемые сорбенты в значительной степени извлекают ионы меди(II) и серебра(I). При этом в случае СЭХ 0.5 и СЭХ 0.7 дальнейшего увеличения сорбции при большем времени контакта фаз не наблюдается. В случае СЭХ 0.3 и СЭХ 1.0 сорбция меди(II) и серебра(I) после резкого возрастания в первые моменты контакта фаз медленно увеличивается и достигает максимального значения в течение суток. Это обстоятельство объясняется особенностями сшивки рассматриваемых сорбентов. С учетом того, что в водных растворах глутаровый альдегид присутствует в различных формах [21, 22], при его взаимодействии с СЭХ формируется специфический набор азотсодержащих функциональных групп.
С использованием параметров, полученных при обработке кинетических кривых (табл. 2), нами рассчитаны значения начальной скорости сорбции серебра(I) (v, ммоль/(мин г)) исследуемыми сорбентами в соответствии с выражением [23]:
Таблица 2.
Параметры, полученные при математическом моделировании экспериментальных кривых сорбции ионов серебра(I) и меди(II) СЭХ с разными СМ при pH 6.5 уравнениями химической кинетики
| Сорбент | Ион металла | |||||
|---|---|---|---|---|---|---|
| Ag(I) | Cu(II) | |||||
| Модель псевдопервого порядка | ||||||
| R2 | ae | k1 | R2 | ae | k1 | |
| СЭХ 0.3 | 0.896 | 0.10 | 0.11 | 0.889 | 0.09 | 0.04 |
| СЭХ 0.5 | 0.997 | 0.15 | 0.20 | 0.977 | 0.06 | 0.14 |
| СЭХ 0.7 | 0.997 | 0.16 | 0.11 | 0.973 | 0.06 | 0.12 |
| СЭХ 1.0 | 0.970 | 0.12 | 0.20 | 0.960 | 0.05 | 0.22 |
| Модель псевдовторого порядка | ||||||
| R2 | ae | k2 | R2 | ae | k2 | |
| СЭХ 0.3 | 0.949 | 0.10 | 1.79 | 0.953 | 0.09 | 0.66 |
| СЭХ 0.5 | 0.993 | 0.16 | 4.21 | 0.994 | 0.06 | 3.62 |
| СЭХ 0.7 | 0.999 | 0.16 | 2.45 | 0.987 | 0.06 | 4.09 |
| СЭХ 1.0 | 0.982 | 0.12 | 3.99 | 0.970 | 0.05 | 11.6 |
| Модель Еловича | ||||||
| R2 | Α | β | R2 | α | β | |
| СЭХ 0.3 | 0.989 | 4.9 | 116 | 0.982 | 0.045 | 79.3 |
| СЭХ 0.5 | 0.987 | 1.5 | 186 | 0.971 | 0.28 | 133 |
| СЭХ 0.7 | 0.998 | 1.5 | 172 | 0.977 | 10.8 | 228 |
| СЭХ 1.0 | 0.992 | 5.3 × 104 | 180 | 0.981 | 1.4 × 105 | 487 |
Значения начальной скорости сорбции серебра(I) сорбентами на основе сульфоэтилированных аминополимеров представлены в виде их зависимости от СМ на рис. 3. Начальные скорости сорбции серебра(I) сульфоэтилированными полиаминостиролами (СЭПАС, cхема 1, структура 4) рассчитаны на основании данных наших предыдущих работ, в том числе [24].
Рис. 3.
Зависимость начальной скорости сорбции серебра(I) от СМ сорбентов на основе сульфоэтилированных аминополимеров. 1 – СЭПАС, 2 – СЭПЭИ, рН 7.0; 3 – СЭХ, 4 – СЭПАА, 5 – СЭПЭИ, рН 4.0.
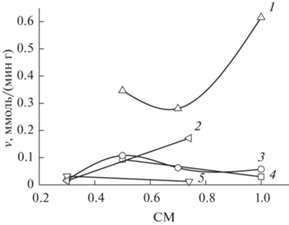
Для СЭХ 0.5 и СЭХ 0.7 определены наибольшие значения скорости сорбции серебра(I), что согласуется с меньшим временем установления равновесия по сравнению с СЭХ 0.3 и СЭХ 1.0. Однако в целом СЭХ и СЭПАА с различными СМ характеризуются близкими значениями начальной скорости сорбции серебра(I). Скорость сорбции меди(II) СЭХ с различными СМ лежит в интервале 3.2 × 10–4–5.5 × 10–4 ммоль/(мин г). Существенно более низкие значения данного параметра в случае меди(II) по сравнению с серебром(I) являются благоприятным фактором с точки зрения достижения высокой селективности сорбции последнего в динамических условиях, когда эффективность разделения ионов металлов во многом определяется кинетикой процесса.
Установлено, что в большинстве случаев кинетические кривые сорбции серебра(I) и меди(II) сорбентами СЭХ наилучшим образом описываются моделями псевдовторого порядка и Еловича. При этом последняя модель наилучшим образом описывает зависимости, полученные для СЭХ 0.3 и СЭХ 1.0, что, согласно данным [19, 20], свидетельствует о высокой энергетической неоднородности поверхности сорбентов.
Кинетика сорбции ионов металлов сульфоэтилированными полиэтилениминами
Ранее [14] нами установлено, что сорбенты на основе полиэтиленимина (СЭПЭИ), в отличие от других сульфоэтилированных аминополимеров, в зависимости от кислотности среды способны выступать как групповые сорбенты для извлечения ряда ионов переходных металлов, так и для селективного извлечения меди(II) и серебра(I). По этой причине кинетические кривые сорбции ионов металлов СЭПЭИ получены при соответствующих значениях рН.
Установлено, что при рН 4.0 во всем диапазоне времени контакта фаз сорбенты селективно извлекают ионы меди(II) и серебра(I). При этом с ростом СМ СЭПЭИ сорбция исследуемых ионов металлов уменьшается. Это связано с уменьшением основности аминогрупп в составе сорбента из-за возрастания содержания сульфоэтильных групп, обладающих отрицательным индуктивным эффектом. Как следствие, уменьшается и устойчивость комплексов, образуемых ионами металлов в фазе СЭПЭИ.
Таблица 3.
Значения коэффициентов распределения серебра(I) при сорбции их сорбентами на основе сульфоэтилированных аминополимеров (Vр-ра = 50.0 мл, g(сорбента) = 0.0200 г, Сисх = 1 × 10–4 моль/л)
| τ, мин | СЭПАА (pH 5.0 ) |
СЭХ (pH 6.5) |
СЭПЭИ (рН 7.0) |
СЭПЭИ (рН 4.0) |
СЭПАС* (pH 6.0 ) |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0.5 | 1.0 | 0.3 | 0.5 | 0.7 | 1.0 | 0.34 | 0.74 | 0.34 | 0.74 | 0.5 | 1.0 | |
| 5 | 1.6 | 0.6 | – | – | – | – | – | – | – | – | 3.33 | 3.93 |
| 10 | – | – | 0.39 | 1.32 | – | 0.59 | 0.5 | 2.6 | 2.4 | 0.3 | 3.35 | 3.93 |
| 20 | 24.3 | 15.1 | 0.41 | 1.99 | 2.23 | 0.70 | 1.0 | 2.8 | 4.2 | 0.9 | 3.35 | 4.24 |
| 30 | 13.1 | 31.6 | 0.43 | 1.91 | 2.51 | 0.62 | 1.7 | 3.7 | 3.1 | 0.3 | 4.69 | 4.24 |
| 60 | 8.6 | 4.6 | 0.48 | 2.19 | 2.83 | 0.71 | 3.0 | 4.2 | 2.6 | 0.3 | 4.69 | 4.24 |
| 120 | 4.2 | 8.3 | 0.52 | 2.59 | 3.32 | 0.72 | 4.2 | 4.3 | 2.4 | 0.6 | 6.02 | 6.99 |
| 180 | 8.5 | 5.7 | 0.55 | 1.83 | 3.54 | 0.69 | 4.2 | 4.1 | 1.4 | 0.3 | ||
| 240 | 0.54 | 3.21 | 0.69 | 4.6 | 3.6 | 1.9 | 0.3 | |||||
| 300 | 0.56 | 3.25 | 0.77 | 4.3 | 4.1 | 3.3 | 0.5 | |||||
| 360 | 0.58 | 0.80 | 4.4 | 7.9 | 1.6 | 0.6 | ||||||
| 420 | 0.65 | 0.78 | 5.0 | 4.3 | 2.0 | 0.5 | ||||||
| 480 | 0.66 | 0.87 | 5.2 | |||||||||
| 540 | 0.66 | 0.59 | 8.3 | |||||||||
| 600 | 0.72 | 0.69 | 5.1 | |||||||||
* Значения коэффициентов распределения для СЭПАС рассчитаны на основании данных [24].
Кинетические кривые сорбции ионов металлов СЭПЭИ с различными СМ при рН 7.0 приведены на рис. 4. Закономерно, что в условиях эксперимента, когда по сравнению с сорбцией из более кислых сред степень депротонирования функциональных аминогрупп СЭПЭИ выше, он выступает в качестве группового сорбента по отношению к ряду ионов металлов. Так, СЭПЭИ 0.34 при рН 7.0 совместно извлекает серебро(I), медь(II), никель(II), кобальт(II), кадмий(II) и цинк(II), СЭПЭИ 0.74 – серебро(I), медь(II) и никель(II), т.е. рост СМ СЭПЭИ при рН 7.0, так же как и при рН 4.0, приводит к возрастанию селективности сорбции отдельных ионов металлов.
Рис. 4.
Интегральные кинетические кривые сорбции ионов металлов СЭПЭИ с СМ 0.34 (а), СМ 0.74 (б) при их совместном присутствии в аммиачно-ацетатном буферном растворе, рН 7.0. Исходная концентрация ионов металлов 1 × × 10–4 моль/л, g(сорбента) = 0.0200 г, а: 1 – Ni(II), 2 – Cu(II), 3 – Ag(I), 4 – Cd(II), 5 – Co(II); 6 – Zn(II), 7–10 – Ca(II), Mg(II), Ba(II), Sr(II); б: 1 – Ag(I), 2 – Cu(II), 3 – Ni(II), 4 – Cd(II), 5 – Co(II); 6–10 – Zn(II), Ca(II), Mg(II), Ba(II), Sr(II).
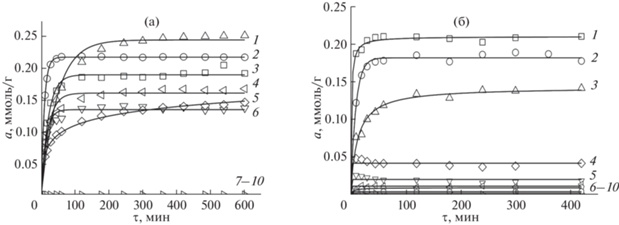
В обоих случаях (при рН 4.0 и 7.0) увеличение СМ СЭПЭИ приводит к уменьшению времени установления равновесия в исследуемых системах раствор солей металлов–СЭПЭИ. Так, при рН 4.0 время достижения равновесия с ростом СМ сорбента от 0.30 до 0.74 уменьшается от 120 до 40 мин. При рН 7.0 время достижения равновесия составляет 400 мин для СЭПЭИ 0.34 и 60 мин для СЭПЭИ 0.74.
По полученным данным рассчитаны значения коэффициентов распределения ионов серебра(I) (табл. 3).
С целью выявления стадии, лимитирующей общую скорость процесса, полученные интегральные кинетические кривые сорбции обработаны математически уравнениями диффузионной и химической кинетики. Как и в случае СЭПАА и СЭХ, в целом модели химической кинетики лучше описывают экспериментальные данные. Соответствующие коэффициенты корреляции приведены в табл. 4, 5. Значения параметров, полученных при обработке интегральных кинетических кривых сорбции ионов металлов СЭПЭИ, приведены в табл. 4 и 6.
Таблица 4.
Параметры, полученные при математическом моделировании экспериментальных кривых сорбции ионов металлов СЭПЭИ с разными СМ при pH 4.0 уравнениями химической кинетики
| Сорбент | Металл | |||||
|---|---|---|---|---|---|---|
| Ag(I) | Cu(II) | |||||
| Модель псевдопервого порядка | ||||||
| R2 | ae | k1 | R2 | ae | k1 | |
| СЭПЭИ 0.34 | 0.968 | 0.157 | 0.489 | 0.980 | 0.226 | 0.088 |
| СЭПЭИ 0.74 | 0.988 | 0.066 | 0.090 | 0.991 | 0.126 | 0.310 |
| Модель псевдовторого порядка | ||||||
| R2 | ae | k2 | R2 | ae | k2 | |
| СЭПЭИ 0.34 | 0.968 | 0.157 | 1.302 | 0.9998 | 0.237 | 0.717 |
| СЭПЭИ 0.74 | 0.972 | 0.069 | 2.647 | 0.995 | 0.128 | 10.65 |
| Модель Еловича | ||||||
| R2 | Α | β | R2 | α | β | |
| СЭПЭИ 0.34 | 0.962 | 2.84 | 710 | 0.987 | 18.3 | 53.4 |
| СЭПЭИ 0.74 | 0.930 | 16.2 | 203 | 0.996 | 2.53 | 440 |
Таблица 5.
Коэффициенты детерминации, полученные при математическом моделировании экспериментальных кривых сорбции ионов металлов СЭПЭИ с разными СМ при pH 7.0 уравнениями химической кинетики
| СМ | Модель | Ag(I) | Cu(II) | Ni(II) | Co(II) | Zn(II) | Cd(II) |
|---|---|---|---|---|---|---|---|
| 0.34 | Псевдопервого порядка | 0.988 | 0.9995 | 0.990 | 0.930 | 0.971 | 0.965 |
| Псевдовторого порядка | 0.980 | 0.990 | 0.999 | 0.984 | 0.993 | 0.998 | |
| Еловича | 0.920 | 0.959 | 0.972 | 0.997 | 0.961 | 0.978 | |
| 0.74 | Псевдопервого порядка | 0.994 | 0.993 | 0.944 | – | – | – |
| Псевдовторого порядка | 0.996 | 0.989 | 0.982 | – | – | – | |
| Еловича | 0.992 | 0.955 | 0.978 | – | – | – |
Таблица 6.
Параметры, полученные при математическом моделировании экспериментальных кривых сорбции ионов металлов СЭПЭИ с разными СМ при pH 7.0 уравнениями химической кинетики
| СМ | Модель | Параметр | Ag(I) | Cu(II) | Cd(II) | Ni(II) | Co(II) | Zn(II) |
|---|---|---|---|---|---|---|---|---|
| 0.34 | Псевдопервого порядка | ae, ммоль/г | 0.190 | 0.217 | 0.160 | 0.245 | 0.134 | 0.135 |
| k1, мин–1 | 0.049 | 0.113 | 0.049 | 0.021 | 0.034 | 0.074 | ||
| Псевдовторого порядка | ae, ммоль/г | 0.200 | 0.222 | 0.170 | 0.271 | 0.144 | 0.140 | |
| k2, г/(ммоль мин) | 0.380 | 1.25 | 0.467 | 0.103 | 0.345 | 0.951 | ||
| Еловича | α, г/(ммоль мин) | 0.210 | – | 0.208 | 0.0186 | 0.0365 | 3.67 | |
| β, г/ммоль | 41.5 | 100 | 49.8 | 20.0 | 46.9 | 84.2 | ||
| Ag(I) | Cu(II) | Ni(II) | ||||||
| 0.74 | Псевдопервого порядка | ae, ммоль/г | 0.207 | 0.182 | 0.133 | |||
| k1, мин–1 | 0.225 | 0.106 | 0.051 | |||||
| Псевдовторого порядка | ae, ммоль/г | 0.210 | 0.189 | 0.143 | ||||
| k2, г/(ммоль мин) | 3.89 | 1.18 | 0.581 | |||||
| Еловича | α, г/(ммоль мин) | 1.52 | 211 | 0.117 | ||||
| β, г/ммоль | 219 | 82.3 | 53.2 | |||||
Из данных рис. 3 видно, что СЭПЭИ характеризуется сопоставимыми с СЭХ и СЭПАА значениями начальной скорости сорбции. Интересно, что значения данной величины для ионов серебра(I) и меди(II) изменяются антибатно. Так, при рН 4.0 с ростом СМ СЭПЭИ скорость сорбции серебра(I) уменьшается, а меди(II) увеличивается от 0.04 до 0.17 ммоль/(мин г). При рН 7.0, наоборот, скорость сорбции серебра(I) СЭПЭИ возрастает, а меди(II) уменьшается от 0.06 до 0.04 ммоль/ (мин г). Это обстоятельство может объясняться как взаимным влиянием ионов металлов при их сорбции СЭПЭИ, так и разной конформацией полимерной цепи при различных значениях кислотности.
Подводя итог исследованию кинетики сорбции ионов металлов сорбентами – производными таурина, можно сделать ряд выводов. В случае сорбентов СЭХ, СЭПАА и СЭПЭИ химическое строение полимерной матрицы и величина степени модифицирования сульфоэтильными группами не оказывают существенного влияния на начальную скорость сорбции серебра(I). Несколько другие закономерности характерны для сорбентов на основе полиаминостирола–СЭПАС, свойства которых исследованы ранее [24]. Так, СЭПАС характеризуются существенно бόльшими значениями начальной скорости сорбции (рис. 3) и, как следствие, наименьшим временем установления равновесия сорбции. Это обстоятельство обусловлено особенностями надмолекулярного строения СЭПАС. При синтезе данного материала дополнительная сшивка полимера не проводилась, поскольку сетчатая структура полимера формировалась в процессе восстановления нитрополистирола вследствие образования иминогрупп [24]. Для получения же водонерастворимых сорбентов СЭХ, СЭПАА и СЭПЭИ использовали сшивающие агенты, что определяет более высокую степень сшивки этих материалов. Особенность сорбционного поведения СЭПАС демонстрирует, что основным фактором, влияющим на кинетические характеристики сорбентов, полученных полимераналогичными превращениями, является надмолекулярное строение. Его направленное формирование в процессе сшивки линейных полимеров путем подбора сшивающего реагента и условий сшивки позволяет задавать необходимые и требуемые эксплуатационные свойства конечного сорбционного материала.
ЗАКЛЮЧЕНИЕ
Получены кинетические кривые сорбции ряда ионов металлов из многокомпонентных растворов материалами с функциональными группами таурина в зависимости от степени их модифицирования сульфоэтильными группами и природы аминополимерной матрицы. Установлено, что материалы на основе полиаллиламина из растворов сложного состава селективно извлекают ионы серебра(I) во всем исследуемом диапазоне времени контакта фаз, на основе хитозана – ионы меди(II) и серебра(I). В зависимости от кислотности раствора материалы на основе сульфоэтилированного полиэтиленимина могут использоваться в качестве сорбентов для группового извлечения ряда ионов переходных металлов или для совместного извлечения меди(II) и серебра(I). Для исследованных систем раствор солей металлов–сорбент рассчитана начальная скорость сорбции ионов серебра(I) и меди(II) сульфоэтилированными аминополимерами. Установлено, что степень модифицирования и природа полимерной матрицы в случае СЭХ, СЭПЭИ и СЭПАА не влияют значительным образом на кинетические характеристики сорбции серебра(I). Максимальную скорость сорбции демонстрируют сорбенты на основе СЭПАС, что обусловлено особенностями их надмолекулярного строения. При этом и СЭПАС, и СЭПАА характеризуются высокой селективностью сорбции серебра(I). В целом все исследуемые материалы в значительной степени извлекают сорбируемые ионы металлов уже в первые минуты контакта фаз, что определяет перспективность их использования в процессах разделения и концентрирования.
Список литературы
Ghiorghita C., Borchert K., Vasiliu A. et al. // Colloids Surf., A: Physicochem. 2020. V. 607. P. 125504. https://doi.org/10.1016/j.colsurfa.2020.125504
Pestov A.V., Privar Yu.O., Mekhaev A.V. et al. // Eur. Polym. J. 2019. V. 115. P. 356. https://doi.org/10.1016/j.eurpolymj.2019.03.049
Неудачина Л.К., Петрова Ю.С., Засухин А.С. и др. // Аналитика и контроль. 2011. Т. 15. № 1. С. 88.
Хамизов Р.Х. // Журн. физ. химии. 2020. Т. 94. № 1. С. 125. https://doi.org/10.31857/S0044453720010148
Хамизов Р.Х., Свешникова Д.А., Кучерова А.Е. и др. // Журн. физ. химии. 2018. Т. 92. № 10. С. 1619. https://doi.org/10.1134/S004445
Маслова М.В., Иваненко В.И., Герасимова Л.Г. // Журн. физ. химии. 2019. Т. 93. № 7. С. 1002. https://doi.org/10.1134/S0044453719060219
Jalbani N.S., Solangi A.R., Memon S. et al. // J. Mol. Liq. 2021. № 339. P. 116741. https://doi.org/10.1016/j.molliq.2021.116741
Manobala T., Shukla S., Rao T.S. et al. // Chemosphere. 2021. № 269. P. 128722. https://doi.org/10.1016/j.chemosphere.2020.128722
Ярусова С.Б., Макаренко Н.В., Гордиенко П.С. и др. // Журн. физ. химии. 2018. Т. 92. № 3. С. 451. https://doi.org/10.7868/S0044453718030354
Dolganov A.V., Balandina A.V., Chugunov D.B. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 1770. https://doi.org/10.1134/S0036023620110030
Duca G., Zinicovscaia I., Grozdov D. // Russ. J. Gen. Chem. 2020. V. 90. P. 2546. https://doi.org/10.1134/S1070363220130034
Petrova Yu.S., Pestov A.V., Usoltseva M.K. et al. // J. Hazard. Mater. 2015. V. 299. P. 696. https://doi.org/10.1016/j.jhazmat.2015.08.001
Alifkhanova L.M.K., Lopunova K.Y., Pestov A.V. et al. // Sep. Sci. Technol. 2021. V. 56. № 8. P. 1303. https://doi.org/10.1080/01496395.2020.1781175
Kapitanova E.I., Zemlyakova E.O., Pestov A.V. et al. // Russ. Chem. Bull. 2019. V. 68. № 6. P. 1252. https://doi.org/10.1007/s11172-019-2549-5
Boyd G.E., Adamson A.W., Myers L.S. // J. Am. Chem. Soc. 1947. V. 69. № 11. P. 2836. https://doi.org/10.1021/ja01203a066
Sharma Sh., Rajesh N. // J. Environ. Chem. Eng. 2016. V. 4. P. 4287. https://doi.org/10.1016/j.jece.2016.09.028
Ho Y.S., McKay G. // Process Biochem. 1999. V. 34. № 5. P. 451. https://doi.org/10.1016/S0032-9592(98)00112-5
Lin T.L., Lien H.L. // Int. J. Mol. Sci. 2013. V. 14. P. 9834. https://doi.org/10.3390/ijms14059834
Elovich S.Y., Larinov O.G. // Izv. Acad. Nauk. SSSR. Otd. Khim. Nauk. 1962. V. 2. № 2. P. 209.
Han R., Zou W., Zhang Z. et al. // J. Hazard. Mater. 2006. V. 137. P. 384. https://doi.org/10.1016/j.jhazmat.2006.02.021
Перминов П.А., Кильдеева Н.Р., Тимофеева Л.М. и др. // Изв. высших учебных заведений. Сер. Химия и хим. технология. 2007. Т. 50. № 3. С. 53.
Kildeeva N.R., Perminov P.A., Vladimirov L.V. et al. // Russ. J. Bioorg. Chem. 2009. V. 35. № 3. P. 360.
Ozacar M. // Process Biochem. 2005. V. 40. № 2. P. 565. https://doi.org/10.1016/j.procbio.2004.01.032
Alifkhanova L.M.k., Merezhnikova O.I., Petrova Y.S. et al. // Russ. J. Appl. Chem. 2020. T. 93. № 9. P. 1392. https://doi.org/10.1134/S1070427220090128
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии