Журнал неорганической химии, 2022, T. 67, № 7, стр. 972-978
Замещение Cl– на OH– в фенантролиновом комплексе золота(III) и его редокс-взаимодействие с глутатионом в водном растворе
И. В. Миронов a, *, В. Ю. Харламова a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: imir@niic.nsc.ru
Поступила в редакцию 12.01.2022
После доработки 31.01.2022
Принята к публикации 04.02.2022
- EDN: CJAFAT
- DOI: 10.31857/S0044457X22070169
Аннотация
Фенантролиновые комплексы золота(III) широко исследуются в качестве противоопухолевых средств. На примере Au(phen)${\text{X}}_{2}^{ + }$ (X = Cl, OH) изучены два важнейших процесса, сопровождающих применение таких комплексов: равновесие замещения Cl– на OH– и редокс-взаимодействие с глутатионом (GSH) в водном растворе при t = 25°C и I = 0.2 M (NaCl). Равновесие Au(phen)${\text{Cl}}_{2}^{ + }$ + iOH– = Au(phen)Cl2 –i${\text{OH}}_{i}^{ + }$ + iCl– характеризуется lg βi = 8.39 (i = 1) и 15.41 (i = 2). Восстановление Au(phen)${\text{X}}_{2}^{ + }$ под действием GSH протекает быстро. Основными продуктами восстановления являются высокоустойчивые комплексы золота(I): полимерный (AuGSHi)m и Au(GSHi)2. При недостатке GSH основным конечным продуктом его окисления является сульфоновая кислота GSO3H, при избытке – дисульфид GSSG. Показано, что избыток phen на редокс-процесс не влияет, а взаимодействие ${\text{AuCl}}_{2}^{ - }$ с phen в водном растворе приводит к быстрому диспропорционированию с выделением золота(0).
ВВЕДЕНИЕ
Комплексы золота(III) с азотсодержащими лигандами в последнее время вызывают значительный интерес [1–4]. Это связано с результатами многочисленных исследований, показавших, что они проявляют противоопухолевые свойства и часто превосходят в этом отношении соединения платины(II) [5–8]. Характерным примером являются комплексы золота(III) с 1,10-фенантролином (phen) и его производными. Однако в физиологических условиях использование комплексов золота сопряжено со многими процессами, связанными как с обменом лигандов, так и с редокс-превращениями.
Цель настоящей работы – исследование наиболее важной части таких процессов, а именно: замещение Cl– на OH– в Au(phen)${\text{Cl}}_{2}^{ + },$ а также редокс-взаимодействие Au(phen)${\text{X}}_{2}^{ + }$ (X = Cl, OH) с глутатионом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали раствор HAuCl4 [9], хлористый натрий (ос. ч.), соляную кислоту (фиксанал), фосфатный буфер pH 6.86 (фиксанал), безводный сульфит натрия (ч. д. а.), L-глутатион восстановленный (АО “Вектон”, Россия, >98%), фенантролин (phen ⋅ H2O), раствор NaOH (“без CO2”), прокипяченную бидистиллированную воду. Концентрацию HAuCl4 устанавливали по УФ-поглощению раствора (ε = 5600 M–1 см–1 при 314 нм, среда 0.1 M HCl).
Все эксперименты проводили при 25°C (водяной термостат U7) и I = 0.20 M (NaCl), такая концентрация хлорид-ионов близка к составу физиологического раствора.
Измерения pH выполняли при помощи стеклянного комбинированного электрода ЭСК 10301/7, прибор Radelkis OP-208. Время установления потенциала составляло 5 мин. Электрод калибровали по растворам сильной кислоты (HCl в 0.2 M NaCl), т.е. измеряемые величины рН равны –lg[H+]. Необходимое для расчетов ионное произведение воды для 25°С и 0.2 M NaCl равно lgKw = = 13.76 [10]. Пересчет константы протонирования ${\text{HPO}}_{4}^{{2 - }}$ + H+ = ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - }$ по уравнению Дебая–Хюккеля с I = 0.05 (стандарт) к I = 0.2 M приводит к величине pH буферного раствора 6.70 вместо 6.86.
Спектры поглощения записывали на спектрофотометре “СФ-2000” (ОКБ “Спектр”) в диапазоне длин волн 250–350 нм, l = 0.05–0.5 см, раствор сравнения – вода.
Комплекс Au(phen)${\text{Cl}}_{2}^{ + }$ в растворе получали добавлением к раствору HAuCl4 (CAu = 8.41 × × 10–3 моль/л) щелочи NaOH (0.75 : 1) и фенантролина (1.05 : 1). Добавка щелочи нужна, чтобы избежать перехода основной части phen в Hphen+, что сильно замедлило бы дальнейшее замещение. Небольшой избыток phen (5%) применяли для того, чтобы в дальнейшем при замещении Cl– на OH– гарантированно сохранить phen во внутренней сфере. В ходе процесса замещения Cl– в ${\text{AuCl}}_{4}^{ - }$ на phen образуется промежуточный продукт – желтый осадок двойной соли Au(phen)Cl2 ⋅ ⋅ AuCl4. Поэтому раствор нагревали почти до кипения в течение ~1 ч до полного растворения осадка. Полученные таким образом растворы использовали в качестве исходных для дальнейших исследований. Комплекс Au(phen)${\text{(OH)}}_{2}^{ + }$ в растворе получали из Au(phen)${\text{Cl}}_{2}^{ + }$ добавлением щелочи несколькими небольшими порциями с интервалом 10–15 мин между ними. Конечное соотношение COH/CAu было равно 2. Добавление сразу большого количества щелочи (вследствие невысокой скорости замещения Cl– на OH–) приводило к уходу в сильнощелочную область и восстановлению золота(III).
Раствор, содержащий ${\text{AuCl}}_{2}^{ - }{\text{,}}$ готовили восстановлением ${\text{AuCl}}_{4}^{ - }$ сульфитом натрия: ${\text{AuCl}}_{4}^{ - }$ + + ${\text{SO}}_{3}^{{2 - }}$ + H2O = ${\text{AuCl}}_{2}^{ - }$ + ${\text{SO}}_{4}^{{2 - }}$ + 2 H+ + 2 Cl–, взятым с избытком 5–8%, в присутствии NaCl (0.2 M) и добавки NaOH (nNaOH/nAu = 3.00), чтобы избежать появления Au0 вследствие диспропорционирования ${\text{AuCl}}_{2}^{ - }.$ Раствор Na2SO3 (C = 0.2 М) готовили непосредственно перед экспериментом из безводного реактива.
Определение констант замещения из экспериментальной функции образования и разложение спектров проводили при помощи нелинейного и линейного метода наименьших квадратов (МНК).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
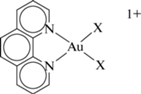
В работе рассмотрены комплексы золота(III) с 1,10-фенантролином Au(phen)${\text{X}}_{2}^{ + }$
где X = Cl–, OH–. Комплекс Au(phen)${\text{Cl}}_{2}^{ + }$ был получен и впервые исследован в растворе в работе [11]. Для X = OH– известен также биядерный комплекс ${\text{(Phen)Au}}\left\langle {_{{\text{O}}}^{{\text{O}}}} \right\rangle {\text{Au(Phen}}{{{\text{)}}}^{{{\text{2 + }}}}}$ и его аналог на основе 2,9-диметилфенантролина, который часто обозначают как “Au2phen” и тоже широко используют в испытаниях противоопухолевой активности [6, 7, 12, 13]. Превращение “Au2phen2+” + + 2H2O ↔ 2Au(phen)${\text{(OH)}}_{2}^{ + }$ при обычных условиях в водном растворе протекает медленно. Известно, например, что для аналогичного биядерного комплекса Au2(bipy)2-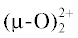 при 70°C и pH 7.4 требуется ~2 ч для количественного превращения в Au(bipy)${\text{(OH)}}_{2}^{ + }$ [14]. Тем не менее сам факт таких переходов свидетельствует о том, что устойчивыми формами
в водном растворе являются моноядерные комплексы. Комплексы с двумя молекулами phen
не образуются.
при 70°C и pH 7.4 требуется ~2 ч для количественного превращения в Au(bipy)${\text{(OH)}}_{2}^{ + }$ [14]. Тем не менее сам факт таких переходов свидетельствует о том, что устойчивыми формами
в водном растворе являются моноядерные комплексы. Комплексы с двумя молекулами phen
не образуются.
Замещение Cl– в Au(phen)${\text{Cl}}_{2}^{ + }$ на OH–
По данным [15], равновесие
(1)
${\text{AuCl}}_{4}^{ - } + {\text{phen}} \leftrightarrow {\text{Au(phen)Cl}}_{2}^{ + } + {\text{2C}}{{{\text{l}}}^{{\text{--}}}}$(2)
$\begin{gathered} {\text{Au}}\left( {{\text{phen}}} \right){\text{Cl}}_{2}^{ + } + {\text{O}}{{{\text{H}}}^{{\text{--}}}} \leftrightarrow {\text{Au}}\left( {{\text{phen}}} \right){\text{ClO}}{{{\text{H}}}^{{\text{ + }}}} + {\text{C}}{{{\text{l}}}^{{\text{--}}}}{\text{,}}{{{{\beta }}}_{{\text{1}}}} \\ {\text{Au}}\left( {{\text{phen}}} \right){\text{Cl}}_{2}^{ + } + {\text{2O}}{{{\text{H}}}^{{\text{--}}}} \leftrightarrow {\text{Au}}\left( {{\text{phen}}} \right)\left( {{\text{OH}}} \right)_{2}^{ + }{\text{ + 2C}}{{{\text{l}}}^{{\text{--}}}}{\text{, }}{{{{\beta }}}_{{\text{2}}}}{\text{.}} \\ \end{gathered} $По данным [16], полученным при помощи Cl–-селективного электрода и 1H ЯМР-спектроскопии, количественный спонтанный переход Au(phen)${\text{Cl}}_{2}^{ + }$ в Au(phen)${\text{(OH)}}_{2}^{ + }$ при pH 7.4 занимает менее 1.5 ч, причем основная часть превращения проходит за 15 мин.
Наше исследование равновесий (2) проводилось pH-метрически, поскольку спектры комплексов различаются очень мало (см. ниже). Процедура была аналогична использованной при изучении замещения Cl– на OH– в ${\text{AuCl}}_{4}^{ - }$ [17]. Раствор, содержащий Au(phen)${\text{Cl}}_{2}^{ + }{\text{,}}$ с исходным pH 3.00 и CNaCl = 0.2 моль/л титровали щелочью (NaOH). Интервалы времени между добавками порций щелочи составляли 10–15 мин, хотя потенциалы принимали стабильные значения уже через 5 мин. Из известных общих концентраций (CAu, $C_{{\text{H}}}^{0},$ COH) и измеренных величин pH рассчитывали значения функции образования:
(3)
$n{\text{* = }}{{{\text{(}}{{C}_{{{\text{OH}}}}}--C_{{\text{H}}}^{0} + {{a}_{{{\text{Hphen}}}}} \cdot C{\text{'}} + [{{{\text{H}}}^{{\text{ + }}}}]{\text{)}}} \mathord{\left/ {\vphantom {{{\text{(}}{{C}_{{{\text{OH}}}}}--C_{{\text{H}}}^{0} + {{a}_{{{\text{Hphen}}}}} \cdot C{\text{'}} + [{{{\text{H}}}^{{\text{ + }}}}]{\text{)}}} {{{C}_{{{\text{Au}}}}}}}} \right. \kern-0em} {{{C}_{{{\text{Au}}}}}}}{\text{,}}$(4)
$n{\text{*}} = {{({{\beta }_{1}}X + 2{{\beta }_{2}}{{X}^{2}})} \mathord{\left/ {\vphantom {{({{\beta }_{1}}X + 2{{\beta }_{2}}{{X}^{2}})} {(1 + {{\beta }_{1}}X + {{\beta }_{2}}{{X}^{2}})}}} \right. \kern-0em} {(1 + {{\beta }_{1}}X + {{\beta }_{2}}{{X}^{2}})}},$Рис. 1.
Функция образования – зависимость n* от lg[OH–]/[Cl–]. CAu (×10–3 М): 1 – 1.0; 2 – 2.0. Символы – эксперимент, пунктир – расчет.
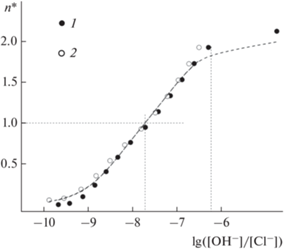
Функция образования n*(X) имеет обычный вид для случая двух неразделенных ступеней. “Расщепление” кривых для разных CAu не наблюдается, что свидетельствует в пользу отсутствия заметного вклада биядерных форм. Поскольку стандартный потенциал ${\text{AuCl}}_{4}^{ - }$ равен $E_{{{\text{3/0}}}}^{0}$ = 1.00 В, из величины lgβ2 следует, что для Au(phen)${\text{(OH)}}_{2}^{ + }$ стандартный потенциал равен $E_{{{\text{3/0}}}}^{0}$ = 0.51 В. Полученные константы замещения также позволяют оценить гидролитическую устойчивость – одну из основных характеристик комплексов, определяемых перед его использованием в биологических экспериментах. Как следует из наших данных, при pH 7.4 и CNaCl = 0.16 М основной формой фенантролиновых комплексов золота(III) является Au(phen)${\text{(OH)}}_{2}^{ + },$ а доля смешанного комплекса Au(phen)ClOH+ составляет ~6%. Возможными продуктами разложения Au(phen)${\text{(OH)}}_{2}^{ + }$ без изменения степени окисления могут быть только хлоридно-гидроксидные формы ${\text{Au(OH}}{{{\text{)}}}_{i}}{\text{Cl}}_{{{\text{4--}}i}}^{ - }{\text{.}}$ Как следует из констант замещения Cl– на OH– в ${\text{AuCl}}_{4}^{ - }$ [18], в данных условиях основной формой является ${\text{AuCl(OH)}}_{3}^{ - }$ (60%), доли ${\text{AuC}}{{{\text{l}}}_{{\text{2}}}}{\text{(OH)}}_{2}^{ - }$ и ${\text{Au(OH)}}_{4}^{ - }$ составляют около 30 и 10% соответственно. Равновесная концентрация Au(phen)${\text{(OH)}}_{2}^{ + }$ и общая концентрация хлоридно-гидроксидных форм $C_{{{\text{Au}}}}^{'}$ = ${{\Sigma }}\left[ {{\text{Au(OH}}{{{\text{)}}}_{i}}{\text{Cl}}_{{4 - i}}^{ - }} \right]$ связаны соотношением:
(5)
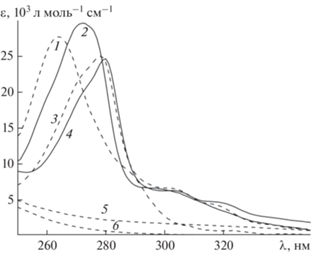
$\frac{{C_{{{\text{Au}}}}^{'}[{\text{phen}}]}}{{[{\text{Au(phen)(OH)}}_{2}^{ + }]}} = \frac{{F{{{[{\text{C}}{{{\text{l}}}^{ - }}]}}^{4}}}}{{{{{{\beta }}}_{{{\text{1Cl}}}}}{{{{\beta }}}_{{\text{2}}}}{{{{\text{[O}}{{{\text{H}}}^{ - }}{\text{]}}}}^{{\text{2}}}}}},$На рис. 2 приведены ЭСП комплексов и форм фенантролина. Спектры форм phen и комплексов заметно перекрываются. Кроме того, спектры всех трех комплексов Au(phen)${\text{Cl}}_{2}^{ + }{\text{,}}$ Au(phen)ClOH+ (не показан) и Au(phen)${\text{(OH)}}_{2}^{ + }$ различаются очень мало. Это же относится и к спектру “Au2phen” [6]. Таким образом, использование УФ-спектроскопии для изучения равновесий (2) было бы невозможно.
Редокс-взаимодействие Au(phen)${\text{X}}_{2}^{ + }$ с GSH
Второе исследование относится к редокс-процессу взаимодействия Au(phen)${\text{Cl}}_{2}^{ + }$ и Au(phen)${\text{(OH)}}_{2}^{ + }$ с глутатионом (GSH) –
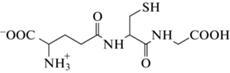
трипептидом, содержащим в своем составе тиольную группу, которая способна к координации и легко окисляется многими окислителями. В физиологических условиях концентрация GSH равна ~1 × 10–5 M в плазме и 1 × 10–3 M в клеточной жидкости, а допустимая концентрация золота составляет (1–10) × 10–6 M. Глутатион может образовывать несколько окисленных форм, основные из которых – это дисульфид GSSG, а также сульфеновая, сульфиновая и сульфоновая кислоты (GSOiH, где i = 1–3).Условную (для pH 7.0) константу равновесия редокс-взаимодействия Au(phen)${\text{(OH)}}_{2}^{ + }$ с GSH можно получить, принимая во внимание известные стандартные потенциалы и константы протонирования [9, 19]:
(6)
$\begin{gathered} {\text{Au}}\left( {{\text{phen}}} \right)\left( {{\text{OH}}} \right)_{2}^{ + }{\text{ + 3}}{{{\text{e}}}^{{\text{--}}}} = {\text{A}}{{{\text{u}}}^{{\text{0}}}} + {\text{phen + 2O}}{{{\text{H}}}^{{\text{--}}}}{\text{,}} \\ E_{{3/0}}^{0} = {\text{0}}{\text{.51}}\,{\text{В(}}E_{{3/0}}^{'} = {\text{0}}{\text{.79}}\,{\text{В),}} \\ {\text{Au}}\left( {{\text{GS}}} \right)_{2}^{{5 - }}{\text{ + }}{{{\text{e}}}^{{\text{--}}}} = {\text{A}}{{{\text{u}}}^{{\text{0}}}} + {\text{2G}}{{{\text{S}}}^{{{\text{3--}}}}}{\text{,}} \\ E_{{1/0}}^{0} = {\text{--0}}{\text{.32В(}}E_{{1/0}}^{'} = {\text{--0}}{\text{.11В),}} \\ {\text{GSSG* + 2}}{{{\text{e}}}^{{\text{--}}}} = {\text{2GS*,}}\,\,\,\,E_{{2/1}}^{'} = {\text{--0}}{\text{.22В,}} \\ {\text{G}}{{{\text{S}}}^{{{\text{3--}}}}} + i{{{\text{H}}}^{{\text{ + }}}} = {\text{GSH}}_{i}^{{i - 3}}{\text{,}} \\ {\text{lg}}{{K}_{{{\text{H1}}}}} = {\text{9}}{\text{.6, lg}}{{K}_{{{\text{H1}}}}}{{K}_{{{\text{H2}}}}} = {\text{18}}{\text{.3,}} \\ {\text{Au}}\left( {{\text{GS}}} \right)_{2}^{{5 - }}{\text{ + 2}}{{{\text{H}}}^{{\text{ + }}}} = {\text{Au}}\left( {{\text{GSH}}} \right)_{2}^{{3 - }}{\text{,}}\,\,\,\,{\text{lg}}{{K}_{{\text{1}}}}{{K}_{{\text{2}}}} \approx {\text{19,}} \\ \end{gathered} $(7)
$\begin{gathered} {\text{Au(phen)(OH)}}_{2}^{ + } + {\text{4GS*}} = \\ = \,\,{\text{Au(GS*}}{{{\text{)}}}_{{\text{2}}}} + {\text{GSSG*}} + {\text{phen}} \\ \end{gathered} $По данным [20], исследование кинетики редокс-взаимодействия ${\text{AuCl}}_{4}^{ - }$ с тиомалатом, цистеином и глутатионом не показало качественных отличий для всех трех тиолов. Общий процесс включает несколько стадий, из них первые две (замещение Cl– на RS* в ${\text{AuCl}}_{4}^{ - }$ и внутрисферное восстановление AuCl3RS* до золота(I)) протекают быстро (τ1/2 < 2 c) и обе имеют первый порядок по тиолу. При недостатке тиола (CRSH < 2CAu) на этом этапе он весь расходуется практически поровну на двухэлектронное восстановление золота(III) и образование высокоустойчивого полимерного тиолатного комплекса золота(I) $({\text{AuRS}})_{m}^{*}.$ В результате концентрация свободного RS* становится очень низкой, и дальнейшее намного более медленное восстановление остатка золота(III) происходит в основном за счет частично окисленных форм тиола (сульфеновой и сульфиновой кислот). Концентрация комплекса $({\text{AuRS}})_{m}^{*}$ при этом изменяется очень медленно, а в случае цистеина этот комплекс к тому же чрезвычайно малорастворим. Конечным продуктом окисления тиола является преимущественно сульфоновая кислота (RSO3H). При значительном избытке тиола процесс восстановления золота(III) протекает очень быстро и количественно. Образовавшаяся на первых стадиях сульфеновая кислота RSOH* быстро взаимодействует со свободным тиолом, давая дисульфид RS–SR*, который в этом случае и является основным продуктом окисления, а все золото(III) переходит в тиолатные формы комплексов золота(I).
Поскольку золото(III) является окислителем, а комплексы золота(I) с тиолами имеют очень высокую устойчивость, у нас не было оснований предполагать, что для других комплексов золота(III) характер взаимодействия будет принципиально другим.
Эксперименты с Au(phen)${\text{Cl}}_{2}^{ + }$ проводили при pH 2.00, CNaCl = 0.2 M и ~CAu = (1–10) × 10–4 M. К раствору, содержащему комплекс, добавляли требуемый объем раствора GSH и регистрировали спектры в диапазоне λ = 250–350 нм или кинетические кривые при λ = const. Экспериментальные спектры разлагали на вклады от спектров отдельных форм Au(phen)${\text{Cl}}_{2}^{ + }{\text{,}}$ (AuGS)*, Hphen+, которые известны (рис. 2):
(8)
$\begin{gathered} {{A(\lambda )} \mathord{\left/ {\vphantom {{A(\lambda )} l}} \right. \kern-0em} l} = {{\varepsilon }_{{{\text{Au}}}}}_{{{\text{(phen)C}}{{{\text{l}}}_{{\text{2}}}}}} \cdot [{\text{Au(phen)Cl}}_{2}^{ + }] + \\ + \,\,{{\varepsilon }_{{{\text{(AuGSH)}}}}} \cdot [{\text{AuGS}}*] + {{\varepsilon }_{{{\text{Hphen}}}}} \cdot [{\text{Hphe}}{{{\text{n}}}^{ + }}]. \\ \end{gathered} $Разложение проводили при помощи линейного МНК: Σ(A(λi)расч – A(λi)эксп)2 → min. Результатом разложения были концентрации форм. Рассчитанные спектры хорошо соответствовали экспериментальным, и стандартное отклонение аппроксимации нигде не превышало 0.01. Поскольку степень полимеризации m неизвестна, полимерный комплекс $({\text{AuGS}})_{m}^{*}$ обозначен просто как (AuGS)*, причем [AuGS*] = m$\left[ {({\text{AuGS}})_{m}^{*}} \right].$ Следует отметить, что условная константа равновесия
(9)
$\left( {{1 \mathord{\left/ {\vphantom {1 m}} \right. \kern-0em} m}} \right){{\left( {{\text{AuGS*}}} \right)}_{m}} + {\text{GS*}} = {\text{Au}}{{\left( {{\text{GS*}}} \right)}_{2}},\,\,K{\text{*}}~$Полученные результаты качественно не отличаются от описанных выше для ${\text{AuCl}}_{4}^{ - }{\text{.}}$ При избытке GSH процесс протекает быстро, и сразу после смешения спектр комплекса переходит в спектр Hphen+, который высвобождается при восстановлении золота(III) в золото(I). В частности, при CGSH/CAu = 2 уже через <1 мин после смешения спектр показывает практически полное восстановление Au(phen)${\text{Cl}}_{2}^{ + }$ в $({\text{AuGS}})_{m}^{*}$ (рис. 3а).
Рис. 3.
Изменение УФ-спектра раствора при редокс-взаимодействии Au(phen)${\text{X}}_{2}^{ + }$ с глутатионом во времени для CGSH/CAu = 2: 1 – через 15 с, 2 – 1 мин, 3 – 10 мин, 4 – исходный комплекс, 5 – phen (Hphen+). CAu = 9.97 × 10–4 M, CNaCl = 0.2 M, l = 0.05 см. а – X = Cl, pH 2.00; б – X = OH, pH 6.70.
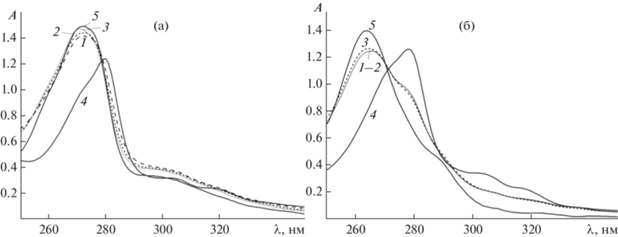
При снижении соотношения CGS/CAu процесс остается быстрым. При CGS/CAu = 0.6 через 20 с состав раствора становится близким к ожидаемому, т.е. [AuGS*] ≈ [phen] ≈ 1/2 CGSH. Однако через ~1 мин появляется желтый осадок. При этом содержание phen и золота(III) в растворе снижается более чем вдвое. Отметим, что это относится только к кислой области и, возможно, связано с диспропорционированием ${\text{AuCl}}_{2}^{ - }$ (см. ниже), присутствующим в растворе при низких соотношениях CGSH/CAu, когда тиола не хватает на связывание всего золота(I) в $({\text{AuGS}})_{m}^{*}.$
Эксперименты с Au(phen)${\text{(OH)}}_{2}^{ + }$ проводили аналогично. Раствор имел pH 6.70 (фосфатный буфер, Cбуф = 0.02 M) и CNaCl = 0.2 M. Несмотря на заметное замедление процесса принципиальных отличий не отмечено (рис. 3б). Для CGS/CAu < 2 УФ-спектр раствора, записанный в ходе протекания процесса, являлся суммой спектров (AuGS)*, Au(phen)${\text{(OH)}}_{2}^{ + }$ и phen, причем наблюдавшееся значение [(AuGS)*] было близким к ожидаемому (CGS/2) и далее изменялось медленно (рис. 4). Так, при CAu = 1.0 × 10–3 M и CGS/CAu = 0.6 через 20 с, 5 мин и 20 мин концентрация [AuGS*] составляла 3.1 × 10–4, 3.3 × 10–4 и 3.7 × 10–4 М соответственно. Выделения осадков не наблюдалось. При всех соотношениях CGS/CAu скорость на начальном этапе была высокой.
Рис. 4.
Изменение соотношения z = = ${{\left[ {{\text{Auphen(OH)}}_{2}^{ + }} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{Auphen(OH)}}_{2}^{ + }} \right]} {C_{{{\text{Au}}}}^{0}}}} \right. \kern-0em} {C_{{{\text{Au}}}}^{0}}}$ во времени в ходе реакции с глутатионом. ${{{{C}_{{{\text{GSH}}}}}} \mathord{\left/ {\vphantom {{{{C}_{{{\text{GSH}}}}}} {C_{{{\text{Au}}}}^{0}}}} \right. \kern-0em} {C_{{{\text{Au}}}}^{0}}}{\text{:}}$ 1 – 0.60, 2 – 1.0, 3 – 2.0. CAu = (9.09–9.90) × 10–4 M, pH 6.70, CNaCl = 0.2 M.
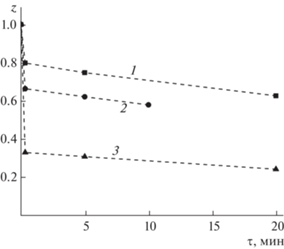
В то же время быстрое полное восстановление Au(phen)${\text{(OH)}}_{2}^{ + }$ до золота(I) происходило только при CGS/CAu > 4. До этих соотношений, несмотря на быстрый начальный процесс и, казалось бы, избыток тиола, в спектрах наблюдалось присутствие заметного, медленно изменяющегося количества Au(phen)${\text{(OH)}}_{2}^{ + }.$ Например, при CGS/CAu = 2 его доля от CAu составляла 30% через 20 с и 20% через 20 мин. На наш взгляд, есть две причины такого замедления. Во-первых, это быстрый процесс взаимодействия образовавшейся в результате окисления сульфеновой кислоты со свободным тиолом: GSOH + GSH = GSSG + H2O. Во-вторых, это образование бис-комплекса Au(GS*)2, влияние которого в нейтральной и щелочной области возрастает (см. выше). Оба этих фактора приводят к снижению концентрации свободного тиола и, следовательно, к замедлению процесса восстановления золота(III).
Дополнительно было установлено, что введение избыточного phen, по крайней мере до Cphen/CAu = 2, не влияет на скорости процессов.
Взаимодействие ${\text{AuCl}}_{2}^{ - }$ с phen
Исходный раствор, содержащий ${\text{AuCl}}_{2}^{ - },$ готовили восстановлением ${\text{AuCl}}_{4}^{ - }$ сульфитом натрия. К полученным растворам (CAu = 1 × 10–3 M, pH 3.0 и 7.0, CNaCl = 0.2 M) добавляли раствор phen до концентрации Cphen = (0.6–1) × 10–3 M. В растворе сразу появлялись розово-желтые хлопья, которые темнели и переходили в коричневые мелкие частицы. Для pH 7.0 спектр отфильтрованного раствора показал наличие в нем комплекса золота(III) Au(phen)${\text{(OH)}}_{2}^{ + }$ с концентрацией, приблизительно вдвое меньшей исходной CAu. На наш взгляд, основная причина наблюдаемого явления – диспропорционирование золота(I). Обычно процесс ${\text{3AuCl}}_{2}^{ - }$ ↔ 2Au0 + ${\text{AuCl}}_{4}^{ - }$ + 2Cl– с lgK = 7.5 эффективно тормозится введением NaCl при условии, что CAu < 10–2 M и pH ≥ 3. Однако введение phen приводит к образованию из ${\text{AuCl}}_{4}^{ - }$ намного более устойчивых Au(phen)${\text{Cl}}_{2}^{ + }$ или Au(phen)${\text{(OH)}}_{2}^{ + }{\text{,}}$ что сильно ускоряет диспропорционирование и ведет к выделению золота(0). Само же золото(I) не способно образовывать хелаты с phen, а устойчивость его комплексов с аминами типа Py–Au–Cl мала.
ЗАКЛЮЧЕНИЕ
Ступенчатое замещение Cl– на OH– в Au(phen)${\text{Cl}}_{2}^{ + }$ с образованием Au(phen)${\text{(OH)}}_{2}^{ + }$ протекает достаточно быстро – при pH 6.7 и [Cl–] = = 0.2 M требуется менее 1 ч. При таких же условиях замещение phen на OH– или Cl– в Au(phen)${\text{(OH)}}_{2}^{ + }$ не происходит.
Комплексы Au(phen)${\text{Cl}}_{2}^{ + }$ и Au(phen)${\text{(OH)}}_{2}^{ + }$ быстро восстанавливаются глутатионом. Как показывают полученные данные, значительных отличий от аналогичного процесса с участием ${\text{AuCl}}_{4}^{ - }$ нет. Основными продуктами восстановления являются тиолатные комплексы золота(I) $({\text{AuGS}})_{m}^{*}$ и Au(GS*)2 (в нейтральной и щелочной среде). Если GSH взят в недостатке, то наряду с $({\text{AuGS}})_{m}^{*}$ образуются и менее устойчивые комплексы золота(I), такие как ${\text{AuCl}}_{2}^{ - }$ и комплексы с окисленными формами глутатиона – остатками сульфиновой и сульфоновой кислот в качестве лигандов. В хлоридной среде эти комплексы устойчивы продолжительное время (обычно несколько часов), однако впоследствии могут диспропорционировать с выделением металлического золота. Если GSH взят в избытке, то золото(III) количественно переходит в тиолатные комплексы, а продуктом окисления GSH является его дисульфид. В биологических экспериментах глутатион присутствует в большом избытке, причем его концентрация в клетках близка к использованной в настоящей работе. Поэтому можно ожидать, что рассматриваемые комплексы золота(III) в течение непродолжительного времени перейдут в устойчивые тиолатные комплексы золота(I).
Список литературы
Radisavljevic´ S., Petrovic´ B. // Front. Chem. 2020. V. 8. P. 379. https://doi.org/10.3389/fchem.2020.00379
Alhoshani A., Sulaiman A.A.A., Sobeai H.M.A. et al. // Molecules. 2021. V. 26. P. 3973. https://doi.org/10.3390/molecules26133973
Ott I. // Coord. Chem. Rev. 2009. V. 253. P. 1670. https://doi.org/10.1016/j.ccr.2009.02.019
Gabbiani C., Casini A., Messori L. // Gold Bull. 2007. V. 40. P. 73. https://doi.org/10.1007/BF03215296
Casini A., Kelter G., Gabbiani C. et al. // J. Biol. Inorg. Chem. 2009. V. 14. P. 1139. https://doi.org/10.1007/s00775-009-0558-9
Cinellu M.A., Maiore L., Manassero M. et al. // ACS Med. Chem. Lett. 2010. V. 1. P. 336. https://doi.org/10.1021/ml100097f
Guidi F., Puglia M., Gabbiani C. et al. // Mol. BioSyst. 2012. V. 8. P. 985. https://doi.org/10.1039/c1mb05386h
Landini I., Lapucci A., Pratesi A. et al. // Oncotarget. 2017. V. 8. P. 96062. https://doi.org/10.18632/oncotarget.21708
Mironov I.V., Kharlamova V.Yu. // J. Solution Chem. 2020. V. 49. P. 583. https://doi.org/10.1007/s10953-020-00994-0
Harned H.S., Owen B.B. The Physical Chemistry of Electrolytic Solutions. N.Y.: Reinhold, 1950.
Block B.P., Bailar J.C. // J. Am. Chem. Soc. 1951. V. 73. P. 4722. https://doi.org/10.1021/ja01154a071
Gorini G., Magherini F., Fiaschi T. et al. // Biomedicines. 2021. V. 9. P. 871. https://doi.org/10.3390/biomedicines9080871
Massai L., Zoppi C., Cirri D. et al. // Front. Chem. 2020. V. 8. P. 581648. https://doi.org/10.3389/fchem.2020.581648
Casini A., Cinellu M.A., Minghetti G. et al. // J. Med. Chem. 2006. V. 49. P. 5524. https://doi.org/10.1021/jm060436a
Миронов И.В., Цвелодуб Л.Д. // Журн. неорган. химии. 2001. Т. 46. № 1. С. 154. [Mironov I.V., Tsvelodub L.D. // Russ. J. Inorg. Chem. 2001. V. 46. № 1. P. 143.]
Abbate F., Orioli P., Bruni B. et al. // Inorg. Chim. Acta. 2000. V. 311. P. 1. https://doi.org/10.1016/S0020-1693(00)00299-1
Миронов И.В., Харламова В.Ю. // Журн. неорган. химии. 2020. Т. 65. № 3. С. 391. [Mironov I.V., Kharlamova V.Yu. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 420. https://doi 10.1134/S0036023620030092]
Миронов И.В., Цвелодуб Л.Д. // Журн. неорган. химии. 2000. Т. 45. № 4. С. 706. [Mironov I.V., Tsvelodub L.D. // Russ. J. Inorg. Chem. 2000. V. 45. № 4. P. 633.]
Jocelyn P.C. // Eur. J. Biochem. 1967. V. 2. P. 327. https://doi.org/10.1111/j.1432-1033.1967.tb00142.x
Mironov I.V., Kharlamova V.Yu. // Inorg. Chim. Acta. 2021. V. 525. P. 120500. https://doi.org/10.1016/j.ica.2021.120500
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии