Журнал неорганической химии, 2022, T. 67, № 7, стр. 1007-1013
Гидротермальный синтез наноразмерного V2O5 с использованием щавелевой кислоты
Ф. Ю. Горобцов a, Т. Л. Симоненко a, Н. П. Симоненко a, Е. П. Симоненко a, В. Г. Севастьянов a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
Поступила в редакцию 30.12.2021
После доработки 28.02.2022
Принята к публикации 28.02.2022
- EDN: COWDST
- DOI: 10.31857/S0044457X22070108
Аннотация
Изучен процесс синтеза V2O5 гидротермальным методом с использованием ванадата аммония и щавелевой кислоты в качестве реагентов. В результате гидротермальной обработки раствора при 200°С (6 ч) образуется темно-синий осадок диоксида ванадия, содержащий в качестве основной моноклинную фазу (B). При дальнейшей термообработке при 350°С в течение 2 ч диоксид ванадия окисляется до пентаоксида. Образовавшиеся частицы V2O5 представляют собой наностержни диаметром 10–20 нм и длиной 1–1.2 мкм. Полученный порошок использован для формирования соответствующего покрытия на поверхности алюминиевой подложки. Распределение локальных электрофизических свойств по поверхности слоя частиц V2O5 изучено с применением Кельвин-зондовой сканирующей микроскопии и сканирующей емкостной микроскопии.
ВВЕДЕНИЕ
Ванадий является распространенным переходным металлом с характерными степенями окисления +2, +3, +4 и +5, в которых он образует оксиды VO, V2O3, VO2 и V2O5 соответственно. В настоящее время последние два из перечисленных оксидов вызывают повышенный интерес с точки зрения практического применения. Диоксид ванадия, обладающий множеством кристаллических модификаций [1], при температуре ~68°С обратимо переходит между двумя основными – моноклинной (M, искаженный рутил, пр. гр. P21/c) и тетрагональной (R, рутил, пр. гр. P42/mmm). Этот фазовый переход сопровождается резким изменением физических свойств оксида: в то время как VO2(M) является полупроводником, VO2(R) обладает металлической проводимостью и высоким поглощением в ближнем ИК-диапазоне [2]. Благодаря данному переходу диоксид ванадия является очень перспективным термохромным материалом [3–5], т.е. материалом, способным изменять свои оптические свойства при нагреве, и рассматривается в качестве функционального компонента “умных” окон, устройств памяти [6, 7] и т.д. Кроме того, VO2 может применяться в качестве электрического переключателя [8, 9] и рецепторного материала в газовых сенсорах различного типа [10–12]. В то же время VO2 можно рассматривать и как прекурсор V2O5, поскольку первый легко окисляется при нагреве на воздухе [13, 14]. Пентаоксид ванадия проявляет меньший полиморфизм, чем VO2, и в основном находится в орторомбической модификации (пр. гр. Pmmn). При этом он имеет слоистую структуру: каждый слой состоит из тетрагональных пирамид, где каждый атом кислорода связан с двумя или тремя атомами ванадия, а между слоями присутствует слабое взаимодействие между кислородом в вершине одной пирамиды и ванадием из центра пирамиды в другом слое [15]. За счет слоистой структуры и свойств восстановителя в окислительно-восстановительных реакциях V2O5 является перспективным катодным материалом для литий-ионных аккумуляторов [15, 16]. Благодаря этим же свойствам оксид ванадия(V) активно изучается и как катодный материал для аккумуляторов на основе поливалентных катионов, таких как Mg2+ [17–20], Zn2+ [21], Al3+ [22], а также как компонент суперконденсаторов [23, 24]. Кроме того, V2O5 благодаря комбинации оптических и электрохимических свойств привлекает большое внимание исследователей как электрохромный материал: под воздействием электрического напряжения происходит восстановление высшего оксида, и он постепенно изменяет цвет от бледно-желтого или бледно-оранжевого до темно-синего, проходя при этом через интенсивный зеленый цвет [25, 26]. Более того, пентаоксид ванадия является уникальным электрохромным материалом из-за способности изменять оптические свойства в видимом диапазоне как на катоде, так и на аноде [26–28]. Это позволяет рассматривать V2O5 как перспективный компонент “умных” окон, электрохромных дисплеев и т.д. Помимо того, что каждое отдельное из названных применений оксида ванадия(V) является важным с точки зрения развития альтернативной энергетики, энергосбережения и, как следствие, экологии, существуют публикации, в которых рассматриваются устройства с материалами на основе V2O5, сочетающие вместе электрохромные и энергетические функции [29]. Пентаоксид ванадия применяется также в газовой сенсорике: датчики на его основе демонстрируют высокие отклики и селективность при детектировании органических соединений [30, 31], а также H2 и NO2 [31, 32].
Таким образом, диоксид и пентаоксид ванадия в наноразмерном состоянии на сегодняшний день являются востребованными материалами, а вопросы их синтеза крайне актуальны. Существует подход, основанный на термолизе гликолятов ванадия (как правило, этиленгликолята) [33, 34] и в целом комплексов ванадия, когда в зависимости от атмосферы, в которой протекает термическая деструкция, образуется тот или иной оксид ванадия: V2O3, VO2 или V2O5. Одним из недостатков данной технологии является ограниченная возможность влияния на морфологию и кристаллическое строение продукта, что особенно важно для VO2. Гораздо более удобным с этой точки зрения методом является гидротермальный синтез, который за счет варьирования целого спектра параметров (температура и длительность термообработки, скорость нагрева и охлаждения, тип растворителя, значение pH среды, степень заполнения автоклава и т.д.) позволяет формировать наноразмерные оксиды разной морфологии и кристаллической структуры [3, 35–38]. Для оценки функциональных характеристик оксидных наноматериалов зачастую требуется определение таких параметров (в том числе локальных), как значение работы выхода электрона, которое дает сведения об электрофизических характеристиках и наличии дефектов в материале. При этом сканирующая зондовая микроскопия с использованием методики Кельвин-зондовой сканирующей микроскопии позволяет совместить изучение локальных микроструктурных и электрофизических свойств исследуемого материала [39–41]. Таким образом, целью данной работы являлось изучение процесса гидротермального синтеза анизотропных наноструктур V2O5 с использованием щавелевой кислоты, а также определение микроструктурных и локальных электрофизических характеристик покрытия, полученного с применением синтезированного оксида ванадия(V).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза оксида ванадия в 40 мл дистиллированной воды при перемешивании растворяли 1.811 г метаванадата аммония и 2.601 г щавелевой кислоты. В результате был получен оранжевый раствор, который быстро менял цвет на желто-зеленый и затем на темно-зеленый. Далее из полученного раствора отбирали 10 мл и переносили в стальной автоклав с тефлоновым вкладышем (объем 25 мл), после чего реакционную систему нагревали в муфельной печи до 200°C со скоростью 5 град./мин и выдерживали при указанной температуре в течение 6 ч. После завершения термообработки происходило естественное охлаждение с печью до 25°С. Полученный в результате темно-синий осадок отделяли от маточного раствора и промывали (2 раза дистиллированной водой и 1 раз этиловым спиртом) путем ступенчатого центрифугирования с последующей сушкой при 60°С в течение 6 ч. Далее, опираясь на результаты рентгенофазового анализа, с целью формирования однофазного оксида V2O5 порошок подвергали термообработке при 350°С на протяжении 2 ч.
После сушки порошка его термическое поведение изучали с помощью синхронного термоанализатора SDT Q600 (TA Instruments) в диапазоне температур 25–600°С в токе воздуха 250 мл/мин (скорость нагрева 10 град/мин, навеска 12.4520 мг, микротигель из Al2O3).
ИК-спектры пропускания порошка после сушки и дополнительной термообработки в диапазоне волновых чисел 350–4000 см–1 записывали с использованием ИК-фурье-спектрометра ИнфраЛЮМ ФТ-08 (время накопления сигнала составляло 15 с, разрешение – 1 см–1). Для этого готовили суспензии в вазелиновом масле, которые помещали в виде пленки между стеклами KBr.
Рентгенофазовый анализ (РФА) порошка после сушки и дополнительной термообработки проводили с использованием дифрактометра Bruker D8 Advance (CuKα = 1.5418 Å, Ni-фильтр, E = 40 кэВ, I = 40 мА, время накопления сигнала в точке 0.3 с, шаг 0.02°, диапазон углов 5°–80°).
Морфологию полученного после термообработки при 350°С порошка оксида ванадия(V) исследовали с помощью просвечивающей электронной микроскопии (ПЭМ, просвечивающий электронный микроскоп JEOL JEM-1011 с цифровой фотокамерой ORIUS SC1000W).
Локальные электрофизические характеристики полученного порошка V2O5 изучали с помощью атомно-силовой микроскопии (АСМ). Для этого порошок диспергировали в дистиллированной воде, после чего каплю образовавшейся дисперсии наносили на алюминиевую подложку и подвергали сушке при 60°С в течение 2 ч. Нанесенный таким образом слой оксидного порошка изучали с помощью сканирующего зондового микроскопа Solver PRO-M (NT-MDT) с использованием зондов с проводящим покрытием HA-HR/W2C+ серии ETALON (резонансная частота ~223 кГц, радиус скругления <35 нм). Измерения проводили в полуконтактном режиме, в котором также было осуществлено сканирование в режимах сканирующей емкостной микроскопии (СЕМ) и Кельвин-зондовой силовой микроскопии (КЗСМ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе было исследовано термическое поведение полученного после сушки при 60°С порошка в токе воздухе до 600°С (рис. 1а). Как видно из термограмм, в интервале температур 25–380°С имеет место двухступенчатая потеря массы: первая ступень (25–200°С, Δm = 5.5%) сопровождается эндотермическим эффектом с минимумом около 80°С и может быть связана с удалением остаточного растворителя и сорбированных атмосферных газов, а для второй ступени (Δm = 3.25%) наблюдается совмещение слабого эндотермического эффекта в области 200–320°С и экзотермического эффекта с максимумом при 373.3°С, что может относиться к превращению имеющихся в продукте моноклинных фаз VO2 в структуру рутила VO2(R) [3] и окислению остаточного углерода. При дальнейшем повышении температуры происходит увеличение массы образца (Δm = 0.5%, рост массы практически полностью завершается при 500°С), сопровождаемое экзотермическим эффектом с максимумом около 417°С, который может быть связан с окислением диоксида до пентаоксида ванадия [13].
Рис. 1.
Результаты ТГА/ДСК анализа оксидного порошка после сушки при 60°С (а) и рентгенограммы полученного порошка после сушки и дополнительной термообработки (б).
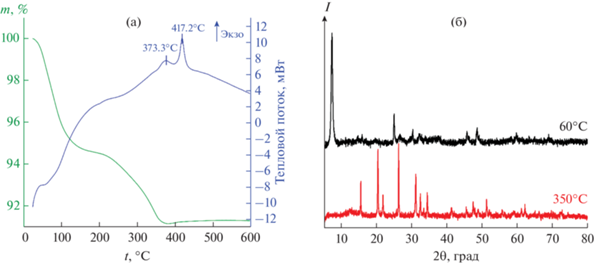
Кристаллическая структура оксидных порошков, полученных в результате сушки и дополнительной термообработки при 350°С, была изучена с помощью РФА. При сравнении полученных результатов (рис. 1б) с литературными данными [42] и рентгеновскими карточками JCPDS № 81-2392 и 31-1438 установлено, что в ходе гидротермального синтеза и последующей сушки при 60°С в качестве основной фазы образуется диоксид ванадия в моноклинной (B) модификации. Помимо характерного для VO2(B) рефлекса около 33° наблюдаются два рефлекса при 32° и 33.8°, набор малоинтенсивных рефлексов в диапазоне 35°–38.5° и отражение около 26.7°. Авторы [3] в аналогичных условиях получили похожие результаты и утверждали, что была сформирована смесь VO2(B) и VO2(D). Однако при рассмотрении другой литературы [43, 44] с учетом рентгеновской карточки JCPDS 15-0755 видно, что к фазе VO2(D) можно отнести только рефлексы в интервале 36°–37°. Из этого можно сделать вывод о присутствии в порошке небольшого количества кристаллической примеси, которую нельзя достоверно отнести ни к одной из указанных модификаций VO2. Дальнейшая термообработка данного порошка при 350°С на протяжении 2 ч, согласно данным РФА, привела к окислению диоксида с образованием однофазного орторомбического V2O5 (JCPDS 60-0767).
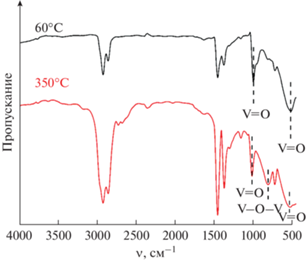
Из приведенного ИК-спектра (рис. 2) также видно, что продукт синтеза после сушки представляет собой диоксид ванадия. Так, не наблюдается интенсивных характеристических полос колебаний O–H и N–H в интервале 3700–3000 см–1, которые могли бы говорить о присутствии гидратированных оксалатов ванадия или комплексов NH4[VO(C2O4)2] и (NH4)2[(VO)2(C2O4)3] [45, 46], но присутствуют полосы поглощения с максимумами при 1000 и 522 см–1, характеризующие колебания связей V=O [47]. В спектре порошка после дополнительной термообработки при 350°С появляется интенсивная полоса с максимумом при 812 см–1, относящаяся к колебаниям мостиковых связей V–O–V в оксиде ванадия(V) [47]. Таким образом, результаты ИК-спектроскопии подтверждают данные РФА, свидетельствующие о том, что продукт гидротермального синтеза представляет собой диоксид ванадия, который после дальнейшей термообработки окисляется до V2O5.
Рис. 2.
ИК-спектры пропускания полученного оксидного порошка после сушки и дополнительной термообработки.
Микроструктура полученного таким образом порошка V2O5 далее была изучена с помощью ПЭМ (рис. 3). Из микрофотографий видно, что порошок представляет собой смесь из агломератов неправильной формы и вытянутых агломератов длиной до 1.2 мкм и шириной ~100 нм, расположенных под углом ~60° друг к другу. Многие из частиц достаточно плотные, однако из полученных данных видно, что они состоят из отдельных нановолокон, самоорганизованных в ходе гидротермального синтеза. Так, наблюдаются отдельные нановолокна, объединенные вдоль своей оси в “пучки”. Длина данных нановолокон составляет около 1–1.1 мкм, в то время как ширина колеблется в диапазоне 10–20 нм. В экспериментах авторов [3], проводившихся в аналогичных условиях, но без дополнительной термообработки порошка с целью его окисления, были получены частицы сравнимого размера (достигающие 700 нм и собирающиеся в микроструктуры размером до 5 мкм) без следов нановолокон или нанолент. Таким образом, предложенный нами подход позволяет формировать анизотропные иерархически организованные одномерные нанострук-туры V2O5.
Рис. 3.
Микрофотографии полученного в результате дополнительной термообработки порошка V2O5 (по данным ПЭМ).

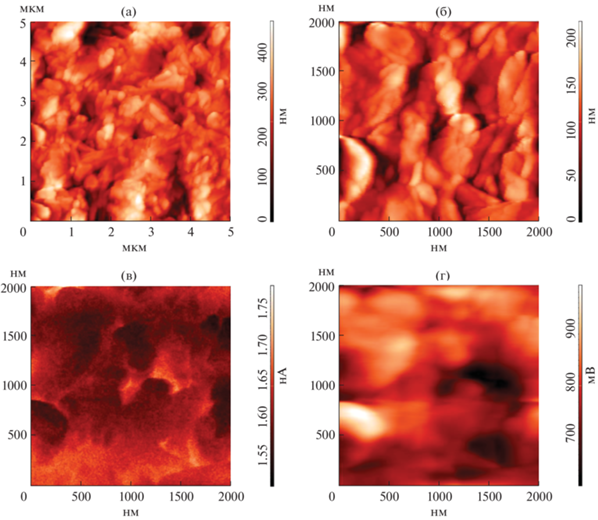
Микроструктуру полученного порошка пентаоксида ванадия, слой которого был нанесен на алюминиевую подложку, изучали также с использованием комплекса методик сканирующей зондовой микроскопии. Для этого проводили сканирование поверхности материала в режимах полуконтактной АСМ, СЕМ и КЗСМ (рис. 4). Из топографических изображений видно, что покрытие образовано вытянутыми частицами шириной от 35 до 200 нм с большим разбросом по длине – от 80 до 460 нм (среднее значение длины 223 ± 22 нм). Согласно карте емкостного контраста, полученной в результате СЕМ (рис. 4в), наблюдается довольно равномерное распределение носителей заряда и дефектов по поверхности частиц. Поверхностный потенциал, как можно судить из результатов КЗСМ (рис. 4г), также распределен достаточно равномерно между частицами, что говорит о хорошем контакте между ними и косвенно свидетельствует о повышенной проводимости. О сравнительно высокой проводимости может говорить и полученное на основе данных КЗСМ значение работы выхода электрона с поверхности материала, составившее 4.017 эВ, что значительно меньше значений 4.7–5.3 эВ, приведенных в литературе для V2O5 на воздухе [38, 48–50]. При этом на локальные электрофизические свойства исследуемого материала может оказывать влияние и тип используемой подложки. Полученные результаты свидетельствуют о возможности применения сформированного описанным методом нанопорошка V2O5 с иерархической организацией одномерных частиц при создании электрохромных материалов планарного типа.
ЗАКЛЮЧЕНИЕ
Изучен процесс синтеза наноразмерного V2O5 гидротермальным методом с применением щавелевой кислоты. Установлено, что в результате синтеза при выбранных условиях (200°С, 6 ч) образуется диоксид ванадия, содержащий в качестве основной моноклинную фазу (B), который в ходе дополнительной термообработки на воздухе при 350°С окисляется до пентаоксида ванадия. При этом формируются анизотропные иерархически организованные одномерные оксидные наноструктуры, представляющие собой нановолокна длиной порядка 1–1.2 мкм и шириной около 10–20 нм. Микроструктура и распределение локальных электрофизических свойств по поверхности слоя частиц V2O5 изучены с применением Кельвин-зондовой сканирующей микроскопии и сканирующей емкостной микроскопии. Построенная карта распределения емкостного контраста свидетельствует о равномерном распределении носителей заряда и дефектов по поверхности частиц. Поверхностный потенциал также распределен достаточно равномерно между частицами, что говорит о хорошем контакте между ними и косвенно свидетельствует о повышенной проводимости. Полученные результаты свидетельствуют о возможности применения сформированного описанным методом нанопорошка V2O5 с иерархической организацией одномерных частиц при создании электрохромных материалов планарного типа.
Список литературы
Devthade V., Lee S. // J. Appl. Phys. 2020. V. 128. № 23. P. 231101. https://doi.org/10.1063/5.0027690
Goodenough J.B. // Annu. Rev. Mater. Sci. 1971. V. 1. № 1. P. 101. https://doi.org/10.1146/annurev.ms.01.080171.000533
Song Z., Zhang L., Xia F. et al. // Inorg. Chem. Front. 2016. V. 3. № 8. P. 1035. https://doi.org/10.1039/c6qi00102e
Li M., Wu X., Li L. et al. // J. Mater. Chem. A. 2014. V. 2. № 13. P. 4520. https://doi.org/10.1039/c3ta14822j
Zhong L., Li M., Wang H. et al. // CrystEngComm. 2015. V. 17. № 30. P. 5614. https://doi.org/10.1039/c5ce00873e
Coy H., Cabrera R., Sepúlveda N. et al. // J. Appl. Phys. 2010. V. 108. № 11. https://doi.org/10.1063/1.3518508
Pellegrino L., Manca N., Kanki T. et al. // Adv. Mater. 2012. V. 24. № 21. P. 2929. https://doi.org/10.1002/adma.201104669
Ko C., Ramanathan S. // Appl. Phys. Lett. 2008. V. 93. № 25. P. 130. https://doi.org/10.1063/1.3050464
Crunteanu A., Givernaud J., Leroy J. et al. // Sci. Technol. Adv. Mater. 2010. V. 11. № 6. https://doi.org/10.1088/1468-6996/11/6/065002
Simo A., Mwakikunga B., Sone B.T. et al. // Int. J. Hydrogen Energy. 2014. V. 39. № 15. P. 8147. https://doi.org/10.1016/j.ijhydene.2014.03.037
Strelcov E., Lilach Y., Kolmakov A. // Nano Lett. 2009. V. 9. № 6. P. 2322. https://doi.org/10.1021/nl900676n
Byon J.W., Kim M.-B., Kim M.H. et al. // J. Phys. Chem. C. 2012. V. 116. № 1. P. 226. https://doi.org/10.1021/jp2080989
Ureña-Begara F., Crunteanu A., Raskin J.P. // Appl. Surf. Sci. 2017. V. 403. P. 717. https://doi.org/10.1016/j.apsusc.2017.01.160
Pan A., Wu H. Bin, Yu L. et al. // Angew. Chem. 2013. V. 125. № 8. P. 2282. https://doi.org/10.1002/ange.201209535
Yue Y., Liang H. // Adv. Energy Mater. 2017. V. 7. № 17. P. 1602545. https://doi.org/10.1002/aenm.201602545
Liu X., Zeng J., Yang H. et al. // RSC Adv. 2018. V. 8. № 8. P. 4014. https://doi.org/10.1039/c7ra12523b
Gershinsky G., Yoo H.D., Gofer Y. et al. // Langmuir. 2013. V. 29. № 34. P. 10964. https://doi.org/10.1021/la402391f
Mukherjee A., Sa N., Phillips P.J. et al. // Chem. Mater. 2017. V. 29. № 5. P. 2218. https://doi.org/10.1021/acs.chemmater.6b05089
Clites M. // Adv. Mater. Lett. 2017. V. 8. № 6. P. 679. https://doi.org/10.5185/amlett.2017.1536
Le D.B., Passerini S., Coustier F. et al. // Chem. Mater. 1998. V. 10. № 3. P. 682. https://doi.org/10.1021/cm9705101
Zhang N., Dong Y., Jia M. et al. // ACS Energy Lett. 2018. V. 3. № 6. P. 1366. https://doi.org/10.1021/acsenergylett.8b00565
Gu S., Wang H., Wu C. et al. // Energy Storage Mater. 2017. V. 6. P. 9. https://doi.org/10.1016/j.ensm.2016.09.001
Foo C.Y., Sumboja A., Tan D.J.H. et al. // Adv. Energy Mater. 2014. V. 4. № 12. P. 1. https://doi.org/10.1002/aenm.201400236
Saravanakumar B., Purushothaman K.K., Muralidharan G. // ACS Appl. Mater. Interfaces. 2012. V. 4. № 9. P. 4484. https://doi.org/10.1021/am301162p
Scherer M.R.J., Li L., Cunha P.M.S. et al. // Adv. Mater. 2012. V. 24. № 9. P. 1217. https://doi.org/10.1002/adma.201104272
Jin A., Chen W., Zhu Q. et al. // Electrochim. Acta. 2010. V. 55. № 22. P. 6408. https://doi.org/10.1016/j.electacta.2010.06.047
Zanarini S., Di Lupo F., Bedini A. et al. // J. Mater. Chem. C. 2014. V. 2. № 42. P. 8854. https://doi.org/10.1039/c4tc01123f
Granqvist C.G. // Thin Solid Films. 2014. V. 564. P. 1. https://doi.org/10.1016/j.tsf.2014.02.002
Wang L., Guo M., Zhan J. et al. // J. Mater. Chem. A. 2020. V. 8. № 33. P. 17098. https://doi.org/10.1039/d0ta04824k
Liu J., Wang X., Peng Q. et al. // Adv. Mater. 2005. V. 17. № 6. P. 764. https://doi.org/10.1002/adma.200400993
Schneider K., Lubecka M., Czapla A. // Sens. Actuators, B. 2016. V. 236. P. 970. https://doi.org/10.1016/j.snb.2016.04.059
Mane A.A., Suryawanshi M.P., Kim J.H. et al. // Appl. Surf. Sci. 2017. V. 403. P. 540. https://doi.org/10.1016/j.apsusc.2017.01.220
Mjejri I., Rougier A., Gaudon M. // Inorg. Chem. 2017. V. 56. № 3. P. 1734. https://doi.org/10.1021/acs.inorgchem.6b02880
Mjejri I., Gaudon M., Rougier A. // Sol. Energy Mater. Sol. Cells. 2019. V. 198. № December 2018. P. 19. https://doi.org/10.1016/j.solmat.2019.04.010
Zhang Y., Xiong W., Chen W. et al. // Nanomaterials. 2021. V. 11. № 2. P. 338. https://doi.org/10.3390/nano11020338
Simonenko T.L., Bocharova V.A., Simonenko N.P. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. https://doi.org/10.1134/S003602362004018X
Simonenko T.L., Bocharova V.A., Gorobtsov P.Y. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 9. P. 1292. https://doi.org/10.1134/S0036023620090193
Simonenko T.L., Bocharova V.A., Gorobtsov P.Y. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 9. P. 1304. https://doi.org/10.1134/S0036023620090181
Gorobtsov P.Y., Fisenko N.A., Solovey V.R. et al. // Colloids Interface Sci. Commun. 2021. V. 43. P. 100452. https://doi.org/10.1016/j.colcom.2021.100452
Simonenko T.L., Simonenko N.P., Gorobtsov P.Y. et al. // J. Alloys Compd. 2020. V. 832. P. 154957. https://doi.org/10.1016/j.jallcom.2020.154957
Simonenko T.L., Simonenko N.P., Mokrushin A.S. et al. // Ceram. Int. 2020. V. 46. № 1. P. 121. https://doi.org/10.1016/j.ceramint.2019.08.241
Milošević S., Stojković I., Kurko S. et al. // Ceram. Int. 2012. V. 38. № 3. P. 2313. https://doi.org/10.1016/j.ceramint.2011.11.001
Nosikova L.A., Baranchikov A.E., Yapryntsev A.D. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 488. https://doi.org/10.1134/S0036023620040142
Teixeira D., Quesada-Cabrera R., Powell M.J. et al. // New J. Chem. 2017. V. 41. № 17. P. 9216. https://doi.org/10.1039/c7nj02165h
Sathyanarayana D.N., Patel C.C. // J. Inorg. Nucl. Chem. 1965. V. 27. № 2. P. 297. https://doi.org/10.1016/0022-1902(65)80342-6
Sathyanarayana D.N., Patel C.C. // J. Inorg. Nucl. Chem. 1966. V. 28. № 10. P. 2277. https://doi.org/10.1016/0022-1902(66)80117-3
Botto I.L., Vassallo M.B., Baran E.J. et al. // Mater. Chem. Phys. 1997. V. 50. P. 267.
Meyer J., Zilberberg K., Riedl T. et al. // J. Appl. Phys. 2011. V. 110. № 3. https://doi.org/10.1063/1.3611392
Shrotriya V., Li G., Yao Y. et al. // Appl. Phys. Lett. 2006. V. 88. № 7. P. 1. https://doi.org/10.1063/1.2174093
Chiang W.T., Su S.H., Lin Y.F. et al. // Jpn. J. Appl. Phys. 2010. V. 49. № 4. https://doi.org/10.1143/JJAP.49.04DK14
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии