Журнал неорганической химии, 2022, T. 67, № 7, стр. 879-883
Синтез и кристаллическая структура нового оксохлорида (Mn,Mg)8Cl3O10
К. А. Досаев a, *, С. Я. Истомин a, Е. В. Антипов a
a Химический факультет, Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: dosaev.kirill1@gmail.com
Поступила в редакцию 01.11.2021
После доработки 16.12.2021
Принята к публикации 18.12.2021
- EDN: WKINOS
- DOI: 10.31857/S0044457X22070066
Аннотация
Разработан метод синтеза оксохлорида Mn8Cl3O10 в токе Ar (600°C, 8 ч) с использованием в качестве исходных веществ MnCl2 и MnO2. Проведено частичное замещение катионов Mn2+ на катионы Mg2+ в этом соединении в соответствии с формулой Mg0.6Mn7.4Cl3O10. Состав полученного оксохлорида определен по результатам уточнения его кристаллической структуры методом Ритвельда по порошковым рентгеновским данным и подтвержден результатами локального рентеноспектрального анализа. Установлено, что катионы Mg2+ в структуре занимают предпочтительно позицию с кубической координацией атомами кислорода (MO8), а не в октаэдрах MCl6.
ВВЕДЕНИЕ
Исследование перовскитов (ABO3) с различными 3d-металлами в B-подрешетке показало, что наибольшую активность в реакции восстановления кислорода (РВК) в щелочной среде имеют сложные оксиды трехвалентного марганца [1–3]. Было показано, что в оксидных соединениях, имеющих в своем составе катион Mn3+, аналогично платине реализуется 4-электронный механизм РВК [4]. Так, недавние исследования марганецсодержащих оксидных соединений, таких как α-Mn2O3, β-MnO2, α-MnOOH, Mn3O4, LaMnO3, показали высокую активность α-Mn2O3 со структурой биксбиита [5, 6]. Установлено существование взаимосвязи между активностью соединения в РВК и поверхностным окислительно-восстановительным потенциалом пары Mn4+/Mn3+ (чем выше потенциал, тем выше активность), что позволяет предположить, что последний является новым дескриптором электрокатализа РВК. Высказано предположение, что исключительно высокая активность α-Mn2O3 (всего в 4 раза меньше, чем у Pt), скорее всего, связана с особенностями кристаллической структуры биксбиита [7, 8].
Можно предположить, что оксогалогениды марганца, содержащие катионы Mn3+, могут представлять интерес для поиска новых электрокатализаторов РВК в щелочном растворе. Это связано с тем, что они, в отличие от оксидов, могут кристаллизоваться в различных кристаллических структурах, а присутствие в них галогенид-ионов может влиять на степень ионности связей Mn3+–O [9]. Среди оксогалогенидов марганца, содержащих катионы Mn3+, известны Mn8Cl3O10 [10–13] и изоструктурная фаза Mn7.5O10Br3 [14]. Кристаллическая структура Mn8Cl3O10$\left( {{\text{M}}{{{\text{n}}}^{{{\text{2 + }}}}}{\text{Mn}}_{7}^{{3 + }}{\text{C}}{{{\text{l}}}_{{\text{3}}}}{{{\text{O}}}_{{10}}}} \right)$ представляет собой трехмерный каркас (рис. 1), в состав которого входят пять кристаллографически независимых катионов марганца. Катионы Mn2+ расположены в кубе MnO8 и октаэдре MnCl6, а катионы Mn3+ – в двух кристаллографически независимых искаженных октаэдрах MnCl2O4 (d(Mn–O) = 1.847–1.918 Å, d(Mn–Cl) = 2.822–2.826 Å [13]) и в практически правильном октаэдре MnO6 (d(Mn–O) = 2.007–2.02 Å [13]).
Рис. 1.
Кристаллическая структура Mn8Cl3O10 [13]. Атомы кислорода и хлора показаны красными и зелеными сферами соответственно. Катионы Mn2+ расположены в кубах MnO8 (синий) и октаэдрах MnCl6 (серый). Катионы Mn3+ находятся в октаэдрах MnCl2O4 (коричневый) и MnO6 (фиолетовый).
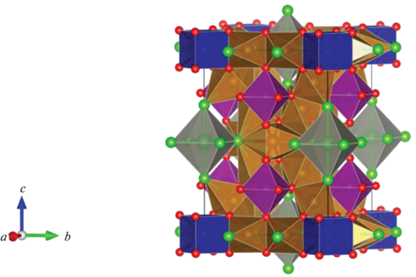
В настоящей работе разработан новый метод синтеза оксохлорида Mn8Cl3O10. Учитывая, что присутствие Mn2+ в Mn8Cl3O10 может влиять на стабильность [15, 16] и электрокаталитическую активность оксогалогенида в РВК [17, 18], проведено замещение катионов Mn2+ на Mg2+ в соответствии с химической формулой MgMn7Cl3O10 и уточнена кристаллическая структура новой фазы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза Mn8Cl3O10 использовали MnCl2 и MnO2 (“Реахим”, Россия). MnCl2 предварительно сушили при 150°С ≥10 ч. Для получения оксохлорида применяли два метода: а) синтез в вакуумированных запаянных кварцевых ампулах при 500°С в течение 8 ч [12] и б) в потоке Ar при 600°С в течение 5 ч. В обоих методах использовали стехиометрические количества исходных перетертых вместе реагентов. Оксохлорид MgMn7Cl3O10 получали отжигом MnCl2, MnO2 и MgO (“Реахим”, Россия) в вакуумированных запаянных кварцевых ампулах при 500° С в течение 8 ч.
Фазовый состав образцов определяли при помощи порошковой рентгеновской дифракции с использованием дифрактометра Huber G670 (CuKα1-излучение). Данные для уточнения кристаллической структуры MgMn7Cl3O10 были получены с помощью порошкового дифрактометра Bruker D8 Advance (CuKα-излучение). Фазовый анализ выполняли с использованием базы данных ICDD PDF-2. Для уточнения параметров элементарных ячеек использовали программный пакет STOE “WinXPOW”. Уточнение кристаллической структуры проводили с помощью программного пакета GSAS [19].
Исследования методом сканирующей электронной микроскопии выполняли с использованием микроскопа Carl Zeiss NVision 40, рабочее напряжение 1–20 кВ.
Удельную поверхность порошков определяли в ходе физической сорбции N2 на анализаторе ASAP 2010 (Micromeritics, США) многоточечным методом Брунауэра–Эммета–Теллера (БЭТ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Однофазные образцы Mn8Cl3O10 были приготовлены двумя методами: в вакуумированных запаянных ампулах и в токе Ar (рис. 2). Поскольку реакция (уравнение (1)) сопровождается выделением большого количества газообразного хлора, синтез в кварцевых ампулах не позволяет получить достаточно большое количество образца для дальнейших исследований.
(1)
${\text{5Mn}}{{{\text{O}}}_{{\text{2}}}} + {\text{3MnC}}{{{\text{l}}}_{{\text{2}}}} \to {\text{M}}{{{\text{n}}}_{{\text{8}}}}{\text{C}}{{{\text{l}}}_{{\text{3}}}}{{{\text{O}}}_{{{\text{10}}}}} + {\text{3/2C}}{{{\text{l}}}_{{\text{2}}}}{\text{.}}$Рис. 2.
Дифрактограммы Mn8Cl3O10, полученного в токе Ar (1) и в вакуумированной и герметичной ампуле из диоксида кремния (2). Внизу показана штрихрентгенограмма Mn8Cl3O10 из базы данных ICDD PDF № 30-821.
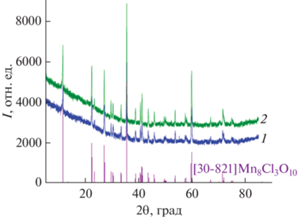
Обнаружили, что однофазные образцы Mn8Cl3O10 можно получить и при синтезе в трубчатой печи в атмосфере Ar при 600°C в течение 8 ч (рис. 2).
Дифрактограмма образца Mn8Cl3O10, полученного в токе Ar при 600°C (8 ч), была успешно проиндицирована в тетрагональной сингонии в пр. гр. I4/mmm с параметрами a = 9.268 (2), c = = 13.054 (3) Å, близкими к представленным в работе [13].
Учитывая, что присутствие Mn2+ в Mn8Cl3O10 может влиять на стабильность и электрокаталитическую активность оксогалогенида в РВК, решили заменить его другим катионом M2+, для которого не будет происходить изменение степени окисления при электрокаталитическом восстановлении кислорода в щелочном растворе. В качестве такого катиона был выбран Mg2+, имеющий близкий ионный радиус с катионом Mn2+ (r(Mn2+) = 0.96 Å, r(Mg2+) = 0.89 Å для КЧ = 8 [20]). Новый замещенный оксохлорид MgMn7Cl3O10 был получен отжигом стехиометрических количеств MnCl2, MnO2 и MgO в вакуумированных и запаянных кварцевых ампулах при 500°С в течение 8 ч. Большинство рефлексов на дифрактограмме MgMn7Cl3O10 (рис. 3), за исключением нескольких слабых отражений (Imax ~ 1%), которые нам не удалось отнести ни к одной из известных фаз, были проиндицированы в тетрагональной ячейке с параметрами a = 9.2361(3), c = = 13.0583(9) Å. Следует отметить уменьшение объема элементарной ячейки MgMn7Cl3O10 (557 Å3) по сравнению с Mn8Cl3O10 (562 Å3) из-за меньшего размера катиона Mg2+.
Рис. 3.
Наблюдаемые, рассчитанные и разностные профили дифрактограмм для Mg0.6Mn7.4Cl3O10. Отражения от примесной фазы отмечены звездочками.
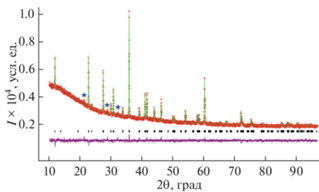
Уточнение кристаллической структуры MgMn7Cl3O10 выполнено с использованием в качестве модели структуры Mn8Cl3O10 [13]. Катионы Mg2+ были помещены в позиции катионов Mn2+ (2a и 2b в пр. гр. I4/mmm). Большая разница в факторах атомного рассеяния рентгеновских лучей Mg (Z = 12) и Mn (Z = 25) позволила с хорошей точностью уточнить заселенность этих позиций катионами. Параметры атомных смещений кислорода в позициях O(1), O(2), O(3) уточняли в блоке, тогда как атомов хлора Cl(1) и Cl(2) – индивидуально. Экспериментальные, расчетные и разностные рентгенограммы приведены на рис. 3. Уточненные координаты атомов, параметры атомных смещений и заселенности позиций приведены в табл. 1, а основные межатомные расстояния – в табл. 2. Уточнение заселенностей катионных позиций 2a и 2b приводит к выводу, что в них все еще присутствуют катионы Mn2+. Обнаружено, что катионы Mg2+ предпочтительно локализуются в позиции 2a (g = 0.90(5)) с кубической координацией атомами кислорода, тогда как позиция 2b с октаэдрической координацией ионами Cl заселена ими только частично (g = 0.27(4)). Таким образом, химический состав фазы, рассчитанный из результатов уточнения кристаллической структуры новой фазы, соответствует формуле Mg0.59 ± 0.03Mn7.41 ± 0.02Cl3O10. Локальный рентгеноспектральный анализ подтвердил более низкое содержание Mg в полученном соединении: Mg0.62 ± 0.05Mn7.38 ± 0.03Cl3O10. Формула оксохлорида с учетом степеней окисления Mn может быть записана как ${\text{M}}{{{\text{g}}}_{{0.6}}}{\text{Mn}}_{{0.4}}^{{2 + }}{\text{Mn}}_{7}^{{3 + }}{\text{C}}{{{\text{l}}}_{{\text{3}}}}{{{\text{O}}}_{{10}}}.$
Таблица 1.
Координаты атомов, параметры атомных смещений и заселенности позиций в кристаллической структуре Mg0.6Mn7.4Cl3O10 (пр. гр. I4/mmm, Z = 4, a = 9.2361(3), c = 13.0583(9) Å, χ2 = 1.38, Rp = 0.0178, Rwp = = 0.0231)
| Атом | Позиция | x | y | z | Ui/Ue × 100 | g |
|---|---|---|---|---|---|---|
| Mn1 | 16m | 0.1862(7) | 0.1862(7) | 0.1712(9) | 1.4(4) | 1.0 |
| Mn2 | 8i | 0.344(2) | 0.0 | 0.0 | 2.9(7) | 1.0 |
| Mn3 | 4d | 0.5 | 0.0 | 0.25 | 2.8(3) | 1.0 |
| Mg1/Mn4 | 2a | 0.0 | 0.0 | 0.0 | 3(1) | 0.90(5)/0.10(5) |
| Mg2/Mn5 | 2b | 0.0 | 0.0 | 0.5 | 4.4(7) | 0.27(4)/0.73(4) |
| Cl1 | 8h | 0.317(2) | 0.317(2) | 0.0 | 0.7(7) | 1.0 |
| Cl2 | 4e | 0.0 | 0.0 | 0.292(2) | 0.3(8) | 1.0 |
| O1 | 16k | 0.148(3) | 0.648(3) | 0.25 | 4.1(5) | 1.0 |
| O2 | 8g | 0.5 | 0.0 | 0.102(5) | 4.1(5) | 1.0 |
| O3 | 16n | 0.191(4) | 0.0 | 0.101(4) | 4.1(5) | 1.0 |
Таблица 2.
Избранные межатомные расстояния (Å) в кристаллической структуре Mg0.6Mn7.4Cl3O10
| Mn1 | Mn2 | Mn3 | Mg1/Mn4 | Mg2/Mn5 |
|---|---|---|---|---|
| O1 1.88(2) × 2 | O2 1.97(4) × 2 | O1 1.94(3) × 4 | O3 2.20(1) × 8 | Cl1 2.39(2) × 4 |
| O3 1.95(2) × 2 | O3 1.93(6) × 2 | O2 1.93(6) × 2 | Cl2 2.72(3) × 2 | |
| Cl1 2.81(2) | Cl1 2.94(1) × 2 | |||
| Cl2 2.99(2) |
Измеренная площадь поверхности порошка Mn8Cl3O10 методом БЭТ составляет всего 3 м2/г. Сканирующая электронная микроскопия показала присутствие в образце частиц размером 200–500 нм (рис. 4). В образце Mg0.6Mn7.4Cl3O10 частицы намного крупнее – 1–4 мкм.
ЗАКЛЮЧЕНИЕ
Путем замещения катионов Mn2+ на Mg2+ синтезирована новая фаза Mg0.6Mn7.4Cl3O10. Соединение кристаллизуется в пр. гр. I4/mmm с параметрами элементарной ячейки a = 9.2361(3), c = = 13.0583(9) Å. Уточнение кристаллической структуры при использовании рентгенографических данных показало преимущественную локализацию катионов Mg2+ в позициях 2а с кубической координацией ионами кислорода.
Список литературы
Suntivich J., Gasteiger H.A., Yabuuchi N. et al. // Nat. Chem. 2011. V. 3. № 7. P. 546. https://doi.org/10.1038/nchem.1069
Chen D., Chen C., Baiyee Z.M. et al. // Chem. Rev. 2015. V. 115. № 18. P. 9869. https://doi.org/10.1021/acs.chemrev.5b00073
Hong W.T., Risch M., Stoerzinger K.A. et al. // Energy Environ. Sci. 2015. V. 8. № 5. P. 1404. https://doi.org/10.1039/c4ee03869j
Stoerzinger K.A., Risch M., Han B. et al. // ACS Catal. 2015. V. 5. № 10. P. 6021. https://doi.org/10.1021/ACSCATAL.5B01444
Ryabova A.S., Napolskiy F.S., Poux T. et al. // Electrochim. Acta. J. 2016. V. 187. P. 161. https://doi.org/10.1016/j.electacta.2015.11.012
Ryabova A.S., Istomin S.Y., Dosaev K.A. et al. // Electrochim. Acta. 2021. V. 367. P. 137378. https://doi.org/10.1016/j.electacta.2020.137378
Nikitina V.A., Kurilovich A.A., Bonnefont A. et al. // J. Electrochem. Soc. 2018. V. 165. № 15. P. J3199. https://doi.org/10.1149/2.0261815jes
Ryabova A.S., Bonnefont A., Zagrebin P. et al. // ChemElectroChem. 2016. V. 3. № 10. P. 1667. https://doi.org/10.1002/celc.201600236
Masquelier C., Croguennec L. // Chem. Rev. 2013. V. 113. № 8. P. 6552. https://doi.org/10.1021/cr3001862
Buisson G. // J. Solid State Chem. 1976. V. 19. № 2. P. 175. https://doi.org/10.1016/0022-4596(76)90166-3
Buisson P.A.R.G. // Acta Cryst. 1977. V. B33. P. 1031. https://doi.org/10.1107/S0567740877005317
Léone P., Euzen P., Palvadeau P. et al. // J. Magn. Magn. Mater. 1997. V. 172. № 1–2. P. 153. https://doi.org/10.1016/S0304-8853(97)00099-1
Euzen P., Leone P., Palvadeau P. et al. // Mater. Res. Bull. 1992. V. 27. № 11. P. 1295. https://doi.org/10.1016/0025-5408(92)90094-G
Euzen P., Leone P., Mansot J.L. et al. // Mater. Res. Bull. 1992. V. 27. № 12. P. 1423. https://doi.org/10.1016/0025-5408(92)90007-M
Su H.-Y., Gorlin Y., Man I.C. et al. // Phys. Chem. Chem. Phys. 2012. V. 14. P. 14010. https://doi.org/10.1039/c2cp40841d
Gorlin Y., Lassalle-Kaiser B., Benck D.J. et al. // J. Am. Chem. Soc. 2013. V. 135. № 23. P. 8525. https://doi.org/10.1021/ja3104632
Cheng F., Shen J., Peng B. et al. // Nat. Chem. 2011. V. 3. № 1. P. 79. https://doi.org/10.1038/nchem.931
Xu C., Lu M., Zhan Y. et al. // RSC Adv. 2014. V. 4. № 48. P. 25089. https://doi.org/10.1039/c4ra01037j
Toby B.H. // J. Appl. Crystallogr. 2001. V. 34. P. 210. https://doi.org/10.5229/jecst.2013.4.1.34
Shannon R.D. // Acta Crystallogr., Sect. A. 1976. V. 32. P. 751. https://doi.org/10.1107/S0567739476001551
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии



