Журнал неорганической химии, 2022, T. 67, № 7, стр. 966-971
Фазовые равновесия в системе Eu–Mn–O
Г. А. Бузанов a, *, Г. Д. Нипан a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: gbuzanov@yandex.ru
Поступила в редакцию 31.12.2021
После доработки 11.02.2022
Принята к публикации 11.02.2022
- EDN: BMJBRZ
- DOI: 10.31857/S0044457X22070054
Аннотация
Методами рентгенофазового анализа исследованы фазовые равновесия в системе Eu–Mn–O для образцов, подвергнутых предварительной механохимической активации и синтезированных при давлении кислорода ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ 10–5–102 кПа, а также в восстановительной атмосфере при парциальном давлении водорода ${{P}_{{{{{\text{H}}}_{{\text{2}}}}}}}$ ~ 5 кПа. Построены проекции ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$–T и x–y фазовой диаграммы P–T–x–y системы Eu–Mn–O, а также изотермы x–y квазитройной системы Eu2O3–MnO–MnO2.
ВВЕДЕНИЕ
При изучении мультиферроиков EuMnO3 [1] и EuMn2O5 [2] исследователи часто соотносят физические свойства с идеализированными стехиометрическими соединениями, между тем это нестехиометрические кристаллические фазы [3, 4], гомогенные составы которых зависят от температуры и парциального давления кислорода при синтезе и отжиге, а граничные составы определяются фазами, находящимися с EuMnO3 и EuMn2O5 в равновесии. Сохранение однофазных структур не обеспечивает постоянство химического состава и, как следствие, свойств материалов. Воспроизводимость физических свойств EuMnO3 (Pbnm) со структурой перовскита [5] и EuMn2O5 (pbaM) [6] связана с получением материалов заданного химического состава при сохранении однофазной структуры, и первым шагом на этом пути является построение фазовой диаграммы системы Eu–Mn–O. Установлено, что диссоциация EuMnO3 (10–8 Па < ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ < 10–4 Па, 1170 K < T < 1400 K) [7] и EuMn2O5 (102 Па < ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ < < 105 Па, 1300 K < T < 1500 K) [8] происходит в соответствии с реакциями:
(1)
${\text{EuMn}}{{{\text{O}}}_{{\text{3}}}} = \left( {{\text{1/2}}} \right){\text{E}}{{{\text{u}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{MnO}} + \left( {{\text{1/2}}} \right){{{\text{O}}}_{{\text{2}}}}{\text{,}}$(2)
${\text{EuM}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}} = {\text{EuMn}}{{{\text{O}}}_{{\text{3}}}} + \left( {{\text{1/3}}} \right){\text{M}}{{{\text{n}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}} + \left( {{\text{1/3}}} \right){{{\text{O}}}_{{\text{2}}}}{\text{.}}$В работах Балакирева В.Ф. с соавт. [3, 9–13] исследованы фазовые равновесия в системе Eu–Mn–O в изобарических условиях (${{P}_{{{{{\text{O}}}_{2}}}}}$ = 21 кПа, 1073 K ≤ T ≤ 1673 K) [3, 7–12] и при изменении парциального давления кислорода [13]. Это позволило в квазибинарном приближении построить ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$–T–x фазовую диаграмму (10–15 Па < ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ < < 105 Па, 973 K ≤ T ≤ 1173 K) [13].
В настоящем исследовании при использовании метода механохимической активации и отжига полученных механокомпозитов при варьируемом парциальном давлении кислорода и водорода исследованы фазовые равновесия в системе Eu–Mn–O и с помощью топологического моделирования построены ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$–T- и x–y -проекции фазовой диаграммы P–T–x–y системы Eu–Mn–O, а также x–y-изотермы квазитройной системы Eu2O3–MnO–MnO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве прекурсоров для получения поликристаллитов системы Eu–Mn–O использовали металлический европий (99.99%), а также оксиды Eu2O3, MnO2 и Mn2O3 высокой чистоты с содержанием основного компонента не ниже 99.98%. Для получения образцов с точно известным заданным составом оксиды просушивали при 473–493 K (для Eu2O3 – 1173 K). MnO получали пиролизом Mn(CH3COO)2 · 4H2O (573 K, 2 ч) в токе аргона высокой чистоты (не ниже 99.9996% Ar).
Перед синтезом исходную смесь реагентов подвергали механохимической активации в течение 30 мин при частоте 30 Гц в вибрационной мельнице Retsch MM400 (размольные сосуды и шары – нержавеющая сталь, V = 25 мл, dшаров = 2–6 мм, соотношение масс шаров и прекурсоров ~20 : 1). Синтез проводили в токе кислорода (${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ ~ 100 кПа), на воздухе (${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ ~ 21 кПа), в токе аргона высокой чистоты (${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ ~ 0.3 кПа), в вакууме (${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ ~ 10–5 кПа) и в восстановительной атмосфере 95% Ar + 5% H2 (${{P}_{{{{{\text{H}}}_{{\text{2}}}}}}}$ ~ 5 кПа). Для синтеза на воздухе использовали муфельную печь Nabertherm L5/11 (отжиг в алундовых тиглях), в остальных случаях – кварцевую трубку-реактор диаметром 26 мм, помещенную в горизонтальную трубчатую печь Nabertherm RT 30-200/15 (отжиг в алундовых цилиндрических тиглях, l = 35 мм, dвнут = 7 мм, dвнеш = 10 мм). Исследования методом РФА выполнены с использованием оборудования ЦКП ИОНХ РАН в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований на рентгеновском дифрактометре Bruker D8 Advancе (СuKα-излучение, Ni-фильтр, детектор LYNXEYE, геометрия на отражение, интервал углов 2θ = 10°–80° с шагом не более 0.01125°) в низкофоновых кюветах с подложкой из ориентированного монокристаллического кремния. Для ТГ–ДСК-исследований в разных газовых средах (воздух и аргон высокой чистоты) до температуры 1273 K использовали комплекс SDT Q600 V8.3 Build 101. Скорость нагрева составляла 10 град./мин, скорость газового потока – 100 мл/мин. Операции, для которых требовалась сухая и/или инертная атмосфера, проводили в боксе СПЕКС ГБ22М (O2 и H2O – 5 и 10 ppm соответственно).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дифрактограммы образцов системы Eu–Mn−O, синтезированных при разных парциальных давлениях кислорода и водорода и различном соотношении компонентов-металлов, представлены на рис. 1–3.
Рис. 1.
Дифрактограммы образцов, полученных в восстановительной атмосфере (ток Ar + 5% H2): a – 2Eu + 3MnO (1023 K), б – Eu2O3 + 4.5Mn2O3 (1123 K). 1 – Eu2O3, 2 – Mn, 3 – MnO.
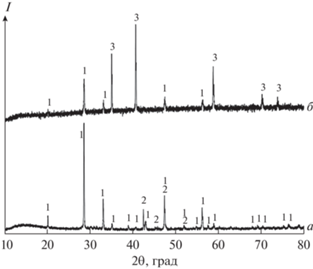
Рис. 2.
Дифрактограммы образцов с соотношением Eu : Mn = 1 : 1 и 1 : 2. Mn2O3 + Eu2O3: a – 1073, б – 1273 K; 2Mn2O3 + Eu2O3: в – 1073, г – 1173, д – 1273 K. е – EuMn2O5, 923 K. a–д – отжиг на воздухе (3 ч), е – отжиг в токе Ar + 5% H2 (150 мл/мин, 2 ч). 1 – EuMnO3, 2 – Eu2O3, 3 – EuMn2O5, 4 – MnO.
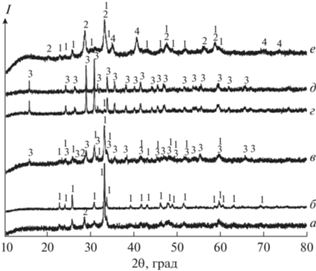
Рис. 3.
Дифрактограммы образцов смеси Eu2O3 + + 6MnO2, подвергшихся отжигу в токе O2. a – 873, б – 973, в – 1073, г – 1173 K. 1 – Mn2O3, 2 – Eu2O3, 3 – MnO2, 4 – Mn3O4, 5 – EuMn2O5.
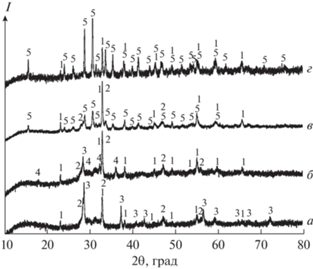
На рис. 1 приведены дифрактограммы образцов, полученных в восстановительной атмосфере. Так, отжиг смеси металлического Eu и MnO (2 : 3, Ar или Ar + H2, 923–1023 K, 2–6 ч) неизменно приводит к образованию смеси Mn и Eu2O3 (рис. 1, кривая a). В условиях эксперимента с использованием данных прекурсоров образование EuO или Eu3O4 не наблюдали. Отжиг смеси Mn2O3 и Eu2O3 (Eu : Mn = 1 : 9) в токе аргона с 5% Н2 при 1173 K (2 ч) приводит к образованию фазы манганозита, что не противоречит данным о стабильных фазовых равновесиях системы Mn–O [14], при этом Eu2O3 в восстановление не вовлекается (рис. 1, кривая б) даже при увеличении температуры до 1323 K (4 ч). При отжиге в среде с бóльшим ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ на воздухе или в кислороде наблюдается образование тройных соединений EuMnO3 и EuMn2O5. Получение однофазных образцов EuMnO3 возможно при температуре не ниже 1273 K (4 ч, воздух) из смесей Eu2O3 и Mn2O3 (или MnO2) с эквимолярным соотношением компонентов-металлов (рис. 2, кривые а, б). При увеличении содержания марганца в смеси (до Eu : Mn = 1 : 2) и отжиге на воздухе при 1073 K (4 ч) происходит образование фазы EuMn2O5, которая сосуществует с Eu2O3 и EuMnO3; выше 1073 K (4 ч) наблюдается растворение Eu2O3, а при 1273 K образцы становятся однофазными (рис. 2, кривые в–д). Отжиг образцов EuMn2O5, полученных вышеуказанным способом, в восстановительной атмосфере (ток Ar + 5% H2) при 773 K (30 мин) не приводит к получению многофазных смесей, однако с повышением температуры отжига до 923 K (1–2 ч) соединение EuMn2O5 распадается с образованием Eu2O3, MnO и EuMnO3 (рис. 2, кривая е). При отжиге в атмосфере кислорода смеси Eu2O3 + + 6MnO2 последний присутствует в равновесии до 973 K (2–4 ч, рис. 3, кривые a, б), с ростом температуры происходит постепенное увеличение содержания Mn2O3; твердый раствор на основе Mn3O4 присутствует в узком интервале температур и отчетливо наблюдается при 973 K (рис. 2, кривая в). Образование фазы EuMn2O5 начинается с 1073 K, при 1173 K в равновесии с ней присутствует только фаза биксбиита – Mn2O3 (рис. 3, кривая г).
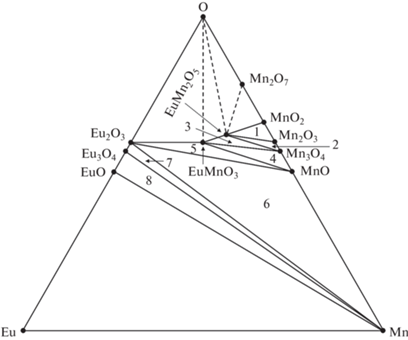
На основании экспериментальных и литературных данных построены проекции x–y и ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$–T диаграммы P–T–x–y системы Eu−Mn−O (рис. 4 и 5), на которых представлены субсолидусные фазовые равновесия с участием трех кристаллических фаз и кислорода. Сплошные линии на проекциях –экспериментальные, а штриховые линии – гипотетические. Из-за низкой температуры плавления Mn2O7 (~280 K) моновариантное равновесие EuMn2O5−MnO2–Mn2O7−O2 (рис. 4) на ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$–T-проекции не рассматривается. Штриховые ноды EuMnO3−O и EuMn2O5−O на рис. 5 проведены формально и выделяют треугольники, соответствующие дивариантным равновесиям EuMn2O5−Mn2O7−O2, EuMnO3−EuMn2O5−O2 и Eu2O3−EuMnO3−O2. Предположение о существовании моновариантного равновесия Eu2O3 −EuMnO3−EuMn2O5−O2 экспериментально не подтверждается [9], что, однако, противоречит экспериментальным данным настоящей работы (рис. 2, кривая в) и может быть следствием различия в элементном составе образцов, нода Eu2O3−EuMn2O5 на x–y-проекции отсутствует. Цифрами на рис. 4 отмечены области моновариантных равновесий, которым на ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$−T-проекции (рис. 6) последовательно отвечают линии моновариантных равновесий с участием трех кристаллических фаз и пара. Для областей 1–5 общее давление практически совпадает с парциальным давлением кислорода: 1 – EuMn2O5−Mn2O3−MnO2−O2 (моноварианта накладывается на моноварианту Mn2O3−MnO2−O2 бинарной системы Mn–O [15]), 2 – EuMn2O5−Mn3O4−Mn2O3−O2 (моноварианта Mn3O4−Mn2O3−O2 для Mn–O [14]), 3 – EuMnO3−EuMn2O5−Mn3O4−O2 (3a [8] и 3б [13] на рис. 5), 4 –EuMnO3–MnO−Mn3O4−O2 (моноварианта MnO−Mn3O4−O2 для Mn–O [15, 16]) и 5 – Eu2O3−EuMnO3−MnO−O2 (5a [7] и 5б [13] на рис. 5). Марганец и европий преобладают в паре в равновесиях 6–9 (рис. 4), парциальное давление кислорода (рис. 6) оценено из активности в электрохимических ячейках: 6 – Eu2O3−Mn−MnO−O2 (Mn−MnO−O2 [17]), 7 – Eu3O4−Eu2O3−Mn–O2 (Eu3O4−Eu2O3−O2 [18–21]), 8 – EuO−Eu3O4−Mn–O2 (EuO−Eu3O4−O2 [18–21]) и 9 – Eu−EuO−Mn–O2 (Eu−EuO−O2 [18]). Кроме того, представлены линии парциального давления кислорода при конгруэнтной сублимации (10 – MnO [14, 22], 11 – Eu2O3 [14]), отвечающие условно моновариантным равновесиям в бинарных системах:
(3)
${\text{MnO (крист}}{\text{.) = Mn (пар) + }}\left( {{\text{1/2}}} \right){{{\text{O}}}_{{\text{2}}}}{\text{,}}$(4)
${\text{E}}{{{\text{u}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}{\text{ (крист}}{\text{.) = 2EuO (пар) + }}\left( {{\text{1/2}}} \right){{{\text{O}}}_{{\text{2}}}}{\text{.}}$Рис. 5.
${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$–T-проекция P–T–x–y-фазовой диаграммы системы Eu–Mn–O.
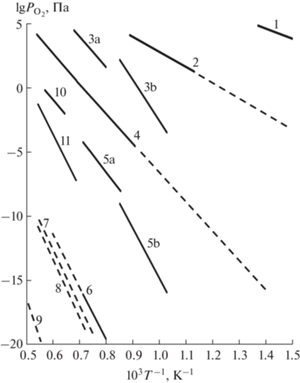
Рис. 6.
x–y-Изотермы квазитройной системы Eu2O3–MnO–MnO2: T1 = 700 K (а), T2 = 1000 K (б), T3 = 1250 K (в), T4 = = 1500 K (г), T5 = 2000 K (д).
Для соотнесения ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$–T-проекции с концентрационной диаграммой Eu2O3–MnO–MnO2 построены x–y-изотермы (рис. 6) для ключевых температур при парциальных давлениях, не превышающих 100 кПа. При построении x–y-изотерм не учитывали нестехиометрию кристаллических фаз и их полиморфизм [23, 24], а также не рассматривали метастабильные состояния в исследуемой тройной [24, 25] и родственных [26–31] системах.
При T1 = 700 K (рис. 6а) EuMnO3 участвует в равновесиях с Eu2O3, MnO, Mn3O4 и EuMn2O5. В свою очередь, EuMn2O5 сосуществует с Mn3O4, Mn2O3 и MnO2, но не с Eu2O3 [9]. Следовательно, не образуются равновесия Eu2O3–EuMnO3−EuMn2O5–O2 и Eu2O3−EuMn2O5–MnO2–O2.
При T2 = 1000 K (рис. 6б) и давлении кислорода <100 кПа диссоциирует MnO2 и не реализуется равновесие EuMn2O5–Mn2O3–MnO2–O2, далее при T3 = 1250 K (рис. 6в) диссоциирует Mn3O4 и исчезает равновесие EuMn2O5–Mn3O4–Mn2O3–O2.
Затем при T4 = 1500 K (рис. 6г) перестает существовать кристаллическая фаза EuMn2O5 и вместе с ней равновесие EuMnO3−EuMn2O5–Mn3O4–O2.
В итоге при T5 = 2000 K (рис. 6д) сохранятся оксид MnO и многофазное равновесие Eu2O3–EuMnO3−MnO–O2. Выше 2500 K в равновесии с кислородом существуют только простые оксиды Eu2O3 и MnO.
ЗАКЛЮЧЕНИЕ
Методами рентгенофазового анализа исследованы фазовые равновесия в системе Eu–Mn–O. Образцы, подвергнутые предварительной механохимической активации, синтезированы при давлении кислорода ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ 10–5–102 кПа и в восстановительной атмосфере при парциальном давлении водорода ${{P}_{{{{{\text{H}}}_{{\text{2}}}}}}}$ ~ 5 кПа. Построены ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$–T- и x–y-проекции фазовой диаграммы P–T–x–y системы Eu–Mn–O, а также ключевые изотермы x–y квазитройной системы Eu2O3–MnO–MnO2.
Список литературы
Mochizuki M., Furukawa N. // Phys. Rev. B. 2009. V. 80. Art. 134416. https://doi.org/0.1103/PhysRevB.80.134416
Vorob’ev S.I., Andrievskii D.S., Barsov S.G. et al. // J. Exp. Theor. Phys. 2016. V. 123. P. 1017. https://doi.org/10.1134/S1063776116130215
Федорова О.М., Балакирев В.Ф., Голиков Ю.В. // Неорган. материалы. 2007. Т. 43. № 9. С.1109.
Deng J., Yang A., Farid M.A. et al. // RSC Adv. 2007. V. 7. P. 2019. https://doi.org/10.1039/c6ra25951k
Wang K.F., Liu Q.M., Luo S.J. et al. // Thin Solid Films. 2010. V. 518. № 24. P. e12. https://doi.org/10.1016/j.tsf.2010.03.132
Golovenchits E.I., Sanina V.A., Zalesskii V.G. // JETP Lett. 2012. V. 95. № 7. P. 386. https://doi.org/10.1134/s0021364012070053
Atsumi T., Ohgushi T., Kamegashira N. // J. Alloys Compd. 1996. V. 238. № 1–2. P. 35. https://doi.org/10.1016/0925-8388(96)02253-0
Satoh H., Suzuki S., Yamamoto K., Kamegashira N. // J. Alloys Compd. 1996. V. 234. № 1. P. 1. https://doi.org/10.1016/0925-8388(95)01881-6
Янкин А.М., Балакирев В.Ф., Федорова О.М., Голиков Ю.В. Манганиты редкоземельных и щелочноземельных элементов. Физико-химический анализ. Екатеринбург: Уро РАН, 2009. 290 с.
Balakirev V.F., Golikov Y.V., Titova S.G. // Dokl. Phys. Chem. 2001. V. 381. P. 301. https://doi.org/10.1023/A:1013241530220
Голиков Ю.В., Балакирев В.Ф., Титова С.Г., Федорова О.М. // Журн. физ. химии. 2003. Т. 77. № 12. С. 2294.
Balakirev V.F., Golikov Y.V. // Inorg. Mater. 2003. V. 39. P. S1. https://doi.org/10.1023/A:1024115817536
Yankin A.M., Vedmid’ L.B., Fedorova O.M. // Russ. J. Phys. Chem. 2012. V. 86. P. 345. https://doi.org/10.1134/S003602441203034X
Казенас Е.К., Цветков Ю.В. Термодинамика испарения оксидов. М.: URSS, 2015. 480 с.
Grundy A.N., Hallstedt B., Gauckler L.J. // J. Phase Equilib. 2003. V. 24. № 1. P. 21. https://doi.org/10.1007/s11669-003-0004-6
Jacob K.T., Kumar A., Rajitha G., Waseda Y. // High Temp. Mater. Proc. 2011. V. 30. № 4. P. 459. https://doi.org/10.1515/htmp.2011.069
Jacob K.T., Kumar A., Waseda Y. // J. Phase Equilib. Diff. 2008. V. 29. № 3. P. 222. https://doi.org/10.1007/s11669-008-9280-5
Jacob K.T., Rajput A. // J. Chem. Eng. Data. 2016. V. 61. P. 1710−1717. https://doi.org/10.1021/acs.jced.5b00728
Сухушина И.С., Васильева И.А., Балабаева Р.Ф. // Журн. физ. химии. 1996. Т. 70. № 1. С. 49.
Сухушина И.С., Васильева И.А. // Журн. физ. химии. 1990. Т. 64. № 12. С. 3218.
Sukhushina I., Vasiljeva I., Balabajeva R. // J. Chim. Phys. 1998. V. 95. № 1. P. 159. https://doi.org/10.1051/jcp:1998114
Левинский Ю.В. p–T–x-Диаграммы состояния двойных металлических систем. Кн. 2. М.: Металлургия, 1990. 400 с.
Balabaeva R.F., Vasil’eva I.A., Sukhushina I.S. et al. // Russ. J. Phys. Chem. 2000. V. 74. № 7. P. 1202.
Балакирев В.Ф., Бархатов В.П., Голиков Ю.В., Майзель С.Г. Манганиты: Равновесные и нестабильные состояния. Екатеринбург: Уро РАН, 2000. 398 с.
Buzanov G.A., Nipan G.D., Zhizhin K.Y. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 5. P. 551. https://doi.org/10.1134/s0036023617050059
Egorova A.A., Bushkova T.M., Kolesnik I.V. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 2. P. 146. https://doi.org/10.1134/S0036023621020066
Simonenko T.L., Simonenko N.P., Gorobtsov P.Y. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 9. P. 1416. https://doi.org/10.1134/S0036023621090138
Zagaynov I.V. // Russ. J. Inorg. Chem. 2021. V. 66. № 8. P. 1212. https://doi.org/10.1134/S0036023621080325
Koroteev P.S., Dobrokhotova Z.V., Novotortsev V.M. // Russ. J. Gen. Chem. 2018. V. 6. № 88. P. 1306. https://doi.org/10.1134/s1070363218060415
Tong Z., Peng G., Li P. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 6. P. 948. https://doi.org/10.1134/S0036023620060273
Gusov A.V., Gagarin P.G., Guskov V.N. // Russ. J. Inorg. Chem. 2021. V. 66. № 11. P. 1710. https://doi.org/10.1134/S0036023621110085
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии